Method Article
通过膜片钳技术记录新鲜分离的基底动脉平滑肌细胞中的向内整流 K + 电流
摘要
该方案描述了一种从大鼠基底动脉中分离平滑肌细胞并使用全细胞膜片钳技术记录这些细胞中向内整流钾通道电流的快速有效方法。它为研究基底动脉和离子通道的研究人员提供了一种新的方法。
摘要
脑血管病是老年人中普遍存在的疾病,发病率稳步上升。基底动脉是供应脑桥、小脑、后脑区和内耳的重要大脑血管。钾 (K+) 通道活性通过调节细胞膜电位在决定血管张力中起重要作用。与其他 K+ 通道一样,向内整流 K+ (Kir) 通道的激活导致细胞膜超极化和血管舒张。在这项研究中,使用从基底动脉中新鲜分离的平滑肌细胞通过全细胞膜片钳技术记录 Kir 电流。研究了 100 μmol/L BaCl2(一种 Kir 通道抑制剂)和 10 μmol/L 硝基血管扩张剂 10 μmol/L 硝普钠 (SNP) 对 Kir 通道电流的影响。结果表明,BaCl2 抑制基底动脉平滑肌细胞中的 Kir 通道电流,而 SNP 增强这些电流。该协议为制备新鲜分离的动脉平滑肌细胞和使用膜片钳技术记录 Kir 通道电流提供了全面的指南,为寻求掌握该方法的研究人员提供了宝贵的资源。
引言
脑血管疾病是老年人群的普遍疾病。随着生活水平的提高、预期寿命的延长和人口老龄化,脑血管病的发病率正在稳步上升1。基底动脉是由双侧椎动脉融合形成的不成对血管,在颅骨内的脑桥下方延伸,分为两条大脑后动脉。它供应脑桥、小脑、大脑后部区域和内耳。基底动脉供血不足会导致阵发性眩晕,通常伴有恶心和呕吐。患者还可能会出现耳鸣、听力损失和其他相关问题等症状。这些症状通常与颈椎病、脑动脉粥样硬化和血压异常等疾病有关。脑血管疾病,尤其在中老年人中普遍存在,通常与这些潜在疾病有关 2,3,4。
阻力动脉在心血管功能和维持身体稳态方面起着至关重要的作用。作为血管阻力的主要部位,它们调节血压和心输出量,确保足够的血流来满足组织和器官的代谢和生理需求5。基底动脉被归类为阻力动脉,主要调节流向脑干6 的血流。平滑肌细胞形成阻力动脉壁,通过调节稳态收缩或血管张力,是血管阻力的关键介质。这些细胞包含许多离子通道,包括 K+ 通道、Ca2+ 通道和 Cl- 通道,这些通道对血管张力的调节至关重要 5,7。
K+ 通道在建立动脉平滑肌细胞的膜电位和调节收缩张力方面至关重要8。动脉平滑肌中有四种类型的 K+ 通道:电压依赖性 K+ (Kᴠ)、Ca2+ 依赖性 K+ (KCa)、ATP 依赖性 K+ (KATP) 和内向整流器 K+ (Kir) 通道 9,10,11。Kir 通道分为 7 个亚型,其中 Kir2.x 是经典的 Kir 通道。其中,Kir2.x 亚家族在脉管系统中最相关。Kir 电流在负电压下表现出向内整流,表明 K+ 净流入电池,而在正电压下,净 K+ 电流很少或没有5。在心血管系统中,Kir 通道对于稳定膜电位至关重要。它们的激活诱导细胞膜超极化和血管舒张 12,13,14。
已在各种动脉(包括冠状动脉、脑动脉、肾动脉和肠系膜动脉)中对新鲜分离的平滑肌细胞进行了膜片钳实验15,16。虽然有些方法使用相同类型的胶原酶进行细胞分离,但确切的程序各不相同。很少有研究全面总结了分离血管平滑肌细胞的方法。因此,本研究的重点是从大鼠基底动脉中新鲜分离原代血管平滑肌细胞,并使用全细胞膜片钳技术记录这些细胞中的 Kir 通道电流,为相关领域的研究人员提供了详细而完整的方案。
研究方案
该动物规程经成都中医药大学实验动物福利伦理委员会批准(备案号2024035)。本研究使用雄性 Sprague-Dawley (SD) 大鼠,体重 260-300 g,年龄 8-10 周龄。随意向动物提供水和食物 (SPF 实验动物饲料)。本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 大鼠基底动脉夹层
- 溶液制备
- 如 表 1 所述准备溶液。
- 通过吸入 2% 异氟醚麻醉大鼠。通过捏住脚趾确认深度麻醉。如果需要,给予额外的麻醉剂。立即打开头骨,将大脑暴露在便携式手术台上。
- 将大脑快速转移到含有 4 °C 下饱和 95% O2 和 5% CO2 的 PSS 的培养皿中。 确保溶液的 pH 值为 7.40。
- 将大脑腹侧向上放置在培养皿中,并用针固定。在光学显微镜下,找到基底动脉并使用高压灭菌的镊子和剪刀小心地去除周围的组织(参见 图 1A)。
- 将一根直径为 25 μm 的 2 cm 长的导线插入离体的基底动脉。用金属丝轻轻摩擦内壁,以有效去除血管内皮。
注意:大鼠的基底动脉位于大脑底部的脑干基底沟内,由左右椎动脉汇合形成2.在隔离过程中,请小心处理动脉,以避免过度拉伸或压缩,从而导致损伤。
2. 分离平滑肌细胞
- 在试管 1、2 和 3 中分别将 1 mL 细胞分离溶液、1 mL 酶解物 I 和 1 mL 酶解物 II 预热至 37 °C(参见 图 1B)。
- 将分离的基底动脉转移到试管 2 中。将 95% O2 和 5% CO2 的混合物连续注入管中,并保持酶处理 30 分钟(参见 图 1C)。
- 将基底动脉从试管 2 转移到试管 3。继续将 95% O2 和 5% CO2 注入管中,并保持酶处理 5 分钟(参见 图 1D)。
- 将 1 mL 的 37 °C 细胞分离溶液从试管 1 中加入试管 3 中。继续注射 95% O2 和 5% CO2 ,同时保持酶处理 3 分钟。研磨基底动脉制剂以释放细胞(参见 图 1E)。
- 向试管 3 中加入 4 °C 分离溶液以终止酶促过程(参见 图 1F)。将混合物以 59 × g 离心 6 分钟。用移液管弃去上清液,再次加入4°C分离溶液(参见 图1G),并重复离心两次以除去残留的酶。
- 使用移液管去除上清液,并将 1 mL 细胞悬液在 4 °C 下储存长达 6-8 小时。
- 取 100 μL 细胞悬液,将其放入浴中(参见 图 1H)。向浴中加入 1 mL 细胞外液,让细胞沉淀 40 分钟以附着在底部(见 图 2)。
注:对于处理组中的细胞(例如,BaCl2 或硝普钠),在附着期间,在室温 (22-26°C) 下与相应物质预孵育 40 分钟。
3. 使用全细胞膜片钳记录 Kir 电流
- 微量移液器的制造
- 打开微量移液器拉拔器(请参阅 材料表)。
- 将玻璃管(外径:1.5 mm,内径:1.10 mm,长度:10 cm)放入拉拔器中。选择 程序 1,单击 Enter,然后访问 程序 1。单击控制面板上的 Ramp 进行升温测试,以测量玻璃管的热值。
注意:使用以下参数编辑程序 1:加热:斜坡,拉动:0,速度:25,延迟:1,压力:500,模式:延迟,启用安全加热。更换细丝或玻璃移液器类型时,必须进行 ramp 测试。微量移液器的吸头直径应为 ~1-2 μm,锥体长度约为 5 mm。较小的枪头直径和较长的吸头锥体会导致更高的移液器阻力。 - 插入新的玻璃管,然后选择 程序 1。单击 Enter 以制造微量移液器。
- 记录 Kir 电流
- 按顺序打开硬件设备:数模转换器、信号放大器、显微作器、显微镜、相机和计算机。
- 按以下顺序启动软件:相机、信号放大器和数据采集软件。
注:如果显微镜未配备摄像头,则只需激活仪器软件。确保在硬件初始化后打开软件以启用正确的功能。 - 在数据采集软件中,选择 File > Set Data File Names 以建立数据存储路径。
- 编辑记录 Kir 电流的协议,如下所示:
- 波形界面:纪元 A & D:类型 = 步长;第一电平 = −60 mV;Delta 电平 = 0 mV;第一个持续时间 = 100 毫秒;增量持续时间 = 0 毫秒。纪元 B:类型 = step;第一电平 = −160 mV;Delta 电平 = 0 mV;第一个持续时间 = 1 毫秒;增量持续时间 = 0 毫秒。纪元 C:类型 = 斜坡;第一电平 = 40 mV;Delta 电平 = 20 mV;第一个持续时间 = 500 毫秒;增量持续时间 = 0 毫秒。
- 模式/速率接口:试验延迟 = 0 s;跑动 = 1;扫描 = 1;扫描持续时间 = 0.8 秒。
- 输出接口:通道 #0;保持电平 = −60 mV。将协议保存并命名为 “Kir protocol”。
注意:协议设置是针对特定的当前记录量身定制的,保存后可以重复使用。确保输出接口与仪器的接线匹配(例如,通道 #0)。
- 在数据采集软件的 Tools 菜单中启用 Membrane Test 功能。
- 将要测量的比色皿放置在显微镜相机视图的中心。
- 将参比丝尖端浸入浴液中。用细胞内溶液填充 20% 的微量移液器(在步骤 3.1 中制备),并将其固定在记录电极支架上。
- 使用注射器施加正压,将移液器吸头移入浴液中,并在信号放大器软件上调整移液器偏移量,将当前基线设置为 0 pA(参见 图 3A)。
注意:使用 Ag/AgCl 参考线。移液器电阻应为 4-6 MΩ。
- 使用注射器施加正压,将移液器吸头移入浴液中,并在信号放大器软件上调整移液器偏移量,将当前基线设置为 0 pA(参见 图 3A)。
- 轻轻地将移液器压在细胞膜上。观察到密封电阻 (Rt) 增加到至少 1 MΩ(图 3B)。去除正压并施加负压以建立 Rt ≥ 1 GΩ 的高电阻(图 3C)。
- 将保持电压设置为 −60 mV 并使用 Cp Fast 和 Cp Slow 补偿电极电容(图 3D)。
注意: 如果 Rt 保持在 1 GΩ 以上,请继续执行下一步;否则,更换细胞或移液器并重复步骤 3.2.6-3.2.8。
- 将保持电压设置为 −60 mV 并使用 Cp Fast 和 Cp Slow 补偿电极电容(图 3D)。
- 施加短暂的负压以破坏细胞膜,形成全细胞构型(图 3E)。在信号放大器软件中选择 Whole Cell ,单击 Auto 进行膜电容补偿(图 3F),加载 Kir 协议,然后开始数据记录。对处理过的细胞重复步骤 3.2.6-3.2.9。
注意: 如果串联电阻 (Ra) 为 >30 MΩ,请选择新电池。如果 30 MΩ > Ra > 10 MΩ,请在录制前应用串联电阻补偿。该协议要求 Ra < 10 MΩ。
- 分析数据
- 打开数据分析软件并加载记录的数据。使用光标分析电流轨迹并导出数据以进行 I-V 曲线绘图。
- 通过选择 Edit > Create Stimulus Waveform Signal 创建激励波形信号 并确认。
- 通过选择 Edit > Transfer Traces,指定完整的迹线区域和信号 (A0 #0),并复制数据以供进一步分析,导出 Kir 协议迹线。
- 通过选择 Edit > Transfer Traces,指定完整的迹线区域和信号 (IN 0),并复制数据以生成电流迹线图,导出具有代表性的 Kir 电流迹线。
注:使用电流密度 (pA/pF) 对电流数据进行归一化,以便在不同大小的电池之间进行准确比较。确保在实验期间记录膜电容 (Cm)17。
结果
分离动脉平滑肌细胞
该程序的第一部分详细介绍了从大鼠的大脑基底动脉中分离平滑肌细胞的过程。 此过程如图 1 所示。该程序包括酶消化和细胞分离步骤,以从动脉中释放平滑肌细胞。
分离的平滑肌细胞的代表性图像
第二部分介绍了分离的平滑肌细胞的代表性图表。 图 2 包括纺锤形平滑肌细胞的明场图像,根据其特征形状确认了它们作为平滑肌细胞的身份。
全细胞膜片钳技术
第三部分概述了用于记录新鲜分离的平滑肌细胞中 Kir 电流的全细胞膜片钳技术的流程图。 图 3 提供了膜片钳设置和建立全细胞配置的程序的详细图示。
记录 Kir 电流
第四部分介绍了使用全细胞膜片钳技术从新鲜分离的平滑肌细胞中记录的代表性 Kir 电流。 图 4 显示了记录的电流和不同干预措施对 Kir 通道活动的影响。 图 4A 显示了典型的 Kir 电流,展示了负电压下的向内整流,表明 K+ 的净流入电池。在正电压下,净 K+ 电流极少或没有。 图 4B 说明了特异性抑制剂 BaCl2 对 Kir 电流的抑制。结果表明,浓度为 100-300 μmol/L 的 Ba2+ 有效阻断了 Kir 通道,证实了电流为 Kir。 图 4C 展示了硝基血管扩张剂硝普钠 (SNP) 对 Kir 电流的影响。数据显示 SNP 增加了 Kir 电流,表明 Kir 通道参与了 SNP 诱导的血管舒张。 图 4F 显示了对照组、BaCl2 组和 SNP 组中的电容 (Cm) 值。结果表明,这些组的 Cm 值没有统计学意义。

图 1:动脉平滑肌细胞的分离。(A) 大鼠大脑和基底动脉的腹侧。(B) 在试管 1、2 和 3 中分别将 1 mL 细胞分离液、1 mL 细胞酶解物 I 和 1 mL 细胞酶解物 II 预热至 37 °C。(C-E)通过酶处理将细胞与血管组织分离的三个步骤。(F,G)通过加入 4 °C 分离溶液终止酶处理。(H) 含有动脉平滑肌细胞的细胞液。请单击此处查看此图的较大版本。

图 2:动脉平滑肌细胞。 (A) 新鲜分离的血管平滑肌细胞的明场视图,表现出纺锤体形态。比例尺:10 μm。(B) 适合膜片钳实验的健康细胞。比例尺:30 μm。 请点击此处查看此图的较大版本。
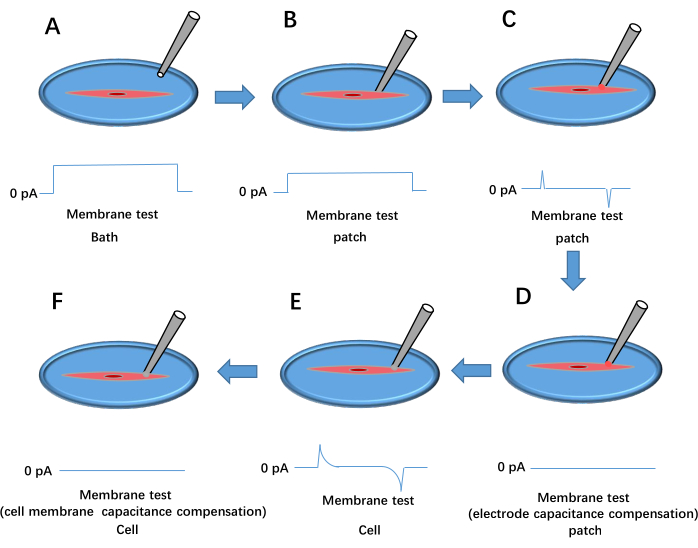
图 3:全细胞膜片钳形成过程。 这显示了电压脉冲膜测试的结果。(A) 将移液管放入浴液中。(B) 移动记录电极以接触电池并压在膜上。(C) 在移液器和电解池之间形成高电阻密封。(D) 电极电容补偿。(E) 细胞膜破裂。(F) 细胞膜电容补偿。 请单击此处查看此图的较大版本。

图 4.动脉平滑肌细胞中的代表性 Kir 电流。 (A) 正常 Kir 电流。(B) 被特异性抑制剂 BaCl2 抑制。(C) 硝普钠 (SNP) 对 Kir 电流的影响。(D) Kir 电流的 I-V 曲线。(E) 统计结果。 p < 0.05,BaCl2 (n = 6) 和 SNP (n = 6) 与对照组 (n = 6) 相比;通过双尾双向方差分析分析差异。(F) Cm (pF), p > 0.05,BaCl2 (n = 6) 和 SNP (n = 6) 与对照组 (n = 6) 相比;通过 T 检验分析差异。刺激方案:保持 -60 mV,从 -160 mV 到 +40 mV 的斜坡刺激 500 ms。对照、BaCl2 和 SNP 分别在不同细胞组中进行。化合物在记录前 40 分钟添加,并且在记录期间可以在浴中保留长达 20 分钟。SNP: 硝普钠。 请单击此处查看此图的较大版本。
| 解决方案类型 | 解决方案组合 | 要点 | ||
| 生理盐溶液 (PSS, mmol/L) | 118 NaCl、4.7 KCl、2.5 CaCl2、1.2 KH2PO4、1.2 MgCl2、25 NaHCO3、11 D-葡萄糖、5 HEPES | 使用前,将溶液浸透并用由 95% O2 和 5% CO2 组成的混合气体鼓泡。然后,使用 NaOH 将溶液的 pH 值调节至 7.4。制作和储存温度分别为室温和 4°C | ||
| 细胞分离液 (mmol/L) | 118 NaCl、4.7 KCl、2.5 CaCl2、1.2 KH2PO4、1.2 MgCl2、25 NaHCO3、11 D-葡萄糖、5 HEPES | 与生理盐溶液相同 | ||
| 细胞酶解物 I | 向细胞分离液中加入牛血清白蛋白 (BSA):1 mg/mL、二硫苏糖醇 (DTT):1 mg/mL 和木瓜蛋白酶:0.5 mg/mL | 立即准备溶液以供使用。在室温下制作的温度 | ||
| 细胞酶解物 II | 向细胞分离液中加入BSA:1 mg/mL、胶原酶H:0.3 mg/mL和胶原酶F:0.7 mg/mL | 与 Cell 酶解物 I 相同 | ||
| Kir 电流浴液 (mmol/L) | 12 氯化钠、130 氯化钾、0.4 KH2PO4 、0.3 NaH2PO4、2 氯化钠3 、1 MgCl2 、1.8 氯化钙2 、10 HEPES、5.5 葡萄糖 | 使用 NaOH 调节至 7.4 的 pH 值和 310 mOsm 的渗透压。制作和储存温度分别为室温和 4°C | ||
| Kir 电流移液器充填液(mmol/L) | 100 葡萄糖酸钾、30 KCl、1 MgCl2、1 EGTA、15 HEPES、1 Na2-ATP | 使用 KOH 调节至 7.2 的 pH 值和 300 mOsm 的渗透压。制作和储存温度分别为室温和 -20°C | ||
表 1:各种溶液的组成和制备注意事项。
讨论
使用新鲜分离的细胞进行全细胞记录可以追溯到 1980 年代初期18,而记录啮齿动物基底平滑肌细胞的通道电流在 1990 年代得到广泛应用19。随着技术的进步,研究人员越来越关注通过这些技术获得的结果。然而,对更新和总结技术方法的关注已经逐渐减少。本文介绍了一种血管平滑肌细胞新鲜分离的详细方法,并随后使用这些细胞来记录 Kir 电流,旨在帮助研究人员了解标准方法过程。
血管平滑肌在调节动脉张力方面起着至关重要的作用。已经报道了许多分离血管平滑肌细胞的方法 20,21,22,23,24,25,其中大多数涉及酶水解。然而,酶的类型和步骤因研究而异,不同的实验条件会影响酶效率。本文介绍了一种酶解方法,与以前的研究相比,对酶的类型和程序进行了轻微的修改。它为原代血管平滑肌细胞的急性分离提供了详细的方案。
该协议的关键步骤是步骤 2.2 至 2.4,因为这些步骤的成功完成直接影响分离细胞的质量。分离的血管平滑肌细胞适用于各种应用,包括研究离子通道的膜片钳实验、用于分子研究的 RNA 和蛋白质提取以及用于研究细胞上蛋白质表达的免疫荧光。因此,该方法为相关研究人员提供了一种通用的方法,提供了更多的实验选择。
动脉平滑肌细胞膜上的钾 (K+) 电导在调节膜电位、血管张力以及最终的局部血流中起着至关重要的作用26,27。Kir 通道是动脉平滑肌细胞中的一种 K+ 通道,有助于稳定膜电位并充当其他 K+ 通道的电放大器。激活后,Kir 通道诱导膜超极化并促进血管扩张28。膜片钳技术长期以来一直被认为是离子通道研究的金标准29,30,全细胞膜片钳是最常用的方法31。虽然这种技术需要高水平的作员技能,但熟练程度最终取决于遵循标准化协议。
本研究提出了一种详细的标准化程序,用于使用全细胞膜片钳记录新鲜分离的血管平滑肌细胞的 Kir 电流,为研究人员提供有价值的参考。协议中的关键步骤是步骤 3.2.7 到 3.2.9,因为这些步骤的成功完成决定了后续的 Kir 电流记录是否会成功。此外,细胞内液和浴液的选择会显著影响记录的电流。例如,在本研究中使用细胞外高钾旨在充分激活向内的整流钾通道。因此,实验的成功取决于对每个作细节的仔细关注。
虽然新鲜分离的细胞比细胞系具有更多的生理相关性,但存在固有的局限性。这些因素包括环境温度对酶分离的影响、不同直径血管的不同消化时间以及细胞天然环境的不稳定性。因此,通常需要调整酶消化时间。膜片钳技术也带来了技术挑战,尤其是在密封和膜破裂步骤中,这需要很高的作技能。细胞的状态直接影响整个膜片钳程序的成功。因此,仔细注意这些限制对于确保实验的成功至关重要。
Ba2+ 已被广泛用作特异性阻断剂,用于研究 Kir 通道在细胞和组织中的作用。在浓度低于 100 μmol/L 时,Ba2+ 选择性阻断 Kir 通道,而浓度高达 300 μmol/L 可完全阻断Kir 通道 32。在本研究中,BaCl2 用于验证 Kir 通道电流。
Kir 通道受血管收缩剂和血管扩张剂的调节。SNP (硝普钠) 是一种硝基血管扩张剂,在本研究中用于探索这一点。SNP 在血管平滑肌中代谢产生一氧化氮,一氧化氮通过作用于静脉和动脉平滑肌来降低全身血管阻力,从而可能提高心输出量。由于其起效快、半衰期短,SNP 通常用作预防和治疗高血压的一线药物33。该研究观察到 SNP 增加了基底动脉平滑肌细胞中的 Kir 电流,表明在 SNP 诱导的血管舒张过程中 Kir 通道被激活。
目前记录的一个局限性是它们是从不同的细胞组获得的,并且通过分析组之间的电流密度来进行比较。一种更精细的方法将涉及记录相同细胞在应用化合物之前和之后的反应,这将最大限度地减少细胞间差异对数据解释的影响。
总之,本文为大鼠基底动脉平滑肌细胞的急性分离和使用全细胞膜片钳研究 Kir 电流提供了详细的方案。该方案用途广泛,可应用于来自其他动脉的平滑肌细胞,例如冠状动脉、肠系膜动脉和肾动脉。但是,酶分离时间可能需要根据动脉的类型进行调整。此外,分离的动脉平滑肌细胞可用于各种其他实验技术。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了成都中医药大学“杏林学者和学科人才研究促进计划”(33002324)和吕梁市引进高层次科技人才重点研发项目(2022RC28)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
参考文献
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。