Method Article
Aufzeichnung von nach innen gerichteten gleichgerichteten k+ Strömen in frisch isolierten glatten Muskelzellen der Arteria basilaris mittels Patch-Clamp-Technik
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein schnelles und effizientes Verfahren zur Isolierung glatter Muskelzellen aus der Basilararterie der Ratte und zur Aufzeichnung von nach innen gerichteten gleichgerichteten Kaliumkanalströmen in diesen Zellen unter Verwendung der Ganzzell-Patch-Clamp-Technik. Es bietet einen neuartigen Ansatz für Forscher, die die Arteria basilaris und die Ionenkanäle untersuchen.
Zusammenfassung
Zerebrovaskuläre Erkrankungen sind eine weit verbreitete Erkrankung bei älteren Menschen, deren Inzidenz stetig zunimmt. Die Arteria basilaris ist ein kritisches Hirngefäß, das die Pons, das Kleinhirn, die hinteren Hirnregionen und das Innenohr versorgt. Die Aktivität des Kaliumkanals (K+) spielt eine wichtige Rolle bei der Bestimmung des Gefäßtonus, indem sie das Zellmembranpotenzial reguliert. Die Aktivierung der nach innen gerichteten gleichrichtenden K+ (Kir)-Kanäle führt wie andere K+ -Kanäle zu einer Hyperpolarisation und Vasodilatation der Zellmembran. In dieser Studie wurden frisch isolierte glatte Muskelzellen aus der Arteria basilaris verwendet, um Kir-Ströme mit Hilfe der Ganzzell-Patch-Clamp-Technik aufzuzeichnen. Es wurden die Auswirkungen von 100 μmol/L BaCl2, einem Kir-Kanal-Inhibitor, und 10 μmol/L Natriumnitroprussid (SNP), einem Nitro-Vasodilatator, auf die Kir-Kanalströme untersucht. Die Ergebnisse zeigten, dass BaCl2 die Kir-Kanalströme in glatten Muskelzellen der Basilararterie hemmte, während SNP diese Ströme verstärkte. Dieses Protokoll bietet einen umfassenden Leitfaden für die Aufbereitung frisch isolierter arterieller glatter Muskelzellen und die Aufzeichnung von Kir-Kanalströmen mit der Patch-Clamp-Technik und bietet eine wertvolle Ressource für Forscher, die diese Methode beherrschen möchten.
Einleitung
Zerebrovaskuläre Erkrankungen sind eine weit verbreitete Erkrankung in der älteren Bevölkerung. Mit der Verbesserung des Lebensstandards, der gestiegenen Lebenserwartung und der alternden Bevölkerung steigt die Inzidenz von zerebrovaskulären Erkrankungen stetigan 1. Die Arteria basilaris, ein unpaariges Gefäß, das durch die Verschmelzung der beidseitigen Wirbelarterien gebildet wird, verläuft unter den Pons im Schädel und teilt sich in zwei hintere Hirnarterien. Es versorgt die Pons, das Kleinhirn, die hinteren Regionen des Gehirns und das Innenohr. Eine unzureichende Blutversorgung der Arteria basilaris kann zu episodischem Schwindel führen, der oft von Übelkeit und Erbrechen begleitet wird. Bei den Patienten können auch Symptome wie Tinnitus, Hörverlust und andere damit zusammenhängende Probleme auftreten. Diese Symptome sind häufig mit Erkrankungen wie zervikaler Spondylose, zerebraler Atherosklerose und abnormalem Blutdruck verbunden. Zerebrovaskuläre Erkrankungen, die besonders bei Menschen mittleren Alters und älteren Menschen auftreten, sind häufig mit diesen Grunderkrankungen verbunden 2,3,4.
Widerstandsarterien spielen eine wichtige Rolle für die kardiovaskuläre Funktion und die Aufrechterhaltung der Homöostase des Körpers. Als primärer Ort des Gefäßwiderstands regulieren sie den Blutdruck und das Herzzeitvolumen und sorgen so für eine ausreichende Durchblutung, um den metabolischen und physiologischen Anforderungen von Geweben und Organen gerecht zu werden5. Die Arteria basilaris, die als Widerstandsarterie klassifiziert wird, reguliert in erster Linie den Blutfluss zum Hirnstamm6. Glatte Muskelzellen, die die Wände der Widerstandsarterien bilden, sind wichtige Mediatoren des Gefäßwiderstands durch die Regulierung der Steady-State-Kontraktion oder der Gefäßspannung. Diese Zellen beherbergen zahlreiche Ionenkanäle, darunter K+-Kanäle, Ca2+-Kanäle und Cl-Kanäle, die für die Modulation des Gefäßtonus entscheidend sind 5,7.
K+-Kanäle sind entscheidend für die Etablierung des Membranpotentials und die Regulierung des kontraktilen Tonus der arteriellen glatten Muskelzellen8. Es gibt vier Arten von K+-Kanälen in der arteriellen glatten Muskulatur: spannungsabhängige K+ (Kᴠ), Ca2+-abhängige K+ (KCa), ATP-abhängige K+ (KATP) und nach innen gerichtete Gleichrichterkanäle K+ (Kir) 9,10,11. Kir-Kanäle werden in sieben Untertypen eingeteilt, wobei Kir2.x klassische Kir-Kanäle sind. Unter diesen sind die Kir2.x-Unterfamilien im Gefäßsystem am relevantesten. Kir-Ströme weisen bei negativen Spannungen eine Gleichrichtung nach innen auf, was auf einen Nettoeinstrom von K+ in die Zelle hinweist, während bei positiven Spannungen nur ein minimaler bis kein Netto-K+-Stromflussvorhanden ist 5. Im Herz-Kreislauf-System sind Kir-Kanäle essentiell für die Stabilisierung des Membranpotentials. Ihre Aktivierung induziert die Hyperpolarisation und Vasodilatation der Zellmembran 12,13,14.
Patch-Clamp-Experimente an frisch isolierten glatten Muskelzellen wurden in verschiedenen Arterien durchgeführt, darunter Koronararterien, Hirn-, Nieren- und Mesenterialarterien15,16. Während einige Methoden die gleiche Art von Kollagenase für die Zellisolierung verwenden, variieren die genauen Verfahren. Nur wenige Studien haben die Methoden zur Isolierung von glatten Gefäßzellen umfassend zusammengefasst. Daher konzentriert sich diese Studie auf die frische Isolierung primärer vaskulärer glatter Muskelzellen aus der Basilararterie der Ratte und die Aufzeichnung von Kir-Kanalströmen in diesen Zellen unter Verwendung der Ganzzell-Patch-Clamp-Technik, um Forschern in verwandten Bereichen ein detailliertes und vollständiges Protokoll zur Verfügung zu stellen.
Protokoll
Das Tierprotokoll wurde von der Ethikkommission für Labortierschutz der Universität Chengdu (Aktenzeichen 2024035) genehmigt. In dieser Studie wurden männliche Sprague-Dawley (SD) Ratten mit einem Gewicht von 260-300 g und einem Alter von 8-10 Wochen verwendet. Die Tiere wurden ad libitum mit Wasser und Futter (SPF-Versuchsfutter) versorgt. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Dissektion der Basilararterie der Ratte
- Vorbereitung der Lösung
- Bereiten Sie Lösungen vor, wie in Tabelle 1 beschrieben.
- Betäuben Sie die Ratte durch Inhalation von 2% Isofluran. Bestätigen Sie die Tiefenanästhesie mit einem Zehenkneifen. Verabreichen Sie bei Bedarf zusätzliche Betäubungsmittel. Fahren Sie sofort damit fort, den Schädel zu öffnen und das Gehirn auf dem tragbaren Operationstisch freizulegen.
- Übertragen Sie das Gehirn schnell in eine Petrischale, die PSS enthält, das mit 95 % O2 und 5 % CO2 bei 4 °C gesättigt ist. Stellen Sie sicher, dass die Lösung einen pH-Wert von 7,40 hat.
- Positionieren Sie das Gehirn ventral nach oben in einer Petrischale und sichern Sie es mit Nadeln. Lokalisieren Sie unter einem Lichtmikroskop die Arteria basilaris und entfernen Sie vorsichtig das umgebende Gewebe mit einer autoklavierten Pinzette und einer Schere (siehe Abbildung 1A).
- Führen Sie einen 2 cm langen Draht mit einem Durchmesser von 25 μm in die isolierte Arteria basilaris ein. Reiben Sie die Innenwand vorsichtig mit dem Draht ab, um das Gefäßendothel effektiv zu entfernen.
HINWEIS: Die Arteria basilaris befindet sich bei Ratten in den basalen Sulci des Hirnstamms an der Basis des Gehirns und wird durch den Zusammenfluss der linken und rechten Wirbelarterien gebildet2. Gehen Sie während des Isolierungsprozesses vorsichtig mit der Arterie um, um übermäßige Dehnung oder Kompression zu vermeiden, die zu Schäden führen könnte.
2. Isolierung der glatten Muskelzellen
- 1 ml Zelltrennlösung, 1 ml enzymatisches Hydrolysat I und 1 ml enzymatisches Hydrolysat II in den Reagenzgläsern 1, 2 und 3 auf 37 °C vorwärmen (siehe Abbildung 1B).
- Übertragen Sie die isolierte Arteria basilaris in das Reagenzglas 2. Injizieren Sie kontinuierlich ein Gemisch aus 95 %O2 und 5 % CO2 in das Röhrchen und halten Sie die enzymatische Behandlung 30 Minuten lang aufrecht (siehe Abbildung 1C).
- Übertragen Sie die Arteria basilaris aus dem Reagenzglas 2 in das Reagenzglas 3. Injizieren Sie weiterhin 95 %O2 und 5 % CO2 in die Sonde und setzen Sie die enzymatische Behandlung 5 Minuten lang fort (siehe Abbildung 1D).
- 1 ml 37 °C Zelltrennlösung aus dem Reagenzglas 1 in das Reagenzglas 3 geben. Setzen Sie die Injektion von 95 %O2 und 5 % CO2 fort, während die enzymatische Behandlung 3 Minuten lang aufrechterhalten wird. Zerreiben Sie das Präparat der Arteria basilaris, um Zellen freizusetzen (siehe Abbildung 1E).
- Geben Sie 4 °C Trennlösung in das Reagenzglas 3, um den enzymatischen Prozess zu beenden (siehe Abbildung 1F). Die Mischung bei 59 × g 6 min zentrifugieren. Der Überstand wird mit einer Pipette verworfen, die 4 °C-Trennlösung erneut zugegeben (siehe Abbildung 1G) und die Zentrifugation zweimal wiederholt, um die Enzymreste zu entfernen.
- Entfernen Sie den Überstand mit einer Pipette und lagern Sie 1 ml der Zellsuspension bei 4 °C für bis zu 6-8 h.
- Nehmen Sie 100 μl der Zellsuspension und legen Sie sie in das Bad (siehe Abbildung 1H). Geben Sie 1 ml extrazelluläre Flüssigkeit in das Bad und lassen Sie die Zellen 40 Minuten lang ruhen, um sich am Boden festzusetzen (siehe Abbildung 2).
HINWEIS: Bei Zellen der Behandlungsgruppe (z. B. BaCl2 oder Natriumnitroprussid) wird die jeweilige Substanz während der Anheftungszeit 40 Minuten lang bei Raumtemperatur (22-26 °C) vorinkubiert.
3. Aufzeichnung des Kir-Stroms mit einer Ganzzell-Patch-Klemme
- Herstellung von Mikropipetten
- Schalten Sie den Mikropipettenabzieher ein (siehe Materialtabelle).
- Legen Sie ein Glasrohr (Außendurchmesser: 1,5 mm, Innendurchmesser: 1,10 mm, Länge: 10 cm) in den Abzieher. Wählen Sie Programm 1 aus, klicken Sie auf Enter und rufen Sie Programm 1 auf. Führen Sie einen Rampentest durch, indem Sie auf dem Bedienfeld auf Rampe klicken, um den Heizwert des Glasrohrs zu messen.
HINWEIS: Bearbeiten Sie Programm 1 mit den folgenden Parametern: Wärme: Rampe, Zug: 0, Geschwindigkeit: 25, Verzögerung: 1, Druck: 500, Modus: Verzögerung, Sichere Hitze aktiviert. Der Rampentest muss beim Wechsel von Filamenten oder Glaspipettentypen durchgeführt werden. Mikropipetten sollten einen Spitzendurchmesser von ~1-2 μm und eine Konuslänge von ca. 5 mm haben. Kleinere Spitzendurchmesser und längere Konen führen zu einem höheren Pipettenwiderstand. - Setzen Sie ein neues Glasrohr ein und wählen Sie Programm 1. Klicken Sie auf Enter , um die Mikropipette herzustellen.
- Aufnahme von Kir Current
- Schalten Sie die Hardwaregeräte nacheinander ein: Digital-Analog-Wandler, Signalverstärker, Mikromanipulator, Mikroskop, Kamera und Computer.
- Starten Sie die Software in der folgenden Reihenfolge: Kamera, Signalverstärker und Datenerfassungssoftware.
HINWEIS: Wenn ein Mikroskop nicht mit einer Kamera ausgestattet ist, muss nur die Gerätesoftware aktiviert werden. Stellen Sie sicher, dass die Software nach der Hardwareinitialisierung geöffnet wird, um die ordnungsgemäße Funktionalität zu ermöglichen. - Wählen Sie in der Datenerfassungssoftware Datei > Datendateinamen festlegen , um einen Datenspeicherpfad einzurichten.
- Bearbeiten Sie das Protokoll für die Aufzeichnung von Kir-Strömen wie folgt:
- Wellenform-Schnittstelle: Epoche A & D: Typ = Schritt; Erste Stufe = −60 mV; Delta-Pegel = 0 mV; Erste Dauer = 100 ms; Delta-Dauer = 0 ms. Epoche B: Typ = Schritt; Erste Stufe = −160 mV; Delta-Pegel = 0 mV; Erste Dauer = 1 ms; Delta-Dauer = 0 ms. Epoche C: Typ = Rampe; Erste Stufe = 40 mV; Delta-Pegel = 20 mV; Erste Dauer = 500 ms; Delta-Dauer = 0 ms.
- Modus/Rate-Schnittstelle: Verzögerung der Testversion = 0 s; Läufe = 1; Sweeps = 1; Sweep-Dauer = 0,8 s.
- Ausgänge Schnittstelle: Kanal #0; Haltehöhe = −60 mV. Speichern Sie das Protokoll, und benennen Sie es als "Kir-Protokoll".
HINWEIS: Die Protokolleinrichtung ist auf bestimmte aktuelle Aufzeichnungen zugeschnitten und kann nach dem Speichern wiederverwendet werden. Stellen Sie sicher, dass die Ausgangsschnittstelle mit der Verkabelung des Instruments übereinstimmt (z. B. Kanal #0).
- Aktivieren Sie die Funktion Membrantest im Menü Extras der Datenerfassungssoftware.
- Positionieren Sie die Zelle für die Messung in der Mitte der Kameraansicht des Mikroskops.
- Tauchen Sie die Referenzdrahtspitze in die Badlösung. Füllen Sie 20 % der Mikropipette (hergestellt in Schritt 3.1) mit der intrazellulären Lösung und befestigen Sie sie auf dem Halter der Aufzeichnungselektrode.
- Üben Sie mit einer Spritze einen Überdruck aus, bewegen Sie die Pipettenspitze in die Badlösung und stellen Sie den Pipettenoffset an der Signalverstärkersoftware so ein, dass die Strombasis auf 0 pA eingestellt wird (siehe Abbildung 3A).
HINWEIS: Verwenden Sie Ag/AgCl-Referenzdrähte. Der Pipettenwiderstand sollte 4-6 MΩ betragen.
- Üben Sie mit einer Spritze einen Überdruck aus, bewegen Sie die Pipettenspitze in die Badlösung und stellen Sie den Pipettenoffset an der Signalverstärkersoftware so ein, dass die Strombasis auf 0 pA eingestellt wird (siehe Abbildung 3A).
- Drücken Sie die Pipette vorsichtig gegen die Zellmembran. Es ist eine Erhöhung des Dichtungswiderstands (Rt) auf mindestens 1 MΩ zu beobachten (Abbildung 3B). Entfernen Sie den Überdruck und wenden Sie einen Unterdruck an, um einen hohen Widerstand mit Rt ≥ 1 GΩ herzustellen (Abbildung 3C).
- Stellen Sie die Haltespannung auf -60 mV ein und kompensieren Sie die Elektrodenkapazität mit Cp Fast und Cp Slow (Abbildung 3D).
HINWEIS: Wenn Rt über 1 GΩ bleibt, fahren Sie mit dem nächsten Schritt fort. Andernfalls setzen Sie die Zelle oder Pipette wieder ein und wiederholen Sie die Schritte 3.2.6 bis 3.2.8.
- Stellen Sie die Haltespannung auf -60 mV ein und kompensieren Sie die Elektrodenkapazität mit Cp Fast und Cp Slow (Abbildung 3D).
- Üben Sie einen kurzen Unterdruck aus, um die Zellmembran zu durchbrechen und eine Ganzzellkonfiguration zu bilden (Abbildung 3E). Wählen Sie in der Signalverstärkersoftware die Option Ganze Zelle , klicken Sie auf Auto für die Membrankapazitätskompensation (Abbildung 3F), laden Sie das Kir-Protokoll und beginnen Sie mit der Datenaufzeichnung. Die Schritte 3.2.6 bis 3.2.9 für behandelte Zellen wiederholen.
HINWEIS: Wenn der Serienwiderstand (Ra) >30 MΩ beträgt, wählen Sie eine neue Zelle aus. Bei 30 MΩ > Ra > 10 MΩ, vor der Aufnahme eine Serienwiderstandskompensation anwenden. Dieses Protokoll erfordert Ra < 10 MΩ.
- Analysieren von Daten
- Öffnen Sie die Datenanalysesoftware und laden Sie die aufgezeichneten Daten. Verwenden Sie Cursor, um aktuelle Kurven zu analysieren und Daten für die Darstellung von I-V-Kurven zu exportieren.
- Erstellen Sie ein Stimulus-Wellenformsignal, indem Sie Bearbeiten > Stimulus-Wellenformsignal erstellen auswählen und bestätigen.
- Exportieren Sie die Kir-Protokoll-Ablaufverfolgung, indem Sie Edit > Transfer Traces auswählen, den vollständigen Trace-Bereich und das Signal (A0 #0) angeben und die Daten zur weiteren Analyse kopieren.
- Exportieren Sie repräsentative Kir-Stromkurven, indem Sie Bearbeiten > Leiterbahnen übertragen, den vollständigen Leiterbahnbereich und das Signal (IN 0) angeben und Daten kopieren, um aktuelle Kurvendiagramme zu erstellen.
HINWEIS: Normalisieren Sie die Stromdaten anhand der Stromdichte (pA/pF) für einen genauen Vergleich zwischen Zellen unterschiedlicher Größe. Es ist sicherzustellen, dass die Membrankapazität (Cm) während des Experiments aufgezeichnetwird 17.
Ergebnisse
Isolierung von arteriellen glatten Muskelzellen
Der erste Abschnitt des Verfahrens beschreibt den Prozess der Isolierung glatter Muskelzellen aus der zerebralen Basilararterie der Ratte. Dieser Prozess ist in Abbildung 1 dargestellt. Das Verfahren umfasst enzymatische Verdauungs- und Zelltrennungsschritte, um glatte Muskelzellen aus der Arterie freizusetzen.
Repräsentative Bilder von isolierten glatten Muskelzellen
Der zweite Abschnitt zeigt ein repräsentatives Diagramm der isolierten glatten Muskelzellen. Abbildung 2 enthält Hellfeldbilder von spindelförmigen glatten Muskelzellen, die ihre Identität als glatte Muskelzellen anhand ihrer charakteristischen Form bestätigen.
Ganzzell-Patch-Clamp-Technik
Der dritte Abschnitt skizziert das Flussdiagramm der Ganzzell-Patch-Clamp-Technik, die zur Aufzeichnung von Kir-Strömen in frisch isolierten glatten Muskelzellen verwendet wird. Abbildung 3 zeigt eine detaillierte Darstellung des Patch-Clamp-Setups und der Verfahren zum Einrichten einer Ganzzellenkonfiguration.
Aufzeichnen des Kir-Stroms
Der vierte Teil stellt den repräsentativen Kir-Strom vor, der aus frisch isolierten glatten Muskelzellen mit der Ganzzell-Patch-Clamp-Technik aufgezeichnet wurde. Abbildung 4 zeigt die aufgezeichneten Ströme und die Auswirkungen verschiedener Eingriffe auf die Aktivität des Kir-Kanals. Abbildung 4A zeigt den typischen Kir-Strom, der die Gleichrichtung nach innen bei negativen Spannungen demonstriert und den Nettoeinstrom von K+ in die Zelle anzeigt. Bei positiven Spannungen fließt nur ein minimaler bis gar kein Netto-K+-Stromfluss. Abbildung 4B zeigt die Hemmung der Kir-Ströme durch den spezifischen Inhibitor BaCl2. Die Ergebnisse zeigen, dass Ba2+ bei Konzentrationen von 100-300 μmol/L die Kir-Kanäle effektiv blockiert, was den Strom als Kir bestätigt. Abbildung 4C zeigt die Wirkung von Natriumnitroprussid (SNP), einem Nitrovasodilatator, auf die Kir-Ströme. Die Daten zeigen, dass SNP den Kir-Strom erhöht, was auf eine Beteiligung von Kir-Kanälen an der SNP-induzierten Vasodilatation hindeutet. Abbildung 4F zeigt die Kapazitätswerte (Cm) in den Gruppen Kontrolle, BaCl2 und SNP. Die Ergebnisse deuten auf keine statistische Signifikanz der Cm-Werte in diesen Gruppen hin.

Abbildung 1: Isolierung von arteriellen glatten Muskelzellen. (A) Die ventrale Seite des Rattengehirns und der Arteria basilaris. (B) Vorwärmen von 1 ml Zelltrennlösung, 1 ml enzymatischem Zellhydrolysat I und 1 ml enzymatischem Zellhydrolysat II auf 37 °C in den Reagenzgläsern 1, 2 bzw. 3. (C-E) Die drei Schritte der Trennung von Zellen vom Gefäßgewebe durch enzymatische Behandlung. (F,G) Beendigung der enzymatischen Behandlung durch Zugabe von 4 °C Trennlösung. (H) Zellflüssigkeit, die arterielle glatte Muskelzellen enthält. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Arterielle glatte Muskelzellen. (A) Hellfeldansicht von frisch isolierten vaskulären glatten Muskelzellen, die eine Spindelmorphologie aufweisen. Maßstabsbalken: 10 μm. (B) Gesunde Zellen, die für Patch-Clamp-Experimente geeignet sind. Maßstabsleiste: 30 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
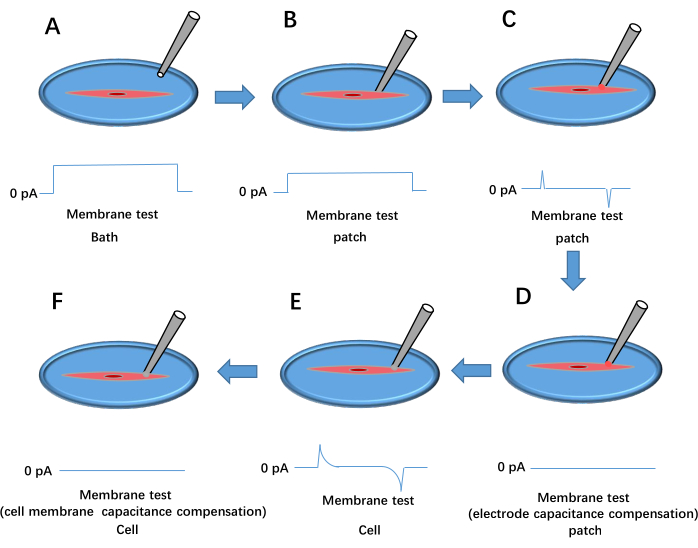
Abbildung 3: Prozess der Bildung von Patch-Clamps für ganze Zellen. Dies zeigt das Ergebnis des Spannungsimpulsmembrantests. (A) Die Pipette wird in das Bad fallen gelassen. (B) Die Aufzeichnungselektrode wird so bewegt, dass sie die Zelle berührt, und gegen die Membran gedrückt. (C) Bildung einer hochohmigen Dichtung zwischen der Pipette und der Zelle. (D) Kompensation der Elektrodenkapazität. (E) Riss der Zellmembran. (F) Kompensation der Zellmembrankapazität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4. Repräsentativer Kir-Strom in arteriellen glatten Muskelzellen. (A) Normaler Kir-Strom. (B) Hemmung durch den spezifischen Inhibitor BaCl2. (C) Wirkung von Natriumnitroprussid (SNP) auf den Kir-Strom. (D) I-V-Kurve der Kir-Ströme. (E) Statistische Ergebnisse. p < 0,05, BaCl2 (n = 6) und SNP (n = 6) im Vergleich zur Kontrollgruppe (n = 6); Die Unterschiede wurden mittels zweiseitiger Zwei-Wege-ANOVA analysiert. (F) Cm (pF), p > 0,05, BaCl2 (n = 6) und SNP (n = 6) im Vergleich zur Kontrollgruppe (n = 6); Die Unterschiede wurden mittels t-Test analysiert. Stimulationsprotokoll: Halten bei -60 mV mit Rampenstimulation von -160 mV bis +40 mV für 500 ms. Kontrolle, BaCl2 und SNP wurden getrennt in verschiedenen Zellgruppen durchgeführt. Die Verbindungen wurden 40 Minuten vor der Aufzeichnung hinzugefügt und konnten während der Aufzeichnung bis zu 20 Minuten im Bad verbleiben. SNP: Natriumnitroprussid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Art der Lösung | Zusammensetzung der Lösung | Wichtige Punkte | ||
| Physiologische Salzlösung (PSS, mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-Glukose, 5 HEPES | Tränken Sie die Lösung und blasen Sie sie vor Gebrauch mit einem Mischgas, das aus 95 % O2 und 5 % CO2 besteht. Stellen Sie dann den pH-Wert der Lösung mit NaOH auf 7,4 ein. Temperatur für die Herstellung und Lagerung bei Raumtemperatur bzw. 4 °C | ||
| Lösung für die Zelltrennung (mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-Glukose, 5 HEPES | Wie die physiologische Salzlösung | ||
| Zellenzymatisches Hydrolysat I | Rinderserumalbumin (BSA): 1 mg/ml, Dithiothreitol (DTT): 1 mg/ml und Papain: 0,5 mg/ml wurden der Zelltrennungslösung zugesetzt | Bereiten Sie die Lösung sofort für den Gebrauch vor. Temperatur für die Zubereitung bei Raumtemperatur | ||
| Zellenzymatisches Hydrolysat II | BSA: 1 mg/ml, Kollagenase H: 0,3 mg/ml und Kollagenase F: 0,7 mg/ml wurden in die Zelltrennungslösung gegeben | Wie das enzymatische Hydrolysat I der Zelle | ||
| Kir-Strombadlösung (mmol/L) | 12 NaCl, 130 KCl, 0,4 KH2PO4 , 0,3 NaH2PO4, 2 NaHCO3 , 1 MgCl2 , 1,8 CaCl2 , 10 HEPES, 5,5 Glukose | Eingestellt auf einen pH-Wert von 7,4 unter Verwendung von NaOH und eine Osmolarität von 310 mOsm. Temperatur für die Herstellung und Lagerung bei Raumtemperatur bzw. 4 °C | ||
| Kir aktuelle Pipettenfülllösung (mmol/L) | 100 Kalium-D-gluconat, 30 KCl, 1 MgCl2 , 1 EGTA, 15 HEPES, 1 Na2-ATP | Eingestellt auf einen pH-Wert von 7,2 mit KOH und eine Osmolarität von 300 mOsm. Temperatur für die Herstellung und Lagerung bei Raumtemperatur bzw. -20 °C | ||
Tabelle 1: Vorsichtsmaßnahmen bei der Zusammensetzung und Zubereitung verschiedener Lösungen.
Diskussion
Die Ganzzellaufzeichnung mit frisch isolierten Zellen geht auf die frühen 1980er Jahre zurück18, und die Aufzeichnung von Kanalströmen aus basilären glatten Muskelzellen von Nagetieren wurde in den 1990er Jahren weit verbreitet19. Mit dem technologischen Fortschritt konzentrieren sich die Forscher zunehmend auf die Ergebnisse, die durch diese Technologien erzielt werden. Die Aufmerksamkeit, die der Aktualisierung und Zusammenfassung der technischen Methoden gewidmet wird, hat jedoch allmählich abgenommen. In diesem Artikel wird eine detaillierte Methode für die frische Trennung von glatten Gefäßmuskelzellen und die anschließende Verwendung dieser Zellen zur Aufzeichnung von Kir-Strömen vorgestellt, um den Forschern das Verständnis des methodischen Standardprozesses zu erleichtern.
Die glatte Gefäßmuskulatur spielt eine entscheidende Rolle bei der Regulierung der arteriellen Spannung. Es wurde über zahlreiche Verfahren zur Trennung von glatten Gefäßmuskelzellen berichtet 20,21,22,23,24,25, von denen die meisten eine enzymatische Hydrolyse beinhalten. Die Arten und Schritte von Enzymen variieren jedoch von Studie zu Studien, und unterschiedliche experimentelle Bedingungen können die enzymatische Effizienz beeinflussen. In diesem Artikel wird eine enzymatische Hydrolysemethode vorgestellt, bei der die Enzymtypen und -verfahren im Vergleich zu früheren Studien geringfügig modifiziert wurden. Es bietet ein detailliertes Protokoll für die akute Trennung von primären vaskulären glatten Muskelzellen.
Die wichtigsten Schritte dieses Protokolls sind die Schritte 2.2 bis 2.4, da sich der erfolgreiche Abschluss dieser Schritte direkt auf die Qualität der isolierten Zellen auswirkt. Die isolierten vaskulären glatten Muskelzellen eignen sich für verschiedene Anwendungen, darunter Patch-Clamp-Experimente zur Untersuchung von Ionenkanälen, RNA- und Proteinextraktion für molekulare Studien und Immunfluoreszenz zur Untersuchung der Proteinexpression auf Zellen. Folglich bietet diese Methode einen vielseitigen Ansatz für relevante Forscher und bietet mehr experimentelle Optionen.
Die Kaliumleitfähigkeit (K+) auf der Membran der arteriellen glatten Muskelzellen spielt eine entscheidende Rolle bei der Regulierung des Membranpotentials, der Gefäßspannung und letztendlich des lokalen Blutflusses26,27. Der Kir-Kanal, eine Art K+-Kanal, der in arteriellen glatten Muskelzellen vorkommt, hilft, das Membranpotenzial zu stabilisieren und fungiert als elektrischer Verstärker für andere K+-Kanäle. Wenn der Kir-Kanal aktiviert wird, induziert er die Hyperpolarisation der Membran und fördert die Gefäßerweiterung28. Die Patch-Clamp-Technologie gilt seit langem als Goldstandard für die Ionenkanalforschung29,30, wobei die Ganzzell-Patch-Clamp die am häufigsten verwendete Methodeist 31. Während diese Technik ein hohes Maß an Bedienerfähigkeiten erfordert, hängt die Kompetenz letztendlich von der Befolgung standardisierter Protokolle ab.
Diese Studie stellt ein detailliertes, standardisiertes Verfahren zur Aufzeichnung von Kir-Strömen aus frisch isolierten vaskulären glatten Muskelzellen mit einer Ganzzell-Patch-Klemme vor und stellt eine wertvolle Referenz für Forscher dar. Kritische Schritte im Protokoll sind die Schritte 3.2.7 bis 3.2.9, da der erfolgreiche Abschluss dieser Schritte darüber entscheidet, ob nachfolgende Kir-Stromaufzeichnungen erfolgreich sein werden. Darüber hinaus hat die Auswahl der intrazellulären und Badflüssigkeiten einen erheblichen Einfluss auf den aufgezeichneten Strom. Zum Beispiel sollte die Verwendung von extrazellulärem hohem Kalium in dieser Studie den nach innen gerichteten Gleichrichter-Kaliumkanal vollständig aktivieren. Daher hängt der Erfolg des Experiments von der sorgfältigen Beachtung jedes operativen Details ab.
Frisch isolierte Zellen bieten zwar eine höhere physiologische Relevanz als Zelllinien, aber es gibt inhärente Einschränkungen. Dazu gehören der Einfluss der Umgebungstemperatur auf die enzymatische Trennung, unterschiedliche Verdauungszeiten für Blutgefäße mit unterschiedlichen Durchmessern und die Instabilität der nativen Umgebung der Zellen. Infolgedessen müssen die enzymatischen Verdauungszeiten oft angepasst werden. Die Patch-Clamp-Technologie stellt auch technische Herausforderungen dar, insbesondere bei den Dichtungs- und Membranbruchschritten, die ein hohes Maß an Bedienerkompetenz erfordern. Der Zustand der Zelle wirkt sich direkt auf den Erfolg des gesamten Patch-Clamp-Verfahrens aus. Folglich ist eine sorgfältige Beachtung dieser Einschränkungen unerlässlich, um den Erfolg des Experiments zu gewährleisten.
Ba2+ wird häufig als spezifischer Blocker verwendet, um die Rolle von Kir-Kanälen in Zellen und Geweben zu untersuchen. Bei Konzentrationen unter 100 μmol/l blockiert Ba2+ selektiv die Kir-Kanäle, während Konzentrationen von bis zu 300 μmol/l sie vollständig blockieren können32. In dieser Studie wurde BaCl2 verwendet, um den Kir-Kanalstrom zu verifizieren.
Die Kir-Kanäle werden sowohl durch Vasokonstriktoren als auch durch Vasodilatatoren reguliert. SNP (Natriumnitroprussid), ein Nitrovasodilatator, wurde in dieser Studie verwendet, um dies zu untersuchen. SNP wird in der glatten Gefäßmuskulatur metabolisiert, um Stickstoffmonoxid zu produzieren, das den systemischen Gefäßwiderstand reduziert, indem es sowohl auf die venöse als auch auf die arterielle glatte Muskulatur wirkt und das Herzzeitvolumen möglicherweise erhöht. Aufgrund seines schnellen Wirkungseintritts und seiner kurzen Halbwertszeit wird SNP häufig als Mittel der ersten Wahl zur Vorbeugung und Behandlung von Bluthochdruck eingesetzt33. Die Studie beobachtete, dass SNP den Kir-Strom in glatten Muskelzellen der Basilararterie erhöhte, was auf die Aktivierung von Kir-Kanälen während der SNP-induzierten Vasodilatation hindeutet.
Eine Einschränkung der vorliegenden Aufzeichnungen besteht darin, dass sie aus verschiedenen Zellgruppen gewonnen wurden und Vergleiche durch die Analyse der Stromdichten zwischen den Gruppen angestellt wurden. Ein verfeinerter Ansatz würde die Aufzeichnung der Reaktionen derselben Zellen vor und nach der Anwendung der Verbindungen beinhalten, was den Einfluss der Variabilität von Zelle zu Zelle auf die Dateninterpretation minimieren würde.
Zusammenfassend bietet dieser Artikel ein detailliertes Protokoll für die akute Isolierung von glatten Muskelzellen der Basilararterie der Ratte und die Verwendung von Ganzzell-Patch-Clamp zur Untersuchung von Kir-Strömen. Dieses Protokoll ist vielseitig und kann auf glatte Muskelzellen anderer Arterien wie Koronararterien, Mesenterial- und Nierenarterien angewendet werden. Die enzymatische Trennzeit muss jedoch je nach Art der Arterie angepasst werden. Darüber hinaus können isolierte arterielle glatte Muskelzellen in einer Vielzahl anderer experimenteller Techniken eingesetzt werden.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt durch das Special Talent Program der Chengdu University of Traditional Chinese Medicine für den "Xinglin Scholars and Discipline Talents Research Promotion Plan" (33002324) und das Key Research and Development Project for Introducing High-level Scientific and Technological Talents in Luliang City (2022RC28).
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
Referenzen
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten