Method Article
Fabrication de résonateurs à microbulles de haute qualité en mode galerie de chuchotement
Dans cet article
Résumé
Ici, nous démontrons un protocole robuste et standardisé pour la fabrication de résonateurs à microbulles (MBR) à facteur de haute qualité (facteur Q) en mode galerie de chuchotement (facteur Q) avec une machine de traitement du verre de précision (PGP).
Résumé
Nous démontrons une méthode robuste et standardisée pour la fabrication de résonateurs à microbulles (MBR) à facteur de qualité élevé (facteur Q) avec une machine de traitement du verre de précision (PGP). Les résonateurs à microbulles sont une classe unique de dispositifs WGM avec des canaux fluidiques intégrés, ce qui les rend idéaux pour diverses applications de détection. Dans cet article, nous présentons un protocole standardisé pour fabriquer des résonateurs à microbulles à Q élevé grâce à l’optimisation de paramètres de performance clés, tels que le facteur Q et l’épaisseur de la paroi. Nous montrons également des méthodes pour améliorer la sensibilité de la plate-forme aux changements d’indice de réfraction et à d’autres cibles de détection grâce à la gravure humide à l’acide fluorhydrique (HF). Enfin, une brève analyse de la résistance des microbulles à l’écoulement du fluide est discutée, montrant que les microbulles de plus petit diamètre présentent une plus grande résistance à l’écoulement pour l’administration de l’analyte - un facteur qui devrait être pris en compte pour l’administration de l’analyte. La mise en œuvre de ce protocole de fabrication raffiné augmente non seulement le taux de réussite de la production du dispositif, mais réduit également le temps de fabrication. De plus, le protocole peut être étendu à d’autres techniques utilisées pour produire des MBR, telles que les méthodes basées sur le laser CO2 .
Introduction
Les microrésonateurs en mode galerie chuchotante (WGM) sont une classe de capteurs optiques qui ont démontré un énorme potentiel non seulement pour la détection de molécules uniques et de nanoparticules 1,2,3,4,5,6, mais aussi pour la détection d’un large éventail de phénomènes physiques tels que les champs magnétiques 7 et électriques8, la température9 et les ondes ultrasonores10, 11. Aéroport international Dans des conditions de résonance optique, la lumière est piégée à l’intérieur du dispositif, ce qui entraîne une amplification de puissance significative12,13. Toute modification localisée du résonateur (telle que la liaison d’une biomolécule ou des modifications de l’indice de réfraction du milieu environnant) induit des modifications de l’environnement optique local, modifiant ainsi la fréquence de résonance ou la longueur d’onde. En surveillant les changements de longueur d’onde ou de fréquence de résonance, on peut détecter et caractériser les analytes en temps réel.
Les microrésonateurs WGM peuvent être conçus dans une variété de géométries. Les géométries courantes comprennent, sans s’y limiter, les microtores14, les microanneaux15 et les résonateurs à microbulles16 (MBR). Ici, nous nous concentrons sur les MBR en raison de leur grand potentiel dans les applications de détection optofluidique. L’un des principaux avantages des MBR est leur intégration fluidique 17,18,19,20, qui est rendue possible par la fabrication du dispositif à partir d’un microcapillaire. Dans cette conception, le capillaire en ligne facilite l’administration de petits volumes (c’est-à-dire des microlitres) d’analytes en solution dans la zone de détection sans avoir besoin de canaux fluidiques externes, comme le montre la figure 1. Grâce à leurs capacités uniques de gestion fluidique, les MBR sont bien adaptés à un large éventail d’applications de détection qui ne sont pas facilement réalisables avec d’autres plates-formes WGM. Par exemple, les MBR ont été remplis de fluides magnétiques, ce qui leur confère une sensibilité aux champs magnétiques externes21. De plus, les MBR ont également été utilisés pour contrôler l’orientation spécifique des nanotiges d’or en solution grâce à des couples optiques22.
La fabrication des MBR peut être résumée comme suit : une pression aérostatique est appliquée à l’intérieur du capillaire tandis qu’une petite zone du capillaire est chauffée localement. La combinaison de l’échauffement localisé et de la pression interne gonfle la section chauffée en une géométrie sphérique capable de supporter des WGM à Q élevé, comme illustré à la figure 2. Diverses méthodes peuvent être utilisées pour obtenir un chauffage localisé du capillaire, telles que l’utilisation d’un laser CO2 23, d’une épissure à fibre optique24, d’une source de flamme d’hydrogène25 et d’une machine de traitement du verre de précision (PGP). Les méthodes présentées ici peuvent être étendues à d’autres sources de chaleur, y compris un laser CO2 . Le PGP est similaire à une épissure de fibre optique, mais offre un meilleur contrôle du temps de chauffage, du réglage de la puissance et du positionnement des fibres ou des capillaires26. Les PGP incluent souvent des microscopes intégrés adjacents aux éléments chauffants, ce qui permet une surveillance en temps réel du processus de fabrication. En règle générale, la lumière d’un laser à diode accordable est couplée au MBR via une fibre optique conique qui est en contact avec l’équateur du MBR. La fibre est conique (à ~1 μm) pour permettre un couplage efficace de la lumière dans et hors du MBR. Les spectres de transmission résultants du MBR sont ensuite capturés par un photodétecteur à travers la fibre optique et visualisés sur un oscilloscope.
La détection avec les MBR WGM repose sur l’interaction du champ WGM avec l’analyte cible. L’intensité de cette interaction est directement proportionnelle à la fraction du champ WGM qui pénètre dans la cavité creuse du MBR où les échantillons en phase liquide ou gazeuse peuvent s’écouler à travers27. Comme le montre la figure 3, les simulations COMSOL illustrent comment la pénétration du champ WGM dans la cavité interne varie avec l’épaisseur de la paroi du MBR. La pénétration maximale du champ WGM se produit lorsque l’épaisseur de la paroi est réduite à moins de 1 μm, ces simulations étant réalisées en utilisant la lumière dans la bande des 780 nm. Il est difficile d’obtenir une telle réduction de l’épaisseur de la paroi grâce au seul protocole de fabrication standard de chauffage et de gonflage. Pour amincir davantage les parois du MBR et rendre l’appareil plus sensible, nous incorporons des étapes de gravure humide supplémentaires à l’aide d’acide fluorhydrique (HF).
À l’aide d’un PGP, nous nous concentrerons sur la fabrication de MBR en ligne avec un capillaire de silice. Une description détaillée du procédé de fabrication et des méthodes permettant d’améliorer la sensibilité aux changements d’indice de réfraction par gravure humide sera également présentée.
Protocole
1. Fabrication de microbulles
- Commencez par un capillaire en verre de silice recouvert de polymère (250 μm de diamètre intérieur et 360 μm de diamètre extérieur) de ~75 cm de longueur. La longueur du capillaire peut varier selon les besoins de l’utilisateur ; Assurez-vous que la pression décrite ci-dessous est atteinte à des longueurs capillaires plus longues.
- Brûlez ~2,5 cm du revêtement polymère à une extrémité du capillaire avec une torche au butane et nettoyez l’extrémité avec une lingette délicate et de l’alcool isopropylique (IPA).
- Placez l’extrémité propre du capillaire dans le PGP et cliquez sur le bouton d’épissure uniquement du logiciel pour chauffer pendant 5 s à 180 W afin de sceller l’extrémité du capillaire. Réglez le temps et la durée de chauffage avec un clic droit sur le bouton d’épissure uniquement .
- Pour assurer une bonne étanchéité, examinez l’extrémité du capillaire scellée, Figure 1B.
- À ~25 cm de l’extrémité scellée (ou 1/3 de la longueur capillaire de l’extrémité scellée), brûlez une bande de revêtement polymère de ~2,5 cm de long du capillaire et nettoyez la zone résultante avec de l’IPA.
REMARQUE : La position décrite ci-dessus n’est pas critique car la pression est uniformément répartie sur toute la longueur du capillaire. Si la configuration expérimentale de l’utilisateur justifie un placement différent du MBR, cela ne devrait pas affecter le reste de la procédure. - Répétez cette étape jusqu’à ce qu’aucun polymère ne soit visible sous le système d’imagerie, qui affiche l’image capillaire avec une résolution inférieure au micron.
- Placez cette section du capillaire nouvellement nettoyée dans l’instrument de traitement en verre au-dessus de l’élément chauffant et sous le microscope décrit précédemment.
- À l’aide d’une seringue étanche au gaz et d’un pousse-seringue, injectez de l’air dans le capillaire de manière à ce que la pression interne atteigne 10 bars (c’est-à-dire en diminuant le volume d’une seringue de 5 mL à 0,5 mL, avec des pressions correspondantes calculées selon la loi de Boyle). Montez le capillaire sur une seringue avec un luer lock sur un adaptateur de 360 μm. Vous pouvez également appliquer une pression à l’aide d’un régulateur de pression et d’un air comprimé/gaz inerte.
- Chauffez le capillaire avec le PGP en utilisant une puissance de filament de ~100-110 W pendant 1,5-2 s.
- Effectuez des étapes de chauffage supplémentaires avec des tirs de 90-100 W et 0,1-1 s du filament. Cette méthode augmentera lentement et de manière contrôlée le diamètre du MBR jusqu’à la plage souhaitée. Cependant, ce processus peut entraîner des MBR asymétriques. Si un MBR asymétrique est observé (la sphère n’est pas symétrique par rapport à l’axe du capillaire), faites-le pivoter autour de l’axe du capillaire entre les étapes de chauffage successives pour favoriser la symétrie.
- Inspectez le MBR au microscope pour le contrôle de la qualité, à la recherche d’éléments tels que la poussière, les fissures ou les déformations. De plus, utilisez le microscope ici pour estimer l’épaisseur de la paroi du MBR.
2. Gravure humide à l’acide fluorhydrique
ATTENTION : L’acide fluorhydrique est très dangereux, toxique et corrosif. Le gluconate de calcium doit être conservé à proximité car ce produit chimique peut neutraliser l’acide fluorhydrique. Portez un équipement de protection individuelle approprié et suivez toutes les précautions de sécurité énoncées dans la fiche signalétique.
- Retirez l’extrémité scellée du capillaire en coupant 2 cm sous l’extrémité scellée.
- Placez une extrémité capillaire à l’intérieur d’une pointe émoussée vers l’adaptateur Luer Lock. Assurez-vous que le diamètre intérieur de l’embout émoussé est aussi proche que possible du diamètre extérieur du capillaire tout en vous assurant que le capillaire peut toujours tenir à l’intérieur.
REMARQUE : Le matériau de l’adaptateur ne doit pas être réactif avec l’acide HF. - Appliquez de l’époxy durcissable aux UV à l’extrémité de l’embout émoussé avec le capillaire à l’intérieur pour joindre les deux, puis polymérisez avec de la lumière UV (source de lumière UV de 50 à 100 W ; une puissance plus élevée accélérera le durcissement).
ATTENTION : Une protection oculaire appropriée doit être portée lors de l’utilisation d’une source de lumière UV28. - Une fois l’époxy durci, fixez l’embout Luer Lock à une seringue de 25 ml inerte à HF.
- Placez la seringue dans un pousse-seringue avec un taux de retrait de 50 μL/min.
- Avec une extrémité du capillaire reliée à la seringue, placez l’autre extrémité du capillaire dans de l’eau désionisée (DI).
- Réglez le pousse-seringue pour aspirer l’eau par le capillaire dans la seringue afin de vérifier que le débit approprié a été établi (c’est-à-dire que le système est exempt de bulles d’air et que le liquide s’écoule constamment dans le capillaire).
- Transférez l’extrémité capillaire de l’eau DI dans un récipient d’acide HF une fois que le débit approprié est établi.
- Calculez un temps de gravure approximatif basé sur l’épaisseur de la paroi MBR avant la gravure, en considérant une vitesse de gravure mesurée de 8,18 μm/h avec 12 % (p/v) d’acide fluorhydrique. L’épaisseur de la paroi peut être mesurée sous un système d’imagerie qui affiche les MBR avec une résolution inférieure au micron.
REMARQUE : La vitesse de gravure pour les acides d’autres concentrations peut être déterminée empiriquement. Cela peut être fait en mesurant l’épaisseur de la paroi capillaire avant et après un temps de gravure défini. - Faites fonctionner la pompe à seringue à 50 μL/min pendant le temps de gravure calculé.
- Rincez le capillaire à l’eau DI pendant 10 à 15 minutes pour éliminer tout l’acide du capillaire une fois le temps de gravure écoulé. Calculez le temps de rinçage pour rincer tout le volume capillaire 3 à 5 fois.
- Mesurez l’épaisseur de la paroi MBR après la gravure. Utilisez ces informations pour mettre à jour la vitesse de gravure de l’acide.
- Répétez ce processus jusqu’à ce que l’épaisseur de paroi souhaitée soit atteinte.
Résultats
Un MBR représentatif fabriqué avec la machine PGP est illustré à la figure 1C. Compte tenu de notre diamètre extérieur capillaire (DO) de départ de 360 μm, nous dilatons le capillaire ~2x dans le processus de fabrication. L’expansion du capillaire à ~700 μm permet d’obtenir des épaisseurs de paroi comprises entre 5 μm et 15 μm. Il a été démontré que l’épaisseur de paroi optimale pour la biodétection avec les MBR est de l’ordre de la longueur d’onde de la lumière utilisée pour exciter le WGM27. Les MBR peuvent théoriquement atteindre un facteur de qualité de 1 x 109, mais 1 x 106 est suffisant pour la plupart des applications de biodétection 29,30,31.
Pour valider les résultats simulés de la figure 3, nous avons évalué la réponse des MBR avec des épaisseurs de paroi variables à diverses concentrations de solutions de chlorure de sodium. La figure 4 confirme les résultats simulés, montrant une augmentation significative de la sensibilité de l’indice de réfraction lorsque l’épaisseur de la paroi MBR était d’environ 1 μm. Les trois MBR à paroi épaisse (c’est-à-dire des épaisseurs de paroi de 9,4 μm, 7,4 μm et 5,0 μm) ont montré une réponse décroissante aux changements de l’indice de réfraction à mesure que l’épaisseur de la paroi augmentait, comme prévu. La figure 5 présente le spectre transmis typique d’un MBR. Sur une large plage de balayage, le spectre présente une densité modale élevée. Dans une plage de balayage étroite de 40 pm, le laser balaie plusieurs résonances. En suivant le décalage de résonance, un mode à Q élevé peut être sélectionné pour la détection dans cette plage de balayage fin. Les mesures de contrôle de la qualité pour la fabrication de MBR peuvent être utilisées pour évaluer qualitativement les propriétés physiques et optiques afin d’optimiser les performances de biodétection. Deux paramètres importants sont le facteur de qualité du résonateur (≥1 x 106) et une faible épaisseur de paroi pour une interaction maximale entre le WGM et l’analyte cible (<1 μm).
Comme mentionné précédemment, la gestion optique et fluidique intégrée est un point fort inhérent aux MBR, ce qui les rend attrayants pour les applications de détection. Dans ce contexte, nous avons cherché à explorer les propriétés fluidiques des capillaires. En expérimentant avec des capillaires de différentes longueurs de 20 cm, 40 cm ou 80 cm et en testant différents débits, 100 μL/min, 250 μL/min et 500 μL/min, pour chaque longueur capillaire, nous avons constaté que le diamètre intérieur (DI) des MBR influence considérablement l’efficacité du transport du fluide (Tableau 1). Plus précisément, à mesure que le MBR ID passe de 75 μm à 250 μm, l’efficacité du transport du liquide à travers ces microcapillaires s’améliore considérablement, permettant à 95 à 100 % du volume défini de liquide d’être tiré à travers les microcapillaires. Cette capacité améliorée met en évidence le potentiel des MBR de plus grand diamètre dans l’optimisation de la manipulation des fluides, ce qui les rend particulièrement adaptés à diverses applications de détection où la dynamique des fluides est cruciale.

Figure 1 : Vue d’ensemble du dispositif expérimental. (A) Schéma d’un système de capteur MBR WGM couplé à un guide d’ondes. Le WGM est excité par un laser à diode accordable et surveillé par un photodétecteur à travers un guide d’ondes à fibre optique conique. L’analyte est ensuite délivré par le canal fluidique en ligne où il interagit avec le champ WGM. (B) Micrographie d’un capillaire de 360 μm scellé par un PGP. (C) Micrographie d’un MBR après fabrication. Les flèches indiquent l’endroit où deux micrographies ont été fusionnées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Schéma du processus de fabrication des MBR, y compris l’étape optionnelle de gravure HF. (1) Commencer avec un capillaire en verre de silice (360 μm OD). (2) Retirez le revêtement polymère à l’aide d’une petite flamme et nettoyez la surface avec de l’alcool isopropylique (IPA). (3) Pour augmenter la pression interne, une extrémité du capillaire doit être scellée. Cette étape se fait avec le PGP. (4) Augmentez la pression interne avec de l’air et tirez le filament PGP pour chauffer localement le capillaire et gonfler un MBR dans une géométrie sphérique. (5) Facultatif. Graver l’intérieur du capillaire avec de l’acide HF pour amincir les parois et augmenter la sensibilité à la biodétection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
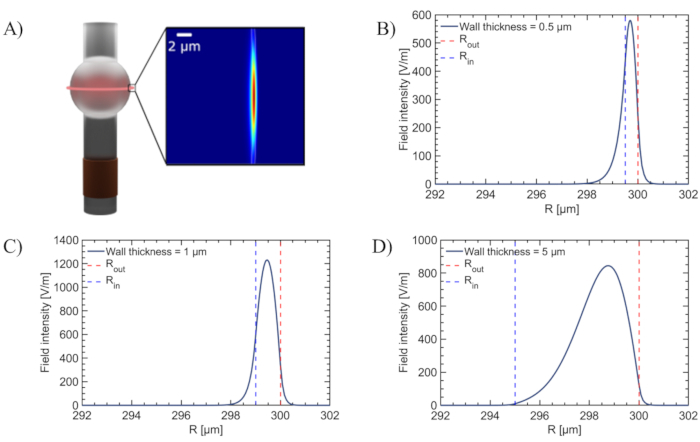
Figure 3 : Simulations de pénétration sur le terrain des WGM. (A) Simulation de la pénétration de WGM dans un MBR lorsque l’épaisseur de la paroi est dans la gamme submicronique. (B-D) L’intensité du champ électrique à l’intérieur du MBR pour différentes épaisseurs de paroi, montrant une plus grande pénétration du champ évanescent dans le cœur du résonateur pour les parois de <1 μm d’épaisseur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Réponse du MBR à une IR variable. Réponse des MBR de différentes épaisseurs de paroi à des concentrations variables de solutions de NaCl, montrant une amélioration notable lorsque la paroi entre dans le régime de 1 μm en raison d’une plus grande pénétration de WGM dans le liquide s’écoulant à l’intérieur du résonateur connecté à un canal fluidique dans la structure capillaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
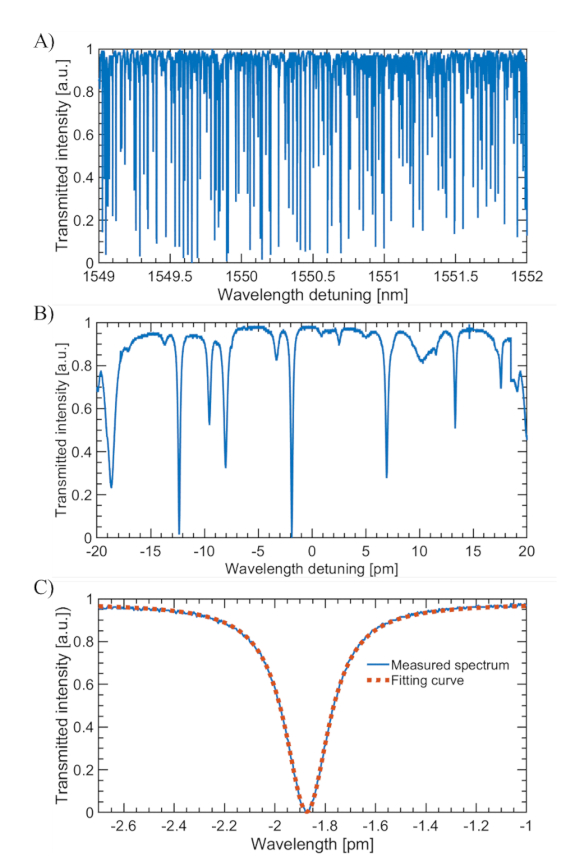
Figure 5 : Spectre WGM typique pour un MBR. (A) Grande plage de balayage sur une plage spectrale libre. (B) Balayage fin sur quelques WGM. (C) Vue en zoom avant d’un WGM en B) et son ajustement de courbe montrant une forme linéaire lorentzienne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Débit | |||
| 75 μm ID 150 μm OD | |||
| Longueur capillaire | 100 μL/min | 250 μL/min | 500 μL/min |
| 20 cm | 15% | 5% | 2.50% |
| 40 cm | 10% | 10% | 10% |
| 80 cm | 5% | 2.50% | 0% |
| 250 μm ID 360 μm OD | |||
| 20 cm | 95% | 95% | 97.50% |
| 40 cm | 100% | 95% | 95% |
| 80 cm | 95% | 95% | 92.50% |
Tableau 1 : Pourcentages d’eau DI aspirée à travers deux capillaires en silice de tailles différentes.
Discussion
Ici, nous avons décrit le protocole permettant de fabriquer des résonateurs à microbulles (MBR) en mode galerie de chuchotement (WGM) de haute qualité à l’aide d’un processeur de verre de précision. Nous présentons les étapes critiques du protocole de fabrication, y compris les étapes de chauffage et d’expansion. Ici, une combinaison de surchauffe, de chauffage trop long ou d’injection d’une pression d’air interne trop importante peut conduire à une fabrication infructueuse. Pour résoudre ces problèmes, des ajustements tels que la réduction de la puissance de chauffage ou de la durée de chauffage dans l’interface utilisateur du logiciel de la machine PGP peuvent aider. Cependant, ce n’est pas la seule méthode utilisée pour fabriquer des MBR. Plusieurs autres protocoles existent dans la littérature, mais la plupart des méthodes partagent les mêmes étapes de base - la chaleur et la dilatation. D’autres méthodes de fabrication utilisent diverses sources de chaleur, telles que la décharge d’arc d’une épissure par fusion ou d’un système laser CO2 , tandis que le processeur de verre de précision utilise un élément chauffant en graphite. La méthode de décharge d’arc32 est similaire à la PGP en ce sens que les deux approches ont des microscopes intégrés pour surveiller le processus de chauffage. L’un des principaux inconvénients de la méthode de décharge d’arc est que ces dispositifs offrent peu de contrôle sur la position du microcapillaire, ce qui rend difficile un réglage précis de la position capillaire.
L’utilisation d’un laser CO2 33 comme élément chauffant offre quelques avantages. Dans cette configuration, deux faisceaux laser deCO2 de puissance égale convergent sur le microcapillaire depuis des directions opposées pour chauffer uniformément le microcapillaire. Ce chauffage uniforme, associé à la pression interne, permet de créer un MBR symétrique sans qu’il soit nécessaire de faire pivoter le microcapillaire pendant la fabrication. Mais l’utilisation d’un laser haute puissance en espace libre présente ses propres problèmes de sécurité et doit être effectuée avec une formation appropriée et des précautions rigoureuses spécifiques à l’utilisation du laser CO2 .
Nous présentons également des méthodes pour diminuer l’épaisseur de la paroi des MBR avec de l’acide HF afin d’améliorer la sensibilité des dispositifs aux changements d’indice de réfraction. L’utilisation d’acide HF est une méthode courante pour graver et amincir progressivement les parois de silice du MBR, mais cette méthode de gravure humide peut augmenter la rugosité de la surface et, par conséquent, réduire le facteur de qualité. D’autres ont obtenu un MBR à paroi mince en chauffant le microcapillaire tout en le tirant, amincissant ainsi le capillaire33 avant de fabriquer le MBR. Bien que cette méthode ne nécessite pas l’utilisation d’acides, le diamètre intérieur est réduit lors de l’amincissement du capillaire, ce qui entraîne des problèmes de manipulation fluidique.
La biodétection avec MBR nécessite l’administration précise de diverses solutions, telles que des silanes, des anticorps spécifiques, des protéines et d’autres cibles d’intérêt ; Par conséquent, une manipulation fluidique fiable est très importante. L’un des principaux avantages de l’utilisation d’un MBR est le canal fluidique intégré fourni par le capillaire, qui permet une administration efficace et ciblée d’un analyte en phase liquide ou gazeuse. Cela représente une amélioration par rapport aux autres microrésonateurs WGM qui nécessitent des canaux microfluidiques externes supplémentaires pour une distribution ciblée d’analytes 5,34,35. L’un des défis de l’utilisation du capillaire intégré pour l’administration de liquide est la résistance fluidique dans le microcapillaire. L’équation 1 montre que la résistance, R, à l’écoulement du fluide est inversement proportionnelle à la puissance quatre du rayon, r.
 (1)
(1)
Où η est la viscosité du fluide et L est la longueur du canal fluidique. Nous avons comparé la résistance fluidique pour deux tailles de capillaires différentes, un diamètre intérieur (ID) de 75 μm et un ID de 250 μm. La taille capillaire de 75 μm ID ne pouvait tirer que ~10 % du volume cible d’eau DI à un débit relativement faible (100 μL/min). Le capillaire DI de 250 μm a tiré 90 à 100 % du volume cible d’eau DI au même débit (100 μL/min).
 (2)
(2)
L’équation 2 montre que la force de résistance visqueuse, F visqueuse, est directement proportionnelle à la vitesse du fluide, vm. Ici, η représente la viscosité du fluide et L est la longueur du canal cylindrique. Cette équation montre que la force de résistance visqueuse augmente avec l’écoulement du fluide. Cette tendance est également observée à titre expérimental. Cela confirme notre hypothèse selon laquelle l’augmentation du diamètre capillaire diminuera la résistance fluidique dans le capillaire et améliorera la manipulation fluidique globale du dispositif.
En résumé, nous avons montré un protocole fiable pour la fabrication de MBR WGM reproductibles avec des canaux fluidiques intégrés à l’aide du PGP, y compris des mesures de contrôle de la qualité. Ce protocole est simple, reproductible et rentable. Il peut être étendu à d’autres méthodes de chauffage, telles que les épisseurs de fibres optiques et les lasers CO2 . D’autres améliorations pourraient inclure l’utilisation de systèmes à haute pression avec des gaz inertes comme le N2 pour contrôler la pression interne du capillaire pendant le processus de fabrication. De plus, nous avons introduit des protocoles pour augmenter la sensibilité des MBR à la liaison aux biomolécules et aux changements d’indice de réfraction en vrac par gravure HF. Enfin, la taille capillaire a été étudiée en termes de résistance fluidique à l’écoulement. Nos résultats ont montré qu’en augmentant le diamètre intérieur du capillaire, un écoulement fiable peut être établi pour faciliter la livraison précise des cibles de détection.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce projet a été soutenu en partie par R41AI152745. L’AJQ a été financée par le T32 Cancer Biology Award (NIH CA009547) et K08EB033409.
matériels
| Name | Company | Catalog Number | Comments |
| Blunt tip to luer lock adapter | Ellsworth Adhesives | 8001286 | |
| Gas-tight syringe | Hamilton | 81520 | |
| Luer Lock to 360 µm adapter | IDEX | p-662 | |
| Silica Capillary | BGB Analytik | TSP250350 | |
| Syringe Pump | Universal | na | |
| UV Glue | Amazon | B09H7BJKT1 | |
| Vytran Glass Processor | Thorlabs/Vytran | GPX3000 | PGP instrument with software |
Références
- Dantham, V. R., Holler, S., Barbre, C., Keng, D., Kolchenko, V., Arnold, S. Label-free detection of single protein using a nanoplasmonic-photonic hybrid microcavity. Nano Lett. 13 (7), 3347-3351 (2013).
- Chen, W., Özdemir, ŞK., Zhao, G., Wiersig, J., Yang, L. Exceptional Points enhance sensing in an optical microcavity. Nature. 548 (7666), 192-195 (2017).
- Zhu, J., et al. On-chip single nanoparticle detection and sizing by mode splitting in an ultrahigh-Q microresonator. Nat Photonics. 4 (1), 46-49 (2010).
- Dantham, V. R., Holler, S., Kolchenko, V., Wan, Z., Arnold, S. Taking whispering gallery-mode single virus detection and sizing to the limit. Appl Phys Lett. 101, 043704(2012).
- Vollmer, F., Arnold, S. Whispering-gallery-mode biosensing: Label-free detection down to single molecules. Nat Methods. 5 (7), 591-596 (2008).
- Wang, Y., Zeng, S., Humbert, G., Ho, H. P. Microfluidic whispering gallery mode optical sensors for biological applications. Laser Photonics Rev. 14 (12), 2000135(2020).
- Li, B. B., Bulla, D., Prakash, V., Forstner, S., Dehghan-Manshadi, A., Rubinsztein-Dunlop, H., Foster, S., Bowen, W. P. Invited Article: Scalable high-sensitivity optomechanical magnetometers on a chip. APL Photonics. 3, 120806(2018).
- Ioppolo, T., Ayaz, U., Ötügen, M. V. Tuning of whispering gallery modes of spherical resonators using an external electric field. Opt Express. 17 (19), 16465(2009).
- Xu, L., et al. High-Q silk fibroin whispering gallery microresonator. Opt Express. 24 (18), 20825(2016).
- Kim, K. H., et al. Air-coupled ultrasound detection using capillary-based optical ring resonators. Sci Rep. 7, 109(2017).
- Pan, J., et al. Microbubble resonators combined with a digital optical frequency comb for high-precision air-coupled ultrasound detectors. Photonics Res. 8 (3), 303(2020).
- Foreman, M. R., Swaim, J. D., Vollmer, F. Whispering gallery mode sensors. Opt Express. 7 (2), 168-240 (2015).
- Sumetsky, M., Dulashko, Y., Windeler, R. S. Optical microbubble resonator. Opt Lett. 35 (7), 898(2010).
- Jiang, X. F., Xiao, Y. F., Yang, Q. F., Shao, L., Clements, W. R., Gong, Q. Free-space coupled, ultralow-threshold Raman lasing from a silica microcavity. Appl Phys Lett. 103, 101102(2013).
- Xu, Q., Schmidt, B., Pradhan, S., Lipson, M. Micrometre-scale silicon electro-optic modulator. Nature. 435 (7040), 325-327 (2005).
- Henze, R., Seifert, T., Ward, J., Benson, O. Tuning whispering gallery modes using internal aerostatic pressure. Opt Lett. 36 (23), 4536(2011).
- Wade, J. H., Jones, J. D., Lenov, I. L., Riordan, C. M., Sligar, S. G., Bailey, R. C. Microfluidic platform for efficient nanodisc assembly, membrane protein incorporation, and purification. Lab Chip. 17 (17), 2951-2959 (2017).
- Zhu, H., White, I. M., Suter, J. D., Zourob, M., Fan, X. Opto-fluidic micro-ring resonator for sensitive label-free viral detection. Analyst. 133 (3), 356-360 (2008).
- White, I. M., Gohring, J., Sun, Y., Yang, G., Lacey, S., Fan, X. Versatile waveguide-coupled optofluidic devices based on liquid core optical ring resonators. Appl Phys Lett. 91, 241104(2007).
- Wang, Z., et al. Monitoring and identifying pendant droplets in microbottle resonators. Photonics Res. 10 (3), 662(2022).
- Liu, W., et al. Magnetic sensor based on WGM hollow microbubble resonator filled with magnetic fluid. Opt Commun. 497, 127148(2021).
- Hogan, L. T., Horak, E. H., Ward, J. M., Knapper, K. A., Nic Chormaic, S., Goldsmith, R. H. Toward real-time monitoring and control of single nanoparticle properties with a microbubble resonator spectrometer. ACS Nano. 13 (11), 12743-12757 (2019).
- Yu, J., et al. A tellurite glass optical microbubble resonator. Opt Express. 28 (22), 32858-32868 (2020).
- Guo, W., Liu, J., Liu, J., Wang, G., Wang, G., Huang, M. A single-ended ultra-thin sphericalmicrobubble based on the improved critical-state pressure-assisted arc discharge method. Coatings. 9 (2), 144(2019).
- Jiang, J., et al. Wall-thickness-controlled microbubble fabrication for WGM-based application. Appl Opt. 59 (16), 5052(2020).
- Wang, B., Mies, E. Review of fabrication techniques for fused fiber components for fiber lasers. Fiber Lasers VI Technol Syst Appl. 7195, 71950A(2009).
- Yang, Y., Ward, J., Chormaic, S. N. Quasi-droplet microbubbles for high resolution sensing applications. Opt Express. 22 (6), 6881(2014).
- University of Rochester Ultraviolet Light Safety Guidelines. , University of Rochester. At https://www.safety.rochester.edu/ih/guidelines/pdf/Ultraviolet_Light_Guidelines.pdf (2021).
- Sun, Y., Shopova, S. I., Frye-mason, G., Fan, X. Rapid chemical-vapor sensing using optofluidic ring resonators. Opt. Lett. 33 (8), 788-790 (2008).
- Giannetti, A., et al. Optical micro-bubble resonators as promising biosensors. Proc SPIE 9506, Optical Sensors. 2015, 950617(2015).
- Guo, Z., Lu, Q., Zhu, C., Wang, B., Zhou, Y., Wu, X. Ultra-sensitive biomolecular detection by external referencing optofluidic microbubble resonators. Opt Express. 27 (9), 12424(2019).
- Berneschi, S., et al. High Q silica microbubble resonators fabricated by arc discharge. Opt Lett. 36 (17), 3521(2011).
- Yang, Y., Saurabh, S., Ward, J. M., Nic Chormaic, S. High-Q, ultrathin-walled microbubble resonator for aerostatic pressure sensing. Opt Express. 24 (1), 294-299 (2016).
- Jiang, X., Qavi, A. J., Huang, S. H., Yang, L. Whispering-gallery sensors. Matter. 3 (2), 371-392 (2020).
- Yu, D., Humar, M., Meserve, K., Bailey, R. C., Chormaic, S. N., Vollmer, F. Whispering-gallery-mode sensors for biological and physical sensing. Nat Rev Methods Prim. 1, 83(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon