Method Article
Evaluación del salidrósido como agente terapéutico para la calcificación vascular mediante farmacología de redes y modelos experimentales de ratas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio establece un modelo de calcificación vascular en ratas inducida por una dieta alta en grasas (HFD) combinada con vitamina D3 (VD3). El modelo se utilizó para evaluar la eficacia terapéutica del salidrósido en la prevención y el tratamiento de la calcificación vascular, proporcionando información sobre sus posibles mecanismos de acción a través de la farmacología en red y experimentos in vivo .
Resumen
La calcificación vascular (VC) es una condición patológica crítica asociada con una morbilidad y mortalidad significativas. Este estudio emplea un enfoque híbrido de farmacología de redes y biología molecular para delinear los mecanismos terapéuticos del salidrósido (SAL), un compuesto activo de Rhodiola crenulata, contra el VC. A través de la minería de bases de datos y el análisis de redes, se identificaron 388 objetivos SAL que se cruzan con 2871 objetivos asociados a VC, lo que dio como resultado 208 objetivos comunes. Una red de interacción proteína-proteína (PPI) construida a través de la base de datos String y el análisis topológico en Cytoscape 3.9.1 identificó 10 objetivos clave, incluidos IL6, TNF, TP53, IL1B, HIF1A, CASP3 y STAT3, entre otros. Los genes identificados se concentraron en las vías lipídica y de aterosclerosis, lo que indica que la mejora de la VC por SAL puede ocurrir a través de la regulación de la expresión anormal de factores lipídicos e inflamatorios. También se encontró que la SAL inhibe la expresión anormal de factores inflamatorios, activando así la vía JAK2/STAT3 para intervenir en la progresión de la VC. La vía JAK2/STAT3 es un mecanismo molecular clave por el cual SAL previene un mayor deterioro de la VC. Los análisis de enriquecimiento funcional revelaron la implicación de estas dianas en las respuestas inflamatorias y el metabolismo de los lípidos, vías fundamentales en la VC. Los estudios in vivo en ratas demostraron la eficacia de SAL en la mitigación de la dislipidemia y la inflamación vascular, con perfiles lipídicos séricos mejorados y una reducción de la deposición vascular de calcio. La exploración mecanicista, basada en el análisis de Western blot, demostró la capacidad del salidrósido para regular la vía de señalización JAK2/STAT3, destacando su potencial como modulador en este mecanismo molecular crítico y ofreciendo un objetivo terapéutico potencial para la VC. La fortaleza de esta investigación radica en su rigor metodológico, integrando predicciones computacionales con validaciones in vivo . Este enfoque integral establece un marco sólido para explorar los mecanismos terapéuticos de los compuestos naturales en la lucha contra la VC.
Introducción
La calcificación vascular (VC) se refiere a la deposición anormal de calcio dentro de las paredes de los vasos, lo que conduce a un endurecimiento arterial y una disminución de la elasticidad, lo que en última instancia perjudica la función vascular. Tradicionalmente, la VC se ha dividido en dos tipos: calcificación intimal, relacionada con la acumulación de lípidos, y calcificación medial. El primero está estrechamente asociado con la infiltración inflamatoria, desencadenando una transformación osteogénica en la pared vascular, caracterizada por la migración, proliferación y diferenciación de células del músculo liso vascular (CMV) en células similares a los osteoblastos1.
La capacidad de las VSMC para experimentar una diferenciación osteogénica, influenciada por factores como el envejecimiento, la genética y las condiciones ambientales como la diabetes y la enfermedad renal crónica, es un factor importante que contribuye a la VC relacionada con la edad. Esta transformación osteoblástica exacerba la calcificación arterial y la degeneración1.
La VC es una afección multifacética, impulsada por cambios degenerativos, desequilibrios metabólicos y diversas afecciones sistémicas. Aproximadamente el 80% de las lesiones vasculares y el 90% de los casos de enfermedad arterial coronaria presentan VC, lo que aumenta significativamente el riesgo de eventos cardiovasculares graves 1,2. Por lo tanto, existe una necesidad apremiante de descubrir tratamientos farmacológicos que mitiguen o reviertan eficazmente esta afección.
En la actualidad, las estrategias de tratamiento de la CV implican diversas intervenciones farmacológicas, aunque no hay fármacos diseñados específicamente para este fin. Para los pacientes con calcificación leve, a menudo se recetan estatinas para estabilizar las placas. Sin embargo, si bien pueden reducir la estenosis de las arterias coronarias al disminuir los niveles de lípidos, su efecto sobre la calcificación es limitado2.
Dadas las complejidades de la aterosclerosis, muchos pacientes presentan una mayor activación plaquetaria, lo que requiere el uso de fármacos antiplaquetarios como la aspirina o el clopidogrel para inhibir la agregación plaquetaria y reducir el riesgo de trombosis. Sin embargo, la terapia con aspirina solo es beneficiosa para las personas con una puntuación alta de calcio en las arterias coronarias y un bajo riesgo de sangrado3.
Además, la investigación sobre suplementos, como la vitamina K, sugiere potencial en la prevención de la progresión de la VC4. En casos graves, se pueden considerar intervenciones invasivas, aunque a menudo no son adecuadas para la VC5 generalizada. Para las personas sin VC, el manejo de los factores de riesgo, como la presión arterial, los perfiles lipídicos y las opciones de estilo de vida, sigue siendo fundamental6.
La Rhodiola crenulata, una hierba perenne de la familia Crassulaceae, se ha utilizado tradicionalmente en la medicina china. Su principal constituyente bioactivo, el salidrósido, merece una atención significativa debido a sus notables actividades biológicas. El salidrósido es conocido por su capacidad para inhibir la apoptosis, exhibir sólidas propiedades antioxidantes y poseer características antiinflamatorias 7,8. Estos atributos contribuyen a su potencial para mejorar la función vascular, retrasar el envejecimiento vascular y salvaguardar el endotelio vascular. Como agente terapéutico potencial para la VC, el salidrósido tiene un valor sustancial para la investigación. Sin embargo, los mecanismos precisos por los cuales el salidrósido mejora la VC aún no se han dilucidado por completo y justifican una mayor investigación para aprovechar su potencial terapéutico en el tratamiento de la VC.
Para explorar estos mecanismos, este estudio aprovecha la farmacología de redes, una metodología innovadora que combina la farmacología, la bioinformática y la informática para analizar sistemas biológicos y dilucidar los mecanismos de los fármacos. En comparación con la investigación tradicional de fármacos de un solo objetivo, la farmacología en red ofrece un enfoque más completo mediante el análisis de los efectos de un fármaco en múltiples dianas biológicas y vías de señalización. Como herramienta clave en el desarrollo moderno de fármacos, construye redes de fármacos, dianas y vías para revelar los mecanismos subyacentes de la acción de los fármacos 9,10. A pesar de su amplio uso en la exploración de mecanismos terapéuticos, ha habido poca investigación sobre los mecanismos interactivos entre el salidrósido y la VC desde las perspectivas de la bioinformática y la farmacología de redes.
Esta investigación construye un mapa de red molecular del impacto potencial de salidrósido en VC mediante la identificación y el análisis de objetivos clave a través de una extensa minería de bases de datos. Se genera una red de interacción proteína-proteína (PPI) y se aplica un análisis topológico para resaltar los nodos críticos en el proceso de calcificación.
Para confirmar las predicciones computacionales, se desarrolla un modelo de VC en ratas mediante la administración de una dieta alta en grasas con vitamina D3 (VD3). Este modelo replica las características patológicas de la VC humana. La lesión vascular se evalúa a través de técnicas histológicas, los perfiles lipídicos séricos y los marcadores de inflamación se evalúan para investigar los efectos sistémicos del salidrósido, y la expresión de las proteínas relacionadas con SAL anti-VC se mide mediante Western blot para explorar el impacto del salidrósido en la VC inducida experimentalmente, este estudio tiene como objetivo aportar información valiosa sobre el potencial de este compuesto como estrategia terapéutica para combatir la VC.
Protocolo
El protocolo fue aprobado por el Comité de Animales Experimentales de la Universidad de Medicina China de Changchun (Aprobación Nº 2023091). Este estudio se adhiere a las directrices internacionales, incluidas las Directrices de la Comunidad Europea y la Directiva CEE de 1986, lo que garantiza el tratamiento ético de los animales durante todo el estudio. Para el estudio se utilizaron ratas Wistar macho (8-10 semanas, peso 200-220 g). Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Predicción farmacológica de la red de posibles dianas de salidrósido-VC
NOTA: La farmacología de redes utiliza métodos computacionales y análisis de datos a gran escala para investigar las complejas interacciones entre las moléculas de los fármacos y los objetivos biológicos, como las vías, los genes y las proteínas dentro de un organismo11,12. Este enfoque ayuda a descifrar las funciones y relaciones biológicas de las entidades estudiadas. La metodología abarca la utilización de bases de datos, el procesamiento de información química, la adquisición de datos de bioactividad, la recuperación de datos de proteínas, el análisis de perfiles de expresión génica, la construcción de redes de interacción y el análisis de enriquecimiento de vías11. La Figura 1 muestra la red de interacción de los objetivos principales entre el salidrósido y la calcificación vascular.
- Construcción de la base de datos de objetivos "Ingredientes"
- Utilice "Salidroside" como palabra clave para los ingredientes en las bases de datos13 (véase la Tabla complementaria 1), como HERB, TCMSP, PubChem, SwissTargetPrediction, CTD, PharmMapper, SEA y STITCH.
- Revisar la literatura relevante para identificar objetivos asociados con el salidrósido, con la especie establecida en Homo sapiens. Después de eliminar los duplicados, estandarizar las proteínas diana utilizando UniProt (véase la Tabla Suplementaria 1) y establecer una base de datos completa de dianas de Salidroside14.
- Construcción de la base de datos objetivo "Enfermedad"
- Utilice "Calcificación vascular" como palabra clave para buscar en las bases de datos15 (véase la Tabla complementaria 1), incluidas GeneCards, OMIM, PharmGkb y DrugBank, con las especies establecidas en Homo sapiens. Después de la deduplicación, cree una base de datos de objetivos de calcificación vascular.
- Predicción de posibles dianas terapéuticas
- Introduzca los objetivos para el salidrósido y la calcificación vascular (consulte la Tabla complementaria 1) para identificar los objetivos comunes. Generar un diagrama de Venn para visualizar las posibles dianas terapéuticas del salidrósido en el tratamiento de la calcificación vascular.
- Construcción de la red de interacción proteína-proteína (IBP) "Salidroside-Calcificación vascular"
- Compile los objetivos potenciales en una Lista de Proteínas Múltiples y analícelos utilizando STRING (ver Tabla Suplementaria 1), con el organismo establecido en Homo sapiens y la puntuación de interacción establecida en confianza media (>0.4)16. Extraiga los datos de PPI en formato TSV para su posterior análisis.
NOTA: Dado que el 85% de los genes de rata son homólogos a genes humanos, realizando funciones biológicas similares, se seleccionaron ratas como sujetos experimentales para validar los efectos del salidrósido sobre la calcificación vascular17.
- Compile los objetivos potenciales en una Lista de Proteínas Múltiples y analícelos utilizando STRING (ver Tabla Suplementaria 1), con el organismo establecido en Homo sapiens y la puntuación de interacción establecida en confianza media (>0.4)16. Extraiga los datos de PPI en formato TSV para su posterior análisis.
- Selección y construcción de redes de objetivos clave
- Importe los datos de la red PPI en Cytoscape 3.9.1 (consulte la Tabla complementaria 1) para su análisis utilizando el complemento CytoNCA para evaluar parámetros como la intermediación (BC), la cercanía (CC), el grado (DC), el vector propio (EC), la conectividad promedio local (LAC) y la centralidad de la red (NC). Seleccione los objetivos clave con CC=1 para construir un mapa de espectro de acción de objetivos principales para 'SAL-VC'.
- Utilice el complemento CytoHubba para identificar los 10 genes hub principales en función de los cálculos de Centralidad de Camarilla Máxima (MCC), Componente de Vecindario Máximo (MNC) y Grado, generando un mapa de espectro de genes Hub.
- Análisis de enriquecimiento de las vías GO y KEGG
- Realice la conversión de ID de genes utilizando DAVID (consulte la Tabla complementaria 1), seleccionando ENSEMBL_GENE_ID para el tipo de gen 9606 para obtener información sobre la especie. Analice la lista de genes convertidos utilizando Omicshare (ver Tabla suplementaria 1) para el enriquecimiento funcional de GO y de la vía KEGG, con una significación establecida en un valor de P < 0,0518.
NOTA: El análisis funcional de GO incluye la función molecular (MF), el proceso biológico (BP) y el componente celular (CC). El análisis de la vía KEGG implica el enriquecimiento de la vía y el enriquecimiento de la clasificación de la vía19. Los resultados del análisis de enriquecimiento se muestran en la Figura 2.
- Realice la conversión de ID de genes utilizando DAVID (consulte la Tabla complementaria 1), seleccionando ENSEMBL_GENE_ID para el tipo de gen 9606 para obtener información sobre la especie. Analice la lista de genes convertidos utilizando Omicshare (ver Tabla suplementaria 1) para el enriquecimiento funcional de GO y de la vía KEGG, con una significación establecida en un valor de P < 0,0518.
2. Experimento con animales
- Aclimatación
- Aclimata ratas Wistar en condiciones específicas libres de patógenos (SPF) con un ciclo de luz/oscuridad de 12 horas. Asegurarse de que tengan acceso ad libitum a alimentos y agua para mantener su salud antes del comienzo de los experimentos. Realizar alimentación adaptativa durante 1 semana.
- Establecimiento modelo
- Aclimatar a las ratas a las condiciones ambientales y asignarlas aleatoriamente a cinco grupos: grupo de control (Ctrl, ND + Vehículo), grupo de modelo (modelo, HFD + vehículo), grupo de dosis baja de SAL (SAL-L, HFD + SAL 5 mg/kg), grupo de dosis alta de SAL (SAL-H, HFD + SAL 10 mg/kg) y grupo de simvastatina (SIM) (HFD + SIM 5 mg/kg).
- Administrar una dieta normal (ND) al grupo Ctrl y una dieta alta en grasas (HFD) a los grupos restantes durante toda la duración del experimento. El primer día de administración de HFD, inyectar una dosis subcutánea única de 600.000 UI/kg VD3 a todos los grupos excepto al grupo Ctrl20,21. A continuación, se administran inyecciones subcutáneas semanales de 100.000 UI/kg de VD3 durante las siguientes 8 semanas (Figura 3).
- Controlar diariamente el estado de salud y la supervivencia de los animales. Iniciar las intervenciones experimentales en la novena semana.
- Sacrificar a los animales al final del estudio (siguiendo los protocolos aprobados institucionalmente). Recoger muestras de suero, dejarlas reposar durante 30 minutos y centrifugar para aislar el suero (siguiendo los informes publicados anteriormente20,21). Diseccionar los tejidos vasculares (aorta abdominal) y enjuagar con solución salina tamponada con fosfato (PBS) para eliminar la sangre.
- Fije una porción del tejido en paraformaldehído al 4% para el examen histológico y almacene otra porción en nitrógeno líquido para el análisis molecular.
NOTA: Diluya el salidrósido con agua tibia antes de usar.
3. Evaluación de la lesión del tejido vascular mediante tinción HE, VK, EVG
NOTA: Fijar el tejido vascular (aorta abdominal) en paraformaldehído al 4%, deshidratado en etanol después de 48 h e incrustado en parafina. Corte los bloques de parafina incrustados en rodajas de 5 μm para la tinción con hematoxilina-eosina (HE), Elastica van Gieson (EVG) y Von Kossa (VK), y observe la morfología histológica bajo un microscopio óptico. La tinción HE se utiliza para evaluar los cambios en la morfología del tejido. En el tejido vascular, destaca las alteraciones estructurales en la pared del vaso, incluida la proliferación de células musculares lisas, la disposición celular desorganizada y la inflamación. La tinción EVG visualiza las fibras elásticas y de colágeno, lo cual es esencial para evaluar el daño o la remodelación de las fibras elásticas en el tejido vascular y ayuda a comprender el impacto de la calcificación en la elasticidad vascular. La tinción con VK detecta depósitos de calcio, una característica clave en la VC, por lo que es crucial para evaluar el alcance y la distribución de la calcificación en el tejido vascular22,23.
- Tinción HE para la detección de daños en el tejido vascular
- Desparafinación y rehidratación
- Desparafinar las secciones en dos cambios de xileno durante 8 min cada una y rehidratar a través de una serie de etanol graduada (100%, 95%, 85%, 75%) durante 3 min por paso. A continuación, enjuague de 2 minutos con agua corriente del grifo.
- Tinción con hematoxilina
- Tiñe las secciones con hematoxilina durante 5-10 minutos y lávalas para eliminar el exceso de mancha, seguido de un enjuague con agua corriente del grifo.
NOTA: Se recomienda una tinción ligera de 5 min para evitar tinciones demasiado oscuras, que pueden afectar el color citoplasmático.
- Tiñe las secciones con hematoxilina durante 5-10 minutos y lávalas para eliminar el exceso de mancha, seguido de un enjuague con agua corriente del grifo.
- Diferenciación
- Diferencie las secciones en una solución de diferenciación durante 30 s, seguidas de dos enjuagues con agua del grifo durante 3 minutos cada una.
- Contratinción de eosina
- Coloque las secciones en la tinción de eosina durante 1 min. Después de eliminar el exceso de mancha, realice una deshidratación rápida.
- Deshidratación, clarificación y montaje
- Para una deshidratación rápida, sumerja las secciones en etanol al 75%, 85%, 95% y 100% durante 3 s cada una, seguidas de etanol al 100% durante 1 min.
NOTA: Se recomienda una deshidratación rápida ya que la eosina puede perder color en los gradientes de agua y etanol.
- Para una deshidratación rápida, sumerja las secciones en etanol al 75%, 85%, 95% y 100% durante 3 s cada una, seguidas de etanol al 100% durante 1 min.
- Desparafinación y rehidratación
- Tinción VK para la detección de calcio
- Desparafinación y rehidratación
- Realice este paso siguiendo el paso 3.1.1.
- Reacción del nitrato de plata
- Seque las secciones, delinee con un pincel fino y tiña con Von Kossa (ver Tabla de Materiales). Exponerlos a la luz ultravioleta durante 4 h, luego enjuagar bien con agua corriente del grifo.
- Contratinción con hematoxilina
- Teñir las secciones con hematoxilina durante 5 minutos, enjuagar con agua corriente del grifo, diferenciar y enjuagar nuevamente, seguido de un enjuague con agua corriente del grifo.
- Contratinción de eosina
- Deshidratar las secciones con etanol graduado (85% y 95% durante 5 minutos cada una), luego teñir con eosina durante 5 minutos.
- Deshidratación y montaje
- Deshidratar las secciones en baños de etanol (100% Etanol I, II, III durante 5 min cada uno) y clarificar en baños de xileno (Xileno I y II durante 5 min cada uno). A continuación, monta las secciones con bálsamo neutro.
- Examen microscópico y captura de imágenes
- Examine las secciones manchadas bajo un microscopio óptico y capture imágenes para su análisis.
NOTA: Asegúrese de que los depósitos de calcio aparezcan de color marrón negruzco a negro oscuro, los núcleos sean azules y el fondo sea rojo. Prepare la solución de nitrato de plata para la tinción fresca de VK inmediatamente antes de usarla.
- Examine las secciones manchadas bajo un microscopio óptico y capture imágenes para su análisis.
- Desparafinación y rehidratación
- Tinción EVG para fibras elásticas y de colágeno
- Desparafinación y rehidratación
- Trate las secciones de parafina con calor durante 50 minutos, luego sumérjalas en xileno durante 20 minutos para eliminar la parafina. Proceda sometiendo las secciones a una serie de etanol graduada (100%, 95%, 85%, 75%) durante 5 minutos cada una, concluyendo con un enjuague con agua corriente del grifo durante 5 minutos.
- Tinción EVG
- Aplique la solución de tinción EVG (consulte la tabla de materiales) durante 10 minutos, luego enjuague brevemente con agua corriente del grifo durante 5 s para eliminar el exceso de mancha.
- A continuación, aplique la solución de trabajo de Verhoeff (consulte la tabla de materiales) durante 5 minutos, seguido de otro breve enjuague con agua corriente del grifo durante 5 s. Aplique la solución diferenciadora de Verhoeff durante 5 s hasta que las fibras de elastina sean claramente visibles, y luego enjuague con agua corriente del grifo durante 5 s.
NOTA: Mezcle los componentes A, B y C (provistos en el kit disponible comercialmente) en una proporción de 5:2:2 para preparar la solución de trabajo de Verhoeff antes de usarla. Use la solución dentro de las 2 horas y reponga según sea necesario durante el proceso de tinción para evitar que las secciones se sequen.
- Deshidratación y montaje
- Deshidratar las secciones a través de una serie de etanol graduadas (75%, 85%, 95% y 100%) durante 5 s cada una, seguidas de una clarificación en dos cambios de xileno durante 1 min cada una. Después de un breve período de secado al aire, monte las secciones con bálsamo neutro.
- Examen microscópico y análisis de imágenes
- Examine las secciones teñidas bajo un microscopio óptico para visualizar las fibras elásticas y de colágeno, y capture imágenes para su posterior análisis.
- Desparafinación y rehidratación
4. Ensayo de fosfatasa alcalina (ALP)
NOTA: Utilice la fosfatasa alcalina como indicador clave para evaluar la eficacia de los tratamientos anticalcificantes.
- Preparación de reactivos
- Disuelva el sustrato revelador de color en un tampón de carbonato de pH 9,6 de 0,05 M helado hasta un volumen final de 2,5 mL.
NOTA: Prepare el tampón disolviendo 1,59 g de carbonato de sodio y 2,93 g de bicarbonato de sodio en 1.000 mL de agua bidestilada.
- Disuelva el sustrato revelador de color en un tampón de carbonato de pH 9,6 de 0,05 M helado hasta un volumen final de 2,5 mL.
- Dilución del sustrato
- Diluir 10 μL de solución de p-nitrofenol (10 mM) con tampón de carbonato de pH 9,6 de 0,05 M hasta un volumen final de 0,2 mL para lograr una concentración final de 0,5 mM.
- Preparación de la muestra
- Homogeneizar la aorta abdominal en tampón de lisis. Centrifugar el homogeneizado (~12.000 x g durante 10 min a 4 °C) y recoger el sobrenadante para la detección de la actividad de ALP.
NOTA: Asegúrese de que el tampón de lisis esté libre de inhibidores de la fosfatasa. Almacene las muestras de prueba pendientes a -80 °C, evitando ciclos repetidos de congelación y descongelación.
- Homogeneizar la aorta abdominal en tampón de lisis. Centrifugar el homogeneizado (~12.000 x g durante 10 min a 4 °C) y recoger el sobrenadante para la detección de la actividad de ALP.
- Preparación de microplacas para ensayos
- Prepare una placa de 96 pocillos con pocillos en blanco, estándar y de muestra. Agregue 50 μL de la solución estándar a los pocillos estándar y 50 μL de muestras de prueba pendientes a los pocillos de muestreo. Incubar la placa a 37 °C durante 10 min.
- Terminación de reacción y medición de absorbancia
- Agregue 100 μL de solución de parada a cada pocillo para terminar la reacción. Mida la absorbancia a 405 nm y calcule la actividad de ALP en función de los valores de absorbancia (siguiendo las instrucciones del fabricante, consulte la Tabla de materiales).
NOTA: Los pocillos que contienen el estándar o muestras con actividad ALP mostrarán diferentes tonos de amarillo. El color es estable hasta por 2 h.
- Agregue 100 μL de solución de parada a cada pocillo para terminar la reacción. Mida la absorbancia a 405 nm y calcule la actividad de ALP en función de los valores de absorbancia (siguiendo las instrucciones del fabricante, consulte la Tabla de materiales).
5. Determinación del contenido de calcio
NOTA: La determinación del contenido de calcio es fundamental para evaluar el grado de mineralización en los tejidos biológicos.
- Preparación de tejidos
- Picar el tejido en trozos pequeños y homogeneizar en tampón de lisis.
- Dilución y centrifugación de muestras
- Diluir el tejido en tampón de lisis en una proporción de 1:10. Homogeneizar la mezcla y centrifugar a 4 °C, 12.000 x g durante 5 min. Recoja el sobrenadante para su análisis.
NOTA: Prepare diluciones estándar de calcio (0-1.0 mM) usando una solución estándar de calcio de 5 mM (ver Tabla de Materiales).
- Diluir el tejido en tampón de lisis en una proporción de 1:10. Homogeneizar la mezcla y centrifugar a 4 °C, 12.000 x g durante 5 min. Recoja el sobrenadante para su análisis.
- Configuración de placas e incubación
- Agregue 50 μL de muestras estándar o de prueba a cada pocillo de una placa de 96 pocillos. Añadir 150 μL de solución de trabajo para ensayos, mezclar bien e incubar la placa en la oscuridad a temperatura ambiente durante 10 min. Mida la absorbancia a 575 nm y construya una curva estándar.
- Cálculo del contenido de calcio
- Calcule el contenido de calcio utilizando la curva estándar, incorporando el factor de dilución, el volumen de la muestra y el peso atómico del calcio.
6. Ensayo de inmunoabsorción enzimática (ELISA) para citocinas inflamatorias (IL-6, TNF-α, IL-1β)
NOTA: La IL-6, la IL-1β y el TNF-α son citocinas proinflamatorias clave que indican la presencia y la gravedad de una respuesta inflamatoria. La medición de estas citocinas es esencial para comprender el proceso inflamatorio y evaluar la eficacia de los tratamientos antiinflamatorios.
- Recogida de muestras
- Recoge suero de la aorta abdominal de la rata. Deje que se coagule a temperatura ambiente durante 2 h. Centrifugar la muestra a 3.000 x g durante 10 min a 4 °C y recoger el sobrenadante.
- Preparación de la microplaca para el ensayo
- Prepare una placa de 96 pocillos con pocillos designados para patrones y muestras de prueba. Agregue 50 μL de patrones (consulte la Tabla de Materiales) a diferentes concentraciones a los pocillos apropiados.
- Preparación de la muestra
- Añada 40 μL de diluyente de muestra a cada pocillo designado para muestras de ensayo. Agregue 10 μL de la muestra a los mismos pocillos, lo que resulta en una dilución de 5 veces.
- Incubación con reactivos marcados con enzimas
- Agregue 100 μL de reactivos marcados con enzimas específicos para IL-6, TNF-α o IL-1β a todos los pocillos excepto al blanco. Incubar la placa a 37 °C durante 60 min.
- Lavado
- Deseche el líquido de todos los pocillos excepto el blanco. Lave los pocillos con 1 solución de lavado (preparada como una dilución de 20 veces en agua destilada). Repita este paso de lavado cinco veces y seque los pozos.
- Desarrollo y terminación del color
- Agregue 50 μL de soluciones de sustrato A y B (del kit disponible comercialmente, consulte la Tabla de materiales) a cada pocillo. Mezclar suavemente e incubar la placa a 37 °C en la oscuridad durante 15 min. Agregue 50 μL de solución de parada a cada pocillo para terminar la reacción.
- Medición de absorbancia y análisis de datos
- Establezca el pozo en blanco como cero. Mida la absorbancia a 450 nm utilizando un lector de microplacas. Genere una curva estándar basada en los valores de OD y las concentraciones estándar. Calcule las concentraciones de la muestra mediante interpolación y ajuste el factor de dilución.
7. Ensayo del perfil lipídico
NOTA: El ensayo de perfil lipídico detecta niveles anormales de lípidos, donde los niveles de lípidos elevados o desequilibrados pueden acelerar el riesgo de calcificación vascular.
- Colesterol total y triglicéridos (CT y TG)
- Recoja el suero y prepare una placa de 96 pocillos con pocillos designados para muestras en blanco, de calibración y de prueba pendientes. Agregue 2,5 μL de suero, patrón de calibración o solución en blanco a cada pocillo.
- Agregue 250 μL de la solución de trabajo a cada pocillo. Mezclar suavemente e incubar la placa a 37 °C durante 10 min. Mida la absorbancia a 500 nm utilizando un lector de microplacas.
- Lipoproteínas de baja densidad y lipoproteínas de alta densidad (LDL-C y HDL-C)
- Recoja el suero y prepare una placa de 96 pocillos con pocillos designados para muestras en blanco, de calibración y de prueba pendientes. Agregue 2,5 μL de suero, patrón de calibración o solución en blanco a los pocillos respectivos.
- Añada el reactivo adecuado (reactivo uno para 180 μl o reactivo dos para 60 μl, consulte la tabla de materiales) a cada pocillo como se especifica en las instrucciones del kit de ensayo. Incubar a la temperatura (37 °C) y durante el tiempo (Reactivo Uno durante 5 min o Reactivo Dos durante 10 min) recomendados para cada reactivo.
- Mida la absorbancia a la longitud de onda específica (600 nm) indicada para LDL-C o HDL-C utilizando un lector de microplacas.
8. Western blot
NOTA: El Western blot (WB) es fundamental para evaluar los niveles de expresión de proteínas clave, lo que permite la detección de formas totales y fosforiladas.
- Preparación de tejidos
- Pesar 0,05 g de pañuelo de papel y enjuagar bien con PBS para eliminar el exceso de residuos. Añadir 500 μL de tampón de lisis que contenga 1x inhibidores de fosfatasa y proteasa. Incubar el tejido a 4 °C durante 10 min y homogeneizarlo con un triturador de tejidos.
- Extracción de proteínas
- Deje reposar la muestra homogeneizada durante 1 min, luego centrifuga a 4 °C y 12.000 x g durante 15 min. Recoja el sobrenadante para el análisis de proteínas. Determine la concentración de proteínas utilizando el método BCA siguiendo las instrucciones del fabricante (ver Tabla de Materiales). Utilice una curva estándar para calcular la concentración.
NOTA: Enfríe previamente la centrífuga a 4 °C antes de usarla. Mida la concentración de proteínas a 562 nm.
- Deje reposar la muestra homogeneizada durante 1 min, luego centrifuga a 4 °C y 12.000 x g durante 15 min. Recoja el sobrenadante para el análisis de proteínas. Determine la concentración de proteínas utilizando el método BCA siguiendo las instrucciones del fabricante (ver Tabla de Materiales). Utilice una curva estándar para calcular la concentración.
- Preparación de la muestra
- Mezcle la muestra de proteína con tampón de carga 5x que contenga β-mercaptoetanol y SDS en una proporción de 4:1. Calentar la mezcla a 100 °C durante 5 min para desnaturalizar las proteínas.
NOTA: Si se requiere un tampón de carga 1x, diluya el tampón 5x con tampón de lisis.
- Mezcle la muestra de proteína con tampón de carga 5x que contenga β-mercaptoetanol y SDS en una proporción de 4:1. Calentar la mezcla a 100 °C durante 5 min para desnaturalizar las proteínas.
- Preparación del gel SDS-PAGE
- Prepare un gel SDS-PAGE al 12% y colóquelo en el aparato de electroforesis. Agregue 1x tampón de electroforesis hasta la mitad del camino según las instrucciones (consulte la Tabla complementaria 2).
- Electroforesis
- Recupere las muestras de proteínas a -20 °C. Cargue 60 μg de proteína por pocillo y ejecute el gel.
- Ajuste la corriente a 50 mA durante 20 min para el gel de apilamiento, luego aumente a 100 mA durante 60 min para el gel separador hasta que el frente del tinte llegue al fondo.
- Transferencia de membranas
- Activar la membrana de PVDF en metanol durante 5 min.
- Ensamble el sándwich de transferencia en el siguiente orden: papel de filtro → gel SDS-PAGE → membrana de PVDF → papel de filtro. Transfiera proteínas a 300 mA durante 60 min.
NOTA: Asegúrese de que no queden burbujas de aire atrapadas entre el gel SDS-PAGE y la membrana de PVDF.
- Bloqueante
- Incubar la membrana de PVDF en BSA al 5% (preparado en 1x TBST) a temperatura ambiente agitando suavemente durante 60 min. Lave la membrana con 1x TBST tres veces durante 5 minutos cada una.
- Incubación primaria de anticuerpos
- Incubar la membrana en 5 mL del anticuerpo primario apropiado (por ejemplo, p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB, p65, NF-κB, p65, IκBα) diluido en tampón de bloqueo a temperatura ambiente durante 2,5 h.
- Incubación secundaria de anticuerpos
- Lave la membrana con 1x TBST tres veces durante 5 minutos cada una después de la incubación primaria de anticuerpos. Incubar con el anticuerpo secundario adecuado a temperatura ambiente durante 1 h. Vuelva a lavar la membrana con 1x TBST tres veces durante 5 minutos cada una.
- Detección
- Visualice las bandas de proteínas mediante la detección de quimioluminiscencia ECL24 (consulte la tabla de materiales).
- Análisis de densitometría
- Cuantifique las bandas de proteínas con el software ImageJ. Siga este flujo de trabajo en ImageJ: Image → 8-bit → Process → Substra Background. Analice → establezca medidas → analice → escala establecida. Edite → invierta → analice → mida → resultados. Archivo → Guardar como → IntDen.
- Genere gráficos estadísticos utilizando software de gráficos y análisis estadístico.
NOTA: Asegúrese de que los resultados sean coherentes en todas las réplicas para validar los hallazgos.
9. Análisis estadístico
- Recopile y organice datos con GraphPad Prism 9.0.
- Calcule y trace las barras de error utilizando la media ± SD de los datos sin procesar.
- Realice análisis estadísticos utilizando ANOVA de un factor, seguido de la prueba post-hoc de Tukey para comparaciones múltiples.
- Determine la significancia estadística a P < 0.05, donde los valores de P más pequeños indican mayores diferencias en los resultados.
Resultados
Análisis de farmacología de red
Utilizando bases de datos como HERB, TCMSP, Pubmed, SwissTargetPrediction, CTD, PharmMapper, SEA y STITCH, se identificaron 388 genes diana potenciales para el salidrósido. Además, se recuperaron 2871 genes diana potenciales relacionados con la VC de bases de datos como GeneCards, OMIM, PharmGkb y DrugBank. El análisis de intersección a través de diagramas VENN reveló 208 objetivos superpuestos, considerados objetivos clave para la intervención de salidrósido en VC (Figura 1A).
Análisis de la red PPI
Se utilizó la plataforma STRING para analizar las interacciones entre los 208 objetivos clave, de los cuales se seleccionaron los 100 nodos principales. Estos nodos se importaron a Cytoscape 3.9.1 para construir una red PPI detallada. El análisis de la topología de la red utilizando parámetros como EC, BC, NC, LAC, CC y DC identificó 37 objetivos principales. Un mayor refinamiento centrado en el grado, MCC y MNC identificó los 10 objetivos principales principales, incluidos IL6, TNF, TP53, IL1B, HIF1A, CASP3 y STAT3 (Figura 1B).
Análisis funcional de GO y de la vía KEGG
El análisis funcional de GO de los 208 objetivos clave identificó 4808 procesos biológicos, 294 componentes celulares y 515 funciones moleculares. El análisis de la vía KEGG informó de 281 vías de señalización, principalmente relacionadas con el metabolismo, el procesamiento de información genética y ambiental, los sistemas de organismos, los procesos celulares y las enfermedades humanas. Se encontró que la mayoría de los genes identificados estaban enriquecidos en la vía de los lípidos y la aterosclerosis, lo que indica que el mecanismo clave por el cual el SAL mejora la VC puede implicar la regulación de cambios anormales en los factores lipídicos e inflamatorios (Figura 2).
Validación de experimentos in vivo
En comparación con el grupo Ctrl, las ratas del grupo modelo mostraron obesidad, letargo y pelaje opaco. Los perfiles lipídicos séricos mostraron aumentos significativos en los niveles de TC, TG y LDL-C y una disminución en el HDL-C en el grupo modelo (p < 0,05). Por el contrario, los grupos SAL-L, SAL-H y SIM mostraron mejoras significativas en estos parámetros, con un efecto dosis-dependiente en los grupos SAL (p < 0,05) (Figura 4).
La tinción HE se utilizó para identificar alteraciones estructurales en la aorta abdominal de rata, mientras que la tinción EVG evaluó la condición de las fibras elásticas, y la tinción VK se empleó para identificar depósitos de calcio. En el grupo de control, la tinción HE delineó las distintas capas del tejido de la aorta abdominal, y la tinción EVG reveló una disposición ordenada de fibras elásticas con interrupciones mínimas. Los depósitos de calcio no estaban marcadamente presentes según la tinción con VK. Por el contrario, el grupo modelo exhibió tejido vascular con hiperplasia íntima e infiltración de células inflamatorias, junto con un extenso desorden estructural en la capa media. La distinción entre las fibras elásticas y las células musculares lisas era indistinta, y las fibras estaban dispuestas irregularmente, con calcificación necrótica visible. También se observó infiltración linfocitaria adventicia. La tinción de EVG en este grupo mostró un patrón desordenado de fibras elásticas, con roturas extensas, y la tinción de VK confirmó depósitos de calcio sustanciales.
Después de la intervención de SAL, se observó una mejora notable en el daño vascular por VC. La tinción HE indicó que los grupos SAL-L y SAL-H tenían estructuras de la capa vascular bien definidas, con una degeneración mínima de las células musculares lisas en el medio. Después de la tinción con EVG, las fibras elásticas de ambos grupos se alinearon perfectamente con pocas interrupciones, y el grupo SAL-H superó al grupo SAL-L. La tinción con VK no mostró depósitos significativos de calcio en ninguno de los grupos, lo que sugiere que el SAL mitigó las alteraciones estructurales vasculares inducidas por la VC.
Después de la intervención SIM, los cambios estructurales vasculares reflejaron los del grupo SAL-H. La tinción con HE demostró una arquitectura clara de la aorta abdominal con una degeneración mínima de las células del músculo liso en el medio. La tinción con EVG confirmó la disposición ordenada de las fibras elásticas con pocas interrupciones, y la tinción de Von Kossa no detectó depósitos de calcio significativos. Estos hallazgos sugieren que el grupo SAL mejoró significativamente los síntomas adversos asociados con la VC (Figura 5).
Tanto los niveles de iones de calcio (Ca2+) como los de ALP se elevaron significativamente en el grupo modelo en relación con el grupo Ctrl (p < 0,05). Sin embargo, estos niveles disminuyeron marcadamente en los grupos SAL-L y SAL-H, y la dosis más alta de SAL demostró una eficacia superior (Figura 6A,B). Además, la expresión de la Proteína Morfogenética Ósea-2 (BMP2) mejoró notablemente en el grupo modelo (p < 0,001), mientras que los grupos SAL mostraron una reducción en la expresión de BMP2 en diversos grados (p < 0,01) (Figura 6C). El análisis de los factores inflamatorios reveló una regulación positiva significativa de TNF-α e IL-6 en el grupo modelo (p < 0,05), lo que indica una respuesta inflamatoria debido a la VC (Figura 6D-F). Tras el tratamiento con SAL, estos marcadores inflamatorios disminuyeron significativamente (p < 0,05), con mejores resultados en el grupo SAL-H.
El análisis de la expresión de proteínas en el tejido vascular mostró un aumento de los niveles de fosforilación de JAK2, STAT3 y NF-κB p65, y una disminución de la expresión de IκBα en el grupo modelo (p < 0,05). Tanto el tratamiento con SAL-L como con SAL-H disminuyeron significativamente los niveles de fosforilación de JAK2, STAT3 y NF-κB p65, al tiempo que aumentaron la expresión de IκBα, lo que sugiere que el salidrósido mitiga la progresión de VC a través de la vía de señalización JAK2/STAT3 (Figura 7).
Estos resultados ponen de manifiesto los posibles efectos terapéuticos de la SAL sobre la VC, respaldados por la farmacología de red y la validación in vivo , al tiempo que ofrecen información sobre sus posibles mecanismos de acción.

Figura 1: Red de interacción de las dianas principales entre el salidrósido y la calcificación vascular. (A) El diagrama de flujo de la red de interacción de los objetivos centrales entre el salidrósido y la calcificación vascular. (B) Diagrama de Venn que muestra la superposición entre los objetivos de salidrósido (púrpura) y los objetivos de calcificación vascular (verde). Los objetivos que se intersecan se indican con texto negro. (C) La posible red de interacción de objetivos centrales involucrada en los efectos del salidrósido en el VC. (1) Los 100 principales nodos vecinos de la red PPI. Cada nodo representa un destino y cada borde representa una interacción entre destinos. (2) Red de genes hub (37 nodos identificados mediante el plugin CytoNCA). (3) Los 20 principales nodos vecinos de la red PPI. (4-6) Objetivos clave identificados en función de los criterios de Grado, MCC y MNC utilizando el complemento CytoHubba (10 nodos cada uno). Haga clic aquí para ver una versión más grande de esta figura.
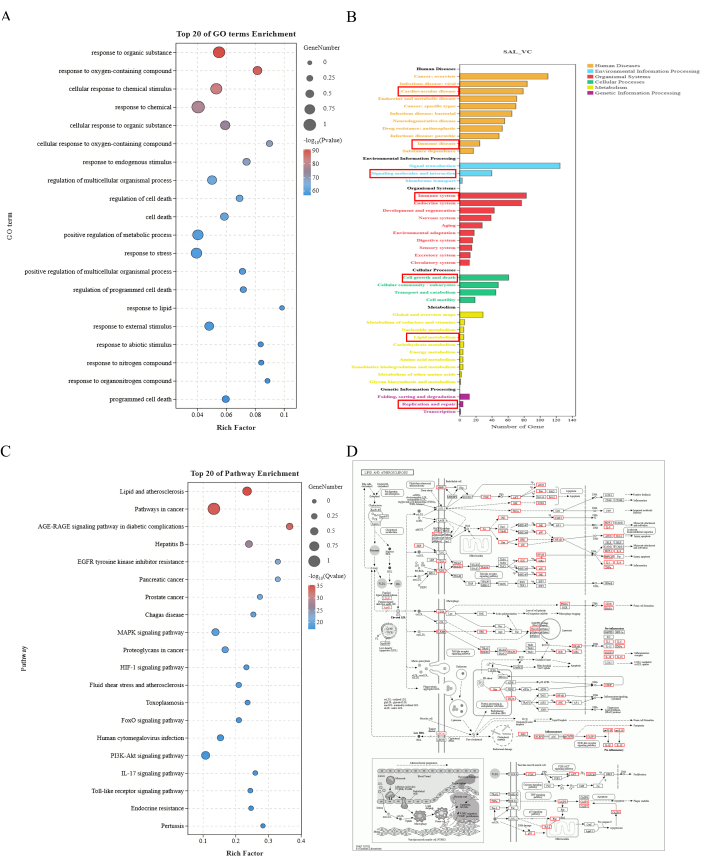
Figura 2: Resultados del análisis de enriquecimiento. (A) Los 20 principales enriquecimiento de términos de GO. El eje X representa el factor enriquecido y el eje Y representa los términos GO. El tamaño de los puntos indica el número de genes, y el color representa -log10 (valor P ), mientras que el rojo indica un valor P menor. (B) Anotación de enriquecimiento de la vía KEGG. El eje X representa el número de genes y el eje Y representa diferentes niveles de información de anotación. Los diferentes colores representan varias categorías de anotaciones de primer nivel. (C) Enriquecimiento de las 20 vías principales. El eje X representa el factor enriquecido y el eje Y representa los términos GO. El tamaño de los puntos indica el número de genes, y el color representa -log10 (valor P ), mientras que el rojo indica un valor P menor. (D) Mapa de vías lipídicas y aterosclerosis. Los recuadros rojos indican los posibles objetivos de la intervención de salidrósidos en la VC que están enriquecidos en la vía de los lípidos y la aterosclerosis. Haga clic aquí para ver una versión más grande de esta figura.
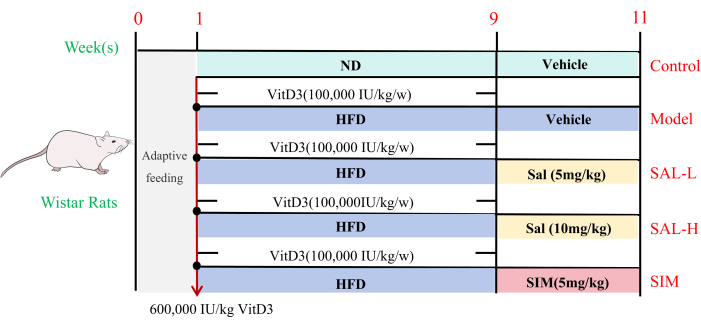
Figura 3: Investigación del efecto del salidrósido sobre la calcificación vascular en ratas mediante experimentos in vivo . Diagrama de flujo del diseño experimental. Se utilizaron ratas Wistar para un experimento de 11w. Durante la primera semana, las ratas se aclimataron y luego se dividieron aleatoriamente en cinco grupos: Ctrl, Model, SAL-L, SAL-H y SIM para los experimentos posteriores. Las semanas 1-9 consistieron en alimentar al grupo Ctrl con una dieta normal (ND), mientras que los otros grupos recibieron una dieta alta en grasas (HFD) a partir de 8 semanas después de una sola inyección de 600.000 UI/kg VD3, seguida de inyecciones semanales de 100.000 UI/kg VD3. A partir de las semanas 9 y 10, todos los grupos cambiaron a HFD (excepto el grupo Ctrl), con los grupos SAL-L y SAL-H recibiendo inyecciones intraperitoneales de salidrósido a 5 mg/kg y 10 mg/kg, respectivamente, mientras que el grupo SIM recibió simvastatina a 5 mg/kg (n = 8). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Niveles séricos de lípidos en ratas VC tratadas con salidrósido. Los niveles de lípidos séricos en ratas VC se midieron utilizando los métodos GPO-PAP de reactivo único y reactivo directo dual. (A) Niveles de TG (método GPO-PAP de reactivo único). (B) Niveles de TC (método GPO-PAP de reactivo único). (C) Niveles de HDL-C (método directo de doble reactivo). (D) Niveles de LDL-C (método directo de doble reactivo). Cada columna representa la media ± DE (n = 8). En comparación con el grupo Ctrl, P < 0,001; en comparación con el grupo Modelo, ###P < 0.001, ##P <0.01, #P < 0.05. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Evaluación histológica del daño del tejido vascular en ratas VC. Se utilizó la tinción HE para evaluar el daño tisular, con flechas rojas que indican calcificación medial y flechas verdes que indican infiltración linfocítica en la adventicia. Los núcleos se tiñen de azul y el citoplasma se tiñe de rojo. La tinción EVG se utilizó para observar el daño a las fibras elásticas en la aorta abdominal, con flechas azules que indican áreas de ruptura y desorganización de las fibras elásticas. Las fibras elásticas aparecen rojas y los músculos parecen de color rojo pálido. Se utilizó la tinción VK para observar la deposición de calcio en la aorta abdominal, con áreas anaranjadas que indican depósitos de calcio, que aparecen negras (barras de escala: 100 μm, n = 8). Haga clic aquí para ver una versión más grande de esta figura.
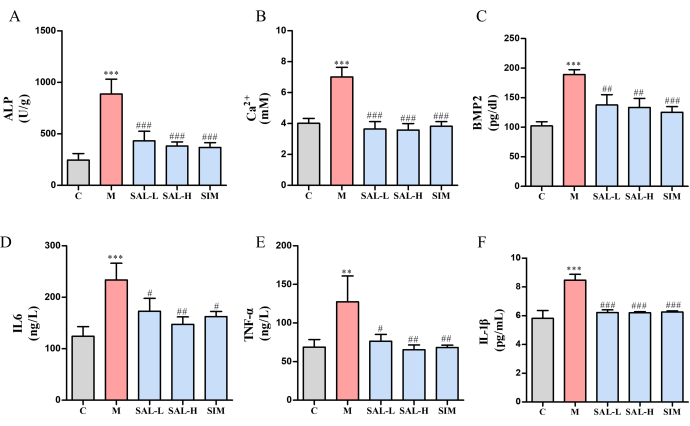
Figura 6: Expresión de marcadores de calcificación ósea y citocinas inflamatorias en ratas VC tratadas con salidrósido. (A) Actividad de ALP (un marcador de calcificación vascular). (B) Contenido de iones de calcio. (C) Expresión de BMP2 (Proteína Morfogenética Ósea). (D) Expresión de IL-6 (citoquina proinflamatoria). (E) Expresión de TNF-α (citocina proinflamatoria). (F) Expresión de IL-1β (citocina proinflamatoria). Cada columna representa la media ± DE (n = 8). En comparación con el grupo Ctrl, P < 0,001, **P < 0,01; en comparación con el grupo Modelo, ###P < 0.001, ##P < 0.01, #P < 0.05. Haga clic aquí para ver una versión más grande de esta figura.
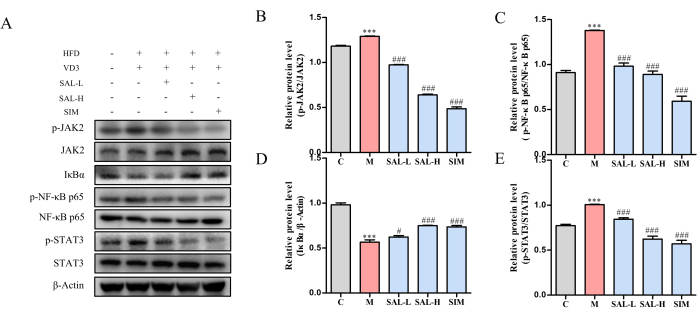
Figura 7: Análisis de Western blot de la expresión de proteínas clave en ratas VC tratadas con salidrósido. (A) Análisis de Western blot de los niveles de expresión de proteínas p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB, p65, NF-κB, p65 e IκBα. (B) Expresión relativa de proteínas de P-JAK2/JAK2 en diferentes grupos. (C) Expresión relativa de proteínas de p-NF-κB, p65, NF-κB, p65 en diferentes grupos. (D) Expresión Relativa de la Proteína IκBα en diferentes grupos. (E) Expresión proteica relativa de P-STAT3/STAT3 en diferentes grupos. Cada columna representa la media ± DE (n = 8). En comparación con el grupo Ctrl, P < 0,001; en comparación con el grupo Modelo, ###P < 0.001, ##P < 0.01, #P < 0.05. Haga clic aquí para ver una versión más grande de esta figura.
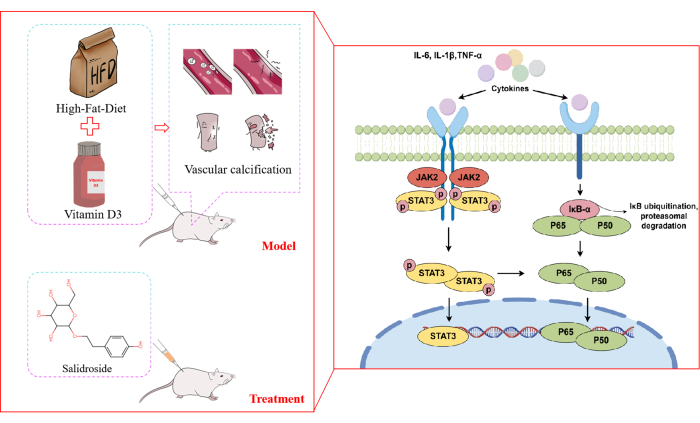
Figura 8: Mecanismo molecular propuesto para la intervención de salidrósido en ratas VC. El mecanismo molecular propuesto por el cual el salidrósido interviene en la VC implica la inhibición de factores relacionados con lípidos y citocinas proinflamatorias (IL-1β, IL-6, TNF-α). El salidrósido suprime la activación de IκBα y la fosforilación de JAK2, inhibiendo así la vía inflamatoria-inmune NF-κB/STAT3. En última instancia, esto reduce el daño del tejido vascular asociado con la progresión de la VC. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Información de la base de datos de farmacología de la red. Haga clic aquí para descargar este archivo.
Tabla complementaria 2: Componentes de SDS-PAGE (para 1 muestra). Haga clic aquí para descargar este archivo.
Discusión
La VC se caracteriza por cambios degenerativos en las células y tejidos vasculares, con depósitos minerales patológicos dentro de los vasos sanguíneos que conducen al endurecimiento de las paredes de los vasos o a la formación de placas ateroscleróticas, que pueden dar lugar a enfermedades vasculares obstructivas25. Los estudios muestran que alrededor del 85% de las placas de VC pueden evolucionar a trombosis, lo que puede desencadenar episodios cardiovasculares agudos. Además, la VC es un indicador crucial de posibles eventos cardiovasculares agudos, accidentes cerebrovasculares y enfermedades vasculares periféricas26. Los métodos de tratamiento actuales se centran principalmente en la anticoagulación, los fármacos hipolipemiantes y la regulación de la tensión vascular, pero estos enfoques suelen tener una eficacia y unos efectos secundarios limitados, especialmente en las fases avanzadas de la calcificación.
El salidrósido (SAL), un compuesto identificado como p-hidroxifenetil-beta-D-glucopiranósido, ha demostrado un potencial terapéutico significativo en diversas afecciones vasculares que afectan los sistemas nervioso, cardiovascular e inmunológico, así como en enfermedades renales crónicas27,28. La investigación moderna ha confirmado sus efectos antioxidantes, antienvejecimiento, inmunomoduladores y antiinflamatorios 29,30,31. El salidrósido mejora notablemente la función endotelial y aumenta la elasticidad de los vasos sanguíneos mediante la inhibición de los vasoconstrictores y la promoción de los vasodilatadores32. La elasticidad de los vasos sanguíneos refleja directamente los cambios posteriores a la calcificación, donde una pérdida de elasticidad a menudo acompaña a la degradación de las proteínas elásticas, dañando las capas internas y medias de los vasos sanguíneos. Este daño a menudo se manifiesta como la activación de células inflamatorias. Numerosos estudios destacan la estrecha asociación entre la VC y la inflamación. La inflamación crónica se considera un factor clave de la calcificación ectópica, donde las células proinflamatorias proliferan y liberan factores que contribuyen a la VC a través de múltiples vías 33,34,35,36. El potencial del salidrósido como agente terapéutico multidiana es especialmente relevante dado que la calcificación vascular es un proceso patológico complejo que implica inflamación, metabolismo lipídico y estrés oxidativo. El enfoque multiobjetivo de Salidroside, que inhibe las vías inflamatorias al tiempo que regula la acumulación de lípidos y el estrés oxidativo, presenta una clara ventaja sobre los fármacos de un solo objetivo que se utilizan actualmente. Por lo tanto, en este estudio, se examinará la expresión de factores inflamatorios para investigar más a fondo si el salidrósido influye en VC al reducir la inflamación.
El concepto de farmacología de red, introducido por Hopkins en 2007, implica el uso de enfoques basados en redes para examinar cómo los fármacos, las enfermedades y las dianas interactúan a través de múltiples componentes, dianas y vías37. En este estudio, se empleó la farmacología de redes para predecir cómo el SAL interactúa con el VC, identificando objetivos cruciales como IL6, STAT3, TNF, TP53 y ALB. Los resultados indicaron una concentración de estos genes en el metabolismo de los lípidos y las vías de aterosclerosis, lo que sugiere que la VC puede estar relacionada con la acumulación de lípidos y la inflamación en las arterias. Para verificar estas predicciones, se utilizó un modelo de rata de VC inducida por una dieta alta en grasas combinada con VD3. Este modelo permitió una mayor exploración del impacto de SAL en el VC. Los hallazgos revelaron que la VC aumentó los niveles de TC, TG y LDL-C mientras que disminuyó el HDL-C. Además, el SAL a diferentes dosis demostró efectos variables en la regulación de estos indicadores anormales. Los resultados de investigaciones posteriores indicaron que la SAL redujo eficazmente la deposición de calcio en la aorta abdominal, corrigió los niveles anormales de iones de calcio y disminuyó la infiltración de células inflamatorias, al tiempo que redujo la expresión de marcadores relacionados con la calcificación, como ALP y BMP2.
La vía JAK/STAT desempeña un papel crucial en diversos procesos de crecimiento y señalización, regulando las respuestas inmunitarias y la diferenciación celular, lo que la hace parte integral de las respuestas inflamatorias38. STAT3, activado por IL-6, es parte de una respuesta de fase aguda, con IL-6 induciendo la fosforilación de JAK, que a su vez fosforila STAT3. Esta activación controla la expresión génica relacionada con el crecimiento, la diferenciación y la supervivencia de las células. La fosforilación persistente de STAT3 se ha asociado con enfermedades vasculares y puede conducir a una expresión anormal de moléculas de adhesión, lo que en etapas tempranas de VC facilita la adhesión de los monocitos a la íntima vascular, dañando aún más la estructura vascular39,40. Los resultados experimentales muestran que SAL inhibe la expresión de JAK2, STAT3 y NF-κB p65 fosforilados, al tiempo que promueve la expresión de IκBα, lo que sugiere que el papel de SAL en la inhibición de la progresión de VC está mediado a través de la vía de señalización IL-6/JAK2/STAT3 (Figura 8).
En este estudio, la farmacología de redes predijo con éxito los mecanismos clave implicados en la progresión de la VC, identificando las dianas y las vías a través de las cuales interviene la SAL. Los paralelismos fisiológicos y patológicos entre los sistemas de ratas y humanos hacen que los modelos de ratas sean particularmente valiosos para la investigación clínica en el futuro. Además, las ratas son rentables y fáciles de manejar, lo que las hace adecuadas para la investigación de enfermedades y el descubrimiento de fármacos. A pesar de las ventajas de los modelos animales, existen limitaciones. Los modelos de ratas, si bien son útiles, no pueden capturar completamente la complejidad del desarrollo de VC en humanos. Los estudios futuros deben incluir modelos más diversos y considerar factores como las comorbilidades y los diferentes antecedentes de los pacientes.
Sin embargo, este estudio tiene varias limitaciones. El período experimental fue de 10 semanas, durante las cuales las ratas fueron alimentadas con una dieta alta en grasas (HFD) con una dosis inicial alta seguida de múltiples dosis más bajas de VD3 para inducir VC. La alta tasa de mortalidad observada en el modelo de rata se observó por primera vez durante los experimentos preliminares, donde se descubrió que las dosis altas y prolongadas de VD3 redujeron significativamente las tasas de supervivencia de las ratas, lo que en última instancia afectó la calidad y el cronograma del experimento. Esto subraya la necesidad de optimizar el modelo para mejorar las tasas de supervivencia y obtener datos más sólidos. Si bien este estudio confirmó los efectos de SAL en VC en ratas, la complejidad de VC y su prolongado proceso de desarrollo significa que un solo estudio en animales puede no capturar completamente su fisiopatología. Los estudios futuros deberían centrarse en refinar el modelo para mejorar las tasas de supervivencia de las ratas. Además, si bien los experimentos in vivo demostraron que el SAL reduce la VC mediante la modulación de los factores inflamatorios a través de la vía JAK2/STAT3, se deben realizar estudios adicionales para explorar objetivos in vitro aguas arriba y aguas abajo. Por último, los estudios clínicos sobre el SAL son limitados y se necesita más investigación para evaluar su eficacia y seguridad en humanos. La VC se asocia con múltiples afecciones, incluida la enfermedad renal crónica, las enfermedades cerebrovasculares y la aterosclerosis coronaria. Este estudio estableció con éxito un modelo de VC que se puede utilizar más para explorar tratamientos para afecciones relacionadas con los vasos sanguíneos. El diseño experimental y las técnicas utilizadas aquí también proporcionan una base valiosa para el descubrimiento de fármacos relacionados con la VC.
En resumen, este estudio utilizó la farmacología de redes y la biología molecular para investigar el efecto del salidrósido sobre la calcificación vascular. Los resultados muestran que SAL inhibe la VC al reducir la inflamación, disminuir la expresión del factor lipídico y disminuir los marcadores de VC a través de la vía JAK2/STAT3, lo que sugiere un enfoque terapéutico prometedor para el tratamiento de la VC.
Divulgaciones
Asegurarse de que todos los autores hayan revelado todos y cada uno de los conflictos de intereses.
Agradecimientos
Este trabajo contó con el apoyo financiero del Proyecto del Departamento Provincial de Ciencia y Tecnología de Jilin (YDZJ202301ZYTS460) y el Proyecto del Departamento Provincial de Educación de Jilin (JJKH20230991KJ).
Materiales
| Name | Company | Catalog Number | Comments |
| 30% (29:1) Acrylamide/Bis Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | A1010 | |
| 4% Paraformaldehyde Fix Solution | Beyotime Biotech Inc (Beyotime) , China | P0099 | |
| 5*loading buffer | Beijing Solarbio Science & Technology Co., Ltd ,China | P1040 | |
| Alkaline Phosphatase Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0321S | |
| AlphaView Software | Proteinsimple Inc.USA | AlphaView SA | |
| BCA Protein Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0012 | |
| Bluing Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | G1866 | |
| Calcium Colorimetric Assay Kit | Beyotime Biotech Inc (Beyotime) , China | S1063S | |
| Collagen Fiber And Elastic Fiber Staining Kit(EVG-Verh eff Method) | Beijing Solarbio Science & Technology Co., Ltd ,China | G1597 | |
| Dewatering machine | Diapath Biosciences Ltd, Italy | Donatello | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd,China | JB-P5 | |
| Enzyme-labeled instrument | Biotek Co., Ltd,USA | Epoch | |
| Ethanol absolute | GHTECH Co., Ltd, China | 64-17-5 | |
| Goat Anti-Mouse IgG (H+L) HRP | Bioworld technology, co, Ltd.,China | BS20242-Y | |
| GraphPad Prism Software | GraphPad Software.,USA | GraphPad Prism 9.0 | |
| Hematoxylin-Eosin Stain Kit | Beijing Solarbio Science & Technology Co., Ltd ,China | G1120 | |
| High-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A112 | |
| HRP-labeled Goat Anti-Rabbit IgG(H+L) | Guangzhou saiguo biotech Co.,LTD | A0208 | |
| Image J Software | National Institutes of Health(NIH),USA | Image J | |
| IκB Alpha Polyclonal antibody | Proteintech Group, Inc.A,USA | 10268-1-AP | |
| JAK2 Antibody | Affinity Biosciences Co., Ltd,China | AF6022 | |
| Low-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A113 | |
| NF-κB p65 Antibody | Proteintech Group, Inc.A,USA | 10745-1-AP | |
| Pathological microtome | Leica Biosystems,USA | RM2016 | |
| Phosphatase Inhibitor Cocktail Tables | F. Hoffmann-La Roche, Ltd,Switzerland | 04906845001 | |
| Phospho-JAK2 (Tyr931) Antibody | Affinity Biosciences Co., Ltd,China | AF3024 | |
| Phospho-NF-κB p65(Ser276) Antibody | Affinity Biosciences Co., Ltd,China | AF2006 | |
| Phospho-STAT3(S727) Antibody | Abways Science & Technology Co., Ltd ,China | CY5291 | |
| Protease Inhibitor Cocktail | F. Hoffmann-La Roche, Ltd,Switzerland | 11873580001 | |
| PVDF membrane | F. Hoffmann-La Roche, Ltd,Switzerland | 3010040001 | |
| Rat IL-1β ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI303 | |
| Rat IL-6 ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI328 | |
| Rat TNF-α ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PT516 | |
| RIPA Lysis Buffer | Beyotime Biotech Inc (Beyotime) , China | P0013B | |
| Salisoroside | Shanghai yuanye Bio-Technology Co., Ltd,China | S25475 | |
| SDS | Guangzhou saiguo biotech Co.,LTD,China | 3250KG001 | |
| Sodium carbonate | China National Pharmaceutical Group Co., Ltd. , China | 1001921933 | |
| Sodium hydrogen carbonate | China National Pharmaceutical Group Co., Ltd. , China | 10018960 | |
| Sodium thiosulfate | China National Pharmaceutical Group Co., Ltd. , China | 20042518 | |
| STAT3 Antibody | Proteintech Group, Inc.A,USA | 10253-2-AP | |
| TBST (10×) | Beyotime Biotech Inc (Beyotime) , China | ST673 | |
| Total cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A111 | |
| Triglyceride assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A110 | |
| Tris Base | Guangzhou saiguo biotech Co.,LTD | 1115GR500 | |
| Upright optical microscope | Nikon Corporation,Japan | Eclipse E100 | |
| Von Kossa Solution | Wuhan servicebio technology CO.,LTD,China | G1043 | |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology, Inc. ,USA | SC-2048 | |
| β-Actin antibody | Cell Signaling Technology, Inc.,USA | E4967 |
Referencias
- Sutton, N. R., et al. Molecular mechanisms of vascular health: Insights from vascular aging and calcification. Arterioscler Thromb Vasc Biol. 43 (1), 15-29 (2023).
- Henein, M. Y., Owen, A. Statins moderate coronary stenoses but not coronary calcification: Results from meta-analyses. Int J Cardiol. 153 (1), 31-35 (2011).
- Ajufo, E., et al. Value of coronary artery calcium scanning in association with the net benefit of aspirin in primary prevention of atherosclerotic cardiovascular disease. JAMA Cardiol. 6 (2), 179-187 (2021).
- Vossen, L. M., Kroon, A. A., Schurgers, L. J., De Leeuw, P. W. Pharmacological and nutritional modulation of vascular calcification. Nutrients. 12 (1), 100 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC Cardiovasc Interv. 14 (12), 1275-1292 (2021).
- Demer, L. L., Watson, K. E., Boström, K. Mechanism of calcification in atherosclerosis. Trends Cardiovasc Med. 4 (1), 45-49 (1994).
- Chen, F., et al. Network pharmacology analysis combined with experimental validation to explore the therapeutic mechanism of salidroside on intestine ischemia-reperfusion. Biosci Rep. 43 (8), BSR20230539 (2023).
- Rong, L., et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer ags cells through the pi3k/akt/MTOR pathway. Biomed Pharmacother. 122, 109726 (2020).
- Zhang, P., et al. Network pharmacology: Towards the artificial intelligence-based precision traditional Chinese medicine. Brief Bioinform. 25 (1), bbad518 (2023).
- Jiao, X., et al. A comprehensive application: Molecular docking and network pharmacology for the prediction of bioactive constituents and elucidation of mechanisms of action in component-based Chinese medicine. Comput Biol Chem. 90, 107402 (2021).
- Li, S., Zhang, B. Traditional Chinese medicine network pharmacology: Theory, methodology and application. Chin J Nat Med. 11 (2), 110-120 (2013).
- Wang, X., Hu, Y., Zhou, X., Li, S. Editorial: Network pharmacology and traditional medicine: Setting the new standards by combining in silico and experimental work. Front Pharmacol. 13, 1002537 (2022).
- Huang, Z., Yang, Y., Fan, X., Ma, W. Network pharmacology-based investigation and experimental validation of the mechanism of scutellarin in the treatment of acute myeloid leukemia. Front Pharmacol. 13, 952677 (2022).
- Zhang, R., Zhu, X., Bai, H., Ning, K. Network pharmacology databases for traditional Chinese medicine: Review and assessment. Front Pharmacol. 10, 123 (2019).
- Wang, C., Liu, X., Guo, S. Network pharmacology-based strategy to investigate the effect and mechanism of alpha-solanine against glioma. BMC Complement Med Ther. 23 (1), 371 (2023).
- Li, X., et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huang Lian jiedu decoction against sepsis. Comput Biol Med. 144, 105389 (2022).
- Holmes, R. S., et al. Recommended nomenclature for five mammalian carboxylesterase gene families: Human, mouse, and rat genes and proteins. Mamm Genome. 21 (9-10), 427-441 (2010).
- Geng, J., Zhou, G., Guo, S., Ma, C., Ma, J. Underlying mechanism of traditional herbal formula Chuang-ling-ye in the treatment of diabetic foot ulcer through network pharmacology and molecular docking. Curr Pharm Des. 30 (6), 448-467 (2024).
- Chen, X., et al. Puerarin inhibits emt induced by oxaliplatin via targeting carbonic anhydrase xii. Front Pharmacol. 13, 969422 (2022).
- Herrmann, J., Babic, M., Tolle, M., Van Der Giet, M., Schuchardt, M. Research models for studying vascular calcification. Int J Mol Sci. 21 (6), 2204 (2020).
- Zhou, H., X, W., Yuan, Y., Qi, X. Comparison of methods for establishing a rat model of atherosclerosis using three doses of vitamin D3 and atherogenic diet. Chin J Arterioscler. 20 (11), 995-998 (2012).
- Zhang, Y., et al. Il-18 mediates vascular calcification induced by high-fat diet in rats with chronic renal failure. Front Cardiovasc Med. 8, 724233 (2021).
- Kazlouskaya, V., et al. The utility of elastic verhoeff-van gieson staining in dermatopathology. J Cutan Pathol. 40 (2), 211-225 (2013).
- Tang, X., et al. Underlying mechanism and active ingredients of tianma gouteng acting on cerebral infarction as determined via network pharmacology analysis combined with experimental validation. Front Pharmacol. 12, 760503 (2021).
- Lee, S. J., Lee, I. K., Jeon, J. H. Vascular calcification-new insights into its mechanism. Int J Mol Sci. 21 (8), 2685 (2020).
- Magdic, J., et al. Intracranial vertebrobasilar calcification in patients with ischemic stroke is a predictor of recurrent stroke, vascular disease, and death: A case-control study. Int J Environ Res Public Health. 17 (6), 2013 (2013).
- Zhou, L., et al. Salidroside-pretreated mesenchymal stem cells contribute to neuroprotection in cerebral ischemic injury in vitro and in vivo. J Mol Histol. 52 (6), 1145-1154 (2021).
- Hutcheson, J. D., Goettsch, C. Cardiovascular calcification heterogeneity in chronic kidney disease. Circ Res. 132 (8), 993-1012 (2023).
- Zhang, X., et al. Salidroside: A review of its recent advances in synthetic pathways and pharmacological properties. Chem Biol Interact. 339, 109268 (2021).
- Zhang, P., Li, Y., Guo, R., Zang, W. Salidroside protects against advanced glycation end products-induced vascular endothelial dysfunction. Med Sci Monit. 24, 2420-2428 (2018).
- Li, Y., et al. Salidroside promotes angiogenesis after cerebral ischemia in mice through shh signaling pathway. Biomed Pharmacother. 174, 116625 (2024).
- Gao, X. F., Shi, H. M., Sun, T., Ao, H. Effects of radix et rhizoma Rhodiolae kirilowii on expressions of von Willebrand factor, hypoxia-inducible factor 1 and vascular endothelial growth factor in myocardium of rats with acute myocardial infarction. Zhong Xi Yi Jie He Xue Bao. 7 (5), 434-440 (2009).
- Li, X., Liu, C., Li, Y., Xiong, W., Zuo, D. Inflammation promotes erythropoietin induced vascular calcification by activating p38 pathway. Bioengineered. 13 (3), 5277-5291 (2022).
- Bessueille, L., Magne, D. Inflammation: A culprit for vascular calcification in atherosclerosis and diabetes. Cell Mol Life Sci. 72 (13), 2475-2489 (2015).
- Li, R., et al. Salidroside prevents tumor necrosis factor-alpha-induced vascular inflammation by blocking mitogen-activated protein kinase and nf-kappa B signaling activation. Exp Ther Med. 18 (5), 4137-4143 (2019).
- Xing, S. S., et al. Salidroside attenuates endothelial cellular senescence via decreasing the expression of inflammatory cytokines and increasing the expression of sirt3. Mech Ageing Dev. 175, 1-6 (2018).
- Hopkins, A. L. Network pharmacology. Nat Biotechnol. 25 (10), 1110-1111 (2007).
- Xin, P., et al. The role of jak/stat signaling pathway and its inhibitors in diseases. Int Immunopharmacol. 80, 106210 (2020).
- Fu, X., et al. Glycosides from buyang huanwu decoction inhibit atherosclerotic inflammation via jak/stat signaling pathway. Phytomedicine. 105, 154385 (2022).
- Macri, F., et al. High phosphate-induced jak-stat signalling sustains vascular smooth muscle cell inflammation and limits calcification. Biomolecules. 14 (1), 107328 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados