Method Article
Evaluierung von Salidrosid als Therapeutikum gegen Gefäßverkalkung unter Verwendung von Netzwerkpharmakologie und experimentellen Rattenmodellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie wird ein Rattenmodell für die Gefäßverkalkung etabliert, die durch eine fettreiche Diät (HFD) in Kombination mit Vitamin D3 (VD3) induziert wird. Das Modell wurde verwendet, um die therapeutische Wirksamkeit von Salidrosid bei der Vorbeugung und Behandlung von Gefäßverkalkungen zu bewerten und Einblicke in seine potenziellen Wirkmechanismen durch Netzwerkpharmakologie und in vivo-Experimente zu geben.
Zusammenfassung
Die Gefäßverkalkung (VC) ist ein kritischer pathologischer Zustand, der mit einer signifikanten Morbidität und Mortalität einhergeht. Diese Studie verwendet einen hybriden Ansatz aus Netzwerkpharmakologie und Molekularbiologie, um die therapeutischen Mechanismen von Salidrosid (SAL), einem Wirkstoff aus Rhodiola crenulata, gegen VC abzugrenzen. Durch Datenbank-Mining und Netzwerkanalyse wurden 388 SAL-Ziele identifiziert, die sich mit 2871 VC-assoziierten Zielen überschneiden, was zu 208 gemeinsamen Zielen führt. Ein Protein-Protein-Interaktionsnetzwerk (PPI), das über die String-Datenbank und die topologische Analyse in Cytoscape 3.9.1 erstellt wurde, identifizierte 10 Schlüsselziele, darunter IL6, TNF, TP53, IL1B, HIF1A, CASP3 und STAT3. Die identifizierten Gene waren in den Lipid- und Atherosklerose-Signalwegen konzentriert, was darauf hindeutet, dass die Verbesserung der VC durch SAL durch die Regulation einer abnormalen Expression von Lipid- und Entzündungsfaktoren erfolgen kann. Es wurde auch festgestellt, dass SAL die abnormale Expression von Entzündungsfaktoren hemmt und dadurch den JAK2/STAT3-Signalweg aktiviert, um in das Fortschreiten der VC einzugreifen. Der JAK2/STAT3-Signalweg ist ein wichtiger molekularer Mechanismus, durch den SAL eine weitere Verschlechterung der VC verhindert. Funktionelle Anreicherungsanalysen zeigten, dass diese Ziele an Entzündungsreaktionen und Fettstoffwechsel beteiligt sind, den zentralen Signalwegen bei VC. In-vivo-Studien an Ratten zeigten die Wirksamkeit von SAL bei der Linderung von Dyslipidämie und vaskulären Entzündungen mit verbesserten Serumlipidprofilen und reduzierter vaskulärer Kalziumablagerung. Die mechanistische Untersuchung, die auf der Western-Blot-Analyse basiert, demonstrierte die Fähigkeit von Salidrosid, den JAK2/STAT3-Signalweg zu regulieren, was sein Potenzial als Modulator in diesem kritischen molekularen Mechanismus unterstreicht und ein potenzielles therapeutisches Ziel für VC bietet. Die Stärke dieser Forschung liegt in ihrer methodischen Strenge, die rechnerische Vorhersagen mit In-vivo-Validierungen integriert. Dieser umfassende Ansatz schafft einen robusten Rahmen für die Erforschung der therapeutischen Mechanismen von Naturstoffen bei der Bekämpfung von VC.
Einleitung
Gefäßverkalkung (VC) bezieht sich auf die abnormale Ablagerung von Kalzium in den Gefäßwänden, die zu einer arteriellen Versteifung und verminderter Elastizität führt, was letztendlich die Gefäßfunktion beeinträchtigt. Traditionell wird VC in zwei Arten unterteilt: Intimaverkalkung, die mit Lipidaufbau verbunden ist, und mediale Verkalkung. Ersteres ist eng mit der entzündlichen Infiltration verbunden und löst eine osteogene Transformation in der Gefäßwand aus, die durch die Migration, Proliferation und Differenzierung von vaskulären glatten Muskelzellen (VSMCs) in osteoblastenähnliche Zellen gekennzeichnetist 1.
Die Fähigkeit von VSMCs, eine osteogene Differenzierung zu durchlaufen, die von Faktoren wie Alterung, Genetik und Umweltbedingungen wie Diabetes und chronischen Nierenerkrankungen beeinflusst wird, trägt wesentlich zur altersbedingten VC bei. Diese osteoblastenähnliche Umwandlung verschlimmert die arterielle Verkalkung und Degeneration1.
VC ist eine vielschichtige Erkrankung, die durch degenerative Veränderungen, metabolische Ungleichgewichte und verschiedene systemische Erkrankungen verursacht wird. Etwa 80 % der Gefäßverletzungen und 90 % der Fälle von koronarer Herzkrankheit weisen VC auf, was das Risiko schwerer kardiovaskulärer Ereignisse signifikant erhöht 1,2. Daher besteht ein dringender Bedarf, pharmakologische Behandlungen zu finden, die diesen Zustand wirksam mildern oder umkehren.
Derzeit beinhalten die Behandlungsstrategien für VC verschiedene pharmakologische Interventionen, obwohl keine Medikamente speziell für diesen Zweck entwickelt wurden. Bei Patienten mit leichter Verkalkung werden häufig Statine verschrieben, um Plaques zu stabilisieren. Obwohl sie die Koronararterienstenose durch Senkung des Lipidspiegels reduzieren können, ist ihre Wirkung auf die Verkalkung begrenzt2.
Angesichts der Komplexität der Atherosklerose weisen viele Patienten eine erhöhte Thrombozytenaktivierung auf, was die Einnahme von Thrombozytenaggregationshemmern wie Aspirin oder Clopidogrel erforderlich macht, um die Thrombozytenaggregation zu hemmen und das Thromboserisiko zu verringern. Die Aspirin-Therapie ist jedoch nur für Personen mit einem hohen Kalziumwert der Koronararterien und einem geringen Blutungsrisiko von Vorteil3.
Darüber hinaus deutet die Forschung an Nahrungsergänzungsmitteln wie Vitamin K auf ein Potenzial bei der Verhinderung des Fortschreitens von VChin 4. In schweren Fällen können invasive Eingriffe in Betracht gezogen werden, obwohl sie bei einer weit verbreiteten VC5 oft ungeeignet sind. Für Personen ohne vorhandene VC bleibt der Umgang mit Risikofaktoren wie Blutdruck, Lipidprofilen und Lebensstilentscheidungen von entscheidender Bedeutung6.
Rhodiola crenulata, ein mehrjähriges Kraut aus der Familie der Crassulaceae, wird traditionell in der chinesischen Medizin verwendet. Sein bioaktiver Hauptbestandteil, Salidrosid, verdient aufgrund seiner bemerkenswerten biologischen Aktivitäten große Aufmerksamkeit. Salidrosid ist bekannt für seine Fähigkeit, die Apoptose zu hemmen, robuste antioxidative Eigenschaften zu aufweisen und entzündungshemmende Eigenschaften zu besitzen 7,8. Diese Eigenschaften tragen zu seinem Potenzial bei, die Gefäßfunktion zu verbessern, die Gefäßalterung zu verzögern und das Gefäßendothel zu schützen. Als potenzielles Therapeutikum für VC ist Salidrosid von erheblichem Wert für die Forschung. Die genauen Mechanismen, durch die Salidrosid VC verbessert, müssen jedoch noch vollständig geklärt werden und rechtfertigen weitere Untersuchungen, um sein therapeutisches Potenzial bei der Behandlung von VC zu nutzen.
Um diese Mechanismen zu erforschen, nutzt diese Studie die Netzwerkpharmakologie, eine innovative Methodik, die Pharmakologie, Bioinformatik und Informatik kombiniert, um biologische Systeme zu analysieren und Arzneimittelmechanismen aufzuklären. Im Vergleich zur traditionellen Einzelziel-Wirkstoffforschung bietet die Netzwerkpharmakologie einen umfassenderen Ansatz, indem sie die Auswirkungen eines Medikaments auf mehrere biologische Ziele und Signalwege analysiert. Als Schlüsselwerkzeug in der modernen Arzneimittelentwicklung konstruiert es Netzwerke von Medikamenten, Zielen und Signalwegen, um die zugrunde liegenden Mechanismen der Wirkstoffwirkung aufzudecken 9,10. Trotz seiner umfangreichen Verwendung bei der Erforschung therapeutischer Mechanismen wurden die interaktiven Mechanismen zwischen Salidrosid und VC aus der Perspektive der Bioinformatik und Netzwerkpharmakologie nur begrenzt erforscht.
Diese Forschung erstellt eine molekulare Netzwerkkarte der potenziellen Auswirkungen von Salidrosid auf VC, indem sie Schlüsselziele durch umfangreiches Datenbank-Mining identifiziert und analysiert. Es wird ein Protein-Protein-Interaktionsnetzwerk (PPI) generiert, und die topologische Analyse wird angewendet, um kritische Knoten im Kalzifizierungsprozess hervorzuheben.
Um die rechnerischen Vorhersagen zu bestätigen, wird ein Rattenmodell für VC entwickelt, indem eine fettreiche Diät mit Vitamin D3 (VD3) verabreicht wird. Dieses Modell repliziert die pathologischen Merkmale der menschlichen VC. Gefäßschäden werden durch histologische Techniken beurteilt, Serumlipidprofile und Entzündungsmarker werden ausgewertet, um die systemischen Wirkungen von Salidrosid zu untersuchen, und die Expression von SAL-Anti-VC-verwandten Proteinen wird mittels Western Blotting gemessen. Um die Auswirkungen von Salidrosid auf experimentell induzierte VC zu untersuchen, zielt diese Studie darauf ab, wertvolle Einblicke in das Potenzial dieser Verbindung als therapeutische Strategie zur Bekämpfung von VC zu liefern.
Protokoll
Das Protokoll wurde vom Experimental Animals Committee der Changchun University of Chinese Medicine genehmigt (Zulassung Nr. 2023091). Diese Studie hält sich an internationale Richtlinien, einschließlich der Leitlinien der Europäischen Gemeinschaft und der EWG-Richtlinie von 1986, die eine ethische Behandlung von Tieren während der gesamten Studie gewährleisten. Für die Studie wurden männliche Wistar-Ratten (8-10 Wochen, Gewicht 200-220 g) verwendet. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Netzwerkpharmakologische Vorhersage potenzieller Salidrosid-VC-Ziele
HINWEIS: Die Netzwerkpharmakologie nutzt computergestützte Methoden und groß angelegte Datenanalysen, um die komplexen Wechselwirkungen zwischen Arzneimittelmolekülen und biologischen Zielen wie Signalwegen, Genen und Proteinen innerhalb eines Organismus zu untersuchen11,12. Dieser Ansatz hilft, die biologischen Funktionen und Beziehungen der untersuchten Entitäten zu entschlüsseln. Die Methodik umfasst die Nutzung von Datenbanken, die Verarbeitung chemischer Informationen, die Erfassung von Bioaktivitätsdaten, das Abrufen von Proteindaten, die Analyse von Genexpressionsprofilen, den Aufbau von Interaktionsnetzwerken und die Anreicherungsanalyse von Signalwegen11. Abbildung 1 zeigt das Interaktionsnetzwerk der Kernziele zwischen Salidrosid und Gefäßverkalkung.
- Aufbau der Zieldatenbank "Ingredient"
- Verwenden Sie "Salidrosid" als Schlüsselwort für Inhaltsstoffe, um Datenbanken13 zu durchsuchen (siehe Ergänzende Tabelle 1), wie z. B. HERB, TCMSP, PubChem, SwissTargetPrediction, CTD, PharmMapper, SEA und STITCH.
- Überprüfen Sie die einschlägige Literatur, um Ziele zu identifizieren, die mit Salidrosid assoziiert sind, wobei die Spezies auf Homo sapiens festgelegt ist. Nach dem Entfernen von Duplikaten standardisieren Sie die Zielproteine mit UniProt (siehe Ergänzende Tabelle 1) und etablieren eine umfassende Salidrosid-Zieldatenbank14.
- Aufbau der Zieldatenbank "Krankheit"
- Verwenden Sie "Gefäßverkalkung" als Schlüsselwort, um Datenbanken15 zu durchsuchen (siehe ergänzende Tabelle 1), einschließlich GeneCards, OMIM, PharmGkb und DrugBank, wobei die Spezies auf Homo sapiens festgelegt ist. Erstellen Sie nach der Deduplizierung eine Zieldatenbank für die Gefäßverkalkung.
- Vorhersage potenzieller therapeutischer Ziele
- Geben Sie die Ziele für Salidrosid und Gefäßverkalkung ein (siehe Ergänzende Tabelle 1), um gemeinsame Ziele zu identifizieren. Erstellen Sie ein Venn-Diagramm, um die potenziellen therapeutischen Ziele für Salidrosid bei der Behandlung von Gefäßverkalkung zu visualisieren.
- Aufbau des Protein-Protein-Interaktions-Netzwerks (PPI) "Salidrosid-Vascular Calcification"
- Stellen Sie die potenziellen Ziele in einer Liste mehrerer Proteine zusammen und analysieren Sie sie mit STRING (siehe Ergänzende Tabelle 1), wobei der Organismus auf Homo sapiens und der Interaktionswert auf mittlere Konfidenz (>0,4)16 eingestellt ist. Extrahieren Sie die PPI-Daten im TSV-Format für die weitere Analyse.
ANMERKUNG: Angesichts der Tatsache, dass 85 % der Gene der Ratte homolog zu menschlichen Genen sind und ähnliche biologische Funktionen erfüllen, wurden Ratten als Versuchspersonen ausgewählt, um die Auswirkungen von Salidrosid auf die Gefäßverkalkung zu validieren17.
- Stellen Sie die potenziellen Ziele in einer Liste mehrerer Proteine zusammen und analysieren Sie sie mit STRING (siehe Ergänzende Tabelle 1), wobei der Organismus auf Homo sapiens und der Interaktionswert auf mittlere Konfidenz (>0,4)16 eingestellt ist. Extrahieren Sie die PPI-Daten im TSV-Format für die weitere Analyse.
- Auswahl und Netzwerkaufbau der wichtigsten Ziele
- Importieren Sie die PPI-Netzwerkdaten in Cytoscape 3.9.1 (siehe Ergänzende Tabelle 1) zur Analyse mit dem CytoNCA-Plugin, um Parameter wie Betweenness (BC), Closeness (CC), Degree (DC), Eigenvector (EC), Local Average Connectivity (LAC) und Network Centrality (NC) zu bewerten. Wählen Sie Schlüsselziele mit CC=1 aus, um eine Kernziel-Aktionsspektrumkarte für 'SAL-VC' zu erstellen.
- Verwenden Sie das CytoHubba-Plug-in, um die Top 10 Hub-Gene basierend auf Berechnungen der maximalen Clique Centrality (MCC), der Maximum Neighborhood Component (MNC) und des Grades zu identifizieren und eine Hub-Gene-Spektrumkarte zu erstellen.
- Analyse der Anreicherung des GO- und KEGG-Signalwegs
- Führen Sie die Gen-ID-Konversion mit DAVID durch (siehe Ergänzende Tabelle 1), und wählen Sie ENSEMBL_GENE_ID für den Gentyp 9606 für Speziesinformationen aus. Analysieren Sie die konvertierte Genliste mit Omicshare (siehe Ergänzende Tabelle 1) für die Anreicherung der GO-Funktion und des KEGG-Signalwegs, wobei die Signifikanz auf den P-Wert < 0,0518 festgelegt ist.
HINWEIS: Die GO-Funktionsanalyse umfasst die molekulare Funktion (MF), den biologischen Prozess (BP) und die zelluläre Komponente (CC). Die KEGG-Signalweganalyse umfasst die Anreicherung des Signalwegs und die Anreicherung der Signalwegklassifizierung19. Die Ergebnisse der Anreicherungsanalyse sind in Abbildung 2 dargestellt.
- Führen Sie die Gen-ID-Konversion mit DAVID durch (siehe Ergänzende Tabelle 1), und wählen Sie ENSEMBL_GENE_ID für den Gentyp 9606 für Speziesinformationen aus. Analysieren Sie die konvertierte Genliste mit Omicshare (siehe Ergänzende Tabelle 1) für die Anreicherung der GO-Funktion und des KEGG-Signalwegs, wobei die Signifikanz auf den P-Wert < 0,0518 festgelegt ist.
2. Tierversuch
- Akklimatisation
- Akklimatisieren Sie Wistar-Ratten unter spezifischen pathogenfreien Bedingungen (LSF) mit einem 12-stündigen Hell-Dunkel-Zyklus. Stellen Sie sicher, dass sie ad libitum Zugang zu Nahrung und Wasser haben, um ihre Gesundheit zu erhalten, bevor die Experimente beginnen. Führen Sie 1 Woche lang eine adaptive Fütterung durch.
- Modell-Etablissement
- Akklimatisieren Sie die Ratten an die Umgebungsbedingungen und teilen Sie sie nach dem Zufallsprinzip in fünf Gruppen ein: Kontrollgruppe (Strg, ND + Fahrzeug), Modellgruppe (Modell, HFD + Fahrzeug), SAL-Niedrigdosisgruppe (SAL-L, HFD + SAL 5 mg/kg), SAL-Hochdosisgruppe (SAL-H, HFD + SAL 10 mg/kg) und Simvastatin (SIM)-Gruppe (HFD + SIM 5 mg/kg).
- Verabreichen Sie der Strg-Gruppe während der gesamten Dauer des Experiments eine normale Diät (ND) und den übrigen Gruppen eine fettreiche Diät (HFD). Am ersten Tag der HFD-Verabreichung injizieren Sie eine subkutane Einzeldosis von 600.000 I.E./kg VD3 an alle Gruppen mit Ausnahme der Strg-Gruppe20,21. Anschließend werden in den folgenden 8 Wochen wöchentlich subkutane Injektionen von 100.000 I.E./kg VD3 verabreicht (Abbildung 3).
- Überwachen Sie täglich den Gesundheitszustand und das Überleben der Tiere. Beginnen Sie in der neunten Woche mit experimentellen Interventionen.
- Euthanasieren Sie die Tiere am Ende der Studie (gemäß den institutionell anerkannten Protokollen). Sammeln Sie Serumproben, lassen Sie sie 30 Minuten stehen und zentrifugieren Sie, um das Serum zu isolieren (gemäß den zuvor veröffentlichten Berichten20,21). Präparieren Sie das Gefäßgewebe (abdominale Aorta) und spülen Sie es mit phosphatgepufferter Kochsalzlösung (PBS) aus, um Blut zu entfernen.
- Fixieren Sie einen Teil des Gewebes in 4% Paraformaldehyd für die histologische Untersuchung und lagern Sie einen anderen Teil in flüssigem Stickstoff für die molekulare Analyse.
HINWEIS: Salidrosid vor Gebrauch mit warmem Wasser verdünnen.
3. Beurteilung der Schädigung des Gefäßgewebes mittels HE-, VK-, EVG-Färbung
HINWEIS: Gefäßgewebe (Bauchschlagader ) in 4% Paraformaldehyd fixieren, nach 48 h in Ethanol dehydriert und in Paraffin eingebettet. Schneiden Sie die eingebetteten Paraffinblöcke in 5 μm große Scheiben für die Färbung mit Hämatoxylin-Eosin (HE), Elastica van Gieson (EVG) und Von Kossa (VK) und beobachten Sie die histologische Morphologie unter einem Lichtmikroskop. Die HE-Färbung wird verwendet, um Veränderungen in der Gewebemorphologie zu beurteilen. Im Gefäßgewebe weist es auf strukturelle Veränderungen in der Gefäßwand hin, einschließlich der Proliferation von glatten Muskelzellen, einer unorganisierten Zellanordnung und Entzündungen. Die EVG-Färbung visualisiert elastische und kollagene Fasern, was für die Beurteilung von elastischen Faserschäden oder den Umbau im Gefäßgewebe unerlässlich ist und zum Verständnis der Auswirkungen der Verkalkung auf die Gefäßelastizität beiträgt. Die VK-Färbung detektiert Kalkablagerungen, ein Schlüsselmerkmal der VC, und ist daher entscheidend für die Beurteilung des Ausmaßes und der Verteilung der Verkalkung im Gefäßgewebe22,23.
- HE-Färbung zur Erkennung von Schädigungen des Gefäßgewebes
- Entparaffinisierung und Rehydrierung
- Entparaffinisieren Sie Abschnitte in zwei Xylolwechseln für jeweils 8 min und rehydrieren Sie durch eine abgestufte Ethanolreihe (100 %, 95 %, 85 %, 75 %) für 3 min pro Schritt. Anschließend 2 Minuten unter fließendem Leitungswasser spülen.
- Hämatoxylin-Färbung
- Färben Sie die Abschnitte 5-10 Minuten lang mit Hämatoxylin und waschen Sie sie, um überschüssige Flecken zu entfernen, gefolgt von einer Spülung mit fließendem Leitungswasser.
HINWEIS: Eine helle Färbung von 5 Minuten wird empfohlen, um eine zu dunkle Färbung zu vermeiden, die die zytoplasmatische Farbe beeinträchtigen kann.
- Färben Sie die Abschnitte 5-10 Minuten lang mit Hämatoxylin und waschen Sie sie, um überschüssige Flecken zu entfernen, gefolgt von einer Spülung mit fließendem Leitungswasser.
- Differenzierung
- Differenzieren Sie die Schnitte in einer Differenzierlösung für 30 s, gefolgt von zwei Spülungen in Leitungswasser für jeweils 3 min.
- Eosin-Gegenfärbung
- Legen Sie die Abschnitte 1 Minute lang in Eosin-Fleck. Nachdem Sie den überschüssigen Fleck entfernt haben, führen Sie eine schnelle Dehydrierung durch.
- Dehydratisierung, Klärung und Montage
- Für eine schnelle Dehydrierung tauchen Sie die Abschnitte jeweils 3 s lang in 75 %, 85 %, 95 % und 100 % Ethanol, gefolgt von 100 % Ethanol für 1 min.
HINWEIS: Eine schnelle Dehydrierung wird empfohlen, da Eosin in Wasser- und Ethanolgradienten an Farbe verlieren kann.
- Für eine schnelle Dehydrierung tauchen Sie die Abschnitte jeweils 3 s lang in 75 %, 85 %, 95 % und 100 % Ethanol, gefolgt von 100 % Ethanol für 1 min.
- Entparaffinisierung und Rehydrierung
- VK-Färbung für den Calciumnachweis
- Entparaffinisierung und Rehydrierung
- Führen Sie diesen Schritt nach Schritt 3.1.1 aus.
- Reaktion von Silbernitrat
- Die Partien trocken tupfen, mit einem feinen Pinsel umreißen und mit Von Kossa beizen (siehe Materialtabelle). Setzen Sie sie 4 Stunden lang ultraviolettem Licht aus und spülen Sie sie dann gründlich mit fließendem Leitungswasser ab.
- Gegenfärbung mit Hämatoxylin
- Die Abschnitte 5 min lang mit Hämatoxylin einfärben, unter fließendem Leitungswasser abspülen, differenzieren und erneut spülen, gefolgt von einer Spülung unter fließendem Leitungswasser.
- Eosin-Gegenfärbung
- Die Schnitte durch abgestuftes Ethanol dehydrieren (85 % und 95 % für jeweils 5 Minuten) und dann 5 Minuten lang mit Eosin färben.
- Entwässerung und Montage
- Die Abschnitte in Ethanolbädern (100% Ethanol I, II, III für je 5 min) entwässern und in Xylolbädern (Xylol I und II für je 5 min) klären. Montieren Sie dann die Abschnitte mit neutralem Balsam.
- Mikroskopische Untersuchung und Bilderfassung
- Untersuchen Sie die gefärbten Schnitte unter einem Lichtmikroskop und nehmen Sie Bilder für die Analyse auf.
HINWEIS: Stellen Sie sicher, dass Kalziumablagerungen braun-schwarz bis dunkelschwarz erscheinen, die Zellkerne blau sind und der Hintergrund rot ist. Bereiten Sie die Silbernitratlösung unmittelbar vor der Verwendung für die frische VK-Färbung vor.
- Untersuchen Sie die gefärbten Schnitte unter einem Lichtmikroskop und nehmen Sie Bilder für die Analyse auf.
- Entparaffinisierung und Rehydrierung
- EVG-Färbung für elastische und kollagene Fasern
- Entparaffinisierung und Rehydrierung
- Behandeln Sie die Paraffinabschnitte 50 Minuten lang mit Hitze und tauchen Sie sie dann 20 Minuten lang in Xylol, um Paraffin zu entfernen. Fahren Sie fort, indem Sie die Abschnitte jeweils 5 Minuten lang einer abgestuften Ethanolserie (100 %, 95 %, 85 %, 75 %) aussetzen und abschließend 5 Minuten lang in fließendem Leitungswasser spülen.
- EVG-Färbung
- Tragen Sie die EVG-Färbelösung (siehe Materialtabelle) 10 Minuten lang auf und spülen Sie sie dann 5 s lang kurz unter fließendem Leitungswasser aus, um überschüssige Flecken zu entfernen.
- Tragen Sie anschließend die Verhoeff-Arbeitslösung (siehe Materialtabelle) für 5 Minuten auf, gefolgt von einem weiteren kurzen Spülen in fließendem Leitungswasser für 5 s. Tragen Sie die Differenzierungslösung von Verhoeff 5 s lang auf, bis die Elastinfasern deutlich sichtbar sind, und spülen Sie dann 5 s lang mit fließendem Leitungswasser ab.
HINWEIS: Mischen Sie die Komponenten A, B und C (im Lieferumfang des im Handel erhältlichen Kits enthalten) in einem Verhältnis von 5:2:2, um die Verhoeff-Arbeitslösung vor der Verwendung vorzubereiten. Verwenden Sie die Lösung innerhalb von 2 h und füllen Sie sie bei Bedarf während des Färbeprozesses auf, um ein Austrocknen der Schnitte zu verhindern.
- Entwässerung und Montage
- Die Abschnitte werden durch eine abgestufte Ethanolreihe (75 %, 85 %, 95 % und 100 %) für jeweils 5 s dehydriert, gefolgt von einer Klärung in zwei Xylolwechseln für jeweils 1 min. Nach einer kurzen Lufttrocknungsphase die Abschnitte mit neutralem Balsam montieren.
- Mikroskopische Untersuchung und Bildanalyse
- Untersuchen Sie die gefärbten Schnitte unter einem Lichtmikroskop, um elastische und kollagene Fasern sichtbar zu machen, und nehmen Sie Bilder für die anschließende Analyse auf.
- Entparaffinisierung und Rehydrierung
4. Alkalische Phosphatase (ALP)-Assay
HINWEIS: Verwenden Sie ALP als Schlüsselindikator, um die Wirksamkeit von Anti-Verkalkungsbehandlungen zu bewerten.
- Vorbereitung der Reagenzien
- Das farbentwickelnde Substrat wird in eiskaltem 0,05 M pH 9,6 Karbonatpuffer auf ein Endvolumen von 2,5 mL aufgelöst.
HINWEIS: Bereiten Sie den Puffer vor, indem Sie 1,59 g Natriumcarbonat und 2,93 g Natriumbicarbonat in 1.000 ml doppelt destilliertem Wasser auflösen.
- Das farbentwickelnde Substrat wird in eiskaltem 0,05 M pH 9,6 Karbonatpuffer auf ein Endvolumen von 2,5 mL aufgelöst.
- Verdünnung des Substrats
- Verdünnen Sie 10 μl p-Nitrophenollösung (10 mM) mit 0,05 M pH 9,6 Karbonatpuffer auf ein Endvolumen von 0,2 mL, um eine Endkonzentration von 0,5 mM zu erreichen.
- Probenvorbereitung
- Homogenisieren Sie die abdominale Aorta in Lysepuffer. Zentrifugieren Sie das Homogenat (~12.000 x g für 10 min bei 4 °C) und sammeln Sie den Überstand für den Nachweis der ALP-Aktivität.
HINWEIS: Stellen Sie sicher, dass der Lysepuffer frei von Phosphatase-Inhibitoren ist. Lagern Sie ausstehende Prüfmuster bei -80 °C, um wiederholte Gefrier-Tau-Zyklen zu vermeiden.
- Homogenisieren Sie die abdominale Aorta in Lysepuffer. Zentrifugieren Sie das Homogenat (~12.000 x g für 10 min bei 4 °C) und sammeln Sie den Überstand für den Nachweis der ALP-Aktivität.
- Mikrotiterplattenvorbereitung für den Assay
- Bereiten Sie eine 96-Well-Platte mit Leer-, Standard- und Proben-Wells vor. Geben Sie 50 μl der Standardlösung in Standard-Wells und 50 μl ausstehende Testproben in die Proben-Wells. Die Platte bei 37 °C 10 min inkubieren.
- Reaktionsbeendigung und Absorptionsmessung
- Geben Sie 100 μl Stopplösung in jede Vertiefung, um die Reaktion zu beenden. Messen Sie die Extinktion bei 405 nm und berechnen Sie die ALP-Aktivität auf der Grundlage von Absorptionswerten (gemäß den Anweisungen des Herstellers, siehe Materialtabelle).
HINWEIS: Vertiefungen, die den Standard enthalten, oder Proben mit ALP-Aktivität zeigen unterschiedliche Gelbtöne. Die Farbe ist bis zu 2 h stabil.
- Geben Sie 100 μl Stopplösung in jede Vertiefung, um die Reaktion zu beenden. Messen Sie die Extinktion bei 405 nm und berechnen Sie die ALP-Aktivität auf der Grundlage von Absorptionswerten (gemäß den Anweisungen des Herstellers, siehe Materialtabelle).
5. Bestimmung des Kalziumgehalts
HINWEIS: Die Bestimmung des Kalziumgehalts ist entscheidend für die Beurteilung des Ausmaßes der Mineralisierung in biologischen Geweben.
- Vorbereitung des Gewebes
- Das Gewebe in kleine Stücke zerkleinern und in Lysepuffer homogenisieren.
- Probenverdünnung und Zentrifugation
- Verdünnen Sie das Gewebe in Lysepuffer im Verhältnis 1:10. Die Mischung homogenisieren und bei 4 °C, 12.000 x g 5 min zentrifugieren. Sammeln Sie den Überstand für die Analyse.
HINWEIS: Bereiten Sie Calcium-Standardverdünnungen (0-1,0 mM) mit einer 5 mM Calcium-Standardlösung vor (siehe Materialtabelle).
- Verdünnen Sie das Gewebe in Lysepuffer im Verhältnis 1:10. Die Mischung homogenisieren und bei 4 °C, 12.000 x g 5 min zentrifugieren. Sammeln Sie den Überstand für die Analyse.
- Plattenaufbau und Inkubation
- Geben Sie 50 μl Standard- oder Testproben in jede Vertiefung einer 96-Well-Platte. Fügen Sie 150 μl der Assay-Arbeitslösung hinzu, mischen Sie gründlich und inkubieren Sie die Platte 10 Minuten lang im Dunkeln bei Raumtemperatur. Messen Sie die Extinktion bei 575 nm und erstellen Sie eine Standardkurve.
- Berechnung des Kalziumgehalts
- Berechnen Sie den Kalziumgehalt anhand der Standardkurve unter Einbeziehung des Verdünnungsfaktors, des Probenvolumens und des Atomgewichts des Kalziums.
6. Enzyme-Linked Immunosorbent Assay (ELISA) für inflammatorische Zytokine (IL-6, TNF-α, IL-1β)
HINWEIS: IL-6, IL-1β und TNF-α sind wichtige proinflammatorische Zytokine, die das Vorhandensein und die Schwere einer Entzündungsreaktion anzeigen. Die Messung dieser Zytokine ist wichtig, um den Entzündungsprozess zu verstehen und die Wirksamkeit entzündungshemmender Behandlungen zu bewerten.
- Musterkollektion
- Sammle Serum aus der Bauchschlagader der Ratte. Lassen Sie es 2 h bei Raumtemperatur gerinnen. Die Probe bei 3.000 x g für 10 min bei 4 °C zentrifugieren und den Überstand auffangen.
- Vorbereitung der Mikrotiterplatten für den Assay
- Bereiten Sie eine 96-Well-Platte mit Wells vor, die für Standards und Testproben vorgesehen sind. Geben Sie 50 μl Standards (siehe Materialtabelle) in unterschiedlichen Konzentrationen in die entsprechenden Vertiefungen.
- Probenvorbereitung
- Geben Sie 40 μl Probenverdünnungsmittel in jede Vertiefung, die für die Testproben vorgesehen ist. Geben Sie 10 μl der Probe in die gleichen Vertiefungen, was zu einer 5-fachen Verdünnung führt.
- Inkubation mit enzymmarkierten Reagenzien
- Geben Sie 100 μl enzymmarkierte Reagenzien, die spezifisch für IL-6, TNF-α oder IL-1β sind, in alle Vertiefungen mit Ausnahme des Blindwerts. Die Platte bei 37 °C 60 min inkubieren.
- Waschen
- Entsorgen Sie die Flüssigkeit aus allen Vertiefungen außer dem Rohling. Waschen Sie die Vertiefungen mit 1x Waschlösung (hergestellt als 20-fache Verdünnung in destilliertem Wasser). Wiederholen Sie diesen Waschschritt fünfmal und trocknen Sie die Vertiefungen.
- Farbentwicklung und -beendigung
- Geben Sie 50 μl der Substratlösungen A und B (aus dem im Handel erhältlichen Kit, siehe Materialtabelle) in jede Vertiefung. Vorsichtig mischen und die Platte bei 37 °C im Dunkeln 15 min inkubieren. Geben Sie 50 μl Stopplösung in jede Vertiefung, um die Reaktion zu beenden.
- Absorptionsmessung und Datenanalyse
- Setzen Sie den leeren Bereich auf Null. Messen Sie die Extinktion bei 450 nm mit einem Mikroplatten-Reader. Generieren Sie eine Standardkurve basierend auf den OD-Werten und Standardkonzentrationen. Berechnen Sie die Probenkonzentrationen durch Interpolation und passen Sie den Verdünnungsfaktor an.
7. Lipidprofil-Assay
HINWEIS: Der Lipidprofil-Assay erkennt abnormale Lipidwerte, bei denen erhöhte oder unausgeglichene Lipidspiegel das Risiko einer Gefäßverkalkung erhöhen können.
- Gesamtcholesterin und Triglyceride (TC und TG)
- Sammeln Sie Serum und bereiten Sie eine 96-Well-Platte mit ausgewiesenen Wells für Blind-, Kalibrierungs- und ausstehende Testproben vor. Geben Sie 2,5 μl Serum, Kalibrierstandard oder Blindlösung in jede Vertiefung.
- Geben Sie 250 μl der Arbeitslösung in jede Vertiefung. Vorsichtig mischen und die Platte bei 37 °C 10 min inkubieren. Messen Sie die Extinktion bei 500 nm mit einem Mikroplatten-Reader.
- Low-Density-Lipoprotein und High-Density-Lipoprotein (LDL-C und HDL-C)
- Sammeln Sie Serum und bereiten Sie eine 96-Well-Platte mit Vertiefungen vor, die für Blind-, Kalibrierungs- und ausstehende Testproben vorgesehen sind. Geben Sie 2,5 μl Serum, Kalibrierstandard oder Blindlösung in die jeweiligen Wells.
- Geben Sie das entsprechende Reagenz (Reagenz eins für 180 μl oder Reagenz zwei für 60 μl, siehe Materialtabelle) in jede Vertiefung, wie in den Anweisungen des Assay-Kits angegeben. Inkubieren Sie bei der Temperatur (37 °C) und für die für jedes Reagenz empfohlene Zeit (Reagenz eins für 5 min oder Reagenz zwei für 10 min).
- Messen Sie die Extinktion bei der spezifischen Wellenlänge (600 nm), die für LDL-C oder HDL-C angegeben ist, mit einem Mikroplatten-Reader.
8. Westliche Blotting
HINWEIS: Der Western Blot (WB) ist maßgeblich an der Beurteilung der Expressionsniveaus von Schlüsselproteinen beteiligt und ermöglicht den Nachweis sowohl der Gesamt- als auch der phosphorylierten Form.
- Vorbereitung des Gewebes
- Wiegen Sie 0,05 g Taschentuch und spülen Sie es gründlich mit PBS aus, um überschüssige Ablagerungen zu entfernen. Fügen Sie 500 μl Lysepuffer hinzu, der 1x Phosphatase und Proteaseinhibitoren enthält. Inkubieren Sie das Gewebe 10 Minuten lang bei 4 °C und homogenisieren Sie es mit einer Gewebeschleifmaschine.
- Protein-Extraktion
- Lassen Sie die homogenisierte Probe 1 Minute lang stehen, zentrifugieren Sie sie dann 15 Minuten lang bei 4 °C und 12.000 x g . Sammeln Sie den Überstand für die Proteinanalyse. Bestimmen Sie die Proteinkonzentration mit der BCA-Methode gemäß den Anweisungen des Herstellers (siehe Materialtabelle). Verwenden Sie eine Standardkurve, um die Konzentration zu berechnen.
HINWEIS: Kühlen Sie die Zentrifuge vor Gebrauch auf 4 °C vor. Messen Sie die Proteinkonzentration bei 562 nm.
- Lassen Sie die homogenisierte Probe 1 Minute lang stehen, zentrifugieren Sie sie dann 15 Minuten lang bei 4 °C und 12.000 x g . Sammeln Sie den Überstand für die Proteinanalyse. Bestimmen Sie die Proteinkonzentration mit der BCA-Methode gemäß den Anweisungen des Herstellers (siehe Materialtabelle). Verwenden Sie eine Standardkurve, um die Konzentration zu berechnen.
- Probenvorbereitung
- Mischen Sie die Proteinprobe mit 5x Ladepuffer, der β-Mercaptoethanol und SDS im Verhältnis 4:1 enthält. Die Mischung 5 min bei 100 °C erhitzen, um die Proteine zu denaturieren.
HINWEIS: Wenn 1x Ladepuffer benötigt wird, verdünnen Sie den 5x Puffer mit Lysepuffer.
- Mischen Sie die Proteinprobe mit 5x Ladepuffer, der β-Mercaptoethanol und SDS im Verhältnis 4:1 enthält. Die Mischung 5 min bei 100 °C erhitzen, um die Proteine zu denaturieren.
- SDS-PAGE Gel-Vorbereitung
- Bereiten Sie ein 12%iges SDS-PAGE-Gel vor und geben Sie es in das Elektrophoresegerät. Geben Sie 1x Elektrophoresepuffer bis zur Hälfte der Strecke gemäß den Anweisungen hinzu (siehe Ergänzende Tabelle 2).
- Elektrophorese
- Entnehmen Sie die Proteinproben aus einer Temperatur von -20 °C. Laden Sie 60 μg Protein pro Vertiefung und lassen Sie das Gel laufen.
- Stellen Sie den Strom für das Stapelgel für 20 min auf 50 mA ein und erhöhen Sie ihn dann für das Trenngel für 60 min auf 100 mA, bis die Farbstofffront den Boden erreicht.
- Membran-Transfer
- Aktivieren Sie die PVDF-Membran in Methanol für 5 min.
- Montieren Sie das Transfersandwich in der folgenden Reihenfolge: Filterpapier → SDS-PAGE-Gel → PVDF-Membran → Filterpapier. Übertragen Sie Proteine bei 300 mA für 60 min.
HINWEIS: Stellen Sie sicher, dass keine Luftblasen zwischen dem SDS-PAGE-Gel und der PVDF-Membran eingeschlossen sind.
- Blockierend
- Inkubieren Sie die PVDF-Membran in 5% BSA (hergestellt in 1x TBST) bei Raumtemperatur unter leichtem Schütteln für 60 min. Waschen Sie die Membran dreimal für je 5 min mit 1x TBST.
- Inkubation von Primärantikörpern
- Die Membran wird in 5 ml des entsprechenden Primärantikörpers (z. B. p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB p65, NF-κB p65, IκBα) in einem Blockierungspuffer bei Raumtemperatur für 2,5 h inkubiert.
- Inkubation von sekundären Antikörpern
- Waschen Sie die Membran nach der Primärantikörper-Inkubation dreimal für jeweils 5 min mit 1x TBST. Mit dem entsprechenden Sekundärantikörper 1 h bei Raumtemperatur inkubieren. Waschen Sie die Bahn nochmals dreimal für je 5 min mit 1x TBST.
- Erkennung
- Visualisierung von Proteinbanden mit ECL-Chemilumineszenzdetektion24 (siehe Materialtabelle).
- Densitometrie-Analyse
- Quantifizieren Sie Proteinbanden mit der ImageJ-Software. Befolgen Sie diesen Arbeitsablauf in ImageJ: Image → 8-Bit-→ Prozess → Hintergrund subtrahieren. Analysieren → Einstellen von Messungen → Analysieren → Festlegen des Maßstabs. Bearbeiten → Invertieren → Analysieren → Messen → Ergebnisse. Datei → Speichern unter → IntDen.
- Erstellen Sie statistische Diagramme mit Hilfe von Grafik- und statistischer Analysesoftware.
HINWEIS: Stellen Sie sicher, dass die Ergebnisse über alle Replikate hinweg konsistent sind, um die Ergebnisse zu validieren.
9. Statistische Auswertung
- Sammeln und organisieren Sie Daten mit GraphPad Prism 9.0.
- Berechnen und Darstellen von Fehlerbalken unter Verwendung von mittleren ± SD aus Rohdaten.
- Führen Sie eine statistische Analyse mit einer unidirektionalen ANOVA durch, gefolgt von dem Post-hoc-Test von Tukey für mehrere Vergleiche.
- Bestimmen Sie die statistische Signifikanz bei P < 0,05, wobei kleinere P-Werte auf größere Unterschiede in den Ergebnissen hinweisen.
Ergebnisse
Netzwerkpharmakologische Analyse
Mit Hilfe von Datenbanken wie HERB, TCMSP, Pubmed, SwissTargetPrediction, CTD, PharmMapper, SEA und STASH wurden 388 potenzielle Zielgene für Salidrosid identifiziert. Darüber hinaus wurden 2871 potenzielle Zielgene im Zusammenhang mit VC aus Datenbanken wie GeneCards, OMIM, PharmGkb und DrugBank abgerufen. Die Schnittpunktanalyse mit Hilfe von VINN-Diagrammen ergab 208 überlappende Ziele, die als Schlüsselziele für die Intervention von Salidrosid in VC gelten (Abbildung 1A).
PPI-Netzwerkanalyse
Die STRING-Plattform wurde verwendet, um die Interaktionen zwischen den 208 Schlüsselzielen zu analysieren, aus denen die 100 wichtigsten Knoten ausgewählt wurden. Diese Knoten wurden dann in Cytoscape 3.9.1 importiert, um ein detailliertes PPI-Netzwerk zu erstellen. Bei der Analyse der Netzwerktopologie anhand von Parametern wie EC, BC, NC, LAC, CC und DC wurden 37 Kernziele identifiziert. Weitere Verfeinerungen mit Schwerpunkt auf Grad, MCC und MNC identifizierten die 10 wichtigsten Kernziele, darunter IL6, TNF, TP53, IL1B, HIF1A, CASP3 und STAT3 (Abbildung 1B).
GO-Funktions- und KEGG-Signalweganalyse
Die GO-Funktionsanalyse der 208 Schlüsselziele identifizierte 4808 biologische Prozesse, 294 zelluläre Komponenten und 515 molekulare Funktionen. Die KEGG-Signalweganalyse berichtete über 281 Signalwege, die hauptsächlich den Stoffwechsel, die Verarbeitung genetischer und umweltbedingter Informationen, organismische Systeme, zelluläre Prozesse und menschliche Krankheiten betreffen. Es wurde festgestellt, dass die meisten der identifizierten Gene im Lipid- und Atheroskleroseweg angereichert waren, was darauf hindeutet, dass der Schlüsselmechanismus, durch den SAL die VC verbessert, die Regulierung abnormaler Veränderungen der Lipid- und Entzündungsfaktoren beinhalten könnte (Abbildung 2).
In-vivo-Validierung von Experimenten
Im Vergleich zur Ctrl-Gruppe zeigten die Ratten der Modellgruppe Fettleibigkeit, Lethargie und stumpfes Fell. Serumlipidprofile zeigten in der Modellgruppe einen signifikanten Anstieg der TC-, TG- und LDL-C-Spiegel und eine Abnahme des HDL-C (p < 0,05). Umgekehrt zeigten die Gruppen SAL-L, SAL-H und SIM signifikante Verbesserungen dieser Parameter, mit einem dosisabhängigen Effekt in den SAL-Gruppen (p < 0,05) (Abbildung 4).
Die HE-Färbung wurde verwendet, um strukturelle Veränderungen in der abdominalen Aorta der Ratte zu identifizieren, während die EVG-Färbung den Zustand der elastischen Fasern bewertete und die VK-Färbung zur Identifizierung von Kalziumablagerungen eingesetzt wurde. In der Kontrollgruppe grenzte die HE-Färbung die unterschiedlichen Schichten des abdominalen Aortengewebes ab, und die EVG-Färbung zeigte eine saubere Anordnung der elastischen Fasern mit minimalen Störungen. Kalkablagerungen waren gemäß der VK-Färbung nicht signifikant vorhanden. Umgekehrt zeigte die Modellgruppe Gefäßgewebe mit Intimahyperplasie und inflammatorischer Zellinfiltration sowie eine ausgedehnte strukturelle Unordnung in der Medienschicht. Die Unterscheidung zwischen elastischen Fasern und glatten Muskelzellen war unklar, und die Fasern waren unregelmäßig angeordnet, mit sichtbarer nekrotischer Verkalkung. Eine adventitiale Lymphozyteninfiltration wurde ebenfalls festgestellt. Die EVG-Färbung in dieser Gruppe zeigte ein ungeordnetes Muster elastischer Fasern mit ausgedehnten Brüchen, und die VK-Färbung bestätigte erhebliche Kalziumablagerungen.
Nach SAL-Intervention wurde eine spürbare Verbesserung der Gefäßschädigung bei VC beobachtet. Die HE-Färbung zeigte, dass die SAL-L- und SAL-H-Gruppen gut definierte Gefäßschichtstrukturen mit minimaler Degeneration der glatten Muskelzellen in den Medien aufwiesen. Nach der EVG-Färbung waren die elastischen Fasern in beiden Gruppen sauber und mit wenigen Unterbrechungen ausgerichtet, wobei die SAL-H-Gruppe die SAL-L-Gruppe übertraf. Die VK-Färbung zeigte in keiner der beiden Gruppen signifikante Kalziumablagerungen, was darauf hindeutet, dass SAL die durch VC induzierten vaskulären strukturellen Veränderungen abschwächte.
Nach der SIM-Intervention spiegelten die vaskulären strukturellen Veränderungen denen der SAL-H-Gruppe wider. Die HE-Färbung zeigte eine klare Architektur der abdominalen Aorta mit minimaler Degeneration der glatten Muskelzellen in den Medien. Die EVG-Färbung bestätigte die geordnete Anordnung der elastischen Fasern mit wenigen Störungen, und die Von-Kossa-Färbung wies keine signifikanten Kalziumablagerungen auf. Diese Ergebnisse deuten darauf hin, dass die SAL-Gruppe die mit VC verbundenen Nebenwirkungen signifikant verbesserte (Abbildung 5).
Sowohl die Calciumionen- (Ca2+) als auch die ALP-Spiegel waren in der Modellgruppe im Vergleich zur Ctrl-Gruppe signifikant erhöht (p < 0,05). Diese Spiegel waren jedoch in den SAL-L- und SAL-H-Gruppen deutlich erniedrigt, wobei die höhere Dosierung von SAL eine überlegene Wirksamkeit zeigte (Abbildung 6A,B). Zusätzlich war die Expression von knochenmorphogenetischem Protein-2 (BMP2) in der Modellgruppe deutlich erhöht (p < 0,001), während die SAL-Gruppen eine Verringerung der BMP2-Expression in unterschiedlichem Ausmaß zeigten (p < 0,01) (Abbildung 6C). Die Analyse der Entzündungsfaktoren zeigte eine signifikante Hochregulation von TNF-α und IL-6 in der Modellgruppe (p < 0,05), was auf eine Entzündungsreaktion aufgrund von VC hinweist (Abbildung 6D-F). Nach der SAL-Behandlung nahmen diese Entzündungsmarker signifikant ab (p < 0,05), mit besseren Ergebnissen in der SAL-H-Gruppe.
Die Proteinexpressionsanalyse im Gefäßgewebe zeigte in der Modellgruppe eine erhöhte Phosphorylierung von JAK2, STAT3 und NF-κB p65 und eine verminderte Expression von IκBα (p < 0,05). Sowohl die SAL-L- als auch die SAL-H-Behandlung verringerten signifikant die Phosphorylierungsniveaus von JAK2, STAT3 und NF-κB p65, während sie die IκBα-Expression erhöhten, was darauf hindeutet, dass Salidrosid die VC-Progression über den JAK2/STAT3-Signalweg abschwächt (Abbildung 7).
Diese Ergebnisse unterstreichen die potenziellen therapeutischen Effekte von SAL auf VC, unterstützt durch Netzwerkpharmakologie und In-vivo-Validierung , und bieten Einblicke in ihre möglichen Wirkmechanismen.

Abbildung 1: Interaktionsnetzwerk von Kernzielen zwischen Salidrosid und Gefäßverkalkung. (A) Das Flussdiagramm des Interaktionsnetzwerks der Kernziele zwischen Salidrosid und Gefäßverkalkung. (B) Venn-Diagramm, das die Überlappung zwischen Salidrosid-Zielen (violett) und Gefäßverkalkungszielen (grün) zeigt. Die sich überschneidenden Ziele sind durch schwarzen Text gekennzeichnet. (C) Das potentielle Kern-Zielinteraktionsnetzwerk, das an den Wirkungen von Salidrosid auf VC beteiligt ist. (1) Top 100 benachbarte Knoten des PPI-Netzwerks. Jeder Knoten stellt ein Ziel dar, und jede Kante stellt eine Interaktion zwischen Zielen dar. (2) Hub-Gene-Netzwerk (37 Knoten mit dem CytoNCA-Plugin identifiziert). (3) Top 20 benachbarte Knoten des PPI-Netzwerks. (4-6) Die wichtigsten Ziele, die anhand von Grad-, MCC- und MNC-Kriterien mit dem CytoHubba-Plugin (jeweils 10 Knoten) identifiziert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
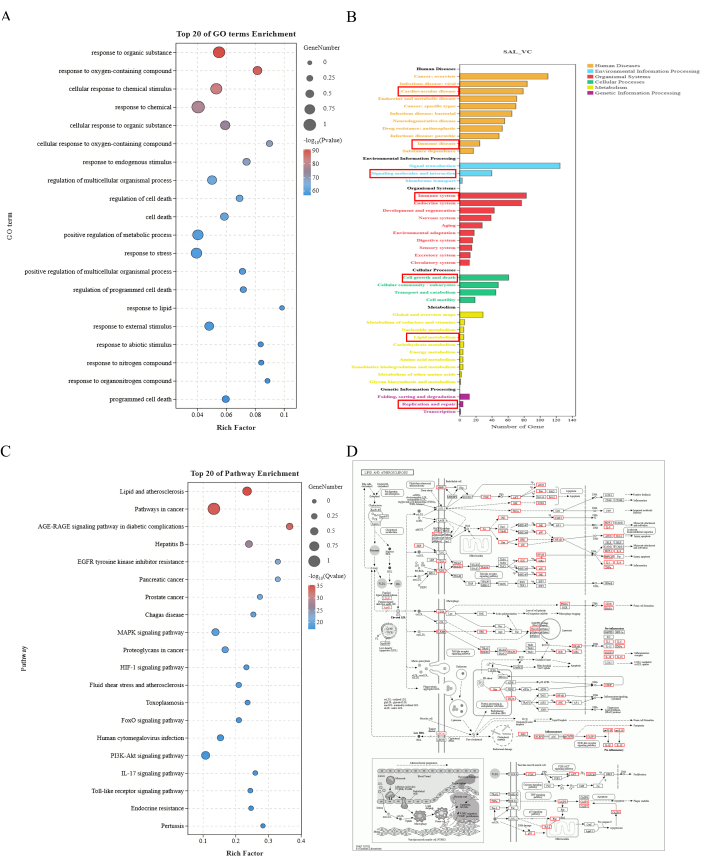
Abbildung 2: Ergebnisse der Anreicherungsanalyse. (A) Top 20 GO-Begriffsanreicherung. Die X-Achse stellt den Rich-Faktor dar, und die Y-Achse stellt die GO-Terme dar. Die Größe der Punkte gibt die Anzahl der Gene an, und die Farbe steht für -log10(P-Wert ), wobei Rot einen kleineren P-Wert anzeigt. (B) Annotation zur Anreicherung des KEGG-Signalwegs. Die X-Achse stellt die Anzahl der Gene dar, und die Y-Achse stellt verschiedene Ebenen von Annotationsinformationen dar. Unterschiedliche Farben stellen verschiedene Kategorien von Anmerkungen der ersten Ebene dar. (C) Anreicherung der Top 20 Signalwege. Die X-Achse stellt den Rich-Faktor dar, und die Y-Achse stellt die GO-Terme dar. Die Größe der Punkte gibt die Anzahl der Gene an, und die Farbe steht für -log10(P-Wert ), wobei Rot einen kleineren P-Wert anzeigt. (D) Karte des Lipid- und Atherosklerose-Signalwegs. Rote Kästchen zeigen die potenziellen Ziele der Salidrosid-Intervention bei VC, die im Lipid- und Atheroskleroseweg angereichert sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
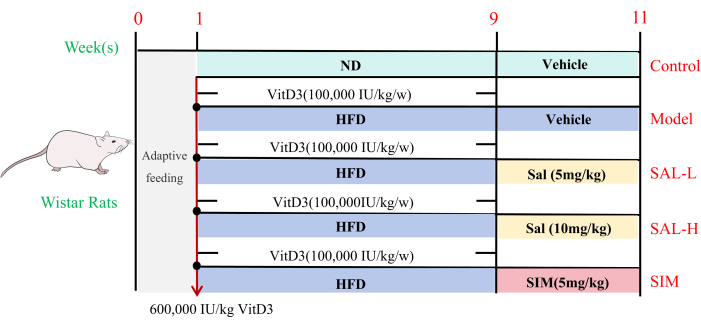
Abbildung 3: Untersuchung der Wirkung von Salidrosid auf die Gefäßverkalkung bei Ratten durch in vivo Experimente. Flussdiagramm des Versuchsdesigns. Wistar-Ratten wurden für ein 11-W-Experiment verwendet. In der ersten Woche wurden die Ratten akklimatisiert und dann für die nachfolgenden Experimente nach dem Zufallsprinzip in fünf Gruppen eingeteilt: Ctrl, Model, SAL-L, SAL-H und SIM. In den Wochen 1-9 wurde die Ctrl-Gruppe mit einer normalen Diät (ND) gefüttert, während die anderen Gruppen eine fettreiche Diät (HFD) ab 8 W nach einer einzigen Injektion von 600.000 IE/kg VD3 erhielten, gefolgt von wöchentlichen Injektionen von 100.000 IE/kg VD3. Von Woche 9 bis 10 wechselten alle Gruppen zu HFD (mit Ausnahme der Ctrl-Gruppe), wobei die SAL-L- und SAL-H-Gruppen intraperitoneale Injektionen von Salidrosid in einer Menge von 5 mg/kg bzw. 10 mg/kg erhielten, während die SIM-Gruppe Simvastatin in einer Menge von 5 mg/kg (n = 8) erhielt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Serumlipidspiegel bei VC-Ratten, die mit Salidrosid behandelt wurden. Die Serum-Lipid-Spiegel bei VC-Ratten wurden mit GPO-PAP mit einem Reagenz und direkten Dual-Reagenzien gemessen. (A) TG-Spiegel (GPO-PAP-Methode mit einem Reagenz). (B) TC-Spiegel (GPO-PAP-Methode mit einem Reagenz). (C) HDL-C-Spiegel (direkte Methode mit zwei Reagenzien). (D) LDL-C-Spiegel (direkte Methode mit zwei Reagenzien). Jede Spalte stellt den Mittelwert ± SD (n = 8) dar. Im Vergleich zur Strg-Gruppe < P 0,001; Im Vergleich zur Modellgruppe < ###P 0,001, ##P <0,01, #P < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Histologische Beurteilung der Schädigung des Gefäßgewebes bei VC-Ratten. Die HE-Färbung wurde zur Beurteilung der Gewebeschädigung verwendet, wobei rote Pfeile die mediale Verkalkung und grüne Pfeile die lymphozytäre Infiltration in der Adventitia anzeigten. Die Zellkerne werden blau und das Zytoplasma rot gefärbt. Die EVG-Färbung wurde verwendet, um eine Schädigung der elastischen Fasern in der Bauchaorta zu beobachten, wobei blaue Pfeile Bereiche mit elastischem Faserriss und Desorganisation anzeigen. Elastische Fasern erscheinen rot und Muskeln erscheinen blassrot. Die VK-Färbung wurde verwendet, um die Kalziumablagerung in der abdominalen Aorta zu beobachten, wobei orangefarbene Bereiche auf Kalziumablagerungen hinweisen, die schwarz erscheinen (Skalenbalken: 100 μm, n = 8). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
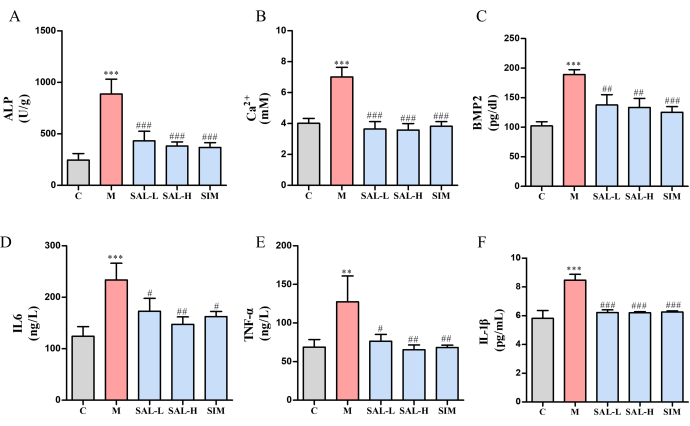
Abbildung 6: Expression von Knochenverkalkungsmarkern und inflammatorischen Zytokinen bei VC-Ratten, die mit Salidrosid behandelt wurden. (A) ALP-Aktivität (ein Marker für Gefäßverkalkung). (B) Gehalt an Kalziumionen. (C) BMP2-Expression (Bone Morphogenetic Protein). (D) IL-6-Expression (proinflammatorisches Zytokin). (E) TNF-α-Expression (proinflammatorisches Zytokin). (F) IL-1β-Expression (proinflammatorisches Zytokin). Jede Spalte stellt den Mittelwert ± SD (n = 8) dar. Im Vergleich zur Strg-Gruppe < P 0,001, **P < 0,01; Im Vergleich zur Modellgruppe < ###P 0,001, ##P < 0,01, #P < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
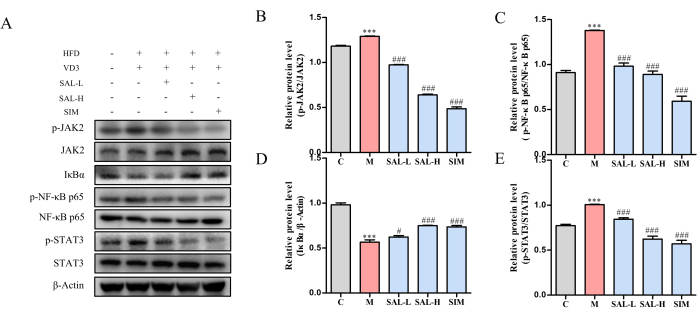
Abbildung 7: Western-Blot-Analyse der Schlüsselproteinexpression bei VC-Ratten, die mit Salidrosid behandelt wurden. (A) Western-Blot-Analyse der Proteinexpressionsniveaus von p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB p65, NF-κB p65 und IκBα. (B) Relative Proteinexpression von p-JAK2/JAK2 in verschiedenen Gruppen. (C) Relative Proteinexpression von p-NF-κB p65, NF-κB p65 in verschiedenen Gruppen. (D) Relative Proteinexpression von IκBα in verschiedenen Gruppen. (E) Relative Proteinexpression von p-STAT3/STAT3 in verschiedenen Gruppen. Jede Spalte stellt den Mittelwert ± SD (n = 8) dar. Im Vergleich zur Strg-Gruppe < P 0,001; Im Vergleich zur Modellgruppe < ##P 0,001, ##P < 0,01, #P < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
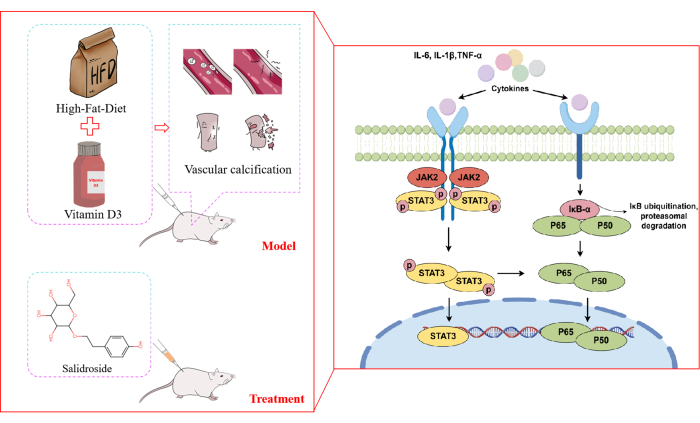
Abbildung 8: Vorgeschlagener molekularer Mechanismus der Salidrosid-Intervention bei VC-Ratten. Der vorgeschlagene molekulare Mechanismus, durch den Salidrosid in VC eingreift, beinhaltet die Hemmung von lipidverwandten Faktoren und proinflammatorischen Zytokinen (IL-1β, IL-6, TNF-α). Salidrosid unterdrückt die Aktivierung von IκBα und die Phosphorylierung von JAK2 und hemmt dadurch den NF-κB/STAT3-Entzündungs-Immunweg. Dies reduziert letztendlich die Schädigung des Gefäßgewebes, die mit der VC-Progression verbunden ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle 1: Informationen zur pharmakologischen Netzwerkdatenbank. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 2: Bestandteile von SDS-PAGE (für 1 Stichprobe). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
VC ist gekennzeichnet durch degenerative Veränderungen der Gefäßzellen und -gewebe, wobei pathologische Mineralablagerungen in den Blutgefäßen zu einer Versteifung der Gefäßwände oder zur Bildung von atherosklerotischen Plaques führen, die zu obstruktiven Gefäßerkrankungen führen können25. Studien zeigen, dass sich etwa 85 % der VC-Plaques zu Thrombosen entwickeln können, die akute kardiovaskuläre Episoden auslösen können. Darüber hinaus ist VC ein entscheidender Indikator für potenzielle akute kardiovaskuläre Ereignisse, Schlaganfälle und periphere Gefäßerkrankungen26. Aktuelle Behandlungsmethoden konzentrieren sich hauptsächlich auf Antikoagulation, lipidsenkende Medikamente und die Regulierung der Gefäßspannung, aber diese Ansätze haben oft begrenzte Wirksamkeit und Nebenwirkungen, insbesondere in fortgeschrittenen Stadien der Verkalkung.
Salidrosid (SAL), eine Verbindung, die als p-Hydroxyphenethyl-beta-D-Glucopyranosid identifiziert wurde, hat ein signifikantes therapeutisches Potenzial bei verschiedenen Gefäßerkrankungen gezeigt, die das Nerven-, Herz-Kreislauf- und Immunsystem betreffen, sowie bei chronischen Nierenerkrankungen27,28. Die moderne Forschung hat seine antioxidative, Anti-Aging-, immunmodulatorische und entzündungshemmende Wirkung bestätigt 29,30,31. Salidrosid verbessert insbesondere die Endothelfunktion und erhöht die Elastizität der Blutgefäße, indem es Vasokonstriktoren hemmt und Vasodilatatoren fördert32. Die Elastizität der Blutgefäße spiegelt direkt die Veränderungen nach der Verkalkung wider, bei der ein Elastizitätsverlust oft mit dem Abbau elastischer Proteine einhergeht und die inneren und mittleren Schichten der Blutgefäße schädigt. Diese Schädigung äußert sich häufig in der Aktivierung von Entzündungszellen. Zahlreiche Studien unterstreichen den engen Zusammenhang zwischen VC und Entzündungen. Chronische Entzündungen werden als Haupttreiber der ektopischen Verkalkung angesehen, bei der sich entzündungsfördernde Zellen vermehren und Faktoren freisetzen, die über mehrere Wege zur VC beitragen 33,34,35,36. Das Potenzial von Salidrosid als Multi-Target-Therapeutikum ist besonders relevant, da die Gefäßverkalkung ein komplexer pathologischer Prozess ist, der Entzündungen, Fettstoffwechsel und oxidativen Stress umfasst. Der Multi-Target-Ansatz von Salidrosid, der Entzündungswege hemmt und gleichzeitig die Lipidakkumulation und oxidativen Stress reguliert, stellt einen deutlichen Vorteil gegenüber den derzeit verwendeten Single-Target-Medikamenten dar. Daher wird in dieser Studie die Expression von Entzündungsfaktoren untersucht, um weiter zu untersuchen, ob Salidrosid VC beeinflusst, indem es Entzündungen reduziert.
Das Konzept der Netzwerkpharmakologie, das 2007 von Hopkins eingeführt wurde, beinhaltet die Verwendung netzwerkbasierter Ansätze, um zu untersuchen, wie Medikamente, Krankheiten und Ziele über mehrere Komponenten, Ziele und Signalwege hinweg interagieren37. In dieser Studie wurde die Netzwerkpharmakologie eingesetzt, um vorherzusagen, wie SAL mit VC interagiert, indem wichtige Ziele wie IL6, STAT3, TNF, TP53 und ALB lokalisiert wurden. Die Ergebnisse deuteten auf eine Konzentration dieser Gene im Fettstoffwechsel und in den Atherosklerose-Signalwegen hin, was darauf hindeutet, dass VC mit der Lipidakkumulation und Entzündung in den Arterien in Verbindung gebracht werden könnte. Um diese Vorhersagen zu verifizieren, wurde ein Rattenmodell für VC verwendet, das durch eine fettreiche Ernährung in Kombination mit VD3 induziert wurde. Dieses Modell ermöglichte eine weitere Untersuchung der Auswirkungen von SAL auf VC. Die Ergebnisse zeigten, dass VC die Spiegel von TC, TG und LDL-C erhöhte, während es HDL-C senkte. Darüber hinaus zeigte SAL in verschiedenen Dosen unterschiedliche Wirkungen bei der Regulierung dieser abnormalen Indikatoren. Weitere Forschungsergebnisse deuteten darauf hin, dass SAL die Kalziumablagerung in der abdominalen Aorta effektiv reduzierte, abnormale Kalziumionenspiegel korrigierte und die Infiltration von Entzündungszellen verringerte, während gleichzeitig die Expression von verkalkungsrelevanten Markern wie ALP und BMP2 reduziert wurde.
Der JAK/STAT-Signalweg spielt eine entscheidende Rolle bei verschiedenen Wachstums- und Signalprozessen, reguliert Immunantworten und Zelldifferenzierung, was ihn zu einem integralen Bestandteil der Entzündungsreaktionen macht38. STAT3, das durch IL-6 aktiviert wird, ist Teil einer Akute-Phase-Antwort, wobei IL-6 die JAK-Phosphorylierung induziert, die wiederum STAT3 phosphoryliert. Diese Aktivierung steuert die Genexpression im Zusammenhang mit Zellwachstum, Differenzierung und Überleben. Eine persistierende Phosphorylierung von STAT3 wurde mit Gefäßerkrankungen in Verbindung gebracht und kann zu einer abnormalen Expression von Adhäsionsmolekülen führen, was in frühen VC-Stadien die Adhäsion von Monozyten an die vaskuläre Intima erleichtert und die Gefäßstruktur weiter schädigt39,40. Die experimentellen Ergebnisse zeigen, dass SAL die Expression von phosphoryliertem JAK2, STAT3 und NF-κB p65 hemmt, während es die Expression von IκBα fördert, was darauf hindeutet, dass die Rolle von SAL bei der Hemmung der VC-Progression über den IL-6/JAK2/STAT3-Signalweg vermittelt wird (Abbildung 8).
In dieser Studie konnte die Netzwerkpharmakologie erfolgreich Schlüsselmechanismen vorhersagen, die an der VC-Progression beteiligt sind, und die Ziele und Wege identifizieren, über die SAL interveniert. Die physiologischen und pathologischen Parallelen zwischen Ratten- und Mensch-Systemen machen Rattenmodelle für die klinische Forschung in der Zukunft besonders wertvoll. Darüber hinaus sind Ratten kostengünstig und einfach zu handhaben, was sie für die Erforschung von Krankheiten und die Wirkstoffforschung geeignet macht. Trotz der Vorteile von Tiermodellen gibt es Einschränkungen. Rattenmodelle sind zwar hilfreich, können aber die Komplexität der VC-Entwicklung beim Menschen nicht vollständig erfassen. Zukünftige Studien sollten vielfältigere Modelle einbeziehen und Faktoren wie Komorbiditäten und unterschiedliche Patientenhintergründe berücksichtigen.
Diese Studie hat jedoch einige Einschränkungen. Der Versuchszeitraum betrug 10 Wochen, in denen Ratten mit einer fettreichen Diät (HFD) mit einer anfänglich hohen Dosis gefüttert wurden, gefolgt von mehreren niedrigeren Dosen von VD3, um VC zu induzieren. Die im Rattenmodell beobachtete hohe Mortalitätsrate wurde erstmals in vorläufigen Experimenten festgestellt, bei denen festgestellt wurde, dass hohe und anhaltende Dosen von VD3 die Überlebensraten der Ratten signifikant reduzierten, was sich letztendlich auf die Qualität und den Zeitplan des Experiments auswirkte. Dies unterstreicht die Notwendigkeit, das Modell zu optimieren, um die Überlebensraten zu verbessern und robustere Daten zu erhalten. Während diese Studie die Auswirkungen von SAL auf VC bei Ratten bestätigte, bedeutet die Komplexität von VC und sein langwieriger Entwicklungsprozess, dass eine einzelne Tierstudie seine Pathophysiologie möglicherweise nicht vollständig erfasst. Zukünftige Studien sollten sich auf die Verfeinerung des Modells konzentrieren, um die Überlebensraten von Ratten zu verbessern. Während die In-vivo-Experimente zeigten, dass SAL VC reduziert, indem es Entzündungsfaktoren über den JAK2/STAT3-Signalweg moduliert, sollten weitere Studien vor- und nachgelagerte Ziele in vitro untersuchen. Schließlich sind klinische Studien zu SAL begrenzt, und es sind weitere Untersuchungen erforderlich, um ihre Wirksamkeit und Sicherheit beim Menschen zu bewerten. VC wird mit mehreren Erkrankungen in Verbindung gebracht, darunter chronische Nierenerkrankungen, zerebrovaskuläre Erkrankungen und koronare Atherosklerose. In dieser Studie wurde erfolgreich ein VC-Modell etabliert, das zur Erforschung von Behandlungen für vaskuläre Erkrankungen weiter verwendet werden kann. Das experimentelle Design und die Techniken, die hier verwendet werden, bieten auch eine wertvolle Grundlage für die Wirkstoffforschung im Zusammenhang mit VC.
Zusammenfassend lässt sich sagen, dass diese Studie Netzwerkpharmakologie und Molekularbiologie nutzte, um die Wirkung von Salidrosid auf die Gefäßverkalkung zu untersuchen. Die Ergebnisse zeigen, dass SAL VC hemmt, indem es Entzündungen reduziert, die Expression von Lipidfaktoren senkt und VC-Marker über den JAK2/STAT3-Signalweg verringert, was auf einen vielversprechenden therapeutischen Ansatz für die VC-Behandlung hindeutet.
Offenlegungen
Stellen Sie sicher, dass alle Autoren alle Interessenkonflikte offengelegt haben.
Danksagungen
Diese Arbeit wurde finanziell unterstützt durch das Projekt des Ministeriums für Wissenschaft und Technologie der Provinz Jilin (YDZJ202301ZYTS460) und das Projekt des Bildungsministeriums der Provinz Jilin (JJKH20230991KJ).
Materialien
| Name | Company | Catalog Number | Comments |
| 30% (29:1) Acrylamide/Bis Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | A1010 | |
| 4% Paraformaldehyde Fix Solution | Beyotime Biotech Inc (Beyotime) , China | P0099 | |
| 5*loading buffer | Beijing Solarbio Science & Technology Co., Ltd ,China | P1040 | |
| Alkaline Phosphatase Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0321S | |
| AlphaView Software | Proteinsimple Inc.USA | AlphaView SA | |
| BCA Protein Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0012 | |
| Bluing Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | G1866 | |
| Calcium Colorimetric Assay Kit | Beyotime Biotech Inc (Beyotime) , China | S1063S | |
| Collagen Fiber And Elastic Fiber Staining Kit(EVG-Verh eff Method) | Beijing Solarbio Science & Technology Co., Ltd ,China | G1597 | |
| Dewatering machine | Diapath Biosciences Ltd, Italy | Donatello | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd,China | JB-P5 | |
| Enzyme-labeled instrument | Biotek Co., Ltd,USA | Epoch | |
| Ethanol absolute | GHTECH Co., Ltd, China | 64-17-5 | |
| Goat Anti-Mouse IgG (H+L) HRP | Bioworld technology, co, Ltd.,China | BS20242-Y | |
| GraphPad Prism Software | GraphPad Software.,USA | GraphPad Prism 9.0 | |
| Hematoxylin-Eosin Stain Kit | Beijing Solarbio Science & Technology Co., Ltd ,China | G1120 | |
| High-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A112 | |
| HRP-labeled Goat Anti-Rabbit IgG(H+L) | Guangzhou saiguo biotech Co.,LTD | A0208 | |
| Image J Software | National Institutes of Health(NIH),USA | Image J | |
| IκB Alpha Polyclonal antibody | Proteintech Group, Inc.A,USA | 10268-1-AP | |
| JAK2 Antibody | Affinity Biosciences Co., Ltd,China | AF6022 | |
| Low-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A113 | |
| NF-κB p65 Antibody | Proteintech Group, Inc.A,USA | 10745-1-AP | |
| Pathological microtome | Leica Biosystems,USA | RM2016 | |
| Phosphatase Inhibitor Cocktail Tables | F. Hoffmann-La Roche, Ltd,Switzerland | 04906845001 | |
| Phospho-JAK2 (Tyr931) Antibody | Affinity Biosciences Co., Ltd,China | AF3024 | |
| Phospho-NF-κB p65(Ser276) Antibody | Affinity Biosciences Co., Ltd,China | AF2006 | |
| Phospho-STAT3(S727) Antibody | Abways Science & Technology Co., Ltd ,China | CY5291 | |
| Protease Inhibitor Cocktail | F. Hoffmann-La Roche, Ltd,Switzerland | 11873580001 | |
| PVDF membrane | F. Hoffmann-La Roche, Ltd,Switzerland | 3010040001 | |
| Rat IL-1β ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI303 | |
| Rat IL-6 ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI328 | |
| Rat TNF-α ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PT516 | |
| RIPA Lysis Buffer | Beyotime Biotech Inc (Beyotime) , China | P0013B | |
| Salisoroside | Shanghai yuanye Bio-Technology Co., Ltd,China | S25475 | |
| SDS | Guangzhou saiguo biotech Co.,LTD,China | 3250KG001 | |
| Sodium carbonate | China National Pharmaceutical Group Co., Ltd. , China | 1001921933 | |
| Sodium hydrogen carbonate | China National Pharmaceutical Group Co., Ltd. , China | 10018960 | |
| Sodium thiosulfate | China National Pharmaceutical Group Co., Ltd. , China | 20042518 | |
| STAT3 Antibody | Proteintech Group, Inc.A,USA | 10253-2-AP | |
| TBST (10×) | Beyotime Biotech Inc (Beyotime) , China | ST673 | |
| Total cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A111 | |
| Triglyceride assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A110 | |
| Tris Base | Guangzhou saiguo biotech Co.,LTD | 1115GR500 | |
| Upright optical microscope | Nikon Corporation,Japan | Eclipse E100 | |
| Von Kossa Solution | Wuhan servicebio technology CO.,LTD,China | G1043 | |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology, Inc. ,USA | SC-2048 | |
| β-Actin antibody | Cell Signaling Technology, Inc.,USA | E4967 |
Referenzen
- Sutton, N. R., et al. Molecular mechanisms of vascular health: Insights from vascular aging and calcification. Arterioscler Thromb Vasc Biol. 43 (1), 15-29 (2023).
- Henein, M. Y., Owen, A. Statins moderate coronary stenoses but not coronary calcification: Results from meta-analyses. Int J Cardiol. 153 (1), 31-35 (2011).
- Ajufo, E., et al. Value of coronary artery calcium scanning in association with the net benefit of aspirin in primary prevention of atherosclerotic cardiovascular disease. JAMA Cardiol. 6 (2), 179-187 (2021).
- Vossen, L. M., Kroon, A. A., Schurgers, L. J., De Leeuw, P. W. Pharmacological and nutritional modulation of vascular calcification. Nutrients. 12 (1), 100 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC Cardiovasc Interv. 14 (12), 1275-1292 (2021).
- Demer, L. L., Watson, K. E., Boström, K. Mechanism of calcification in atherosclerosis. Trends Cardiovasc Med. 4 (1), 45-49 (1994).
- Chen, F., et al. Network pharmacology analysis combined with experimental validation to explore the therapeutic mechanism of salidroside on intestine ischemia-reperfusion. Biosci Rep. 43 (8), BSR20230539 (2023).
- Rong, L., et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer ags cells through the pi3k/akt/MTOR pathway. Biomed Pharmacother. 122, 109726 (2020).
- Zhang, P., et al. Network pharmacology: Towards the artificial intelligence-based precision traditional Chinese medicine. Brief Bioinform. 25 (1), bbad518 (2023).
- Jiao, X., et al. A comprehensive application: Molecular docking and network pharmacology for the prediction of bioactive constituents and elucidation of mechanisms of action in component-based Chinese medicine. Comput Biol Chem. 90, 107402 (2021).
- Li, S., Zhang, B. Traditional Chinese medicine network pharmacology: Theory, methodology and application. Chin J Nat Med. 11 (2), 110-120 (2013).
- Wang, X., Hu, Y., Zhou, X., Li, S. Editorial: Network pharmacology and traditional medicine: Setting the new standards by combining in silico and experimental work. Front Pharmacol. 13, 1002537 (2022).
- Huang, Z., Yang, Y., Fan, X., Ma, W. Network pharmacology-based investigation and experimental validation of the mechanism of scutellarin in the treatment of acute myeloid leukemia. Front Pharmacol. 13, 952677 (2022).
- Zhang, R., Zhu, X., Bai, H., Ning, K. Network pharmacology databases for traditional Chinese medicine: Review and assessment. Front Pharmacol. 10, 123 (2019).
- Wang, C., Liu, X., Guo, S. Network pharmacology-based strategy to investigate the effect and mechanism of alpha-solanine against glioma. BMC Complement Med Ther. 23 (1), 371 (2023).
- Li, X., et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huang Lian jiedu decoction against sepsis. Comput Biol Med. 144, 105389 (2022).
- Holmes, R. S., et al. Recommended nomenclature for five mammalian carboxylesterase gene families: Human, mouse, and rat genes and proteins. Mamm Genome. 21 (9-10), 427-441 (2010).
- Geng, J., Zhou, G., Guo, S., Ma, C., Ma, J. Underlying mechanism of traditional herbal formula Chuang-ling-ye in the treatment of diabetic foot ulcer through network pharmacology and molecular docking. Curr Pharm Des. 30 (6), 448-467 (2024).
- Chen, X., et al. Puerarin inhibits emt induced by oxaliplatin via targeting carbonic anhydrase xii. Front Pharmacol. 13, 969422 (2022).
- Herrmann, J., Babic, M., Tolle, M., Van Der Giet, M., Schuchardt, M. Research models for studying vascular calcification. Int J Mol Sci. 21 (6), 2204 (2020).
- Zhou, H., X, W., Yuan, Y., Qi, X. Comparison of methods for establishing a rat model of atherosclerosis using three doses of vitamin D3 and atherogenic diet. Chin J Arterioscler. 20 (11), 995-998 (2012).
- Zhang, Y., et al. Il-18 mediates vascular calcification induced by high-fat diet in rats with chronic renal failure. Front Cardiovasc Med. 8, 724233 (2021).
- Kazlouskaya, V., et al. The utility of elastic verhoeff-van gieson staining in dermatopathology. J Cutan Pathol. 40 (2), 211-225 (2013).
- Tang, X., et al. Underlying mechanism and active ingredients of tianma gouteng acting on cerebral infarction as determined via network pharmacology analysis combined with experimental validation. Front Pharmacol. 12, 760503 (2021).
- Lee, S. J., Lee, I. K., Jeon, J. H. Vascular calcification-new insights into its mechanism. Int J Mol Sci. 21 (8), 2685 (2020).
- Magdic, J., et al. Intracranial vertebrobasilar calcification in patients with ischemic stroke is a predictor of recurrent stroke, vascular disease, and death: A case-control study. Int J Environ Res Public Health. 17 (6), 2013 (2013).
- Zhou, L., et al. Salidroside-pretreated mesenchymal stem cells contribute to neuroprotection in cerebral ischemic injury in vitro and in vivo. J Mol Histol. 52 (6), 1145-1154 (2021).
- Hutcheson, J. D., Goettsch, C. Cardiovascular calcification heterogeneity in chronic kidney disease. Circ Res. 132 (8), 993-1012 (2023).
- Zhang, X., et al. Salidroside: A review of its recent advances in synthetic pathways and pharmacological properties. Chem Biol Interact. 339, 109268 (2021).
- Zhang, P., Li, Y., Guo, R., Zang, W. Salidroside protects against advanced glycation end products-induced vascular endothelial dysfunction. Med Sci Monit. 24, 2420-2428 (2018).
- Li, Y., et al. Salidroside promotes angiogenesis after cerebral ischemia in mice through shh signaling pathway. Biomed Pharmacother. 174, 116625 (2024).
- Gao, X. F., Shi, H. M., Sun, T., Ao, H. Effects of radix et rhizoma Rhodiolae kirilowii on expressions of von Willebrand factor, hypoxia-inducible factor 1 and vascular endothelial growth factor in myocardium of rats with acute myocardial infarction. Zhong Xi Yi Jie He Xue Bao. 7 (5), 434-440 (2009).
- Li, X., Liu, C., Li, Y., Xiong, W., Zuo, D. Inflammation promotes erythropoietin induced vascular calcification by activating p38 pathway. Bioengineered. 13 (3), 5277-5291 (2022).
- Bessueille, L., Magne, D. Inflammation: A culprit for vascular calcification in atherosclerosis and diabetes. Cell Mol Life Sci. 72 (13), 2475-2489 (2015).
- Li, R., et al. Salidroside prevents tumor necrosis factor-alpha-induced vascular inflammation by blocking mitogen-activated protein kinase and nf-kappa B signaling activation. Exp Ther Med. 18 (5), 4137-4143 (2019).
- Xing, S. S., et al. Salidroside attenuates endothelial cellular senescence via decreasing the expression of inflammatory cytokines and increasing the expression of sirt3. Mech Ageing Dev. 175, 1-6 (2018).
- Hopkins, A. L. Network pharmacology. Nat Biotechnol. 25 (10), 1110-1111 (2007).
- Xin, P., et al. The role of jak/stat signaling pathway and its inhibitors in diseases. Int Immunopharmacol. 80, 106210 (2020).
- Fu, X., et al. Glycosides from buyang huanwu decoction inhibit atherosclerotic inflammation via jak/stat signaling pathway. Phytomedicine. 105, 154385 (2022).
- Macri, F., et al. High phosphate-induced jak-stat signalling sustains vascular smooth muscle cell inflammation and limits calcification. Biomolecules. 14 (1), 107328 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten