Method Article
Türkiye'de Karasal İklim Altında Mercimek Tarlalarının Fusarium Solgunluğu ve Kök Çürüklüğü Açısından Taranması
Bu Makalede
Özet
Yozgat ilinde yapılan bir araştırma, solgunluk ve kök çürüklüğü gibi mantar hastalıkları gibi biyotik faktörlerin mercimek üretimini sınırladığını buldu. Fusarium izolatları örneklerin %95,4'ünde bulundu, bu da sürdürülebilir teknoloji geliştirme ve etkili kontrol stratejileri için periyodik yerel anketler ve düzenli izleme önermektedir.
Özet
Mercimek, kendi kendine tozlaşan önemli bir baklagil mahsulü bitkisidir. Üretimi, solgunluk ve kök çürüklüğü kompleksine neden olan mantar ajanları başta olmak üzere çeşitli biyotik faktörlerle sınırlıdır. Bu çalışmada fitopatojenik fungal etkenlerin bölgesel epidemiyolojisi ve etiyolojisinin anlaşılarak toprak kaynaklı Fusarium spp.'ye karşı kontrol stratejilerinin geliştirilmesi amaçlanmıştır. Bu çalışmada, Yozgat ilinde 2022 ve 2023 yıllarında yaygın olarak görülen Fusarium türlerinin neden olduğu solgunluk, kök ve taç çürüklüğü hastalıkları açısından 83 mercimek ekim bölgesi incelenmiştir. Mantar izolasyonu ve identifikasyonu için semptomatik mercimek bitkileri toplandı. Fusarium izolatları koloni morfolojisine göre gruplandırıldı ve PDA besiyerinde kültüre edildi. Ayrıca, Fusarium izolatlarından elde edilen genomik DNA'lar PCR kullanılarak analiz edildi ve NCBI GenBank'ta kayıtlı diğer Fusarium izolatları ile karşılaştırıldı. Fusarium izolatları arasındaki genetik ilişkiler Mega 11 programında Maximum Parsimony (MP) yöntemi kullanılarak belirlenmiştir. Yozgat ilinde solgunluk ve kök çürüklüğü hastalıklarının sonuçları, ortalama insidansı ve hastalık şiddet oranı sırasıyla %16.9 ve %38.6 olarak bulundu. Örneklerin %95.4'ünde Fusarium izolatları bulunmuştur. F. oxysporum, F. culmorum, F. graminearum, F. acuminatum ve F. solani izolatları arasında %99,5 ile %100 arasında nükleotid dizi homojenliği bulunmuş olup, en çok izole edilen tür F. oxysporum olmuştur. Fusarium izolatlarının MP dendrogramı iki ana dala ayrıldı, ilk dal tüm F. solani izolatlarını içeriyordu. İkinci ana dal, bu çalışmada ve NCBI GenBank'ta izole edilen diğer Fusarium türlerini içeriyordu. Çalışma, mercimekte baskılanma için Fusarium solgunluğunun sıklığını belirlemek için periyodik yerel araştırmalar önermektedir. Hastalığı kontrol altına almak ve mercimek üretim sistemini korumak için Fusarium bazlı hasarların zamanında bastırılması şiddetle tavsiye edilir.
Giriş
Fabaceae familyasına ait küçük yenilebilir bir baklagil olan mercimek (Lens culinaris Medik.), iğne benzeri yaprakları ve beyaz ila soluk mor veya koyu mor çiçekleri olan kendi kendine tozlaşan, serin mevsim mahsulüdür1. Yaklaşık 10.000 yıl önce Bereketli Hilal'in Mezopotamya bölgesinde insanlar tarafından evcilleştirildi ve hızla Akdeniz Havzası ve Orta Asya da dahil olmak üzere Yeni Dünya'ya yayıldı ve daha sonra Amerika2'ye vatandaşlığa kabul edildi. Dünya mercimek ekim alanı yaklaşık 5,5 milyon hektar olup, üretim 6,6 milyon tondur3. Türkiye, mercimek üretiminde Kanada, Hindistan ve Avustralya'dan sonra 4.sırada yer almaktadır. Türkiye'de mercimek yetiştiriciliği çok önemlidir ve dünya üretiminin %6,7'sini oluşturmaktadır. Türkiye'nin toplam mercimek üretimi 474.000 ton olup, en az 40 ilde üretilmektedir4. Türkiye'nin mercimek üretiminin yaklaşık %89,5'ini kırmızı ve yeşil mercimek oluşturmakta olup, bu oran Güneydoğu Anadolu Bölgesi'nde kışlık mahsulün %10,5'ini oluşturmaktadır. Mahsulün geri kalanı yaz bitkileri olarak yetiştirilir. Yozgat (%39,5), Konya (%23,7), Kırşehir (%16,3), Çorum (%7,6) ve Ankara (%2,9) illeri yeşil mercimek üretimine büyük ölçüde katkı sağlamaktadır4. Mercimek üretimi biyotik ve abiyotik stres faktörleri ile sınırlanabilir. Don ve kuraklık, yaz yeşil mercimek üretiminde en sık görülen abiyotik stres faktörleridir5. Ascochyta lentis, Rhizoctonia solani, R. bataticola, Aphanomyces euteiche, Pythium ve Fusarium türlerinin neden olduğu solgunluk, kök ve taç çürüklüğü kompleksi gibi mantar hastalıkları, enfeksiyonun zamanlamasına, konak duyarlılığına ve meteorolojik koşullara bağlı olarak sönümleme, fide yanıklığı, solgunluk ve kök çürüklüğü gibi hastalıkların bir kombinasyonuna neden olan en önemli mantar hastalıklarıdır 6,7, 8.
Fusarium, toprakta, bitkilerde ve organik substratlarda bulunan ipliksi kusurlu bir mantardır ve bu patojenler arasında kozmopolit bir cinstir9. Fusarium solgunluğu, kök ve kök boğazı çürüklüğü gibi çeşitli hastalıkların yanı sıra buğdayda Fusarium baş yanıklığı, kabakgillerde Fusarium solgunluğu ve mercimek de dahil olmak üzere çoğu baklagilde kök çürüklüğüne neden olur 10,11,12. Fusarium spp.'nin neden olduğu damar solgunluğu, kök ve kök boğazı çürüklüğü tüm dünyada birçok mercimek ekim alanında mercimeğin en önemli hastalığıdır10. Fusarium oxysporum, mercimekte solgunluk, kök ve kök boğazı çürüklüğü ile ilişkili en yaygın Fusarium türüdür. Tüm dünyada mercimek ekim alanlarında solgunluk, kök ve taç çürüklüğü hastalıklarına F. graminearum, F. sporotrichioides, F. equity, F. acuminatum, F. redolent, F. avenaceum, F. culmorum, F. solani ve F. verticillioides neden olmaktadır7. Fusarium spp.'nin neden olduğu solgunluk, kök ve taç çürüklüğü hastalıkları hem fide hem de yetişkin aşamalarında ortaya çıkar ve yaprakların ani solmasına, kurumasına ve sonunda ölümüne neden olur. Hastalığın belirtileri arasında tohum çürümesi, kök çürümesi, üst yaprakçıkların solması, bodurluk, büzülme ve yaprakların kıvrılması yer alır. Orta ve geç bakla doldurma aşamalarında, tohumlar genellikle küçülür ve kök semptomları arasında bodur büyüme, kahverengi renk değişikliği, hasarlı kazık kök uçları ve ikincil köklerin çoğalması yer alır. Damar dokusunda renk değişikliği her olguda görülmeyebilir13.
İç Anadolu Bölgesi'nde mercimekte solgunluk ve kök çürüklüğü hastalıklarının durumu ile ilgili çalışmalar sınırlı sayıda yapılmıştır. Ilıman ve ılıman bir iklime sahip olan Yozgat, kış aylarında yaz aylarına göre bol yağış alır ve Köppen ve Geiger14 tarafından Dsb (Ilık, nemli karasal iklim) olarak sınıflandırılır. Ortalama sıcaklık 9,6 °C, ortalama yağış miktarı 512 mm'dir. Yozgat kuzey yarımkürede yer almaktadır. Yaz haziran, temmuz, ağustos ve eylül aylarında gerçekleşir. Hastalık kontrolünde toprak kaynaklı Fusarium spp.'ye karşı farklı kontrol stratejilerinin geliştirilmesi için hastalığa neden olan fitopatojenik mantar etkenlerinin bölgesel epidemiyolojisi ve etiyolojisi hakkında bilgi sahibi olmak çok önemlidir15. Bu bağlamda, bu çalışmanın amacı, toplam yeşil mercimek üretiminin yaklaşık %40'ının tek başına yapıldığı Yozgat ilinde bir yüzey araştırması yapılarak mercimekte solgunluk, kök ve taç çürüklüğü hastalıklarının hastalık parametrelerinin (hastalık prevalansı, insidansı ve şiddeti) belirlenmesi ve tanımlanmasıdır Mercimeklerde solgunluk ve kök çürüklüğüne neden olan türlerin morfolojik ve moleküler analizler ile belirlenmesi ve Fusarium türlerinin patojenite testleri yapılarak tekil virülans seviyelerinin belirlenmesidir.
Protokol
NOT: Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Saha araştırması, numune alma ve mantar izolasyonu
NOT: Anket çalışması 2022 ve 2023 yıllarında Endes16'ya göre yapılmıştır. Yozgat ilinde dokuz ilçeyi kapsayan toplam 83 mercimek ekim alanında solgunluk, kök ve kök boğazı çürüklüğü hastalığı gözlenmiştir (Şekil 1).
- Örnekleme alanı olarak 1000m2'den büyük mercimek tarlalarını seçin. Her bir örneği, 1m2'lik bir çerçeve kullanarak köşegenler boyunca zikzaklar çizerek sınırdan alanın merkezine veya ortasına rastgele yürüyerek toplayın ve rastgele seçilen en az üç farklı noktaya yerleştirin. Hastalık belirtisi gösteren mercimek bitkilerini her noktadan toplayarak kese kağıtlarına koyup, mantar izolasyonu ve tanımlama çalışmalarında kullanılmak üzere laboratuvara aktarıyor.
NOT: Laboratuvara aktarılan hastalıklı mercimek bitkilerinin kökleri ve kök boğazları önce iri tortulardan kurtulmak için musluk suyu ile yıkanmış; daha sonra, Endes16 tarafından tarif edildiği gibi mantar patojenlerinin izolasyonu için yüzey dezenfeksiyonuna tabi tutuldular. - Hastalıklı bitki dokularını 10-15 saniye% 70 etanol içinde bekletin ve ardından 3 kez steril suda her birini 3 dakika durulayın. Hepsini %1 sodyum hipoklorit (NaOCl) içinde 5 dakika tutun ve her birini 3 kez 5 dakika steril su ile tekrar durulayın.
- Yüzey dezenfeksiyon işlemini bitirmek için ıslak bitki dokularını steril bir dolapta filtre kağıtları üzerinde kurutun. Bunu takiben, dezenfekte edilmiş bitki dokularını 5-10 mm uzunluğunda parçalar halinde kesin ve 4-5 parçayı Petri kapları (90 mm çapında) içinde% 0.01 streptomisin içeren bir PDA ortamına yerleştirin. Petri kaplarını karanlıkta 25 ± 1 °C'de 4-7 gün boyunca bir kuluçka makinesine koyun ve mantar büyümesini gözlemleyin.
NOT: Gelişen mantar izolatları tek spor izolasyon yöntemi ile saflaştırılmıştır. Bu amaçla, Choi ve ark.17 tarafından Ascomycetes, Basidiomycetes, Coelomycetes ve Hyphomycetes'e ait mantarların tek spor kültürlerinin elde edilmesi üzerine yapılan çalışmada aşağıda tarif edildiği gibi modifiye edilmiş ve kullanılmıştır. - Mantar izolatlarını saflaştırmak için, izolasyon çalışmaları sonunda elde edilen mantar izolatlarını 25 ± 1 °C'de 12 saat floresan ışık / 12 saat karanlıkta 15 gün süreyle bir inkübatörde bekleterek PDA üzerinde anamorfik üreme yapılarının oluşumunu teşvik edin.
- 15 günlük kültürlerden yaklaşık 100 mg mantar miselyumunu bir spatula ile tartın, 1.5 mL'lik steril bir mikrosantrifüj tüpüne aktarın ve ardından homojenizasyon için steril plastik tokmaklarla iyice öğütün.
- Sporların suya transferini sağlamak için 1 mL steril su ekleyin ve 1 dakika boyunca girdap yapın. Suya geçen sporların sayısını ayarlamak için, bu karışımdan bir pipetle 20 μL çekin ve ışık mikroskobunun 10x büyütmesi altında spor sayısını kontrol edin.
- Spor miktarı istenilen miktardan fazla olduğunda spor-su karışımını 1/10, 1/100 ve 1/1000 gibi oranlarda seyreltiniz. Mikroskop görüş alanında 4-6 spor içeren bir karışım sağlayın.
- Hazırlanan spor süspansiyonunun 100 μL'sini alın ve% 0.1 streptomisin ile takviye edilmiş PDA ortamı içeren 90 mm çapındaki Petri kaplarına aktarın. Ardından, aktarılan süspansiyonu bir Drigalski spatula ile PDA üzerine yayın.
- Hazırlanan Petri kaplarını karanlıkta 25 ± 1 °C'de 12-24 saat inkübe edin. Bu sürenin sonunda, bir aşılama halkası olan tek bir konidiadan geliştirilen küçük hif parçalarını, PDA ortamı içeren yeni bir Petri kabına aktarın. Her spordan elde edilen her kültür, tek bir spor kültürüdür. Bunları patojenite testlerinde ve morfolojik ve moleküler tanımlamada kullanılmak üzere saklayın.
NOT: Temel amaç, mantar izolatlarını morfolojilerini, genetiklerini ve virülanslarını değiştirmeden uzun süre canlı tutmaktır. Depolama işlemi iki farklı yöntem kullanılarak gerçekleştirilmiştir18,19. Bu çalışmada kullanılan tüm saklama yöntemleri aşağıda detaylı olarak açıklanmıştır.- Numuneleri saklamanın ilk yöntemi aşağıdaki gibidir. Steril suda saklanabilen 4 mm çapında miselyum diskleri elde etmek için 12:12 saat karanlık: 15 gün boyunca 25 ± 1 ° C'de mantar izolatlarını büyütün: 15 gün boyunca aydınlatın.
- Miselyum disklerini (4 mm çapında, 10 disk) yukarıda belirtilen koşullar altında büyüyen mantar kültürlerinden bir mantar delici ile kesin. Miselyum disklerini 1 mL steril su içeren mikrosantrifüj tüplerine aktarın. Numuneleri mikrosantrifüj tüplerinde buzdolabında -20 °C'de 6 ay saklayın.
- Numuneleri saklamanın ikinci yöntemi aşağıdaki gibidir. İlk olarak, bir aşılama halkası ile elde edilen tek spor kültürlerinden saf mantar diskinden bir tutam alın ve kloramfenikol, laktik asit, ampisilin, rifampisin, tetrasiklin, streptomisin vb. ile takviye edilmiş PDA içeren Petri kaplarına aktarın.
- Depolama işleminden 5-10 gün önce 25 ± 1 °C'de 12 saat: 12 saat karanlık: aydınlık durumda büyütün. 1 cm x 1 cm genel amaçlı filtre kağıtlarını otoklavda 121 °C, 15 psi'de 60 dakika kesin ve sterilize edin.
- Filtre kağıtlarını aynı veya seçici ortama sahip yeni Petri kaplarına yerleştirin. Saf mantar kültüründen kolonileri/sporları kesin ve her parçanın üzerine yerleştirin.
- Petri kaplarını kapatın ve uygun büyüme koşullarında (yukarıda belirtildiği gibi) bir inkübatöre yerleştirin. Mantar izolatları filtre kağıdı üzerinde yavaş büyür. Tam kolonizasyonu sağlamak için yaklaşık 15 gün kuluçkaya yatırın.
- Filtre kağıtlarında sporülasyon veya tam koloni oluşumundan sonra, tek tek kağıt parçalarını kültür ortamı olmayan yeni bir petri kabına aktarın. Daha sonra, filtre kağıdı ve mantar tamamen kuruyana kadar (yaklaşık 20-30 gün) Petri kaplarını inkübatöre koyun.
- Kuruduktan sonra her bir steril kağıt zarfın içine 10 adet filtre kağıdı koyun, her zarfı etiketleyin, bu zarfları plastik poşetlere koyun ve zarfların bulunduğu plastik poşetleri -20 °C'de plastik ve şeffaf bir kapta saklayın.
- Yozgat'ta mercimek solgunluğu, kök ve taç çürüklüğü hastalığının yaygınlık oranını, her bir mercimek tarlasında hastalığın yaygınlığını ve ardından ilin ilçe adını göz önünde bulundurarak aşağıda verilen formüle göre hesaplayın.
Hastalık yaygınlık oranı (%) = (a / b) x 100
burada a, hastalıklı alanların sayısını gösterir; b, bir ilçede incelenen alanların toplam sayısını gösterir. - Bora ve Karaca20 tarafından bildirilen ağırlıklı ortalama yöntemine göre hastalığın görülme sıklığını hesaplayın. Tarladaki her karedeki bitkileri sayın. Bunları her karede hastalıklı ve hastalıksız bitkilere ayırın ve aşağıda verilen formüle göre hastalık prevalansını hesaplayın.
Hastalık yaygınlık oranı (%) = (x / y) x 100
burada x hastalıklı bitkilerin sayısını gösterir; Y, incelenen toplam bitki sayısını gösterir. - Öğüt21'in 0-4 ölçeğine göre hastalık şiddetini hesaplayın, burada 0 = hiçbir belirti göstermedi, 1 = yaprakların %25'inde hafif düzeyde semptomlar; 2 = yaprakların %26-50'sinde orta düzeyde semptomlar; 3= yaprakların %51-75'inde şiddetli kloroz ve solma; ve 4 = aynı sırayla %75'ten fazla bitkide çok şiddetli kloroz ve solma semptomları veya kuruma, dökülme, büyüme geriliği veya ölü yapraklar (Şekil 2).
- Elde edilen ölçek değerleri ile aşağıdaki formülü kullanarak hastalık şiddetini hesaplayın16.
Hastalık Şiddeti (%) = [∑ [ i (ni x vi) / (V) x N)] x 100
burada ölçek değerindeki bitki sayısı ni; VI ölçek değeri; V en yüksek ölçek değeri; N gözlenen toplam bitki sayısı; i, sınıf sayısını gösterir.
2. Meteorolojik veriler
- Anket çalışmaları yapın. Bu protokol için 2022 yılı Mayıs ve Haziran ayları ile 2023 dönemlerinde anket çalışmaları gerçekleştirilmiştir. 2022, 2023 yılı Mart-Temmuz dönemi ve uzun yıllara ait sıcaklık, bağıl nem ve toplam yağış değerlerini Yozgat İl Meteoroloji Müdürlüğü'nden temin ediniz (Tablo 1).
3. Morfolojik tanımlama
- Fusarium izolatlarının kültürel (koloni rengi, hava miselyumu, misel büyüme hızı) ve konidiyal (konidiyal boyutlar, şekil, renk ve septum sayısı) özelliklerini daha önceki çalışmalarınkilerle karşılaştırın ve mantar türlerini geçici olarak tanımlayın.
- Morfolojik tanımlamada kullanılacak gruplardan temsili örnekler seçin. Bu numuneleri yukarıda belirtildiği gibi tek spor izolasyon yöntemine göre saflaştırın. Bu süre zarfında, Fusarium izolatlarının koloni pigmentasyon özelliklerinin yanı sıra mikro/makrokonidia ve klamidospor yapılarını gözlemleyin.
- Elde edilen saf mantar kültürlerinde mikro/makrokonidia ve klamidosporlar gibi mikromorfolojik yapıların oluşumunu teşvik etmek için, bir inkübatörde 25 ± 1 °C'de ve 12 saat: 12 saat karanlık: 25-30 gün boyunca PDA'da inkübe edin. Işık mikroskobu ile her Fusarium izolatı için conidia'nın uzunluğunu ve genişliğini ölçün. Ek olarak, bir dijital kamerayla birlikte verilen bir ışık mikroskobu kullanarak conidia'nın yapısını, şeklini, rengini ve septasını veya septasını belgeleyin.
- Yukarıdaki gözlemlere dayanarak, Fusarium izolatlarını Leslie ve Suerell22'de açıklandığı gibi tür düzeyine göre gruplandırın.
4. Moleküler tanımlama
NOT: Fusarium izolatlarının toplam genomik DNA'sı, Cenis 23 protokolünden biraz modifiye edilmiş olan aşağıdaki yöntem kullanılarak ekstrakte edildi. Fusarium izolatlarının PCR analizleri ve elektroforezi Aras ve Endes24 tarafından tarif edilen protokol kullanılarak gerçekleştirildi.
- Mantar genomik DNA ekstraksiyonu
- PDA üzerinde yetiştirilen taze bir Fusarium izolat kültüründen (10 günlük), steril bir neşter ile 100 mg miselyum kazıyın ve daha sonra 2 mL'lik bir mikrosantrifüj tüpüne aktarın. Tüpleri gece boyunca -20 °C'de inkübe edin.
- Gece boyunca inkübasyondan sonra, tüplere 500 μL DNA ekstraksiyon tamponu (200 mM Tris-HCl pH: 8.5, 250 mM NaCl, 25 mM EDTA,% 0.5 Sodyum dodesil sülfat) ekleyin ve steril bir plastik tokmak ile ezin.
- Daha sonra, tüplere 150 μL 3M sodyum asetat (NaOAc) pH 5.2 ekleyin ve -20 °C'de 30 dakika inkübe edin. Bu aşamadan sonra, tüpleri 10 dakika boyunca 4.000 x g'da santrifüjleyin.
- Santrifüjlemeden sonra, tüpün üst kısmındaki 400 μL süpernatanı yeni tüplere (1.5 mL) aktarın ve eşit hacimde izopropanol (2-propanol) ekleyin. Yeni tüpleri -20 °C'de 30 dakika inkübe edin. Bu süre zarfında, tüpleri 5x veya 6x yavaşça karıştırın.
- Genomik DNA'yı çökeltmek için 10 dakika boyunca 4.000 x g'da santrifüjleyin ve tüplerde kalan tüm sıvıyı atın.
- Tüpün dibinde beyaz veya krem renkli bir tortu olarak genomik DNA peletine 1 mL %70 etanol ekleyin. Tüpü yaklaşık 1 dakika boyunca 4x-5x yukarı ve aşağı karıştırın ve tüplerdeki tüm etanolü atın. Ardından, DNA peleti üzerindeki etanolü tamamen buharlaştırmak için tüpleri laminer hava akışında 30 dakika açın.
- Genomik DNA'yı çözmek ve uzun süre saklamak için, tüplere 50 μL TE (1M Tris-HCl pH: 8.0; 0.5M EDTA pH 8.0) tampon çözeltisi ekleyin ve tüpleri 65 ° C'de 1 saat boyunca bir su banyosunda inkübe edin. Bu süre zarfında, tüpü yavaşça 8x-10x yukarı ve aşağı karıştırın. TE tampon çözeltisi içinde çözünen genomik DNA'yı moleküler çalışmalarda kullanılmak üzere -20 °C'lik derin dondurucuda saklayın.
- PCR çalışmaları için, rDNA 25'in ITS bölgesini amplifiye etmek için oligonükleotid primerleri ITS5 F (5'GGAAGTAAAGTCGTAACAAGG3') /ITS4 R (5'TCCTCCGCTTATTGATATGC3') kullanın. Her PCR reaksiyonunu 2.5 μL 10x PCR tamponu, 2.5 μL MgCl2 (25 mM), 2.5 μL dNTP (2 mM), her primerden 0.5 μL (10 μM), 2 μL şablon DNA, 0.5 μL Taq DNA polimeraz (1 U/μL, Fermantas) ve 14 μL sQH2O ile toplam 25 μL hacimde gerçekleştirin.
- 25 μL PCR reaksiyonu için, aşağıdaki PCR programını 95 °C'de 2 dakika (ilk denatürasyon), ardından 40 döngü çalıştırın; 30 sn için 95 °C (denatürasyon), 45 sn için 55 °C (tavlama), 90 sn için 72 °C (uzatma) ve 5 dk için 72 °C (son uzatma). 1x TAE (Tris Baz - Buzul Asetik Asit - EDTA) tampon çözeltisinde hazırlanan% 1.5 agaroz jel içinde 90 V'ta 1.5 saat boyunca elektroforez PCR ürünleri.
- Jel elektroforezi için TAE tamponu hazırlamak için 242 g Tris bazını 700 mL steril suda çözün; 57.1 mL Buzlu asetik asit ekleyin; 100 mL 0,5 M EDTA solüsyonunu ekleyin ve steril su ekleyerek hacmi 1 L'ye ayarlayın. 1 L 50x TAE tamponunun son pH'ını 8,5'e ayarlayın. 1x TAE çalışma tamponunu yapmak için, 50x TAE tamponunun 1 kısmına 49 kısım steril su ekleyin.
- Jelleri 0,5 μg/mL etidyum bromür ile boyayın ve bir UV transilluminatöründe görünür hale getirerek görsel olarak inceleyin.
- Kök ve taç çürüklüğü ajan izolatları arasındaki filogenetik ilişkiyi incelemek için, bir satıcı aracılığıyla çift yönlü olarak (5'-3' ve 3'- 5') sentezlenen PCR ile ITS gen baz dizilerini elde edin. Blast programını kullanarak baz dizilerini NCBI (Ulusal Biyoteknoloji Bilgi Merkezi) web sitesindeki gen verileriyle ve dünyadaki diğer Fusarium izolatlarının ITS geninin baz dizileriyle karşılaştırın. Aşağıda açıklandığı gibi tür düzeyinde izolatları tanımlamak için bunu kullanın.
- https://www.ncbi.nlm.nih.gov web sitesine gidin. Popüler Kaynaklar bölümündeki BLAST sekmesine tıklayın.
- Yeni penceredeki Nucleotide BLAST sekmesine tıklayın. Yeni pencerede yer alan Enter Query Sequence (Sorgu Sırasını Girin) bölümünde, temel dizileri Fasta formatında girin ve İş Unvanı kısmına etüdün adını yazın.
- Daha sonra alt kısımda bulunan Choose Search Set (Arama Kümesi Seç) kısmında Database sekmesinde Standard databases (nr etc.) seçeneğini işaretleyiniz.
- Program Seçimi bölümündeki Optimize for sekmesinde Highly similar sequences (megablast) seçeneğini işaretleyin ve sayfanın altındaki BLAST sekmesine tıklayın.
- Fusarium izolatları arasındaki filogenetik ilişkiyi belirlemek için MEGA 11 filogenetik analiz programını kullanın. ClustalW programını kullanarak baz dizilerini hizalayın ve ITS geni26 için maksimum cimriliğe göre izolatların genetik aile ağaçlarını oluşturun.
- Mega yazılımını indirmek için https://www.megasoftware.net web sitesine gidin ve Mega yazılımını yükleyin. MEGA yazılımı, araştırma ve eğitimde kullanılmak üzere ÜCRETSİZ olarak sağlanmaktadır.
- İlk olarak, dizileri masaüstüne FASTA formatında bir Not Defteri dosyası (.txt) olarak kaydedin. Mega yazılım programını çalıştırın ve ALIGN sekmesine tıklayın. Pencerede Hizalamayı Düzenle/Oluştur'a tıklayın. Ardından, kontrol edin Yeni Bir Hizalama Oluştur yeni pencerede ve onaylamak için Tamam'a tıklayın.
- DNA sekmesine tıklayın. 1'i silin. Pencerede otomatik olarak görünen sıra ve Dosyayı düzenle'ye gidin, ardından Dosyadan Sıra Ekle sekmesine tıklayın. Dizileri içeren ve masaüstünde bulunan Not Defteri (.txt) dosyasını açın.
- Bu aşamada, tüm diziler ekranda belirir. Önce ekranda görünen Herhangi Bir Diziye tıklayın, ardından tüm dizileri CTRL + A ile işaretleyin. Alignment (Hizalama) dosyasını açın ve oradan Align by Clustal W (Clustal W ile Hizala ) seçeneğine tıklayın ve programı varsayılan ayarlarda çalıştırmak için OK (Tamam ) butonuna tıklayın.
- Dizilerin hizalanmasındaki farklılıkları inceledikten sonra, Veri dosyasına gidin, Filogenetik Analiz'e tıklayın ve ardından dizilerin protein sentezleyip sentezlemediğini görmek için penceredeki onay kutusunda Hayır'a tıklayın. Dizilerimiz proteinleri sentezlemezler çünkü bunlar ITS bölgesine aittir.
- Mega yazılımının ana penceresine dönün. Filogeni'ye tıklayın ve Maksimum Parsimony Ağaç(lar)ını Oluştur/Test Et'i seçin. Yeni pencerede, Filogeni testi için Bootstrap Yöntemi'ni seçin ve Dal gücünü test etmek için bootstrap değerlerini 1.000 girin. Boşluklar/eksik Veri İşleme sekmesinde Kısmi Silme'yi seçin, MP arama yöntemi olarak Alt Ağaç-budama-Yeniden Aşılama (SPR) seçeneğini belirleyin ve işlemleri onaylamak için Tamam'a tıklayın.
- Analiz sonucunun Filogenetik ağacı göstermesini bekleyin.
5. Patojenite testi
- Moleküler yöntemlerle tanımlanan Fusarium türlerinden her temsili tür için patojenite çalışmaları için dört izolat kullanın. Klimalı bir odada 24 °C'de, 16 saat floresan ışığında / 8 saat karanlık fotoperiyotta, %65 nemde patojenite çalışmaları gerçekleştirin.
- Mercimek tohumlarını 5 cm çapında 45 delikli siyah plastik şişelere ekin. Her şişeyi 3 dakika% 1 sodyum hipoklorit içinde tutun ve ardından 3 kez steril damıtılmış su ile durulayın. Tohumları steril bir dolapta 24 saat kurutun ve her deliğe bir tohum ekin.
NOT: Tüm patojenite testlerinde hastalığa duyarlı Kayı 91 çeşidinin mercimek tohumları kullanılmıştır6. Aşılama yöntemi olarak fide daldırma tekniği kullanılmıştır27. - Her izolatın saf kültürlerini PDA'da 24 ° C'de 7-10 gün inkübe edin. Stok kültüründen yetiştirilen kolonileri bir spatula ile ortamın yüzeyinden kazıyın ve steril damıtılmış su kullanarak spor/miselyum süspansiyonunu hazırlayın.
- 4 katmanlı bir tülbentten süzülerek süspansiyondaki büyük kalıntıları çıkarın ve spor/miselyum konsantrasyonunu bir hemositometre yardımıyla 1 x 106 spor/mL'ye ayarlayın.
- Bu aşamadan sonra, daha önce şişelerde yetiştirilen fidelerin köklerini 2-3 gerçek yaprakları olduğunda sökün. Musluk suyunda yıkayın ve steril bir iğne ile kökleri hafifçe yaralayın. Bu fideleri hazırlanan spor/miselyum süspansiyonuna 3 dakika daldırın ve ardından steril toprak/turba (2:1; h/h) karışımı içeren plastik şişelere nakledin.
- Kontrol olarak kullanılan fideler için köklerini sökün, yaralayın ve ardından sadece steril suya batırarak dikin. Aşılama işleminden 3 hafta sonra 0-4 ölçeğine göre patojenite test değerlendirmeleri yapın.
- Hesaplanan hastalık şiddet değerleri açı dönüşümüne tabi tutulduktan sonra elde edilen değerler varyans analizine tabi tutulmuş ve Tukey'in HSD (p=0.05) testine göre ortalamalar arasındaki farklar değerlendirilmiştir. Hastalık şiddeti: %0-%15 olan izolatlar çok düşük virülanslı (LV), %16-%35 oranlı izolatlar düşük virülanslı (LV), %36-%50 olan izolatlar orta virülanslı (O), %51-%70 oranlı izolatlar yüksek virülanslı (VV), %71-%100 oranlı izolatlar çok yüksek virülanslı (VV) ve hastalık semptomu olmayan izolatlar saprofit veya epifitik izolat olarak değerlendirildi.
Sonuçlar
Hastalık parametrelerinin belirlenmesi
Yozgat'ın dokuz farklı bölgesini kapsayan toplam 83 mercimek ekim alanı, 1.1984 x 106 m2'lik bir alana yayılan solgunluk, kök ve taç çürüklüğü hastalığı belirtileri açısından değerlendirilmiştir (Tablo 2). Solgunluk veya kök çürüklüğü hastalığı semptomları ile her alanda karşılaşılmıştır. Ancak Yozgat'ta solgunluk ve kök çürüklüğü hastalığının görülme sıklığı %16,9 olarak belirlenmiş, hastalık şiddeti Sorgun ve Sarıkaya ilçelerinde ise %38,6'dır. Hastalığın görülme sıklığı Şefaatli (%26.4), Boğazlayan (%23.0) ve Sorgun (%20.1) ilçelerinde de tespit edilmiştir. Paradoksal olarak en yüksek hastalık şiddet yüzdesi %45,2 ile Sorgun ilçesinde belirlenirken, bunu %36,0 ile Boğazlayan ve %35,4 ile Sarıkaya izledi. Ayrıca, incelenen işaretli alanların mercimek tarlalarından toplanan örneklerde 679 bitki hastalık belirtileri göstermiştir (Tablo 3). Bunu, iki gruba ayrılan izole fungal ajanların morfolojik olarak tanımlanması izledi. İlk grupta sınıflandırılan fusarium izolatları, Alternaria sp., Ascochyta sp. ve Rhizoctonia sp. gibi patojenleri veya saprofitleri içeriyordu. Fusarium izolatlarının izolasyon oranı yüzdesi %95.4 idi. Yozgat'ta hastalık belirtileri gösteren mercimek bitkilerinden en çok izole edilen mantar türü olarak %59,5'lik izolasyon oranı yüzdesi ile F. oxysporum belirlenmiştir. Bu patojen Fusarium türünü F. graminearum (%15.8) ve F. culmorum (%10.2) izledi. Paradoksal olarak, F. solani (%4.4) ve F. acuminatum (%5.5) hastalık belirtileri gösteren bitkilerden daha düşük seviyelerde izole edildi. Anket çalışmasının yapıldığı tüm ilçelerden F. oxysporum elde edilmiş, ilçelere göre izolasyon oranı yüzdesi %45.3 ile %72.2 arasında dağılmıştır. Yozgat'ın Merkez (%72.2), Şefaatli (%71.9), Akdağmadeni (%68.3) ve Sorgun (%62.2) ilçelerinde en fazla F . oxysporum izole edilmiştir. Buna karşılık, F. solani ve F. acuminatum Yozgat'ta en az izole edilen Fusarium türleridir. F. solani , Çekerek ve Merkez ilçelerinden tecrit edilmedi; F. acuminatum ayrıca Akdağmadeni, Merkez ve Şefaatlı ilçelerinden izole edilmemiştir (Tablo 3).
Morfolojik tanımlama
Fusarium izolatlarının saf kültürleri, koloni karakterlerinin yanı sıra mikro-konidia, makro-konidia ve klamidospor yapılarına göre morfolojik olarak tanımlandı. Leslie ve Summerell22'ye göre tanımlama çalışmaları tür düzeyinde gerçekleştirilmiştir. Mercimeklerde solgunluk, kök ve kök boğazı çürüklüğü belirtileri gösteren bitkilerden elde edilen tüm mantar izolatları koloni ve mikromorfolojilerine göre altı grupta toplanmıştır (Tablo 3). İlk beş grupta Fusarium türüne ait izolatlar yer alırken, diğer grupta Fusarium cinsi dışında kalan Alternaria, Rhizoctonia ve Ascochyta gibi patojen mantar izolatları yer alıyordu.
En yüksek izolasyon oranına sahip F. oxysporum izolatları beyazdan sarıya kolonilere ve leylak-mor pigmentasyona sahiptir. Makrokoni kısa ila orta uzunlukta, hafif eğri ve genellikle 3-5 septalıdır. Bazı izolatların spor yapısı, 33.8 ila 71.5 μm x 3.1 ila 4.5 μm olarak belirlenen makrokonidia boyutları ile hafifçe bağlanır. Mikrokonidia genellikle septasyonsuz, oval, eliptik veya böbrek şeklindedir. Klamidospor oluşumu yavaş yavaş meydana geldi (4-6 hafta). Çift kümeler halinde ve kısa zincirli bir yapıda gözlenmiştir16.
En yüksek izolasyon oranına sahip ikinci tür olan F. graminearum izolatları, beyaz-pembe hava miselyumuna ve koyu kırmızı pigmentasyona sahiptir. Macroconidia ince, düz veya hafif kavislidir ve beş ila yedi septalıdır. Septa oldukça belirgindir. Sivri bir apikal hücreye ve belirgin şekilde ayak şeklinde bir bazal hücreye sahiptir. Boyutlar 25,7 ila 97,3 μm x 3,5 ila 5,5 μm'dir. Mikrokonidia ve klamidospor oluşumu gözlenmedi28.
Üçüncü grupta yer alan F. culmorum izolatlarının kolonileri başlangıçta beyaz renkliyken, yaşla birlikte açık pembe ila koyu pembe misel yapısı gözlenmiştir. Macroconidia kısa, 4-6 bölmeli ve hafif kavislidir. Makrospor boyutları; 15,8 - 60,0 μm x 3,2 - 5,1 μm. Onlar çoktur. Mikrosporlar gözlenmedi. Klamidospor oluşumu diğer türlere göre hızlıdır (3-5 hafta). Tek başlarına veya ikişerli kümeler halinde bulunurlar29.
Dördüncü türün kolonileri olan F. acuminatum isolatları, soluk turuncu, turuncu ve açık bordodur. Nispeten yavaş büyüyen bir türdür. Makrokonidiaları incedir, belirgin bir eğriliğe sahiptir ve 3-5 bölmeli bir yapıya sahiptir. Makrokonidia boyutları 31.0-65.5 × 4.3-6.6 μm olarak belirlendi. Microconidia'nın 0 ve 1 bölmesi vardır. Mikroskobik görüntülerde nadir olarak gözlenmiştir. Klamidospor oluşumu çok yavaştır (6 haftadan fazla). Zincirler ve kümeler halinde oluşur22.
Tanımlanan son patojenik tür olan F. solani izolatının koloni rengi beyaz ve krem renklidir. Makrokonyası geniş, düz ve hafif kavislidir. Hifler 3-7 bölmeli ve bol miktarda bulunur. Makrospor boyutları 20.2 ila 50.6 μm x 3.1 ila 6.2 μm olarak belirlenmiştir. Mikrokonidia bölünmemiş veya 1 bölünmüştür. Oval ve elipsoid yapıdadırlar. Klamidosporlar, 2-4 hafta içinde CLA ortamında kısa zincirler halinde terminal olarak bulunur30.
Moleküler tanımlama
PCR, Fusarium izolatlarından elde edilen toplam genomik DNA ile ITS4/ITS5 primerleri kullanılarak gerçekleştirildi. Çift yönlü (5'-3' ve 3'-5') baz dizileri kaydedildi ve Blast programı kullanılarak diğer NCBI GenBank ile karşılaştırıldı (Tablo 4 ve Tablo 5). F. oxysporum izolatları, Hindistan (MT740398), Litvanya (KF646094) ve Almanya'dan (MT453296) izolatlarla %99.5 ila %100 nükleotid dizisi homojenliği göstermiştir. F. culmorum izolatları, Kanada (AY147290), Fransa (OW983123) ve Çekya'dan (MT453296) gelen izolatlarla %100 nükleotid dizisi homojenliği göstermiştir. F. graminearum izolatları, Kolombiya (MT598163) ve Çin'den (ON527490) izolatlarla %99.5 ila %100 nükleotid dizi homojenliği göstermiştir. F. acuminatum izolatları, Özbekistan (OR975902) ve Çin'den (MZ424810, PP336554) gelen izolatlarla %99.5 ila %100 nükleotid dizi homojenliği göstermiştir. F. solani izolatları, Mısır (OR713084), Çin (PQ482231) ve Hindistan'dan (OP848138) izolatlarla %100 nükleotid dizisi homojenliği göstermiştir. Daha sonra Mega 11 programı kullanılarak Maksimum Parsimoni (MP) yöntemine göre elde edilen filogenetik ağaç ile Fusarium izolatları arasındaki genetik ilişki belirlenmiştir (Şekil 3). MP filogenetik ağacında, boşluklar dahil 638 nükleotid karakteri kullanılmış ve bu nükleotidlerin 145'i cimrilik sağlayan bilgilendirici bölgeler olarak belirlenmiştir. MP analizleri en cimri ağaçlardan birini verdi (Şekil 3; Ağaç Uzunluğu: 172; tutarlılık indeksi (ConI): 0.974; Tutma İndeksi (RI): 0.961; Bileşik Endeks (ComI): 0.7600). Fusarium izolatlarının bu MP dendrogramı incelendiğinde, soy ağacı ilk olarak iki ana dala ayrılmıştır. Bunlardan ilki, %100 bootstrap değeri ile desteklenen tüm F. solani izolatlarına karşılık geldi. Diğer ana dal ise %78 bootstrap değeri ve F. acuminatum, F. redolens, F. proliferatum ve F. acutatum olmak üzere dört alt grup ile kendi içinde toplanmıştır. Diğer ana dal ise F. oxysporum, F. culmorum, F. graminarum, F. pseudograminearum ve F. equiseti olmak üzere beş alt gruba ayrıldı ve bootstrap değeri %97 oldu.
Fusarium izolatlarının virülans seviyelerinin belirlenmesi
Morfolojik ve moleküler karakterizasyon çalışmaları tamamlanan solgunluk ve kök çürüklüğü gösteren mercimeklerden izole edilen Fusarium spp.'nin patojenite çalışmalarının sonuçları Tablo 6 ve Şekil 4'te özetlenmiştir. Genel olarak tüm Fusarium izolatları, Kayı 91 mercimek çeşidi F(19-60; 0.05) = 43.06; s< 0.0001). En öldürücü izolatlar F. oxysporum (YBUFol4), F. culmorum (YBUFc1, YBUFc2) ve F. graminearum (YBUFg1, YBUFg3) idi. Bu beş izolatın çok yüksek virülans seviyesine sahip olduğu bulundu. Öte yandan, F. oxysporum (YBUFol2), F. solani (YBUFs1) ve F. graminearum'un (YBUFg2) her birinin bir izolatının orta derecede virülansa sahip olduğu bulundu. Ek olarak, F. acuminatum (YBUFa1, YBUFa2, YBUFa3 ve YBUFa4) izolatlarının zayıf veya düşük virülansa sahip olduğu bulundu. Patojenite çalışmalarında kullanılan tüm izolatlar %42.5 ile %97.5 arasında değişmekte olup, mercimek fidelerinin aşılanmasından sonra elde edilmiştir.

Şekil 1: Fusarium türlerinden etkilenen mercimek bitkileri . (A) Hastalık şiddeti yüksek bir mercimek tarlasındaki lokalize hastalıklı alanların genel görünümü. (B) Hastalık şiddeti olan bitkilerin görünümü 4. (C) Hastalık şiddeti olan bitkilerin görünümü 3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mercimek bitkilerinin hastalık şiddet düzeyleri 0 - 4'teki görünümü. Seviye 0 = hiçbir belirti göstermedi, 1 = %25'inde yaprak belirtileri; 2 = %26-%50; 3 = yaprakların %51-%75'i; 4 = aynı sırada %75'ten fazla. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
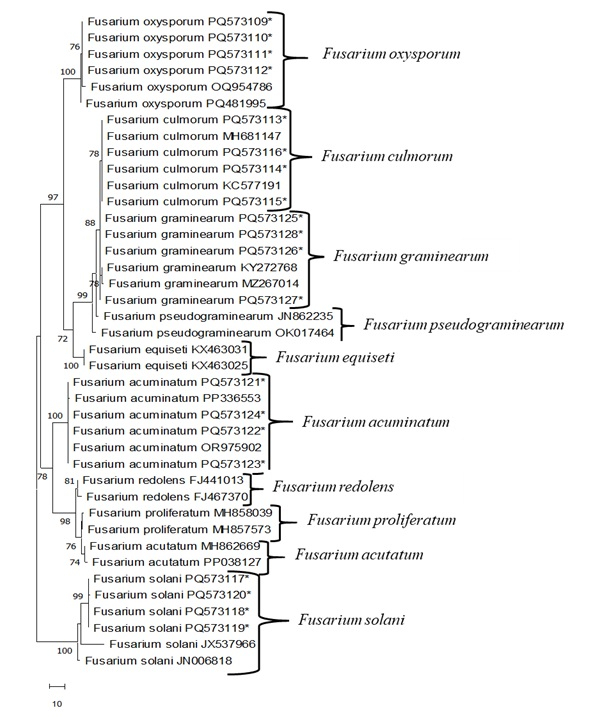
Şekil 3: Fusarium sp.'nin ITS bölgesine göre MEGA 11 kullanan en cimri köksüz ağaç.İzolatlar yıldızlarla gösterilir. Geri kalanı GenBank'tan alınır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
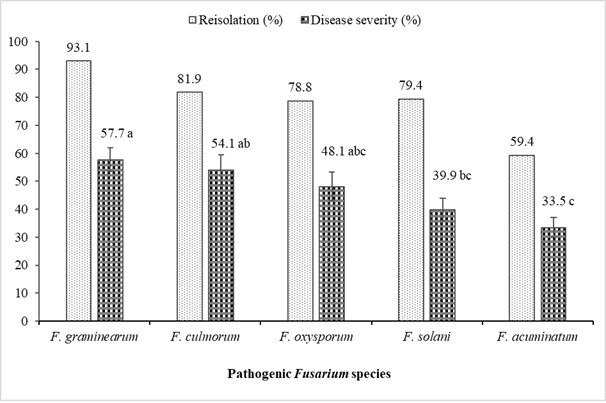
Şekil 4: Mercimek bitkilerinden izole edilen Fusarium spp.'nin reizolasyonu (%) ve hastalık şiddet oranları (%) Dikey çizgiler, çubuktaki standart hatayı temsil eder (n = 16). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Sıcaklık (°C) | Bağıl nem (%) | Yağış (mm) | |||||||
| Ay | 2022 | 2023 | Uzun vadeli | 2022 | 2023 | Uzun vadeli | 2022 | 2023 | Uzun vadeli |
| Akdağmadeni | |||||||||
| Mart | 11.1 | 7.4 | 3.8 | 45.1 | 68.8 | 71.1 | 21.4 | 78.7 | 60.6 |
| Nisan | 11.1 | 11.4 | 8.8 | 59.2 | 67 | 61.5 | 56.5 | 109.8 | 42.6 |
| Mayıs | 16.3 | 15.1 | 12.9 | 64.3 | 73.9 | 64.8 | 48.5 | 83.6 | 74.1 |
| Haziran | 16.5 | 18.4 | 16.2 | 63.4 | 53.2 | 69.1 | 0.3 | 20.1 | 57.2 |
| Temmuz | 22 | 22.2 | 18.7 | 48 | 40.5 | 60.5 | 1.4 | 0 | 7 |
| Boğazlıyan | |||||||||
| Mart | 12.3 | 9.9 | 5.2 | 47.8 | 65.5 | 66 | 13 | 64 | 40.1 |
| Nisan | 12.8 | 13.5 | 10.2 | 62.6 | 66.6 | 59.3 | 20.2 | 24.2 | 24.4 |
| Mayıs | 18.7 | 17.7 | 14.6 | 62.5 | 67.4 | 61.2 | 65.4 | 20 | 35.1 |
| Haziran | 19.7 | 20.6 | 18.6 | 52.9 | 49.9 | 59.9 | 0 | 2.4 | 35.5 |
| Temmuz | 24.3 | 24 | 21.7 | 42.5 | 39.5 | 50 | 0 | 0 | 3.9 |
| Çekerek | |||||||||
| Mart | 13.5 | 10.8 | 6.6 | 52.8 | 70.4 | 69 | 24.3 | 111.3 | 48.7 |
| Nisan | 14.1 | 13.9 | 11.5 | 63.9 | 72.3 | 61 | 48.1 | 73.4 | 32 |
| Mayıs | 19.3 | 18.6 | 15.8 | 69.1 | 72.7 | 65.4 | 80.3 | 69 | 59.3 |
| Haziran | 20.1 | 21.8 | 19.4 | 61.5 | 57.5 | 67.8 | 0 | 16.4 | 62.8 |
| Temmuz | 24.6 | 24.7 | 22 | 57.8 | 52.4 | 57.5 | 33.2 | 0 | 10.9 |
| Yozgat | |||||||||
| Mart | 11.5 | 8.4 | 4 | 47.3 | 68.7 | 67.5 | 14.6 | 84.8 | 87.3 |
| Nisan | 12.4 | 12.7 | 9.3 | 60.1 | 65.2 | 58.7 | 47.4 | 54.4 | 41.9 |
| Mayıs | 17.5 | 16.8 | 13.7 | 64.2 | 68 | 60.2 | 92.6 | 61.6 | 72.2 |
| Haziran | 18.3 | 20.3 | 17.4 | 57.9 | 50.7 | 61.2 | 1 | 4.8 | 63.6 |
| Temmuz | 22.9 | 23.6 | 20.5 | 50.9 | 44.3 | 52.7 | 7 | 0.2 | 8.8 |
| Saraykent | |||||||||
| Mart | 14.8 | 9 | 6.2 | 50.9 | 71.1 | 71 | 11.1 | 77.3 | 55.3 |
| Nisan | 12.5 | 12.3 | 10.5 | 64.6 | 73.2 | 60.7 | 35.3 | 36.1 | 29 |
| Mayıs | 17.6 | 16.4 | 14.2 | 69.1 | 76.7 | 65.9 | 47.8 | 72.4 | 57 |
| Haziran | 18.2 | 19.2 | 18.2 | 63.8 | 61 | 69.6 | 0 | 28.6 | 56.1 |
| Temmuz | 23.2 | 23.1 | 21.6 | 54.2 | 51.7 | 57.9 | 0 | 0 | 7.4 |
| Sarıkaya | |||||||||
| Mart | 12.9 | 9.6 | 5.6 | 47 | 68.2 | 66.5 | 18.4 | 75.5 | 53.6 |
| Nisan | 13.2 | 13.1 | 10.7 | 59 | 68.8 | 56.5 | 24.8 | 60.6 | 27.2 |
| Mayıs | 18.5 | 17.3 | 14.7 | 63.2 | 71.6 | 60.6 | 57.6 | 64.5 | 47.2 |
| Haziran | 18.9 | 20.5 | 18.4 | 59 | 53.9 | 62 | 0 | 16.1 | 50.6 |
| Temmuz | 24 | 24 | 21.3 | 48.6 | 45.4 | 51.5 | 0 | 0 | 6.4 |
| Şefaatli | |||||||||
| Mart | 13.1 | 10.6 | 6.2 | 48.2 | 61.1 | 67 | 12.6 | 71.5 | 50.2 |
| Nisan | 11.2 | 14.3 | 11.1 | 61.6 | 60.9 | 58.6 | 48.4 | 50.5 | 26 |
| Mayıs | 19.9 | 18.6 | 15.4 | 66.7 | 61.9 | 62.3 | 65.2 | 95.4 | 53.7 |
| Haziran | 20.4 | 22.2 | 19.7 | 55.8 | 45.5 | 61.2 | 1.2 | 2.5 | 46.8 |
| Temmuz | 25 | 25.3 | 23.2 | 47.9 | 39.5 | 47.1 | 0 | 0 | 4.1 |
| Sorgun | |||||||||
| Mart | 12.2 | 9.4 | 4.8 | 48.4 | 68.2 | 67 | 21.6 | 104.2 | 49.8 |
| Nisan | 13 | 13.3 | 10.1 | 59.7 | 66.1 | 58.9 | 53.2 | 33.8 | 31.7 |
| Mayıs | 18.3 | 17.4 | 14.5 | 63.7 | 69.1 | 60.9 | 56.6 | 89.6 | 44.2 |
| Haziran | 18.9 | 20.3 | 18.3 | 56.8 | 53.4 | 61.5 | 0 | 16.6 | 55.2 |
| Temmuz | 23.7 | 23.7 | 21.2 | 50 | 44.9 | 52.9 | 4 | 0 | 7.5 |
| Yerköy | |||||||||
| Mart | 15 | 12.1 | 6 | 41.2 | 60.5 | 61.3 | 4.4 | 46.1 | 60.1 |
| Nisan | 16.2 | 16.2 | 13.5 | 54.8 | 60.4 | 50.9 | 40.9 | 46.8 | 23 |
| Mayıs | 21.5 | 20.6 | 17.4 | 55.4 | 59.6 | 52.2 | 57 | 23.6 | 35.1 |
| Haziran | 23 | 24.5 | 20.9 | 45.2 | 41.4 | 56.4 | 0.2 | 0 | 39.1 |
| Temmuz | 27.5 | 27.7 | 24.4 | 38.2 | 35.5 | 42.2 | 0.2 | 0 | 3.5 |
Tablo 1: Mercimek üretim sezonunda incelenen yerin yıllara göre meteorolojik verileri.
| County | Alan Sayısı | Etüt Yapılan Ekim Alanı (Dekar) | Hastalık Prevalansı (%) | Hastalık İnsidansı (%) | Hastalık Şiddeti (%) |
| Akdağmadeni | 4 | 43.2 | 100 | 7 | 21.8 |
| Boğazlıyan | 4 | 86.4 | 100 | 23 | 36 |
| Çekerek | 1 | 2.7 | 100 | 1.6 | 14.4 |
| Merkez | 3 | 24.3 | 100 | 5.8 | 23 |
| Saraykent | 6 | 53.3 | 100 | 8.1 | 28.2 |
| Sarıkaya | 12 | 189.3 | 100 | 17 | 35.4 |
| Sorgun | 48 | 683.2 | 100 | 20.1 | 45.2 |
| Şefaatli | 2 | 73.7 | 100 | 26.4 | 23.4 |
| Yerköy | 3 | 42.3 | 100 | 9.1 | 32.9 |
| Genel | 83 | 1198.4 | 100 | 16.9 | 38.6 |
Tablo 2: Mercimek tarlalarında hastalık parametreleri, prevalansı, insidansı ve solgunluk, kök ve kök boğazı çürüklüğünün şiddeti.
| County | İzolasyon için kullanılan bitki sayısı | İzolasyon frekansı (%) | |||||
| F. oksisporum | F. culmorum (Kültür) | F. solani | F. aküminatum | F. graminearum | Diğer | ||
| Akdağmadeni | 41 | 68.3 | 9.8 | 2.4 | 0 | 14.6 | 4.9 |
| Boğazlıyan | 57 | 54.4 | 1.8 | 12.3 | 7 | 15.8 | 8.8 |
| Çekerek | 21 | 52.4 | 4.8 | 0 | 23.8 | 9.5 | 9.5 |
| Merkez | 36 | 72.2 | 11.1 | 0 | 0 | 13.9 | 2.8 |
| Saraykent | 64 | 45.3 | 12.5 | 7.8 | 4.7 | 21.9 | 7.8 |
| Sarıkaya | 148 | 56.8 | 11.5 | 7.4 | 5.4 | 15.5 | 3.4 |
| Sorgun | 233 | 62.2 | 9.4 | 1.3 | 7.3 | 16.3 | 3.4 |
| Şefaatli | 32 | 71.9 | 15.6 | 3.1 | 0 | 9.4 | 0 |
| Yerköy | 47 | 57.4 | 14.9 | 4.3 | 2.1 | 14.9 | 6.4 |
| Genel | 679 | 59.5 | 10.2 | 4.4 | 5.5 | 15.8 | 4.6 |
Tablo 3: Türkiye'nin Yozgat ilinden mantar izolasyon sıklığı için numune alınan mercimeklere ilişkin bilgiler.
| Fusarium türleri | Ayırmak | County | İzolasyon kaynağı | GeneBank erişim numarası |
| F. oksisporum | YBUFol1 | Sorgun | Kök | PQ573109 |
| YBUFol2 | Boğazlayan | Kök boğazı | PQ573110 | |
| YBUFol3 | Sarıkaya | Kök | PQ573111 | |
| YBUFol4 | Akdağmadeni | Kök | PQ573112 | |
| F. culmorum (Kültür) | YBUFc1 | Sorgun | Kök | PQ573113 |
| YBUFc2 | Yerköy | Kök | PQ573114 | |
| YBUFc3 | Sarıkaya | Kök | PQ573115 | |
| YBUFc4 | Saraykent | Kök boğazı | PQ573116 | |
| F. solani | YBUF'lar1 | Yozgat | Kök | PQ573117 |
| YBUFs2 | Sorgun | Kök | PQ573118 | |
| YBUFs3 | Sefaatlı | Kök | PQ573119 | |
| YBUFs4 | Sarıkaya | Kök | PQ573120 | |
| F. aküminatum | YBUFa1 | Çekerek | Kök | PQ573121 |
| YBUFa2 | Boğazlayan | Kök boğazı | PQ573122 | |
| YBUFa3 | Sarıkaya | Kök boğazı | PQ573123 | |
| YBUFa4 | Sorgun | Kök | PQ573124 | |
| F. graminearum | YBUFg1 | Yozgat | Kök | PQ573125 |
| YBUFg2 | Sorgun | Kök | PQ573126 | |
| YBUFg3 | Saraykent | Kök | PQ573127 | |
| YBUFg4 | Sarıkaya | Kök boğazı | PQ573128 |
Tablo 4: Filogenetik çalışmada Türkiye'nin merkezi Yozgat ilinden mercimek (Lens culinaris) izolatları kullanılmıştır.
| Fusarium türleri | Ayırmak | Ülke | İzolasyon kaynağı | GenBank katılım numarası |
| F. aküminatum | AAG4 | Yok | Prunus persica | OR975902 |
| WHWNSHJ1 | Çin | Malus domestica | PP336553 | |
| F. acutatum | CBS 739.97 | Hindistan | Yok | MH862669 |
| NSF1 Serisi | Mısır | Tetraena alba | PP038127 | |
| F. culmorum (Kültür) | 2090 | Hindistan | Yok | KC577191 |
| G49 Serisi | Polonya | Pisum sativum (Pisum sativum) | MH681147 | |
| F. eşitlik | Fusarium equiseti A577 Serisi | Çin | Paçuli | KX463031 |
| Fusarium equiseti A571 Serisi | Çin | Paçuli | KX463025 | |
| F. graminearum | Wm-233 Serisi | Çin | Yok | MZ267014 |
| 16a | Yok | Yok | KY272768 | |
| F. oksisporum | YBUFoc4 | Türkiye | Cicer arietinum | OQ954786 |
| LuC-8 Serisi | Çin | Kasımpatı x morifolium | PQ481995 | |
| F. çoğalma | CBS 246.61 | Almanya | Yok | MH858039 |
| CBS 186.56 | Yok | Yok | MH857573 | |
| F. psödograminearum | WZ-8A Serisi | Çin | Buğday | JN862235 |
| GAAET080 | Çin | Mısır | OK017464 | |
| F. redolens | M11 Serisi | Yok | Mantar | FJ441013 |
| 2008 | Yok | Mantar | FJ467370 | |
| F. solani | S2-27 | Fransa | Yok | JX537966 |
| UENFCF279 | Brezilya | Guava | JN006818 |
Tablo 5: Filogenetik çalışmada GenBank'tan kullanılan Fusarium türlerinin dizileri.
| Fusarium türleri | Ayırmak | Hastalık şiddeti (%) a | İzolatın virülans seviyesi | Yeniden izolasyon (%) |
| (Standart Hata ± Ortalama) | ||||
| F. oksisporum | YBUFol1 | 20. 0 ± 1.1 i | Zayıf | 62.5 |
| YBUFol2 | 56,9 ± 1.2 cde | Orta | 85 | |
| YBUFol3 | 42.5 ± 1.0 efg | Daha az | 77.5 | |
| YBUFol4 | 73.1 ± 3.9 AB | Son derece | 90 | |
| F. culmorum (Kültür) | YBUFc1 | 72,5 ± 1,0 AB | Son derece | 95 |
| YBUFc2 | 72,5 ± 2,7 AB | Son derece | 95 | |
| YBUFc3 | 23.6 ± 1.6 Merhaba | Zayıf | 60 | |
| YBUFc4 | 48.1 ± 2.6 Savunma | Daha az | 77.5 | |
| F. solani | YBUF'lar1 | 58.8 ± 1.6 bcd | Orta | 97.5 |
| YBUFs2 | 46.9 ± 2.1 Savunma | Daha az | 75 | |
| YBUFs3 | 17.5 ± 2.3 i | Zayıf | 65 | |
| YBUFs4 | 36.3 ± 1.6 fgh | Daha az | 80 | |
| F. aküminatum | YBUFa1 | 42.5 ± 2.3 efg | Daha az | 65 |
| YBUFa2 | 16.9 ± 2.8 i | Zayıf | 42.5 | |
| YBUFa3 | 30.6 ± 6.1 Merhaba | Daha az | 62.5 | |
| YBUFa4 | 44.1 ± 7.1 Defg | Daha az | 67.5 | |
| F. graminearum | YBUFg1 | 76,3 ± 2,2 bir | Son derece | 97.5 |
| YBUFg2 | 50.6 ± 3.3 Savunma | Orta | 92.5 | |
| YBUFg3 | 68.1 ± 2.1 ABC | Orta | 95 | |
| YBUFg4 | 35.6 ± 1.9 fgh | Daha az | 87.5 |
Tablo 6: Fusarium türlerinin mercimek bitkileri üzerindeki patojenite testleri. İzolatlar ortalama sıralama <%10 = agresif olmayan; % 11 -% 25 = zayıf agresif; %26-%50 = daha az agresif; % 51 -% 70 = orta derecede agresif; >%70 = son derece agresif. bir Tukey HSD testine göre izolatlar arasındaki istatistiksel fark (p < 0.05).
Tartışmalar
Fusarium solgunluğunun dünyanın bazı bölgelerinde ciddi ekonomik verim kayıplarına neden olduğu bilinmektedir31. Hastalık ilk olarak Macaristan'da32 bildirilmiş ve daha sonra Mısır, Hindistan, Myanmar, Nepal, Pakistan, Türkiye, Suriye ve ABD gibi birçok ülkede bildirilmiştir33. Kumar ve ark.34, dünya çapında en az 26 ülkede meydana geldiğine dair raporlarla birlikte mercimek solgunluğu, kök ve kök boğazı çürüklüğünün geniş bir dağılımını bildirmiştir. Yakın zamanda yapılan bir çalışmada, Hindistan'ın farklı eyaletlerinden toplanan hastalıklı mercimek bitkilerinden 12 mantar türü izole edilmiş ve F. oxysporum f. sp. lentis en önemli patojen (%30) olarak tanımlanmış, bunu Rhizoctonia bataticola (%17,5) ve Sclerotium rolfsii (%15,7) izlemiştir31. Benzer şekilde, bu çalışmada en sık izole edilen mantar cinsi Fusarium (%95.4) idi. Zitnick-Anderson ve ark.7'ye göre, Fusarium (%50) Kuzey Dakota mercimek tarlalarında solgunluk, kök ve kök boğazı çürümesine neden olan baskın mantar cinsiydi. Ayrıca F. oxysporum, F. solani, F. culmorum, F. equiseti, F. acuminatum, F. graminearum, F. redolens ve F. avenaceum'un bu cins içindeki patojenler olduğunu bildirmişlerdir.
Bu çalışmada tanımlanan beş Fusarium türünün morfolojik özellikleri, son çalışmalarabenzer nitelikteydi 35. Rathod ve ark.36'ya göre F. oxysporum izolatları, PDA üzerinde septat, dallanmış, başlangıçta beyaz ve daha sonra kabarık veya batık koloni gelişimi gösterdiklerini, bu kolonilerin farklı pigmentasyonlarda renklendiğini bildirmişlerdir. Benzer şekilde, mevcut çalışmada, F. oxysporum izolatları başlangıçta beyaz, daha sonra sarı, mor veya pembe koloniler oluşturmuştur. Öte yandan, yaklaşık 30 günlük kolonilerde, F. oxysporum izolatlarının tanımlanmasının morfolojik bir kriteri olarak kullanılan iki veya üç zincir şeklindeki klamidosporlar gözlenmiştir. Nitekim Endes15 , Yozgat ili nohut ekim alanlarından elde edilen ve >30 gün süreyle bekletilen F. oxysporum izolatlarına ait klamidosporların genellikle eski ortamlarda bitki bulaşma eğiliminin daha yüksek olduğunu bildirmiştir.
Nohut ve mercimekte bulunan Fusarium kök çürüklüğüne F. solani, F. oxysporum ve F. graminearum37 gibi birçok Fusarium türü neden olur. Dean ve ark.38 tarafından bildirildiği gibi, F. graminearum ve F. oxysporum, dünya çapında bitki mikologları tarafından en sık izole edilen bitki mantar patojenleri arasındadır. Ancak Aydın ve ark.6 F. graminearum'un Türkiye'nin Güneydoğu Anadolu Bölgesi'ndeki mercimek ekim alanlarında solgunluk, kök ve taç çürüklüğüne neden olan etkenler arasında olduğunu bildirmişlerdir. Ayrıca F. graminearum'un ABD'nin Kuzey Dakota eyaletinde mercimekte kök ve taç çürümesine neden olduğu bilinmektedir7.
Fletcher ve ark.39 , F. culmorum'un mercimek ekim alanlarında nadiren bir patojen olarak izole edilebileceğini bildirmiştir. Ayrıca Zitnick-Anderson ve ark.7 tarafından yakın zamanda yapılan bir çalışmada F. culmorum'un mercimek bitkilerinde solgunluk, kök ve kök boğazı çürüklüğü ile ilişkili olduğu bildirilmiştir. Ancak Aydın ve ark.6 mercimek ekim alanlarında solgunluk ve kök çürüklüğüne neden olan birçok Fusarium türü tanımlamış, ancak F. culmorum'u patojen olarak bildirmemiştir. Mevcut çalışmadan farklı olan bu durum, araştırılan alanların sayısının farklı olmasından ya da mevcut çalışmada morfolojik çalışmaların moleküler yöntemlerle desteklenmesinden kaynaklanıyor olabilir.
Zitnick-Anderson ve ark.7 , F. acuminatum'un Kuzey Dakota mercimek tarlalarında solgunluk ve kök ve kök boğazı çürüklüğüne neden olan Fusarium türleri arasında yer aldığını bildirmişlerdir. Öte yandan Aydın ve ark.6 F . solani'nin mercimek yetiştiriciliği yapılan alanlarda solgunluk ve kök çürüklüğüne neden olan etkenler arasında yer aldığını belgelemişlerdir. F . solani'nin mercimek ekim alanlarından zayıf bir patojen olarak izole edildiği de bilinmektedir7.
Fusarium türleri fakültatif parazitlerdir. Mercimeklerdeki Fusarium cinsine bağlı enfeksiyonlar, özellikle ilkbaharın sonlarında veya yazın başlarında aşırı sıcaklıklarda bitkilerin tamamen tahrip olmasına neden olabilir. 40 yaşındaki Al Ahmad ve Mouselli, F. oxysporum ve F. solani'nin Suriye'nin güneyindeki mercimek tarlalarında sararma, yaprak dökülmesi ve kuruma semptomlarına neden olduğunu bildirmiştir. F. solani , Yozgat16 ilini de içine alan Orta Anadolu'da kök çürüklüğü ve solgunluk hastalıklarına neden olmaktadır. Ayrıca diğer bazı Fusarium türlerinin de belirli oranlarda patojenik olduğu tespit edilmiştir. Zitnick-Anderson ve ark.7 Fusarium solgunluğu hastalığına Fusarium oxysporum f. sp lentis'in neden olduğunu ancak F. culmorum, F. solani, F. graminearum türlerinin de morfolojik, fizyolojik ve patolojik özelliklerine göre solgunluk hastalığına neden olabileceğini bildirmişlerdir. Ayrıca Fletcher ve ark.39 mercimekte solgunluk ve kök çürüklüğüne neden olan F. acuminatum'un virülansının zayıf veya düşük virülansa sahip olduğunu bildirmişlerdir.
Çalışmada, incelenen mercimek tarlalarından elde edilen Fusarium izolatlarının %95,4'ünün Fusarium türü olduğu ve mercimek bitkilerinde insidansı %1,6 - %26,4, hastalık şiddeti ise %14,4 - %45,2 arasında olduğu ortaya konmuştur. Sıcak ve kurak ilkbahar ve erken yaz sıcağı gibi olumsuz iklim koşulları bitki büyümesini zayıflatır ve bitkileri Fusarium türlerine karşı duyarlı hale getirir. Fusarium türlerinin çoğu zayıf patojenlerdir ve çevre koşulları konukçu bitkiyi zayıflattığında özellikle kuraklık koşullarında Fusarium solgunluğunun artmasına neden olurlar.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma Bozok Üniversitesi Proje Koordinasyon Uygulama ve Araştırma Merkezi, BAP birimi tarafından FÇD-2022-1096 proje numarası ile desteklenmiştir. Bu çalışma Sevim Atmaca'nın doktora çalışmasının bir parçasıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (S)-lactic acid | Merck | 100366 | Was used as an antibiotic in studies. |
| 2-propanol | Merck | 109634 | Used in molecular studies. |
| Adjustable micro automatic pipette (0.1-2.5 µL) | Eppendorf Research | LB.EP.3123000012 | Used to measure small volumes of liquids. |
| Adjustable micro automatic pipette set (2 – 20 µl, 20 – 200 µl, 100 – 1.000 µl) | Eppendorf Research | LB.EP.4924000916 | Used to measure small volumes of liquids. |
| Agar | Merck | 110453 | For use in making fungal media. |
| Agarose | Sigma-Aldrich | 18300012 | For use in gel preparation in electrophoresis. |
| Air conditioning room | ?klimlab | Was used to grow plants under controlled conditions. | |
| Ampisilin | Sigma-Aldrich | A9393 | Was used as an antibiotic in studies. |
| Analytical precision balance | Shimadzu ATX224 | Was used to weigh the solid materials used in the study. | |
| Autoclave sterilizer | Zealway | GF-120DR | It was used to sterilize solid and liquid materials at every stage of the study. |
| Binocular microscope | Leica DM750 | For use in morphological diagnosis. | |
| Biological safety cabinet | HFsafe Class II A2 | To ensure the safety of the work area, the user, the environment and the operation. | |
| Centrifugal | DLAB DM1424 | LB.DL.903001124 | Used to separate particles in a sample based on their shape, size and density |
| Chloramphenicol | Sigma-Aldrich | 220551 | Was used as an antibiotic in studies. |
| Cork-borer set | Sigma-Aldrich | Z165220 | It was used to take samples from fungus culture in petri dishes. |
| Cover glass and slide | ISOLAB | 075.01.006 / 075.02.005 | Was used in the preparation process for microscope studies. |
| D(+)-glucose monohydrate | Merck | 108342 | For use in making fungal media. |
| DFC450 with digital camera | Leica | Digital microscope camera with c-mount interface and with a 5 megapixel ccd sensor. | |
| Dm750 binocular microscope | Leica | MIC5246 | Was used for morphological identification of fungi. |
| DNA gel electrophoresis | thermo fisher scientific | B2-UVT | |
| Dna gel loading dye (6x) | Thermo Scientific | R0611 | For use in molecular diagnostics. |
| dNTP mix | Thermo Scientific | R0192 | Used in molecular studies. |
| Dreamtaq pcr master mixes (2x) | Thermo Scientific | K1082 | For use in molecular diagnostics. |
| Drigalski spatule | ISOLAB | 082.03.001 | It was used to scrape and spread fungal cultures grown in petri dishes. |
| Edta | Thermo Scientific | 17892 | For use in molecular diagnostics. |
| Ethanol | Merck | 100983 | Used in molecular studies and surface disinfection studies. |
| Ethidium bromide | Sigma-Aldrich | E7637 | Used to stain dna in gels during gel electrophoresis. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | Used in molecular studies. |
| Filter paper | ISOLAB | 107.58.158 | Used in stock culture studies. |
| Forced air drying cabinet | ZHICHENG ZXDS-A-1090 | For use in incubation processes. | |
| Fume hood | Elektromag EM1201 | LB.EM.EM1201 | It was used to control harmful chemical vapors, gases and dust. |
| Gel imaging system | Syngene G:BOX Chemi XX6 | For use in molecular diagnostics. | |
| Generuler 50 bp dna ladder | Thermo Scientific | SM0372 | For use in molecular diagnostics. |
| Glacial acetic acid | Merck | 1005706 | Used in molecular studies. |
| Glycerol | Merck | 104094 | For use in stock culture of fungi. |
| Lancet | ISOLAB | 048.50.002 | Used to remove diseased tissue from plant samples. |
| Magnesium chloride | Sigma-Aldrich | 814733 | Used in molecular studies. |
| Measuring tape | ISOLAB | 016.07.500 | Used to measure liquid volumes. |
| Microcentrifuge tubes | ISOLAB | 0778.03.001 / 0778.03.002 / 0778.03.003 | Used to store different volumes of liquids. |
| PCR tube | ISOLAB | 123.01.002 | It was used to put dna mix in pcr studies. |
| Petri dishes | ISOLAB | 120.13.090 | For use in growing fungus culture. |
| Pipette tips | ISOLAB | 005.01.001 / 005.01.002 / 005.01.003 / 005.01.004 | To transfer liquid volumes used in analyses. |
| Plastic bag | ISOLAB | 039.30.005 | Was used to transport samples to the laboratory. |
| Plastic pot | ToXA | Was used for growing plants. | |
| Pliers, clamps | ISOLAB | 048.08.130 | It was used to put filter papers into envelopes after the fungus grew in the petri dish. |
| Porcelain mortar | ISOLAB | 038.02.150 | Was used to crush fungal mycelia. |
| Potato dextrose agar | Condalab | 1022 | For the identification and cultivation and of fungi. |
| Pure water system | human CORPORATION | LT.HC.NHP009 | Was used in solution preparation and analysis throughout the studies. |
| Refrigerator (+4 °C / -20 °C) | Vestel | For use in the storage of stock materials. | |
| Rifampicin | Sigma-Aldrich | 557303 | Was used as an antibiotic in studies. |
| Sodium acetate | Merck | 106268 | Used in molecular studies. |
| Sodium chloride | Merck | 1064041000 | Used in molecular studies. |
| Sodium dodecyl sulfate | Sigma-Aldrich | 436143 | Used in molecular studies. |
| Sodium hypochlorite solution | Merck | 105614 | Used for surface disinfection. |
| Spatula | ISOLAB | 047.33.210 | It was used to scrape the fungus culture growing in petri dishes. |
| Streptomyc?n sulfate | BioShop Canada | STP101 | To prevent contamination in fungal culture cultivation. |
| Teksoll extra pure | Tekkim | TK.200650 | For use as a disinfectant in all stages of work. |
| Tetrasiklin | Sigma-Aldrich | T3258 | Was used as an antibiotic in studies. |
| Thermal cycler PCR | Bio?Rad T100 | For use in genomic analyses. | |
| Thoma lam | ISOLAB | 075.03.002 | For use in spore counting. |
| Tris HCL | Roche | 10812846001 | Used in molecular studies. |
| Trizma | Sigma-Aldrich | T1503 | Used in molecular studies. |
| Tween 80 | Merck | 822187 | For use in spore solution in pathogenicity testing. |
| Vortex mixer vorteks | Velp WIZARD | LB.VLP.F202A0175 | Used to mix substances in liquid volumes. |
| Water baths | Memmert WNB 22 | 1018-5702 | It was used during incubation in dna extraction studies. |
Referanslar
- Skrzypkowski, W., Kiełkowska, A. Current status of haploidization in cool-season grain legume crop species. Agriculture. 14 (7), 1031 (2024).
- Liber, M., Duarte, I., Maia, A. T., Oliveira, H. R. The history of lentil (Lens culinaris subsp. culinaris) domestication and spread as revealed by genotyping-by-sequencing of wild and landrace accessions. Front Plant Sci. 12, 628439 (2021).
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data (2022)
- TÜİK. . Agricultural statistics report. , (2023).
- Baxevanos, D., et al. Lentil cultivar evaluation in diverse organic mediterranean environments. Agronomy. 14 (4), 790 (2024).
- Aydın, M., Koç, M., Sağır, A. Investigations on determination of soilborne fungal pathogens causing root rot, crown rot and wilt on lentil in Southeast Anatolia Region. Plant Protect Bulletin. 44 (1), 93-103 (2004).
- Zitnick-Anderson, K., et al. Fusarium species associated with root rot of lentil (Lens culinaris) in North Dakota. Plant Health Prog. 22 (4), 524-528 (2021).
- Kushwaha, D. A. . A research book of seed mycoflora of chickpea (Cicer arietinum). , (2020).
- Ekwomadu, T. I., Mwanza, M. Fusarium fungi pathogens, identification, adverse effects, disease management, and global food security: A review of the latest research. Agriculture. 13 (9), 1810 (2023).
- Jiskani, A. M., et al. A destructive disease of lentil: Fusarium wilt of lentil. Plant Arch. 21 (1), 2117-2127 (2021).
- Alisaac, E., Mahlein, A. K. Fusarium head blight on wheat: biology, modern detection and diagnosis and integrated disease management. Toxins. 15 (3), 192 (2023).
- Yang, F., et al. Effects of rhizosphere microbial communities on cucumber Fusarium wilt disease suppression. Microorganisms. 11 (6), 1576 (2023).
- Kumari, N., Katoch, S. Wilt and root rot complex of important pulse crops: their detection and integrated management. Management of Fungal Pathogens in Pulses. Fungal Biology. , (2020).
- Köppen, W., Geiger, R. . Handbuch der klimatologie. , (1936).
- Agrios, G. N. . Plant Pathology. , (2005).
- Endes, A. Occurrence and distribution of Chickpea root rot and wilt disease in Yozgat Kırşehir and Kırıkkale Provinces. Çukurova J Agri Food Sci. 38 (2), 284-298 (2023).
- Choi, Y. W., Hyde, K. D., Ho, W. H. Single spore isolation of fungi. Fungal Diversity. 3, 29-38 (1999).
- Baskarathevan, J., Jaspers, M. V., Jones, E. E., Ridgway, H. J. Evaluation of different storage methods for rapid and cost effective preservation of Botryosphaeria species. New Zealand Plant Protect. 62, 234-237 (2009).
- Dikilitaş, M., Katırcıoğlu, Z., Altınok, H. Latest developments and methods on long-term storage, protection, and recycle of fungi and fungal material. JAgric Fac HR U. 15 (1), 55-69 (2011).
- Bora, T., Karaca, &. #. 3. 0. 4. ;. . Measurement of disease and damage in cultivated plants. , (1970).
- Öğüt, E. . Pathogenic and molecular characterization of some Fusarium spp. causing root rot and wilt on lentil with determination of variety reactions in south eastern Anatolia. , (2015).
- Leslie, J. F., Summerell, B. A. . The Fusarium Laboratory manual. , (2006).
- Cenis, J. L. Rapid extraction of fungal DNA for PCR amplification. Nuc Acids Res. 20 (9), 2380 (1992).
- Aras, S., Endes, A. Effect of Fusarium oxysporum infection on strawberry under calcium, iron, and zinc deficiency conditions. Zemdirbyste-Agri. 110 (1), 71-78 (2023).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc A Guide Metho Appl. , 315-322 (1990).
- Endes, A. Characterization and pathogenicity of Botryosphaeriaceae species associated with Gummosis, Dieback, Trunk and Branch Cankers of almond trees in Türkiye. J Agri Sci. 30 (4), 698-711 (2024).
- Gordon, T. R., Okamoto, D., Jacobson, D. J. Colonization of muskmelon and non-susceptible crops by Fusarium oxysporum f. sp. melonis and other species of Fusarium. Phytopathology. 79 (10), 1095-1100 (1989).
- Xu, X., et al. Fusarium species associated with maize leaf blight in Heilongjiang Province, China. J Fungi. 8 (11), 1170 (2022).
- Fonseca-Guerra, I. R., Chiquillo-Pompeyo, J. C., Benavides Rozo, M. E., Díaz Ovalle, J. F. Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Sci Rep. 12 (1), 20841 (2022).
- Khan, M. F., et al. First report of damping-off and seedling rot of Hemp (Cannabis sativa) caused by Fusarium solani in North Dakota, U.S.A. Plant Dis. 107 (1), 232 (2023).
- Chaudhary, R. G., Saxena, D. R., Dhar, V., Singh, R. K., Namdev, J. K. Prevalence of wilt-root rot and their associated pathogens at reproductive phase in lentil. Arch Phytopathol Plant Protect. 43 (10), 996-1000 (2010).
- Fleischmann, R. Some observations on Maize smut in Hungary. Pflanzenbau. 14 (5), 199-206 (1937).
- Bedasa, T. . Distribution and management of Fusarium wilt (Fusarium oxysporum f. sp. lentis) of lentil (Lens culinaris Medikus) in Central Highlands of Ethiopia. , (2018).
- Kumar, S., et al. Vascular wilt disease of lentil: A review. J Lentil Res. 4, 1-14 (2010).
- Chenari, S., Abbasi, S., Chehri, K. Phylogeny and host specificity of Fusarium solani species complex isolated from chickpea, lentil and common bean. Arch Phytopathol Plant Protect. , 1-15 (2024).
- Rathod, A., et al. Isolation of causal organism of wilt and collar rot of lentil and its pathogenicity tests. Int J Curr Microbiol Appl Sci. 10 (12), 276-282 (2021).
- Hayit, T., Endes, A., Hayit, F. The severity level classification of Fusarium wilt of chickpea by pre-trained deep learning models. J Plant Pathol. 106 (1), 93-105 (2024).
- Dean, R., et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 13 (4), 414-430 (2012).
- Fletcher, J. D., Broadhurst, P. G., Bansal, R. K. F. avenaceum: A pathogen of lentil in New Zealand. New Zealand J Crop Horticultural Sci. 19 (2), 207-210 (1991).
- Al Ahmad, M., Mouselli, N. Wilt and root rot of lentis. Lens. 14 (1/2), 27-31 (1987).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır