Method Article
陸域気候下におけるトルコにおけるフザリウム萎凋病および根腐病の存在に関するレンズ豆畑のスクリーニング
要約
ヨズガット州で行われた研究では、萎凋病や根腐れ病などの生物的要因がレンズ豆の生産を制限していることがわかりました。 フザリウム 分離株はサンプルの95.4%で見つかり、持続可能な技術開発と効果的な制御戦略のための定期的な局所調査と定期的なモニタリングを示唆しています。
要約
レンズ豆は重要な自家受粉マメ科作物植物です。その生産は、さまざまな生物的要因、特に萎凋病と根腐れ複合体を引き起こす真菌剤によって制限されます。この研究は、植物病原性真菌剤の地域疫学と病因を理解し、土壌伝染性 フザリウム 属菌に対する防除戦略を開発することを目的としていました。この研究では、2022年から2023年にかけて、ヨズガット州の83のレンズ豆播種地域で、一般的な フザリウム 種によって引き起こされる萎凋病、根腐れ病、冠腐病について調査しました。症候性のレンズ豆植物を採取し、真菌の単離と同定を行った。 フザリウム 分離株は、コロニーの形態に従ってグループ化され、PDA培地で培養されました。さらに、 Fusarium 分離株から得られたゲノムDNAをPCRを使用して分析し、NCBI GenBankに登録されている他の Fusarium 分離株と比較しました。 Fusarium 分離株間の遺伝的関係は、Mega 11プログラムのMaximum Parsimony(MP)法を使用して決定されました。その結果、ヨズガット州における萎凋病と根腐れ病の平均発生率と重症化率は、それぞれ16.9%と38.6%であると判断されました。 フザリウム 分離株はサンプルの95.4%で発見されました。 F. oxysporum、 F. culmorum、F. graminearum、F. acuminatum 、 およびF. solani 分離株の間で99.5%から100%の塩基配列の均一性があり、最も分離された種は F. oxysporumでした。 Fusarium 分離株のMP樹状図は2つの主要な枝に分けられ、最初の枝にはすべての F.solani 分離株が含まれていました。2番目の主要なブランチには、本研究とNCBI GenBankで分離された他の フザリウム 種が含まれていました。この研究では、レンズ豆の抑制のための フザリウム 萎凋病の頻度を決定するための定期的な局所調査が提案されています。 フザリウムによる損傷を適時に抑制することは、病気を制御し、レンズ豆の生産システムを保護するために強く推奨されます。
概要
レンズ豆(Lens culinaris Medik.)は、マメ科に属する小さな食用穀物マメ科のマメ科植物で、針のような葉と白から淡い紫色または濃い紫色の花を持つ自家受粉の涼しい季節の作物です1。約1万年前に肥沃な三日月地帯のメソポタミア地方で人類によって家畜化され、地中海沿岸や中央アジアなどの新世界に急速に広がり、その後アメリカ大陸2に帰化しました。世界のレンズ豆の栽培面積は約550万ヘクタールで、生産量は660万トンです3。トルコはレンズ豆の生産量でカナダ、インド、オーストラリアに次いで4位にランクされています。トルコでのレンズ豆の栽培は非常に重要であり、世界の生産量の6.7%を占めています。トルコのレンズ豆の総生産量は 474,000 トンで、少なくとも 40 の州で生産されています4.トルコのレンズ豆生産量の約 89.5% は赤と緑のレンズ豆で、南東アナトリア地域の冬季作物の 10.5% を占めています。残りの作物は夏の作物として栽培されます。ヨズガト(39.5%)、コンヤ(23.7%)、クルシェヒル(16.3%)、チョルム(7.6%)、アンカラ(2.9%)の各州が緑レンズ豆の生産に大きく貢献している4。レンズ豆の生産は、生物的および非生物的ストレス要因によって制限される可能性があります。霜と干ばつは、夏の緑レンズ豆の生産で最も一般的な非生物的ストレス要因です5。Ascochyta lentis、Rhizoctonia solani、R. bataticola、Aphanomyces euteiche、Pythium、およびFusarium種によって引き起こされる萎凋病、根腐れ病、および冠腐病複合体のような真菌性疾患は、感染のタイミング、宿主の感受性、および気象条件に応じて、減衰、苗枯病、萎凋病、および根腐れを含む疾患の組み合わせを引き起こす最も重要な真菌性疾患です6,7、8.
フザリウムは、土壌、植物、有機基質に見られる糸状の不完全真菌であり、これらの病原体9のコスモポリタン属です。これは、フザリウム萎凋病、根、根襟腐病などのさまざまな病気を引き起こします。また、小麦のフザリウム頭枯病、ウリ科のフザリウム萎凋病、レンズ豆を含むほとんどのマメ科植物の根腐れなど10,11,12。Fusarium属によって引き起こされる維管束萎凋病、根、および根襟腐病は、世界中の多くのレンズ豆栽培地域でレンズ豆の最も重要な病気です10。Fusarium oxysporumは、レンズ豆の萎凋病、根、根の襟腐れに関連する最も一般的なFusarium種です。世界的に、萎凋病、根腐れ病、および冠腐病は、レンズ豆の植栽地域では、F. graminearum、F. sporotrichioides、F. equity、F. acuminatum、F. redolent、F. avenaceum、F. culmorum、F. solani、および F. verticillioides によって引き起こされています7.フザリウム属による萎凋病、根腐れ病、冠腐病は、苗木と成虫の両段階で発生し、葉の突然のしおれ、乾燥、そして最終的には死滅を引き起こします。この病気の症状には、種子の腐敗、根腐れ、上部のリーフレットのしおれ、発育阻害、収縮、葉のカールなどがあります。鞘を埋める中期および後期の段階では、種子は通常縮小し、根の症状には発育阻害、茶色の変色、主根の先端の損傷、二次根の増殖などがあります。血管組織の変色は、すべての場合に見られるわけではありません13。
中央アナトリア地方では、レンズ豆の萎凋病や根腐れ病の状況に関する研究が限られた数で行われています。ヨズガットは温暖で温暖な気候で、夏に比べて冬季の降雨量が多く、ケッペンとガイガー14によってDsb(暖かく湿った陸生気候)に分類されています。平均気温は9.6 °C、平均降水量は512 mmです。ヨズガットは北半球に位置しています。夏は6月、7月、8月、9月に発生します。病気を引き起こす植物病原性真菌剤の地域疫学と病因に関する情報を持つことは、土壌伝染性 フザリウム 属に対するさまざまな制御戦略を開発し、病気を制御するために非常に重要です15。これに関連して、本研究の目的は決定し、特定することです - レンズ豆の萎凋病、根腐れ病、およびクラウン腐敗病の疾患パラメータ(疾患の有病率、発生率、および重症度) ヨズガット州で調査を実施することにより、 緑のレンズ豆の総生産量の約40%が単独で行われている、病原性 フザリウム 形態学的および分子学的解析によりレンズ豆の萎凋病および根腐れを引き起こす種、および病原性試験を実施することにより フザリウム 種の個々の病原性レベルを決定すること。
プロトコル
注:研究で使用された試薬と機器の詳細は、資料表に記載されています。
1. 現地調査、サンプリング、菌類の分離
注:調査作業は、Endes16によると、2022年と2023年に実施されました。ヨズガット州の9つの地区にまたがる合計83のレンズ豆の作付地域で、萎凋病、根、根襟腐病が観察されました(図1)。
- サンプリングエリアとして1000 m2 以上の面積を持つレンズ豆畑を選択します。1 m2 フレームを使用して対角線に沿ってジグザグに歩くことにより、境界からフィールドの中央または中央にランダムに歩き、各サンプルを収集し、ランダムに選択された3つの異なるポイントを少なくとも3つランダムに配置します。各ポイントから病気の症状を示すレンズ豆植物を採取し、紙袋に入れて実験室に移し、真菌の分離および同定研究に使用します。
注:実験室に移された病気のレンズ豆植物の根と根の襟は、粗い残留物を取り除くために最初に水道水で洗浄されました。その後、Endes16で説明されているように、真菌病原体を分離するために表面消毒が行われました。 - 病気にかかった植物組織を70%エタノールに10〜15秒間浸し、滅菌水でそれぞれ3分間3回すすいでください。それらすべてを1%次亜塩素酸ナトリウム(NaOCl)に5分間保持し、滅菌水でそれぞれ3回5分間再度すすぎます。
- 滅菌キャビネット内の濾紙で湿った植物組織を乾燥させ、表面消毒プロセスを終了します。その後、消毒した植物組織を5〜10 mmの長さに切断し、ペトリ皿(直径90 mm)内の0.01%ストレプトマイシンを含むPDA培地に4〜5個を置きます。ペトリ皿を25±1°Cの暗闇のインキュベーターに4〜7日間入れ、真菌の増殖を観察します。
注:発生中の真菌分離株は、単一胞子分離法によって精製されました。この目的のために、子嚢菌類、担子菌類、コエロ菌類、および菌糸菌類に属する真菌の単一胞子培養物の取得に関するChoiら17 によって実施された研究を、以下に説明するように変更して使用しました。 - 真菌分離株を精製するには、単離研究の終了時に得られた真菌分離株をインキュベーター内で25±1°Cで12時間の蛍光灯/12時間の暗闇で15日間保管し、PDA上でのアナモルフィック再生構造の形成を促進します。
- 15日齢培養物から得られた約100 mgの真菌菌糸体をへらで秤量し、1.5 mLの滅菌微量遠心チューブに移し、滅菌プラスチック乳棒で徹底的に粉砕して均質化します。
- 1 mLの滅菌水を加え、1分間渦巻きして、胞子が水に移るようにします。水中に移動する胞子の数を調整するには、この混合物をピペットで20μL引き出し、光学顕微鏡の10倍倍で胞子の数を確認します。
- 胞子の量が所望の量より多い場合は、胞子と水の混合物を1/10、1/1000、1/1000などの比率で希釈します。顕微鏡の視野に4〜6個の胞子を含む混合物を提供します。
- 調製した胞子懸濁液100μLを取り出し、0.1%ストレプトマイシンを添加したPDA培地を含む直径90mmのシャーレに移します。次に、転送したサスペンションをDrigalskiスパチュラでPDAに広げます。
- 調製したペトリ皿を25±1°Cの暗闇で12〜24時間インキュベートします。この期間の終わりに、接種ループを備えた単一の分生子から発達した菌糸の小片を、PDA培地を含む新しいペトリ皿に移します。各胞子から得られる各培養物は、単一の胞子培養物です。これらを保存しておけば、病原性試験や形態学的・分子的同定に使用することができます。
注:主な目的は、真菌分離株をその形態、遺伝学、および病原性を変えることなく長期間生存させることです。貯蔵プロセスは、2つの異なる方法を用いて行った18、19。この研究で使用したすべての保存方法について、以下で詳しく説明します。- サンプルを保存する最初の方法は次のとおりです。PDA培地で25±1°C、12:12 hの暗色:光で15日間増殖させ、滅菌水に保存できる直径4mmの菌糸体ディスクを取得します。
- 菌糸体ディスク(直径4 mm、10枚のディスク)を、前述の条件下で成長した真菌培養物からのコルク穴あけ器で切断します。菌糸体ディスクを1mLの滅菌水が入ったマイクロ遠心チューブに移します。サンプルを冷蔵庫の微量遠心チューブに入れ、-20°Cで6か月間保管します。
- サンプルを保存する2番目の方法は次のとおりです。まず、接種ループで得られた単一胞子培養物から純粋な真菌円盤をひとつまみ取り、クロラムフェニコール、乳酸、アンピシリン、リファンピシン、テトラサイクリン、ストレプトマイシンなどを添加したPDAを含むペトリ皿に移します。
- 保管プロセスの5〜10日前に、25±1°Cで12時間:12時間の暗い:明るい状態で成長させます。1 cm x 1 cmの汎用フィルターペーパーをオートクレーブで121°C、15 psi、60分間切断して滅菌します。
- 濾紙を同じまたは選択的な媒体を使用して新しいペトリ皿に入れます。純粋な真菌培養物からコロニー/胞子を切り取り、各ピースの上に置きます。
- ペトリ皿を密封し、適切な成長条件(上記のように)でインキュベーターに入れます。真菌分離株は、濾紙上でゆっくりと成長します。完全なコロニー形成を確実にするために、約15日間インキュベートします。
- 濾紙上で胞子形成または完全なコロニー形成を行った後、個々の紙片を培地のない新しいシャーレに移します。その後、濾紙と真菌が完全に乾くまで(約20〜30日)、ペトリ皿をインキュベーターに入れます。
- 乾燥後、滅菌紙の封筒に濾紙を10枚入れ、封筒にラベルを貼り、ビニール袋に入れ、封筒の入ったビニール袋をプラスチック製の透明容器に入れて-20°Cで保管します。
- ヨズガットのレンズ豆萎凋病、根腐れ病、冠腐病の有病率を、各レンズ豆畑での病気の有病率を考慮して、以下の式に従って計算し、その後に州の地区の名前を続けます。
疾病罹患率(%)=(a/b)×100
ここで、aは病気にかかったフィールドの数を示します。b は、地区内の調査されたフィールドの総数を示します。 - Bora and Karaca20によって報告された加重平均法に従って、病気の発生率を計算します。フィールドの各正方形の植物を数えます。それらを各正方形で病気にかかった植物と病気にかからない植物に分け、以下の式に従って病気の有病率を計算します。
疾病有病率(%)=(x / y)x 100
ここで、xは病気にかかった植物の数を示します。y は、調査された植物の総数を示します。 - Öğüt21のスケール0-4に従って疾患の重症度を計算します。ここで、0 =症状は示さず、1 =葉の25%で軽度の症状を示します。2 = 葉の 26%-50% に中等度の症状。3 =葉の51%〜75%で重度のクロロシスとしおれ。4 = 非常に重度のクロロシスとしおれの症状、または同じ順序で75%以上の植物で乾燥、脱落、成長遅延、または枯れ葉。
- 得られたスケール値16を使用して、次の式を使用して疾患の重症度を計算します。
疾患の重症度 (%) = [∑ [ i (ni x vi) / (V) x N)] x 100
ここで、スケール値の植物の数 niviスケール値;V最高スケール値。観察された植物の総数N。i はクラスの数を示します。
2. 気象データ
- 調査研究を実施します。この議定書では、2022年5月と6月、および2023年の期間に調査が実施されました。2022年、2023年、および長い年月の3月から7月の期間の気温、相対湿度、および総降水量の値を、ヨズガットの州気象局から取得します(表1)。
3. 形態学的同定
- Fusarium分離株の文化的特性(コロニーの色、空中菌糸体、菌糸体の成長率)および分生子(分生子の寸法、形状、色、および中隔の数)の特性を以前の研究の特性と比較し、真菌種を暫定的に特定します。
- 形態学的同定に使用するグループから代表的なサンプルを選択します。これらのサンプルは、上記のように単一胞子分離法に従って精製します。この期間中、 Fusarium 分離株のコロニー色素沈着特性、およびミクロ/マクロコニシアおよびクラミドスポア構造を観察します。
- 得られた純粋な真菌培養物におけるミクロ/マクロコニシアやクラミドスポアなどの微形態学的構造の形成を促進するには、PDA上で25±1°Cおよび12時間:12時間暗:インキュベーター内で25〜30日間インキュベートします。各 フザリウム 分離株の分生子の長さと幅を光学顕微鏡で測定します。さらに、分生子の構造、形状、色、および分生子の中隔または中隔なしを、デジタルカメラ付属の光学顕微鏡を使用して文書化します。
- 上記の観察結果に基づいて、Leslie and Suerell22に記載されているように、Fusarium分離株を種レベルに従ってグループ化します。
4. 分子の同定
注: Fusarium 分離株の全ゲノムDNAは、Cenis23のプロトコルからわずかに変更された以下の方法を使用して抽出されました。フザリウム分離株のPCR分析および電気泳動は、ArasおよびEndes24によって記載されたプロトコルを用いて行った。
- 真菌ゲノムDNA抽出
- PDAで増殖させた フザリウム 分離株の新鮮な培養物(10日齢)から、滅菌メスで100mgの菌糸体をこすり落とし、2mLの微量遠心チューブに移します。チューブを-20°Cで一晩インキュベートします。
- 一晩インキュベートした後、500 μLのDNA抽出バッファー(200 mM Tris-HCl pH:8.5、250 mM NaCl、25 mM EDTA、0.5%ドデシル硫酸ナトリウム)をチューブに加え、滅菌プラスチック乳棒で粉砕します。
- その後、pH 5.2の3M酢酸ナトリウム(NaOAc)150 μLをチューブに加え、-20°Cで30分間インキュベートします。この段階の後、チューブを4,000 x g で10分間遠心分離します。
- 遠心分離後、チューブ上部の上清400 μLを新しいチューブ(1.5 mL)に移し、等量のイソプロパノール(2-プロパノール)を加えます。新しいチューブを-20°Cで30分間インキュベートします。この間、チューブを5回または6回穏やかに混ぜます。
- 4,000 x g で10分間遠心分離し、ゲノムDNAを沈殿させ、チューブに残っている液体をすべて廃棄します。
- 1 mLの70%エタノールをゲノムDNAペレットに、チューブの底に白色またはクリーム色の沈殿物として加えます。チューブを4x〜5xで約1分間上下に穏やかに混合し、チューブ内のすべてのエタノールを捨てます。次に、層流でチューブを30分間開き、DNAペレット上のエタノールを完全に蒸発させます。
- ゲノムDNAを溶解して長期間保存するには、チューブに50 μLのTE(1M Tris-HCl pH:8.0、0.5M EDTA pH 8.0)緩衝液を加え、チューブを65°Cのウォーターバスで1時間インキュベートします。この間、チューブを8倍から10倍まで優しく上下に混ぜます。TEバッファー溶液に溶解したゲノムDNAを-20°Cのディープフリーザーで保存し、分子研究に使用します。
- PCR研究では、オリゴヌクレオチドプライマーITS5 F(5′GGAAGTAAAGTCGTAACAAGG3')/ ITS4 R(5‥TCCTCCGCTTATTGATATGC3')を使用して、rDNA25のITS領域を増幅します。各PCR反応は、2.5 μLの10x PCRバッファー、2.5 μLのMgCl2 (25 mM)、2.5 μLのdNTP(2 mM)、0.5 μLの各プライマー(10 μM)、2 μLのテンプレートDNA、0.5 μLのTaq DNAポリメラーゼ(1 U/μL、Fermantas)、および14 μLのsQH2O(総容量25 μL)で行います。
- 25 μL PCR反応では、以下のPCRプログラムを95°Cで2分間(初期変性)実行し、続いて40サイクル実行します。95 °C で 30 秒 (変性)、55 °C で 45 秒 (アニーリング)、72 °C で 90 秒 (延長)、72 °C で 5 分間 (最終延長)。1x TAE(Tris Base - Glacial Acetic Acid - EDTA)緩衝液で調製した1.5%アガロースゲル中の90 Vで1.5時間の電気泳動PCR産物。
- ゲル電気泳動用のTAEバッファーを調製するには、242 gのトリスベースを700 mLの滅菌水に溶解します。57.1mLの氷酢酸を追加します。0.5 M EDTA溶液100 mLを加え、滅菌水を加えて容量を1 Lに調整します。1 L 50x TAEバッファーの最終pHを8.5に調整します。1x TAEワーキングバッファーを作るには、50x TAEバッファーの1部に49部の滅菌水を加えます。
- ゲルを0.5 μg/mLの臭化エチジウムで染色し、UVトランスイルミネーターで見えるようにして目視検査します。
- 根腐朽病剤とクラウン腐敗病原体分離株の系統関係を調べるためには、ベンダーを通じて双方向(5'-3'および3'-5')に合成したITS遺伝子塩基配列をPCRで取得します。塩基配列をNCBI(National Center of Biotechnology Information)のウェブサイトの遺伝子データや、Blastプログラムを用いて世界の他の フザリウム 分離株のITS遺伝子の塩基配列と比較します。これを使用して、以下で説明するように種レベルで分離株を特定します。
- https://www.ncbi.nlm.nih.gov Web サイトに移動します。「Popular Resources」セクションの「BLAST 」タブをクリックします。
- 新しいウィンドウで「 Nucleotide BLAST 」タブをクリックします。新しいウィンドウのEnter Query Sequenceセクションで、BaseシーケンスをFasta形式で入力し、Job Titleセクションにスタディの名前を記入します。
- その後、下部にある「検索セットの選択」セクションの「データベース」タブで 「標準データベース(nr など)」 をオンにします。
- 「Program Selection」セクションの「Optimize for」タブで 「Highly similar sequences (megablast)」 にチェックを入れ、ページ下部の 「BLAST 」タブをクリックします。
- MEGA 11系統解析プログラムを使用して、 Fusarium 分離株間の系統関係を決定します。ClustalWプログラムを使用して塩基配列を整列させ、ITS遺伝子26の最大倹約に従って分離株の遺伝的家族系統樹を作成します。
- Megaソフトウェアをダウンロードするには、Webサイト https://www.megasoftware.net にアクセスし、Megaソフトウェアをインストールします。MEGAソフトウェアは、研究や教育で使用するために無料で提供されています。
- まず、デスクトップ上のシーケンスをFASTA形式のメモ帳ファイル(.txt)として保存します。Megaソフトウェアプログラムを実行し、[ 位置合わせ ]タブをクリックします。ウィンドウで [Edit/Build Alignment ] をクリックします。続いて、新しいウィンドウで [新しい線形を作成] をオンにし、[ OK ]をクリックして確定します。
- DNAタブをクリックします。1 を削除します。ウィンドウに自動的に表示されるシーケンスに移動し、編集ファイルに移動し、[ファイルからシーケンスを挿入]タブをクリックします。シーケンスを含み、デスクトップ上にあるメモ帳 (.txt) ファイルを開きます。
- この段階では、すべてのシーケンスが画面に表示されます。まず、画面に表示される 任意のシーケンス をクリックし、 次にすべてのシーケンスをCTRL + Aでマークします。Alignmentファイルを開き、そこから Align by Clustal W をクリックし、 OK をクリックしてデフォルト設定でプログラムを実行します。
- 配列のアラインメントの違いを調べた後、データファイルに移動し、 系統発生解析 をクリックしてから、配列がタンパク質を合成するかどうかのウィンドウのチェックボックスで No をクリックします。私たちの配列は、ITS領域に属しているため、タンパク質を合成しません。
- Megaソフトウェアのメインウィンドウに戻ります。 [Phylogeny ] をクリックし、[ Construct/Test Maximum Parsimony Tree(s)] を選択します。新しいウィンドウで、系統発生テストの ブートストラップメソッド を選択し、ブートストラップ値1,000を入力してブランチの強度をテストします。「ギャップ/欠損データの処理」タブで、「 部分削除」を選択し、MP検索方法として 「Subtree-pruning-Regrafting(SPR)」 を選択し、「 OK 」をクリックして操作を確定します。
- 解析結果が系統樹を示すのを待ちます。
5. 病原性試験
- 分子的方法によって同定された Fusarium 種からの代表的な各種の病原性研究には、4つの分離株を使用してください。エアコンの効いた部屋で、24°C、16時間の蛍光灯/8時間の暗日長、湿度65%で病原性研究を行います。
- レンズ豆の種を直径5cmの45の穴がある黒いプラスチックバイアルに蒔きます。各バイアルを1%次亜塩素酸ナトリウムに3分間保持し、滅菌蒸留水で3回すすいでください。種子を滅菌キャビネットで24時間乾燥させ、各穴に1つの種子を播種します。
注:この病気に敏感なKayı91品種のレンズ豆の種子は、すべての病原性試験で使用されました6。接種方法27としては、苗浸漬技術を用いた。 - 各分離株の純粋培養物をPDAで24°Cで7〜10日間インキュベートします。培地の表面からストック培養から培養したコロニーをへらで掻き取り、滅菌蒸留水を使用して胞子/菌糸体懸濁液を調製します。
- 4層のチーズクロスによるろ過により懸濁液から大きな残留物を取り除き、血球計算盤を使用して胞子/菌糸体濃度を1 x 106 胞子/ mLに調整します。
- この段階の後、バイアルで以前に育てられた苗の根が2〜3本あるときに根こそぎにします。水道水で洗い、滅菌針で根をわずかに傷つけます。これらの苗を調製した胞子/菌糸体懸濁液に3分間浸し、次に滅菌土壌/泥炭(2:1; v / v)混合物を含むプラスチックバイアルに移植します。
- 防除として使用される苗木は、根を根こそぎにして傷つけてから、滅菌水のみに浸して植えます。接種プロセスの3週間後に、0〜4スケールに従って病原性試験の評価を行います。
- 計算された疾患の重症度値を角度変換した後、得られた値を分散分析の対象とし、テューキーのHSD(p = 0.05)検定に従って平均間の差を評価します。疾患の重症度:0%〜15%の分離株は非常に低い病原性(LV)であると評価され、16%〜35%の分離株は低病原性(LV)として評価され、36%〜50%の分離株は中程度の病原性(O)として評価され、51%〜70%の分離株は高病原性(VV)として評価され、71%〜100%の分離株は非常に高い病原性(VV)として評価され、疾患症状のない分離株は腐生性または着生性分離株として評価されました。
結果
疾患パラメータの決定
ヨズガットの9つの異なる地域をカバーする合計83のレンズ豆播種エリアが、萎凋病、根腐れ病、および冠腐病の症状の観点から評価され、1.1984 x 106 m2 の面積に広がっています(表2)。萎凋病や根腐れ病の症状は、すべての分野で発生しました。しかし、ヨズガットでの萎凋病と根腐れ病の発生率は16.9%と決定され、ソルグン地区とサルカヤ地区での病気の重症度は38.6%でした。この病気のかなりの発生率は、シェファートリ(26.4%)、ボアズラヤン(23.0%)、ソルグン(20.1%)の各地区でも確認されました。逆説的ですが、重症度が最も高いのはソルグン地区で45.2%、次いでボアズラヤンが36.0%、サルカヤが35.4%でした。さらに、調査したマークされた地域のレンズ豆畑から採取されたサンプルでは、679の植物が病気の症状を示しました(表3)。その後、2つのグループに分布する単離された真菌剤の形態学的同定が行われました。最初のグループに分類された フザリウム 分離株には、Alternaria sp.、Ascochyta sp.、 およびRhizoctonia sp.などの病原体または腐生植物が含まれていました。 フザリウム 分離株の分離率は95.4%でした。 F. oxysporum は、ヨズガットで病気の症状を示すレンズ豆植物から最も分離された真菌種として決定され、分離率は59.5%でした。この病原性 フザリウム 種に続いて、 F. graminearum (15.8%) と F. culmorum (10.2%) が続きました。逆説的ですが、 F. solani (4.4%)と F. acuminatum (5.5%)は、病気の症状を示す植物から低レベルで分離されました。 F. oxysporum は、調査研究が実施されたすべての地区から取得され、地区ごとの分離率は45.3%から72.2%の間で分布していました。 F. oxysporum は、ヨズガットの中央地区(72.2%)、シェファートリ地区(71.9%)、アクダマデニ地区(68.3%)、ソルグン地区(62.2%)で最も多く分離されました。対照的に、 F. solani と F. acuminatum は、ヨズガットで最も分離されていない Fusarium 種でした。 F. solani は、ÇekerekとCentral地区から孤立していませんでした。 F. acuminatum は、Akdağmadeni、Central、Şefaatli地区からも分離されませんでした(表3)。
形態学的同定
Fusarium分離株の純粋な培養物は、それらのコロニーの特徴、ならびに微小分生子、マクロ分生子、およびクラミド胞子の構造に従って形態学的に同定されました。同定研究は種レベルで実施された、とLeslieとSummerell22は言う。レンズ豆の萎凋病、根、および根襟腐病の症状を示す植物から得られたすべての真菌分離株は、コロニーと微小形態に従って6つのグループに収集されました(表3)。最初の5つのグループにはフザリウム種に属する分離株が含まれていましたが、他のグループには、Alternaria、Rhizoctonia、Ascochytaなど、Fusarium属以外の病原性真菌分離株が含まれていました。
分離率が最も高いF.oxysporum分離株は、白から黄色のコロニーとライラック紫色の色素沈着を持っています。マクロコニアは短から中の長さで、わずかに湾曲しており、通常は3〜5個の中隔があります。一部の分離株の胞子構造は、33.8〜71.5μm x 3.1〜4.5μmとして決定された大分生子の寸法でわずかに引っ掛かっています。微分生子は、一般に、中隔なし、楕円形、楕円形、または腎臓の形をしています。クラミド胞子の形成はゆっくりと(4〜6週間)起こりました。それは二重クラスターと短い鎖構造16で観察された。
分離率が最も高い2番目の種である F.graminearum 分離株は、白ピンクの空中菌糸体と暗赤色の色素沈着を持っています。大分生子は細い、まっすぐ、またはわずかに湾曲しており、中隔は5〜7つあります。セプタムはかなり独特です。それは尖った頂細胞とはっきりとした足の形をした基底細胞を持っています。寸法は25.7〜97.3μm×3.5〜5.5μmです。Microconidiaおよびchlamydosporeの形成は観察されなかった28。
第3グループの F. culmorum 分離株のコロニーは、最初は白かったが、年齢とともに、淡いピンク色から濃いピンク色の菌糸体構造が観察された。Macroconidiaは短く、4〜6隔壁でわずかに湾曲しています。マクロスポアの寸法;15.8 - 60.0 μm x 3.2 - 5.1 μm彼らはたくさんいます。小胞子は観察されませんでした。クラミドスポアの形成は、他の種に比べて急速です(3〜5週間)。それらは単独で、または2つの29のクラスターで見つかります。
4番目の種である F.acuminatum 分離株のコロニーは、淡いオレンジ、オレンジ、および明るいバーガンディです。比較的成長の遅い種です。その大分生子は薄く、明確な湾曲を持ち、3〜5の中隔構造を持っています。分生子の寸法は、31.0〜65.5×4.3〜6.6μmと決定されました。Microconidiaには0と1のセプテートがあります。顕微鏡画像ではめったに観察されませんでした。クラミド胞子の形成は非常に遅い(6週間以上)。それは鎖とクラスター22で形成されます。
最後に同定された病原性種である F.solani 分離株のコロニーの色は、白とクリーム色です。そのマクロコニアは幅が広く、平らで、わずかに湾曲しています。菌糸は3〜7隔状で豊富です。大胞子の寸法は、20.2〜50.6μm×3.1〜6.2μmと決定されます。Microconidiaは未分割または1分割です。それらは楕円形で楕円形の構造です。クラミド胞子は、2〜4週間以内にCLA培地の短鎖に末端に見られます30。
分子同定
PCRは、ITS4/ITS5プライマーを用いて、 Fusarium 分離株から得られた全ゲノムDNAを用いて行いました。二方向(5'-3'および3'-5')塩基配列を登録し、Blastプログラムを使用して他のNCBI GenBankと比較しました(表4 および 表5)。 F. oxysporum 分離株は、インド(MT740398)、リトアニア(KF646094)、ドイツ(MT453296)の分離株と99.5%から100%のヌクレオチド配列の均質性を示しました。 F. culmorum 分離株は、カナダ(AY147290)、フランス(OW983123)、およびチェコ(MT453296)の分離株と100%のヌクレオチド配列の均質性を示しました。 F. graminearum 分離株は、コロンビア (MT598163) および中国 (ON527490) の分離株と 99.5% から 100% のヌクレオチド配列の均質性を示しました。 F. acuminatum 分離株は、ウズベキスタン(OR975902)および中国(MZ424810、PP336554)からの分離株と99.5〜100%のヌクレオチド配列の均質性を示しました。 F. solani 分離株は、エジプト(OR713084)、中国(PQ482231)、およびインド(OP848138)の分離株と100%のヌクレオチド配列の均質性を示しました。次に、 Fusarium 分離株間の遺伝的関係は、Mega 11プログラム(図3)を使用したMaximum Parsimony(MP)法に従って得られた系統樹によって決定されました。MP系統樹では、ギャップを含む638のヌクレオチド特性が使用され、これらのヌクレオチドのうち145が倹約を提供する情報領域として決定されました。MP分析により、最も倹約的な木の1つが得られました(図3;木の長さ:172;一貫性指数(ConI):0.974;リテンションインデックス(RI):0.961;総合指数(ComI):0.7600)。 このフザリウム 分離株のMP樹状図を調べたとき、家系図は最初に2つの主要な枝に分割されました。これらのうちの最初のものは、100%ブートストラップ値でサポートされるすべての F.solani 分離株に対応していました。もう一方の主要な枝は、78%のブートストラップ値と4つのサブグループ F.acuminatum、 F.redolens、 F.proliferatum 、 およびF.acutatumでそれ自体に集められました。もう一方の主要な枝は、 F. oxysporum、 F. culmorum、 F. graminarum、 F. pseudograminearum 、 および F. equiseti の 5 つのサブグループに分けられ、ブートストラップ値は 97% でした。
Fusarium分離株の病原性レベルの決定
レンズ豆から分離された Fusarium spp.の病原性研究の結果は、萎凋病と根腐れを示し、形態学的および分子的特性評価研究が完了したことを 表6 と 図4にまとめた。一般に、すべての フザリウム 分離株は、Kayı 91レンズ豆品種F(19-60; 0.05) = 43.06で引き起こした疾患の重症度レベルに違いを示しました。p< 0.0001)。最も毒性の強い分離株は、F. oxysporum (YBUFol4)、 F. culmorum (YBUFc1、YBUFc2)、 F. graminearum (YBUFg1、YBUFg3) でした。これらの5つの分離株は、非常に高い病原性レベルを有することがわかった。一方、 F. oxysporum (YBUFol2)、 F. solani (YBUFs1)、 F. graminearum (YBUFg2) の分離株は、それぞれ 1 つずつ中程度の病原性を持つことがわかった。さらに、 F. acuminatum (YBUFa1、YBUFa2、YBUFa3、およびYBUFa4)分離株は、病原性が弱いか低いことがわかった。病原性試験で使用されたすべての分離株は42.5%から97.5%の範囲であり、レンズ豆の苗の接種後に得られた。

図1:フザリウム種の影響を受けたレンズ豆植物。(A)疾患の重症度が高いレンズ豆畑の限局性疾患領域の一般的な見方。(B)病気の重症度を持つ植物の眺め 4.(C)病気の重症度を持つ植物の眺め3。この図の拡大版を表示するには、ここをクリックしてください。

図2:病気の重症度レベル0〜4のレンズ豆植物の図。レベル0 =症状は示さず、1 =葉の症状は25%です。2 = 26%-50%;3 = 葉の51%-75%。4 = 同じ順序で 75% 以上。この図の拡大版を表示するには、ここをクリックしてください。
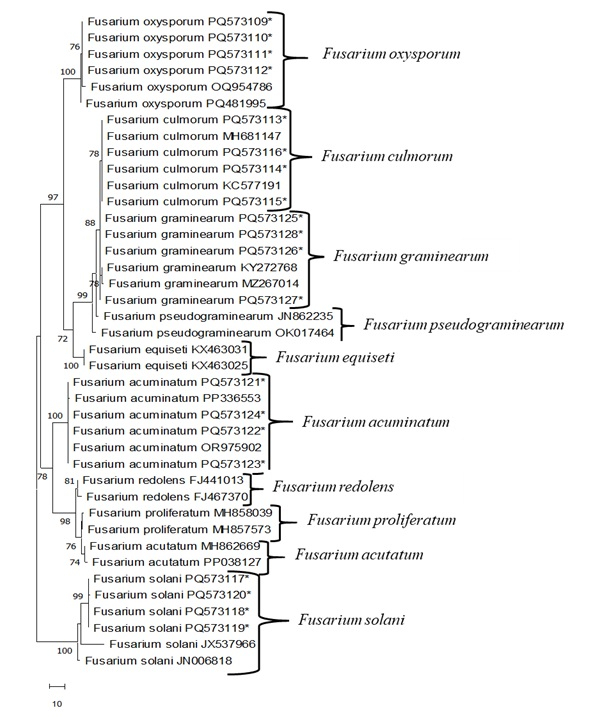
図3:MEGA 11を使用した Fusarium sp.のITS領域に基づく最も倹約的な根のない木。分離株はアスタリスクで示されます。残りはGenBankから取得されます。この図の拡大版を表示するには、ここをクリックしてください。
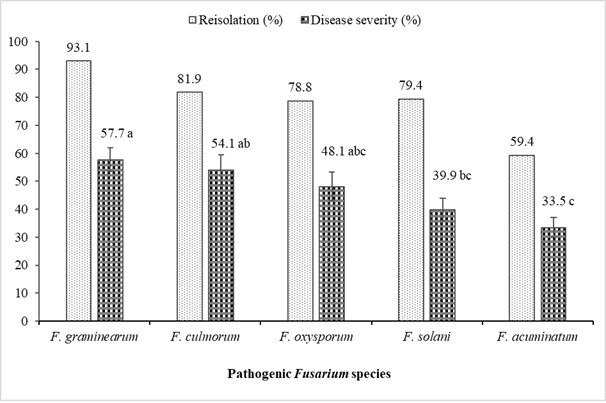
図4:レンズ豆植物から単離されたフザリウム属の再隔離(%)と疾患の重症化率(%)。縦線はバー(n = 16)の標準誤差を表します。この図の拡大版を表示するには、ここをクリックしてください。
| 温度 (°C) | 相対湿度(%) | 降水量 (mm) | |||||||
| 月 | 2022 | 2023 | 長期 | 2022 | 2023 | 長期 | 2022 | 2023 | 長期 |
| Akdağmadeni | |||||||||
| 3 月 | 11.1 | 7.4 | 3.8 | 45.1 | 68.8 | 71.1 | 21.4 | 78.7 | 60.6 |
| 4 月 | 11.1 | 11.4 | 8.8 | 59.2 | 67 | 61.5 | 56.5 | 109.8 | 42.6 |
| 5 月 | 16.3 | 15.1 | 12.9 | 64.3 | 73.9 | 64.8 | 48.5 | 83.6 | 74.1 |
| 6 月 | 16.5 | 18.4 | 16.2 | 63.4 | 53.2 | 69.1 | 0.3 | 20.1 | 57.2 |
| 7 月 | 22 | 22.2 | 18.7 | 48 | 40.5 | 60.5 | 1.4 | 0 | 7 |
| ボアズルヤン | |||||||||
| 3 月 | 12.3 | 9.9 | 5.2 | 47.8 | 65.5 | 66 | 13 | 64 | 40.1 |
| 4 月 | 12.8 | 13.5 | 10.2 | 62.6 | 66.6 | 59.3 | 20.2 | 24.2 | 24.4 |
| 5 月 | 18.7 | 17.7 | 14.6 | 62.5 | 67.4 | 61.2 | 65.4 | 20 | 35.1 |
| 6 月 | 19.7 | 20.6 | 18.6 | 52.9 | 49.9 | 59.9 | 0 | 2.4 | 35.5 |
| 7 月 | 24.3 | 24 | 21.7 | 42.5 | 39.5 | 50 | 0 | 0 | 3.9 |
| チェケレク | |||||||||
| 3 月 | 13.5 | 10.8 | 6.6 | 52.8 | 70.4 | 69 | 24.3 | 111.3 | 48.7 |
| 4 月 | 14.1 | 13.9 | 11.5 | 63.9 | 72.3 | 61 | 48.1 | 73.4 | 32 |
| 5 月 | 19.3 | 18.6 | 15.8 | 69.1 | 72.7 | 65.4 | 80.3 | 69 | 59.3 |
| 6 月 | 20.1 | 21.8 | 19.4 | 61.5 | 57.5 | 67.8 | 0 | 16.4 | 62.8 |
| 7 月 | 24.6 | 24.7 | 22 | 57.8 | 52.4 | 57.5 | 33.2 | 0 | 10.9 |
| ヨズガット | |||||||||
| 3 月 | 11.5 | 8.4 | 4 | 47.3 | 68.7 | 67.5 | 14.6 | 84.8 | 87.3 |
| 4 月 | 12.4 | 12.7 | 9.3 | 60.1 | 65.2 | 58.7 | 47.4 | 54.4 | 41.9 |
| 5 月 | 17.5 | 16.8 | 13.7 | 64.2 | 68 | 60.2 | 92.6 | 61.6 | 72.2 |
| 6 月 | 18.3 | 20.3 | 17.4 | 57.9 | 50.7 | 61.2 | 1 | 4.8 | 63.6 |
| 7 月 | 22.9 | 23.6 | 20.5 | 50.9 | 44.3 | 52.7 | 7 | 0.2 | 8.8 |
| サライケント | |||||||||
| 3 月 | 14.8 | 9 | 6.2 | 50.9 | 71.1 | 71 | 11.1 | 77.3 | 55.3 |
| 4 月 | 12.5 | 12.3 | 10.5 | 64.6 | 73.2 | 60.7 | 35.3 | 36.1 | 29 |
| 5 月 | 17.6 | 16.4 | 14.2 | 69.1 | 76.7 | 65.9 | 47.8 | 72.4 | 57 |
| 6 月 | 18.2 | 19.2 | 18.2 | 63.8 | 61 | 69.6 | 0 | 28.6 | 56.1 |
| 7 月 | 23.2 | 23.1 | 21.6 | 54.2 | 51.7 | 57.9 | 0 | 0 | 7.4 |
| サルカヤ | |||||||||
| 3 月 | 12.9 | 9.6 | 5.6 | 47 | 68.2 | 66.5 | 18.4 | 75.5 | 53.6 |
| 4 月 | 13.2 | 13.1 | 10.7 | 59 | 68.8 | 56.5 | 24.8 | 60.6 | 27.2 |
| 5 月 | 18.5 | 17.3 | 14.7 | 63.2 | 71.6 | 60.6 | 57.6 | 64.5 | 47.2 |
| 6 月 | 18.9 | 20.5 | 18.4 | 59 | 53.9 | 62 | 0 | 16.1 | 50.6 |
| 7 月 | 24 | 24 | 21.3 | 48.6 | 45.4 | 51.5 | 0 | 0 | 6.4 |
| シェファートリ | |||||||||
| 3 月 | 13.1 | 10.6 | 6.2 | 48.2 | 61.1 | 67 | 12.6 | 71.5 | 50.2 |
| 4 月 | 11.2 | 14.3 | 11.1 | 61.6 | 60.9 | 58.6 | 48.4 | 50.5 | 26 |
| 5 月 | 19.9 | 18.6 | 15.4 | 66.7 | 61.9 | 62.3 | 65.2 | 95.4 | 53.7 |
| 6 月 | 20.4 | 22.2 | 19.7 | 55.8 | 45.5 | 61.2 | 1.2 | 2.5 | 46.8 |
| 7 月 | 25 | 25.3 | 23.2 | 47.9 | 39.5 | 47.1 | 0 | 0 | 4.1 |
| ソルグン | |||||||||
| 3 月 | 12.2 | 9.4 | 4.8 | 48.4 | 68.2 | 67 | 21.6 | 104.2 | 49.8 |
| 4 月 | 13 | 13.3 | 10.1 | 59.7 | 66.1 | 58.9 | 53.2 | 33.8 | 31.7 |
| 5 月 | 18.3 | 17.4 | 14.5 | 63.7 | 69.1 | 60.9 | 56.6 | 89.6 | 44.2 |
| 6 月 | 18.9 | 20.3 | 18.3 | 56.8 | 53.4 | 61.5 | 0 | 16.6 | 55.2 |
| 7 月 | 23.7 | 23.7 | 21.2 | 50 | 44.9 | 52.9 | 4 | 0 | 7.5 |
| ヤルキョイ | |||||||||
| 3 月 | 15 | 12.1 | 6 | 41.2 | 60.5 | 61.3 | 4.4 | 46.1 | 60.1 |
| 4 月 | 16.2 | 16.2 | 13.5 | 54.8 | 60.4 | 50.9 | 40.9 | 46.8 | 23 |
| 5 月 | 21.5 | 20.6 | 17.4 | 55.4 | 59.6 | 52.2 | 57 | 23.6 | 35.1 |
| 6 月 | 23 | 24.5 | 20.9 | 45.2 | 41.4 | 56.4 | 0.2 | 0 | 39.1 |
| 7 月 | 27.5 | 27.7 | 24.4 | 38.2 | 35.5 | 42.2 | 0.2 | 0 | 3.5 |
表1:レンズ豆の生産シーズンに調査した場所の年ごとの気象データ。
| 郡 | フィールドの数 | 調査播種面積(デカレ) | 疾患の有病率(%) | 疾病発生率(%) | 疾患の重症度(%) |
| Akdağmadeni | 4 | 43.2 | 100 | 7 | 21.8 |
| ボアズルヤン | 4 | 86.4 | 100 | 23 | 36 |
| チェケレク | 1 | 2.7 | 100 | 1.6 | 14.4 |
| メルケズ | 3 | 24.3 | 100 | 5.8 | 23 |
| サライケント | 6 | 53.3 | 100 | 8.1 | 28.2 |
| サルカヤ | 12 | 189.3 | 100 | 17 | 35.4 |
| ソルグン | 48 | 683.2 | 100 | 20.1 | 45.2 |
| シェファートリ | 2 | 73.7 | 100 | 26.4 | 23.4 |
| ヤルキョイ | 3 | 42.3 | 100 | 9.1 | 32.9 |
| 全 | 83 | 1198.4 | 100 | 16.9 | 38.6 |
表2:レンズ豆畑における萎凋病、根腐れ病、根腐れ病の疾患パラメータ、有病率、発生率、重症度。
| 郡 | 分離に使用されるプラントの数 | アイソレーション周波数(%) | |||||
| F.オキシスポラム | F.カルモラム | F.ソラニ | F.アキュミナタム | F.グラミネアラム | 他 | ||
| Akdağmadeni | 41 | 68.3 | 9.8 | 2.4 | 0 | 14.6 | 4.9 |
| ボアズルヤン | 57 | 54.4 | 1.8 | 12.3 | 7 | 15.8 | 8.8 |
| チェケレク | 21 | 52.4 | 4.8 | 0 | 23.8 | 9.5 | 9.5 |
| メルケズ | 36 | 72.2 | 11.1 | 0 | 0 | 13.9 | 2.8 |
| サライケント | 64 | 45.3 | 12.5 | 7.8 | 4.7 | 21.9 | 7.8 |
| サルカヤ | 148 | 56.8 | 11.5 | 7.4 | 5.4 | 15.5 | 3.4 |
| ソルグン | 233 | 62.2 | 9.4 | 1.3 | 7.3 | 16.3 | 3.4 |
| シェファートリ | 32 | 71.9 | 15.6 | 3.1 | 0 | 9.4 | 0 |
| ヤルキョイ | 47 | 57.4 | 14.9 | 4.3 | 2.1 | 14.9 | 6.4 |
| 全 | 679 | 59.5 | 10.2 | 4.4 | 5.5 | 15.8 | 4.6 |
表3:トルコのヨズガット県からサンプリングされた真菌分離周波数のレンズ豆に関する情報。
| フザリウム種 | 隔離する | 郡 | 分離ソース | GeneBankアクセッション番号 |
| F.オキシスポラム | YBUホール1 | ソルグン | 根 | PQ573109 |
| YBUフィル2 | ボアズラヤン | ルートカラー | PQ573110 | |
| YBUFol3 | サルカヤ | 根 | PQ573111 | |
| YBUFol4 | アクダグマデニ | 根 | PQ573112 | |
| F.カルモラム | YBUFc1 | ソルグン | 根 | PQ573113 |
| YBUFc2 | ヤルキョイ | 根 | PQ573114 | |
| YBUFc3 | サルカヤ | 根 | PQ573115 | |
| YBUFc4 | サライケント | ルートカラー | PQ573116 | |
| F.ソラニ | YBUFs1 | ヨズガット | 根 | PQ573117 |
| YBUFs2 | ソルグン | 根 | PQ573118 | |
| YBUFs3 | セファートリ | 根 | PQ573119 | |
| YBUFs4 | サルカヤ | 根 | PQ573120 | |
| F.アキュミナタム | YBUFa1(イーブファ1) | チェケレク | 根 | PQ573121 |
| YBUFa2(ユブファ2) | ボアズラヤン | ルートカラー | PQ573122 | |
| YBUFa3 | サルカヤ | ルートカラー | PQ573123 | |
| YBUFa4(イブファ4) | ソルグン | 根 | PQ573124 | |
| F.グラミネアラム | YBUFg1 | ヨズガット | 根 | PQ573125 |
| YBUFg2 | ソルグン | 根 | PQ573126 | |
| YBUFg3 | サライケント | 根 | PQ573127 | |
| YBUFg4 | サルカヤ | ルートカラー | PQ573128 |
表4:系統発生研究で使用されたトルコ中部のヨズガット県産レンズ豆(Lens culinaris)から分離されたフザリウム属。
| フザリウム 種 | 隔離する | 国 | 分離ソース | GenBankアクセッション番号 |
| F.アキュミナタム | AAG4の | 該当なし | サクラペルシカ | OR975902 |
| WHWNSHJ1 | 中国 | マルス・ドメスティカ | PP336553 | |
| F.アクタタム | CBSの739.97 | インド | 該当なし | MH862669 |
| NSF1の | エジプト | テトラエナアルバ | PP038127 | |
| F.カルモラム | 2090 | インド | 該当なし | KC577191 |
| G49の | ポーランド | ピサム・サティヴム | MH681147 | |
| F.エクイセティ | フザリウム・エクイセティ A577型 | 中国 | パチョリ | KX463031 |
| フザリウム・エクイセティ A571の | 中国 | パチョリ | KX463025 | |
| F.グラミネアラム | WM-233 | 中国 | 該当なし | MZ267014 |
| 16a | 該当なし | 該当なし | KY272768 | |
| F.オキシスポラム | YBUフォック4 | トルコ | Cicer arietinum | OQ954786 |
| LuC-8 | 中国 | 菊×モリフォリウム | PQ481995 | |
| F.増殖 | CBSの246.61 | ドイツ | 該当なし | MH858039 |
| CBSの186.56 | 該当なし | 該当なし | MH857573 | |
| F.シュードグラミネアラム | WZ-8Aの | 中国 | 麦 | JN862235 |
| GAAET080 | 中国 | トウモロコシ | OK017464 | |
| F.レドレンズ | M11の | 該当なし | 茸 | FJ441013 |
| 2008 | 該当なし | 茸 | FJ467370 | |
| F.ソラニ | S2-27 | フランス | 該当なし | JX537966 |
| UENFCF279 | ブラジル | グアバ | JN006818 |
表5: GenBankの系統発生研究に使用したフザリウム種の配列。
| フザリウム 種 | 隔離する | 疾患の重症度 (%) | アイソレートの病原性レベル | 再分離 (%) |
| (平均±標準誤差) | ||||
| F.オキシスポラム | YBUホール1 | 20. 0 ± 1.1 i | 弱い | 62.5 |
| YBUフィル2 | 56.9 ± 1.2 CDE | ほどほど | 85 | |
| YBUFol3 | 42.5 ± 1.0 EFG | レス | 77.5 | |
| YBUFol4 | 73.1 ± 3.9 AB | 頗る | 90 | |
| F.カルモラム | YBUFc1 | 72.5 ± 1.0 AB | 頗る | 95 |
| YBUFc2 | 72.5 ± 2.7 AB | 頗る | 95 | |
| YBUFc3 | 23.6 ± 1.6 こんにちは | 弱い | 60 | |
| YBUFc4 | 48.1 ± 2.6 デフ | レス | 77.5 | |
| F.ソラニ | YBUFs1 | 58.8 ± 1.6 BCD | ほどほど | 97.5 |
| YBUFs2 | 46.9 ± 2.1 デフ | レス | 75 | |
| YBUFs3 | 17.5 ± 2.3 i | 弱い | 65 | |
| YBUFs4 | 36.3 ± 1.6 FGH | レス | 80 | |
| F.アキュミナタム | YBUFa1(イーブファ1) | 42.5 ± 2.3 EFG | レス | 65 |
| YBUFa2(ユブファ2) | 16.9 ± 2.8 i | 弱い | 42.5 | |
| YBUFa3 | 30.6 ± 6.1 こんにちは | レス | 62.5 | |
| YBUFa4(イブファ4) | 44.1 ± 7.1 デフ | レス | 67.5 | |
| F.グラミネアラム | YBUFg1 | 76.3 ± 2.2 a | 頗る | 97.5 |
| YBUFg2 | 50.6 ± 3.3 デフ | ほどほど | 92.5 | |
| YBUFg3 | 68.1 ± 2.1 ABCの | ほどほど | 95 | |
| YBUFg4 | 35.6 ± 1.9 FGH | レス | 87.5 |
表6:レンズ豆植物に対するフザリウム種の病原性試験。分離平均ランク <10% = 非攻撃的。11%-25% = 弱い攻撃性;26%-50% = 攻撃性が低い。51%-70% = やや攻撃的。>70% = 非常に攻撃的。 ある Tukey HSD検定による分離株間の統計的差(p < 0.05)。
ディスカッション
フザリウム 萎凋病は、世界の一部の地域で深刻な経済的収量損失を引き起こすことが知られています31。この病気はハンガリーで最初に報告され32 、その後、エジプト、インド、ミャンマー、ネパール、パキスタン、トルコ、シリア、米国などの多くの国で報告されました33。Kumar et al.34 は、レンズ豆の萎凋病、根、および根の襟腐れの広範な分布を報告し、少なくとも世界26か国での発生が報告されています。最近の研究では、インドのさまざまな州から収集された病気のレンズ豆植物から12の真菌種が分離され、 F. oxysporum f. sp. lentis が最も重要な病原体(30%)として特定され、次いで Rhizoctonia bataticola (17.5%)と Sclerotium rolfsii (15.7%)31。同様に、本研究では、最も多く分離された真菌属は フザリウム (95.4%)でした。Zitnick-Anderson et al.7によると、 フザリウム (50%)は、ノースダコタ州のレンズ豆プランテーションで萎凋病、根腐れ、根襟腐れを引き起こす主要な真菌属でした。彼らはまた 、F. oxysporum、F. solani、F. culmorum、F. equiseti、F. acuminatum、F. graminearum、F. redolens 、 および F. avenaceum がこの属の病原体であると報告しました。
この研究で同定された5つの フザリウム 種の形態学的特徴は、最近の研究の形態学的特徴と類似していた35。Rathod et al.36によると、 F. oxysporum 分離株は、PDA上で中隔、分岐、最初は白、その後、隆起または沈没したコロニーの発達を示し、それがさまざまな色素沈着で着色されたと報告しました。同様に、現在の研究では、 F. oxysporum 分離株は最初に白いコロニーを形成し、後に黄色、紫色、またはピンク色を形成しました。一方、 F. oxysporum isolatesの同定の形態学的基準として使用された2本または3本の鎖の形のクラミドスポアは、約30日齢のコロニーで観察されました。実際のところ、Endes15 は、ヨズガット州のひよこ豆栽培地域の植物に感染する傾向が高かったから>30日間保持された F.oxysporum 分離株のクラミドスポアは、一般的に古い環境で観察されたと報告しました。
ひよこ豆やレンズ豆のフザリウム根腐れは、F. solani、F. oxysporum、F. graminearum37などの多くのフザリウム種によって引き起こされます。Deanらによって報告されているように、F. graminearumおよびF. oxysporumは、世界中の植物真菌学者によって最も一般的に単離された植物真菌病原体の1つです。しかし、Aydın et al.6 は、F. graminearum がトルコ南東部アナトリア地方のレンズ豆栽培地域における萎凋病、根腐れ、冠腐れの原因物質の一つであると報告しました。さらに、F. graminearumは、米国ノースダコタ州のレンズ豆に根腐れと冠腐れを引き起こすことが知られています7。
Fletcherら39 は、レンズ豆の栽培地域で F.culmorum が病原体として分離されることはめったにないことを報告しました。さらに、Zitnick-Andersonらによる最近の研究では7、 F. culmorum はレンズ豆植物の萎凋病、根、根の襟腐れに関連していることが報告されました。しかし、Aydınら6 は、レンズ豆の栽培地域で萎凋病や根腐れを引き起こす多くの フザリウム 種を特定しましたが、病原体として F.culmorum を報告していませんでした。この状況は、現在の研究とは異なるが、調査対象地域の数が異なることや、現在の研究で分子的方法による形態学的研究が支持されていることが原因と考えられます。
Zitnick-Andersonら7 は、 F. acuminatum がノースダコタ州のレンズ豆畑で萎凋病と根と根の襟腐れを引き起こす Fusarium 種の1つであると報告しました。一方、Aydınら6 は、 F.solani がレンズ豆栽培地域における萎凋病と根腐れの原因物質の1つであることを文書化しました。 また、F. solani は弱い病原体としてレンズ豆の栽培地域から分離されていることも知られている7。
フザリウム 種は通性寄生虫です。レンズ豆の フザリウム 属による感染は、特に春の終わりや初夏の極端な気温で、植物の完全な破壊を引き起こす可能性があります。Al Ahmad and Mouselli40 は、シリア南部のレンズ豆プランテーションで 、F. oxysporum と F. solani が黄変、落葉、乾燥症状を引き起こしたと報告した。 F. solani は、Yozgat16を含む中央アナトリアで根腐れ病と萎凋病を引き起こします。さらに、他のいくつかの フザリウム 種も特定の割合で病原性であることがわかっています。Zitnick-Andersonら7 は、 フザリウム 萎凋病は Fusarium oxysporum f. sp lentisによって引き起こされるが、形態学的、生理学的、病理学的特性に応じて 、F. culmorum、F. solani、F. graminearum 種も萎凋病を引き起こす可能性があると報告した。さらに、Fletcherら39 は、レンズ豆の萎凋病や根腐れの原因となる F. acuminatumは、病原性が弱いか低いと報告しています。
この研究では、調査したレンズ豆畑から得られた フザリウム 分離株の95.4%が フザリウム 種であり、レンズ豆植物の発生率は1.6%〜26.4%、疾患の重症度は14.4%〜45.2%であることが明らかになりました。暑くて乾燥した春や初夏の暑さなどの悪天候は、植物の成長を弱め、植物を フザリウム 種に敏感にします。ほとんどの フザリウム 種は弱い病原体であり、環境条件が宿主植物を弱めると、特に干ばつ状態で フザリウム 萎凋病が増加します。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、ボゾク大学プロジェクト調整アプリケーション研究センター、BAP ユニット (プロジェクト番号 FÇD-2022-1096) の支援を受けました。この研究は、Sevim Atmacaの博士課程の研究の一部です。
資料
| Name | Company | Catalog Number | Comments |
| (S)-lactic acid | Merck | 100366 | Was used as an antibiotic in studies. |
| 2-propanol | Merck | 109634 | Used in molecular studies. |
| Adjustable micro automatic pipette (0.1-2.5 µL) | Eppendorf Research | LB.EP.3123000012 | Used to measure small volumes of liquids. |
| Adjustable micro automatic pipette set (2 – 20 µl, 20 – 200 µl, 100 – 1.000 µl) | Eppendorf Research | LB.EP.4924000916 | Used to measure small volumes of liquids. |
| Agar | Merck | 110453 | For use in making fungal media. |
| Agarose | Sigma-Aldrich | 18300012 | For use in gel preparation in electrophoresis. |
| Air conditioning room | ?klimlab | Was used to grow plants under controlled conditions. | |
| Ampisilin | Sigma-Aldrich | A9393 | Was used as an antibiotic in studies. |
| Analytical precision balance | Shimadzu ATX224 | Was used to weigh the solid materials used in the study. | |
| Autoclave sterilizer | Zealway | GF-120DR | It was used to sterilize solid and liquid materials at every stage of the study. |
| Binocular microscope | Leica DM750 | For use in morphological diagnosis. | |
| Biological safety cabinet | HFsafe Class II A2 | To ensure the safety of the work area, the user, the environment and the operation. | |
| Centrifugal | DLAB DM1424 | LB.DL.903001124 | Used to separate particles in a sample based on their shape, size and density |
| Chloramphenicol | Sigma-Aldrich | 220551 | Was used as an antibiotic in studies. |
| Cork-borer set | Sigma-Aldrich | Z165220 | It was used to take samples from fungus culture in petri dishes. |
| Cover glass and slide | ISOLAB | 075.01.006 / 075.02.005 | Was used in the preparation process for microscope studies. |
| D(+)-glucose monohydrate | Merck | 108342 | For use in making fungal media. |
| DFC450 with digital camera | Leica | Digital microscope camera with c-mount interface and with a 5 megapixel ccd sensor. | |
| Dm750 binocular microscope | Leica | MIC5246 | Was used for morphological identification of fungi. |
| DNA gel electrophoresis | thermo fisher scientific | B2-UVT | |
| Dna gel loading dye (6x) | Thermo Scientific | R0611 | For use in molecular diagnostics. |
| dNTP mix | Thermo Scientific | R0192 | Used in molecular studies. |
| Dreamtaq pcr master mixes (2x) | Thermo Scientific | K1082 | For use in molecular diagnostics. |
| Drigalski spatule | ISOLAB | 082.03.001 | It was used to scrape and spread fungal cultures grown in petri dishes. |
| Edta | Thermo Scientific | 17892 | For use in molecular diagnostics. |
| Ethanol | Merck | 100983 | Used in molecular studies and surface disinfection studies. |
| Ethidium bromide | Sigma-Aldrich | E7637 | Used to stain dna in gels during gel electrophoresis. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | Used in molecular studies. |
| Filter paper | ISOLAB | 107.58.158 | Used in stock culture studies. |
| Forced air drying cabinet | ZHICHENG ZXDS-A-1090 | For use in incubation processes. | |
| Fume hood | Elektromag EM1201 | LB.EM.EM1201 | It was used to control harmful chemical vapors, gases and dust. |
| Gel imaging system | Syngene G:BOX Chemi XX6 | For use in molecular diagnostics. | |
| Generuler 50 bp dna ladder | Thermo Scientific | SM0372 | For use in molecular diagnostics. |
| Glacial acetic acid | Merck | 1005706 | Used in molecular studies. |
| Glycerol | Merck | 104094 | For use in stock culture of fungi. |
| Lancet | ISOLAB | 048.50.002 | Used to remove diseased tissue from plant samples. |
| Magnesium chloride | Sigma-Aldrich | 814733 | Used in molecular studies. |
| Measuring tape | ISOLAB | 016.07.500 | Used to measure liquid volumes. |
| Microcentrifuge tubes | ISOLAB | 0778.03.001 / 0778.03.002 / 0778.03.003 | Used to store different volumes of liquids. |
| PCR tube | ISOLAB | 123.01.002 | It was used to put dna mix in pcr studies. |
| Petri dishes | ISOLAB | 120.13.090 | For use in growing fungus culture. |
| Pipette tips | ISOLAB | 005.01.001 / 005.01.002 / 005.01.003 / 005.01.004 | To transfer liquid volumes used in analyses. |
| Plastic bag | ISOLAB | 039.30.005 | Was used to transport samples to the laboratory. |
| Plastic pot | ToXA | Was used for growing plants. | |
| Pliers, clamps | ISOLAB | 048.08.130 | It was used to put filter papers into envelopes after the fungus grew in the petri dish. |
| Porcelain mortar | ISOLAB | 038.02.150 | Was used to crush fungal mycelia. |
| Potato dextrose agar | Condalab | 1022 | For the identification and cultivation and of fungi. |
| Pure water system | human CORPORATION | LT.HC.NHP009 | Was used in solution preparation and analysis throughout the studies. |
| Refrigerator (+4 °C / -20 °C) | Vestel | For use in the storage of stock materials. | |
| Rifampicin | Sigma-Aldrich | 557303 | Was used as an antibiotic in studies. |
| Sodium acetate | Merck | 106268 | Used in molecular studies. |
| Sodium chloride | Merck | 1064041000 | Used in molecular studies. |
| Sodium dodecyl sulfate | Sigma-Aldrich | 436143 | Used in molecular studies. |
| Sodium hypochlorite solution | Merck | 105614 | Used for surface disinfection. |
| Spatula | ISOLAB | 047.33.210 | It was used to scrape the fungus culture growing in petri dishes. |
| Streptomyc?n sulfate | BioShop Canada | STP101 | To prevent contamination in fungal culture cultivation. |
| Teksoll extra pure | Tekkim | TK.200650 | For use as a disinfectant in all stages of work. |
| Tetrasiklin | Sigma-Aldrich | T3258 | Was used as an antibiotic in studies. |
| Thermal cycler PCR | Bio?Rad T100 | For use in genomic analyses. | |
| Thoma lam | ISOLAB | 075.03.002 | For use in spore counting. |
| Tris HCL | Roche | 10812846001 | Used in molecular studies. |
| Trizma | Sigma-Aldrich | T1503 | Used in molecular studies. |
| Tween 80 | Merck | 822187 | For use in spore solution in pathogenicity testing. |
| Vortex mixer vorteks | Velp WIZARD | LB.VLP.F202A0175 | Used to mix substances in liquid volumes. |
| Water baths | Memmert WNB 22 | 1018-5702 | It was used during incubation in dna extraction studies. |
参考文献
- Skrzypkowski, W., Kiełkowska, A. Current status of haploidization in cool-season grain legume crop species. Agriculture. 14 (7), 1031 (2024).
- Liber, M., Duarte, I., Maia, A. T., Oliveira, H. R. The history of lentil (Lens culinaris subsp. culinaris) domestication and spread as revealed by genotyping-by-sequencing of wild and landrace accessions. Front Plant Sci. 12, 628439 (2021).
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data (2022)
- TÜİK. . Agricultural statistics report. , (2023).
- Baxevanos, D., et al. Lentil cultivar evaluation in diverse organic mediterranean environments. Agronomy. 14 (4), 790 (2024).
- Aydın, M., Koç, M., Sağır, A. Investigations on determination of soilborne fungal pathogens causing root rot, crown rot and wilt on lentil in Southeast Anatolia Region. Plant Protect Bulletin. 44 (1), 93-103 (2004).
- Zitnick-Anderson, K., et al. Fusarium species associated with root rot of lentil (Lens culinaris) in North Dakota. Plant Health Prog. 22 (4), 524-528 (2021).
- Kushwaha, D. A. . A research book of seed mycoflora of chickpea (Cicer arietinum). , (2020).
- Ekwomadu, T. I., Mwanza, M. Fusarium fungi pathogens, identification, adverse effects, disease management, and global food security: A review of the latest research. Agriculture. 13 (9), 1810 (2023).
- Jiskani, A. M., et al. A destructive disease of lentil: Fusarium wilt of lentil. Plant Arch. 21 (1), 2117-2127 (2021).
- Alisaac, E., Mahlein, A. K. Fusarium head blight on wheat: biology, modern detection and diagnosis and integrated disease management. Toxins. 15 (3), 192 (2023).
- Yang, F., et al. Effects of rhizosphere microbial communities on cucumber Fusarium wilt disease suppression. Microorganisms. 11 (6), 1576 (2023).
- Kumari, N., Katoch, S. Wilt and root rot complex of important pulse crops: their detection and integrated management. Management of Fungal Pathogens in Pulses. Fungal Biology. , (2020).
- Köppen, W., Geiger, R. . Handbuch der klimatologie. , (1936).
- Agrios, G. N. . Plant Pathology. , (2005).
- Endes, A. Occurrence and distribution of Chickpea root rot and wilt disease in Yozgat Kırşehir and Kırıkkale Provinces. Çukurova J Agri Food Sci. 38 (2), 284-298 (2023).
- Choi, Y. W., Hyde, K. D., Ho, W. H. Single spore isolation of fungi. Fungal Diversity. 3, 29-38 (1999).
- Baskarathevan, J., Jaspers, M. V., Jones, E. E., Ridgway, H. J. Evaluation of different storage methods for rapid and cost effective preservation of Botryosphaeria species. New Zealand Plant Protect. 62, 234-237 (2009).
- Dikilitaş, M., Katırcıoğlu, Z., Altınok, H. Latest developments and methods on long-term storage, protection, and recycle of fungi and fungal material. JAgric Fac HR U. 15 (1), 55-69 (2011).
- Bora, T., Karaca, &. #. 3. 0. 4. ;. . Measurement of disease and damage in cultivated plants. , (1970).
- Öğüt, E. . Pathogenic and molecular characterization of some Fusarium spp. causing root rot and wilt on lentil with determination of variety reactions in south eastern Anatolia. , (2015).
- Leslie, J. F., Summerell, B. A. . The Fusarium Laboratory manual. , (2006).
- Cenis, J. L. Rapid extraction of fungal DNA for PCR amplification. Nuc Acids Res. 20 (9), 2380 (1992).
- Aras, S., Endes, A. Effect of Fusarium oxysporum infection on strawberry under calcium, iron, and zinc deficiency conditions. Zemdirbyste-Agri. 110 (1), 71-78 (2023).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc A Guide Metho Appl. , 315-322 (1990).
- Endes, A. Characterization and pathogenicity of Botryosphaeriaceae species associated with Gummosis, Dieback, Trunk and Branch Cankers of almond trees in Türkiye. J Agri Sci. 30 (4), 698-711 (2024).
- Gordon, T. R., Okamoto, D., Jacobson, D. J. Colonization of muskmelon and non-susceptible crops by Fusarium oxysporum f. sp. melonis and other species of Fusarium. Phytopathology. 79 (10), 1095-1100 (1989).
- Xu, X., et al. Fusarium species associated with maize leaf blight in Heilongjiang Province, China. J Fungi. 8 (11), 1170 (2022).
- Fonseca-Guerra, I. R., Chiquillo-Pompeyo, J. C., Benavides Rozo, M. E., Díaz Ovalle, J. F. Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Sci Rep. 12 (1), 20841 (2022).
- Khan, M. F., et al. First report of damping-off and seedling rot of Hemp (Cannabis sativa) caused by Fusarium solani in North Dakota, U.S.A. Plant Dis. 107 (1), 232 (2023).
- Chaudhary, R. G., Saxena, D. R., Dhar, V., Singh, R. K., Namdev, J. K. Prevalence of wilt-root rot and their associated pathogens at reproductive phase in lentil. Arch Phytopathol Plant Protect. 43 (10), 996-1000 (2010).
- Fleischmann, R. Some observations on Maize smut in Hungary. Pflanzenbau. 14 (5), 199-206 (1937).
- Bedasa, T. . Distribution and management of Fusarium wilt (Fusarium oxysporum f. sp. lentis) of lentil (Lens culinaris Medikus) in Central Highlands of Ethiopia. , (2018).
- Kumar, S., et al. Vascular wilt disease of lentil: A review. J Lentil Res. 4, 1-14 (2010).
- Chenari, S., Abbasi, S., Chehri, K. Phylogeny and host specificity of Fusarium solani species complex isolated from chickpea, lentil and common bean. Arch Phytopathol Plant Protect. , 1-15 (2024).
- Rathod, A., et al. Isolation of causal organism of wilt and collar rot of lentil and its pathogenicity tests. Int J Curr Microbiol Appl Sci. 10 (12), 276-282 (2021).
- Hayit, T., Endes, A., Hayit, F. The severity level classification of Fusarium wilt of chickpea by pre-trained deep learning models. J Plant Pathol. 106 (1), 93-105 (2024).
- Dean, R., et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 13 (4), 414-430 (2012).
- Fletcher, J. D., Broadhurst, P. G., Bansal, R. K. F. avenaceum: A pathogen of lentil in New Zealand. New Zealand J Crop Horticultural Sci. 19 (2), 207-210 (1991).
- Al Ahmad, M., Mouselli, N. Wilt and root rot of lentis. Lens. 14 (1/2), 27-31 (1987).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved