Method Article
Скрининг чечевичных полей на наличие фузариозного увядания и корневых гнилей в Турции в условиях наземного климата
В этой статье
Резюме
Исследование, проведенное в провинции Йозгат, показало, что биотические факторы, такие как грибковые заболевания, такие как увядание и корневая гниль, ограничивают производство чечевицы. Изоляты фузариоза были обнаружены в 95,4% образцов, что предполагает периодические локальные обследования и регулярный мониторинг для устойчивого развития технологий и эффективных стратегий борьбы.
Аннотация
Чечевица является важным самоопыляемым растением бобовых культур. Его производство ограничено различными биотическими факторами, особенно грибковыми агентами, вызывающими увядание и комплекс корневых гнилей. Целью исследования было понимание региональной эпидемиологии и этиологии фитопатогенных грибковых агентов для разработки стратегий борьбы с почвенным Fusarium spp. В ходе этого исследования в 2022 и 2023 гг. были изучены 83 района посева чечевицы в провинции Йозгат на предмет болезней увядания, корневых и коронных гнилей, вызванных распространенными видами Fusarium . Для выделения и идентификации грибов были собраны растения чечевицы с симптомами. Изоляты Fusarium были сгруппированы в соответствии с морфологией колонии и культивировались на среде PDA. Кроме того, геномные ДНК, полученные из изолятов Fusarium , были проанализированы с помощью ПЦР и сравнены с другими изолятами Fusarium , зарегистрированными в NCBI GenBank. Генетические родства между изолятами Fusarium определяли с помощью метода максимальной парсимонии (МП) в программе Mega 11. В результате средние показатели заболеваемости и тяжести болезней увядания и корневых гниль в провинции Йозгат составили 16,9% и 38,6% соответственно. Изоляты Fusarium обнаружены в 95,4% образцов. Среди изолятов F. oxysporum, F. culmorum, F. graminearum, F. acuminatum и F. solani наблюдалась гомогенность нуклеотидных последовательностей от 99,5% до 100%, а наиболее изолированным видом был F. oxysporum. Дендрограмма МП изолятов Fusarium была разделена на две основные ветви, первая из которых включала все изоляты F. solani . Вторая основная ветвь включала другие виды Fusarium, выделенные в настоящем исследовании и в NCBI GenBank. В исследовании предлагается проводить периодические локальные обследования для определения частоты подавления фузариоза у чечевицы. Для борьбы с болезнью и сохранения системы производства чечевицы настоятельно рекомендуется своевременное подавление повреждений, вызванных фузариозом.
Введение
Чечевица (Lens culinaris Medik.), мелкосъедобная зерновая бобовая, принадлежащая к семейству Fabaceae, представляет собой самоопыляющуюся культуру прохладного сезона с игольчатыми листьями и белыми или бледно-фиолетовыми или темно-фиолетовыми цветами1. Он был одомашнен человеком около 10 000 лет назад в месопотамской части Плодородного полумесяца и быстро распространился в Новом Свете, включая Средиземноморский бассейн и Центральную Азию, а позже был натурализован в Северной и ЮжнойАмерике. Мировые площади выращивания чечевицы составляют около 5,5млн га при производстве 6,6 млн тонн3. Турция занимает4-е место по производству чечевицы после Канады, Индии и Австралии. Выращивание чечевицы в Турции имеет очень важное значение и составляет 6,7% мирового производства. Общий объем производства чечевицы в Турции составляет 474 000 тонн и производится по меньшей мере в 40провинциях. Около 89,5% производства чечевицы в Турции составляют красная и зеленая чечевица, которые составляют 10,5% озимых культур в регионе Юго-Восточной Анатолии. Остальной урожай выращивается как яровый. Наибольший вкладв производство зеленой чечевицы вносят провинции Йозгат (39,5%), Конья (23,7%), Кыршехир (16,3%), Чорум (7,6%) и Анкара (2,9%). Производство чечевицы может быть ограничено биотическими и абиотическими стрессовыми факторами. Морозы и засуха являются наиболее распространенными абиотическими факторами стресса при выращивании зеленой чечевицылетом 5. Грибковые заболевания, такие как увядание, комплекс корневых и коронных гнилей, вызываемые видами Ascochyta lentis, Rhizoctonia solani, R. bataticola, Aphanomyces euteiche, Pythium и Fusarium, являются наиболее серьезными грибковыми заболеваниями, которые вызывают комбинацию заболеваний, включая выползание, фитофтороз рассады, увядание и корневую гниль, в зависимости от времени заражения, восприимчивости хозяина и метеорологических условий 6,7, 8.
Fusarium представляет собой нитчатый несовершенный грибок, обнаруженный в почве, растениях и органических субстратах и являющийся космополитическим родом среди этих патогенов9. Он вызывает различные заболевания, такие как фузариозное увядание, корневая гниль и гниль корневой шейки, а также фузариозное поражение кочана у пшеницы, фузариозное увядание у бахчевых и корневая гниль у большинства бобовых, включая чечевицу 10,11,12. Сосудистое увядание, корневая гниль и гниль корневой шейки, вызываемые Fusarium spp., являются наиболее распространенным заболеванием чечевицы во многих районах выращивания чечевицы во всем мире10. Fusarium oxysporum является наиболее распространенным видом Fusarium, связанным с увяданием, корневой гнилью и гнилью корневой шейки чечевицы. В глобальном масштабе увядание, корневые и кронные гнили вызываются F. graminearum, F. sporotrichioides, F. equity, F. acuminatum, F. redolent, F. avenaceum, F. culmorum, F. solani и F. verticillioides на посадках чечевицы7. Болезни увядших, корневых и кронных гнилей, вызываемые Fusarium spp., проявляются как на рассадной, так и на взрослой стадиях и вызывают внезапное увядание, засыхание и последующую гибель листьев. Симптомы заболевания включают гниль семян, корневую гниль, увядание верхних листьев, отставание в росте, усыхание и скручивание листьев. На средних и поздних стадиях наполнения стручков семена обычно сжимаются, а симптомы корней включают задержку роста, коричневое обесцвечивание, поврежденные кончики стержневых корней и разрастание вторичных корней. Изменение цвета сосудистой ткани может наблюдаться не во всех случаях13.
В регионе Центральной Анатолии исследования состояния болезней увядания и корневой гнили у чечевицы проводились в ограниченном количестве. Йозгат имеет мягкий и умеренный климат с обильными осадками зимой по сравнению с летом и классифицируется как Dsb (теплый, влажный наземный климат) по шкале Кеппена иГейгера 14. Средняя температура составляет 9,6 °C при среднем количестве осадков 512 мм. Йозгат расположен в северном полушарии. Лето приходится на июнь, июль, август и сентябрь. Очень важно иметь информацию о региональной эпидемиологии и этиологии фитопатогенных грибковых агентов, вызывающих заболевание, для разработки различных стратегий борьбы с почвенным Fusarium spp., для борьбы с болезнью15. В связи с этим целями настоящего исследования являются определение и идентификация параметров заболевания (распространенность, частота и тяжесть заболевания) болезней увядания, корневой и корончатой гнили чечевицы путем проведения обследования в провинции Йозгат, где примерно 40% от общего объема производства зеленой чечевицы производится единолично, патогенный фузариоз виды, вызывающие увядание и корневую гниль у чечевицы, с помощью морфологического и молекулярного анализа, а также для определения индивидуальных уровней вирулентности видов Fusarium путем проведения тестов на патогенность.
протокол
ПРИМЕЧАНИЕ: Подробная информация о реагентах и оборудовании, использованном в исследовании, приведена в Таблице материалов.
1. Полевое обследование, отбор проб и выделение грибов
ПРИМЕЧАНИЕ: Исследовательские работы проводились в 2022 и 2023 годах, согласно Endes16. В общей сложности на 83 участках посадки чечевицы в девяти районах провинции Йозгат наблюдались случаи увядания, корневой гнили и гнили корневой шейки (Рисунок 1).
- Выберите поля чечевицы площадью более 1000м2 в качестве участка отбора проб. Соберите каждый образец, проходя хаотично от границы к центру или середине поля зигзагами, идущими по диагоналям с помощью рамки 1м2 , размещая его случайным образом как минимум в трех случайно выбранных разных точках. Соберите растения чечевицы с симптомами болезни с каждой точки, положите их в бумажные пакеты и передайте в лабораторию для использования в исследованиях по выделению грибов и идентификации.
ПРИМЕЧАНИЕ: Корни и корневая шейка больных растений чечевицы, перенесенные в лабораторию, сначала промывали водопроводной водой, чтобы избавиться от грубых остатков; позже они были подвергнуты поверхностной дезинфекции для выделения грибковых патогенов, как описано в Endes16. - Замочите больные ткани растений в 70% этаноле на 10-15 с, а затем промойте 3 раза по 3 мин в стерильной воде. Подержите их все в 1% гипохлорите натрия (NaOCl) в течение 5 минут и снова промойте 3 раза в течение 5 минут каждый раз стерильной водой.
- Высушите влажные растительные ткани на фильтровальной бумаге в стерильном шкафу, чтобы завершить процесс дезинфекции поверхности. После этого продезинфицированные ткани растения разрезать на кусочки длиной 5-10 мм и поместить 4-5 штук на среду КПК, содержащую 0,01% стрептомицина, в чашках Петри (диаметр 90 мм). Поместите чашки Петри в инкубатор в темноте при температуре 25 ± 1 °C на 4-7 дней и наблюдайте за ростом грибка.
Примечание: Развивающиеся грибковые изоляты очищали методом выделения одиночных спор. С этой целью было модифицировано и использовано исследование, проведенное Choi et al.17 по получению одиночных споровых культур грибов, принадлежащих к Ascomycetes, Basidiomycetes, Coelomycetes и Hyphomycetes. - Для очистки грибковых изолятов следует хранить грибковые изоляты, полученные в конце исследований изоляции, в инкубаторе при температуре 25 ± 1 °C в течение 12 часов флуоресцентного света / 12 часов в темноте в течение 15 дней, чтобы стимулировать образование анаморфотных репродуктивных структур на ОАП.
- Взвесьте шпателем около 100 мг грибного мицелия из 15-дневных культур, переложите его в стерильную микроцентрифужную пробирку объемом 1,5 мл, а затем тщательно измельчите стерильными пластиковыми пестиками для гомогенизации.
- Добавьте 1 мл стерильной воды и сделайте вихрь на 1 минуту, чтобы обеспечить перенос спор в воду. Чтобы отрегулировать количество спор, попадающих в воду, наберите 20 мкл этой смеси с помощью пипетки и проверьте количество спор при 10-кратном увеличении светового микроскопа.
- Когда количество спор станет больше желаемого, разбавьте спорово-водную смесь в соотношении 1/10, 1/100 и 1/1000. Обеспечьте смесь, содержащую 4-6 спор, в поле зрения микроскопа.
- Возьмите 100 мкл приготовленной споровой суспензии и перенесите ее в чашки Петри диаметром 90 мм, содержащие среду ОАП с добавлением 0,1% стрептомицина. Затем распределите перенесенную суспензию по КПК с помощью шпателя Дригальского.
- Подготовленные чашки Петри выдерживать в темноте при температуре 25 ± 1 °C в течение 12-24 часов. В конце этого периода перенесите небольшие кусочки гиф, образованных из одной конидии с петлей инокуляции, в новую чашку Петри, содержащую среду PDA. Каждая культура, полученная из каждой споры, представляет собой отдельную культуру спор. Храните их для использования в тестах на патогенность и морфологической и молекулярной идентификации.
ПРИМЕЧАНИЕ: Основная цель состоит в том, чтобы сохранить грибковые изоляты живыми в течение длительного времени без изменения их морфологии, генетики и вирулентности. Процесс хранения осуществлялся с использованием двух различных методов18,19. Все методы хранения, использованные в данном исследовании, подробно описаны ниже.- Первый способ хранения образцов заключается в следующем. Выращивайте грибковые изоляты на среде PDA при температуре 25 ± 1 °C при 12:12 ч темный: световой в течение 15 дней для получения мицелиевых дисков диаметром 4 мм, которые можно хранить в стерильной воде.
- Срезайте диски мицелия (диаметр 4 мм, 10 дисков) пробковым точильщиком из грибных культур, выросших в вышеупомянутых условиях. Перенесите диски мицелия в микроцентрифужные пробирки, содержащие 1 мл стерильной воды. Хранить образцы в микроцентрифужных пробирках в холодильнике при температуре -20 °C в течение 6 месяцев.
- Второй способ хранения образцов заключается в следующем. Во-первых, возьмите щепотку чистого грибкового диска из одиночных споровых культур, полученных с помощью петли инокуляции, и перенесите ее в чашки Петри, содержащие КПК с добавлением хлорамфеникола, молочной кислоты, ампициллина, рифампицина, тетрациклина, стрептомицина и т.д.
- Выращивать в течение 5-10 дней до процесса хранения при температуре 25 ± 1 °C в течение 12 часов: 12 часов в темноте: светло. Отрежьте и простерилизуйте фильтровальную бумагу общего назначения размером 1 см x 1 см в автоклаве при температуре 121 °C, 15 фунтов на квадратный дюйм в течение 60 минут.
- Поместите фильтровальную бумагу в новые чашки Петри с такой же или селективной средой. Вырежьте колонии/споры из чистой грибковой культуры и поместите их поверх каждого кусочка.
- Укупорьте чашки Петри и поместите их в инкубатор при соответствующих условиях роста (о чем говорилось выше). Грибковые изоляты медленно растут на фильтровальной бумаге. Инкубируйте примерно 15 дней, чтобы обеспечить полную колонизацию.
- После спороношения или полного образования колонии на фильтровальной бумаге перенесите отдельные листы бумаги в новую чашку Петри без питательной среды. Позже поместите чашки Петри в инкубатор до полного высыхания фильтровальной бумаги и грибка (примерно 20-30 дней).
- После высыхания положите 10 листов фильтровальной бумаги в каждый стерильный бумажный конверт, промаркируйте каждый конверт, положите эти конверты в полиэтиленовые пакеты и храните пластиковые пакеты с конвертами в пластиковом и прозрачном контейнере при температуре -20 °C.
- Рассчитайте распространенность чечевичного увядания, корневой гнили и гнили короны в Йозгате по приведенной ниже формуле, учитывая распространенность болезни на каждом поле чечевицы, а затем укажите название района провинции.
Распространенность заболевания (%) = (а / б) х 100
где a обозначает количество пораженных полей; b указывает общее количество обследованных полей в округе. - Рассчитайте заболеваемость в соответствии с методом средневзвешенного значения, о котором сообщили Bora и Karaca20. Посчитайте растения в каждом квадрате на поле. Разделите их на больные и небольные растения в каждом квадрате и рассчитайте распространенность болезни по приведенной ниже формуле.
Распространенность заболевания (%) = (x / y) x 100
где x обозначает количество больных растений; y обозначает общее количество обследованных растений. - Рассчитайте тяжесть заболевания по шкале 0-4 по шкале Öğüt21, где 0 = симптомы не проявились, 1 = слабо выраженные симптомы у 25% листьев; 2 = умеренные симптомы в 26%-50% листьев; 3 = сильный хлороз и увядание у 51%-75% листьев; и 4 = очень тяжелые симптомы хлороза и увядания или высыхание, осыпание, задержка роста или отмершие листья на более чем 75% растений в том же порядке (Рисунок 2).
- Рассчитайте тяжесть заболевания по следующей формуле с полученными значениями шкалы16.
Тяжесть заболевания (%) = [∑ [ i (ni x vi) / (V) x N)] x 100
где ni количество растений в масштабе; значение масштаба vi; Наибольшее значение шкалы V; N общее количество наблюдаемых растений; i указывает количество классов.
2. Метеорологические данные
- Проведение обзорных исследований. Для этого протокола опросы проводились в периоды с мая по июнь 2022 и 2023 годов. Получите значения температуры, относительной влажности и общего количества осадков за период с марта по июль в 2022 году, 2023 году и за долгие годы от Управления провинциальной метеорологии в Йозгате (Таблица 1).
3. Морфологическая идентификация
- Сравните культуральные (цвет колонии, воздушный мицелий, скорость роста мицелия) и конидиальные (размеры конидиальности, форма, цвет и количество перегородок) изоляты Fusarium с более ранними исследованиями и предварительно определите виды грибов.
- Выберите репрезентативные образцы из групп, которые будут использоваться для морфологической идентификации. Очистите эти образцы в соответствии с методом выделения одиночных спор, как упоминалось выше. В течение этого периода наблюдайте за характеристиками пигментации колоний изолятов Fusarium , а также за микро/макроконидиями и хламидоспоровыми структурами.
- Чтобы способствовать образованию микроморфологических структур, таких как микро/макроконидии и хламидоспоры в полученных чистых грибных культурах, инкубируют на ОАП при 25 ± 1 °C и 12 ч: 12 ч темноте: свет в течение 25-30 дней в инкубаторе. Измерьте длину и ширину конидий для каждого изолята Fusarium с помощью световой микроскопии. Кроме того, задокументируйте структуру, форму, цвет и перегородки конидий или без них с помощью светового микроскопа, оснащенного цифровой камерой.
- Основываясь на вышеприведенных наблюдениях, сгруппируйте изоляты Fusarium по видовому уровню, как описано в Leslie and Suerell22.
4. Молекулярная идентификация
Примечание: Общая геномная ДНК изолятов Fusarium была экстрагирована с использованием следующего метода, который был немного модифицирован по сравнению с протоколом Cenis23. ПЦР-анализы и электрофорез изолятов Fusarium проводили по протоколу, описанному Aras and Endes24.
- Экстракция геномной ДНК грибов
- Из свежей культуры (возрастом 10 дней) изолятов Fusarium , выращенных на ОАП, соскребите 100 мг мицелия стерильным скальпелем и затем перенесите его в микроцентрифужную пробирку объемом 2 мл. Инкубируйте пробирки при температуре -20 °C в течение ночи.
- После ночной инкубации добавьте в пробирки 500 мкл буфера для экстракции ДНК (200 мМ Tris-HCl pH: 8,5, 250 мМ NaCl, 25 мМ ЭДТА, 0,5% додецилсульфата натрия) и измельчите стерильным пластиковым пестиком.
- Затем добавьте в пробирки 150 мкл 3М ацетата натрия (NaOAc) pH 5,2 и инкубируйте при -20 °C в течение 30 минут. После этой стадии центрифугируйте пробирки при давлении 4 000 x g в течение 10 минут.
- После центрифугирования перенесите 400 мкл надосадочной жидкости в верхней части пробирки в новые пробирки (1,5 мл) и добавьте равный объем изопропанола (2-пропанола). Инкубируйте новые пробирки при температуре -20 °C в течение 30 минут. За это время аккуратно перемешайте трубки 5x или 6x.
- Центрифугируйте при давлении 4000 x g в течение 10 минут, чтобы осадить геномную ДНК и отбросить всю жидкость, оставшуюся в пробирках.
- Добавьте 1 мл 70% этанола в гранулу геномной ДНК в виде белого или кремового осадка на дне пробирки. Аккуратно перемешайте пробирку вверх и вниз 4-5 раз в течение примерно 1 минуты, сбрасывая весь этанол из пробирок. Затем откройте трубки в ламинарном потоке воздуха на 30 минут, чтобы полностью испарить этанол на грануле ДНК.
- Чтобы растворить геномную ДНК и сохранить ее в течение длительного времени, необходимо добавить в пробирки 50 мкл буферного раствора TE (1M Tris-HCl pH: 8,0; 0,5M EDTA pH 8,0) и инкубировать пробирки на водяной бане при 65 °C в течение 1 ч. За это время аккуратно перемешайте трубку вверх и вниз 8x-10x. Храните геномную ДНК, растворенную в буферном растворе TE, в морозильной камере при температуре -20 °C для использования в молекулярных исследованиях.
- Для ПЦР-исследований используют олигонуклеотидные праймеры ITS5 F (5'GGAAGTAAAGTCGTAACAAGG3') / ITS4 R (5'TCCTCCGCTTATTGATATGC3') для амплификации ITS участка рДНК25. Проводите каждую ПЦР-реакцию с 2,5 мкл 10x ПЦР-буфера, 2,5 мкл MgCl2 (25 мМ), 2,5 мкл dNTP (2 мМ), 0,5 мкл каждого праймера (10 мкМ), 2 мкл матричной ДНК, 0,5 мкл Taq ДНК-полимеразы (1 ед/мкл, Фермантаса) и 14 мкл sQH2O в общем объеме 25 мкл.
- Для проведения ПЦР-реакции объемом 25 мкл выполните следующую программу ПЦР при температуре 95 °C в течение 2 мин (начальная денатурация), после чего следует 40 циклов; 95 °C в течение 30 с (денатурация), 55 °C в течение 45 с (отжиг), 72 °C в течение 90 с (растяжение) и 72 °C в течение 5 мин (окончательное растяжение). Электрофорезные продукты ПЦР в течение 1,5 ч при 90 В в 1,5% агарозном геле, приготовленном в 1x TAE (Tris Base - Glacial Acetic Acid - EDTA) буферном растворе.
- Для приготовления буфера ТАЭ для гель-электрофореза растворите 242 г основания Триса в 700 мл стерильной воды; добавьте 57,1 мл ледяной уксусной кислоты; добавьте 100 мл 0,5 М раствора ЭДТА и отрегулируйте объем до 1 л, добавив стерильную воду. Отрегулируйте окончательный pH буфера 1 л 50x TAE до 8,5. Чтобы сделать 1x TAE рабочим буфером, добавьте 49 частей стерильной воды в 1 часть 50x TAE буфера.
- Окрасьте гели бромидом этидии с концентрацией 0,5 мкг/мл и визуально осмотрите их, сделав видимыми на УФ-трансиллюминаторе.
- Для изучения филогенетических отношений между изолятами возбудителей корневой и корончатой гнили с помощью ПЦР получены последовательности оснований гена ITS, которые были синтезированы двунаправленно (5'-3' и 3'-5') через поставщика. Сравните последовательности оснований с данными генов с веб-сайта NCBI (Национальный центр биотехнологической информации) и последовательностями оснований гена ITS других изолятов Fusarium в мире с помощью программы Blast. Используйте его для идентификации изолятов на видовом уровне, как описано ниже.
- Перейдите на https://www.ncbi.nlm.nih.gov сайт. Нажмите на вкладку BLAST в разделе Популярные ресурсы.
- Нажмите на вкладку Nucleotide BLAST в новом окне. В разделе Введите последовательность запроса в новом окне введите базовые последовательности в формате Fasta и напишите название исследования в разделе Название должности.
- Затем отметьте Стандартные базы данных (nr и т. д.) на вкладке База данных в разделе Выберите набор поиска внизу.
- Отметьте галочкой Highly similar sequences (megablast) на вкладке Optimize for в разделе Program Selection и нажмите на вкладку BLAST внизу страницы.
- Используйте программу филогенетического анализа MEGA 11 для определения филогенетического родства между изолятами Fusarium . Выровняйте последовательности оснований с помощью программы ClustalW и создайте генетические генеалогические деревья изолятов в соответствии с максимальной экономией для гена ITS26.
- Чтобы скачать программное обеспечение Mega, перейдите на веб-сайт https://www.megasoftware.net и установите программное обеспечение Mega. Программное обеспечение MEGA предоставляется БЕСПЛАТНО для использования в научных исследованиях и образовании.
- Сначала сохраните последовательности на рабочем столе в виде файла Блокнота (.txt) в формате FASTA. Запустите программу Mega и нажмите на вкладку ALIGN . Нажмите « Редактировать/Построить выравнивание» в окне. Затем отметьте флажок «Создать новую трассу » в новом окне и нажмите «ОК» для подтверждения.
- Нажмите на вкладку ДНК. Исключите пункт 1. Последовательность, которая автоматически появится в окне, и перейдите в раздел Редактировать файл, затем нажмите на Вставить последовательность из вкладки Файл. Откройте файл «Блокнот» (.txt), который содержит последовательности и находится на рабочем столе.
- На этом этапе на экране появляются все последовательности. Сначала нажмите на любую последовательность , которая появится на экране, затем отметьте все последовательности с помощью CTRL + A. Откройте файл Alignment и нажмите Align by Clustal W оттуда, а затем нажмите OK , чтобы запустить программу с настройками по умолчанию.
- Изучив различия в выравнивании последовательностей, перейдите в файл данных, нажмите на Филогенетический анализ , а затем нажмите на Нет в чекбоксе в окне, чтобы узнать, синтезируют ли последовательности белки или нет. Наши последовательности не синтезируют белки, потому что они принадлежат к области ITS.
- Возврат в главное окно программного обеспечения Mega. Нажмите на Phylogeny и выберите Construct/Test Maximum Parsimony Tree(s). В новом окне выберите Bootstrap Method для теста Phylogeny и введите значения Bootstrap 1,000 для проверки силы ветви. На вкладке Gaps/missing Data Treatment выберите Partial Deletion, выберите Subtree-pruning-Regrafting (SPR) в качестве метода поиска MP и нажмите OK для подтверждения операций.
- Дождитесь результата анализа, который покажет филогенетическое дерево.
5. Тест на патогенность
- Используйте четыре изолята для изучения патогенности для каждого репрезентативного вида из видов Fusarium , которые были идентифицированы молекулярными методами. Проводите исследования патогенности при температуре 24 °C, 16 ч флуоресцентного света/8 ч темном фотопериоде, при влажности 65% в помещении с кондиционером.
- Посейте семена чечевицы в черные пластиковые флаконы с 45 отверстиями диаметром 5 см. Выдержите каждый флакон в 1% гипохлорите натрия в течение 3 минут, а затем промойте стерильной дистиллированной водой 3 раза. Просушите семена в стерильном шкафу в течение 24 часов и посейте по одному семени в каждую лунку.
ПРИМЕЧАНИЕ: Семена чечевицы сорта Kayı 91, чувствительные к заболеванию, использовались во всех испытаниях на патогенность6. В качестве метода инокуляции использовался метод погружения рассады27. - Инкубировать чистые культуры каждого изолята в КПК при температуре 24 °С в течение 7-10 дней. Колонии, выращенные из исходной культуры, соскребают с поверхности среды с помощью шпателя и готовят спорово-мицелиевую суспензию с использованием стерильной дистиллированной воды.
- Удалите крупные остатки из суспензии путем фильтрации через 4-слойную марлю и отрегулируйте концентрацию спор/мицелия до 1 х 106 спор/мл с помощью гемоцитометра.
- После этого этапа выкорчевывайте корни ранее выращенной в флаконах рассады, когда у них появится 2-3 настоящих листочка. Промойте в водопроводной воде и слегка травмируйте корни стерильной иглой. Погрузите эти сеянцы в приготовленную спорово-мицелиевую суспензию на 3 минуты, а затем пересадите в пластиковые флаконы, содержащие стерильную смесь грунт/торф (2:1; v/v).
- Для рассады, используемой в качестве контроля, выкорчевывайте их корни, травмируйте их, а затем высаживайте, погружая только в стерильную воду. Проведите оценку патогенности через 3 недели после процесса инокуляции по шкале от 0 до 4.
- После того, как рассчитанные значения тяжести заболевания были подвергнуты угловому преобразованию, полученные значения подвергнуть дисперсионному анализу и оценить различия между средними по критерию HSD Тьюки (p = 0,05). Тяжесть заболевания: изоляты с 0%-15% оценивали как имеющие очень низкую вирулентность (ЛЖ), изоляты с 16%-35% оценивали как низкую вирулентность (ЛЖ), изоляты с 36%-50% оценивали как умеренную вирулентность (O), изоляты с 51%-70% оценивали как высоковирулентные (VV), изоляты с 71%-100% оценивали как очень высокую вирулентность (VV), а изоляты без симптомов заболевания оценивали как сапрофитные или эпифитные изоляты.
Результаты
Определение параметров заболевания
В общей сложности было оценено 83 посевных участка чечевицы в девяти различных районах Йозгата с точки зрения увядания, корневой гнили и симптомов гнили короны, охватывающих площадь 1,1984 x 106 м2 (Таблица 2). Симптомы увядания или корневой гнили встречались на всех полях. Тем не менее, заболеваемость увяданием и корневой гнилью в Йозгате составила 16,9%, а в Соргунском и Сарыкайском районах – 38,6%. Значительная заболеваемость также выявлена в Шефаатлинском (26,4%), Богазлаянском (23,0%) и Соргунском (20,1%) районах. Парадоксально, но самый высокий процент тяжести заболевания был определен в Соргунском районе – 45,2%, за ним следуют Богазлаян – 36,0% и Сарыкая – 35,4%. Кроме того, у 679 растений проявились симптомы заболевания в образцах, собранных с чечевичных полей на обследованных участках (табл. 3). За этим последовала морфологическая идентификация выделенных грибковых агентов, распределенных в две группы. Изоляты Fusarium , классифицированные в первую группу, включали патогены или сапрофиты, такие как Alternaria sp., Ascochyta sp. и Rhizoctonia sp. Процент выделения изолятов Fusarium составил 95,4%. F. oxysporum был определен как наиболее изолированный вид грибов из растений чечевицы с симптомами заболевания в Йозгате с процентом изоляции 59,5%. За этим патогенным видом Fusarium следовали F. graminearum (15,8%) и F. culmorum (10,2%). Парадоксально, но F. solani (4,4%) и F. acuminatum (5,5%) были выделены в более низких концентрациях от растений с симптомами болезни. F. oxysporum был получен из всех районов, где проводилось обследование, а процент изоляции по районам распределился между 45,3% и 72,2%. Больше всего F. oxysporum был выделен в Центральном (72,2%), Шефаатлинском (71,9%), Акдагмаденском (68,3%) и Соргунском (62,2%) районах Йозгата. Напротив, F. solani и F. acuminatum были наименее изолированными видами Fusarium в Йозгате. F. solani не был изолирован от Чекерекского и Центрального районов; F. acuminatum также не был изолирован от районов Акдагмаден, Центральный и Шефаатли (табл. 3).
Морфологическая идентификация
Чистые культуры изолятов Fusarium были идентифицированы морфологически в соответствии с их колонийными признаками, а также структурой микроконидий, макроконидий и хламидоспор. Исследования идентификации проводились на уровне видов, согласно Лесли и Саммереллу22. Все грибковые изоляты, полученные от растений с симптомами увядания, корневой гнили и корневой шейки на чечевице, были собраны в шесть групп в соответствии с их колонией и микроморфологией (табл. 3). В то время как первые пять групп включали изоляты, принадлежащие к видам Fusarium , другая группа включала патогенные грибковые изоляты, не относящиеся к роду Fusarium , такие как Alternaria, Rhizoctonia и Ascochyta.
Изоляты F. oxysporum с самой высокой степенью выделения имеют колонии от белого до желтого цвета и лилово-фиолетовую пигментацию. Макроконии короткой или средней длины, слегка изогнутые, обычно имеют 3-5 перегородок. Споровая структура некоторых изолятов слабо изогнута, размеры макроконидий определены как 33,8-71,5 мкм x 3,1-4,5 мкм. Микроконидии обычно несептированные, овальные, эллиптические или почковидные. Образование хламидоспор происходило медленно (4-6 недель). Он наблюдался в двойных кластерах и короткой цепной структуре16.
Второй вид с самой высокой степенью выделения, изоляты F. graminearum , имеют бело-розовый воздушный мицелий и темно-красную пигментацию. Макроконидии тонкие, прямые или слегка изогнутые, с пятью-семью перегородками. Септы довольно отчетливы. Он имеет заостренную апикальную ячейку и отчетливо ногообразную базальную клетку. Размеры составляют от 25,7 до 97,3 мкм x от 3,5 до 5,5 мкм. Микроконидии и образование хламидоспор не наблюдались28.
Колонии изолятов F. culmorum в третьей группе первоначально были белыми, но с возрастом наблюдалась структура мицелия от светло-розового до темно-розового. Макроконидии короткие, 4-6 септированные и слегка изогнутые. Размеры макроспор; 15,8 - 60,0 μм x 3,2 - 5,1 μм. Они многочисленны. Микроспор не наблюдалось. Образование хламидоспор происходит быстро по сравнению с другими видами (3-5 недель). Они встречаются поодиночке или в скоплениях подва 29.
Колонии четвертого вида, изолятов F. acuminatum , бледно-оранжевые, оранжевые и светло-бордовые. Это относительно медленнорастущий вид. Макроконидии тонкие, имеют отчетливую кривизну и 3-5 септированную структуру. Размеры макроконидий определялись как 31,0-65,5 × 4,3-6,6 мкм. Микроконидии имеют 0 и 1 септат. На микроскопических изображениях наблюдался редко. Образование хламидоспор происходит очень медленно (более 6 недель). Он формируется цепочками и кластерами22.
Окраска колонии последнего идентифицированного патогенного вида, изолята F. solani , белая и кремовая. Макрокония у него широкая, плоская, слегка изогнутая. Гифы 3-7 септированные, обильные. Размеры макроспор определяются как от 20,2 до 50,6 мкм x от 3,1 до 6,2 мкм. Микроконидии бывают неразделенными или 1-делящимися. Они имеют овальную и эллипсовидную структуру. Хламидоспоры обнаруживаются в терминальной форме короткими цепочками в среде CLA в течение 2-4 недель30.
Молекулярная идентификация
ПЦР проводили с использованием праймеров ITS4/ITS5 с общей геномной ДНК, полученной из изолятов Fusarium . Двунаправленные (5'-3' и 3'-5') последовательности оснований регистрировали и сравнивали с другими NCBI GenBank с помощью программы Blast (табл. 4 и табл. 5). Изоляты F. oxysporum показали гомогенность нуклеотидных последовательностей от 99,5% до 100% с изолятами из Индии (MT740398), Литвы (KF646094) и Германии (MT453296). Изоляты F. culmorum показали 100% гомогенность нуклеотидных последовательностей с изолятами из Канады (AY147290), Франции (OW983123) и Чехии (MT453296). Изоляты F. graminearum показали гомогенность нуклеотидных последовательностей от 99,5% до 100% с изолятами из Колумбии (MT598163) и Китая (ON527490). Изоляты F. acuminatum показали гомогенность нуклеотидной последовательности от 99,5% до 100% с изолятами из Узбекистана (OR975902) и Китая (MZ424810, PP336554). Изоляты F. solani показали 100% однородность нуклеотидных последовательностей с изолятами из Египта (OR713084), Китая (PQ482231) и Индии (OP848138). Затем генетическое родство между изолятами Fusarium определяли по филогенетическому дереву, полученному по методу Maximum Parsimony (MP) с использованием программы Mega 11 (рис. 3). В филогенетическом дереве МП было использовано 638 нуклеотидных признаков, включая пробелы, и 145 из этих нуклеотидов были определены как информативные области, обеспечивающие экономию. Анализ МП показал одно из самых экономных деревьев (Рисунок 3; Длина дерева: 172; Индекс консистенции (ConI): 0,974; Индекс удержания (RI): 0,961; Композитный индекс (ComI): 0.7600). Когда была изучена эта древовидная диаграмма изолятов Fusarium , генеалогическое древо сначала было разделено на две основные ветви. Первый из них соответствовал всем изолятам F. solani , поддерживаемым 100% значением bootstrap. Другая основная ветвь была собрана внутри себя с 78% значением бутстрепа и четырьмя подгруппами F. acuminatum, F. redolens, F. proliferatum и F. acutatum. Другая основная ветвь была разделена на пять подгрупп F. oxysporum, F. culmorum, F. graminarum, F. pseudograminearum и F. equiseti со значением бутстрепа 97%.
Определение уровней вирулентности изолятов Fusarium
Результаты исследований патогенности Fusarium spp., выделенных из чечевицы с увяданием и корневой гнилью, для которых были завершены морфологические и молекулярные характеризаторы, сведены в таблицу 6 и рисунок 4. В целом, все изоляты Fusarium показали различия в уровнях тяжести вызываемых ими болезней у сорта чечевицы Kayı 91 F(19-60; 0,05) = 43,06; стр< 0,0001). Наиболее вирулентными изолятами оказались F. oxysporum (YBUFol4), F. culmorum (YBUFc1, YBUFc2) и F. graminearum (YBUFg1, YBUFg3). Было обнаружено, что эти пять изолятов обладают очень высоким уровнем вирулентности. С другой стороны, было обнаружено, что по одному изоляту F. oxysporum (YBUFol2), F. solani (YBUFs1) и F. graminearum (YBUFg2) обладают умеренной вирулентностью. Кроме того, было обнаружено, что изоляты F. acuminatum (YBUFa1, YBUFa2, YBUFa3 и YBUFa4) обладают слабой или низкой вирулентностью. Все изоляты, использованные в исследованиях патогенности, варьировали от 42,5% до 97,5% и были получены после инокуляции рассады чечевицы.

Рисунок 1: Растения чечевицы, пораженные видами Fusarium. (А) Общий вид локализованных пораженных участков на чечевичном поле с высокой степенью тяжести заболевания. (Б) Вид растений с вредоносностью 4. (C) Вид растений с вредоносностью 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Вид на растения чечевицы при уровнях тяжести заболевания 0 - 4. Уровень 0 = отсутствие симптомов, 1 = симптомы листьев у 25%; 2 = 26%-50%; 3 = 51%-75% листьев; 4 = более 75% в том же порядке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
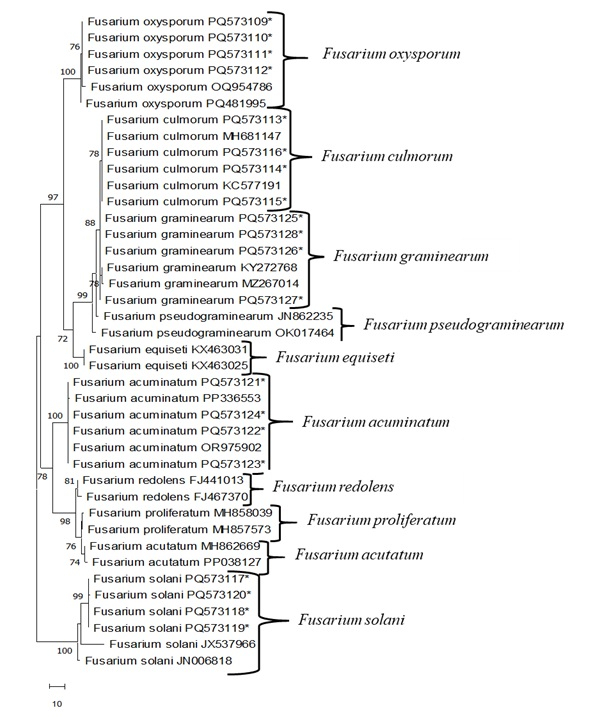
Рисунок 3: Наиболее экономное дерево без корней на основе региона ITS Fusarium sp. с использованием MEGA 11. Изоляты обозначены звездочками. Остальные взяты из GenBank. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
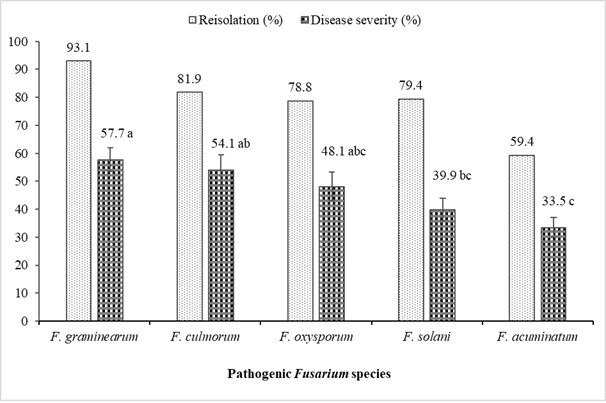
Рисунок 4: Повторная изоляция (%) и показатели тяжести заболевания (%) Fusarium spp., выделенных из растений чечевицы. Вертикальные линии представляют собой стандартную ошибку на баре (n = 16). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Температура (°C) | Относительная влажность воздуха (%) | Осадки (мм) | |||||||
| Месяц | 2022 | 2023 | Долгосрочный | 2022 | 2023 | Долгосрочный | 2022 | 2023 | Долгосрочный |
| Akdağmadeni | |||||||||
| Март | 11.1 | 7.4 | 3.8 | 45.1 | 68.8 | 71.1 | 21.4 | 78.7 | 60.6 |
| Апрель | 11.1 | 11.4 | 8.8 | 59.2 | 67 | 61.5 | 56.5 | 109.8 | 42.6 |
| Май | 16.3 | 15.1 | 12.9 | 64.3 | 73.9 | 64.8 | 48.5 | 83.6 | 74.1 |
| Июнь | 16.5 | 18.4 | 16.2 | 63.4 | 53.2 | 69.1 | 0.3 | 20.1 | 57.2 |
| Июль | 22 | 22.2 | 18.7 | 48 | 40.5 | 60.5 | 1.4 | 0 | 7 |
| Богазлыян | |||||||||
| Март | 12.3 | 9.9 | 5.2 | 47.8 | 65.5 | 66 | 13 | 64 | 40.1 |
| Апрель | 12.8 | 13.5 | 10.2 | 62.6 | 66.6 | 59.3 | 20.2 | 24.2 | 24.4 |
| Май | 18.7 | 17.7 | 14.6 | 62.5 | 67.4 | 61.2 | 65.4 | 20 | 35.1 |
| Июнь | 19.7 | 20.6 | 18.6 | 52.9 | 49.9 | 59.9 | 0 | 2.4 | 35.5 |
| Июль | 24.3 | 24 | 21.7 | 42.5 | 39.5 | 50 | 0 | 0 | 3.9 |
| Чекерек | |||||||||
| Март | 13.5 | 10.8 | 6.6 | 52.8 | 70.4 | 69 | 24.3 | 111.3 | 48.7 |
| Апрель | 14.1 | 13.9 | 11.5 | 63.9 | 72.3 | 61 | 48.1 | 73.4 | 32 |
| Май | 19.3 | 18.6 | 15.8 | 69.1 | 72.7 | 65.4 | 80.3 | 69 | 59.3 |
| Июнь | 20.1 | 21.8 | 19.4 | 61.5 | 57.5 | 67.8 | 0 | 16.4 | 62.8 |
| Июль | 24.6 | 24.7 | 22 | 57.8 | 52.4 | 57.5 | 33.2 | 0 | 10.9 |
| Йозгат | |||||||||
| Март | 11.5 | 8.4 | 4 | 47.3 | 68.7 | 67.5 | 14.6 | 84.8 | 87.3 |
| Апрель | 12.4 | 12.7 | 9.3 | 60.1 | 65.2 | 58.7 | 47.4 | 54.4 | 41.9 |
| Май | 17.5 | 16.8 | 13.7 | 64.2 | 68 | 60.2 | 92.6 | 61.6 | 72.2 |
| Июнь | 18.3 | 20.3 | 17.4 | 57.9 | 50.7 | 61.2 | 1 | 4.8 | 63.6 |
| Июль | 22.9 | 23.6 | 20.5 | 50.9 | 44.3 | 52.7 | 7 | 0.2 | 8.8 |
| Сарайкент | |||||||||
| Март | 14.8 | 9 | 6.2 | 50.9 | 71.1 | 71 | 11.1 | 77.3 | 55.3 |
| Апрель | 12.5 | 12.3 | 10.5 | 64.6 | 73.2 | 60.7 | 35.3 | 36.1 | 29 |
| Май | 17.6 | 16.4 | 14.2 | 69.1 | 76.7 | 65.9 | 47.8 | 72.4 | 57 |
| Июнь | 18.2 | 19.2 | 18.2 | 63.8 | 61 | 69.6 | 0 | 28.6 | 56.1 |
| Июль | 23.2 | 23.1 | 21.6 | 54.2 | 51.7 | 57.9 | 0 | 0 | 7.4 |
| Сарыкая | |||||||||
| Март | 12.9 | 9.6 | 5.6 | 47 | 68.2 | 66.5 | 18.4 | 75.5 | 53.6 |
| Апрель | 13.2 | 13.1 | 10.7 | 59 | 68.8 | 56.5 | 24.8 | 60.6 | 27.2 |
| Май | 18.5 | 17.3 | 14.7 | 63.2 | 71.6 | 60.6 | 57.6 | 64.5 | 47.2 |
| Июнь | 18.9 | 20.5 | 18.4 | 59 | 53.9 | 62 | 0 | 16.1 | 50.6 |
| Июль | 24 | 24 | 21.3 | 48.6 | 45.4 | 51.5 | 0 | 0 | 6.4 |
| Шефаатли | |||||||||
| Март | 13.1 | 10.6 | 6.2 | 48.2 | 61.1 | 67 | 12.6 | 71.5 | 50.2 |
| Апрель | 11.2 | 14.3 | 11.1 | 61.6 | 60.9 | 58.6 | 48.4 | 50.5 | 26 |
| Май | 19.9 | 18.6 | 15.4 | 66.7 | 61.9 | 62.3 | 65.2 | 95.4 | 53.7 |
| Июнь | 20.4 | 22.2 | 19.7 | 55.8 | 45.5 | 61.2 | 1.2 | 2.5 | 46.8 |
| Июль | 25 | 25.3 | 23.2 | 47.9 | 39.5 | 47.1 | 0 | 0 | 4.1 |
| Соргун | |||||||||
| Март | 12.2 | 9.4 | 4.8 | 48.4 | 68.2 | 67 | 21.6 | 104.2 | 49.8 |
| Апрель | 13 | 13.3 | 10.1 | 59.7 | 66.1 | 58.9 | 53.2 | 33.8 | 31.7 |
| Май | 18.3 | 17.4 | 14.5 | 63.7 | 69.1 | 60.9 | 56.6 | 89.6 | 44.2 |
| Июнь | 18.9 | 20.3 | 18.3 | 56.8 | 53.4 | 61.5 | 0 | 16.6 | 55.2 |
| Июль | 23.7 | 23.7 | 21.2 | 50 | 44.9 | 52.9 | 4 | 0 | 7.5 |
| Йеркёй | |||||||||
| Март | 15 | 12.1 | 6 | 41.2 | 60.5 | 61.3 | 4.4 | 46.1 | 60.1 |
| Апрель | 16.2 | 16.2 | 13.5 | 54.8 | 60.4 | 50.9 | 40.9 | 46.8 | 23 |
| Май | 21.5 | 20.6 | 17.4 | 55.4 | 59.6 | 52.2 | 57 | 23.6 | 35.1 |
| Июнь | 23 | 24.5 | 20.9 | 45.2 | 41.4 | 56.4 | 0.2 | 0 | 39.1 |
| Июль | 27.5 | 27.7 | 24.4 | 38.2 | 35.5 | 42.2 | 0.2 | 0 | 3.5 |
Таблица 1: Метеорологические данные обследованной местности в сезон производства чечевицы по годам.
| Графство | Номер поля | Обследованная посевная площадь (Decare) | Распространенность заболевания (%) | Заболеваемость (%) | Тяжесть заболевания (%) |
| Akdağmadeni | 4 | 43.2 | 100 | 7 | 21.8 |
| Богазлыян | 4 | 86.4 | 100 | 23 | 36 |
| Чекерек | 1 | 2.7 | 100 | 1.6 | 14.4 |
| Меркез | 3 | 24.3 | 100 | 5.8 | 23 |
| Сарайкент | 6 | 53.3 | 100 | 8.1 | 28.2 |
| Сарыкая | 12 | 189.3 | 100 | 17 | 35.4 |
| Соргун | 48 | 683.2 | 100 | 20.1 | 45.2 |
| Шефаатли | 2 | 73.7 | 100 | 26.4 | 23.4 |
| Йеркёй | 3 | 42.3 | 100 | 9.1 | 32.9 |
| Полный | 83 | 1198.4 | 100 | 16.9 | 38.6 |
Таблица 2: Параметры болезни, распространенность, заболеваемость и тяжесть увядания, корневой гнили и гнили корневой шейки на чечевичных полях.
| Графство | Количество растений, используемых для изоляции | Частота изоляции (%) | |||||
| F. oxysporum | F. culmorum | Ф. solani | F. acuminatum | F. graminearum | Другой | ||
| Akdağmadeni | 41 | 68.3 | 9.8 | 2.4 | 0 | 14.6 | 4.9 |
| Богазлыян | 57 | 54.4 | 1.8 | 12.3 | 7 | 15.8 | 8.8 |
| Чекерек | 21 | 52.4 | 4.8 | 0 | 23.8 | 9.5 | 9.5 |
| Меркез | 36 | 72.2 | 11.1 | 0 | 0 | 13.9 | 2.8 |
| Сарайкент | 64 | 45.3 | 12.5 | 7.8 | 4.7 | 21.9 | 7.8 |
| Сарыкая | 148 | 56.8 | 11.5 | 7.4 | 5.4 | 15.5 | 3.4 |
| Соргун | 233 | 62.2 | 9.4 | 1.3 | 7.3 | 16.3 | 3.4 |
| Шефаатли | 32 | 71.9 | 15.6 | 3.1 | 0 | 9.4 | 0 |
| Йеркёй | 47 | 57.4 | 14.9 | 4.3 | 2.1 | 14.9 | 6.4 |
| Полный | 679 | 59.5 | 10.2 | 4.4 | 5.5 | 15.8 | 4.6 |
Таблица 3: Информация о частоте выделения грибов чечевицы из провинции Йозгат Турции.
| Виды Fusarium | Изолировать | Графство | Источник изоляции | Регистрационный номер GeneBank |
| F. oxysporum | YBUФол1 | Соргун | Корень | PQ573109 |
| YBUФол2 | Богаслаян | Корневая шейка | PQ573110 | |
| YBUFол3 | Сарыкая | Корень | PQ573111 | |
| YBUФол4 | Акдагмадени | Корень | PQ573112 | |
| F. culmorum | YBUFc1 | Соргун | Корень | PQ573113 |
| YBUFc2 | Еркой | Корень | PQ573114 | |
| YBUFc3 | Сарыкая | Корень | PQ573115 | |
| YBUFc4 | Сарайкент | Корневая шейка | PQ573116 | |
| Ф. solani | YBUFs1 | Йозгат | Корень | PQ573117 |
| YBUFs2 | Соргун | Корень | PQ573118 | |
| YBUFs3 | Сефаатли | Корень | PQ573119 | |
| YBUFs4 | Сарыкая | Корень | PQ573120 | |
| F. acuminatum | YBUFa1 | Цекерек | Корень | PQ573121 |
| YBUFa2 | Богаслаян | Корневая шейка | PQ573122 | |
| YBUFa3 | Сарыкая | Корневая шейка | PQ573123 | |
| YBUFa4 | Соргун | Корень | PQ573124 | |
| F. graminearum | YBUFg1 | Йозгат | Корень | PQ573125 |
| YBUFg2 | Соргун | Корень | PQ573126 | |
| YBUFg3 | Сарайкент | Корень | PQ573127 | |
| YBUFg4 | Сарыкая | Корневая шейка | PQ573128 |
Таблица 4: Изоляты Fusarium spp. из чечевицы (Lens culinaris) из провинции Йозгат, центральная Турция, использованные в филогенетическом исследовании.
| Виды Fusarium | Изолировать | Страна | Источник изоляции | Регистрационный номер GenBank |
| F. acuminatum | ААГ4 | н/д | Слива персидская | OR975902 |
| WHWNSHJ1 | Китай | Яблочный яблон домашний | PP336553 | |
| F. acutatum | КБС 739.97 | Индия | н/д | MH862669 |
| НСФ1 | Египет | Тетраена белая | PP038127 | |
| F. culmorum | 2090 | Индия | н/д | KC577191 |
| Г49 | Польша | Pisum sativum | MH681147 | |
| F. equiseti | Fusarium equiseti А577 | Китай | Пачули | KX463031 |
| Fusarium equiseti А571 | Китай | Пачули | KX463025 | |
| F. graminearum | ВМ-233 | Китай | н/д | MZ267014 |
| 16а | н/д | н/д | KY272768 | |
| F. oxysporum | YBUFoc4 | Турция | Цицер ариетический | OQ954786 |
| Люк-8 | Китай | Хризантема x morifolium | PQ481995 | |
| F. proliferatum | КБС 246.61 | Германия | н/д | MH858039 |
| КБС 186.56 | н/д | н/д | MH857573 | |
| F. pseudograminearum | WZ-8A | Китай | Пшеница | JN862235 |
| GAAET080 | Китай | Кукуруза | OK017464 | |
| F. redolens | М11 | н/д | Гриб | FJ441013 |
| 2008 | н/д | Гриб | FJ467370 | |
| Ф. solani | С2-27 | Франция | н/д | JX537966 |
| UENFCF279 | Бразилия | Гуава | JN006818 |
Таблица 5: Последовательности видов Fusarium, использованные из GenBank в филогенетических исследованиях.
| Виды Fusarium | Изолировать | Тяжесть заболевания (%) a | Уровень вирулентности изолята | Повторная изоляция (%) |
| (среднее значение ± стандартной погрешности) | ||||
| F. oxysporum | YBUФол1 | 20. 0 ± 1.1 i | Слабый | 62.5 |
| YBUФол2 | 56,9 ± 1,2 CDE | Умеренно | 85 | |
| YBUFол3 | 42,5 ± 1,0 EFG | Менее | 77.5 | |
| YBUФол4 | 73,1 ± 3,9 АВ | Весьма | 90 | |
| F. culmorum | YBUFc1 | 72,5 ± 1,0 АБ | Весьма | 95 |
| YBUFc2 | 72,5 ± 2,7 АВ | Весьма | 95 | |
| YBUFc3 | 23.6 ± 1.6 ПРИВЕТ | Слабый | 60 | |
| YBUFc4 | 48.1 ± 2.6 def | Менее | 77.5 | |
| Ф. solani | YBUFs1 | 58,8 ± 1,6 до н.кд | Умеренно | 97.5 |
| YBUFs2 | 46.9 ± 2.1 защ | Менее | 75 | |
| YBUFs3 | 17.5 ± 2.3 i | Слабый | 65 | |
| YBUFs4 | 36,3 ± 1,6 ФГГ | Менее | 80 | |
| F. acuminatum | YBUFa1 | 42.5 ± 2.3 EFG | Менее | 65 |
| YBUFa2 | 16.9 ± 2.8 i | Слабый | 42.5 | |
| YBUFa3 | 30.6 ± 6.1 Привет | Менее | 62.5 | |
| YBUFa4 | 44.1 ± 7.1 defg | Менее | 67.5 | |
| F. graminearum | YBUFg1 | 76,3 ± 2,2 А | Весьма | 97.5 |
| YBUFg2 | 50.6 ± 3.3 def | Умеренно | 92.5 | |
| YBUFg3 | 68,1 ± 2,1 ABC | Умеренно | 95 | |
| YBUFg4 | 35.6 ± 1.9 FGH | Менее | 87.5 |
Таблица 6: Тесты на патогенность видов Fusarium на растениях чечевицы. Изоляты имеют средний ранг <10% = неагрессивный; 11%-25% = слабый агрессивный; 26%-50% = менее агрессивный; 51%-70% = умеренно агрессивный; >70% = очень агрессивный. a Статистическая разница между изолятами по критерию Тьюки HSD (p < 0,05).
Обсуждение
Известно, что фузариозное увядание приводит к серьезным экономическим потерям урожая в некоторых частях мира31. Болезнь была впервые зарегистрирована в Венгрии32, а затем во многих странах, таких как Египет, Индия, Мьянма, Непал, Пакистан, Турция, Сирия и США33. Kumar et al.34 сообщили о широком распространении чечевичного увядания, корневой гнили и гнили корневой шейки с сообщениями о возникновении по меньшей мере в 26 странах мира. В недавнем исследовании из больных растений чечевицы, собранных в разных штатах Индии, было выделено 12 видов грибов, и наиболее важным патогеном был идентифицирован F. oxysporum f. sp. lentis (30%), за ним следуют Rhizoctonia bataticola (17,5%) и Sclerotium rolfsii (15,7%)31. Аналогичным образом, в настоящем исследовании наиболее часто выделяемым родом грибов был Fusarium (95,4%). Согласно Zitnick-Anderson et al.7, Fusarium (50%) был доминирующим родом грибов, вызывающим увядание, корневую гниль и гниль корневой шейки на плантациях чечевицы в Северной Дакоте. Они также сообщили, что F. oxysporum, F. solani, F. culmorum, F. equiseti, F. acuminatum, F. graminearum, F. redolens и F. avenaceum являются патогенами внутри этого рода.
Морфологические характеристики пяти видов Fusarium , идентифицированных в этом исследовании, были аналогичны таковым в последних исследованиях35. Согласно Rathod et al.36, изоляты F. oxysporum сообщили, что у них наблюдалось септатное, разветвленное, первоначально белое, а затем приподнятое или впавшее развитие колоний на ОАП, которые окрашивались в различные пигментации. Аналогичным образом, в текущем исследовании изоляты F. oxysporum первоначально образовывали белые колонии, позже желтые, фиолетовые или розовые. С другой стороны, хламидоспоры в виде двух или трех цепей, которые использовались в качестве морфологического критерия идентификации изолятов F. oxysporum , наблюдались в колониях возрастом около 30 дней. На самом деле, Endes15 сообщил, что хламидоспоры изолятов F. oxysporum , хранящихся в течение >30 дней, имели более высокую склонность к заражению растений в районах выращивания нута в провинции Йозгат, как правило, наблюдались в старых условиях.
Фузариозная корневая гниль нута и чечевицы вызывается многими видами Fusarium , такими как F. solani, F. oxysporum и F. graminearum37. Как сообщают Dean et al.38, F. graminearum и F. oxysporum являются одними из наиболее часто выделяемых грибковых патогенов растений микологами растений во всем мире. Тем не менее, Aydın et al.6 сообщили, что F. graminearum является одним из возбудителей увядания, корневой и корончатой гнили в районах выращивания чечевицы в юго-восточном регионе Анатолии в Турции. Кроме того, известно, что F. graminearum вызывает корневую гниль и гниль кроны чечевицы в штате Северная Дакота, США7.
Fletcher et al.39 сообщили, что F. culmorum редко можно выделить в качестве патогена в районах выращивания чечевицы. Кроме того, в недавнем исследовании Zitnick-Anderson et al.7 сообщалось, что F. culmorum связан с увяданием, корневой гнилью и гнилью корневой шейки у растений чечевицы. Тем не менее, Aydın et al.6 идентифицировали многие виды Fusarium , вызывающие увядание и корневую гниль в районах выращивания чечевицы, но не сообщали о F. culmorum как о патогене. Такая ситуация, которая отличается от текущего исследования, может быть связана с разным количеством обследованных областей или с поддержкой морфологических исследований молекулярными методами в текущем исследовании.
Zitnick-Anderson et al.7 сообщили, что F. acuminatum относится к числу видов Fusarium , вызывающих увядание и гниль корней и корневой шейки на чечевичных полях Северной Дакоты. С другой стороны, Aydın et al.6 документально подтвердили, что F. solani является одним из возбудителей увядания и корневой гнили в районах выращивания чечевицы. Известно также, что F. solani выделен из районов выращивания чечевицы как слабый патоген7.
Виды Fusarium являются факультативными паразитами. Инфекции, вызванные родом Fusarium у чечевицы, могут вызвать полное уничтожение растений, особенно при экстремальных температурах в конце весны или начале лета. Аль Ахмад и Муселли40 сообщили, что F. oxysporum и F. solani вызывают пожелтение, дефолиацию и симптомы высыхания на чечевичных плантациях на юге Сирии. F. solani вызывает корневую гниль и увядание в Центральной Анатолии, в том числе в Йозгате16. Кроме того, некоторые другие виды Fusarium также были признаны патогенными с определенной скоростью. Zitnick-Anderson et al.7 сообщили, что болезнь фузариозного увядания вызывается Fusarium oxysporum f. sp lentis, но виды F. culmorum, F. solani, F. graminearum также могут вызывать болезнь увядания в соответствии с морфологическими, физиологическими и патологическими характеристиками. Кроме того, Fletcher et al.39 сообщили, что F. acuminatum, вызывающий увядание и корневую гниль у чечевицы, имеет слабую или низкую вирулентность.
В результате исследования выявлено, что 95,4% изолятов Fusarium , полученных с обследованных чечевичных полей, являются видами Fusarium и имеют заболеваемость 1,6% - 26,4% и вредоносность 14,4% - 45,2% у растений чечевицы. Неблагоприятные климатические условия, такие как жаркая и сухая весна и ранняя летняя жара, ослабляют рост растений и делают растения восприимчивыми к видам Fusarium . Большинство видов Fusarium являются слабыми патогенами, и когда условия окружающей среды ослабляют растение-хозяина, они вызывают увеличение фузариозного увядания, особенно в условиях засухи.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано Центром координации проектов и исследований Университета Бозок, подразделение BAP с номером проекта FÇD-2022-1096. Это исследование является частью докторской диссертации Севим Атмака.
Материалы
| Name | Company | Catalog Number | Comments |
| (S)-lactic acid | Merck | 100366 | Was used as an antibiotic in studies. |
| 2-propanol | Merck | 109634 | Used in molecular studies. |
| Adjustable micro automatic pipette (0.1-2.5 µL) | Eppendorf Research | LB.EP.3123000012 | Used to measure small volumes of liquids. |
| Adjustable micro automatic pipette set (2 – 20 µl, 20 – 200 µl, 100 – 1.000 µl) | Eppendorf Research | LB.EP.4924000916 | Used to measure small volumes of liquids. |
| Agar | Merck | 110453 | For use in making fungal media. |
| Agarose | Sigma-Aldrich | 18300012 | For use in gel preparation in electrophoresis. |
| Air conditioning room | ?klimlab | Was used to grow plants under controlled conditions. | |
| Ampisilin | Sigma-Aldrich | A9393 | Was used as an antibiotic in studies. |
| Analytical precision balance | Shimadzu ATX224 | Was used to weigh the solid materials used in the study. | |
| Autoclave sterilizer | Zealway | GF-120DR | It was used to sterilize solid and liquid materials at every stage of the study. |
| Binocular microscope | Leica DM750 | For use in morphological diagnosis. | |
| Biological safety cabinet | HFsafe Class II A2 | To ensure the safety of the work area, the user, the environment and the operation. | |
| Centrifugal | DLAB DM1424 | LB.DL.903001124 | Used to separate particles in a sample based on their shape, size and density |
| Chloramphenicol | Sigma-Aldrich | 220551 | Was used as an antibiotic in studies. |
| Cork-borer set | Sigma-Aldrich | Z165220 | It was used to take samples from fungus culture in petri dishes. |
| Cover glass and slide | ISOLAB | 075.01.006 / 075.02.005 | Was used in the preparation process for microscope studies. |
| D(+)-glucose monohydrate | Merck | 108342 | For use in making fungal media. |
| DFC450 with digital camera | Leica | Digital microscope camera with c-mount interface and with a 5 megapixel ccd sensor. | |
| Dm750 binocular microscope | Leica | MIC5246 | Was used for morphological identification of fungi. |
| DNA gel electrophoresis | thermo fisher scientific | B2-UVT | |
| Dna gel loading dye (6x) | Thermo Scientific | R0611 | For use in molecular diagnostics. |
| dNTP mix | Thermo Scientific | R0192 | Used in molecular studies. |
| Dreamtaq pcr master mixes (2x) | Thermo Scientific | K1082 | For use in molecular diagnostics. |
| Drigalski spatule | ISOLAB | 082.03.001 | It was used to scrape and spread fungal cultures grown in petri dishes. |
| Edta | Thermo Scientific | 17892 | For use in molecular diagnostics. |
| Ethanol | Merck | 100983 | Used in molecular studies and surface disinfection studies. |
| Ethidium bromide | Sigma-Aldrich | E7637 | Used to stain dna in gels during gel electrophoresis. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | Used in molecular studies. |
| Filter paper | ISOLAB | 107.58.158 | Used in stock culture studies. |
| Forced air drying cabinet | ZHICHENG ZXDS-A-1090 | For use in incubation processes. | |
| Fume hood | Elektromag EM1201 | LB.EM.EM1201 | It was used to control harmful chemical vapors, gases and dust. |
| Gel imaging system | Syngene G:BOX Chemi XX6 | For use in molecular diagnostics. | |
| Generuler 50 bp dna ladder | Thermo Scientific | SM0372 | For use in molecular diagnostics. |
| Glacial acetic acid | Merck | 1005706 | Used in molecular studies. |
| Glycerol | Merck | 104094 | For use in stock culture of fungi. |
| Lancet | ISOLAB | 048.50.002 | Used to remove diseased tissue from plant samples. |
| Magnesium chloride | Sigma-Aldrich | 814733 | Used in molecular studies. |
| Measuring tape | ISOLAB | 016.07.500 | Used to measure liquid volumes. |
| Microcentrifuge tubes | ISOLAB | 0778.03.001 / 0778.03.002 / 0778.03.003 | Used to store different volumes of liquids. |
| PCR tube | ISOLAB | 123.01.002 | It was used to put dna mix in pcr studies. |
| Petri dishes | ISOLAB | 120.13.090 | For use in growing fungus culture. |
| Pipette tips | ISOLAB | 005.01.001 / 005.01.002 / 005.01.003 / 005.01.004 | To transfer liquid volumes used in analyses. |
| Plastic bag | ISOLAB | 039.30.005 | Was used to transport samples to the laboratory. |
| Plastic pot | ToXA | Was used for growing plants. | |
| Pliers, clamps | ISOLAB | 048.08.130 | It was used to put filter papers into envelopes after the fungus grew in the petri dish. |
| Porcelain mortar | ISOLAB | 038.02.150 | Was used to crush fungal mycelia. |
| Potato dextrose agar | Condalab | 1022 | For the identification and cultivation and of fungi. |
| Pure water system | human CORPORATION | LT.HC.NHP009 | Was used in solution preparation and analysis throughout the studies. |
| Refrigerator (+4 °C / -20 °C) | Vestel | For use in the storage of stock materials. | |
| Rifampicin | Sigma-Aldrich | 557303 | Was used as an antibiotic in studies. |
| Sodium acetate | Merck | 106268 | Used in molecular studies. |
| Sodium chloride | Merck | 1064041000 | Used in molecular studies. |
| Sodium dodecyl sulfate | Sigma-Aldrich | 436143 | Used in molecular studies. |
| Sodium hypochlorite solution | Merck | 105614 | Used for surface disinfection. |
| Spatula | ISOLAB | 047.33.210 | It was used to scrape the fungus culture growing in petri dishes. |
| Streptomyc?n sulfate | BioShop Canada | STP101 | To prevent contamination in fungal culture cultivation. |
| Teksoll extra pure | Tekkim | TK.200650 | For use as a disinfectant in all stages of work. |
| Tetrasiklin | Sigma-Aldrich | T3258 | Was used as an antibiotic in studies. |
| Thermal cycler PCR | Bio?Rad T100 | For use in genomic analyses. | |
| Thoma lam | ISOLAB | 075.03.002 | For use in spore counting. |
| Tris HCL | Roche | 10812846001 | Used in molecular studies. |
| Trizma | Sigma-Aldrich | T1503 | Used in molecular studies. |
| Tween 80 | Merck | 822187 | For use in spore solution in pathogenicity testing. |
| Vortex mixer vorteks | Velp WIZARD | LB.VLP.F202A0175 | Used to mix substances in liquid volumes. |
| Water baths | Memmert WNB 22 | 1018-5702 | It was used during incubation in dna extraction studies. |
Ссылки
- Skrzypkowski, W., Kiełkowska, A. Current status of haploidization in cool-season grain legume crop species. Agriculture. 14 (7), 1031 (2024).
- Liber, M., Duarte, I., Maia, A. T., Oliveira, H. R. The history of lentil (Lens culinaris subsp. culinaris) domestication and spread as revealed by genotyping-by-sequencing of wild and landrace accessions. Front Plant Sci. 12, 628439 (2021).
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data (2022)
- TÜİK. . Agricultural statistics report. , (2023).
- Baxevanos, D., et al. Lentil cultivar evaluation in diverse organic mediterranean environments. Agronomy. 14 (4), 790 (2024).
- Aydın, M., Koç, M., Sağır, A. Investigations on determination of soilborne fungal pathogens causing root rot, crown rot and wilt on lentil in Southeast Anatolia Region. Plant Protect Bulletin. 44 (1), 93-103 (2004).
- Zitnick-Anderson, K., et al. Fusarium species associated with root rot of lentil (Lens culinaris) in North Dakota. Plant Health Prog. 22 (4), 524-528 (2021).
- Kushwaha, D. A. . A research book of seed mycoflora of chickpea (Cicer arietinum). , (2020).
- Ekwomadu, T. I., Mwanza, M. Fusarium fungi pathogens, identification, adverse effects, disease management, and global food security: A review of the latest research. Agriculture. 13 (9), 1810 (2023).
- Jiskani, A. M., et al. A destructive disease of lentil: Fusarium wilt of lentil. Plant Arch. 21 (1), 2117-2127 (2021).
- Alisaac, E., Mahlein, A. K. Fusarium head blight on wheat: biology, modern detection and diagnosis and integrated disease management. Toxins. 15 (3), 192 (2023).
- Yang, F., et al. Effects of rhizosphere microbial communities on cucumber Fusarium wilt disease suppression. Microorganisms. 11 (6), 1576 (2023).
- Kumari, N., Katoch, S. Wilt and root rot complex of important pulse crops: their detection and integrated management. Management of Fungal Pathogens in Pulses. Fungal Biology. , (2020).
- Köppen, W., Geiger, R. . Handbuch der klimatologie. , (1936).
- Agrios, G. N. . Plant Pathology. , (2005).
- Endes, A. Occurrence and distribution of Chickpea root rot and wilt disease in Yozgat Kırşehir and Kırıkkale Provinces. Çukurova J Agri Food Sci. 38 (2), 284-298 (2023).
- Choi, Y. W., Hyde, K. D., Ho, W. H. Single spore isolation of fungi. Fungal Diversity. 3, 29-38 (1999).
- Baskarathevan, J., Jaspers, M. V., Jones, E. E., Ridgway, H. J. Evaluation of different storage methods for rapid and cost effective preservation of Botryosphaeria species. New Zealand Plant Protect. 62, 234-237 (2009).
- Dikilitaş, M., Katırcıoğlu, Z., Altınok, H. Latest developments and methods on long-term storage, protection, and recycle of fungi and fungal material. JAgric Fac HR U. 15 (1), 55-69 (2011).
- Bora, T., Karaca, &. #. 3. 0. 4. ;. . Measurement of disease and damage in cultivated plants. , (1970).
- Öğüt, E. . Pathogenic and molecular characterization of some Fusarium spp. causing root rot and wilt on lentil with determination of variety reactions in south eastern Anatolia. , (2015).
- Leslie, J. F., Summerell, B. A. . The Fusarium Laboratory manual. , (2006).
- Cenis, J. L. Rapid extraction of fungal DNA for PCR amplification. Nuc Acids Res. 20 (9), 2380 (1992).
- Aras, S., Endes, A. Effect of Fusarium oxysporum infection on strawberry under calcium, iron, and zinc deficiency conditions. Zemdirbyste-Agri. 110 (1), 71-78 (2023).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc A Guide Metho Appl. , 315-322 (1990).
- Endes, A. Characterization and pathogenicity of Botryosphaeriaceae species associated with Gummosis, Dieback, Trunk and Branch Cankers of almond trees in Türkiye. J Agri Sci. 30 (4), 698-711 (2024).
- Gordon, T. R., Okamoto, D., Jacobson, D. J. Colonization of muskmelon and non-susceptible crops by Fusarium oxysporum f. sp. melonis and other species of Fusarium. Phytopathology. 79 (10), 1095-1100 (1989).
- Xu, X., et al. Fusarium species associated with maize leaf blight in Heilongjiang Province, China. J Fungi. 8 (11), 1170 (2022).
- Fonseca-Guerra, I. R., Chiquillo-Pompeyo, J. C., Benavides Rozo, M. E., Díaz Ovalle, J. F. Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Sci Rep. 12 (1), 20841 (2022).
- Khan, M. F., et al. First report of damping-off and seedling rot of Hemp (Cannabis sativa) caused by Fusarium solani in North Dakota, U.S.A. Plant Dis. 107 (1), 232 (2023).
- Chaudhary, R. G., Saxena, D. R., Dhar, V., Singh, R. K., Namdev, J. K. Prevalence of wilt-root rot and their associated pathogens at reproductive phase in lentil. Arch Phytopathol Plant Protect. 43 (10), 996-1000 (2010).
- Fleischmann, R. Some observations on Maize smut in Hungary. Pflanzenbau. 14 (5), 199-206 (1937).
- Bedasa, T. . Distribution and management of Fusarium wilt (Fusarium oxysporum f. sp. lentis) of lentil (Lens culinaris Medikus) in Central Highlands of Ethiopia. , (2018).
- Kumar, S., et al. Vascular wilt disease of lentil: A review. J Lentil Res. 4, 1-14 (2010).
- Chenari, S., Abbasi, S., Chehri, K. Phylogeny and host specificity of Fusarium solani species complex isolated from chickpea, lentil and common bean. Arch Phytopathol Plant Protect. , 1-15 (2024).
- Rathod, A., et al. Isolation of causal organism of wilt and collar rot of lentil and its pathogenicity tests. Int J Curr Microbiol Appl Sci. 10 (12), 276-282 (2021).
- Hayit, T., Endes, A., Hayit, F. The severity level classification of Fusarium wilt of chickpea by pre-trained deep learning models. J Plant Pathol. 106 (1), 93-105 (2024).
- Dean, R., et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 13 (4), 414-430 (2012).
- Fletcher, J. D., Broadhurst, P. G., Bansal, R. K. F. avenaceum: A pathogen of lentil in New Zealand. New Zealand J Crop Horticultural Sci. 19 (2), 207-210 (1991).
- Al Ahmad, M., Mouselli, N. Wilt and root rot of lentis. Lens. 14 (1/2), 27-31 (1987).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены