Method Article
Düşük DNA Parçalanma İndeksine Sahip Yüksek Kaliteli Sperm Hazırlamak İçin U Şeklinde Yatay Yüzme Tekniği
Bu Makalede
Özet
Bu protokol, sperm motilite özellikleri ve timotaksis kullanılarak düşük DNA parçalanma indeksine sahip yüksek kaliteli spermlerin taranması için bir yöntemi tanımlar. Yöntem, U şeklinde yatay bir yüzme şeridi kullanır ve yüksek kaliteli spermin tampon damlacıklar yoluyla karşı tarafa ulaşmasını sağlarken, ölü sperm, hücre kalıntıları ve safsızlıklar hariç tutulur.
Özet
İnsan spermi, ilerleyici olarak hareketli spermatozoa, ilerleyici olmayan hareketli spermatozoa, hareketsiz spermatozoa, hücre artıkları ve viskoz seminal plazma içeren karmaşık bir karışımdır. Yüksek kaliteli sperm, genellikle daha düşük bir DNA parçalanma indeksi (DFI) ve daha yüksek döllenme potansiyeli sergileyen normal morfolojiye sahip, aşamalı olarak hareketli spermatozoaları ifade eder. Yüksek kaliteli sperm hazırlamak, insan destekli üreme teknolojisinde kritik bir adımdır. Geleneksel sperm hazırlama yöntemi olan süreksiz yoğunluk gradyan santrifüjleme (DGC), zaman alıcı ve emek yoğundur. Tekrarlanan santrifüjleme sperm DNA'sına zarar verebilir, böylece sonraki döllenmeyi ve embriyo gelişimini etkileyebilir. Bu çalışma, santrifüjlemenin sperm DNA'sı üzerindeki zararlı etkilerini önemli ölçüde ortadan kaldıran intrasitoplazmik sperm enjeksiyonu (ICSI) spermi hazırlamak için U şeklinde bir yatay yüzme (UHS) yöntemini tanıtmaktadır. UHS yöntemi, bir ICSI çalışma kabı içinde bir gübreleme ortamı kullanarak bir UHS şeridi oluşturmayı içerir. Spermi tutmak için UHS şeridinin sol tarafındaki başlangıç noktasına 10 μL'lik bir dölleme ortamı mikro damlası yerleştirilir. İki adet ilave 10 μL gübreleme ortamı tampon damlacığı, şeridin sol orta kısmı boyunca aralıklarla konumlandırılır ve tüm damlacıklar gübreleme ortamı ile bağlanır. Çanak daha sonra kültür yağı ile kaplanır ve dengelemek için% 6 CO2 ile gece boyunca 37 ° C'de inkübe edilir. Daha sonra, başlangıç noktasında mikro damlacığa 3 μL meni eklenir. Yüksek kaliteli spermatozoalar, UHS şeridinin sağ tarafına yüzerek ICSI enjeksiyon iğnesine emilmelerini kolaylaştırır. Ölü sperm, hücre kalıntıları ve diğer viskoz safsızlıklar büyük ölçüde başlangıç noktasında veya tampon damlacıklarında kalır. Hem UHS hem de DGC tekniklerini kullanarak 21 semen örneğini aynı anda işledik ve DFI'lerini karşılaştırdık. Sonuçlar, DGC grubundaki DFI'nin %5,5 ± %3,2 olduğunu, UHS grubundaki DFI'nin ise %1,7 ± %1,1 olduğunu gösterdi. İki grup arasındaki fark istatistiksel olarak anlamlıydı (P < 0.05).
Giriş
Semen optimizasyonu ve spermatozoa hazırlama teknikleri, insan destekli üreme teknolojisinde önemli bir adım olan yapısal ve fonksiyonel olarak üstün spermatozoa ile zenginleştirilmiş hücre fraksiyonlarının elde edilmesinde çok önemli bir rol oynamaktadır1. Semen optimizasyonunun amacı şudur: (1) Prostaglandinleri, bağışıklık aktif hücreleri, anti-sperm antikorlarını, hareketsiz düşük kaliteli spermleri, bakterileri ve seminal plazmadaki kalıntıları azaltmak veya uzaklaştırmak; (2) Meni viskozitesini azaltın veya ortadan kaldırın; ve (3) Sperm kapasitesini teşvik edin ve döllenme kabiliyetini artırın. İdeal bir sperm hazırlama tekniği, DNA bütünlüğünü koruyan ve sperm ve lökositler tarafından reaktif oksijen türlerinin (ROS) üretimi yoluyla işlev bozukluğuna neden olmayan oldukça işlevsel bir sperm popülasyonunu geri kazanmalıdır2.
Günümüzde en yaygın kullanılan sperm hazırlama teknolojisi DGC yöntemidir. Bu yöntemin avantajları, yüksek geri kazanım oranı3 ve kolay standardizasyondur. Pratik kullanımda, çift yoğunluklu gradyan yöntemi4, mini DGC yöntemi veya tek katmanlı gradyan santrifüjleme yöntemi5 için numunenin kalitesine göre esnek bir şekilde seçilebilir. Bu yöntem, hücre kalıntılarından, kontamine beyaz kan hücrelerinden, germ olmayan hücrelerden ve dejenere germ hücrelerinden arındırılmış, iyi canlılığa sahip yüksek kaliteli sperm hazırlamak için kullanılabilir. Bununla birlikte, bu yöntemin dezavantajı, sperm DNA'sına zarar verebileceksantrifüjleme gerektirmesidir 6.
Burada sunulan yöntem, Baldini ve ark.7 tarafından enjeksiyon kaplarında yatay sperm göçüne odaklanan orijinal çalışmadan uyarlanmıştır. Bu modifiye edilmiş yöntem, yüksek kaliteli spermleri güçlü canlılıkla ayırmak için U şeklinde bir yatay şerit içerir. Santrifüjlemenin neden olduğu DNA hasarını önler ve intrasitoplazmik sperm enjeksiyonu (ICSI) prosedürleri sırasında ölü sperm, hücre kalıntıları ve diğer viskoz safsızlıkların etkisini en aza indirir.
Spesifik yaklaşım, ICSI çalışma kabında bir UHS şeridi oluşturmak için bir gübreleme ortamının kullanılmasını içerir. Spermayı tutmak için UHS şeridinin sol başlangıç noktasına 10 μL'lik bir döllenme ortamı mikro damlası yerleştirilir. İki adet ilave 10 μL gübreleme ortamı tampon damlacığı, UHS şeridinin sol orta bölümüne aralıklarla yerleştirilir ve tüm damlacıklar gübreleme ortamı ile bağlanır. Kurulumu yetiştirme yağı ile kapladıktan sonra, çanak dengeleme için% 6 CO2 ile 37 ° C'de gece boyunca inkübe edilir. Daha sonra, UHS şeridinin sol tarafındaki başlangıç noktasındaki mikro damlacığa 3 μL meni eklenir. Yüksek kaliteli spermler, UHS şeridinin sağ tarafındaki piste yüzerek ICSI enjeksiyon iğnesi ile toplanmalarını kolaylaştırır. Ölü sperm, hücre kalıntıları ve diğer viskoz safsızlıklar esas olarak orijinal yerde veya tampon damlacıklarında kalır.
Mikroakışkan çip, dişi üreme sistemindeki doğal seçim sürecini simüle ederek, yüksek kaliteli spermin santrifüjleme olmadan spermden en uygun şekilde izole edilmesini sağlar. Bu, sperm motilitesini8 iyileştirmek, sperm DNA parçalanma indeksini9 azaltmak ve hamilelik sonuçlarınıiyileştirmek 10 için kritik öneme sahiptir. Bununla birlikte, bu tür cihazların üretimi karmaşık, maliyetli ve geniş çapta uygulanması zordur.
Burada açıklanan protokol yeni, basit ve uygulanabilir bir alternatif sunmaktadır. Sperm hareketliliği özelliklerinden yararlanan bu yöntem, mikroakışkan teknolojisiyle karşılaştırılabilir sonuçlar elde eder. Hazırlanan spermler güçlü canlılık, düşük DNA parçalanma indeksleri sergiler ve ICSI'de kullanım için çok uygundur.
Protokol
Bu çalışma, Nanjing Tıp Üniversitesi'ne bağlı Huai'an Birinci Halk Hastanesi Tıbbi Etik Komitesi tarafından onaylanmıştır (Onay numarası: KY-2024-181-01). Bu çalışmada örnekleri kullanılan hastalardan bilgilendirilmiş onam alındı. İşlem, deneyimli personel tarafından iyi laboratuvar uygulamalarına ve klinik kılavuzlara uygun olarak yapılmalıdır11,12. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda verilmiştir.
1. Bir ICSI ameliyat kabının hazırlanması
- ICSI çalışma kabında U şeklinde izler oluşturmak için 20 μL gübreleme ortamı kullanın (Şekil 1). U şeklindeki rayın sol izinin uzunluğu yaklaşık 30 mm olmalı ve sağ yolun uzunluğu da yaklaşık 30 mm olmalıdır.
- 10 μL'lik gübreleme ortamını bir pipetle emdirin ve U şeklindeki yolun sol başlangıç noktasında dairesel bir damlacık oluşturun. Semen stoğu çözeltisini eklemek için U şeklindeki rayın sol başlangıç noktasına bağlayın.
- UHS şeridinin sol orta kısmında aralıklarla iki adet 10 μL'lik gübreleme ortamı tampon damlacığı oluşturun. Tüm damlacıkları gübreleme ortamına bağlayın.
- 2,5 μL Polivinil pirolidon (PVP) kullanarak U şeklindeki şeridin sağ tarafında uzun bir sıvı damlası şeridi oluşturun. PVP şeridinin U şeklindeki şeridin sağ şeridine paralel olduğundan emin olun.
- PVP şeridinin sağ tarafındaki oosit işleme ortamını kullanarak, damlacık başına 20 μL olacak şekilde altı mikro damlacık yapın.
- Yemeğe 7 mL kültür yağı ekleyin, yağın damlacığın en yüksek noktasını kapladığından emin olun. Dengelemek için gece boyunca 37 °C,% 6 CO2 inkübatöre koyun.
2. Semen örneği toplama
- Hastalara semen örneğinin toplanmasıyla ilgili açık yazılı ve sözlü talimatlar verin. Numune alımının tamamlandığından emin olun ve hastalara toplamadan önce 3-7 gün boyunca boşalmadan kaçınmalarını söyleyin.
- Mastürbasyon yoluyla spermi tek kullanımlık, steril ve toksik olmayan özel bir sperm toplama kabına toplayın. Tüm ejakülatın toplandığından emin olun ve bireye numunenin herhangi bir fraksiyonundaki herhangi bir kaybı bildirmesi talimatını verin.
- Hastanın eşinin adlarını, geçerli kimlik belgelerini ve parmak izlerini doğrulayın. Sperm toplama kabının gövdesine ve kapağına hastanın eşinin adını ve tıbbi kayıt numarasını işaretleyin.
- Erkek hasta meni topladıktan sonra, numuneyi personel ve hasta arasında yüz yüze teslim edin. Paketleme ve saklama için az miktarda semen örneği alın. Hastanın paketleme alanında imzaladığından emin olun.
- Kapsüllenmiş örnekleri numaralandırın ve 2 yıl boyunca saklayın. Hasta bilgilerini, kimlik numarasını ve alıcının ve tanıkların imzalarını semen işleme kayıt defterine kaydedin.
- Üreme merkezinin herhangi bir personeli şüpheli bir hastanın kimliğini keşfederse, numuneyi almayı bırakın ve hastanın kimliğini yeniden doğrulayın. Aynı anda iki veya daha fazla numune almayın. Örneklerde karışıklık şüphesi varsa, bunları almayı bırakın.
3. Semen örneğinin analizi
- Semen örneklerinin rengini gözlemleyin.
NOT: Normal meni sıvılaşmadan sonra homojen ve grimsi beyaz görünür. Çok düşük sperm konsantrasyonuna sahip meni şeffaf görünebilir. Kırmızı kan hücreleri varsa, meni kırmızımsı kahverengi görünebilir. Hastada sarılık varsa veya bazı vitaminleri alırsa, meni sarı görünebilir. - Tartım yöntemini kullanarak meni hacmini 0,1 mL'ye kadar hassas bir şekilde ölçün.
- Semen örneğini 37 °C'de 15-30 dakika bekletin. Geniş delikli (yaklaşık 1,5 mm çapında) plastik tek kullanımlık bir pipete aspire edin ve spermin yerçekimi ile düşmesine izin verin. Herhangi bir ipliğin uzunluğuna dikkat edin.
NOT: Normal bir sıvılaştırılmış ejakülat, küçük, ayrı damlalar oluşturur. Viskozite anormal ise, damla 2 cm'den daha uzun bir iplik oluşturacaktır. - Meni 60 dakika içinde hala sıvılaşmazsa, eşit miktarda gübreleme ortamı ekleyin. Ardından, tamamen sıvılaşana kadar tek kullanımlık bir plastik transfer pipeti kullanarak karışımı tekrar tekrar soluyun ve verin.
- Hassas pH test kağıdı (pH 6.0-10.0) kullanarak spermin pH değerini ölçün.
- 10 μL tamamen sıvılaştırılmış meni alın ve bir Makler sayma odasına damlatın. Optik mikroskop ile 200x alan altında sperm hareketliliğini değerlendirin. Sperm aglütinasyonu ve sperm olmayan hücrelerin varlığını gözlemleyin.
- Optik mikroskop ile 200x alan altında sperm konsantrasyonunu değerlendirin.
4. Oositlerin toplanması
- Oosit alımından bir gün önce oositleri (OPD) almak için bir tabak hazırlayın. 35 mm'lik steril bir kültür kabına 2,5 mL oosit işleme ortamı ekleyin. Daha sonra 1,5 mL yağ ekleyin ve kabı dengeleme için gece boyunca 37 °C'lik bir inkübatöre koyun.
- Oosit alımından bir gün önce oosit kültürü (OKB) için iki yemek hazırlayın. Steril bir merkezi kuyu kültürü kabının iç halkasına 1 mL gübreleme ortamı ekleyin, ardından 1 mL yağ ekleyin. Dış halkaya 4 mL gübreleme ortamı ekleyin. Çanağı gece boyunca dengelemek için 37 °C, %6CO2 inkübatöre yerleştirin.
- Tüm ısıtıcıları ve ısıtma plakalarını açın ve oosit alımından 30 dakika önce sıcaklığı ölçün.
- Ellerinizi el dezenfektanı ile yıkayın ve akan su ile iyice durulayın. Temiz, steril ve tozsuz eldivenler giyin.
- Steril kültür kabını 37 °C'lik bir ısıtma platformunda önceden ısıtın.
- Oosit alımından önce hastanın kimliğini kesinlikle doğrulayın.
- Foliküler sıvıyı negatif basınçla steril test tüplerine soluyun, ardından hemen laboratuvar embriyologlarına teslim edin.
- Tüm foliküler sıvıyı steril kültür kaplarına dökün ve düşük büyütmeli stereomikroskop altında oosit korona kümülüs kompleksleri (OCCC'ler) arayın. OCCC'leri bir pipet kullanarak alın ve 37 °C'de geçici olarak saklamak için bir OPD'ye yerleştirin.
- Foliküler sıvıdaki foliküler sıvının miktarını, rengini, folikül sayısını ve OCCC sayısını kaydedin.
- Oosit alımından sonra, steril bir Pasteur pipeti kullanarak OCCC'leri OKB'ye aktarın. Bunları 2 saat boyunca hızlı bir şekilde bir kültür inkübatörüne (37 ° C,% 6 CO2,% 5 O2 ve doymuş nem) yerleştirin.
- Dört oyuklu bir tabak hazırlayın, ilk oyuğa 0.5 mL hyaluronidaz çözeltisi ve kalan üç oyuğun her birine 1 mL oosit işleme ortamı ekleyin. 37 °C'de 1 saat inkübe edin.
- OCCC'leri adım 4.10'dan 30 saniye boyunca iyi içeren bir hyaluronidaza aktarmak için bir Pasteur pipeti kullanın. Ardından, OCCC'leri iyi içeren bir oosit işleme ortamına aktarın.
- Granüloza hücrelerini çıkarmak için OCCC'leri üflemek ve aspire etmek için 150 μm çapında bir oosit sıyırma tüpü kullanın. Ardından, oositleri yıkamak üzere oosit işleme ortamına aktarmak için yeni bir Pasteur pipeti kullanın. Bunları önceden dengelenmiş başka bir OKB'ye aktarın ve 37 °C,% 6 CO2 inkübatöre yerleştirin.
5. Sperm seçimi ve ICSI operasyonu
- Adım 1.1'den adım 1.6'ya kadar hazırlanan ICSI çalışma kabındaki U şeklindeki yolun sol başlangıç noktasındaki döllenme ortamı mikro damlacığına 5 μL semen ekleyin.
- ICSI çalışma kabını 37 °C, %6CO2'de 30-60 dakika süreyle bir inkübatöre yerleştirin.
- Ters çevrilmiş mikroskobu, mikroskop işletim sistemini ve s'yi açıntage ısıtma aşaması tüm operasyonel kontrollerin orijinal kontrol edilebilir aralıklarına geri yüklendiğinden emin olmak için sorunsuz ve rahat çalışma sağlar.
- ICSI iğnesini iğne tutucusuna takın. İğne tutucuyu mikromanipülatöre sabitleyin, tutma iğnesini ve enjeksiyon iğnesini 4x objektif merceğinde ayarlayın ve açılarını ve konumlarını, iki iğne sahneye göreceli ve paralel olacak şekilde sırayla ayarlayın. × 20 objektif merceğinin altındaki çalıştırma iğnesinin hareket aralığını kontrol edin.
- Oosit tutma iğnesinin ve enjeksiyon iğnesinin açısını ve konumunu, 4x objektif merceğinin altında, iki iğne başı sahneye göreceli ve paralel olacak şekilde ayarlayın. Çalıştırma iğnesini ileri, geri, sola ve sağa hareket ettirin. 10x ve 20x objektiflerin altındaki çalıştırma iğnesinin hareket aralığını kontrol edin.
- Ameliyat masası ile ısıtma masası arasındaki yüksekliğin, ameliyat iğnesine dokunmadan ameliyat kabının kolayca yerleştirilmesine izin verdiğinden emin olmak için oosit tutma iğnesini ve enjeksiyon iğnesini kaldırın.
- İki kez kontrol ettikten sonra, adım 4.12'den seçilen oositleri, damlacık başına bir tane olmak üzere ICSI çalışma kabındaki oosit işleme ortamı mikro damlacıklarına aktarın.
- Oosit içeren ameliyat kabını hazırlanan mikroskop operatörünün sıcak tablasına yerleştirin.
- Ameliyat çanağının içindeki mikro damlacıkların kenarlarını net ve görünür hale getirmek için mikroskobun odak uzaklığını 10x objektif merceğinin altında ayarlayın.
- Enjeksiyon iğnesini ICSI çalıştırma kabının PVP şeridine indirin. Enjeksiyon iğnesini net bir şekilde görünür hale getirmek için mikroskobu ayarlayın ve aynı anda enjeksiyon iğnesine az miktarda PVP soluyun.
- Enjeksiyon iğnesini U şeklindeki yolun sağ tarafındaki uzun şeride yerleştirin ve iyi morfoloji ve ilerleyici motiliteye sahip yüksek kaliteli spermatozoaları çıkarın.
- Spermi sağ taraftaki PVP şeridine aktarın ve spermi ameliyat kabının dibine yerleştirin.
- Enjeksiyon iğnesini sperm kuyruğunun orta veya alt kısmına hafifçe bastırın, enjeksiyon iğnesini hızlı bir şekilde geri çekin ve durdurmak için spermi çizin.
- Spermi kuyruktan kafaya kadar enjeksiyon iğnesine soluyun.
- Enjeksiyon iğnesini sağ taraftaki oositi içeren oosit işleme ortamı damlacığına aktarın.
- Oosit tutma iğnesini indirin ve oositi sabitleyerek ilk polar gövdeyi saat 12'ye yerleştirmek için oositi yavaşça hareket ettirin.
- Mikrocerrahi iğneyi ve oosit zarını aynı yatay düzleme ayarlayın. Spermi enjeksiyon iğnesi ucuna itin.
- Oosit üzerinde saat 3 konumunda zona pellucida'dan dikey olarak geçin ve enjeksiyon iğnesinin hafifçe geri çekilmesiyle iğneyi oositin merkezine ulaşana veya merkez konumunu hafifçe geçene kadar enjekte etmeye devam edin.
NOT: Sitoplazmada ve spermde hızlı reflü olması oosit zarının kırıldığını ve aspirasyonun durduğunu gösterir. - Spermi yavaşça oositin sitoplazmasına enjekte edin ve enjeksiyon iğnesinden çıkın. Sitoplazmaya sperm enjeksiyonunun derinliği, oosit çapının yaklaşık% 50-75'i olmalıdır.
- Enjeksiyon iğnesini geri çektikten sonra, oositleri serbest bırakmak için oosit tutma iğnesinin negatif basıncını ayarlayın.
- Tüm olgun oositler enjekte edilene kadar yukarıdaki adımları tekrarlayın.
- ICSI kabını mikroskop sıcak plakasından diseksiyon mikroskobuna aktarın.
- Bölünme kültürü kabını inkübatörden çıkarın.
- Enjekte edilen sperm oositini bir bölünme kültürü kabındaki bir mikro damlacığa aktarın.
- Bölünme kültürü kabını 37 °C, %6 CO2,% 5 O2 inkübatöre geri yerleştirin.
6. DGC yöntemi kullanılarak sperm hazırlanması
- 15 mL steril konik tabanlı test tüpüne 1,5 mL %45 yoğunluk gradyan santrifüj çözeltisi ekleyin.
- %45 yoğunluk gradyanlı santrifüj solüsyonunun altına yavaşça 1,5 mL %90 yoğunluk gradyanlı santrifüj solüsyonu ekleyin ve iki sıvı arasındaki arayüzü koruyun.
- Sıvılaştırılmış spermi gradyan santrifüj çözeltisine yavaşça ekleyin ve 300 x g'da 15 dakika (oda sıcaklığında) santrifüjleyin.
- Süpernatanı çıkarın ve kalan sperm tortusunun yaklaşık 0,5 mL'sini 3 mL döllenme ortamına ekleyin. Üfleyin ve iyice karıştırın.
- Oda sıcaklığında 200 x g'da 5 dakika santrifüjleyin.
- Süpernatanı pipetleyin ve yaklaşık 0.2 mL tortu bırakın.
- Tortuyu yeniden süspanse etmek, sperm konsantrasyonunu ve canlılığını saymak ve kaydetmek için uygun miktarda döllenme ortamı ekleyin. Daha sonra kullanmak üzere 37°C, %6 CO2 inkübatöre yerleştirin.
7. Sperm nükleer DNA bütünlüğünün tespiti (Sperm Kromatin Dispersiyon Yöntemi, SCD)
- Deneyi gerçekleştirmeden önce iç ortam sıcaklığını 20-28 °C'ye ayarlayın. Reaktif kitini çıkarın ve oda sıcaklığında 30-60 dakika dengelenmesine izin verin.
- Denatüre edici çözeltiyi hazırlayın: 0.8 mL konsantre denatüre edici çözelti alın ve 100 mL damıtılmış suya ekleyin.
- % 70 etanol çözeltisini hazırlayın: % 70 etanol çözeltisini hazırlamak için 26.65 mL damıtılmış su ve 70.35 mL susuz etanol alın.
- % 90 etanol çözeltisini hazırlayın: % 90 etanol çözeltisini hazırlamak için 9.55 mL damıtılmış su ve 90.45 mL susuz etanol alın.
- Düşük erime noktalı agaroz tüpünü (25 μL düşük erime noktalı agaroz çözeltisi içeren) agaroz jeli tamamen eriyene kadar 1-2 dakika boyunca 90-100 ° C'lik bir su banyosuna yerleştirin. Ardından, tüpü sıcaklık sabit olana kadar 5 dakika boyunca 37 ° C'lik bir su banyosuna yerleştirin.
- Optimizasyon tedavisinden önce 3-10 μL meni alın ve optimizasyon tedavisinden sonra sperm süspansiyonu alın. Bunları farklı düşük erime noktalı agaroz tüplerine ekleyin, ardından iyice karıştırın.
- Sperm içeren düşük erime noktalı agaroz süspansiyonundan 30 μL alın ve yatay konumda önceden işlenmiş bir cam slayt üzerine bırakın.
- Kapak camını (22 mm x 11 mm boyutunda) sürgüyle nazikçe kapatın ve kabarcık oluşumunu mümkün olduğunca önleyin.
- Ön işlem görmüş cam sürgüyü 2-8 °C'de 4 dakika buzdolabına koyun ve tüm süreç boyunca sürgüyü yatay konumda tutun. Cam sürgüyü buzdolabından çıkarın ve kapak camını çıkarmak için hafifçe kaydırın.
- Ön işlem görmüş cam sürgüyü 7 dakika boyunca denatüre edici solüsyona hızlı bir şekilde daldırın.
- Ön işlem görmüş cam sürgüyü çıkarın ve 5 saniye boyunca damıtılmış suda bekletin.
- Ön işlem görmüş cam sürgüyü çıkarın ve dik durmasını sağlayın. Slaytın yüzeyindeki su damlacıklarını emmek için filtre kağıdı kullanın ve numune alanına dokunmaktan kaçının.
- Ön işlem görmüş cam slaytı lizis tamponuna daldırın ve 20 dakika boyunca doğru şekilde tepki verin.
- Lizis solüsyonunu yıkamak için önceden işlenmiş parçaları 3 dakika yıkama solüsyonuna daldırın.
- Ön işlem görmüş cam sürgüyü çıkarın ve 2 dakika boyunca %70'lik bir etanol çözeltisine daldırın.
- Ön işlem görmüş cam sürgüyü çıkarın ve 2 dakika boyunca %90 etanol çözeltisine daldırın.
- Ön işlem görmüş cam sürgüyü çıkarın ve 2 dakika boyunca susuz etanol çözeltisine batırın.
- Ön işlem görmüş cam sürgüyü çıkarın ve doğal olarak kurumaya bırakın.
- Wright leke çözeltisi A'yı ve çözelti B'yi kahverengi boş bir şişede 1: 1 oranında hazırlayın.
- Ön işlem görmüş cam slaytı yatay olarak yerleştirin ve karışık boya solüsyonunu lam üzerine ekleyin, boya solüsyonunun tüm slaydı kapladığından emin olun (yaklaşık 0,5-1 mL boya solüsyonu).
- 5 dakika lekeledikten sonra, fazla boyama maddesini çıkarmak için vitray slaytı damıtılmış suyla 10-15 kez nazikçe durulayın.
- Camın doğal olarak kurumasını bekleyin ve optik mikroskop altında ×400'de gözlemleyin. 200'den fazla sperm sayın ve küçük halo halkaları, halo halkaları ve dejenerasyonu olmayan anormal sperm yüzdesini belirleyin.
8. İstatistiksel analiz
- Piyasada bulunan yazılımı kullanarak istatistiksel analiz yapın.
- Friedman testini kullanarak orijinal sperma, DGC ve UHS arasındaki DFI'yi (%) karşılaştırın.
NOT: İki yöntemin ikili karşılaştırmaları için Wilcoxon işaretli sıra testini kullanın. 0,05 ≤ bir p değerini istatistiksel olarak anlamlı olarak düşünün.
Sonuçlar
UHS ve DGC yöntemleri, 21 örneğin tedavisini optimize etmek ve iki yöntem arasındaki sperm DNA fragmantasyon indeksini karşılaştırmak için kullanıldı. ICSI kabındaki UHS izini kullanan yöntem, spermde hasara neden olabilecek DGC'nin yerini alabilir. İyi ilerleyici motiliteye sahip yüksek kaliteli spermler, U şeklindeki yolun kenarı boyunca düzgün bir şekilde yüzer (Şekil 2), bu da ICSI iğnesinin bunları ayrı ayrı kavramasını kolaylaştırır. UHS izi kullanılarak izole edilen yüksek kaliteli spermler daha düşük DFI'ye sahiptir (Şekil 3).
Şekil 3'te sunulan verileri oluşturmak için, DGC ve UHS yöntemleriyle ayrılan yüksek kaliteli spermlerin DFI'si, sperm kromatin dispersiyonu (SCD) yöntemi kullanılarak tespit edildi. Sonuçlar, DGC ile ayrılan yüksek kaliteli spermlerin DFI'sinin %5.5 ± %3.2 kadar yüksek olduğunu, UHS yöntemi ile ayrılan yüksek kaliteli spermlerin DFI'sinin ise %1.7 ± %1.1 olduğunu gösterdi (P < 0.05) (Tablo 1).

Şekil 1: Önceden hazırlanmış bir ICSI işletim paneli. Solda, meni eklemek için başında dairesel bir damlacık bulunan U şeklinde bir sperm şeridi vardır. Hareketsiz spermleri, hücre kalıntılarını ve viskoz safsızlıkları filtrelemek için sol şeride iki tampon damlacık yerleştirilmiştir. Ortada, sperm immobilizasyonu için kullanılan uzun bir PVP şeridi vardır. Sağ tarafta, oosit salınımı ve ICSI ponksiyon işlemleri için kullanılan altı oosit işleme ortamı damlacığı sırayla düzenlenmiştir. (A) Şematik diyagram. (B) Gerçekçi görünüm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Tampon damlacıklarının ve U şeklindeki şeritlerin sağ iz kenarının görüntülerinin karşılaştırılması. (A) Tampon damlacıkları, meniden büyük miktarda yuvarlak hücre, hareketsiz sperm, hücre kalıntısı, safsızlıklar vb. içerir. (B) Yüksek kaliteli sperm, UHS yolunun sağ kenarında dağılır ve ileri doğru yüzer, bu da ICSI iğne emilimini kolaylaştırır. Büyütme: 200x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
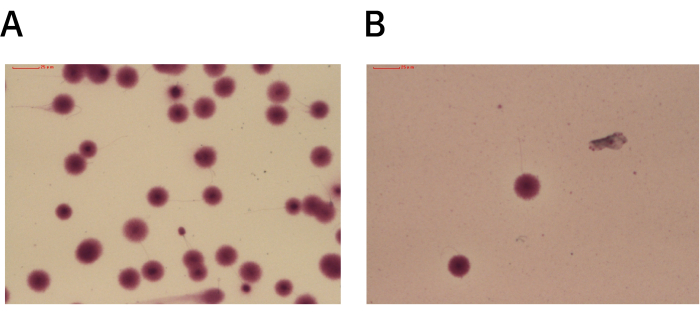
Şekil 3: DGC veya UHS ile elde edilen yüksek kaliteli spermin SCD testinden temsili görüntüler. (A) DGC kullanılarak işlenen SCD tahlil slaydı, minimal veya hiç hale olmayan parçalanmış sperm hücrelerini gösterir. Kalan sperm hücreleri, parçalanmanın olmadığını gösteren büyük dağınık DNA haleleri sergiler. (B) UHS yöntemi kullanılarak işlenen SCD tahlil slaydı, büyük dağınık DNA halelerine sahip parçalanmamış sperm hücrelerini gösterir. Büyütme: 100x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Madde | Ortalama ± SD | Aralık |
| Yaş (yıl) | 30 ± 3,6 | 26-38 |
| Semen hacmi (mL) | 3,50 ± 1,27 | 1.6-5.9 |
| Sperm konsantrasyonu (×106/mL) | 65,91 ± 24,65 | 38.76-146.63 |
| Progresif motilite (%) | 57,46 ± 10,49 | 28.65-77.69 |
| Toplam motilite (%) | 78,1 ± 8,67 | 44.99-83.50 |
| Orijinal spermanın DFI(%) | 8.0 ± 4.3 | 2.4-19.8 |
| DGC'nin DFI(%) | 5,5 ± 3,2* | 1.7-16.3 |
| UHS'nin DFI(%) | 1,7 ± 1,1* | 0-4.4 |
| NOT: * Orijinal spermanın DFI (%) ile karşılaştırıldığında, P < 0.05 | ||
Tablo 1: Çalışma popülasyonu hakkında genel bilgiler (n=21).
Tartışmalar
Bu makalede açıklanan UHS yöntemi kullanılarak yüksek kaliteli spermlerin ayrılmasının en önemli adımı, tampon damlacıklarla bir UHS şeridinin oluşturulmasıdır. Hem UHS şeridi hem de tampon damlacıkları, yıkanmış ve alınmış sperma kullanılarak oluşturulur. UHS şeridi, yüksek kaliteli spermlerin serbestçe yüzmesine ve parkurun kenarı boyunca birikmesine rehberlik ederek toplamayı kolaylaştırır. Tampon damlacıkları, ölü spermi, hücre kalıntılarını ve diğer safsızlıkları filtreleyerek meninin viskozitesini azaltır. UHS şeridinin sağ tarafı ile paralel PVP şeridi arasındaki mesafe, tüm ICSI iğne hareketi için gereken süreyi azaltmak için en aza indirilmelidir.
Süreksiz yoğunluk gradyanı yöntemiyle karşılaştırıldığında, UHS şerit yöntemi, laboratuvar personeli için daha az manuel işlem adımı içerir ve bu da emek yoğunluğunu azaltmaya yardımcı olur. UHS şerit yöntemiyle elde edilen yüksek kaliteli spermler, tekrarlanan santrifüj prosedürlerine tabi tutulmaz ve bu da daha düşük bir DFI ile sonuçlanır. Bu, döllenme, hamilelik sonuçları ve yavru güvenliği için daha elverişlidir13.
Burada sunulan protokolün ana sınırlaması, yüksek kaliteli spermin kendi kendine yüzme kabiliyetine yüksek oranda güvenmesidir. Bu yöntem spermi tamamen hareketsiz olan hastalar için uygun değildir. Aşırı astenozoospermi veya aşırı oligozoospermi vakalarında, doğru yola yüzebilecek daha az sayıda yüksek kaliteli sperm olduğunda, yüksek kaliteli sperm arama süresi artabilir. Bazen, sol yoldan veya tampon damlacıktan yüksek kaliteli sperm aramak gerekebilir. Bu alanlardaki ölü sperm, hücre kalıntıları ve viskoz safsızlıklar ICSI iğnesinin tıkanmasına neden olabilir, böylece tüm ICSI prosedürünü uzatabilir ve potansiyel olarak döllenme oranlarını etkileyebilir.
Burada sunulan yöntem, Baldini ve ark.7 tarafından enjeksiyon kaplarında yatay sperm göçüne odaklanan orijinal çalışmadan uyarlanmıştır. Baldini ve ark. yaklaşımında, küçük bir kültür ortamı ile bağlanan üç damlacık, spermin ilk damlacıktan (spermin eklendiği yer) üçüncü damlacığa (spermin aspire edildiği yer) yatay göçünü kolaylaştırdı ve damlacıkları birbirine bağlayan iki köprü ile birlikte. Bununla birlikte, bu yaklaşımda, yüksek kaliteli spermlerin göç ettiği küçük mesafe nedeniyle, menideki diğer bileşenlerden henüz tamamen ayrılmamıştır. Özellikle viskoz semen veya safsızlıklar, ICSI iğnesinin yapışmasına veya tıkanmasına neden olarak ICSI işleminin başarısız olmasına neden olabilir.
Sağlam DNA'ya sahip hareketli spermler, tigotaksis özelliğini sergiler, yani sınır duvarlarının yakınında yüzmeye meyillidirler14. Başka bir çalışma, timotaksisin ayrılan spermin kalitesini önemli ölçüde etkilediğinibuldu 15. Bu araştırma bulgularına dayanarak, timotaksis sperm ayrılmasında çok önemli bir rol oynar. Bu yöntemdeki U şeklindeki yörünge, yüksek kaliteli spermlerin serbest dolaşımını kolaylaştıran, hareketsiz spermlerden, safsızlıklardan ve diğer bileşenlerden tamamen ayrılmalarını sağlayan daha uzun bir sınıra sahiptir. Ayrıca, yüksek kaliteli spermler pistin kenarında birikir ve bu da ICSI prosedürü sırasında kavramayı ve manevra yapmayı kolaylaştırır.
Sonuç olarak, mevcut protokol, yüksek kaliteli spermleri ayırmak için bir ICSI kabında bir UHS şeridinin kullanımını açıklamaktadır. Prosedür, personelden daha az manuel adım gerektirir ve bu da ayrılan spermin düşük DFI'sine neden olur. Bu yöntem, in vitro fertilizasyon laboratuvarlarında tanıtım ve uygulama için çok uygundur.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7% Polyvinyl pyrrolidone Solution | Vitrolife Sweden AB | 10111 | ICSI |
| Aspirator | LABOTECT | - | Aspirator |
| Biological clean workbench | Suzhou Antai | - | Biological clean workbench |
| Blastocyst culture medium | Vitrolife Sweden AB | 10132 | Blastocyst culture medium |
| Cleavage culture medium | Vitrolife Sweden AB | 10128 | Cleavage culture medium |
| CO2 incubator | Thermo Scientific | - | CO2 incubator |
| Culture oil | Vitrolife Sweden AB | 10029 | OVOIL |
| Disposable plastic transfer pipette | BD Falcon | 357575 | disposable plastic transfer pipette |
| Fertilization medium | Vitrolife Sweden AB | 10136 | G-IVF PLUS |
| ICSI operating dish | BD Falcon | 351006 | Petri dish |
| Instant hyaluronidase | Vitrolife Sweden AB | 10017 | Instant hyaluronidase |
| Inverted microscope | NIKON | - | Inverted microscope |
| IVF Workstation | Denmark K-SYSTEM | - | IVF Workstation |
| Makler counting chamber | Sefi Medical Instruments | Makler counting chamber | |
| Micro operating system | NIKON | - | Micro operating system |
| Oocyte processing medium | Vitrolife Sweden AB | 10130 | G-MOPS PLUS |
| Optical microscope | OLYMPUS | - | Optical microscope |
| Phase contrast microscope | NIKON | - | Phase contrast microscope |
| Sperm Counting Board | Markler | - | Sperm Counting Board |
| Sperm gradient separation solution | Vitrolife Sweden AB | 10138 | SpermGrad |
| Sperm nucleus DNA integrity Kit | Shenzhen HuaKang | - | Sperm Nucleus DNA Integrity Kit (SCD) |
| Stereoscopic microscope | NIKON | - | Stereoscopic microscope |
| Tabletop centrifuge | HETTICH | - | Tabletop centrifuge |
| Thermostatic test tube rack | GRANT | - | Thermostatic test tube rack |
| Tri-gas incubator | ASTEC | - | Tri-gas incubator |
Referanslar
- Villeneuve, P., et al. Spermatozoa isolation with Felix outperforms conventional density gradient centrifugation preparation in selecting cells with low DNA damage. Andrology. 11 (8), 1593-1604 (2023).
- World Health Organization. . WHO laboratory manual for the examination and processing of human semen. , (2021).
- Fernandes, N. S., et al. Comparative sperm recovery rate after density gradient centrifugation with two media for in vitro fertilization. JBRA Assist Reprod. 27 (1), 25-28 (2023).
- Dai, X., et al. Sperm enrichment from poor semen samples by double-density gradient centrifugation in combination with swim-up for IVF cycles. Sci Rep. 10 (1), 2286 (2020).
- Hoa, N. T., et al. The effectiveness of sperm preparation using density mini-gradient and single-layer centrifugation for oligospermia samples. Acta Inform Med. 30 (2), 100-104 (2022).
- Le, M. T., et al. Effects of sperm preparation techniques on sperm survivability and DNA fragmentation. J Int Med Res. 50 (5), 1-11 (2022).
- Baldini, D., et al. A fast and safe technique for sperm preparation in ICSI treatments within a randomized controlled trial (RCT). Reprod Biol Endocrinol. 18 (88), 1-9 (2020).
- Gode, F., et al. Comparison of microfluid sperm sorting chip and density gradient methods for use in intrauterine insemination cycles. Fertil Steril. 112 (5), 842-848.e1 (2019).
- Simchi, M., et al. Selection of high-quality sperm with thousands of parallel channels. Lab Chip. 21 (12), 2464-2475 (2021).
- Shapouri, F., et al. A comparison between the Felix electrophoretic system of sperm isolation and conventional density gradient centrifugation: a multicentre analysis. J Assist Reprod Gen. 40 (1), 83-95 (2023).
- De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories. Human Reproduction. 31 (4), 685-686 (2015).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing performance and outcomes. , (2017).
- Duan Li, F., Li, X., Ma, X. Sperm DNA fragmentation index affects pregnancy outcomes and offspring safety in assisted reproductive technology. Sci Rep. 14 (1), 356 (2024).
- Denissenko, P., Kantsler, V., Smith, D. J., Kirkman-Brown, J. Human spermatozoa migration in microchannels reveals boundary-following navigation. P Natl Acad Sci USA. 109 (21), 8007-8010 (2012).
- Ahmadkhani, N., Saadatmand, M., Kazemnejad, S., Abdekhodaie, M. Qualified sperm selection based on the rheotaxis and thigmotaxis in a microfluidic system. Biomed Eng Lett. 13 (4), 671-680 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır