Method Article
U 型水平游泳技术制备低 DNA 片段化指数的高质量精子
摘要
该方案描述了一种利用精子运动特性和触觉性筛选低 DNA 片段化指数的高质量精子的方法。该方法采用 U 形水平泳道,使优质精子通过缓冲液滴到达对侧,同时排除死精子、细胞碎片和杂质。
摘要
人精液是一种复杂的混合物,包括进行性运动的精子、非进行性运动的精子、不动的精子、细胞碎片和粘性精浆。优质精子是指具有正常形态的逐渐运动的精子,通常表现出较低的 DNA 片段化指数 (DFI) 和较高的受精潜力。制备高质量的精子是人类辅助生殖技术的关键步骤。传统的精子制备方法,即非连续密度梯度离心法 (DGC),既费时又费力。重复离心会破坏精子 DNA,从而影响随后的受精和胚胎发育。本研究介绍了一种制备卵胞浆内单精子注射 (ICSI) 精子的 U 形水平游泳 (UHS) 方法,该方法显着消除了离心对精子 DNA 的不利影响。UHS 方法涉及在 ICSI作皿中使用施肥培养基创建 UHS 泳道。将 10 μL 受精培养基微滴放置在 UHS 泳道左侧的起点以容纳精液。两个额外的 10 μL 受精培养基缓冲液滴沿泳道的左侧中间部分间隔放置,所有液滴都由施肥培养基连接。然后将培养皿涂上培养油,并在 37 °C 和 6% CO2 下孵育过夜以平衡。随后,在起点将 3 μL 精液添加到微滴中。高质量的精子游到 UHS 泳道的右侧,促进它们被吸入 ICSI 注射针。死精子、细胞碎片和其他粘性杂质大部分保留在初始点或缓冲液滴中。我们使用 UHS 和 DGC 技术同时处理了 21 份精液样本,并比较了它们的 DFI。结果表明,DGC 组的 DFI 为 5.5% ± 3.2%,而 UHS 组的 DFI 为 1.7% ± 1.1%。两组间差异有统计学意义 (P < 0.05)。
引言
精液优化和精子制备技术在获得富含结构和功能优越精子的细胞组分方面起着至关重要的作用,这是人类辅助生殖技术的关键步骤1。精液优化的目的是: (1) 减少或去除精浆中的前列腺素、免疫活性细胞、抗精子抗体、固定的低质量精子、细菌和碎片;(2) 降低或消除精液的粘度;(3) 促进精子获能并增强受精能力。理想的精子制备技术应该恢复功能强大的精子种群,该精子种群保持 DNA 完整性,并且不会通过精子和白细胞产生活性氧 (ROS) 来诱导功能障碍2。
目前使用最广泛的精子制备技术是 DGC 方法。这种方法的优点是回收率高3 和易于标准化。在实际使用中,可以根据样品的质量灵活选择双密度梯度法4、mini-DGC法或单层梯度离心法5。该方法可用于制备具有良好生命力、不含细胞碎片、污染白细胞、非生殖细胞和退化生殖细胞的优质精子。然而,这种方法的缺点是需要离心,这可能导致精子 DNA6 的损伤。
这里介绍的方法改编自 Baldini 等人 7 的原始研究,该研究侧重于注射培养皿中的水平精子迁移。这种改进的方法结合了 U 形水平通道,以分离具有强大生命力的优质精子。它避免了离心引起的 DNA 损伤,并最大限度地减少了胞浆内单精子注射 (ICSI) 过程中死精子、细胞碎片和其他粘性杂质的影响。
具体方法涉及使用施肥培养基在 ICSI作皿中创建 UHS 泳道。将 10 μL 受精培养基微滴放置在 UHS 泳道的左侧起点以容纳精液。在 UHS 泳道的左侧中间部分间隔放置两个额外的 10 μL 受精培养基缓冲液滴,并且所有液滴都通过施肥培养基连接。用培养油覆盖设置后,将培养皿在 37 °C 和 6% CO2 下孵育过夜以平衡。随后,将 3 μL 精液添加到 UHS 泳道左侧起点的微滴中。高质量的精子游到 UHS 泳道右侧的跑道上,便于使用 ICSI 注射针收集精子。死精子、细胞碎片和其他粘性杂质主要保留在原始位置或缓冲液滴中。
微流控芯片模拟女性生殖道中的自然选择过程,无需离心即可从精液中最佳分离出优质精子。这对于提高精子活力8 (sperm Movility)、降低精子 DNA 片段化指数(sperm DNA fragmentation index) 9 和提高妊娠结局10 至关重要。然而,此类设备的制造复杂、昂贵且难以广泛实施。
此处描述的协议提供了一种新颖、简单且可行的替代方案。通过利用精子活力特性,该方法获得了与微流体技术相当的结果。制备的精子具有很强的生命力、低 DNA 片段化指数,非常适合用于 ICSI。
研究方案
本研究经南京医科大学附属淮安第一人民医院医学伦理委员会批准(批准号:KY-2024-181-01)。从本研究中使用的样本的患者那里获得知情同意。该程序应由经验丰富的人员根据良好的实验室规范和临床指南11,12 进行。材料表中提供了所用试剂和设备的详细信息。
1. ICSI作皿的准备
- 使用 20 μL 受精培养基在 ICSI作皿中创建 U 形轨道(图 1)。U 型轨道的左轨道长度应在 30 毫米左右,右轨道的长度也应在 30 毫米左右。
- 用移液管吸取 10 μL 受精培养基,并在 U 形轨道的左侧起点形成一个圆形液滴。将其与 U 形轨道的左侧起点连接,以添加精液原液。
- 在 UHS 泳道的左侧中间部分间隔创建两个 10 μL 受精培养基缓冲液液滴。将所有液滴与施肥培养基连接。
- 使用 2.5 μL 聚乙烯吡咯烷酮 (PVP) 在 U 形泳道的右侧创建一条长液滴。确保 PVP 条带与 U 形车道的右侧车道平行。
- 使用 PVP 试纸条右侧的卵母细胞加工培养基制备 6 个微滴,每个液滴 20 μL。
- 向培养皿中加入 7 mL 培养油,确保油覆盖液滴的最高点。将其置于 37 °C、6% CO2 培养箱中过夜以平衡。
2. 精液样本采集
- 向患者提供有关精液样本采集的明确书面和口头说明。确保样本采集完成,并指导患者在采集前 3-7 天避免射精。
- 通过手淫将精液收集到一次性、无菌且无毒的专用精子收集杯中。确保收集整个射精,并指示个人报告样本任何部分的任何损失。
- 核实患者配偶的姓名、有效身份证件和指纹。在精子采集杯的身体和盖子上标记患者配偶的姓名和病历编号。
- 男性患者采集精液后,在工作人员和患者之间面对面交出样本。取少量精液样本进行包装和储存。确保患者在包装区域签名。
- 对封装的标本进行编号并储存 2 年。在精液处理日志中记录患者信息、身份证号以及受者与证人的签名。
- 如果生殖中心的任何工作人员发现可疑患者的身份,请停止接收样本并重新验证患者的身份。不要同时接收两个或多个标本。如果怀疑样本中存在混淆,请停止接收它们。
3. 精液标本分析
- 观察精液标本的颜色。
注意:正常精液液化后呈均匀和灰白色。精子浓度非常低的精液可能呈透明状。如果存在红细胞,精液可能呈红棕色。如果患者患有黄疸或服用某些维生素,精液可能会呈黄色。 - 使用称重法测量精液的体积,精确到 0.1 mL。
- 将精液样品在 37 °C 下放置 15-30 分钟。将其吸入大口径(直径约 1.5 mm)塑料一次性移液器中,使精液通过重力滴落。观察任何线程的长度。
注意:正常的液化射精会形成小而离散的液滴。如果粘度异常,液滴会形成长于 2 厘米的线。 - 如果精液在 60 分钟内仍未液化,则加入等量的受精培养基。然后,使用一次性塑料移液管反复吸入和呼出混合物,直至完全液化。
- 使用精密 pH 试纸 (pH 6.0-10.0) 测量精液的 pH 值。
- 取 10 μL 完全液化的精液,滴入 Makler 计数室。用光学显微镜在 200 倍视野下评估精子活力。观察精子凝集和非精子细胞的存在。
- 用光学显微镜在 200 倍视野下评估精子浓度。
4. 拾取卵母细胞
- 在取卵前一天准备一个用于拾取卵母细胞 (OPD) 的培养皿。将 2.5 mL 卵母细胞加工培养基添加到 35 mm 无菌培养皿中。然后,加入 1.5 mL 油,将培养皿置于 37 °C 培养箱中过夜以平衡。
- 取卵前一天准备两个用于卵母细胞培养 (OCD) 的培养皿。将 1 mL 受精培养基添加到无菌中心孔培养皿的内环中,然后加入 1 mL 油。向外环中加入 4 mL 受精培养基。将培养皿置于 37 °C、6% CO2 培养箱中平衡过夜。
- 打开所有加热器和加热板,并在取卵前 30 分钟测量温度。
- 用免洗手消毒液洗手,并用流水彻底冲洗。戴上干净、无菌和无尘的手套。
- 在 37 °C 加热平台上预热无菌培养皿。
- 取卵前严格验证患者身份。
- 通过负压将卵泡液吸入无菌试管中,然后立即交给实验室胚胎学家。
- 将所有卵泡液倒入无菌培养皿中,并在低倍率立体显微镜下寻找卵母细胞冠状卵丘复合体 (OCCC)。用移液管拾取 OCCC 并将其置于 OPD 中,在 37 °C 下临时储存。
- 记录卵泡液中 OCCC 的数量、颜色、卵泡数量和 OCCC 数量。
- 取卵后,使用无菌巴斯德移液器将 OCCC 转移到 OCD。将它们快速置于培养箱(37°C、6% CO2、5% O2 和饱和湿度)中 2 小时。
- 准备一个四孔培养皿,向第一个孔中加入 0.5 mL 透明质酸酶溶液,向其余三个孔中各加入 1 mL 卵母细胞加工培养基。在 37 °C 孵育 1 小时。
- 使用巴斯德移液器将步骤 4.10 中的 OCCC 转移到含有良好的透明质酸酶中 30 秒。然后,将 OCCC 转移到含有良好的卵母细胞加工培养基中。
- 使用直径为 150 μm 的卵母细胞剥离管吹气和吸出 OCCC 以去除颗粒细胞。然后,使用新的巴斯德移液器将卵母细胞转移到卵母细胞处理培养基中进行洗涤。将它们转移到另一个预平衡的 OCD 中,并将它们置于 37 °C、6% CO2 培养箱中。
5. 精子选择和 ICSI作
- 将 5 μL 精液加入 ICSI 操作皿中 U 形轨道左侧起点的受精培养基微滴中,该微滴是从步骤 1.1 到步骤 1.6 制备的。
- 将 ICSI作皿放入 37 °C、6% CO2 的培养箱中 30-60 分钟。
- 打开倒置显微镜、显微镜作系统和载物台加热台,确保所有作控制恢复到原来的可控范围,实现平稳舒适的作。
- 将 ICSI 针安装到持针器中。将持针器固定在显微作器上,调整 4x 物镜中的持针和注射针,依次调整它们的角度和位置,使两针相对平行于载物台。检查 × 20 物镜下手术针的运动范围。
- 调整 4 倍物镜下卵母细胞固定针和注射针的角度和位置,使两个针头相对平行于载物台。向前、向后、向左和向右移动手术针。检查 10 倍和 20 倍物镜下作针的移动范围。
- 抬起卵母细胞固定针和注射针,确保手术台和加热台之间的高度允许在不接触手术针的情况下轻松放置手术容器。
- 仔细检查后,将步骤 4.12 中选定的卵母细胞转移到 ICSI作皿中的卵母细胞处理培养基微滴中,每个液滴一个。
- 将含有卵母细胞的作皿放在准备好的显微镜作员的热台上。
- 在 10 倍物镜下调整显微镜的焦距,使手术皿内微滴的边缘清晰可见。
- 将注射针放入 ICSI作皿的 PVP 条中。调整显微镜,使注射针清晰可见,同时向注射针中吸入少量 PVP。
- 将注射针移至 U 形轨道右侧的长条中,提取形态良好、运动性强的优质精子。
- 将精子转移到右侧的 PVP 条带中,并将精子放在手术皿的底部。
- 轻轻按压精子尾部中部或下部的注射针,快速将注射针向后拉,并刮擦精子使其停止。
- 将精子从尾巴吸入头部吸入注射针中。
- 将注射针转移到右侧含有卵母细胞的卵母细胞加工培养基液滴中。
- 放下卵母细胞固定针,轻轻移动卵母细胞,将第一极体定位在 12 点钟位置,固定卵母细胞。
- 将显微外科针和卵母细胞膜调整到相同的水平面。将精子推到注射针尖。
- 垂直穿过卵母细胞上 3 点钟位置的透明带,继续注射针头,直到到达卵母细胞中心或略微越过中心位置,注射针略微缩回。
注意:当细胞质和精子发生快速反流时,表明卵母细胞膜已破裂,误吸已停止。 - 将精子缓慢注射到卵母细胞的细胞质中,然后退出注射针。精子注射到细胞质中的深度应为卵母细胞直径的 50%-75% 左右。
- 拔出注射针后,调整持卵母细胞针的负压,释放卵母细胞。
- 重复上述步骤,直到注射完所有成熟的卵母细胞。
- 将 ICSI 培养皿从显微镜热板转移到解剖显微镜中。
- 从培养箱中取出切割培养皿。
- 将注射的精子卵母细胞转移到卵裂培养皿中的微滴中。
- 将裂解培养皿放回 37 °C、6% CO2、5% O2 培养箱中。
6. 使用 DGC 方法制备精子
- 将 1.5 mL 45% 密度梯度离心溶液添加到 15 mL 无菌锥形底部试管中。
- 将 1.5 mL 90% 密度梯度离心液缓慢加入 45% 密度梯度离心液的底部,保持两种液体之间的界面。
- 将液化精液轻轻加入梯度离心溶液中,并以 300 x g 离心 15 分钟(在室温下)。
- 去除上清液,将大约 0.5 mL 剩余的精子沉淀物添加到 3 mL 受精培养基中。吹制并充分混合。
- 在室温下以 200 x g 离心 5 分钟。
- 移液上清液,留下约 0.2 mL 沉淀物。
- 加入适量的受精培养基,使沉淀物重悬,计算精子浓度和活力,并记录。置于 37°C、6% CO2 培养箱中以备后用。
7. 精子核 DNA 完整性检测(精子染色质分散法,SCD)
- 在进行实验之前,将室内温度调节到 20-28 °C。取出试剂盒,在室温下平衡 30-60 分钟。
- 准备变性溶液:取 0.8 mL 浓变性溶液,加入 100 mL 蒸馏水中。
- 制备 70% 乙醇溶液:取 26.65 mL 蒸馏水和 70.35 mL 无水乙醇制备 70% 乙醇溶液。
- 制备 90% 乙醇溶液:取 9.55 mL 蒸馏水和 90.45 mL 无水乙醇制备 90% 乙醇溶液。
- 将低熔点琼脂糖管(含有 25 μL 低熔点琼脂糖溶液)放入 90-100 °C 水浴中 1-2 分钟,直至琼脂糖凝胶完全熔化。然后,将试管置于 37 °C 水浴中 5 分钟,直到温度恒定。
- 优化处理前取 3-10 μL 精液,优化处理后精子悬吊。将它们添加到不同的低熔点琼脂糖管中,然后充分混合。
- 取 30 μL 含有精子的低熔点琼脂糖悬浮液,将其水平放到经过预处理的载玻片上。
- 用载玻片轻轻盖住盖玻片(尺寸为 22 mm x 11 mm),尽可能避免形成气泡。
- 将预处理过的载玻片放入 2-8 °C 的冰箱中 4 分钟,在整个过程中保持载玻片处于水平位置。从冰箱中取出载玻片,然后轻轻滑动以取下盖玻片。
- 将预处理过的载玻片快速浸入变性溶液中 7 分钟。
- 取出预处理过的载玻片,将其浸泡在蒸馏水中 5 秒。
- 取下预处理过的载玻片,使其直立。使用滤纸吸收载玻片表面的任何水滴,并避免接触标本区域。
- 将预处理过的载玻片浸入裂解缓冲液中,并准确反应 20 分钟。
- 将预处理过的片段浸入洗涤液中 3 分钟,以洗去裂解液。
- 取出预处理过的载玻片,将其浸入 70% 乙醇溶液中 2 分钟。
- 取出预处理过的载玻片,将其浸入 90% 乙醇溶液中 2 分钟。
- 取出预处理过的载玻片,将其浸入无水乙醇溶液中 2 分钟。
- 取下预处理过的载玻片,让它自然风干。
- 将 Wright 染色溶液 A 和溶液 B 以 1:1 的比例制备在棕色空瓶中。
- 将预处理过的载玻片水平放置,并将混合染料溶液添加到载玻片上,确保染料溶液覆盖整个载玻片(约 0.5-1 mL 染料溶液)。
- 染色 5 分钟后,用蒸馏水轻轻冲洗染色载玻片 10-15 次,以去除多余的染色剂。
- 让玻璃玻片自然干燥,并在 400× 的光学显微镜下观察。计数 200 多个精子,并确定具有小光环、无光环和退化的异常精子的百分比。
8. 统计分析
- 使用市售软件执行统计分析。
- 使用 Friedman 测试比较原始精液、DGC 和 UHS 之间的 DFI (%)。
注意:对于两种方法的成对比较,请使用 Wilcoxon 符号秩检验。将 p 值≤ 0.05 视为统计显著性。
结果
采用 UHS 和 DGC 方法对 21 例样品进行优化处理,并比较两种方法之间的精子 DNA 片段化指数。在 ICSI 培养皿中使用 UHS 轨道的方法可以替代 DGC,这可能会对精子造成损害。具有良好渐进运动能力的高质量精子沿着 U 形轨道的边缘平稳地游动(图 2),使 ICSI 针更容易单独抓住它们。使用 UHS 轨道分离的高质量精子具有较低的 DFI(图 3)。
为了生成 图 3 所示的数据,使用精子染色质分散 (SCD) 方法检测通过 DGC 和 UHS 方法分离的高质量精子的 DFI。结果显示,经 DGC 分离的优质精子的 DFI 高达 5.5% ± 3.2%,而 UHS 法分离的优质精子的 DFI 为 1.7% ± 1.1% (P < 0.05) (表1)。

图 1:预制的 ICSI作面板。 左侧是一个 U 形精子通道,开头有一个圆形液滴,用于添加精液。两个缓冲液滴位于左侧泳道上,以过滤掉固定的精子、细胞碎片和粘性杂质。在中间,有一条长长的 PVP 条,用于精子固定。在右侧,按顺序排列了 6 个卵母细胞加工培养基液滴,用于卵母细胞释放和 ICSI 穿刺作。(A) 示意图。(B) 真实视图。 请单击此处查看此图的较大版本。

图 2:缓冲液液滴图像与 U 形泳道右轨道边缘的比较。(A) 缓冲液液滴含有来自精液的大量圆形细胞、固定精子、细胞碎片、杂质等。(B) 高质量的精子在 UHS 轨道的右侧边缘分散并向前游动,促进 ICSI 针吸。放大倍率:200 倍。请单击此处查看此图的较大版本。
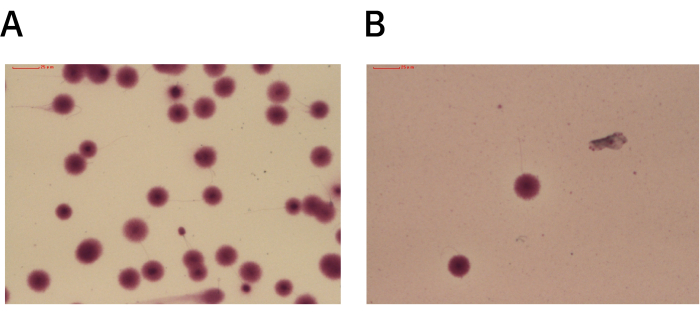
图 3:通过 DGC 或 UHS 获得的高质量精子的 SCD 测定的代表性图像。 (A) 使用 DGC 处理的 SCD 检测玻片,显示碎片化的精子细胞,光晕极少或没有光晕。剩余的精子细胞表现出分散的 DNA 的大光晕,表明没有片段化。(B) 使用 UHS 方法处理的 SCD 检测玻片,显示具有大分散 DNA 光晕的非碎片化精子细胞。放大倍率:100 倍。 请单击此处查看此图的较大版本。
| 项目 | SD ±平均值 | 范围 |
| 年龄 (岁) | 30 ± 3.6 | 26-38 |
| 精液量 (mL) | 3.50 ± 1.27 | 1.6-5.9 |
| 精子浓度 (×106/mL) | 65,91 ± 24,65 | 38.76-146.63 |
| 进行性运动 (%) | 57,46 ± 10,49 | 28.65-77.69 |
| 总活力 (%) | 78.1 ± 8.67 | 44.99-83.50 |
| 原始精液的 DFI(%) | 8.0 ± 4.3 | 2.4-19.8 |
| DGC 的 DFI(%) | 5.5 ± 3.2* | 1.7-16.3 |
| UHS 的 DFI(%) | 1.7 ± 1.1* | 0-4.4 |
| 注:*与原始精液的 DFI(%) 相比, P < 0.05 | ||
表 1:研究人群的一般信息 (n=21)。
讨论
使用本文中描述的 UHS 方法分离高质量精子的关键步骤是建立带有缓冲液滴的 UHS 泳道。UHS 泳道和缓冲液滴都是使用洗涤和接收的精液产生的。UHS 泳道引导优质精子自由游动并沿着跑道边缘积累,便于收集。缓冲液滴可降低精液的粘度,过滤掉死精子、细胞碎片和其他杂质。UHS 泳道右侧与平行 PVP 胶条之间的距离应最小化,以减少整个 ICSI 针移动所需的时间。
与非连续密度梯度法相比,UHS 泳道法涉及实验室人员的手动作步骤更少,有助于减轻他们的劳动强度。通过 UHS 泳道方法获得的高质量精子无需经过重复离心程序,从而降低 DFI。这更有利于受精、怀孕结局和后代安全13。
这里介绍的协议的主要局限性是它高度依赖高质量精子的自泳能力。这种方法不适用于精子完全不动的患者。在极度弱精子症或极度少精子症的情况下,能够游向正确轨道的高质量精子较少,因此寻找高质量精子的时间可能会增加。有时,可能需要从左侧轨迹或缓冲液滴中寻找高质量的精子。这些区域的死精子、细胞碎片和粘性杂质可能会导致 ICSI 针头堵塞,从而延长整个 ICSI 程序并可能影响受精率。
这里介绍的方法改编自 Baldini 等人 7 的原始研究,该研究侧重于注射培养皿中的水平精子迁移。在 Baldini 等人的方法中,由小培养基连接的三个液滴促进了精子从第一个液滴(添加精子的地方)到第三个液滴(吸出精子的地方)的水平迁移,有两个桥连接液滴。然而,在这种方法中,由于高质量精子迁移的距离小,它们尚未与精液中的其他成分完全分离。特别是粘稠的精液或杂质,可能会导致 ICSI 针头卡住或堵塞,从而导致 ICSI 操作失败。
具有完整 DNA 的运动精子表现出趋触性的特征,这意味着它们倾向于在边界壁附近游泳14。另一项研究发现,触觉性显着影响分离精子的质量15。基于这些研究结果,触觉性在精子分离中起着至关重要的作用。该方法中的 U 形眼眶具有更长的边界,这有利于优质精子的自由移动,使它们能够与固定的精子、杂质和其他成分完全分离。此外,高质量的精子积聚在轨道边缘,使其在 ICSI 过程中更容易抓取和纵。
总之,目前的方案描述了在 ICSI 培养皿中使用 UHS 泳道来分离高质量的精子。该程序需要工作人员的手动步骤较少,导致分离精子的 DFI 较低。该方法非常适合 体外受精 实验室的推广和应用。
披露声明
作者没有什么可披露的。
致谢
没有。
材料
| Name | Company | Catalog Number | Comments |
| 7% Polyvinyl pyrrolidone Solution | Vitrolife Sweden AB | 10111 | ICSI |
| Aspirator | LABOTECT | - | Aspirator |
| Biological clean workbench | Suzhou Antai | - | Biological clean workbench |
| Blastocyst culture medium | Vitrolife Sweden AB | 10132 | Blastocyst culture medium |
| Cleavage culture medium | Vitrolife Sweden AB | 10128 | Cleavage culture medium |
| CO2 incubator | Thermo Scientific | - | CO2 incubator |
| Culture oil | Vitrolife Sweden AB | 10029 | OVOIL |
| Disposable plastic transfer pipette | BD Falcon | 357575 | disposable plastic transfer pipette |
| Fertilization medium | Vitrolife Sweden AB | 10136 | G-IVF PLUS |
| ICSI operating dish | BD Falcon | 351006 | Petri dish |
| Instant hyaluronidase | Vitrolife Sweden AB | 10017 | Instant hyaluronidase |
| Inverted microscope | NIKON | - | Inverted microscope |
| IVF Workstation | Denmark K-SYSTEM | - | IVF Workstation |
| Makler counting chamber | Sefi Medical Instruments | Makler counting chamber | |
| Micro operating system | NIKON | - | Micro operating system |
| Oocyte processing medium | Vitrolife Sweden AB | 10130 | G-MOPS PLUS |
| Optical microscope | OLYMPUS | - | Optical microscope |
| Phase contrast microscope | NIKON | - | Phase contrast microscope |
| Sperm Counting Board | Markler | - | Sperm Counting Board |
| Sperm gradient separation solution | Vitrolife Sweden AB | 10138 | SpermGrad |
| Sperm nucleus DNA integrity Kit | Shenzhen HuaKang | - | Sperm Nucleus DNA Integrity Kit (SCD) |
| Stereoscopic microscope | NIKON | - | Stereoscopic microscope |
| Tabletop centrifuge | HETTICH | - | Tabletop centrifuge |
| Thermostatic test tube rack | GRANT | - | Thermostatic test tube rack |
| Tri-gas incubator | ASTEC | - | Tri-gas incubator |
参考文献
- Villeneuve, P., et al. Spermatozoa isolation with Felix outperforms conventional density gradient centrifugation preparation in selecting cells with low DNA damage. Andrology. 11 (8), 1593-1604 (2023).
- World Health Organization. . WHO laboratory manual for the examination and processing of human semen. , (2021).
- Fernandes, N. S., et al. Comparative sperm recovery rate after density gradient centrifugation with two media for in vitro fertilization. JBRA Assist Reprod. 27 (1), 25-28 (2023).
- Dai, X., et al. Sperm enrichment from poor semen samples by double-density gradient centrifugation in combination with swim-up for IVF cycles. Sci Rep. 10 (1), 2286 (2020).
- Hoa, N. T., et al. The effectiveness of sperm preparation using density mini-gradient and single-layer centrifugation for oligospermia samples. Acta Inform Med. 30 (2), 100-104 (2022).
- Le, M. T., et al. Effects of sperm preparation techniques on sperm survivability and DNA fragmentation. J Int Med Res. 50 (5), 1-11 (2022).
- Baldini, D., et al. A fast and safe technique for sperm preparation in ICSI treatments within a randomized controlled trial (RCT). Reprod Biol Endocrinol. 18 (88), 1-9 (2020).
- Gode, F., et al. Comparison of microfluid sperm sorting chip and density gradient methods for use in intrauterine insemination cycles. Fertil Steril. 112 (5), 842-848.e1 (2019).
- Simchi, M., et al. Selection of high-quality sperm with thousands of parallel channels. Lab Chip. 21 (12), 2464-2475 (2021).
- Shapouri, F., et al. A comparison between the Felix electrophoretic system of sperm isolation and conventional density gradient centrifugation: a multicentre analysis. J Assist Reprod Gen. 40 (1), 83-95 (2023).
- De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories. Human Reproduction. 31 (4), 685-686 (2015).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing performance and outcomes. , (2017).
- Duan Li, F., Li, X., Ma, X. Sperm DNA fragmentation index affects pregnancy outcomes and offspring safety in assisted reproductive technology. Sci Rep. 14 (1), 356 (2024).
- Denissenko, P., Kantsler, V., Smith, D. J., Kirkman-Brown, J. Human spermatozoa migration in microchannels reveals boundary-following navigation. P Natl Acad Sci USA. 109 (21), 8007-8010 (2012).
- Ahmadkhani, N., Saadatmand, M., Kazemnejad, S., Abdekhodaie, M. Qualified sperm selection based on the rheotaxis and thigmotaxis in a microfluidic system. Biomed Eng Lett. 13 (4), 671-680 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。