Method Article
Akut Solunum Sıkıntısı Sendromu (ARDS) için Çift Vuruşlu Bir Model Olarak Domuzlarda Bronkoalveoler Lavaj ve Oleik Asit Enjeksiyonu
Bu Makalede
Özet
Akut solunum sıkıntısı sendromunun (ARDS) patofizyolojisini incelemek için farklı, karmaşık hayvan modelleri mevcuttur. Bronkoalveoler lavaj ve oleik asit enjeksiyonunun neden olduğu akciğer hasarı, akut solunum sıkıntısı sendromunu incelemek için yeni bir çift vuruşlu hayvan modeli olarak uygundur.
Özet
ARDS'nin tedavisi, 21. yüzyılda yoğun bakım hekimleri için büyük zorluklar oluşturmaya devam etmekte ve mortalite oranları ciddi vakalarda hala %50'ye ulaşmaktadır. Bu hastalığın karmaşık patofizyolojisini daha iyi anlamak için daha fazla araştırma çabasına ihtiyaç vardır. Akut akciğer hasarını indüklemek için iyi bilinen farklı hayvan modelleri vardır, ancak hiçbiri ARDS'nin karmaşık patomekanizmalarını yeterince taklit edememiştir. Bu durumun gelişmesi için en önemli faktör alveoler kılcal ünitenin hasar görmesidir. İki iyi bilinen akciğer hasarı modelinin kombinasyonu, altta yatan patomekanizmayı daha ayrıntılı olarak taklit etmemizi sağlar. Bronkoalveoler lavaj (BAL), yüzey aktif madde tükenmesine ve alveoler kollapsa yol açar. Sıvı hacimlerinin tekrar tekrar damlatılması sonraki hipoksemiye neden olur. Yüzey aktif madde tükenmesi, insanlarda ARDS'nin önemli bir faktörüdür. BAL sıklıkla diğer akciğer hasarı yaklaşımlarıyla birleştirilir, ancak henüz oleik asit enjeksiyonu (OAI) ile ikinci bir vuruş ile birleştirilmez. Oleik asit enjeksiyonu, ciddi şekilde bozulmuş gaz değişimine, akciğer mekaniğinin bozulmasına ve alveolo-kılcal bariyerin bozulmasına yol açar. OAI, alveoler sızıntı artışı ve gaz değişim bozukluğu ile akciğer dokusunun uzamış inflamasyonundan oluşan ARDS'nin beklenen etkilerinin çoğunu taklit eder. Farklı modellerin kombinasyonunun bir dezavantajı, tek başına BAL'ın, tek başına OAI'nin veya her ikisinin birlikte neden olduğu akciğer hasarına olan etkiyi belirlemenin zorluğudur. Bu raporda sunulan model, yeni bir çift vuruşlu akciğer hasarı modeli olarak BAL ve OAI'nin kombinasyonunu temsil etmektedir. Bu yeni modelin uygulanması kolaydır ve gelecekte ARDS'de farklı terapötik yaklaşımları incelemek için bir alternatiftir.
Giriş
Akut respiratuar distres sendromu (ARDS), sıklıkla yoğun bakım tedavisi gerektiren, bozulmuş gaz değişimi ve akciğer infiltrasyonundan oluşan bir hastalıktır. Şiddetli ARDS'nin mortalitesi, neredeyse 50 yıllık kapsamlı araştırmalara rağmen dünya çapında yüksek (%50'ye kadar)kalmaktadır 1. ARDS, Berlin Tanımı ile tanımlanır ve tanı kriterleri zamanlama, göğüs görüntülemesi, ödemin kökeni ve hipoksemi2 olarak adlandırılır. Farklı ARDS şiddeti seviyelerine sahip hastaları daha iyi kategorize etmek için üç farklı hipoksemi derecesi tanımlanmıştır: hafif (200 mmHg < PaO2 / FIO2 ≤ 300 mmHg), orta (100 mmHg < PaO2 / FIO2 ≤ 200 mmHg) ve şiddetli (PaO2 / FIO2 ≤ 100 mmHg)2. ARDS3'teki patofizyolojik değişiklikleri ve farklı tedavi yaklaşımlarını incelemek için akciğer hasarına odaklanan farklı hayvan modelleri yaygın olarak kullanılmakta ve kabul edilmektedir.
Endotoksinleri kullanan hayvan modelleri (ör., sepsis kaynaklı akciğer hasarını taklit etmek için intravenöz bakteri infüzyonu, çekal ligasyon ve ponksiyon), iskemi / reperfüzyon modelleri, duman / yanık ARDS modelleri, oleik asit infüzyonu ve bronkoalveoler lavaj modelleri bilinmektedir3. Her model, çalışma sonuçlarına göre avantajları ve dezavantajları olan sadece birkaç patofizyolojik değişikliği temsil eder3. Bu, ARDS hastalığının karmaşıklığını yansıtmaz. Kanıtlanmış iki modelin kombinasyonu, ARDS'nin patofizyolojisi hakkında daha iyi sonuçlara varılmasını sağlar. Sunulan modelde, insan ARDS'nin karmaşıklığını taklit etmek için bronkoalveoler lavaj ve oleik asit infüzyonunu birleştirdik. Oleik asit doymamış bir yağ asididir ve doğuştan gelen bağışıklık reseptörlerinin aktivasyonunu tetikleyerek doğrudan akciğerlerin alveolo-kılcal ünitesine etki eder ve ardından nötrofil birikimine, proinflamatuar sitokin üretimine ve hücre ölümüne neden olur 4,5. Oleik asit infüzyonu ciddi hipoksemiye, pulmoner arter basıncında artışa ve ekstravasküler akciğer suyu birikimine neden olur. Sıklıkla sağ ventrikül yetmezliğine bağlı hipotansiyon ve miyokard depresyonu görülür. Dengeli elektrolit çözeltisi ile tekrarlanan bronkoalveoler lavaj (BAL) ile akciğer hasarının indüksiyonu, alveoler yüzey aktif madde lipid konsantrasyonunuazaltır 3. Yüzey aktif maddeler alveolar yüzey gerilimini azaltır ve alveolar kollapsı önler. BAL ani hipoksemiye ve alveolar-arteriyel oksijen farkının artmasına neden olur3. İnsan ARDS'si ayrıca yüzey aktif madde3'ün tükenmesi ile de ilişkilidir. Bu kombine modelin dezavantajları santral venöz giriş, entübasyon ve genel anestezi gerekliliğidir. Ayrıca, translasyonel yönler için şüpheli mekanik alaka düzeyi (örneğin, oleik asit infüzyonu) belirsizliğini korumaktadır. En azından, akciğer hasarının hangi kısmının (BAL ve OAI veya her ikisi birlikte) akciğer hasarına katkıda bulunduğunu belirlemek zordur. Bu modelin avantajları, insan hastalara benzer tanıdık izleme ve enstrümantasyona sahip büyük hayvanlarda kullanılabilirliği (özel ekipman gerekmez), ARDS'nin ana yönlerinin iyi bir şekilde çoğaltılması ve sistemik inflamasyon olmadan izole ARDS'yi inceleme olasılığıdır (ör., endotoksin modelleri). Aşağıdaki makalede, domuzlarda çift vuruşlu (BAL ve OAI) akciğer hasarının ayrıntılı bir tanımını veriyoruz ve akciğer fonksiyonundaki uzlaşmaların stabilitesini karakterize etmek için temsili veriler sağlıyoruz.
Protokol
Burada açıklanan tüm hayvan deneyleri, kurumsal ve devlet hayvan bakım komitesi (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Almanya; onay numarası G18-1-044) tarafından onaylanmıştır ve Avrupa ve Alman Laboratuvar Hayvanları Bilimleri Derneği'nin yönergelerine uygun olarak yürütülmüştür.
1. Anestezi, entübasyon ve mekanik ventilasyon
- Aspirasyon riskini azaltmak için anesteziden 6 saat önce yiyecekleri alıkoyun, ancak stresi azaltmak için suya serbest erişime izin verin.
- Hayvan hayvan kutusundayken sedasyon için kas içine ketamin (4 mg-kg-1) ve azaperon (8 mg-kg-1) kombinasyonunu enjekte edin.
- Alkol ile lokal dezenfeksiyondan sonra kulak damarında ortak bir periferik venöz kateter (20 G) ile venöz bir hat oluşturun.
- Sensörü hayvanın kulaklarından birine veya kuyruğuna takarak periferik oksijen doygunluğunu (SpO2) izlemeye başlayın.
- Anestezi indüksiyonu için fentanil (4 μg-kg-1), propofol (3 mg-kg-1) ve atrakuryum (0.5 mg-kg-1) enjekte edin.
- Domuzu sedye üzerine sırtüstü pozisyonda yerleştirin.
- Dokuzu, tepe solunum basıncı 20cmH2O'nun altında, PEEP'i 5cmH2O, frekansı 14-16 /dk ve FiO2'si 1.0 olan hayvanlar için uygun bir maske ile havalandırın.
- Anesteziyi sürdürmek için dengeli elektrolit çözeltisi (5 mL∙kg-1∙h-1), propofol (8-12 mg∙kg-1∙h-1) ve fentanil (0.1-0.2 mg∙kg-1∙h-1) ile sürekli bir infüzyon başlatın.
- Entübasyon için, endotrakeal tüp introdüseri ile donanmış hayvana uygun ortak bir endotrakeal tüp (örneğin, 25-30 kg ağırlık, endotrakeal tüp ID 6-7) ve Macintosh Blade 4 ile ortak bir laringoskop kullanın. İki kişi gereklidir.
- Kişi 1: Bir elinizle dili dışarı çekin ve diğer elinizle burnu aşağı doğru bastırın.
- Kişi 2: Laringoskopu yerleştirin ve epiglot görüntülenene kadar her zamanki gibi ilerletin.
- Ses tellerini görselleştirmek için laringoskopu yukarı doğru çekin. Bazen epiglot yumuşak data "yapışır". Eğer öyleyse, tüpün ucuyla harekete geçirin.
- Tüpü ses tellerinden geçirin ve introdüseri dışarı çekin.
- Tüpün balonunu bloke edin.
- Tüpü ventilatöre bağlayın ve kapnografi ve oskültasyon ile doğru konumlandırmayı kontrol edin.
- Mekanik ventilasyonu başlatın (tidal hacim 6-8 mL/kg, PEEP 5 cmH2O, FiO2 0.4, etCO2'yi 35 – 45 mmHg arasında tutma frekansı).
2. Enstrümantasyon
- Gerekli damarları kateterize etmek için arka bacakları bandajlarla geri çekin. Pulmoner arter kateterinin yerleştirilmesi için bir arteriyel hat, bir arteriyel introdüser kılıf, bir merkezi venöz hat ve bir venöz introdüser kılıf gereklidir.
- Femoral bölgeyi alkollü dezenfeksiyon ile cömertçe dezenfekte edin. Planlanan muayenelere bağlı olarak, az ya da çok aseptik bir yaklaşım kullanılır.
- Kateterleri tuzlu su ile yıkayarak hazırlayın.
- Ultrason probunu kasık bağı üzerine yerleştirin ve femoral damarları tarayın.
- Uzun eksende femoral arteri tam olarak görselleştirmek için probu 90° çevirin. Gerekirse, farklı durumlarda femoral arteri tam olarak görselleştirmek için kısa eksen görünümünü kullanmak da mümkündür.
- Seldinger'in tekniğinde ayarlanan introdüser iğnesi ile in-line ultrason görselleştirmesi altında femoral arteri kanüle edin. Titreşimli parlak kan dışarı akarken, kılavuz teli yerleştirin ve iğneyi geri çekin.
- Femoral veni görselleştirin ve in-line ultrason görselleştirme ve introdüser setinin iğnesi ile sürekli aspirasyon altında veni kanüle edin. Venöz kan aspire edilebilir olduğunda, şırıngayı ayırın ve kılavuz teli yerleştirin. İğneyi geri çekin.
- Ultrason ile tellerin konumunu kontrol edin.
- Arteriyel ve venöz hattı yerleştirilen kılavuz tellerin üzerine yerleştirin.
- Diğer tarafta arteriyel ve venöz noktalama işaretlerini tekrarlayın ve yukarıda açıklandığı gibi Seldinger tekniğine göre giriş kılıflarını yerleştirin.
- Arteriyel hattı ve venöz hattı her biri bir dönüştürücüye bağlayın.
- Her iki dönüştürücüyü de kalp hizasına yerleştirin ve sistemi sıfıra kalibre etmek için her iki dönüştürücünün üç musluklarını atmosfere açık hale getirin.
NOT: Makul değerler oluşturmak için sistemde herhangi bir hava kabarcığı ve kan lekesinden kaçınmak gerekir. - Propofol ve fentanil infüzyonunu merkezi venöz hattın portlarından birine geçirin.
- Probu ultra hızlı pO2 ölçümleri için kalibre edin ve arteriyel giriş kılıfından geçirin.
NOT: Ultra hızlı pO2 ölçümü için prob ile pO2 ölçümü zorunlu değildir, ancak pO2'deki gerçek zamanlı değişikliklerin görselleştirilmesine yardımcı olur.
3. Pulmoner arter kateterinin yerleştirilmesi
- Pulmoner arter kateterinin (PAC) balonunda hasar olup olmadığını kontrol edin.
- Dönüştürücüye bağlayın ve kalibre edin.
- PAC'yi giriş kılıfından geçirin (balon sönmüş).
- PAC giriş kılıfından (15-20 cm) geçtiğinde balonu şişirin.
- PAC'yi ilerletin ve tipik dalga formlarını izleyin (venöz damarlar, sağ atriyum, sağ ventrikül, pulmoner arter, pulmoner kapiller kama basıncı). Balonu söndürün ve PAC'nin tüm portlarından kan aspire edilip edilemeyeceğini kontrol edin.
4. Akciğer hasarının indüksiyonu: ilk olarak bronkoalveoler lavaj tarafından vuruldu
- 40 ° C'ye ısıtılmış steril dengeli elektrolit çözeltisi (örneğin, Sterofundin) hazırlayın.
NOT: Akciğer kirliliğini önlemek için steril dengeli elektrolit çözeltisi kullanılır. - Bronkoalveoler lavajı gerçekleştirmeden önce FiO2'yi 10 dakika boyunca 0,4'ten 1,0'a değiştirin.
- Ultra hızlı pO2 ölçümünü başlatın.
- Sürekli infüzyon ve bolus enjeksiyonu için norepinefrin hazırlayın (ortalama arteriyel basınç 60 mmHg< ise). Norepinefrin şırınga pompasını çalıştırmadan santral venöz kateterin portlarından birine bağlayın.
- Isıtılmış steril dengeli elektrolit çözeltisinden 30 mL∙kg-1'i bir huniye doldurun. Huninin endotrakeal tüpe bağlanabildiğini kontrol edin.
- Ventilatörden gelen inspirasyonda PEEP kaybı olmadan tüpü ayırın.
- Huniyi endotrakeal tüpe bağlayın.
- Huniyi hayvanın 1 m üzerine manuel olarak kaldırın.
- Kapağı açın ve ısıtılmış dengeli elektrolit çözeltisinin tamamını huniden hidrostatik basıncı kullanarak 30 saniye boyunca endotrakeal tüpe damlatın.
- 30 saniye sonra, huniyi hayvanın 1 metre altına indirerek demlenmiş çözeltiyi çıkarın ve lavaj sıvısını pasif olarak boşaltın. Oksijenasyon için hayvanı ventilatöre yeniden bağlayın.
- Çıkarılan lavaj sıvısını toplayın ve miktarı not edin. Alveolar sıvı klerensini hesaplamak için gereklidir.
NOT: Yüzey aktif maddenin yıkanmasını en üst düzeye çıkarmak için bir lavajdan sonra dengeli elektrolit çözeltisini tekrar kullanmayın. - Emme kateterleri kullanarak tüpteki çözeltinin geri kalanını aspire edin.
- Bronkoalveoler lavajdan sonra hemodinamiği yakından izleyin ve norepinefrini elinizin altında bulundurun. Gerekirse, kan basıncını stabilize etmek için bolus veya sürekli infüzyon olarak norepinefrin verin (adım 4.4 ile karşılaştırın).
- PaO2 / FiO2 oranı 250 mmHg'nin altına düşene kadar 4.5-4.13 adımlarında tarif edildiği gibi 30 mL∙kg-1 dengeli elektrolit çözeltisinin infüzyonunu tekrarlayın. Bronkoalveoler lavajın dört ila beş tekrarı gerekli olabilir.
- PaO2 / FiO2 oranı 250 mmHg'den düşükse, oleik asit enjeksiyonu ile akciğer hasarının indüksiyonu ile başlayın. Bu prosedür sırasında ventilatör ayarlarını değiştirmeyin.
5. Akciğer hasarının indüksiyonu: oleik asit enjeksiyonu ile ikinci vuruş
- Oleik asit çözeltisi hazırlayın: 20 mL'lik bir şırıngada 0.1 mL∙kg-1 oleik asit ve 3 bir musluka bağlayın. Başka bir 20 mL şırıngada 2 mL kan alın. Her iki şırıngada toplam 20 mL'lik bir hacme salin ekleyin ve ikinci şırıngayı da 3 musluka bağlayın.
DİKKAT: Oleik asitle çalışırken eldiven ve göz koruması kullanın. - Sürekli infüzyon ve bolus enjeksiyonu için norepinefrin hazırlayın (ortalama arteriyel basınç 60 mmHg< ise). Norepinefrin şırınga pompasını çalıştırmadan santral venöz kateterin portlarından birine bağlayın.
- Hala ölçülmekte olan ultra hızlı pO2 ölçümünü izlemeye devam edin. FiO2 hala 1.0.
- 3 musluğu PAC'nin proksimal bağlantı noktasına bağlayın.
- Oleik asit ve kan / salin karışımını, çözeltiyi bir şırıngadan diğer şırıngaya tekrar tekrar kaydırarak ve bunun tersini üç musluk aracılığıyla iyice karıştırın ve her zaman karıştırmaya devam edin. Homojen bir emülsiyon olduğunda, 2 mL emülsiyonu enjekte edin ve karıştırmaya devam edin.
NOT: Karıştırma durursa, emülsiyon bir lipofilik ve bir hidrofilik kısma ayrılabilir. - Oleik asit enjeksiyonundan sonra hemodinamiği yakından izleyin ve norepinefrini elinizin altında bulundurun. Gerekirse, kan basıncını stabilize etmek için bolus veya sürekli infüzyon olarak norepinefrin verin (adım 5.2 ile karşılaştırın).
NOT: Uyanık olun; Bu işlem sırasında hayvanlar ölebilir. - PaO2 / FiO2 oranı 150 mmHg'nin altına düşene kadar her 3 dakikada bir 2 mL çözelti enjeksiyonunu tekrarlayın.
- PaO2 / FiO2 oranı 100 ila 200 mmHg arasında olmadan şırınga boşsa, adım 5.1'de açıklandığı gibi 2 şırınga daha hazırlayın. PaO2/FiO2 oranı 100 ila 200 mmHg arasına düşene kadar 5.5-5.8 adımlarını tekrarlayın.
NOT: Oleik asidin yarım ila tam şırıngası ve kan / salin karışımı genellikle gereklidir. - PaO2/FiO2 oranı 100 ila 200 mmHg arasındaysa, 30 dakika bekleyin ve tekrar kontrol edin. Sürekli olarak 200 mmHg'nin altındaysa, deney / tedaviye başlayın; Aksi takdirde, adım 5.1'de açıklandığı gibi 2 şırınga daha hazırlayın ve 5.5-5.9 adımlarını tekrarlayın.
NOT: Tarif edildiği gibi akciğer hasarının indüksiyonundan sonra, akciğer fonksiyonundaki bozulma sabit kalabilir veya bozulabilir ve hatta belirli sınırlar içinde iyileşebilir.
6. Deneyin sonu ve ötenazi
- Sürekli anesteziye ek olarak 0.5 mg fentanil enjekte edin ve 5 dakika bekleyin. Derin anestezide hayvanı öldürmek için 200 mg propofol ve 40 mmol potasyum klorür enjekte edin.
Sonuçlar
PaO2 / FiO2 oranı, bronkoalveoler lavaj ve fraksiyone oleik asit uygulamasından sonra azalır (Şekil 1). Bronkoalveoler lavajın etkisini tahmin etmek belirsiz olduğundan (ör., fraksiyone oleik asit dozunun etkisi) PaO2 / FiO2 oranı üzerinde, akciğer hasarını indüklerken PaO2 / FiO2 oranının izlenmesi önerilir. Ultra hızlı pO2 ölçümü, PaO2'nin gerçek zamanlı olarak izlenmesine olanak tanır ve iyi kurulmuştur6. Çift vuruştan sonra, PaO2 / FiO2 oranı, 5 cm H2O'luk bir PEEP'te 30 dakika boyunca 100 ila 200 mmHg arasında kalmalıdır. 200 mmHg'nin üzerindeyse, deney süresince hayvanın kendiliğinden iyileşmesini önlemek için yukarıda açıklandığı gibi 5.8 ve 5.9 adımlarını tekrarlayın. Eşzamanlı olarak, akciğer hasarının indüksiyonu sırasında ortalama pulmoner arteriyel basınç (mPAP) artar ve tüm deney boyunca daha yüksek kalır (Şekil 2). Bu akut pulmoner hipertansiyon, ani hemodinamik dekompansansasyona ve hayvanın ölümüne yol açabilir. Bu olayları önlemek için, hemodinamik yakından ölçülmeli ve sapmalar hemen katekolaminlerle (ör., norepinefrin) tedavi edilmelidir. Akciğerin fonksiyonel rezidüel kapasitesi (FRC), akciğer hasarının indüksiyonundan sonra da düşer ve deneyin geri kalanında daha düşük kalır (Şekil 3). Akciğer hasarı da histolojik olarak (Şekil 4) hayvanın ölümünden sonra çıkarılan akciğerlerde saptanabilir.
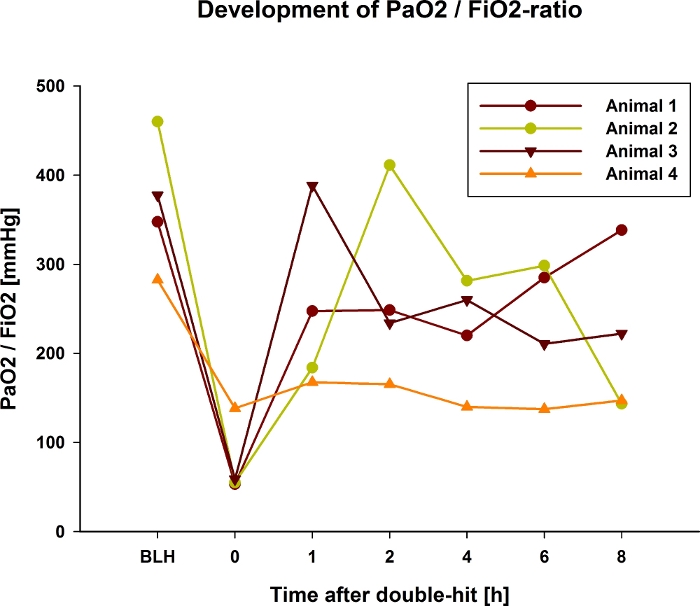
Şekil 1: 4 örnek domuzda çift vuruşlu akciğer hasarından sonraki 8 saat boyunca PaO2/FiO2-Oranının gelişimi.
4 hayvanın hepsinde ilk azalmayı ve küçük dalgalanmalarla stabil değerleri gösteren temsili grafikler (hayvan 4). Daha sonra, 2 hayvanda (hayvan 2 ve 3) ilk artış ve ardından bir azalma tespit edildi. Bir hayvanda (hayvan 4) indüksiyondan sonra sürekli olarak daha düşük değerler kaldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: 4 örnek domuzda çift vuruşlu akciğer hasarından sonraki 8 saat içinde mPAP (= ortalama pulmoner arteriyel basınç) gelişimi.
4 hayvanın hepsinde ilk artışı gösteren temsili araziler. İki hayvanda (hayvan 3 ve 4) mPAP 6 saat boyunca düştü ve son olarak yükseldi, diğer iki hayvanda (hayvan 1 ve 2) mPAP sürekli düştü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: 4 örnek domuzda çift vuruşlu akciğer hasarından sonraki 8 saat içinde FRC gelişimi.
4 hayvanın hepsinde ilk düşüşü gösteren temsili grafikler. Daha sonra sadece bir hayvan (hayvan 4) daha düşük değerlerde sabit kaldı, diğer hayvanlar kısa bir süre sonra yükseldi ve deney boyunca eşit bir şekilde düştü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Çift vuruşlu akciğer hasarı sonrası akciğer hasarının histolojik görüntüleri.
Akciğerler parafin kesiti ve hematoksilen/eozin boyaması için formalin ile fikse edildi. Görüntü büyütme 10x. (A) Lenfositik infiltrasyon (kırmızı ok) ve atelektazi (siyah ok). (B) Aşırı şişkinlik (kırmızı ok) ve alveolar hasar (siyah ok). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Domuzlarda ciddi bir akciğer hasarına neden olmak için tarif edilen çift vuruş yöntemi, ARDS'de farklı tedavi seçeneklerini incelemek için uygundur. Çift vuruşlu model, ARDS'nin patomekanizmasının iki merkezi unsurunu taklit eder: alveolar-kılcal birimin kaybı ve endotel bariyerininbozulması 7. İki isabet nedeniyle, önceden tanımlanmış hedef değerlere sahip bir çalışma protokolüne sahip olmak önemlidir (örneğin, PaO2 / FiO2 oranı).
Bu çift vuruşlu yöntemin ana dezavantajı, akciğer hasarının dengeli elektrolit çözeltisi lavajı, oleik asit infüzyonu veya her ikisinden ne ölçüde kaynaklandığını belirlemenin zorluğudur. Bu, tarif edildiği gibi diğer kombine akciğer hasarı modellerinde yaygın bir sorundur (örneğin, bir lavaj ve mekanik ventilasyon-isabet yöntemi3 için). Ayrıca, oleik asit yöntemi ilk olarak yağ / lipid embolisinin neden olduğu akut akciğer hasarının mekanizmasını araştırmak için tanımlanmıştır8. Oleik asit suda çözünmez ve kanda sürekli olarak emülsifiye edilmelidir. Tekrarlanan oleik asit dozlarının enjeksiyonundan sonra, miyokard depresyonu, sistemik hipotansiyon ve pulmoner hipertansiyon gibi ciddi hemodinamik değişiklikler hemen ortaya çıkabilir ve sağ ventrikül yetmezliğiile sonuçlanabilir 3,6,9. Sağ ventrikül yetmezliği hayvanın ani ölümüne neden olabilir. Çalışma sırasında, açıklanan etkiler nedeniyle iki hayvan kaybedildi. Isıtılmış dengeli elektrolit çözeltisinin damlatılmasıyla yüzey aktif madde tükenmesi ilk olarak Lachmann10 tarafından geliştirilmiştir. İnsan ARDS'si genellikle alveoller3'ten yüzey aktif maddenin tükenmesi ile ilişkilidir. Hayvan modellerinde, dengeli elektrolit çözeltisinin tekrarlanan damlatmaları yapılmalıdır. İlk başta, hipoksemiye çok hızlı bir şekilde ulaşılır, ancak mekanik ventilasyon altında hızla geri dönüşümlüdür3. Geçirgenlik ve iltihaplanma, dengeli elektrolit çözeltisi3 tarafından önemli ölçüde etkilenmez ve tetiklenmez. Enflamatuar değişiklikler (ör., nötrofilik alveolit) yaklaşık 4 saat sonra ortaya çıkar. Dengeli elektrolit çözeltisi kullanmanın en büyük dezavantajı, hayvanların entübasyon, mekanik ventilasyon ve genel anestezi gerektirmesidir3.
Genel olarak, domuzlarda her iki yöntemi kullanırken ve birleştirirken bazı önemli avantajlar da vardır. Oleik asit infüzyonunun neden olduğu akciğer hasarı iyi bilinmektedir ve 3,6'dan önce ayrıntılı olarak tanımlanmıştır. Kamuf ve ark. küçük ve büyük hayvanlarda tekrarlanabilir sonuçlar bildirmiş ve bu nedenle ARDS6'yı incelemek için uygun bir model sunmuştur. Oleik asit, endotel hücreleri için doğrudan toksiktir3. Endotel yaralanmasını artmış pulmoner mikrovasküler geçirgenlik ve intrapulmoner şant3 takip eder. Gaz değişiminde ciddi sorunlar ortaya çıkabilir3. Oleik asit infüzyonu sadece ARDS'nin erken fazını taklit etmekle kalmaz, aynı zamanda alveolar yüzeyde fibrin birikimi ile daha sonraki patofizyolojik değişiklikleri de yeniden üretir. Bronkoalveoler lavaj, akciğer hasarını indüklemek için yaygın bir modeldir ve iyi bilinmektedir11. İnsan ARDS'deki histopatolojik bulgular (ör., atelektazi ve perivasküler ödem) tekrarlanan lavajlardan kaynaklanabilir11. Oleik asit infüzyonu derin alveoler nekroz, tıkanıklık ve ödem oluşumuna yol açarken, bronkoalveoler lavaj daha fazla barotravma, atelektazi ve kanamaya neden olur9.
Bu çift vuruşlu model ile ARDS'de farklı ventilasyon stratejileri, spesifik terapötik yaklaşımlar ve pulmoner değişikliklerin ve akciğer fonksiyonunun araştırılması araştırılabilir. Bu iki yöntemin birleştirilmesi, insan ARDS sırasında meydana gelen patofizyolojik değişiklikleri daha yakından taklit eden bir ARDS modeli ile sonuçlanır. Domuzların enstrümantasyonu ve genişletilmiş izlenmesi, büyük hayvanlarda daha kolaydır ve yoğun bakım ünitesindeki başucu ayarına daha çok benzer. Özetle, bu model yüksek oranda tekrarlanabilir ve ARDS tedavisi için farklı terapötik yaklaşımları daha gerçekçi bir ortamda araştırmak için daha fazla araştırmaya izin verir.
Açıklamalar
Tüm yazarlar hiçbir finansal veya başka bir çıkar çatışması açıklamaz.
Teşekkürler
Yazarlar, mükemmel teknik destek için Dagmar Dirvonskis'e teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 M Kaliumchlorid-Lösung 7.46% 20 mL | Fresenius, Kabi Deutschland GmbH | potassium chloride | |
| Absaugkatheter Ideal CH14, 52 cm, gerade | B. Braun Melsungen AG, Germany | suction catheter | |
| Arterenol 1 mg/mL, 25 mL | Sanofi- Aventis, Seutschland GmbH | norepinephrine | |
| Atracurium Hikma, 50 mg/5 mL | Hikma Pharma GmbH , Martinsried | atracurium | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | canula | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland GmbH | perfusorline | |
| Ketamin-Hameln 50 mg/mL | Hameln Pharmaceuticals GmbH | ketamine | |
| laryngoscope | Rüsch | laryngoscope | |
| logicath 7 Fr 3-lumen 30 cm lang | Smith- Medical Deutschland GmbH | central venous catheter | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Neofox Oxygen sensor 300 micron fiber | Ocean optics Largo, FL USA | ultrafast pO2-measurements | |
| Ölsäure reinst Ph. Eur NF C18H34O2 M0282.47g/mol, Dichte 0.9 | Applichem GmbH Darmstadt, Deutschland | oleic acid | |
| Original Perfusor syringe 50 mL Luer Lock | B.Braun Melsungen AG, Germany | perfusorsyringe | |
| PA-Katheter Swan Ganz 7.5 Fr, 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | PAC | |
| PE-Trichter, 60 mm | Aquintos-Wasseraufbereitung GmbH, Germany | funnel | |
| Percutaneous sheath introducer set 8.5 und 9 Fr, 10 cm with integral haemostasis valve/sideport | Arrow international inc. Reading, PA, USA | introducer sheath | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL Flaschen) | Fresenius, Kabi Deutschland GmbH | propofol | |
| Radifocus Introducer II, Größe 5-8 Fr | Terumo Corporation Tokio, Japan | introducer sheath | |
| Rüschelit Super Safety Clear 6.5 /7.0 | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Seldinger Nadel mit Fixierflügel | Smith- Medical Deutschland GmbH | seldinger canula | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welsch Allyn69604 | blade for laryngoscope | |
| Sterofundin Infusion | B. Braun Melsungen AG, Germany | bronchoalveolar lavage | |
| Stresnil 40 mg/mL | Lilly Deutschland GmbH, Abteilung Elanco Animal Health | azaperon | |
| Vasofix Safety 22 G | B.Braun Melsungen AG, Germany | venous catheter |
Referanslar
- Rubenfeld, G. D., et al. Incidence and Outcomes of Acute Lung Injury. New England Journal of Medicine. 353 (16), 1685-1693 (2005).
- The ARDS Definition Task Force. Acute Respiratory Distress Syndrome, The Berlin Definition. Journal of the American Medical Association. 307 (23), 2526-2533 (2012).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Goncalves-de-Albuquerque, C. F., Silva, A. R., Burth, P., Castro-Faria, M. V., Castro-Faria-Neto, H. C. Acute Respiratory Distress Syndrome: Role of Oleic Acid-Triggered Lung Injury and Inflammation. Mediators of Inflammation. 2015, 260465(2015).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Kamuf, J., et al. Oleic Acid-Injection in Pigs As a Model for Acute Respiratory Distress Syndrome. Journal of Visualized Experiments. (140), e57783(2018).
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. New England Journal of Medicine. 342 (18), 1334-1349 (2000).
- Schuster, D. P. ARDS: clinical lessons from the oleic acid model of acute lung injury. American Journal of Respiratory and Critical Care Medicine. 149 (1), 245-260 (1994).
- Wang, H. M., Bodenstein, M., Markstaller, K. Overview of the pathology of three widely used animal models of acute lung injury. European Surgical Research. 40 (4), 305-316 (2008).
- Lachmann, B., Robertson, B., Vogel, J. In vivo lung lavage as an experimental model of the respiratory distress syndrome. Acta Anaesthesiologica Scandinavica. 24 (3), 231-236 (1980).
- Russ, M., et al. Lavage-induced Surfactant Depletion in Pigs as a Model of the Acute Respiratory Distress Syndrome (ARDS). Journal of Visualized Experiments. (115), e53610(2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır