Method Article
Lavagem broncoalveolar e injeção de ácido oleico em suínos como modelo de duplo acerto para síndrome do desconforto respiratório agudo (SDRA)
Neste Artigo
Resumo
Existem modelos animais diferentes e complexos para estudar a fisiopatologia da síndrome do desconforto respiratório agudo (SDRA). A lavagem broncoalveolar e a lesão pulmonar induzida por injeção de ácido oleico são adequadas como um novo modelo animal de duplo golpe para estudar a síndrome do desconforto respiratório agudo.
Resumo
O tratamento da SDRA continua a representar grandes desafios para os médicos intensistas no século 21, com taxas de mortalidade ainda chegando a 50% em casos graves. Mais esforços de pesquisa são necessários para entender melhor a complexa fisiopatologia desta doença. Existem diferentes modelos animais bem estabelecidos para induzir lesão pulmonar aguda, mas nenhum foi capaz de mimetizar adequadamente os complexos mecanismos patológicos da SDRA. O fator mais crucial para o desenvolvimento dessa condição é o dano à unidade capilar alveolar. A combinação de dois modelos de lesão pulmonar bem estabelecidos nos permite mimetizar com mais detalhes o mecanismo patológico subjacente. A lavagem broncoalveolar (LBA) leva à depleção do surfactante, bem como ao colapso alveolar. A instilação repetida de volumes de fluido causa hipoxemia subsequente. A depleção de surfactante é um fator chave da SDRA em humanos. A LBA é frequentemente combinada com outras abordagens de lesão pulmonar, mas ainda não com um segundo golpe seguido de injeção de ácido oleico (OAI). A injeção de ácido oleico leva a trocas gasosas gravemente prejudicadas, deterioração da mecânica pulmonar e ruptura da barreira alvéolo-capilar. A OAI imita a maioria dos efeitos esperados da SDRA, consistindo em inflamação prolongada do tecido pulmonar com aumento do vazamento alveolar e comprometimento das trocas gasosas. Uma desvantagem da combinação de diferentes modelos é a dificuldade de determinar a influência na lesão pulmonar causada apenas pelo LBA, OAI isolado ou ambos juntos. O modelo apresentado neste relatório representa a combinação de LBA e OAI como um novo modelo de lesão pulmonar de duplo impacto. Este novo modelo é fácil de implementar e uma alternativa para estudar diferentes abordagens terapêuticas na SDRA no futuro.
Introdução
A síndrome do desconforto respiratório agudo (SDRA) é uma doença que consiste em troca gasosa prejudicada e infiltração pulmonar, que muitas vezes necessita de terapia intensiva. A mortalidade da SDRA grave permanece alta (até 50%) em todo o mundo, apesar de quase 50 anos de extensa pesquisa1. A SDRA é definida pela Definição de Berlim, incluindo critérios diagnósticos como tempo, imagem do tórax, origem do edema e hipoxemia2. Para melhor categorizar os pacientes com diferentes níveis de gravidade da SDRA, são definidos três diferentes graus de hipoxemia: leve (200 mmHg < PaO2/FIO2 ≤ 300 mmHg), moderada (100 mmHg < PaO2/FIO2 ≤ 200 mmHg) e grave (PaO2/FIO2 ≤ 100 mmHg)2. Diferentes modelos animais com foco na lesão pulmonar são amplamente utilizados e aceitos para examinar as alterações fisiopatológicas e diferentes abordagens terapêuticas na SDRA3.
Modelos animais usando endotoxinas (por exemplo, infusão intravenosa de bactérias, ligadura cecal e punção para mimetizar uma lesão pulmonar induzida por sepse), modelos de isquemia/reperfusão, modelos de SDRA de fumaça/queimadura, infusão de ácido oleico e modelos de lavagem broncoalveolarsão conhecidos 3. Cada modelo representa apenas algumas alterações fisiopatológicas com vantagens e desvantagens para os resultados do estudo3. Isso não reflete a complexidade da doença da SDRA. A combinação de dois modelos comprovados permite melhores conclusões sobre a fisiopatologia da SDRA. No modelo apresentado, combinamos lavagem broncoalveolar e infusão de ácido oleico para mimetizar a complexidade da SDRA humana. O ácido oleico é um ácido graxo insaturado e atua diretamente na unidade alvéolo-capilar dos pulmões, desencadeando a ativação de receptores imunes inatos, causando acúmulo de neutrófilos, produção de citocinas pró-inflamatórias e morte celular 4,5. A infusão de ácido oleico induz hipoxemia grave, aumento da pressão arterial pulmonar e acúmulo de água pulmonar extravascular. Freqüentemente, ocorrem hipotensão e depressão miocárdica devido à insuficiência ventricular direita. A indução de lesão pulmonar por lavagem broncoalveolar repetida (LBA) com solução eletrolítica balanceada reduz a concentração lipídica do surfactante alveolar3. Os surfactantes diminuem a tensão superficial alveolar e evitam o colapso alveolar. O LBA causa hipoxemia imediata e aumento da diferença alvéolo-arterial de oxigênio3. A SDRA humana também está associada à depleção do surfactante3. As desvantagens desse modelo combinado são a necessidade de acesso venoso central, intubação e anestesia geral. Além disso, a relevância mecanicista questionável (por exemplo, a infusão de ácido oleico) para aspectos translacionais permanece obscura. Pelo menos, é difícil determinar qual parte da lesão pulmonar (LBA vs. OAI, ou ambas juntas) contribui para o dano pulmonar. As vantagens deste modelo são sua usabilidade em animais de grande porte com monitoramento familiar e instrumentação semelhante a pacientes humanos (sem necessidade de equipamento especial), a boa reprodução dos principais aspectos da SDRA e a possibilidade de estudar SDRA isolada sem inflamação sistêmica (por exemplo, modelos de endotoxinas). No artigo a seguir, damos uma descrição detalhada da lesão pulmonar de duplo golpe (LBA e OAI) em suínos e fornecemos dados representativos para caracterizar a estabilidade dos comprometimentos na função pulmonar.
Protocolo
Todos os experimentos com animais descritos aqui foram aprovados pelo comitê institucional e estadual de cuidados com animais (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Alemanha; número de aprovação G18-1-044) e foram conduzidos de acordo com as diretrizes da Sociedade Europeia e Alemã de Ciências de Animais de Laboratório.
1. Anestesia, intubação e ventilação mecânica
- Retenha os alimentos por 6 horas antes da anestesia para reduzir o risco de aspiração, mas permita o livre acesso à água para reduzir o estresse.
- Injete uma combinação de cetamina (4 mg∙kg-1) e azaperona (8 mg∙kg-1) por via intramuscular para sedação enquanto o animal estiver na caixa de animais.
- Estabeleça uma linha venosa com um cateter venoso periférico comum (20 G) em uma veia da orelha após a desinfecção local com álcool.
- Comece a monitorar a saturação periférica de oxigênio (SpO2) prendendo o sensor em uma das orelhas ou na cauda do animal.
- Injete fentanil (4 μg∙kg-1), propofol (3 mg∙kg-1) e atracúrio (0,5 mg∙kg-1) para indução anestésica.
- Coloque o porco em decúbito dorsal na maca.
- Ventile o porco com uma máscara adequada para animais com pico de pressão inspiratória abaixo de 20 cmH2O, PEEP de 5 cmH2O, frequência de 14-16 /min e FiO2 de 1,0.
- Inicie uma infusão contínua com solução eletrolítica balanceada (5 mL∙kg-1∙h-1), propofol (8-12 mg∙kg-1∙h-1) e fentanil (0,1-0,2 mg∙kg-1∙h-1) para manter a anestesia.
- Para a intubação, use um tubo endotraqueal comum adequado para o animal (por exemplo, peso de 25-30 kg, tubo endotraqueal ID 6-7) armado com introdutor de tubo endotraqueal e um laringoscópio comum com uma lâmina Macintosh 4. Duas pessoas são necessárias.
- Pessoa 1: Puxe a língua para fora com uma mão e pressione o focinho para baixo com a outra.
- Pessoa 2: Insira o laringoscópio e avance-o como de costume até que a epiglote possa ser visualizada.
- Puxe o laringoscópio para cima para visualizar as cordas vocais. Às vezes, a epiglote "gruda" no palatino mole. Em caso afirmativo, mobilize-o com a ponta do tubo.
- Insira o tubo através das cordas vocais e puxe o introdutor.
- Bloqueie o balão do tubo.
- Conecte o tubo ao ventilador e verifique o posicionamento correto com capnografia e ausculta.
- Inicie a ventilação mecânica (volume corrente 6-8 mL/kg, PEEP 5 cmH2O, FiO2 0,4, frequência para manter etCO2 entre 35 – 45 mmHg).
2. Instrumentação
- Retraia as patas traseiras com bandagens para cateterizar os vasos necessários. São necessários um cateter arterial, uma bainha introdutora arterial, um cateter venoso central e uma bainha introdutora venosa para a colocação do cateter de artéria pulmonar.
- Desinfete generosamente a área femoral com desinfecção alcoólica. Dependendo dos exames planejados, uma abordagem mais ou menos asséptica é usada.
- Prepare os cateteres lavando-os com solução salina.
- Coloque a sonda de ultrassom no ligamento inguinal e escaneie os vasos femorais.
- Gire a sonda 90° para visualizar totalmente a artéria femoral no eixo longo. Se necessário, também é possível, em diferentes circunstâncias, usar a visão de eixo curto para visualizar completamente a artéria femoral.
- Canular a artéria femoral sob visualização ultrassonográfica em linha com a agulha do introdutor ajustada na técnica de Seldinger. Quando o sangue brilhante pulsante fluir, introduza o fio-guia e retraia a agulha.
- Visualize a veia femoral e canule a veia sob visualização de ultrassom em linha e aspiração contínua com a agulha do conjunto introdutor. Quando o sangue venoso for aspirável, desconecte a seringa e insira o fio-guia. Retraia a agulha.
- Verifique a posição dos fios com ultrassom.
- Insira a linha arterial e venosa sobre os fios-guia colocados.
- Repita a pontuação arterial e venosa do outro lado e insira as bainhas introdutoras de acordo com a técnica de Seldinger, conforme descrito acima.
- Conecte a linha arterial e a linha venosa a um transdutor.
- Posicione ambos os transdutores no nível do coração e abra as torneiras de três vias de ambos os transdutores para a atmosfera para calibrar o sistema para zero.
NOTA: É necessário evitar bolhas de ar e manchas de sangue no sistema para gerar valores plausíveis. - Mude a infusão de propofol e fentanil para uma das portas da linha venosa central.
- Calibre a sonda para medições ultrarrápidas de pO2 e insira-a através da bainha do introdutor arterial.
NOTA: A medição de pO2 com a sonda para medição ultrarrápida de pO2 não é obrigatória, mas ajuda a visualizar as mudanças em tempo real em pO2.
3. Inserção do cateter de artéria pulmonar
- Verifique se o balão do cateter de artéria pulmonar (CAP) está danificado.
- Conecte ao transdutor e calibre-o.
- Insira o CAP através da bainha introdutora (balão desinflado).
- Quando o CAP tiver passado pela bainha introdutora (15-20 cm), encha o balão.
- Avance o CAP e monitore as formas de onda típicas (vasos venosos, átrio direito, ventrículo direito, artéria pulmonar, pressão capilar pulmonar). Esvazie o balão e verifique se o sangue pode ser aspirado por todas as portas do CAP.
4. Indução de lesão pulmonar: primeiro golpe por lavagem broncoalveolar
- Prepare uma solução eletrolítica balanceada estéril (por exemplo, esterofundina) aquecida a 40 °C.
NOTA: A solução eletrolítica balanceada estéril é usada para evitar a poluição pulmonar. - Altere o FiO2 de 0,4 para 1,0 ao longo de 10 minutos antes de realizar a lavagem broncoalveolar.
- Inicie a medição ultrarrápida pO2.
- Prepare a norepinefrina para infusão contínua e para injeção em bolus (se a pressão arterial média < 60 mmHg). Conecte a bomba de seringa de norepinefrina a uma das portas do cateter venoso central sem iniciá-la.
- Encha 30 mL∙kg-1 da solução eletrolítica balanceada estéril aquecida em um funil. Verifique se o funil pode ser conectado ao tubo endotraqueal.
- Desconecte o tubo sem perda de PEEP na inspiração do ventilador.
- Conecte o funil ao tubo endotraqueal.
- Levante o funil 1 m acima do animal manualmente.
- Abra a tampa e instile toda a quantidade da solução eletrolítica balanceada aquecida do funil no tubo endotraqueal por 30 s usando a pressão hidrostática.
- Após 30 s, remova a solução infundida abaixando o funil 1 metro abaixo do animal e drene o fluido de lavagem passivamente. Reconecte o animal ao ventilador para oxigenação.
- Colete o fluido de lavagem removido e anote a quantidade. É necessário calcular a depuração do líquido alveolar.
NOTA: Não reutilize a solução eletrolítica balanceada após uma lavagem para maximizar a lavagem do surfactante. - Aspirar os restos da solução no tubo utilizando cateteres de sucção.
- Monitore de perto a hemodinâmica após a lavagem broncoalveolar e mantenha a norepinefrina à mão. Se necessário, administre norepinefrina em bolus ou infusão contínua para estabilizar a pressão arterial (compare com a etapa 4.4).
- Repita a infusão de 30 mL∙kg-1 de solução eletrolítica balanceada conforme descrito nas etapas 4.5-4.13 até que a relação PaO2/FiO2 esteja abaixo de 250 mmHg. Podem ser necessárias quatro a cinco repetições da lavagem broncoalveolar.
- Se a relação PaO2/FiO2 for inferior a 250 mmHg, comece com a indução de lesão pulmonar por injeção de ácido oleico. Não altere as configurações do ventilador durante este procedimento.
5. Indução de lesão pulmonar: segundo golpe por injeção de ácido oleico
- Prepare a solução de ácido oleico: 0,1 mL∙kg-1 de ácido oleico em uma seringa de 20 mL e conecte-a a uma torneira de 3 vias. Tome 2 mL de sangue em outra seringa de 20 mL. Adicione solução salina a um volume total de 20 mL em ambas as seringas e conecte a segunda seringa também à torneira de 3 vias.
CUIDADO: Use luvas e proteção para os olhos ao trabalhar com ácido oleico. - Prepare a norepinefrina para infusão contínua e para injeção em bolus (se a pressão arterial média < 60 mmHg). Conecte a bomba de seringa de norepinefrina a uma das portas do cateter venoso central sem iniciá-la.
- Continue monitorando a medição ultrarrápida de pO2 que ainda está medindo. FiO2 ainda é 1.0.
- Conecte a torneira de 3 vias à porta proximal do PAC.
- Misturar bem o ácido oleico e a mistura sangue/solução salina deslocando repetidamente a solução de uma seringa para a outra seringa e vice-versa através da torneira de três vias e continuar a misturar sempre. Quando for uma emulsão homogênea, injete 2 mL da emulsão e continue misturando.
NOTA: Se a mistura parar, a emulsão pode se separar em uma parte lipofílica e uma hidrofílica. - Monitore de perto a hemodinâmica após a injeção de ácido oleico e mantenha a norepinefrina à mão. Se necessário, administre norepinefrina em bolus ou infusão contínua para estabilizar a pressão arterial (compare com o passo 5.2).
NOTA: Esteja vigilante; Os animais podem morrer durante este procedimento. - Repita a injeção de 2 mL da solução a cada 3 minutos até que a relação PaO2/FiO2 esteja abaixo de 150 mmHg.
- Se a seringa estiver vazia antes de a relação PaO2/FiO2 estar entre 100 e 200 mmHg, prepare mais 2 seringas conforme descrito no passo 5.1. Repita as etapas 5.5-5.8 até que a relação PaO2/FiO2 caia entre 100 e 200 mmHg.
NOTA: Geralmente é necessária uma seringa meio cheia de ácido oleico e a mistura sangue/solução salina. - Se a relação PaO2/FiO2 estiver entre 100 e 200 mmHg, aguarde 30 min e verifique novamente. Se estiver consistentemente abaixo de 200 mmHg, inicie o experimento/tratamento; caso contrário, prepare mais 2 seringas conforme descrito na etapa 5.1 e repita as etapas 5.5-5.9.
NOTA: Após a indução da lesão pulmonar conforme descrito, o comprometimento da função pulmonar pode permanecer estável ou deteriorar-se ou até melhorar dentro de certos limites.
6. Fim do experimento e eutanásia
- Injete 0,5 mg de fentanil adicionalmente à anestesia contínua e aguarde 5 min. Injete 200 mg de propofol e 40 mmol de cloreto de potássio para matar o animal em anestesia profunda.
Resultados
A relação PaO2/FiO2 diminui após lavagem broncoalveolar e aplicação fracionada de ácido oleico (Figura 1). Como não é claro prever o impacto da lavagem broncoalveolar (por exemplo, o impacto da dose fracionada de ácido oleico) na relação PaO2/FiO2, recomenda-se monitorar a relação PaO2/FiO2 durante a indução da lesão pulmonar. A medição ultrarrápida de pO2 permite monitorar a PaO2 em tempo real e está bem estabelecida6. Após o golpe duplo, a relação PaO2/FiO2 deve persistir entre 100 e 200 mmHg por 30 min a uma PEEP de 5 cm H2O. Se for superior a 200 mmHg, repetir os passos 5.8 e 5.9 acima descritos para evitar a recuperação espontânea do animal durante o decurso da experiência. Simultaneamente, a pressão arterial pulmonar média (PAPm) aumenta durante a indução da lesão pulmonar e permanece mais elevada durante todo o experimento (Figura 2). Essa hipertensão pulmonar aguda pode levar à descompensação hemodinâmica súbita e à morte do animal. Para evitar esses eventos, a hemodinâmica deve ser medida rigorosamente e os desvios tratados imediatamente com catecolaminas (por exemplo, norepinefrina). A capacidade residual funcional (CRF) do pulmão também cai após a indução da lesão pulmonar e permanece menor durante o restante do experimento (Figura 3). A lesão pulmonar também é detectável histologicamente (Figura 4) em pulmões retirados após a morte do animal.
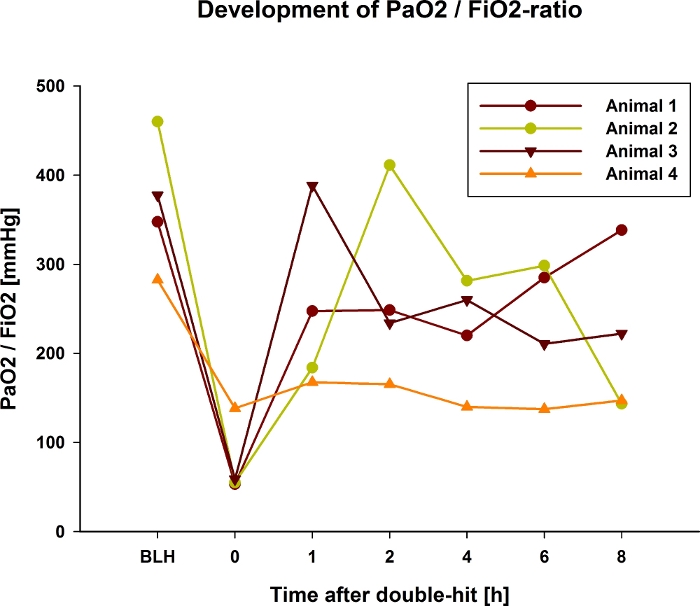
Figura 1: Desenvolvimento da relação PaO2 / FiO2 durante 8 horas após lesão pulmonar dupla em 4 porcos exemplares.
Gráficos representativos mostrando uma diminuição inicial em todos os 4 animais e valores estáveis com poucas flutuações (animal 4). Posteriormente, um aumento inicial seguido de uma diminuição foi detectável em 2 animais (animal 2 e 3). Valores continuamente mais baixos permaneceram após a indução em um animal (animal 4). Clique aqui para ver uma versão maior desta figura.

Figura 2: Desenvolvimento de mPAP (= pressão arterial pulmonar média) durante 8 h após lesão pulmonar dupla em 4 suínos exemplares.
Parcelas representativas mostrando um aumento inicial em todos os 4 animais. Em dois animais (animais 3 e 4) a PAPm caiu ao longo de 6 horas e finalmente aumentou, em outros dois animais (animal 1 e 2) a PAPm caiu continuamente. Clique aqui para ver uma versão maior desta figura.

Figura 3: Desenvolvimento de CRF durante 8 horas após lesão pulmonar dupla em 4 suínos exemplares.
Parcelas representativas mostrando uma diminuição inicial em todos os 4 animais. Depois disso, apenas um animal (animal 4) permaneceu estável em valores mais baixos, os outros animais subiram rapidamente para cair uniformemente ao longo do experimento. Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens histológicas de lesão pulmonar após lesão pulmonar de duplo golpe.
Os pulmões foram fixados em formalina para secção em parafina e coloração de hematoxilina/eosina. Ampliação da imagem 10x. (A) Infiltração linfocítica (seta vermelha) e atelectasia (seta preta). (B) Hiperdistensão (seta vermelha) e dano alveolar (seta preta). Clique aqui para ver uma versão maior desta figura.
Discussão
O método de duplo golpe descrito para causar uma lesão pulmonar grave em porcos é adequado para estudar diferentes opções de tratamento na SDRA. O modelo de duplo acerto mimetiza dois elementos centrais do mecanismo patológico da SDRA: perda da unidade alvéolo-capilar e ruptura da barreira endotelial7. Devido aos dois acertos, é importante ter um protocolo de estudo com valores-alvo predefinidos (por exemplo, relação PaO2/FiO2).
A principal desvantagem desse método de duplo golpe é a dificuldade de determinar até que ponto a lesão pulmonar é causada pela lavagem da solução eletrolítica balanceada, pela infusão de ácido oleico ou por ambos. Este é um problema comum em outros modelos de lesão pulmonar combinada, conforme descrito (por exemplo, para um método de lavagem e ventilação mecânica3). Além disso, o método do ácido oleico foi descrito pela primeira vez para investigar o mecanismo de lesão pulmonar aguda causada por embolia gordurosa/lipídica8. O ácido oleico é insolúvel em água e deve ser emulsionado no sangue continuamente. Após a injeção de doses repetidas de ácido oleico, alterações hemodinâmicas graves, como depressão miocárdica, hipotensão arterial sistêmica e hipertensão pulmonar, podem ocorrer imediatamente e resultar em insuficiência ventricular direita 3,6,9. A insuficiência ventricular direita pode levar à morte súbita do animal. Durante o estudo, dois animais foram perdidos devido aos efeitos descritos. A depleção de surfactante por instilação de solução eletrolítica balanceada aquecida foi desenvolvida pela primeira vez por Lachmann10. A SDRA humana é frequentemente associada à depleção de surfactante dos alvéolos3. Em modelos animais, instilações repetidas de solução eletrolítica balanceada devem ser realizadas. No início, a hipoxemia é atingida muito rapidamente, mas rapidamente reversível sob ventilação mecânica3. A permeabilidade e a inflamação não são significativamente afetadas e desencadeadas pela solução eletrolíticabalanceada 3. Alterações inflamatórias (por exemplo, alveolite neutrofílica) ocorrem após cerca de 4 h. A principal desvantagem do uso de solução eletrolítica balanceada é que os animais necessitam de intubação, ventilação mecânica e anestesia geral3.
No geral, também existem algumas vantagens importantes ao usar e combinar os dois métodos em suínos. A lesão pulmonar causada pela infusão de ácido oleico é bem conhecida e já foi descrita em detalhes antes 3,6. Kamuf et al. relataram resultados reprodutíveis em animais de pequeno e grande porte e, portanto, apresentaram um modelo adequado para estudar a SDRA6. O ácido oleico é diretamente tóxico para as células endoteliais3. A lesão endotelial é acompanhada por aumento da permeabilidade microvascular pulmonar e shunt intrapulmonar3. Problemas graves na troca gasosa podem ocorrer3. A infusão de ácido oleico não apenas mimetiza a fase inicial da SDRA, mas também reproduz as alterações fisiopatológicas posteriores com deposição de fibrina na superfície alveolar. O lavado broncoalveolar é um modelo comum para induzir lesão pulmonar e está bem estabelecido11. Os achados histopatológicos na SDRA humana (por exemplo, atelectasia e edema perivascular) podem ser causados por lavagens repetidas11. A infusão de ácido oleico leva à necrose alveolar profunda, congestão e formação de edema, enquanto o lavado broncoalveolar induz mais barotrauma, atelectasia e hemorragia9.
Com esse modelo de duplo golpe, diferentes estratégias de ventilação, abordagens terapêuticas específicas e a investigação de alterações pulmonares e função pulmonar na SDRA podem ser investigadas. A combinação desses dois métodos resulta em um modelo de SDRA que imita mais de perto as alterações fisiopatológicas que ocorrem durante a SDRA humana. A instrumentação e o monitoramento estendido dos suínos são mais fáceis de realizar em animais de grande porte e são mais semelhantes ao ambiente de cabeceira na unidade de terapia intensiva. Em resumo, este modelo é altamente reprodutível e permite que mais pesquisas investiguem diferentes abordagens terapêuticas para o tratamento da SDRA em um cenário mais realista.
Divulgações
Todos os autores não divulgam nenhum conflito de interesse financeiro ou qualquer outro conflito.
Agradecimentos
Os autores querem agradecer a Dagmar Dirvonskis pelo excelente suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 M Kaliumchlorid-Lösung 7.46% 20 mL | Fresenius, Kabi Deutschland GmbH | potassium chloride | |
| Absaugkatheter Ideal CH14, 52 cm, gerade | B. Braun Melsungen AG, Germany | suction catheter | |
| Arterenol 1 mg/mL, 25 mL | Sanofi- Aventis, Seutschland GmbH | norepinephrine | |
| Atracurium Hikma, 50 mg/5 mL | Hikma Pharma GmbH , Martinsried | atracurium | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | canula | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland GmbH | perfusorline | |
| Ketamin-Hameln 50 mg/mL | Hameln Pharmaceuticals GmbH | ketamine | |
| laryngoscope | Rüsch | laryngoscope | |
| logicath 7 Fr 3-lumen 30 cm lang | Smith- Medical Deutschland GmbH | central venous catheter | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Neofox Oxygen sensor 300 micron fiber | Ocean optics Largo, FL USA | ultrafast pO2-measurements | |
| Ölsäure reinst Ph. Eur NF C18H34O2 M0282.47g/mol, Dichte 0.9 | Applichem GmbH Darmstadt, Deutschland | oleic acid | |
| Original Perfusor syringe 50 mL Luer Lock | B.Braun Melsungen AG, Germany | perfusorsyringe | |
| PA-Katheter Swan Ganz 7.5 Fr, 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | PAC | |
| PE-Trichter, 60 mm | Aquintos-Wasseraufbereitung GmbH, Germany | funnel | |
| Percutaneous sheath introducer set 8.5 und 9 Fr, 10 cm with integral haemostasis valve/sideport | Arrow international inc. Reading, PA, USA | introducer sheath | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL Flaschen) | Fresenius, Kabi Deutschland GmbH | propofol | |
| Radifocus Introducer II, Größe 5-8 Fr | Terumo Corporation Tokio, Japan | introducer sheath | |
| Rüschelit Super Safety Clear 6.5 /7.0 | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Seldinger Nadel mit Fixierflügel | Smith- Medical Deutschland GmbH | seldinger canula | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welsch Allyn69604 | blade for laryngoscope | |
| Sterofundin Infusion | B. Braun Melsungen AG, Germany | bronchoalveolar lavage | |
| Stresnil 40 mg/mL | Lilly Deutschland GmbH, Abteilung Elanco Animal Health | azaperon | |
| Vasofix Safety 22 G | B.Braun Melsungen AG, Germany | venous catheter |
Referências
- Rubenfeld, G. D., et al. Incidence and Outcomes of Acute Lung Injury. New England Journal of Medicine. 353 (16), 1685-1693 (2005).
- The ARDS Definition Task Force. Acute Respiratory Distress Syndrome, The Berlin Definition. Journal of the American Medical Association. 307 (23), 2526-2533 (2012).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Goncalves-de-Albuquerque, C. F., Silva, A. R., Burth, P., Castro-Faria, M. V., Castro-Faria-Neto, H. C. Acute Respiratory Distress Syndrome: Role of Oleic Acid-Triggered Lung Injury and Inflammation. Mediators of Inflammation. 2015, 260465 (2015).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Kamuf, J., et al. Oleic Acid-Injection in Pigs As a Model for Acute Respiratory Distress Syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. New England Journal of Medicine. 342 (18), 1334-1349 (2000).
- Schuster, D. P. ARDS: clinical lessons from the oleic acid model of acute lung injury. American Journal of Respiratory and Critical Care Medicine. 149 (1), 245-260 (1994).
- Wang, H. M., Bodenstein, M., Markstaller, K. Overview of the pathology of three widely used animal models of acute lung injury. European Surgical Research. 40 (4), 305-316 (2008).
- Lachmann, B., Robertson, B., Vogel, J. In vivo lung lavage as an experimental model of the respiratory distress syndrome. Acta Anaesthesiologica Scandinavica. 24 (3), 231-236 (1980).
- Russ, M., et al. Lavage-induced Surfactant Depletion in Pigs as a Model of the Acute Respiratory Distress Syndrome (ARDS). Journal of Visualized Experiments. (115), e53610 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados