Method Article
돼지의 기관지폐포 세척 및 올레산 주입을 급성 호흡곤란 증후군(ARDS)에 대한 이중 히트 모델로 분석
요약
급성 호흡곤란 증후군(ARDS)의 병태생리학을 연구하기 위해 다양하고 복잡한 동물 모델이 존재합니다. 기관지폐포 세척 및 올레산 주입 유도 폐 손상은 급성 호흡곤란 증후군을 연구하기 위한 새로운 이중 히트 동물 모델로 적합합니다.
초록
ARDS의 치료는 21세기에도 중환자실 의사들에게 계속해서 큰 도전을 안겨주고 있으며, 중증의 경우 사망률이 여전히 최대 50%에 달합니다. 이 질병의 복잡한 병태생리학을 더 잘 이해하기 위해서는 추가 연구 노력이 필요합니다. 급성 폐 손상을 유발하는 다양한 잘 정립된 동물 모델이 있지만, ARDS의 복잡한 병리 기전을 적절하게 모방할 수 있는 모델은 없습니다. 이 질환의 발병에 가장 결정적인 요인은 폐포 모세혈관 단위의 손상입니다. 잘 정립된 두 가지 폐 손상 모델의 조합을 통해 근본적인 병리 메커니즘을 보다 자세히 모방할 수 있습니다. 기관지폐포 세척(BAL)은 계면활성제 고갈과 폐포 허탈을 유발합니다. 체액량을 반복적으로 주입하면 후속 저산소혈증이 발생합니다. 계면활성제 고갈은 인간에서 ARDS의 핵심 요인입니다. BAL은 종종 다른 폐 손상 접근법과 결합되지만, 올레산 주사(OAI)에 이어 두 번째 접종은 아직 이루어지지 않았습니다. 올레산 주입은 심각한 가스 교환 장애, 폐 역학의 악화 및 폐포-모세혈관 장벽의 파괴를 초래합니다. OAI는 폐포 누출 증가와 가스 교환 장애의 증가와 함께 폐 조직의 염증이 확장되는 ARDS의 예상되는 영향 대부분을 모방합니다. 서로 다른 모델의 조합의 단점은 BAL 단독, OAI 단독 또는 둘 다로 인한 폐 손상에 대한 영향을 결정하기 어렵다는 것입니다. 이 보고서에 제시된 모델은 BAL과 OAI의 조합을 새로운 이중 타격 폐 손상 모델로 나타냅니다. 이 새로운 모델은 구현하기 쉬우며 향후 ARDS에서 다양한 치료 접근법을 연구할 수 있는 대안이 될 것입니다.
서문
급성 호흡곤란 증후군(ARDS)은 가스 교환 장애와 폐 침윤으로 구성된 질병으로, 집중 치료가 필요한 경우가 많습니다. 중증 ARDS의 사망률은 거의 50년에걸친 광범위한 연구에도 불구하고 전 세계적으로 여전히 높으며(최대 50%)1. ARDS는 시기, 흉부 영상, 부종의 기원 및 저산소혈증과 같은 진단 기준을 포함하는 베를린 정의에 의해 정의됩니다2. 다양한 수준의 ARDS 중증도를 가진 환자를 더 잘 분류하기 위해 경증(200mmHg < PaO2/FIO2 ≤ 300mmHg), 중등도(100mmHg < PaO2/FIO2 ≤ 200mmHg), 중증(PaO2/FIO2 ≤ 100mmHg)2의 세 가지 저산소혈증을 정의합니다. 폐 손상에 초점을 맞춘 다양한 동물 모델이 널리 사용되며 ARDS의 병태생리학적 변화와 다양한 치료 접근법을 조사하기 위해 받아들여지고 있습니다3.
내독소(예: 패혈증으로 인한 폐 손상을 모방하기 위한 박테리아 정맥 주입, 두골 결찰 및 천자), 허혈/재관류 모델, 연기/화상 ARDS 모델, 올레산 주입 및 기관지폐포 세척 모델을 사용하는 동물 모델3. 각 모델은 연구 결과에 장단점이 있는 몇 가지 병태생리학적 변화만을 나타낸다3. 이는 ARDS 질병의 복잡성을 반영하지 않습니다. 두 가지 입증된 모델의 조합은 ARDS의 병태생리학에 대한 더 나은 결론을 내릴 수 있게 해줍니다. 제시된 모델에서는 기관지폐포 세척과 올레산 주입을 결합하여 인간 ARDS의 복잡성을 모방했습니다. 올레산은 불포화 지방산이며 선천성 면역 수용체의 활성화를 유발하여 폐의 폐포-모세혈관 단위에 직접 작용하여 호중구 축적, 전염증성 사이토카인 생성 및 세포 사멸을 유발합니다 4,5. 올레산 주입은 심각한 저산소혈증, 폐동맥압 상승 및 혈관 외 폐수 축적을 유발합니다. 우심실 부전으로 인한 저혈압과 심근 억제가 자주 발생합니다. 균형 잡힌 전해질 용액을 사용한 반복적인 기관지폐포 세척(BAL)에 의한 폐 손상 유도는 폐포 계면활성제 지질 농도를 감소시킵니다3. 계면활성제는 폐포 표면 장력을 감소시키고 폐포 붕괴를 예방합니다. BAL은 즉각적인 저산소혈증을 유발하고 폐포와 동맥 산소의 차이를 증가시킨다3. 인체 ARDS는 계면활성제3의 고갈과도 관련이 있습니다. 이 결합 모델의 단점은 중심 정맥 접근, 삽관 및 전신 마취가 필요하다는 것입니다. 더욱이, 번역 측면에 대한 의심스러운 기계론적 관련성(예: 올레산 주입)은 불분명합니다. 적어도 폐 손상의 어느 부분(BAL 대 OAI 또는 둘 다)이 폐 손상에 기여하는지 판단하기는 어렵습니다. 이 모델의 장점은 인간 환자와 유사한 친숙한 모니터링 및 기기를 사용하여 대형 동물에서 사용할 수 있고(특별한 장비가 필요하지 않음), ARDS의 주요 측면을 잘 재현할 수 있으며, 전신 염증 없이 분리된 ARDS를 연구할 수 있는 가능성(예: 내독소 모델)입니다. 다음 기사에서는 돼지의 이중 히트(BAL 및 OAI) 폐 손상에 대해 자세히 설명하고 폐 기능 손상의 안정성을 특성화하기 위한 대표적인 데이터를 제공합니다.
프로토콜
여기에 설명된 모든 동물 실험은 기관 및 국가 동물 관리 위원회(Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Germany, 승인 번호 G18-1-044)의 승인을 받았으며 유럽 및 독일 실험 동물 과학 협회의 지침에 따라 수행되었습니다.
1. 마취, 삽관 및 기계 환기
- 흡인 위험을 줄이기 위해 마취 전 6시간 동안 음식을 먹지 않지만 스트레스를 줄이기 위해 물을 자유롭게 마실 수 있도록 합니다.
- 케타민(4 mg∙kg-1)과 아자페론(8 mg∙kg-1)을 근육 주사하여 동물이 동물 상자에 있는 동안 진정제를 투여합니다.
- 알코올로 국소 소독한 후 귓정맥에 공통의 말초 정맥 카테터(20G)로 정맥 라인을 구축합니다.
- 센서를 동물의 귀 또는 꼬리 중 하나에 끼워 말초 산소 포화도(SpO2) 모니터링을 시작합니다.
- 마취 유도를 위해 펜타닐(4 μg∙kg-1), 프로포폴(3 mg∙kg-1) 및 아트라큐륨(0.5 mg∙kg-1)을 주사합니다.
- 돼지를 누운 자세로 들것에 눕힙니다.
- 최대 흡기압이 20cmH2O미만, PEEP가 5cmH2O, 빈도가 14-16/min, FiO2 가 1.0인 동물에게 적합한 마스크로 돼지를 환기시킵니다.
- 마취를 유지하기 위해 균형 잡힌 전해질 용액(5mL∙kg-1∙h-1), 프로포폴(8-12 mg∙kg-1∙h-1) 및 펜타닐(0.1-0.2 mg∙kg-1∙h-1)을 지속적으로 주입합니다.
- 삽관을 위해 동물에게 적합한 일반적인 기관내관(예: 체중 25-30kg, 기관내 튜브 ID 6-7)을 사용하고 기관내관 주입기로 무장하고 Macintosh Blade 4가 있는 일반 후두경을 사용합니다. 두 사람이 필요합니다.
- 사람 1 : 한 손으로 혀를 당기고 다른 손으로 주둥이를 누릅니다.
- 사람 2: 후두경을 삽입하고 후두개염이 시각화될 수 있을 때까지 평소와 같이 진행합니다.
- 후두경을 위로 당겨 성대를 시각화합니다. 때때로 후두개는 부드러운 구개에 "달라붙습니다". 그렇다면 튜브 끝으로 동원하십시오.
- 성대를 통해 튜브를 삽입하고 인트로듀서를 당겨 빼냅니다.
- 튜브의 풍선을 막습니다.
- 튜브를 인공호흡기에 연결하고 카프노그래피와 청진으로 올바른 위치를 확인합니다.
- 기계적 환기를 시작합니다(일회 호흡량 6-8 mL/kg, PEEP 5 cmH2O, FiO2 0.4, etCO2 를 35 – 45 mmHg 사이로 유지하기 위한 빈도).
2. 계측
- 필요한 혈관을 카테터로 삽입하기 위해 붕대로 뒷다리를 집어넣습니다. 폐동맥 카테터 삽입을 위한 동맥선, 동맥 도입부 초, 중심 정맥선 및 정맥 도입부 초가 필요합니다.
- 알코올 소독제로 대퇴부 부위를 넉넉하게 소독합니다. 계획된 검사에 따라 다소 무균 접근 방식이 사용됩니다.
- 카테터를 식염수로 씻어내어 준비합니다.
- 초음파 프로브를 서혜부 인대에 놓고 대퇴 혈관을 스캔합니다.
- 프로브를 90° 돌려 장축에서 대퇴 동맥을 완전히 시각화합니다. 필요한 경우 다양한 상황에서 짧은 축 보기를 사용하여 대퇴 동맥을 완전히 시각화할 수도 있습니다.
- Seldinger의 기법에 설정된 도입기의 바늘로 인라인 초음파 시각화에서 대퇴 동맥을 캐뉼레이션합니다. 맥동하는 밝은 혈액이 흘러나오면 가이드와이어를 삽입하고 바늘을 집어넣습니다.
- 대퇴 정맥을 시각화하고 인라인 초음파 시각화 및 도입기 세트의 바늘로 지속적인 흡인으로 정맥을 캐뉼레이션합니다. 정맥혈이 흡인되면 주사기를 분리하고 가이드와이어를 삽입하십시오. 바늘을 집어넣습니다.
- 초음파로 전선의 위치를 확인하십시오.
- 배치된 가이드와이어 위에 동맥과 정맥선을 삽입합니다.
- 반대쪽에서 동맥 및 정맥 구두점을 반복하고 위에서 설명한 대로 Seldinger의 기술에 따라 도입부 덮개를 삽입합니다.
- 동맥관과 정맥선을 각각 변환기에 연결합니다.
- 두 트랜스듀서를 모두 심장 높이에 배치하고 두 트랜스듀서의 3방향 스톱콕을 대기에 개방하여 시스템을 0으로 보정합니다.
알림: 그럴듯한 값을 생성하려면 시스템의 기포와 핏자국을 피해야 합니다. - 프로포폴과 펜타닐의 주입을 중심 정맥 라인의 포트 중 하나로 전환합니다.
- 초고속 pO2 측정을 위해 프로브를 보정하고 동맥 도입부 덮개를 통해 삽입합니다.
참고: 초고속 pO2 측정을 위한 프로브를 사용한 pO2 측정은 필수는 아니지만 pO2의 실시간 변화를 시각화하는 데 도움이 됩니다.
3. 폐동맥 카테터 삽입
- 폐동맥 카테터(PAC)의 풍선이 손상되었는지 확인합니다.
- 변환기에 연결하고 보정합니다.
- 도입부 덮개(풍선 수축)를 통해 PAC를 삽입합니다.
- PAC가 도입부 덮개(15-20cm)를 통과하면 풍선을 팽창시킵니다.
- PAC를 진행하고 일반적인 파형(정맥 혈관, 우심방, 우심실, 폐동맥, 폐 모세혈관 쐐기 압력)을 모니터링합니다. 풍선의 공기를 빼고 PAC의 모든 포트를 통해 혈액을 흡인할 수 있는지 확인합니다.
4. 폐 손상 유도 : 기관지 폐포 세척에 의한 첫 번째 타격
- 40°C로 예열된 멸균 균형 전해질 용액(예: Sterofundin)을 준비합니다.
참고: 폐 오염을 방지하기 위해 멸균 균형 전해질 용액이 사용됩니다. - 기관지 폐포 세척을 수행하기 전에 2분 동안 FiO2 를 0.4에서 1.0으로 10로 변경합니다.
- 초고속 pO2 측정을 시작합니다.
- 지속적인 주입 및 볼루스 주사(평균 동맥압이 60mmHg인 경우)를 위해 노르에피네프린< 준비합니다. 노르에피네프린 주사기 펌프를 시작하지 않고 중앙 정맥 카테터의 포트 중 하나에 연결합니다.
- 가열된 멸균 균형 전해질 용액에서 30mL∙kg-1 을 깔때기에 채웁니다. 깔때기가 기관내관에 연결될 수 있는지 확인합니다.
- 인공호흡기에서 영감을 받아 PEEP 손실 없이 튜브를 분리합니다.
- 깔때기를 기관내관에 연결합니다.
- 깔때기를 동물보다 1m 위로 수동으로 들어 올립니다.
- 캡을 열고 정수압을 사용하여 깔때기에서 기관내관으로 가열된 균형 잡힌 전해질 용액의 전량을 30초 이상 주입합니다.
- 30초 후 깔때기를 동물보다 1m 아래로 내려 주입된 용액을 제거하고 세척액을 수동적으로 배출합니다. 산소 공급을 위해 동물을 인공호흡기에 다시 연결하십시오.
- 제거된 세척액을 모아 양을 기록하십시오. 폐포액 청소율을 계산하는 데 필요합니다.
알림: 계면활성제 세척을 최대화하기 위해 세척 후 평형 전해질 용액을 재사용하지 마십시오. - 흡입 카테터를 사용하여 튜브에 있는 용액의 나머지 부분을 흡인합니다.
- 기관지폐포 세척 후 혈류역학을 면밀히 모니터링하고 노르에피네프린을 가까이에 두십시오. 필요한 경우 노르에피네프린을 볼루스 또는 지속적인 주입으로 제공하여 혈압을 안정시킵니다(4.4단계와 비교).
- PaO2/FiO2-비율이 250mmHg 미만이 될 때까지 4.5-4.13 단계에 설명된 대로 30mL∙kg-1 균형 전해질 용액을 반복적으로 주입합니다. 기관지폐포 세척을 4-5회 반복해야 할 수도 있습니다.
- PaO2/FiO2 비율이 250mmHg 미만인 경우 올레산 주사에 의한 폐 손상 유도부터 시작합니다. 이 절차를 수행하는 동안 인공호흡기 설정을 변경하지 마십시오.
5. 폐 손상의 유도 : 올레산 주입에 의한 두 번째 타격
- 올레산 용액 : 20mL 주사기에 올레산 0.1 mL∙kg-1 을 준비하고 3방향 마개에 연결합니다. 다른 20mL 주사기에 2mL의 혈액을 섭취합니다. 두 주사기에 총 부피 20mL에 식염수를 추가하고 두 번째 주사기도 3방향 마개에 연결합니다.
주의: 올레산으로 작업할 때는 장갑과 보안경을 사용하십시오. - 지속적인 주입 및 볼루스 주사(평균 동맥압이 60mmHg인 경우)를 위해 노르에피네프린< 준비합니다. 노르에피네프린 주사기 펌프를 시작하지 않고 중앙 정맥 카테터의 포트 중 하나에 연결합니다.
- 아직 측정 중인 초고속pO2 측정을 계속 모니터링합니다. FiO2 는 여전히 1.0입니다.
- 3방향 스톱콕을 PAC의 근접 포트에 연결합니다.
- 올레산과 혈액/식염수 혼합물을 한 주사기에서 다른 주사기로 또는 그 반대로 3방향 스톱콕을 통해 용액을 반복적으로 이동하여 철저히 혼합하고 항상 계속 혼합합니다. 균질 에멀젼 인 경우 에멀젼 2mL를 주입하고 혼합을 계속합니다.
참고: 혼합이 중단되면 에멀젼이 친유성 부분과 친수성 부분으로 분리될 수 있습니다. - 올레산 주입 후 혈류역학을 면밀히 모니터링하고 노르에피네프린을 가까이에 두십시오. 필요한 경우 혈압을 안정시키기 위해 노르에피네프린을 볼루스 또는 지속적인 주입으로 제공합니다(5.2단계와 비교).
참고: 경계하십시오. 이 과정에서 동물이 죽을 수 있습니다. - PaO2/FiO2 비율이 150mmHg 미만이 될 때까지 3분마다 2mL의 용액을 반복적으로 주입합니다.
- PaO2/FiO2 비율이 100mmHg에서 200mmHg 사이가 되기 전에 주사기가 비어 있는 경우 5.1단계에 설명된 대로 주사기를 2개 더 준비합니다. PaO5.5/FiO5.8 비율이 2mmHg에서 100mmHg 사이가 될 때까지 2-200단계를 반복합니다.
참고: 올레산과 혈액/식염수 혼합물의 절반에서 전체 주사기가 일반적으로 필요합니다. - PaO2/FiO2 비율이 100mmHg에서 200mmHg 사이인 경우 30분 기다렸다가 다시 확인하십시오. 지속적으로 200mmHg 미만이면 실험/처리를 시작합니다. 그렇지 않으면 5.1단계에 설명된 대로 주사기를 2개 더 준비하고 5.5-5.9단계를 반복합니다.
참고: 설명된 폐 손상 유도 후 폐 기능 손상은 안정적으로 유지되거나 악화되거나 특정 한계 내에서 개선될 수 있습니다.
6. 실험의 종료와 안락사
- 지속적인 마취에 추가로 0.5mg의 펜타닐을 주사하고 5분 동안 기다립니다. 프로포폴 200mg과 염화칼륨 40mmol을 주사하여 깊은 마취 상태에서 동물을 죽입니다.
결과
PaO2/FiO2 비율은 기관지폐포 세척 및 올레산의 분획 적용 후 감소합니다(그림 1). 기관지폐포 세척이 PaO2/FiO2 비율에 미치는 영향(예: 분획 올레산 용량의 영향)을 예측하는 것은 불분명하기 때문에 폐 손상을 유도하면서 PaO2/FiO2 비율을 모니터링하는 것이 좋습니다. 초고속 pO2 측정을 통해 PaO2 를 실시간으로 모니터링 할 수 있으며 잘 확립되어 있습니다6. 더블 히트 후 PaO2/FiO2 비율은 5cm H2O의 PEEP에서 30분 동안 100에서 200mmHg 사이에서 유지되어야 합니다. 200mmHg 이상인 경우 위에서 설명한 대로 5.8 및 5.9 단계를 반복하여 실험 시간 경과 중 동물의 자연 회복을 방지합니다. 동시에 평균 폐동맥압(mPAP)은 폐 손상이 유도되는 동안 증가하며 전체 실험에서 더 높은 상태를 유지합니다(그림 2). 이 급성 폐고혈압은 갑작스런 혈역학적 보상 상실과 동물의 죽음으로 이어질 수 있습니다. 이러한 현상을 예방하기 위해서는 혈역학을 면밀히 측정하고 편차를 카테콜아민(예: 노르에피네프린)으로 즉시 치료해야 합니다. 폐 손상 유도 후 폐의 기능적 잔류 용량(FRC)도 떨어지고 실험의 나머지 기간 동안 더 낮은 상태로 유지됩니다(그림 3). 폐 손상은 또한 조직학적으로(그림 4) 동물의 사체 후 적출된 폐에서 검출될 수 있습니다.
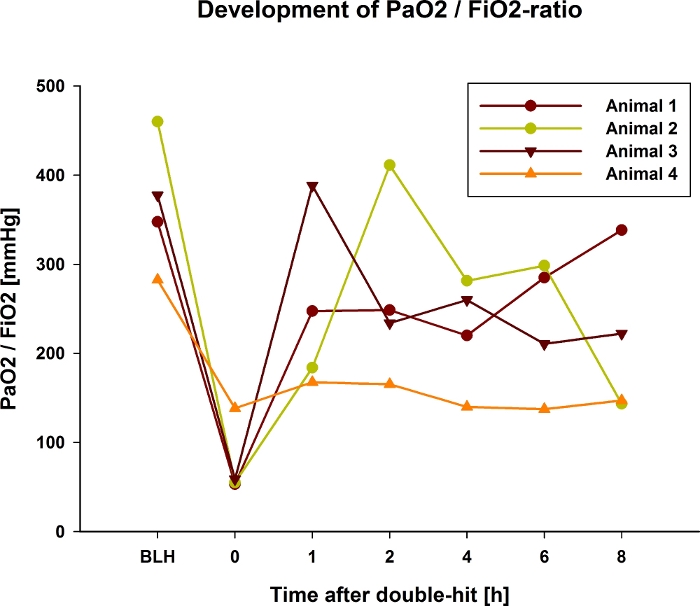
그림 1: 예시적인 돼지 4마리에서 이중 타격 폐 손상 후 8시간 동안 PaO2/FiO2-Ratio의 발달.
4 개 동물 모두의 초기 감소와 변동이 거의없는 안정적인 값을 보여주는 대표 그림 (동물 4). 그 후, 2 마리의 동물 (동물 2 및 3)에서 초기 상승 후 감소가 검출 될 수있었습니다. 한 동물(동물 4)에서 유도 후 지속적으로 낮은 값이 유지되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 예시적인 돼지 4마리에서 이중 타격 폐 손상 후 8시간 동안 mPAP(= 평균 폐동맥압)의 발달.
4 마리의 동물 모두에서 초기 상승을 보여주는 대표적인 그림. 2마리의 동물(동물 3 및 4)에서는 mPAP가 6시간 동안 떨어졌다가 마지막으로 상승했으며, 다른 2마리(동물 1 및 2)에서는 mPAP가 지속적으로 떨어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 예시적인 돼지 4마리에서 이중 타격 폐 손상 후 8시간 동안 FRC의 발병.
4 마리의 동물 모두에서 초기 감소를 보여주는 대표적인 그림. 그 후 한 동물(동물 4)만이 낮은 값에서 안정을 유지했고, 다른 동물들은 곧 상승하여 실험에 걸쳐 고르게 떨어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 이중 타격 폐 손상 후 폐 손상의 조직학적 이미지.
폐는 파라핀 절편 및 헤마톡실린/에오신 염색을 위해 포르말린으로 고정되었습니다. 이미지 확대 10배. (A) 림프구 침투(빨간색 화살표) 및 무기폐(검은색 화살표). (B) 과팽창(빨간색 화살표) 및 폐포 손상(검은색 화살표). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
돼지에서 심각한 폐 손상을 일으키기 위해 설명된 이중 히트 방법은 ARDS의 다양한 치료 옵션을 연구하는 데 적합합니다. 이중 히트 모델은 ARDS의 병리 메커니즘의 두 가지 핵심 요소인 폐포-모세혈관 단위의 손실과 내피 장벽의 파괴7을 모방합니다. 두 번의 히트로 인해 사전 정의된 목표 값(예: PaO2/FiO2-ratio)이 있는 연구 프로토콜을 갖는 것이 중요합니다.
이 이중 히트 방법의 주요 단점은 균형 잡힌 전해질 용액 세척, 올레산 주입 또는 둘 다에 의해 폐 손상이 발생하는 정도를 결정하기 어렵다는 것입니다. 이것은 설명된 바와 같이 다른 복합 폐 손상 모델에서 흔히 발생하는 문제입니다(예: 세척 및 기계적 환기 타격 방법3). 또한, 지방/지질 색전증으로 인한 급성 폐 손상의 기전을 조사하기 위해 올레산 방법이 처음으로 설명되었습니다8. 올레산은 물에 불용성이며 혈액에서 지속적으로 유화되어야 합니다. 올레산을 반복적으로 주사한 후에는 심근 억제, 전신 저혈압 및 폐 고혈압과 같은 심각한 혈역학적 변화가 즉시 발생하여 우심실 부전을 초래할 수 있습니다 3,6,9. 우심실 부전은 동물의 갑작스러운 죽음으로 이어질 수 있습니다. 연구 기간 동안 설명된 효과로 인해 두 마리의 동물이 손실되었습니다. 가열된 균형 잡힌 전해질 용액의 주입에 의한 계면활성제 고갈은 Lachmann10에 의해 처음 개발되었습니다. 인체 ARDS는 종종 폐포에서 계면활성제의 고갈과 관련이 있습니다3. 동물 모델에서는 균형 잡힌 전해질 용액을 반복적으로 주입해야 합니다. 처음에는 저산소혈증에 매우 빠르게 도달하지만 기계적 환기3 하에서 빠르게 회복될 수 있습니다. 투과성과 염증은 크게 영향을 받지 않으며 균형 잡힌 전해질 용액3에 의해 유발됩니다. 염증성 변화(예: 호중구성 폐포염)는 약 4시간 후에 발생합니다. 균형 잡힌 전해질 용액을 사용하는 것의 가장 큰 단점은 동물에게 삽관, 기계적 환기 및 전신 마취가 필요하다는 것입니다3.
전반적으로 돼지에서 두 가지 방법을 모두 사용하고 결합할 때 몇 가지 주요 이점이 있습니다. 올레산 주입에 의한 폐 손상은 잘 알려져 있으며, 3,6 이전에 상세히 기술되어 있다. Kamuf 등은 작은 동물과 큰 동물에서 재현 가능한 결과를 보고했기 때문에 ARDS6 연구에 매우 적합한 모델을 제시했습니다. 올레산은 내피 세포에 직접 독성이 있습니다3. 내피 손상 후에는 폐 미세혈관 투과성(pulmonary microvascular permeability)과 폐내 션트(intrapulmonary shunt)가 증가한다3. 가스 교환에 심각한 문제가 발생할 수 있습니다3. 올레산 주입은 ARDS의 초기 단계를 모방할 뿐만 아니라 폐포 표면에 피브린이 침착되어 후기 병태생리학적 변화를 재현합니다. 기관지폐포 세척은 폐 손상을 유발하는 흔한 모델이며 잘 확립되어 있다11. 인간 ARDS에서 조직병리학적 소견(예: 무기폐 및 혈관 주위 부종)은 반복적인 세척으로 인해 발생할 수 있다11. 올레산 주입은 심각한 폐포 괴사, 울혈 및 부종 형성을 유발하는 반면, 기관지폐포 세척은 더 많은 기압 외상, 무기폐 및 출혈을 유발한다9.
이 이중 히트 모델을 통해 다양한 환기 전략, 특정 치료 접근 방식 및 ARDS의 폐 변화 및 폐 기능에 대한 조사를 조사할 수 있습니다. 이 두 가지 방법을 결합하면 ARDS 모델이 인간 ARDS에서 발생하는 병태생리학적 변화를 더 가깝게 모방할 수 있습니다. 돼지에 대한 기기 및 확장 모니터링은 대형 동물에서 더 쉽게 수행할 수 있으며 중환자실의 침대 옆 설정과 더 유사합니다. 요약하면, 이 모델은 재현성이 높으며 보다 현실적인 환경에서 ARDS를 치료하기 위한 다양한 치료 접근법을 조사하기 위한 추가 연구를 가능하게 합니다.
공개
모든 저자는 재정적 또는 기타 이해 상충을 공개하지 않습니다.
감사의 말
저자는 탁월한 기술 지원을 해준 Dagmar Dirvonskis에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 M Kaliumchlorid-Lösung 7.46% 20 mL | Fresenius, Kabi Deutschland GmbH | potassium chloride | |
| Absaugkatheter Ideal CH14, 52 cm, gerade | B. Braun Melsungen AG, Germany | suction catheter | |
| Arterenol 1 mg/mL, 25 mL | Sanofi- Aventis, Seutschland GmbH | norepinephrine | |
| Atracurium Hikma, 50 mg/5 mL | Hikma Pharma GmbH , Martinsried | atracurium | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | canula | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland GmbH | perfusorline | |
| Ketamin-Hameln 50 mg/mL | Hameln Pharmaceuticals GmbH | ketamine | |
| laryngoscope | Rüsch | laryngoscope | |
| logicath 7 Fr 3-lumen 30 cm lang | Smith- Medical Deutschland GmbH | central venous catheter | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Neofox Oxygen sensor 300 micron fiber | Ocean optics Largo, FL USA | ultrafast pO2-measurements | |
| Ölsäure reinst Ph. Eur NF C18H34O2 M0282.47g/mol, Dichte 0.9 | Applichem GmbH Darmstadt, Deutschland | oleic acid | |
| Original Perfusor syringe 50 mL Luer Lock | B.Braun Melsungen AG, Germany | perfusorsyringe | |
| PA-Katheter Swan Ganz 7.5 Fr, 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | PAC | |
| PE-Trichter, 60 mm | Aquintos-Wasseraufbereitung GmbH, Germany | funnel | |
| Percutaneous sheath introducer set 8.5 und 9 Fr, 10 cm with integral haemostasis valve/sideport | Arrow international inc. Reading, PA, USA | introducer sheath | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL Flaschen) | Fresenius, Kabi Deutschland GmbH | propofol | |
| Radifocus Introducer II, Größe 5-8 Fr | Terumo Corporation Tokio, Japan | introducer sheath | |
| Rüschelit Super Safety Clear 6.5 /7.0 | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Seldinger Nadel mit Fixierflügel | Smith- Medical Deutschland GmbH | seldinger canula | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welsch Allyn69604 | blade for laryngoscope | |
| Sterofundin Infusion | B. Braun Melsungen AG, Germany | bronchoalveolar lavage | |
| Stresnil 40 mg/mL | Lilly Deutschland GmbH, Abteilung Elanco Animal Health | azaperon | |
| Vasofix Safety 22 G | B.Braun Melsungen AG, Germany | venous catheter |
참고문헌
- Rubenfeld, G. D., et al. Incidence and Outcomes of Acute Lung Injury. New England Journal of Medicine. 353 (16), 1685-1693 (2005).
- The ARDS Definition Task Force. Acute Respiratory Distress Syndrome, The Berlin Definition. Journal of the American Medical Association. 307 (23), 2526-2533 (2012).
- Matute-Bello, G., Frevert, C. W., Martin, T. R. Animal models of acute lung injury. American Journal of Physiology - Lung Cellular and Molecular Physiology. 295 (3), 379-399 (2008).
- Goncalves-de-Albuquerque, C. F., Silva, A. R., Burth, P., Castro-Faria, M. V., Castro-Faria-Neto, H. C. Acute Respiratory Distress Syndrome: Role of Oleic Acid-Triggered Lung Injury and Inflammation. Mediators of Inflammation. 2015, 260465 (2015).
- Ballard-Croft, C., Wang, D., Sumpter, L. R., Zhou, X., Zwischenberger, J. B. Large-animal models of acute respiratory distress syndrome. Annals of Thoracic Surgery. 93 (4), 1331-1339 (2012).
- Kamuf, J., et al. Oleic Acid-Injection in Pigs As a Model for Acute Respiratory Distress Syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. New England Journal of Medicine. 342 (18), 1334-1349 (2000).
- Schuster, D. P. ARDS: clinical lessons from the oleic acid model of acute lung injury. American Journal of Respiratory and Critical Care Medicine. 149 (1), 245-260 (1994).
- Wang, H. M., Bodenstein, M., Markstaller, K. Overview of the pathology of three widely used animal models of acute lung injury. European Surgical Research. 40 (4), 305-316 (2008).
- Lachmann, B., Robertson, B., Vogel, J. In vivo lung lavage as an experimental model of the respiratory distress syndrome. Acta Anaesthesiologica Scandinavica. 24 (3), 231-236 (1980).
- Russ, M., et al. Lavage-induced Surfactant Depletion in Pigs as a Model of the Acute Respiratory Distress Syndrome (ARDS). Journal of Visualized Experiments. (115), e53610 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유