Method Article
Разработка доклинической ингаляционной модели для тестирования испаренных дистиллятов каннабиса
В этой статье
Резюме
Картриджи для вейпа с дистиллятом каннабиса представляют собой устройства с питанием от аккумуляторов, которые распыляют экстракты, содержащие высокую концентрацию каннабиноидов. Отсутствие установленных доклинических моделей для этих продуктов создает проблемы в изучении их физиологических эффектов. Чтобы восполнить этот пробел, была разработана стандартизированная доклиническая ингаляционная мышиная модель для испаренных дистиллятов каннабиса.
Аннотация
Несмотря на растущую популярность, вейп-продукты из каннабиса остаются малоизученными. Картриджи для вейпов каннабиса используются с устройствами с батарейным питанием, которые распыляют экстракты цветков каннабиса, содержащие высокую концентрацию каннабиноидов, таких как ТГК. Эти типы продуктов широко известны как дистилляты каннабиса. Эффективность этих продуктов создает проблемы при определении эффективной дозировки для доклинических исследований. В настоящее время не существует устоявшихся, стандартизированных доклинических моделей для проверки безопасности и эффективности этих продуктов способами, аналогичными моделям использования человеком. Таким образом, режим воздействия дистиллята каннабиса in vivo , необходимый для достижения физиологически значимых доз по сравнению с тем, что достигается у человека, остается неопределенным. Чтобы восполнить этот пробел, была разработана стандартизированная доклиническая мышиная модель вдыхания испаренных дистиллятов каннабиса с использованием системы доставки, управляемой компьютером. В этом протоколе подробно описаны процедуры введения дистиллятов вейпов каннабиса с использованием упорядоченной слоеной топографии мышам с помощью вышки только для носа. Также предложены методы мониторинга поведенческих исходов мышей после воздействия и использования полуколичественного иммуноферментного анализа для подтверждения доставки ТГК в системный кровоток. Этот протокол позволит исследователям, заинтересованным в изучении влияния вейпинга каннабиса, исследовать легочные и системные реакции на дистилляты каннабиса с использованием реальных протоколов доставки, тем самым предоставляя возможность для строгой оценки безопасности и терапевтической оценки.
Введение
С легализацией каннабиса, происходящей во всем мире, употребление каннабиса растет. Значительные изменения на розничном рынке каннабиса не только повышают доступность, но и стимулируют разработку и производство новых видов продуктов каннабиса для потребления1. Испарители, которые нагревают продукты каннабиса без горения, становятся все более популярным методом потребления 2,3. Испарители включают картриджи для вейпов каннабиса, в которых используется технология электронных сигарет для нагрева и распыления дистиллятов каннабиса. Эти дистилляты извлекаются из цветков Cannabis sativa для получения вязкой жидкости с высокой концентрацией каннабиноидов, таких как Δ 9-тетрагидроканнабинол (ТГК), основной психоактивный компонент каннабиса4. Эти устройства просты в использовании и скрыты, что делает их привлекательными для начинающих пользователей5. В Канаде, где каннабис был легализован в рекреационных целях в 2018 году, полученные данные опроса показывают увеличение воспринимаемой социальной приемлемости вейпинга каннабиса, а также значительноеувеличение использования вейп-ручек / картриджей с каннабисом.
Потребители каннабиса могут считать, что вейпинг дистиллятов каннабиса безопаснее, чем курение сухого цветка в виде косяка, что способствует его растущей популярности2. Несмотря на возможное снижение воздействия вдыхаемых продуктов сгорания при использовании дистиллятов для вейпов каннабиса, эти продукты не могут быть безопасными. Одной из проблем является воздействие высоких доз каннабиноидов, которые присутствуют в коммерческих картриджах для вейпов. Высушенный цветок каннабиса можно приобрести с содержанием ТГК до 36%, в то время как концентрация ТГК в картриджах с дистиллятом каннабиса может достигать 96%7. Аэрозоли из картриджей с дистиллятом каннабиса содержат примерно в два раза больше концентраций ТГК по сравнению с дымом каннабиса 8,9. Пока неизвестно, какое влияние эти повышенные концентрации ТГК оказывают на дыхательные пути. Кроме того, высокие концентрации ТГК создают проблемы в установлении эффективной дозировки для доклинических исследований на мышах, поскольку чрезмерное воздействие ТГК само по себе может оказать неблагоприятное воздействие намышей. Важно начинать с минимальных уровней воздействия и постепенно увеличивать его до тех пор, пока не будут достигнуты физиологически значимые дозы, чтобы гарантировать, что эти воздействия являются релевантными.
На сегодняшний день нет исследований, изучающих потенциальные эффекты вдыхаемых испаренных дистиллятов каннабиса. Отчасти это связано с отсутствием существующих стандартизированных доклинических моделей. Исследовательские проблемы усугубляются в регионах, где эти продукты остаются незаконными, что побуждает исследователей производить собственные дистилляты, которые могут неточно отражать коммерческие продукты11. Кроме того, широкий ассортимент доступной продукции усложняет стандартизацию. Чтобы восполнить этот пробел, данное исследование было инициировано с использованием легальных, коммерчески доступных продуктов, доступных канадским потребителям. Продукты и устройства, перечисленные как бестселлеры в магазине каннабиса Онтарио, были выбраны для использования. Целью этого протокола является создание простого в использовании режима воздействия на мышей, который обеспечивает дозы ТГК, сопоставимые с физиологически значимыми человеческими уровнями, создавая основу для проведения исследователями дополнительных исследований респираторных и системных эффектов испаренных дистиллятов каннабиса.
протокол
Приведенные ниже процедуры были одобрены Комитетом по уходу за животными Университета Макгилла (протокол No 8087) в соответствии с руководящими принципами Канадского совета по уходу за животными (CCAC).
1. Подготовка оборудования
ПРИМЕЧАНИЕ: Следующий протокол применяется к системе SCIREQ inExpose, поддерживаемой программным обеспечением flexiWare 8.
- Убедитесь в правильной сборке всех компонентов системы, чтобы она напоминала пример, показанный на рисунке 1A. Убедитесь, что в буферную камеру насоса для затяжки вставлена закрытая трубка, чтобы предотвратить утечку из системы, как показано на рисунке 1B.
- Включите систему и запустите программное обеспечение. Выберите модуль «Сеансы экспериментирования ».
- Выберите «Новое исследование» и определите экспериментальные группы и испытуемых, которые будут изучаться. Выберите экспериментальный шаблон, который соответствует нужному режиму воздействия.
- В окне Свойства сеанса заполните раздел Оператор, чтобы отслеживать использование оборудования.
- Чтобы выполнить калибровку, выберите нужный канал и следуйте инструкциям, описанным в операционном программном обеспечении.
- (Критический шаг) Чтобы выполнить тест расхода в системе, выберите нужный насос и следуйте инструкциям, описанным в операционном программном обеспечении. Убедитесь, что поток системы направлен к ротаметру. Эта калибровка предназначена для того, чтобы убедиться в отсутствии утечек в системе. Если система не прошла испытание потоком, очистите компоненты и трубки перед повторной попыткой испытания.
- Отмените запросы на начало записи данных, если они не готовы начать эксперимент.
2. Создание профилей Puff
- Создайте профиль смещения потока 2 л/мин, чтобы обеспечить достаточную аэрацию испытуемых на протяжении всего эксперимента. Для этого обратитесь к техническому примечанию 037: Руководство по созданию профилей во внешнем документе, который можно получить у производителя.
- Создайте затяжку для профилей электронных сигарет. Для этого обратитесь к техническому примечанию 037. В описанном здесь протоколе техническое примечание было модифицировано для выдачи объема 78 мл затяжки с продолжительностью 2,4 с и 1, 2 или 4 затяжки/мин, как было опубликовано ранее 12,13,14,15,16,17.
3. Подготовка животных
- Для этого протокола используйте мышей мужского и женского пола C57BL/6 в возрасте 10-12 недель и весом около 20-30 г. Акклиматизируют мышей к системе постепенно в течение 3 дней.
- Начните акклиматизацию с помещения мышей в мягкое удерживающее устройство, затем начните подачу смещения со скоростью 2 л/мин с комнатным воздухом в течение периода, который будет соответствовать продолжительности их экспериментального воздействия. Используйте период акклиматизации 10 минут, 20 минут или 30 минут, чтобы соответствовать описанным здесь экспериментальным воздействиям. Эти шаги были предприняты для минимизации любого воздействия, вызванного стрессом, на интересующие результаты.
- Чтобы поместить животных в мягкие ограничители, полностью втяните сетчатый компонент, держите весь ограничитель перед животным и подождите, пока животное переместится в компонент поршня.
- Убедитесь, что нос животного виден в поршневом компоненте удерживающего устройства, затем закрепите зажим для крепления прямо за животным, чтобы предотвратить любое движение за пределы удерживающего устройства.
ПРИМЕЧАНИЕ: Молодые и мелкие животные могут легче маневрировать в пределах удерживающего устройства, поэтому важно убедиться, что их нос остается видимым за пределами компонента поршня.
- При работе с мышами разного пола или генотипа рассмотрите возможность использования связующих зажимов с цветовой кодировкой, чтобы различать животных.
4. Воздействие на животных
- Поместите шесть удерживаемых животных в носовую башню системы воздействия и инициируйте поток смещения со скоростью 2 л/мин комнатным воздухом, чтобы обеспечить достаточный поток воздуха.
- В окне настройки задачи в правой части экрана щелкните правой кнопкой мыши по профилю электронной сигареты «Создано», затем выберите «Свойства задачи».
- В поле Частота затяжки введите желаемую частоту для начала затяжки. Например, для режима 2 затяжки/мин требуется ввод 30 с. Нажмите OK, затем Yes, когда программное обеспечение запросит подтверждение этого изменения. Чтобы сохранить этот режим затяжки для использования в будущем, в конце сеанса следуйте инструкциям по сохранению его в качестве шаблона.
- Когда вы будете готовы выполнить экспозицию, дважды щелкните по созданному и теперь измененному профилю электронной сигареты. Обязательно запустите таймер, чтобы отслеживать продолжительность экспозиции.
- Чтобы оценить дозу при увеличении продолжительности экспозиции, выполняйте 10-минутные, 20-минутные и 30-минутные экспозиции со скоростью 1 затяжка/мин. Затем, чтобы оценить возрастающую интенсивность воздействия, поддерживайте продолжительность воздействия в течение 10 минут и увеличьте частоту затяжек до 1 затяжки/мин, 2 затяжек/мин и 4 затяжек/мин.
- После завершения воздействия повторно запустите поток смещения, возвращая животных в клетки.
- Чтобы снять животных с фиксаторов, отсоедините зажим для крепления и полностью втяните сетку в поршень, позволяя животному самостоятельно выйти из ограничителя. Если животное остается в удерживающем устройстве, осторожно потяните его за хвост, чтобы показать, что оно свободно может выйти из удерживающего устройства.
5. Тест на гиполокомоцию
- Сразу после контакта переведите животных в набор поведенческих тестов для проведения теста в открытом поле с использованием программного обеспечения ANY-Maze. Чтобы выполнить базовые записи поведения животных, убедитесь, что они подвержены только потоку смещения.
- Убедитесь, что помещение хорошо освещено, и сведите к минимуму уровень шума, чтобы предотвратить ненужный стресс для животных, так как это может повлиять на их поведение.
- Откройте программу и выберите «Новый пустой эксперимент». На вкладке «Протокол» в верхней части экрана выберите «Добавить элемент», а затем нажмите «Новый источник видео » в раскрывающемся списке, чтобы добавить источник камеры, который будет использоваться для эксперимента.
- В меню в левой части экрана в разделе «Слежение» выберите «Устройство », чтобы определить открытое поле, в которое будет помещено животное.
- На вкладке «Протокол» выберите инструмент «Прямоугольник », чтобы нарисовать область открытого поля, и введите ее размеры в программное обеспечение.
- В меню в левой части экрана в разделе «Отслеживание» выберите «Цвет животного », чтобы указать, является ли животное светлее или темнее фона. Эта информация помогает программному обеспечению точно отслеживать движение животного.
- В меню слева в разделе Тестирование выберите Этапы , чтобы указать продолжительность теста для эксперимента. Введите продолжительность теста 60 с.
- На вкладке Эксперимент определите экспериментальную обработку и количество животных на одну обработку.
- Теперь, чтобы выполнить тест, нажмите на вкладку «Тесты ». Поместите животное в открытое поле и нажмите зеленую кнопку воспроизведения над записью открытого поля, чтобы начать тест.
- По завершении тестирования в меню слева в разделе «Анализ и результаты» выберите «Результаты, отчеты и данные», а затем выберите «Общее пройденное расстояние », чтобы включить эту информацию в отчет.
- Чтобы сформировать отчет, перейдите на вкладку Результаты и экспортируйте данные в нужный формат.
6. Забор образцов сыворотки крови
- Через 30 мин после воздействия обезболить животных внутрибрюшинным введением 250 мг/кг авертина (2,2,2-трибромэтанола). Чтобы обеспечить правильную анестезию, стимулируйте рефлекс отмены педали, защемляя кожу между пальцами ног с помощью тупых щипцов. Как только рефлекс полностью исчезает, животное обезболивают достаточно глубоко, чтобы его можно было усыпить путем обескровливания с помощью пункции сердца. Временная точка в 30 минут выбирается для достижения пиковых концентраций ТГК-СООН в сыворотке крови после воздействия18.
- Соберите кровь с помощью пункции сердца в пробирки для сбора крови, затем центрифугируйте при давлении 10 000 x g в течение 10 минут для отделения сыворотки.
- Используйте образцы сыворотки для проведения ИФА ТГК для количественного определения уровней ТГК-СООН в соответствии с инструкциями производителя и ранее опубликованными19.
Результаты
Первоначальная цель состояла в том, чтобы определить режим воздействия, который мог бы доставить физиологически значимые уровни ТГК в кровь по сравнению с человеком. Таким образом, ключевым компонентом при выборе параметров воздействия было использование признаков, которые имитировали модели использования человеком20,21. Самцы и самки мышей C57BL/6 подвергались воздействию капсулы Pineapple Express Pax Era Pod, содержащей ~85% ТГК, в течение 10 минут, 20 минут и 30 минут со скоростью 1 затяжка/мин с объемом затяжки 78 мл и продолжительностью затяжки 2,4 с. Мышей умерщвляли через 30 минут после воздействия для измерения уровня ТГК-COOH. ТГК-СООН является вторичным метаболитом ТГК22. У мышей сывороточный ТГК достигает пика сразу после воздействия и впоследствии гидроксилируется ферментами CYP450 с образованием 11-OH-THC, который быстро окисляется до THC-COOH23,24. Затем ТГК-СООН накапливается в сыворотке, достигая пиковых концентраций примерно через 30 минут после воздействия, обеспечивая надежный маркер для обнаружения18. Концентрации ТГК-СООН в сыворотке крови были ниже предела обнаружения у мышей, подвергшихся воздействию воздуха, но значительно увеличились до примерно 11,2 нг/мл, 15,2 нг/мл и 16,1 нг/мл у мышей, подвергшихся воздействию вейпа с ТГК в течение 10 минут, 20 минут и 30 минут соответственно (Рисунок 2A). Затем интенсивность воздействия варьировалась путем увеличения количества затяжек в минуту, сохраняя при этом все остальные параметры неизменными в течение 10-минутного времени экспозиции. Здесь содержание ТГК-СООН в сыворотке крови значительно увеличилось примерно до 11,4 нг/мл, 21,8 нг/мл и 25,2 нг/мл у мышей, подвергшихся воздействию вейп-продукта с ТГК со скоростью 1, 2 и 4 затяжки/мин соответственно (рис. 2B). Уровни ТГК-СООН, достигнутые в режимах воздействия 10 минут, 2 затяжки/мин и 4 затяжки/мин, приближаются к уровням ТГК-СООН, обнаруженным в сыворотке крови людей, употребляющих каннабис после ингаляции 22,25,26,27,28.
После определения режима воздействия, который доставлял физиологически значимые дозы каннабиноидов мышам, следующим шагом было подтверждение того, что этот режим также приведет к значительным поведенческим результатам. Чтобы оценить это, был проведен тест на гиполокомоцию, поскольку он является компонентом тетрадного анализа, обычно используемого для оценки поведенческих реакций на ТГК у грызунов29. Исходные измерения на мышах, подвергшихся воздействию только смещенного потока воздуха, привели к смещению на 3,41 м. После воздействия 10 минут вейп-продукта THC со скоростью 2 затяжки/мин смещение значительно уменьшилось до 0,29 м, а при 4 затяжках/мин оно еще больше уменьшилось до 0,05 м (Рисунок 3). Не было существенной разницы в смещении мышей между выдержками 2 затяжки/мин и 4 затяжки/мин. Таким образом, режим воздействия 2 затяжки/мин в течение 10 минут был выбран для использования в будущих исследованиях, поскольку он имеет тенденцию к более плавному восстановлению мышей после воздействия, продолжая при этом доставлять физиологически значимые дозы.

Рисунок 1: Изображение системы. (A) Убедитесь, что оборудование собрано правильно, включая подходящий мундштук для конкретного устройства, чистую трубку и точное направление потока системы в сторону колонны только для носа. (B) Убедитесь, что буферная камера содержит закрытую трубку для предотвращения утечки, как указано стрелкой на виде сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
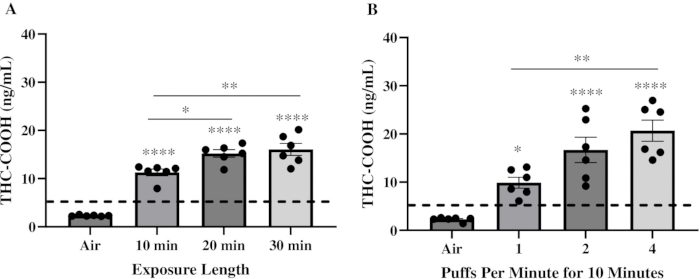
Рисунок 2: Уровни ТГК-COOH в сыворотке крови после воздействия вейп-продукта с ТГК. В общей сложности шесть мышей подверглись воздействию вейп-продукта с ТГК, содержащего 85% ТГК. Через 30 минут после воздействия сыворотку собирали для количественного определения уровней ТГК-COOH с помощью ИФА с ТГК. Графики представляют уровни ТГК-COOH после (A) 10-, 20- или 30-минутного воздействия со скоростью 1 затяжка в минуту или (B) после 10-минутного воздействия со скоростью 1, 2 или 4 затяжки в минуту. Результаты выражаются в виде среднего значения ± SEM. Точки данных представляют отдельных мышей. Пунктирная линия обозначает предел обнаружения. Для определения значимости был использован односторонний дисперсионный анализ (ANOVA) с различиями между группами, обследованными с использованием множественных сравнительных тестов Тьюки (*p = 0,0348; **p = 0,0022; ****p < 0,0001 по сравнению с мышами, подвергшимися воздействию воздуха). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Тест на гиполокомоцию после воздействия вейп-продукта с ТГК. В общей сложности шесть мышей подвергались воздействию смещенного потока воздуха в течение 10 минут, а затем были переведены в открытое поле для проведения теста на гиполокомоцию. По завершении исходных измерений мыши подвергались 10-минутному воздействию со скоростью 2 затяжки/мин или 4 затяжки/мин. Второй тест на гиполокомоцию был проведен сразу после воздействия. Продолжительность испытания составила 60 с. Результаты выражаются в виде среднего значения ± SEM. Точки данных представляют отдельных мышей. Для определения значимости был использован односторонний дисперсионный анализ (ANOVA), при этом различия между группами были изучены с использованием множественных сравнительных тестов Тьюки (****p < 0,0001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Продукты для вейпинга с дистиллятом каннабиса содержат высокую концентрацию каннабиноидов, в том числе до 85% ТГК для продукта, используемого в этом протоколе. Поскольку цветок каннабиса в настоящее время достигает только 36% ТГК7, эффективность вейп-продуктов из дистиллята каннабиса создает проблемы при разработке модели ингаляционного воздействия. Цель состояла в том, чтобы определить режим воздействия, который мог бы эффективно доставлять соответствующие дозы каннабиноидов мышам, не вызывая побочных эффектов от чрезмерного уровня воздействия ТГК.
Широкий ассортимент продуктов каннабиса, доступных для покупки, усложняет сравнение между исследованиями; однако выбор продуктов с аналогичной эффективностью ТГК способствует воспроизводимости. В то время как параметры затяжки можно адаптировать к различным продуктам, использование продуктов с более низкой потенцией может потребовать длительного воздействия для обеспечения воспроизводимости в сочетании с проверкой доставляемой системной дозы. Кроме того, важно отметить, что в этом исследовании одновременно подвергались воздействию шесть мышей. Например, 10-минутное воздействие со скоростью 2 затяжки/мин распределяется между шестью мышами, а это означает, что изменение количества мышей за сеанс воздействия может повлиять на индивидуальную получаемую дозу. Прозрачная отчетность о количестве животных при одном воздействии имеет важное значение в будущих исследованиях с использованием аналогичного оборудования, поскольку это может существенно повлиять на эффективную дозу, получаемую каждым животным, и, следовательно, на общие результаты исследования. Кроме того, несмотря на усилия по разработке профилей затяжек, которые воспроизводят модели использования человеком, важно отметить, что мыши, подвергшиеся воздействию, не вдыхают полностью каждую затяжку, которая производится. Значительная часть аэрозоля выбрасывается в окружающую среду. Таким образом, проверка дозы, доставленной в системный кровоток после воздействия, имеет решающее значение для окончательной интерпретации данных. Кроме того, для оценки осаждения частиц могут использоваться методы мониторинга аэрозолей, такие как включение специализированных фильтров политетрафторэтилена (ПФТЭ) в систему воздействия для улавливания аэрозольных частиц 30,31. После воздействия содержание ТГК, осажденное на этих фильтрах, может быть извлечено и количественно определено с помощью жидкостной хромато-масс-спектрометрии (LC-MS)32. Кроме того, размер частиц может быть измерен с помощью лазерной дифракции33. Интегрируя данные о концентрации аэрозоля, размере частиц и респираторных параметрах мышей, таких как дыхательный объем и частота дыхания, теоретические вдыхаемые дозы могут быть оценены с большей точностью с использованием вычислительных дозиметрических моделей 34,35,36.
В ингаляционных исследованиях используются два основных метода воздействия: воздействие на все тело и воздействие только через нос. При воздействии на все тело животные не сдерживаются, что позволяет всей поверхности тела вступать в контакт с испытательной атмосферой37. Недостатком этого метода является возможность осаждения тестируемых агентов на шерсти, которая может быть проглочена, когда животное вылизывает себя, что создает непреднамеренныйпуть воздействия. Этого можно избежать, используя только носовую ингаляционную башню. Тем не менее, воздействие только через нос также имеет ограничения. Сдерживание животных может усилить стресс, а некоторые ограничения могут нарушить терморегуляцию39. Такой подход также может стать трудоемким при работе с большими группами животных. Чтобы смягчить эти факторы и избежать искажающих результатов, важно поместить контрольных животных в ограничители внутри экспонировочной башни, получая только смещенный поток воздуха.
Здесь предлагается стандартизированная доза воздействия, которая позволяет достичь физиологически значимых уровней каннабиноидов по сравнению с человеком. Эти базовые измерения закладывают основу для изучения исследователями влияния как низких, так и более высоких доз воздействия путем изменения частоты затяжки и продолжительности воздействия для определения эффективной дозы, желаемой для конкретных экспериментальных потребностей. Будущие исследования направлены на сравнение различных коммерческих продуктов и устройств и оценку их респираторных эффектов с использованием описанного здесь протокола. Учитывая, что исследователи респираторных заболеваний часто используют мышей C57BL/6 и Balb/c, также важно определить, применимы ли представленные здесь результаты к мышам Balb/c для руководства будущими исследованиями. Кроме того, предложенная в протоколе доза подходит для расширенных исследований, изучающих острые или хронические эффекты вейп-продуктов из дистиллята каннабиса, что дает возможность для тщательной оценки безопасности. Учитывая, что путь воздействия – вдыхание, важно досконально понимать влияние этих продуктов на легкие. Изучение того, как хроническое воздействие влияет на механику легких, функцию тканевых резидентных иммунных клеток и восприимчивость к заболеваниям, может дать первоначальное понимание их влияния на физиологию легких. Кроме того, опасения по поводу долгосрочных эффектов этих продуктов распространяются не только на легкие, но и на другие органы. Например, хронические последствия воздействия мощного вейпа ТГК на мозг остаются плохо изученными; однако хроническое воздействие ТГК было связано с когнитивными нарушениями, зависимостью и структурными изменениями в мозге 40,41,42,43. Кроме того, учитывая популярность этих продуктов среди молодежи, их потенциальное влияние на развитие мозга требует исследования. Стремление к этим конечным точкам будет иметь важное значение, поскольку рынок каннабиса продолжает расти, и существует потребность в исследованиях для изучения безопасности новых продуктов. Это жизненно важно, потому что это способствует лучшему пониманию последствий каннабиса и помогает обеспечить безопасность миллионов потребителей каннабиса во всем мире.
Раскрытие информации
Авторы заявляют, что у них нет конфликтов интересов, связанных с этой работой, которые они могли бы раскрыть.
Благодарности
Эта работа была поддержана грантом проекта Канадского института исследований в области здравоохранения (CIHR) 162273. CJB был поддержан Fonds de Recherche du Québec -Santé (FRQS).
Материалы
| Name | Company | Catalog Number | Comments |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402-5G | Avertin |
| inExpose | SCIREQ | sales@scireq.com | www.scireq.com |
| Microtainer Serum Separator Tubes | BD | 365967 | |
| Pax Era Vape Pen | PAX | Purchased from Ontario Cannabis Store | |
| Pineapple Express Pax Pod | Good Supply | Purchased from Ontario Cannabis Store | |
| SoftRestraints | SCIREQ | IX-XN1-SR-AL | www.scireq.com |
| THC Forensic ELISA Kit | Neogen | 131019 |
Ссылки
- Spindle, T. R., et al. Acute Effects of Smoked and Vaporized Cannabis in Healthy Adults Who Infrequently Use Cannabis: A Crossover Trial. JAMA Netw Open. 1 (7), e184841-e184841 (2018).
- Morean, M. E., Kong, G., Camenga, D. R., Cavallo, D. A., Krishnan-Sarin, S. High School Students' Use of Electronic Cigarettes to Vaporize Cannabis. Pediatrics. 136 (4), 611-616 (2015).
- Russell, C., Rueda, S., Room, R., Tyndall, M., Fischer, B. Routes of administration for cannabis use - basic prevalence and related health outcomes: A scoping review and synthesis. Int J Drug Policy. 52, 87-96 (2018).
- Lazarjani, M. P., Young, O., Kebede, L., Seyfoddin, A. Processing and extraction methods of medicinal cannabis: a narrative review. J Cannabis Res. 3 (1), 32 (2021).
- Jones, C. B., Hill, M. L., Pardini, D. A., Meier, M. H. Prevalence and correlates of vaping cannabis in a sample of young adults. Psychol Addict Behav. 30 (8), 915-921 (2016).
- . 2023–24 Departmental Plan: Health Canada Available from: https://www.canada.ca/en/health-canada/corporate/transparency/corporate-management-reporting/report-plans-priorities/2023-2024-departmental-plan.html (2023)
- Geweda, M. M., et al. Evaluation of dispensaries' cannabis flowers for accuracy of labeling of cannabinoids content. J Cannabis Res. 6 (1), 11 (2024).
- Meehan-Atrash, J., Rahman, I. Cannabis Vaping: Existing and Emerging Modalities, Chemistry, and Pulmonary Toxicology. Chem Res Toxicol. 34 (10), 2169-2179 (2021).
- Van der Kooy, F., Pomahacova, B., Verpoorte, R. Cannabis smoke condensate I: the effect of different preparation methods on tetrahydrocannabinol levels. Inhal Toxicol. 20 (9), 801-804 (2008).
- Rosenberg, E. C., Patra, P. H., Whalley, B. J. Therapeutic effects of cannabinoids in animal models of seizures, epilepsy, epileptogenesis, and epilepsy-related neuroprotection. Epilepsy Behav. 70 (Pt B), 319-327 (2017).
- National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division. . The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research. , (2017).
- Been, T., et al. Chronic low-level JUUL aerosol exposure causes pulmonary immunologic, transcriptomic, and proteomic changes. Faseb J. 37 (2), e22732 (2023).
- Been, T., et al. Differential impact of JUUL flavors on pulmonary immune modulation and oxidative stress responses in male and female mice. Arch Toxicol. 96 (6), 1783-1798 (2022).
- Caruana, V., et al. Chronic exposure to E-cigarette aerosols potentiates atherosclerosis in a sex-dependent manner. Toxicol Appl Pharmacol. 492, 117095 (2024).
- Paoli, S., Eidelman, D. H., Mann, K. K., Baglole, C. Sex-specific alterations in pulmonary metabolic, xenobiotic and lipid signalling pathways after e-cigarette aerosol exposure during adolescence in mice. BMJ Open Respir Res. 11 (1), e002423 (2024).
- Lamb, T., Muthumalage, T., Meehan-Atrash, J., Rahman, I. Nose-Only Exposure to Cherry- and Tobacco-Flavored E-Cigarettes Induced Lung Inflammation in Mice in a Sex-Dependent Manner. Toxics. 10 (8), 471 (2022).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biol. 37, 101758 (2020).
- Gazarov, E. A., et al. Pharmacokinetics of delta-9-tetrahydrocannabinol following acute cannabis smoke exposure in mice; effects of sex, age, and strain. Front Pharmacol. 14, 1227220 (2023).
- Haidar, Z., Traboulsi, H., Eidelman, D. H., Baglole, C. J. Differential inflammatory profile in the lungs of mice exposed to cannabis smoke with varying THC:CBD ratio. Arch Toxicol. 97 (7), 1963-1978 (2023).
- Behar, R. Z., Hua, M., Talbot, P. Puffing topography and nicotine intake of electronic cigarette users. PLoS One. 10 (2), e0117222 (2015).
- Leavens, E. L. S., et al. electronic cigarette use patterns, other tobacco product use, and reasons for use among ever users: Results from a convenience sample. Addict Behav. 95, 178-183 (2019).
- Huestis, M. A. Human cannabinoid pharmacokinetics. Chem Biodivers. 4 (8), 1770-1804 (2007).
- Hložek, T., et al. Pharmacokinetic and behavioural profile of THC, CBD, and THC+CBD combination after pulmonary, oral, and subcutaneous administration in rats and confirmation of conversion in vivo of CBD to THC. Eur Neuropsychopharmacol. 27 (12), 1223-1237 (2017).
- Nasrin, S., Watson, C. J. W., Perez-Paramo, Y. X., Lazarus, P. Cannabinoid Metabolites as Inhibitors of Major Hepatic CYP450 Enzymes, with Implications for Cannabis-Drug Interactions. Drug Metab Dispos. 49 (12), 1070-1080 (2021).
- Hartman, R. L., et al. Controlled Cannabis Vaporizer Administration: Blood and Plasma Cannabinoids with and without Alcohol. Clin Chem. 61 (6), 850-869 (2015).
- Newmeyer, M. N., et al. Free and Glucuronide Whole Blood Cannabinoids' Pharmacokinetics after Controlled Smoked, Vaporized, and Oral Cannabis Administration in Frequent and Occasional Cannabis Users: Identification of Recent Cannabis Intake. Clin Chem. 62 (12), 1579-1592 (2016).
- Schwope, D. M., Karschner, E. L., Gorelick, D. A., Huestis, M. A. Identification of recent cannabis use: whole-blood and plasma free and glucuronidated cannabinoid pharmacokinetics following controlled smoked cannabis administration. Clin Chem. 57 (10), 1406-1414 (2011).
- Sharma, P., Murthy, P., Bharath, M. M. Chemistry, metabolism, and toxicology of cannabis: clinical implications. Iran J Psychiatry. 7 (4), 149-156 (2012).
- Metna-Laurent, M., Mondésir, M., Grel, A., Vallée, M., Piazza, P. V. Cannabinoid-Induced Tetrad in Mice. Curr Protoc Neurosci. 80, 9.59.1-9.59.10 (2017).
- Soo, J. C., Monaghan, K., Lee, T., Kashon, M., Harper, M. Air sampling filtration media: Collection efficiency for respirable size-selective sampling. Aerosol Sci Technol. 50 (1), 76-87 (2016).
- Tang, Z. J., et al. Cytotoxicity and toxicoproteomic analyses of human lung epithelial cells exposed to extracts of atmospheric particulate matters on PTFE filters using acetone and water. Ecotoxicol Environ Safety. 191, 110223 (2020).
- Puah, P. Y., et al. Extractable impurities from fluoropolymer-based membrane filters - interference in high-throughput, untargeted analysis. RSC Adv. 9 (55), 31918-31927 (2019).
- Berrada-Gomez, M. P., Bui, B., Bondarenko, H., Ferret, P. J. Particle size distribution in the evaluation of the inhalation toxicity of cosmetic spray products. Reg Toxicol Pharmacol. 139, 105359 (2023).
- Hammer, T., Gao, H., Pan, Z., Wang, J. Relationship between Aerosols Exposure and Lung Deposition Dose. Aerosol Air Quality Res. 20 (5), 1083-1093 (2020).
- Asgharian, B., et al. Computational modeling of nanoscale and microscale particle deposition, retention and dosimetry in the mouse respiratory tract. Inhal Toxicol. 26 (14), 829-842 (2014).
- Chou, L. T., et al. Particle size matters: Discrepancies in the health risks posed by traditional cigarettes and e-cigarettes in mice and humans. J Hazardous Mater Lett. 4, 100088 (2023).
- Cheng, Y. S., et al. Exposing Animals to Oxidant Gases. Proc Am Thorac Society. 7 (4), 264-268 (2010).
- Chen, L. C., Lippmann, M. Inhalation Toxicology Methods: The Generation and Characterization of Exposure Atmospheres and Inhalational Exposures. Curr Protoc Toxicol. 63 (1), 24.24.21-24.24.23 (2015).
- Wong, B. A. Inhalation Exposure Systems: Design, Methods and Operation. Toxicologic Pathol. 35 (1), 3-14 (2007).
- Cousijn, J., et al. Grey matter alterations associated with cannabis use: results of a VBM study in heavy cannabis users and healthy controls. Neuroimage. 59 (4), 3845-3851 (2012).
- Filbey, F. M., Schacht, J. P., Myers, U. S., Chavez, R. S., Hutchison, K. E. Marijuana craving in the brain. Proc Natl Acad Sci U S A. 106 (31), 13016-13021 (2009).
- Sneider, J. T., Gruber, S. A., Rogowska, J., Silveri, M. M., Yurgelun-Todd, D. A. A preliminary study of functional brain activation among marijuana users during performance of a virtual water maze task. J Addict. 2013, 461029 (2013).
- Gilman, J. M., et al. Cannabis use is quantitatively associated with nucleus accumbens and amygdala abnormalities in young adult recreational users. J Neurosci. 34 (16), 5529-5538 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены