Method Article
気化した大麻留出物を試験するための前臨床吸入モデルの開発
要約
大麻蒸留物ベイプカートリッジは、高濃度のカンナビノイドを含む抽出物をエアロゾル化するバッテリー駆動のデバイスです。これらの製品には確立された前臨床モデルがないため、その生理学的効果の研究に課題が生じています。このギャップに対処するために、気化した大麻留出物の標準化された前臨床吸入マウスモデルが開発されました。
要約
その人気が高まっているにもかかわらず、大麻ベイプ製品はまだ研究されていません。大麻のベイプカートリッジは、THCなどの高濃度のカンナビノイドを含む大麻の花の抽出物をエアロゾル化するバッテリー駆動のデバイスで使用されます。これらのタイプの製品は、一般に大麻留出物として知られています。これらの製品の効力は、前臨床試験のための効果的な投与量を確立する上で課題を提示します。現在、これらの製品の安全性と有効性を人間の使用パターンに類似した方法で試験するための確立された標準化された前臨床モデルはありません。したがって、ヒトで達成されるものと比較して生理学的に適切な用量を達成するために必要な in vivo 大麻留出物曝露レジームは未確定のままです。このギャップに対処するために、気化した大麻留出物を吸入するための標準化された前臨床マウスモデルが、コンピューター制御の送達システムを使用して開発されました。このプロトコルは、鼻のみの露出タワーでマウスに、管理されたパフトポグラフィーを使用して大麻ベイプ蒸留物を投与する手順を詳しく説明しています。曝露後のマウスの行動結果をモニターする方法や、半定量的ELISAを使用してTHCが体循環に送達することを確認する方法も提供されています。このプロトコルにより、大麻ベイプ留出物製品に対する肺および全身の反応を、実世界のデリバリープロトコルを使用して大麻ベイプの影響を調査することに関心のある研究者による調査が可能になり、それによって厳密な安全性と治療評価の機会が提供されます。
概要
世界中で大麻の合法化が進む中、大麻の使用は増加しています。小売大麻市場の大きな変化は、アクセシビリティを向上させるだけでなく、これらの変化は、消費用の新しいタイプの大麻製品の開発と生産も推進しています1。大麻製品を燃焼せずに加熱する気化器は、ますます人気のある消費方法になりつつあります2,3。気化器には、電子タバコ技術を利用して大麻留出物を加熱およびエアロゾル化する大麻ベイプカートリッジが含まれます。これらの留出物は、カンナビスサティバの花から抽出され、カンナビノイドの高濃度で粘性のある液体を生成します Δ9-テトラヒドロカンナビノール(THC)、大麻4の主要な精神活性成分。これらのデバイスは使いやすく、隠すのが簡単なため、初心者ユーザーにとって魅力的です5。2018年に娯楽目的で大麻が合法化されたカナダでは、得られた調査データによると、大麻を吸うことの社会的受容性が高まっていることが示されています。また、大麻のペン/カートリッジの使用量も大幅に増加しています6。
大麻の消費者は、大麻の蒸留物を蒸気で吸うことは、ジョイントの形でドライフラワーを吸うよりも安全であると信じているかもしれません2。大麻ベイプ蒸留物を使用すると、吸入燃焼生成物への曝露が減少する可能性がありますが、これらの製品はリスクがないとは限りません。1つの懸念は、市販のVAPEカートリッジに含まれる高用量のカンナビノイドにさらされることです。乾燥した大麻の花は最大36%のTHCで購入できますが、大麻蒸留液カートリッジのTHC濃度は96%に達することがあります7。大麻留出物カートリッジからのエアロゾルには、大麻の煙と比較して約2倍のTHC濃度が含まれています8,9。これらのTHC濃度の上昇が気道にどのような影響を与えるかはまだわかっていません。さらに、高濃度の THC は、過剰な THC 曝露自体がマウスに悪影響を与える可能性があるため、前臨床マウス研究のための効果的な投与を確立する上で課題となります10。これらの曝露が適切であることを確認するためには、最小限の曝露レベルから始めて、生理学的に適切な線量が達成されるまで徐々に増加させることが不可欠です。
これまでのところ、吸入された気化大麻蒸留物の潜在的な影響を調べた研究はありません。これは、部分的には、既存の標準化された前臨床モデルの欠如によるものです。これらの製品が違法のままである地域では、研究上の課題がさらに悪化し、研究者は商業製品を正確に反映していない可能性のある社内留出物を生産するよう促されています11。さらに、利用可能な製品が多岐にわたるため、標準化が複雑になります。このギャップを埋めるために、この研究は、カナダの消費者が利用できる合法的な市販製品を使用して開始されました。オンタリオ大麻ストアのトップセラーとしてリストされている製品とデバイスが選択され、使用されました。このプロトコルの目標は、生理学的に適切なヒトレベルに匹敵するTHCの投与量を投与する、使いやすいマウス曝露法を確立することであり、研究者が気化した大麻留出物の呼吸器および全身への影響について追加の研究を行うための基盤を作ることです。
プロトコル
以下の手順は、カナダ動物管理評議会(CCAC)のガイドラインに従って、マギル大学動物管理委員会(プロトコル番号8087)によって承認されました。
1. 機器の準備
注:次のプロトコルは、flexiWare 8ソフトウェアでサポートされているSCIREQ inExposeシステムに適用されます。
- システムのすべてのコンポーネントが正しく組み立てられ、 図 1A に示す例のようになります。 図1Bに示すように、システムの漏れを防ぐために、パフポンプのバッファーチャンバーに閉じたチューブが挿入されていることを確認します。
- システムの電源を入れ、ソフトウェアを起動します。 [実験セッション ] モジュールを選択します。
- 「新規スタディ」を選択し、試験する実験グループと被験者を定義します。目的の曝露レジメンに対応する実験テンプレートを選択します。
- 「セッション・プロパティ」ウィンドウで、「オペレーター」セクションに入力して、機器の使用状況を追跡します。
- キャリブレーションを実行するには、 目的のチャネル を選択し、オペレーティングソフトウェアで説明されている手順に従います。
- (クリティカルステップ)システムフローテストを実行するには、 目的のポンプ を選択し、オペレーティングソフトウェアに記載されている手順に従います。システムの流れが回転計に向けられていることを確認します。このキャリブレーションは、システムに漏れがないことを確認するためのものです。システムがフローテストに合格しない場合は、テストを再試行する前にコンポーネントとチューブを清掃してください。
- 実験を開始する準備ができていない限り、データ記録を開始するように求めるプロンプトをキャンセルします。
2. Puffプロファイルの作成
- 2 L/minのバイアスフロープロファイルを作成し、実験全体で被験者の適切な曝気を確保します。これを行うには、製造元から入手可能な外部ドキュメントのテクニカルノート037:プロファイルの作成ガイドを参照してください。
- 電子タバコのプロファイル用のパフを作成します。これを行うには、Technote 037 を参照してください。ここで説明するプロトコルでは、テクニカルノートは、78 mL の puff 容量、2.4 s の puff 持続時間、および 12、13、14、15、16、17 の12、13、14、15、16、17 の 1、2、または 4 puffs/min で送達するように変更されました。
3.動物の調理
- このプロトコルでは、10〜12週齢、体重約20〜30 gの雄と雌の両方のC57BL / 6マウスを使用します。マウスを3日間かけて徐々にシステムに順応させます。
- マウスをソフト拘束具内に配置することで順応を開始し、次に、実験ばく露の長さに一致する期間にわたって、室内空気で2 L / minでバイアスフローを開始します。10分、20分、または30分の順化期間を使用して、ここで説明する実験曝露に一致させます。これらの措置は、関心のあるアウトカムに対するストレス誘発性の影響を最小限に抑えるために講じられた。
- 動物をソフトレストに配置するには、メッシュコンポーネントを完全に引っ込め、拘束全体を動物の前に保持し、動物がプランジャーコンポーネントに移動するのを待ちます。
- 動物の鼻が拘束具のプランジャーコンポーネントに見えることを確認してから、動物のすぐ後ろにバインダークリップを固定して、拘束具からの動きを防ぎます。
注:若くて小さな動物は、拘束具内でより簡単に操作できるため、鼻がプランジャーコンポーネントの外側に見えるままであることを確認することが不可欠です。
- 性別や遺伝子型の異なるマウスを扱う場合は、動物を区別するために色分けされたバインダークリップを使用することを検討してください。
4. 動物へのばく露
- 6匹の拘束された動物を露光システムの鼻のみのタワーに置き、室内の空気で2 L / minでバイアスフローを開始して、十分な空気の流れを確保します。
- 画面の右側にあるタスクドッカーで、 作成した電子タバコプロファイルを右クリックし、[ タスクのプロパティ]を選択します。
- [Puff Frequency] で、パフを開始するための目的の周波数を入力します。たとえば、2 パフ/分体制では、30 秒の入力が必要です。 [OK] をクリックし、ソフトウェアがこの変更の確認を求めたら [はい] をクリックします。このパフレジームを将来使用するために保存するには、セッションの最後に、プロンプトに従ってテンプレートとして保存します。
- 露光を実行する準備ができたら、作成して変更した 電子タバコプロファイルをダブルクリックします。露出の長さを追跡するために、必ずタイマーを開始してください。
- ばく露時間が長くなるにつれて線量を評価するには、10分、20分、30分のばく露を1puff/minで行ってください。次に、曝露強度の増加を評価するために、10分間の曝露時間を維持し、パフ周波数を1パフ/分、2パフ/分、および4パフ/分に増やします。
- 曝露が完了したら、動物をケージに戻しながらバイアスフローを再開します。
- 動物を拘束具から取り外すには、バインダークリップを取り外し、メッシュをプランジャーまで完全に引っ込めて、動物が自分で拘束から抜け出せるようにします。動物が拘束されたままの場合は、尾をそっと引っ張って、拘束から自由に後退できることを知らせます。
5. 低運動試験
- 曝露後すぐに、動物を行動試験スイートに移し、ANY-Mazeソフトウェアを使用してオープンフィールドテストを実行します。動物の行動のベースライン記録を実行するには、動物がバイアスフローにのみさらされていることを確認してください。
- 部屋が十分に照らされていることを確認し、騒音レベルを最小限に抑えて、動物の行動に影響を与える可能性があるため、動物への不必要なストレスを防ぎます。
- ソフトウェアを開き、[ 新しい空の実験] を選択します。画面上部の「プロトコル」タブで、「 項目の追加」を選択し、ドロップダウンリストから 「新規ビデオソース 」をクリックして、実験に使用するカメラソースを追加します。
- 画面左側のメニューの「トラッキング」セクションで、「 装置 」を選択して、動物を配置するオープンフィールドを定義します。
- [プロトコル]タブで、[ 長方形ツール ]を選択してオープンフィールド領域を描画し、その寸法をソフトウェアに入力します。
- 画面左側のメニューの[トラッキング]セクションで、[ 動物の色 ]を選択して、動物が背景よりも明るいか暗いかを指定します。この情報は、ソフトウェアが動物の動きを正確に追跡するのに役立ちます。
- 左側のメニューの [テスト] セクションで、[ ステージ ] を選択して、テストのテスト期間を指定します。60 秒のテスト期間を入力します。
- 「実験」タブで、実験的な処理と処理ごとの動物の数を定義します。
- 次に、テストを実行するには、[ テスト ]タブをクリックします。動物をオープンフィールドに入れ、オープンフィールドの記録の上にある 緑色の再生ボタンをクリックして テストを開始します。
- テストが完了したら、左側のメニューの [分析と結果] セクションで、[ 結果]、[レポート]、および [データ ] を選択し、[ 移動した合計距離 ] を選択して、この情報をレポートに含めます。
- レポートを生成するには、「 結果 」タブをクリックし、データを目的の形式でエクスポートします。
6. 血清サンプルの採取
- 曝露後30分で、250 mg / kgのアベルチン(2,2,2-トリブロモエタノール)の腹腔内注射で動物に麻酔をかけます。.適切な麻酔を確実にするために、鈍い鉗子を使用してつま先の間の皮膚をつまむことにより、ペダル離脱反射を刺激します。反射が完全に消えると、動物は心臓穿刺による放血によって安楽死させるのに十分なほど深く麻酔をかけられます。30分の時点は、曝露後の血清THC-COOH濃度のピークを達成するために選択されます18。
- 採血管に心臓穿刺により採血し、10,000 x g で10分間遠心分離して血清を分離します。
- 血清サンプルを使用して THC 法医学 ELISA を実行し、製造元の指示に従って、以前に公開された19 に従って THC-COOH レベルを定量化します。
結果
当初の目的は、人間と比較して生理学的に適切なレベルのTHCを血液中に送達できる曝露レジームを決定することでした。したがって、曝露パラメータを選択するための重要な要素は、人間の使用パターンを模倣した特徴を使用することであった20,21。雌雄の C57BL/6 マウスを、~85% の THC を含む Pineapple Express Pax Era Pod に 10 分、20 分、30 分間、1 パフ/分、パフ量 78 mL、パフ時間 2.4 秒でばく露しました。マウスは、THC-COOHレベルを測定するために、曝露の30分後に犠牲にされました。THC-COOHはTHC22の二次代謝物です。マウスでは、血清THCは曝露直後にピークに達し、その後CYP450酵素によってヒドロキシル化されて11-OH-THCを形成し、THC-COOHに急速に酸化されます23,24。その後、THC-COOHは血清中に蓄積し、曝露後約30分でピーク濃度に達し、検出のための信頼性の高いマーカーを提供します18。血清 THC-COOH 濃度は、空気中マウスでは検出限界を下回っていましたが、THC VAPE 製品に 10 分間、20 分間、30 分間曝露したマウスでは、それぞれ約 11.2 ng/mL、15.2 ng/mL、16.1 ng/mL と大幅に増加しました(図 2A)。次に、10分間の曝露時間中に他のすべてのパラメーターを同じに保ちながら、1分間に送達されるパフの数を増やすことにより、曝露の強度を変化させました。ここで、THC VAPE 製品に 1、2、4 puff/min で曝露したマウスでは、血清 THC-COOH が約 11.4 ng/mL、21.8 ng/mL、25.2 ng/mL と大幅に増加しました(図 2B)。10分、2パフ/分、および4パフ/分の曝露レジームで達成されたTHC-COOHのレベルは、吸入後の大麻のヒトユーザーの血清中に見られるTHC-COOHのレベルに近似しています22,25,26,27,28。
生理学的に適切な量のカンナビノイドをマウスに投与する曝露レジームを特定した後、次のステップは、このレジームが有意な行動結果も引き出すことを確認することでした。これを評価するために、げっ歯類のTHCに対する行動反応を評価するために一般的に使用されるテトラッドアッセイの構成要素である低運動試験が実施された29。バイアスフローの空気のみにばく露されたマウスのベースライン測定では、3.41mの変位が得られました。THC ベイプ製品を 2 パフ/分で 10 分間さらした後、排気量は 0.29 m に大幅に減少し、4 パフ/分ではさらに 0.05 m に減少しました(図 3)。2 puffs/minと4 puffs/minのばく露でマウスの変位に有意差はなかった。したがって、10分間の2パフ/分の曝露レジームは、生理学的に適切な用量を提供し続けながら、曝露後のマウスのよりスムーズな回復に向かう傾向があるため、将来の研究で使用するために選択されました。

図1:システムの図。 (A)特定のデバイスに適したマウスピース、清潔なチューブ、ノーズ専用露出タワーへの正確なシステムの流れ方向など、機器が正しく組み立てられていることを確認してください。 (B)バッファチャンバーに、オーバーヘッドビューの矢印で示されているように、漏れを防ぐために閉じたチューブが含まれていることを確認します。 この図の拡大版を表示するには、ここをクリックしてください。
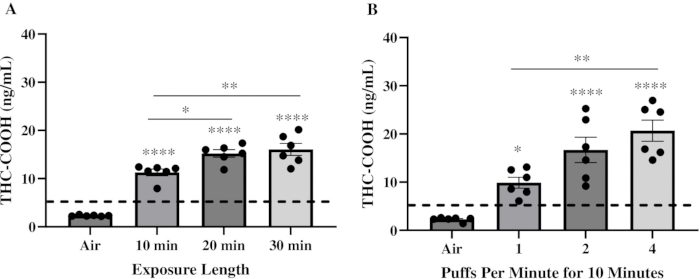
図2:THCベイプ製品への曝露後の血清THC-COOHレベル。 合計6匹のマウスが、THCを85%含むTHCベイプ製品に曝露されました。曝露後 30 分で血清を採取し、THC ELISA による THC-COOH レベルを定量化しました。グラフは、(A)10分、20分、または30分を1パフ/分で、または(B)10分を1、2、または4パフ/分で10分間曝露した後のTHC-COOHレベルを表しています。結果はSEM±平均値で表され、データポイントは個々のマウスを表します。点線は検出限界を表します。有意性を決定するために一元配置分散分析(ANOVA)を使用し、テューキーの多重比較検定(*p = 0.0348; **p = 0.0022; ****p < 0.0001)を使用して、空気中マウスと比較しました。 この図の拡大版を表示するには、ここをクリックしてください。

図3:THCベイプ製品への曝露後の低運動テスト。 合計6匹のマウスをバイアスフローの空気に10分間曝露した後、オープンフィールドに移して低運動試験を行いました。ベースライン測定の完了後、マウスを2パフ/分または4パフ/分で10分間の曝露に曝露した。2回目の低運動試験は、曝露直後に実施された。試験時間は60秒でした。結果はSEM±平均値で表され、データポイントは個々のマウスを表します。有意性を決定するために一元配置分散分析(ANOVA)を使用し、テューキーの多重比較検定(****p < 0.0001)を使用してグループ間の差を調べました。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
大麻蒸留ベイプ製品には、このプロトコルで使用される製品の最大85%のTHCを含む高濃度のカンナビノイドが含まれています。現在、大麻の花はTHC7の36%までしか到達しないため、大麻蒸留ベイプ製品の効力は、吸入曝露のモデルを開発する際に課題となります。その目的は、過剰な THC 曝露レベルによる悪影響を引き起こさずに、適切な量のカンナビノイドをマウスに効果的に投与できる曝露レジームを決定することでした。
購入可能な大麻製品の幅広い範囲は、研究間の比較を複雑にします。しかし、THCの効力が類似した製品を選択することで、再現性が向上します。パフパラメータはさまざまな製品に適応できますが、効力の低い製品の使用には、再現性を確保するために長時間の曝露が必要であり、送達された全身用量の検証と相まって、さらに、この研究では6匹のマウスが同時に曝露されたことに注意することが重要です。例えば、2パフ/分での10分間のばく露は6匹のマウスに分散されるため、ばく露セッションごとのマウスの数を変更すると、受ける個々の線量に影響を与える可能性があります。曝露あたりの動物数の透明性のある報告は、各動物が受ける実効線量、ひいては研究の全体的な結果に大きな影響を与える可能性があるため、同様の機器を使用する将来の研究では不可欠です。さらに、ヒトの使用パターンを再現するパフプロファイルを開発する努力にもかかわらず、ばく露されたマウスは、生成される各パフを完全には吸い込まないことに注意することが重要です。エアロゾルのかなりの部分が周囲の環境に放出されます。したがって、曝露後に体循環に送達される線量を確認することは、データの最終的な解釈にとって重要です。さらに、エアロゾル粒子を捕捉するために曝露システム内に特殊なポリテトラフルオロエチレン(PFTE)フィルターを組み込むなどのエアロゾルモニタリング技術は、粒子沈着を評価するために利用することができる30,31。曝露後、これらのフィルターに堆積したTHC含有量は、液体クロマトグラフィー-質量分析(LC-MS)32を用いて抽出および定量することができる。さらに、粒子径はレーザー回折33を用いて測定することができる。エアロゾル濃度、粒子サイズ、および潮汐量や呼吸頻度などのマウスの呼吸パラメータに関するデータを統合することにより、計算線量測定モデル34,35,36を使用して、理論上の吸入線量をより正確に推定することができる。
吸入試験では、全身曝露と鼻のみの曝露という2つの主要な曝露モダリティが使用されます。全身曝露では、動物は拘束されず、全身表面が試験雰囲気37に接触することを可能にする。この方法の欠点は、試験剤が毛皮に堆積する可能性であり、これは動物が自ら毛づくろいをするときに摂取され、意図しない曝露経路38を導入する可能性がある。これは、鼻専用の吸入タワーを使用することで回避できます。ただし、鼻のみの露出にも制限があります。動物を拘束するとストレスが増大する可能性があり、特定の拘束は体温調節を損なう可能性がある39。このアプローチは、大規模な動物のグループで作業する場合にも労働集約的になる可能性があります。これらの要因を軽減し、交絡結果を招かないようにするためには、制御動物を曝露塔内の拘束具に配置し、バイアス気流のみを受け取ることが不可欠です。
ここで提案されているのは、人間と比較して生理学的に適切なレベルのカンナビノイドを達成するための標準化された曝露量です。このベースライン測定は、研究者がパフ頻度と曝露時間を変更して特定の実験ニーズに必要な実効線量を決定することにより、低曝露量と高曝露量の両方の影響を調査するための基盤を確立します。今後の研究は、さまざまな市販製品やデバイスを比較し、ここで説明するプロトコルを使用してそれらの呼吸器への影響を評価することを目的としています。呼吸器研究者がC57BL/6およびBalb/cマウスを頻繁に使用することを考えると、ここで紹介した知見がBalb/cマウスに適用可能かどうかを判断し、将来の研究を導くことも不可欠です。さらに、このプロトコルで提案されている用量は、大麻留出物ベイプ製品の急性または慢性の影響を調査する広範な研究に適しており、厳密な安全性評価の機会を提供します。曝露経路が吸入であることを考えると、これらの製品が肺に及ぼす影響を十分に理解することが不可欠です。慢性的な曝露が肺のメカニズム、組織に常在する免疫細胞の機能、および疾患に対する感受性にどのように影響するかを調査することで、それらが肺の生理機能に与える影響を最初に理解することができます。さらに、これらの製品の長期的な影響に関する懸念は、肺だけでなく他の臓器にも及びます。例えば、THCベイプへの強力な曝露が脳に与える慢性的な影響については、まだよくわかっていません。しかし、慢性的なTHCへの曝露は、認知障害、依存症、および脳の構造的変化に関連しています40,41,42,43。さらに、これらの製品が若者の間で人気があることを考えると、脳の発達に対する潜在的な影響は調査が必要です。大麻市場が成長を続け、新製品の安全性を調査するための研究が必要になるため、これらのエンドポイントの追求は重要になります。これは、大麻の影響についての理解を深め、世界中の何百万人もの大麻消費者の安全を確保するのに役立つため、非常に重要です。
開示事項
著者は、この作品に関連する利益相反が開示されていないことを宣言します。
謝辞
この研究は、カナダ衛生研究所(CIHR)のプロジェクト助成金162273の支援を受けました。CJBは、Fonds de Recherche du Québec -Santé(FRQS)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402-5G | Avertin |
| inExpose | SCIREQ | sales@scireq.com | www.scireq.com |
| Microtainer Serum Separator Tubes | BD | 365967 | |
| Pax Era Vape Pen | PAX | Purchased from Ontario Cannabis Store | |
| Pineapple Express Pax Pod | Good Supply | Purchased from Ontario Cannabis Store | |
| SoftRestraints | SCIREQ | IX-XN1-SR-AL | www.scireq.com |
| THC Forensic ELISA Kit | Neogen | 131019 |
参考文献
- Spindle, T. R., et al. Acute Effects of Smoked and Vaporized Cannabis in Healthy Adults Who Infrequently Use Cannabis: A Crossover Trial. JAMA Netw Open. 1 (7), e184841-e184841 (2018).
- Morean, M. E., Kong, G., Camenga, D. R., Cavallo, D. A., Krishnan-Sarin, S. High School Students' Use of Electronic Cigarettes to Vaporize Cannabis. Pediatrics. 136 (4), 611-616 (2015).
- Russell, C., Rueda, S., Room, R., Tyndall, M., Fischer, B. Routes of administration for cannabis use - basic prevalence and related health outcomes: A scoping review and synthesis. Int J Drug Policy. 52, 87-96 (2018).
- Lazarjani, M. P., Young, O., Kebede, L., Seyfoddin, A. Processing and extraction methods of medicinal cannabis: a narrative review. J Cannabis Res. 3 (1), 32(2021).
- Jones, C. B., Hill, M. L., Pardini, D. A., Meier, M. H. Prevalence and correlates of vaping cannabis in a sample of young adults. Psychol Addict Behav. 30 (8), 915-921 (2016).
- 2023–24 Departmental Plan: Health Canada. , https://www.canada.ca/en/health-canada/corporate/transparency/corporate-management-reporting/report-plans-priorities/2023-2024-departmental-plan.html (2023).
- Geweda, M. M., et al. Evaluation of dispensaries' cannabis flowers for accuracy of labeling of cannabinoids content. J Cannabis Res. 6 (1), 11(2024).
- Meehan-Atrash, J., Rahman, I. Cannabis Vaping: Existing and Emerging Modalities, Chemistry, and Pulmonary Toxicology. Chem Res Toxicol. 34 (10), 2169-2179 (2021).
- Van der Kooy, F., Pomahacova, B., Verpoorte, R. Cannabis smoke condensate I: the effect of different preparation methods on tetrahydrocannabinol levels. Inhal Toxicol. 20 (9), 801-804 (2008).
- Rosenberg, E. C., Patra, P. H., Whalley, B. J. Therapeutic effects of cannabinoids in animal models of seizures, epilepsy, epileptogenesis, and epilepsy-related neuroprotection. Epilepsy Behav. 70 (Pt B), 319-327 (2017).
- National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division. The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research. , (2017).
- Been, T., et al. Chronic low-level JUUL aerosol exposure causes pulmonary immunologic, transcriptomic, and proteomic changes. Faseb J. 37 (2), e22732(2023).
- Been, T., et al. Differential impact of JUUL flavors on pulmonary immune modulation and oxidative stress responses in male and female mice. Arch Toxicol. 96 (6), 1783-1798 (2022).
- Caruana, V., et al. Chronic exposure to E-cigarette aerosols potentiates atherosclerosis in a sex-dependent manner. Toxicol Appl Pharmacol. 492, 117095(2024).
- Paoli, S., Eidelman, D. H., Mann, K. K., Baglole, C. Sex-specific alterations in pulmonary metabolic, xenobiotic and lipid signalling pathways after e-cigarette aerosol exposure during adolescence in mice. BMJ Open Respir Res. 11 (1), e002423(2024).
- Lamb, T., Muthumalage, T., Meehan-Atrash, J., Rahman, I. Nose-Only Exposure to Cherry- and Tobacco-Flavored E-Cigarettes Induced Lung Inflammation in Mice in a Sex-Dependent Manner. Toxics. 10 (8), 471(2022).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biol. 37, 101758(2020).
- Gazarov, E. A., et al. Pharmacokinetics of delta-9-tetrahydrocannabinol following acute cannabis smoke exposure in mice; effects of sex, age, and strain. Front Pharmacol. 14, 1227220(2023).
- Haidar, Z., Traboulsi, H., Eidelman, D. H., Baglole, C. J. Differential inflammatory profile in the lungs of mice exposed to cannabis smoke with varying THC:CBD ratio. Arch Toxicol. 97 (7), 1963-1978 (2023).
- Behar, R. Z., Hua, M., Talbot, P. Puffing topography and nicotine intake of electronic cigarette users. PLoS One. 10 (2), e0117222(2015).
- Leavens, E. L. S., et al. electronic cigarette use patterns, other tobacco product use, and reasons for use among ever users: Results from a convenience sample. Addict Behav. 95, 178-183 (2019).
- Huestis, M. A. Human cannabinoid pharmacokinetics. Chem Biodivers. 4 (8), 1770-1804 (2007).
- Hložek, T., et al. Pharmacokinetic and behavioural profile of THC, CBD, and THC+CBD combination after pulmonary, oral, and subcutaneous administration in rats and confirmation of conversion in vivo of CBD to THC. Eur Neuropsychopharmacol. 27 (12), 1223-1237 (2017).
- Nasrin, S., Watson, C. J. W., Perez-Paramo, Y. X., Lazarus, P. Cannabinoid Metabolites as Inhibitors of Major Hepatic CYP450 Enzymes, with Implications for Cannabis-Drug Interactions. Drug Metab Dispos. 49 (12), 1070-1080 (2021).
- Hartman, R. L., et al. Controlled Cannabis Vaporizer Administration: Blood and Plasma Cannabinoids with and without Alcohol. Clin Chem. 61 (6), 850-869 (2015).
- Newmeyer, M. N., et al. Free and Glucuronide Whole Blood Cannabinoids' Pharmacokinetics after Controlled Smoked, Vaporized, and Oral Cannabis Administration in Frequent and Occasional Cannabis Users: Identification of Recent Cannabis Intake. Clin Chem. 62 (12), 1579-1592 (2016).
- Schwope, D. M., Karschner, E. L., Gorelick, D. A., Huestis, M. A. Identification of recent cannabis use: whole-blood and plasma free and glucuronidated cannabinoid pharmacokinetics following controlled smoked cannabis administration. Clin Chem. 57 (10), 1406-1414 (2011).
- Sharma, P., Murthy, P., Bharath, M. M. Chemistry, metabolism, and toxicology of cannabis: clinical implications. Iran J Psychiatry. 7 (4), 149-156 (2012).
- Metna-Laurent, M., Mondésir, M., Grel, A., Vallée, M., Piazza, P. V. Cannabinoid-Induced Tetrad in Mice. Curr Protoc Neurosci. 80, 9.59.1-9.59.10 (2017).
- Soo, J. C., Monaghan, K., Lee, T., Kashon, M., Harper, M. Air sampling filtration media: Collection efficiency for respirable size-selective sampling. Aerosol Sci Technol. 50 (1), 76-87 (2016).
- Tang, Z. J., et al. Cytotoxicity and toxicoproteomic analyses of human lung epithelial cells exposed to extracts of atmospheric particulate matters on PTFE filters using acetone and water. Ecotoxicol Environ Safety. 191, 110223(2020).
- Puah, P. Y., et al. Extractable impurities from fluoropolymer-based membrane filters - interference in high-throughput, untargeted analysis. RSC Adv. 9 (55), 31918-31927 (2019).
- Berrada-Gomez, M. P., Bui, B., Bondarenko, H., Ferret, P. J. Particle size distribution in the evaluation of the inhalation toxicity of cosmetic spray products. Reg Toxicol Pharmacol. 139, 105359(2023).
- Hammer, T., Gao, H., Pan, Z., Wang, J. Relationship between Aerosols Exposure and Lung Deposition Dose. Aerosol Air Quality Res. 20 (5), 1083-1093 (2020).
- Asgharian, B., et al. Computational modeling of nanoscale and microscale particle deposition, retention and dosimetry in the mouse respiratory tract. Inhal Toxicol. 26 (14), 829-842 (2014).
- Chou, L. T., et al. Particle size matters: Discrepancies in the health risks posed by traditional cigarettes and e-cigarettes in mice and humans. J Hazardous Mater Lett. 4, 100088(2023).
- Cheng, Y. S., et al. Exposing Animals to Oxidant Gases. Proc Am Thorac Society. 7 (4), 264-268 (2010).
- Chen, L. C., Lippmann, M. Inhalation Toxicology Methods: The Generation and Characterization of Exposure Atmospheres and Inhalational Exposures. Curr Protoc Toxicol. 63 (1), 24.24.21-24.24.23 (2015).
- Wong, B. A. Inhalation Exposure Systems: Design, Methods and Operation. Toxicologic Pathol. 35 (1), 3-14 (2007).
- Cousijn, J., et al. Grey matter alterations associated with cannabis use: results of a VBM study in heavy cannabis users and healthy controls. Neuroimage. 59 (4), 3845-3851 (2012).
- Filbey, F. M., Schacht, J. P., Myers, U. S., Chavez, R. S., Hutchison, K. E. Marijuana craving in the brain. Proc Natl Acad Sci U S A. 106 (31), 13016-13021 (2009).
- Sneider, J. T., Gruber, S. A., Rogowska, J., Silveri, M. M., Yurgelun-Todd, D. A. A preliminary study of functional brain activation among marijuana users during performance of a virtual water maze task. J Addict. 2013, 461029(2013).
- Gilman, J. M., et al. Cannabis use is quantitatively associated with nucleus accumbens and amygdala abnormalities in young adult recreational users. J Neurosci. 34 (16), 5529-5538 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved