Method Article
Desenvolvimento de um modelo pré-clínico de inalação para testar destilados de cannabis vaporizados
Neste Artigo
Resumo
Os cartuchos vape destilados de cannabis são dispositivos alimentados por bateria que aerossolizam extratos contendo altas concentrações de canabinóides. A ausência de modelos pré-clínicos estabelecidos para esses produtos cria desafios no estudo de seus efeitos fisiológicos. Para resolver essa lacuna, foi desenvolvido um modelo murino de inalação pré-clínico padronizado para destilados de cannabis vaporizados.
Resumo
Apesar de sua crescente popularidade, os produtos vape de cannabis permanecem pouco estudados. Os cartuchos vape de cannabis são usados com dispositivos alimentados por bateria que aerossolizam extratos de flores de cannabis contendo altas concentrações de canabinóides, como o THC. Esses tipos de produtos são comumente conhecidos como destilados de cannabis. A potência desses produtos apresenta desafios no estabelecimento de uma dosagem eficaz para estudos pré-clínicos. Atualmente, não existem modelos pré-clínicos estabelecidos e padronizados para testar a segurança e a eficácia desses produtos de maneira análoga aos padrões de uso humano. Assim, o regime de exposição ao destilado de cannabis in vivo necessário para atingir doses fisiologicamente relevantes em comparação com o que é alcançado em humanos permanece indeterminado. Para resolver essa lacuna, um modelo murino pré-clínico padronizado para inalação de destilados de cannabis vaporizados foi desenvolvido usando um sistema de entrega controlado por computador. Este protocolo detalha os procedimentos para administrar destilados de vape de cannabis usando uma topografia regimentada a camundongos por uma torre de exposição apenas de nariz. Métodos para monitorar os resultados comportamentais do camundongo pós-exposição e a utilização de um ELISA semiquantitativo para confirmar a entrega de THC na circulação sistêmica também são fornecidos. Este protocolo permitirá a investigação das respostas pulmonares e sistêmicas aos produtos destilados de cannabis por pesquisadores interessados em explorar o impacto do vaping de cannabis usando protocolos de entrega do mundo real, proporcionando assim uma oportunidade para uma rigorosa avaliação terapêutica e de segurança.
Introdução
Com a legalização da cannabis ocorrendo em todo o mundo, o uso de cannabis está aumentando. Mudanças significativas no mercado de varejo de cannabis não estão apenas aumentando a acessibilidade, mas também estão impulsionando o desenvolvimento e a produção de novos tipos de produtos de cannabis para consumo1. Os vaporizadores, que aquecem os produtos de cannabis sem combustão, estão se tornando um método de consumo cada vez mais popular 2,3. Os vaporizadores incluem cartuchos de vape de cannabis que utilizam a tecnologia de cigarro eletrônico para aquecer e aerossolizar destilados de cannabis. Esses destilados são extraídos da flor de Cannabis sativa para produzir um líquido viscoso com altas concentrações de canabinóides, como o Δ 9-tetrahidrocanabinol (THC), o principal componente psicoativo da cannabis4. Esses dispositivos são fáceis de usar e ocultar, tornando-os atraentes para usuários iniciantes5. No Canadá, onde a cannabis foi legalizada para fins recreativos em 2018, os dados da pesquisa obtidos mostram um aumento na aceitabilidade social percebida da cannabis vaping, bem como aumentos significativos no uso de caneta/cartucho vape de cannabis6.
Os consumidores de cannabis podem acreditar que vaporizar destilados de cannabis é mais seguro do que fumar a flor seca na forma de um baseado, contribuindo para sua crescente popularidade2. Apesar da possível redução na exposição a produtos de combustão inalada ao usar destilados vape de cannabis, esses produtos podem não ser isentos de riscos. Uma preocupação é a exposição a altas doses de canabinóides presentes em cartuchos de vape comerciais. A flor de cannabis seca pode ser comprada com até 36% de THC, enquanto a concentração de THC em cartuchos de destilado de cannabis pode chegar a 96%7. Os aerossóis dos cartuchos de destilado de cannabis contêm aproximadamente o dobro das concentrações de THC em comparação com a fumaça de cannabis 8,9. Ainda não se sabe quais efeitos essas concentrações elevadas de THC têm no trato respiratório. Além disso, as altas concentrações de THC oferecem desafios no estabelecimento de uma dosagem eficaz para estudos murinos pré-clínicos, pois a exposição excessiva ao THC em si pode ter efeitos adversos em camundongos10. É essencial começar com níveis mínimos de exposição e aumentar gradualmente até que doses fisiologicamente relevantes sejam alcançadas para garantir que essas exposições sejam relevantes.
Até o momento, não há estudos examinando os efeitos potenciais dos destilados de cannabis vaporizados inalados. Isso se deve, em parte, à falta de modelos pré-clínicos padronizados existentes. Os desafios de pesquisa são agravados em regiões onde esses produtos permanecem ilegais, levando os pesquisadores a produzir destilados internos que podem não refletir com precisão os produtos comerciais11. Além disso, a ampla gama de produtos disponíveis complica a padronização. Para preencher essa lacuna, este estudo foi iniciado usando produtos legais e comercialmente disponíveis acessíveis aos consumidores canadenses. Os produtos e dispositivos listados como mais vendidos na Ontario Cannabis Store foram selecionados para uso. O objetivo deste protocolo é estabelecer um regime de exposição murina fácil de usar que forneça doses de THC comparáveis aos níveis humanos fisiologicamente relevantes, criando uma base para os pesquisadores realizarem estudos adicionais sobre os efeitos respiratórios e sistêmicos dos destilados de cannabis vaporizados.
Protocolo
Os procedimentos abaixo foram aprovados pelo Comitê Institucional de Cuidados com Animais da Universidade McGill (Protocolo Número 8087) de acordo com as diretrizes do Conselho Canadense de Cuidados com Animais (CCAC).
1. Preparação do equipamento
NOTA: O protocolo a seguir se aplica ao sistema SCIREQ inExpose suportado pelo software flexiWare 8.
- Garanta a montagem correta de todos os componentes do sistema para se parecer com o example mostrado na Figura 1A. Certifique-se de que haja um tubo fechado inserido na câmara tampão da bomba de sopro para evitar vazamento do sistema, conforme mostrado na Figura 1B.
- Ligue o sistema e inicie o software. Selecione o módulo Sessões de Experimentação .
- Selecione Novo estudo e defina os grupos experimentais e os sujeitos a serem estudados. Selecione o modelo experimental que corresponde ao regime de exposição desejado.
- Na janela Propriedades da sessão, preencha a seção Operador para rastrear o uso do equipamento.
- Para realizar a calibração, selecione o canal desejado e siga as etapas descritas no software operacional.
- (Etapa crítica) Para realizar o teste de fluxo do sistema, selecione a bomba desejada e siga as etapas descritas no software operacional. Verifique se o fluxo do sistema está direcionado para o rotâmetro. Esta calibração é para garantir que não haja vazamento no sistema. Se o sistema não passar no teste de fluxo, limpe os componentes e a tubulação antes de tentar novamente o teste.
- Cancele os prompts para iniciar a gravação de dados, a menos que esteja pronto para iniciar o experimento.
2. Criação de perfis Puff
- Crie um perfil de fluxo de polarização de 2 L/min para garantir a aeração adequada dos sujeitos durante todo o experimento. Para fazer isso, consulte a Technote 037: Um guia para criar perfis em um documento externo disponível no fabricante.
- Crie um puff para perfis de cigarro eletrônico. Para fazer isso, consulte a Technote 037. No protocolo aqui descrito, a nota técnica foi modificada para fornecer um volume de sopro de 78 mL, com duração de sopro de 2,4 s e 1, 2 ou 4 sopros / min, conforme publicado anteriormente 12,13,14,15,16,17.
3. Preparação do animal
- Use camundongos C57BL/6 machos e fêmeas, com idade entre 10 e 12 semanas e pesando aproximadamente 20 a 30 g para este protocolo. Aclimate os ratos ao sistema gradualmente ao longo de 3 dias.
- Comece a aclimatação com a colocação dos camundongos dentro da contenção macia e, em seguida, inicie o fluxo de polarização a 2 L / min com ar ambiente durante um período que corresponda à duração de sua exposição experimental. Use um período de aclimatação de 10 min, 20 min ou 30 min para corresponder às exposições experimentais descritas aqui. Essas medidas foram tomadas para minimizar quaisquer impactos induzidos pelo estresse nos resultados de interesse.
- Para colocar os animais em restrições suaves, retraia totalmente o componente de malha, segure toda a restrição na frente do animal e espere que o animal se mova para o componente do êmbolo.
- Verifique se o nariz do animal está visível no componente do êmbolo da contenção e, em seguida, prenda um clipe de fichário logo atrás do animal para evitar qualquer movimento para fora da contenção.
NOTA: Animais mais jovens e menores podem manobrar mais facilmente dentro da contenção, por isso é essencial verificar se o nariz permanece visível fora do componente do êmbolo.
- Ao trabalhar com camundongos de diferentes sexos ou genótipos, considere o uso de clipes de fichário codificados por cores para distinguir entre os animais.
4. Exposição dos animais
- Coloque seis animais contidos na torre do sistema de exposição apenas para o nariz e inicie o fluxo de polarização a 2 L/min com ar ambiente para garantir fluxo de ar suficiente.
- Na área de tarefas no lado direito da tela, clique com o botão direito do mouse no Perfil de cigarro eletrônico criado e selecione Propriedades da tarefa.
- Em Frequência de sopro, insira a frequência desejada para iniciar um sopro. Por exemplo, um regime de 2 puffs/min requer uma entrada de 30 s. Clique em OK e, em seguida, em Sim quando o software solicitar a confirmação dessa alteração. Para salvar esse regime de puff para uso futuro, no final da sessão, siga as instruções para salvá-lo como um modelo.
- Quando estiver pronto para realizar a exposição, clique duas vezes no perfil de cigarro eletrônico criado e agora modificado. Certifique-se de iniciar um cronômetro para rastrear a duração da exposição.
- Para avaliar a dose em comprimentos de exposição crescentes, execute exposições de 10 min, 20 min e 30 min a 1 baforada/min. Em seguida, para avaliar o aumento da intensidade da exposição, mantenha uma duração de exposição de 10 minutos e aumente a frequência de inalação para 1 inalação/min, 2 inalações/min e 4 inalações/min.
- Após a conclusão da exposição, reiniciar o fluxo de polarização enquanto os animais regressam às suas gaiolas.
- Para remover os animais das restrições, solte o clipe de fichário e retraia totalmente a malha para o êmbolo, permitindo que o animal saia da contenção por conta própria. Se o animal permanecer na contenção, puxe suavemente sua cauda para sinalizar que ele está livre para se mover para trás para fora da contenção.
5. Teste de hipolocomoção
- Imediatamente após a exposição, transfira os animais para um conjunto de testes comportamentais para realizar um teste de campo aberto usando o software ANY-Maze. Para realizar registros de linha de base do comportamento animal, certifique-se de que eles sejam expostos apenas ao fluxo de viés.
- Certifique-se de que a sala esteja bem iluminada e minimize os níveis de ruído para evitar estresse desnecessário nos animais, pois isso pode influenciar seu comportamento.
- Abra o software e selecione Novo experimento vazio. Na guia Protocolo na parte superior da tela, selecione Adicionar item e clique em Nova fonte de vídeo na lista suspensa para adicionar a fonte da câmera a ser usada para o experimento.
- No menu do lado esquerdo da tela, na seção Rastreamento, selecione Aparelho para definir o campo aberto em que o animal será colocado.
- Na guia Protocolo, selecione a ferramenta Retângulo para desenhar a área de campo aberto e inserir suas dimensões no software.
- No menu do lado esquerdo da tela, na seção Rastreamento, selecione Cor do animal para especificar se o animal é mais claro ou mais escuro que o plano de fundo. Essas informações ajudam o software a rastrear com precisão o movimento do animal.
- No menu à esquerda, na seção Teste, selecione Estágios para especificar a duração do teste para o experimento. Insira uma duração de teste de 60 s.
- Na guia Experimento, defina o tratamento experimental e o número de animais por tratamento.
- Agora, para realizar o teste, clique na aba Testes . Coloque o animal no campo aberto e clique no botão verde Play acima da gravação do campo aberto para iniciar o teste.
- Após a conclusão do teste, no menu à esquerda, na seção Análise e Resultados, selecione Resultados, Relatórios e Dados e selecione Distância Total percorrida para incluir essas informações no relatório.
- Para gerar o relatório, clique na guia Resultados e exporte os dados no formato desejado.
6. Coleta de amostras de soro
- Aos 30 minutos após a exposição, anestesiar os animais com uma injeção intraperitoneal de 250 mg/kg de Avertin (2,2,2-tribromoetanol). Para garantir a anestesia adequada, estimule o reflexo de retirada do pedal beliscando a pele entre os dedos dos pés usando uma pinça romba. Uma vez que o reflexo tenha desaparecido completamente, o animal é anestesiado profundamente o suficiente para ser sacrificado por exsanguinação por punção cardíaca. O ponto de tempo de 30 minutos é selecionado para atingir as concentrações séricas máximas de THC-COOH pós-exposição18.
- Colete sangue por punção cardíaca em tubos de coleta de sangue e, em seguida, centrifugue a 10.000 x g por 10 min para separar o soro.
- Use amostras de soro para realizar um ELISA forense de THC para quantificar os níveis de THC-COOH de acordo com as instruções do fabricante e conforme publicado anteriormente19.
Resultados
O objetivo inicial era determinar um regime de exposição que pudesse fornecer níveis fisiologicamente relevantes de THC ao sangue em comparação com os humanos. Assim, um componente-chave para selecionar os parâmetros de exposição foi usar características que imitassem os padrões de uso humano20,21. Camundongos C57BL/6 machos e fêmeas foram expostos a um Pineapple Express Pax Era Pod contendo ~85% de THC por 10 min, 20 min e 30 min a 1 puff/min com um volume de sopro de 78 mL e duração de sopro de 2,4 s. Os camundongos foram sacrificados 30 minutos após a exposição para medir os níveis de THC-COOH. O THC-COOH é um metabólito secundário do THC22. Em camundongos, o THC sérico atinge o pico imediatamente após a exposição e é subsequentemente hidroxilado pelas enzimas CYP450 para formar 11-OH-THC, que é rapidamente oxidado em THC-COOH 23,24. O THC-COOH então se acumula no soro, atingindo concentrações máximas aproximadamente 30 minutos após a exposição, fornecendo um marcador confiável para detecção18. As concentrações séricas de THC-COOH estavam abaixo do limite de detecção em camundongos expostos ao ar, mas aumentaram significativamente para aproximadamente 11,2 ng/mL, 15,2 ng/mL e 16,1 ng/mL em camundongos expostos ao produto vape THC por 10 min, 20 min e 30 min, respectivamente (Figura 2A). Em seguida, a intensidade das exposições foi variada aumentando o número de inalações por minuto, mantendo todos os outros parâmetros iguais durante um tempo de exposição de 10 minutos. Aqui, o THC-COOH sérico aumentou significativamente para aproximadamente 11,4 ng/mL, 21,8 ng/mL e 25,2 ng/mL em camundongos expostos ao produto vape THC em 1, 2 e 4 inalações/min, respectivamente (Figura 2B). Os níveis de THC-COOH alcançados nos regimes de exposição de 10 min, 2 puffs/min e 4 puffs/min aproximam-se dos níveis de THC-COOH encontrados no soro de usuários humanos de cannabis pós-inalação 22,25,26,27,28.
Depois de identificar um regime de exposição que fornecia doses de canabinóides fisiologicamente relevantes a camundongos, o próximo passo foi confirmar que esse regime também provocaria resultados comportamentais significativos. Para avaliar isso, foi realizado um teste de hipolocomoção, pois é um componente do ensaio de tétrade comumente usado para avaliar as respostas comportamentais ao THC em roedores29. As medições de linha de base em camundongos expostos apenas ao fluxo de ar polarizados resultaram em um deslocamento de 3,41 m. Após a exposição a 10 min de produto vape THC a 2 baforadas/min, o deslocamento foi significativamente reduzido para 0,29 m, e a 4 baforadas/min, foi reduzido ainda mais para 0,05 m (Figura 3). Não houve diferença significativa no deslocamento dos camundongos entre as exposições de 2 inalações/min e 4 inalações/min. Assim, o regime de exposição de 2 inalações/min por 10 min foi selecionado para uso em estudos futuros porque tende a uma recuperação mais suave para os camundongos pós-exposição, continuando a fornecer doses fisiologicamente relevantes.

Figura 1: Representação do sistema. (A) Certifique-se de que o equipamento esteja montado corretamente, incluindo o bocal apropriado para o dispositivo específico, tubulação limpa e direção precisa do fluxo do sistema em direção à torre de exposição somente do nariz. (B) Certifique-se de que a câmara tampão contém um tubo fechado para evitar vazamentos, conforme designado pela seta na vista aérea. Clique aqui para ver uma versão maior desta figura.
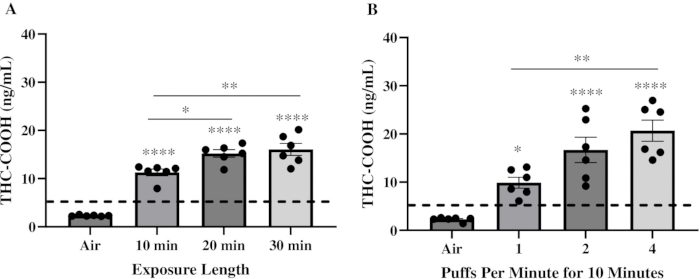
Figura 2: Níveis séricos de THC-COOH após exposição ao produto vape THC. Um total de seis camundongos foram expostos a um produto vape THC contendo 85% de THC. Aos 30 minutos após a exposição, o soro foi coletado para quantificar os níveis de THC-COOH por THC ELISA. Os gráficos representam os níveis de THC-COOH após uma exposição de (A) 10, 20 ou 30 minutos a 1 baforada/min ou (B) após uma exposição de 10 minutos a 1, 2 ou 4 baforadas/min. Os resultados são expressos como média ± SEM. Os pontos de dados representam camundongos individuais. A linha pontilhada representa o limite de detecção. Uma análise de variância (ANOVA) de uma via foi usada para determinar a significância, com diferenças entre os grupos examinadas usando os testes de comparação múltipla de Tukey (*p = 0,0348; **p = 0,0022; **** p < 0,0001 em comparação com camundongos expostos ao ar). Clique aqui para ver uma versão maior desta figura.

Figura 3: Teste de hipolocomoção após exposição ao produto vape THC. Um total de seis camundongos foram expostos ao fluxo de polarização do ar por 10 minutos e depois transferidos para um campo aberto para realizar um teste de hipolocomoção. Após a conclusão das medições basais, os camundongos foram expostos a uma exposição de 10 minutos a 2 inalações/min ou 4 inalações/min. Um segundo teste de hipolocomoção foi realizado imediatamente após a exposição. A duração do teste foi de 60 s. Os resultados são expressos como média ± SEM. Os pontos de dados representam camundongos individuais. Uma análise de variância (ANOVA) de uma via foi usada para determinar a significância, com diferenças entre os grupos examinadas usando os testes de comparação múltipla de Tukey (****p < 0,0001). Clique aqui para ver uma versão maior desta figura.
Discussão
Os produtos vape destilados de cannabis contêm altas concentrações de canabinóides, incluindo até 85% de THC para o produto utilizado neste protocolo. Como a flor de cannabis atualmente atinge apenas 36% de THC7, a potência dos produtos vape destilados de cannabis oferece desafios ao desenvolver um modelo de exposição por inalação. O objetivo era determinar um regime de exposição que pudesse efetivamente fornecer doses relevantes de canabinóides a camundongos sem causar efeitos adversos de níveis excessivos de exposição ao THC.
A ampla gama de produtos de cannabis disponíveis para compra complica as comparações entre os estudos; no entanto, a seleção de produtos com uma potência semelhante de THC promove a reprodutibilidade. Embora os parâmetros de sopro sejam adaptáveis a vários produtos, o uso de produtos de menor potência pode exigir exposições prolongadas para garantir a reprodutibilidade, juntamente com a verificação da dose sistêmica administrada. Além disso, é importante notar que este estudo expôs seis camundongos simultaneamente. Por exemplo, uma exposição de 10 minutos a 2 inalações/min é distribuída por seis camundongos, o que significa que alterar o número de camundongos por sessão de exposição pode afetar a dose individual recebida. A comunicação transparente do número de animais por exposição é essencial em estudos futuros com equipamento semelhante, uma vez que pode ter um impacto significativo na dose efetiva recebida por cada animal e, consequentemente, nos resultados globais do estudo. Além disso, apesar dos esforços para desenvolver perfis de sopro que reproduzam os padrões de uso humano, é importante observar que os camundongos expostos não inalam totalmente cada sopro produzido. Uma parte considerável do aerossol é liberada no ambiente circundante. Portanto, verificar a dose administrada na circulação sistêmica após a exposição é fundamental para a interpretação final dos dados. Além disso, técnicas de monitoramento de aerossóis, como a incorporação de filtros especializados de politetrafluoretileno (PFTE) dentro do sistema de exposição para capturar partículas de aerossol, podem ser utilizadas para avaliar a deposiçãode partículas 30,31. Após a exposição, o conteúdo de THC depositado nesses filtros pode ser extraído e quantificado usando cromatografia líquida-espectrometria de massa (LC-MS) 32 . Além disso, o tamanho das partículas pode ser medido usando difração a laser33. Ao integrar dados sobre concentração de aerossóis, tamanho de partícula e parâmetros respiratórios murinos, como volume corrente e frequência respiratória, as doses teóricas inaladas podem ser estimadas com maior precisão usando modelos de dosimetria computacional 34,35,36.
Em estudos de inalação, duas modalidades de exposição primária são usadas: exposições de corpo inteiro e apenas nariz. Nas exposições de corpo inteiro, os animais não são restringidos, permitindo que toda a superfície corporal entre em contato com a atmosfera de teste37. Uma desvantagem deste método é o potencial de os agentes de ensaio se depositarem na pele, que pode ser ingerida quando o animal se limpa, introduzindo uma via de exposição não intencional38. Isso pode ser evitado usando uma torre de inalação somente nariz. No entanto, as exposições apenas do nariz também têm limitações. A contenção de animais pode aumentar o estresse, e certas restrições podem prejudicar a termorregulação39. Essa abordagem também pode se tornar trabalhosa ao trabalhar com grupos maiores de animais. Nos esforços para mitigar esses fatores e evitar resultados confusos, é essencial colocar os animais controle em restrições dentro da torre de exposição, recebendo apenas fluxo de ar polarizado.
A proposta aqui é uma dose de exposição padronizada que atinge níveis fisiologicamente relevantes de canabinóides em comparação com os humanos. Essa medição de linha de base estabelece uma base para os pesquisadores explorarem os impactos de doses de exposição mais baixas e mais altas, modificando a frequência de inalação e a duração da exposição para determinar a dose efetiva desejada para necessidades experimentais específicas. Estudos futuros visam comparar vários produtos e dispositivos comerciais e avaliar seus efeitos respiratórios usando o protocolo aqui descrito. Dado que os pesquisadores respiratórios freqüentemente usam camundongos C57BL / 6 e Balb / c, também é essencial determinar se as descobertas apresentadas aqui são aplicáveis a camundongos Balb / c para orientar pesquisas futuras. Além disso, a dose proposta pelo protocolo é adequada para estudos prolongados que investigam os efeitos agudos ou crônicos dos produtos vape destilados de cannabis, proporcionando uma oportunidade para uma avaliação rigorosa da segurança. Dado que a via de exposição é a inalação, é essencial entender completamente os efeitos desses produtos nos pulmões. Investigar como as exposições crônicas influenciam a mecânica pulmonar, a função das células imunes residentes no tecido e a suscetibilidade a doenças pode fornecer uma compreensão inicial de seu impacto na fisiologia pulmonar. Além disso, as preocupações com os efeitos a longo prazo desses produtos se estendem além dos pulmões para outros órgãos. Por exemplo, os efeitos crônicos da potente exposição ao vape de THC no cérebro permanecem pouco compreendidos; no entanto, a exposição crônica ao THC tem sido associada a comprometimento cognitivo, dependência e alterações estruturais no cérebro 40,41,42,43. Além disso, dada a popularidade desses produtos entre os jovens, seu impacto potencial no desenvolvimento do cérebro merece investigação. A busca por esses pontos finais será importante à medida que o mercado de cannabis continua a crescer e há necessidade de pesquisas para investigar a segurança de novos produtos. Isso é vital porque contribui para uma melhor compreensão dos efeitos da cannabis e ajuda a garantir a segurança de milhões de consumidores de cannabis em todo o mundo.
Divulgações
Os autores declaram não ter conflitos de interesse relacionados a este trabalho a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Canadian Institutes for Health Research (CIHR) Project Grant 162273. O CJB foi apoiado pelo Fonds de Recherche du Québec-Santé (FRQS).
Materiais
| Name | Company | Catalog Number | Comments |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402-5G | Avertin |
| inExpose | SCIREQ | sales@scireq.com | www.scireq.com |
| Microtainer Serum Separator Tubes | BD | 365967 | |
| Pax Era Vape Pen | PAX | Purchased from Ontario Cannabis Store | |
| Pineapple Express Pax Pod | Good Supply | Purchased from Ontario Cannabis Store | |
| SoftRestraints | SCIREQ | IX-XN1-SR-AL | www.scireq.com |
| THC Forensic ELISA Kit | Neogen | 131019 |
Referências
- Spindle, T. R., et al. Acute Effects of Smoked and Vaporized Cannabis in Healthy Adults Who Infrequently Use Cannabis: A Crossover Trial. JAMA Netw Open. 1 (7), e184841-e184841 (2018).
- Morean, M. E., Kong, G., Camenga, D. R., Cavallo, D. A., Krishnan-Sarin, S. High School Students' Use of Electronic Cigarettes to Vaporize Cannabis. Pediatrics. 136 (4), 611-616 (2015).
- Russell, C., Rueda, S., Room, R., Tyndall, M., Fischer, B. Routes of administration for cannabis use - basic prevalence and related health outcomes: A scoping review and synthesis. Int J Drug Policy. 52, 87-96 (2018).
- Lazarjani, M. P., Young, O., Kebede, L., Seyfoddin, A. Processing and extraction methods of medicinal cannabis: a narrative review. J Cannabis Res. 3 (1), 32 (2021).
- Jones, C. B., Hill, M. L., Pardini, D. A., Meier, M. H. Prevalence and correlates of vaping cannabis in a sample of young adults. Psychol Addict Behav. 30 (8), 915-921 (2016).
- . 2023–24 Departmental Plan: Health Canada Available from: https://www.canada.ca/en/health-canada/corporate/transparency/corporate-management-reporting/report-plans-priorities/2023-2024-departmental-plan.html (2023)
- Geweda, M. M., et al. Evaluation of dispensaries' cannabis flowers for accuracy of labeling of cannabinoids content. J Cannabis Res. 6 (1), 11 (2024).
- Meehan-Atrash, J., Rahman, I. Cannabis Vaping: Existing and Emerging Modalities, Chemistry, and Pulmonary Toxicology. Chem Res Toxicol. 34 (10), 2169-2179 (2021).
- Van der Kooy, F., Pomahacova, B., Verpoorte, R. Cannabis smoke condensate I: the effect of different preparation methods on tetrahydrocannabinol levels. Inhal Toxicol. 20 (9), 801-804 (2008).
- Rosenberg, E. C., Patra, P. H., Whalley, B. J. Therapeutic effects of cannabinoids in animal models of seizures, epilepsy, epileptogenesis, and epilepsy-related neuroprotection. Epilepsy Behav. 70 (Pt B), 319-327 (2017).
- National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division. . The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research. , (2017).
- Been, T., et al. Chronic low-level JUUL aerosol exposure causes pulmonary immunologic, transcriptomic, and proteomic changes. Faseb J. 37 (2), e22732 (2023).
- Been, T., et al. Differential impact of JUUL flavors on pulmonary immune modulation and oxidative stress responses in male and female mice. Arch Toxicol. 96 (6), 1783-1798 (2022).
- Caruana, V., et al. Chronic exposure to E-cigarette aerosols potentiates atherosclerosis in a sex-dependent manner. Toxicol Appl Pharmacol. 492, 117095 (2024).
- Paoli, S., Eidelman, D. H., Mann, K. K., Baglole, C. Sex-specific alterations in pulmonary metabolic, xenobiotic and lipid signalling pathways after e-cigarette aerosol exposure during adolescence in mice. BMJ Open Respir Res. 11 (1), e002423 (2024).
- Lamb, T., Muthumalage, T., Meehan-Atrash, J., Rahman, I. Nose-Only Exposure to Cherry- and Tobacco-Flavored E-Cigarettes Induced Lung Inflammation in Mice in a Sex-Dependent Manner. Toxics. 10 (8), 471 (2022).
- Wang, J., et al. Protein thiol oxidation in the rat lung following e-cigarette exposure. Redox Biol. 37, 101758 (2020).
- Gazarov, E. A., et al. Pharmacokinetics of delta-9-tetrahydrocannabinol following acute cannabis smoke exposure in mice; effects of sex, age, and strain. Front Pharmacol. 14, 1227220 (2023).
- Haidar, Z., Traboulsi, H., Eidelman, D. H., Baglole, C. J. Differential inflammatory profile in the lungs of mice exposed to cannabis smoke with varying THC:CBD ratio. Arch Toxicol. 97 (7), 1963-1978 (2023).
- Behar, R. Z., Hua, M., Talbot, P. Puffing topography and nicotine intake of electronic cigarette users. PLoS One. 10 (2), e0117222 (2015).
- Leavens, E. L. S., et al. electronic cigarette use patterns, other tobacco product use, and reasons for use among ever users: Results from a convenience sample. Addict Behav. 95, 178-183 (2019).
- Huestis, M. A. Human cannabinoid pharmacokinetics. Chem Biodivers. 4 (8), 1770-1804 (2007).
- Hložek, T., et al. Pharmacokinetic and behavioural profile of THC, CBD, and THC+CBD combination after pulmonary, oral, and subcutaneous administration in rats and confirmation of conversion in vivo of CBD to THC. Eur Neuropsychopharmacol. 27 (12), 1223-1237 (2017).
- Nasrin, S., Watson, C. J. W., Perez-Paramo, Y. X., Lazarus, P. Cannabinoid Metabolites as Inhibitors of Major Hepatic CYP450 Enzymes, with Implications for Cannabis-Drug Interactions. Drug Metab Dispos. 49 (12), 1070-1080 (2021).
- Hartman, R. L., et al. Controlled Cannabis Vaporizer Administration: Blood and Plasma Cannabinoids with and without Alcohol. Clin Chem. 61 (6), 850-869 (2015).
- Newmeyer, M. N., et al. Free and Glucuronide Whole Blood Cannabinoids' Pharmacokinetics after Controlled Smoked, Vaporized, and Oral Cannabis Administration in Frequent and Occasional Cannabis Users: Identification of Recent Cannabis Intake. Clin Chem. 62 (12), 1579-1592 (2016).
- Schwope, D. M., Karschner, E. L., Gorelick, D. A., Huestis, M. A. Identification of recent cannabis use: whole-blood and plasma free and glucuronidated cannabinoid pharmacokinetics following controlled smoked cannabis administration. Clin Chem. 57 (10), 1406-1414 (2011).
- Sharma, P., Murthy, P., Bharath, M. M. Chemistry, metabolism, and toxicology of cannabis: clinical implications. Iran J Psychiatry. 7 (4), 149-156 (2012).
- Metna-Laurent, M., Mondésir, M., Grel, A., Vallée, M., Piazza, P. V. Cannabinoid-Induced Tetrad in Mice. Curr Protoc Neurosci. 80, 9.59.1-9.59.10 (2017).
- Soo, J. C., Monaghan, K., Lee, T., Kashon, M., Harper, M. Air sampling filtration media: Collection efficiency for respirable size-selective sampling. Aerosol Sci Technol. 50 (1), 76-87 (2016).
- Tang, Z. J., et al. Cytotoxicity and toxicoproteomic analyses of human lung epithelial cells exposed to extracts of atmospheric particulate matters on PTFE filters using acetone and water. Ecotoxicol Environ Safety. 191, 110223 (2020).
- Puah, P. Y., et al. Extractable impurities from fluoropolymer-based membrane filters - interference in high-throughput, untargeted analysis. RSC Adv. 9 (55), 31918-31927 (2019).
- Berrada-Gomez, M. P., Bui, B., Bondarenko, H., Ferret, P. J. Particle size distribution in the evaluation of the inhalation toxicity of cosmetic spray products. Reg Toxicol Pharmacol. 139, 105359 (2023).
- Hammer, T., Gao, H., Pan, Z., Wang, J. Relationship between Aerosols Exposure and Lung Deposition Dose. Aerosol Air Quality Res. 20 (5), 1083-1093 (2020).
- Asgharian, B., et al. Computational modeling of nanoscale and microscale particle deposition, retention and dosimetry in the mouse respiratory tract. Inhal Toxicol. 26 (14), 829-842 (2014).
- Chou, L. T., et al. Particle size matters: Discrepancies in the health risks posed by traditional cigarettes and e-cigarettes in mice and humans. J Hazardous Mater Lett. 4, 100088 (2023).
- Cheng, Y. S., et al. Exposing Animals to Oxidant Gases. Proc Am Thorac Society. 7 (4), 264-268 (2010).
- Chen, L. C., Lippmann, M. Inhalation Toxicology Methods: The Generation and Characterization of Exposure Atmospheres and Inhalational Exposures. Curr Protoc Toxicol. 63 (1), 24.24.21-24.24.23 (2015).
- Wong, B. A. Inhalation Exposure Systems: Design, Methods and Operation. Toxicologic Pathol. 35 (1), 3-14 (2007).
- Cousijn, J., et al. Grey matter alterations associated with cannabis use: results of a VBM study in heavy cannabis users and healthy controls. Neuroimage. 59 (4), 3845-3851 (2012).
- Filbey, F. M., Schacht, J. P., Myers, U. S., Chavez, R. S., Hutchison, K. E. Marijuana craving in the brain. Proc Natl Acad Sci U S A. 106 (31), 13016-13021 (2009).
- Sneider, J. T., Gruber, S. A., Rogowska, J., Silveri, M. M., Yurgelun-Todd, D. A. A preliminary study of functional brain activation among marijuana users during performance of a virtual water maze task. J Addict. 2013, 461029 (2013).
- Gilman, J. M., et al. Cannabis use is quantitatively associated with nucleus accumbens and amygdala abnormalities in young adult recreational users. J Neurosci. 34 (16), 5529-5538 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados