Method Article
Криосекция и иммуноокрашивание сетчатки мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан протокол подготовки криосекций сетчатки мыши и выполнения иммуноокрашивания фоторецепторов. Эта статья позволяет исследователям последовательно получать замороженные срезы сетчатки мыши с хорошо сохраненной морфологией и высококачественными результатами иммуноокрашивания.
Аннотация
Срез тканей и иммуногистохимия являются важными методами в гистологических и патологических исследованиях заболеваний сетчатки с использованием животных моделей. Эти методы позволяют детально изучить морфологию тканей и локализацию специфических белков в ткани, что дает ценную информацию о процессах и механизмах заболевания. Мыши являются наиболее широко используемой моделью для этой цели. Однако, поскольку глазные яблоки мышей маленькие, а сетчатка мышей является чрезвычайно нежной тканью, получение высококачественных срезов сетчатки и изображений иммуноокрашивания глазных яблок мышей, как правило, является сложной задачей. В этом исследовании описан усовершенствованный протокол криосекции сетчатки мышей и выполнения иммуногистохимии. Важным моментом этого протокола является покрытие глазного яблока слоем суперклея, который предотвращает деформацию глазных яблок в процессах удаления роговицы, экстракции и встраивания хрусталика. Этот шаг обеспечивает хорошее сохранение целостности морфологии сетчатки. В этом протоколе подчеркиваются важнейшие технические соображения и стратегии оптимизации для стабильного получения высококачественных срезов сетчатки и достижения отличных результатов иммуноокрашивания.
Введение
Криосекция и иммуногистохимия (ИГХ) являются незаменимыми методами в биомедицинских исследованиях, особенно для изучения сложных биологических структур, таких как сетчатка1. Эти передовые методологии являются неотъемлемой частью понимания сложного клеточного состава и молекулярной организации сетчатки. Они предоставляют исследователям возможность исследовать функциональность и патологию сетчатки на детальном уровне, предлагая идеи, которые имеют решающее значение для продвижения знаний в этой области.
Криосекция играет жизненно важную роль в поддержании морфологической целостности ткани сетчатки. Он гарантирует, что нежная структура сетчатки остается неповрежденной, что позволяет использовать срезы в последующих иммунофлуоресцентных исследованиях с высокой точностью и надежностью. По сравнению с другими методами, такими как встраивание парафина, криосекция имеет значительные преимущества, поскольку она лучше сохраняет как морфологию ткани, так и антигенность, что делает ее особенно подходящей для иммуногистохимическогоокрашивания. Метод замороженного среза широко используется для изучения ряда сложных тканей и даже тонких клеточных структур3, что позволяет проводить точный анализ их архитектуры.
ИГХ — это мощный и универсальный лабораторный метод, который позволяет визуализировать локализацию конкретных белков в тканях. Этот метод стал краеугольным камнем как в клинических, так и в исследовательских условиях, где он широко используется для диагностики, мониторинга заболеваний и биологических исследований. Успех эксперимента с ИГХ в значительной степени зависит от тщательной подготовки образца, бережного обращения с тканью и точного контроля условий иммуноокрашивания. Небольшие изменения в протоколе могут сильно повлиять на качество результатов, что подчеркивает важность стандартизации и оптимизации1.
В сочетании криосекция и ИГХ дают беспрецедентные преимущества для исследователей, стремящихся изучить пространственное распределение, уровни экспрессии и клеточные взаимодействия различных белков в сетчатке. Эти методологии позволяют проводить детальные исследования молекулярных механизмов, лежащих в основе развития, функции и заболеваний сетчатки. Такие выводы особенно ценны при изучении заболеваний сетчатки, включая возрастную макулярную дегенерацию, диабетическую ретинопатию и пигментный ретинит. Выясняя патофизиологию этих состояний, криосекция и ИГХ способствуют выявлению потенциальных биомаркеров и разработке новых терапевтических стратегий.
Несмотря на свою полезность, работа с сетчаткой мыши сопряжена с уникальными проблемами. Мыши широко используются в качестве животных моделей в офтальмологических исследованиях из-за их генетического сходства с человеком и хорошо охарактеризованной структуры сетчатки. Тем не менее, получение высококачественных криорезий по своей природе затруднено из-за небольшого размера и нежного характера ткани сетчатки мыши. В этом исследовании представлена подробная методология криосекции и проведения ИГХ на сетчатке мыши, выделены важнейшие технические соображения и предложены стратегии оптимизации для решения этих проблем. Совершенствуя эти методы, исследователи могут достичь последовательных и высококачественных результатов, продвигая изучение биологии и патологии сетчатки.
протокол
Процедура проводилась в соответствии с руководящими принципами, установленными Ассоциацией исследований в области зрения и офтальмологии для использования животных в исследованиях. Одобрение было получено от Комитета по институциональному уходу за животными и их использованию (IACUC) Народной больницы провинции Сычуань. Для этого протокола использовали самцов мышей C57Bl/6J в возрасте от двух до трех месяцев и весом 25-30 г. Полный список реагентов и оборудования, использованных в этом исследовании, представлен в Таблице материалов.
1. Подготовка реагентов
- 1x буфер PBS
- Взвесьте на весах 8 г NaCl, 1,42 г Na2HPO4, 0,42 г KH2PO4 и 0,2 г KCl. Переложите их в стакан и добавьте соответствующее количество воды двойной дистилляции (ddH2O) для растворения компонентов. Налейте раствор в мерную колбу объемом 1 л и отрегулируйте объем до 1 л с помощью ddH2O.
- 4% раствор параформальдегида (PFA)
- Добавьте 0,4 г порошка PFA и 15 мкл 1 М NaOH в коническую пробирку объемом 15 мл, содержащую 8 мл 1x PBS буфера. Поместите тюбик на водяную баню, установленную на 60 °C, чтобы порошок PFA полностью растворился. Отрегулируйте итоговый объем до 10 мл с помощью 1x PBS.
- Решение для блокировки IHC
- Смешайте 1 мл обычной ослиной сыворотки, 20 мкл 20% NaN3, 200 мкл 20% Triton X-100 и 18,78 мл 1x PBS буфера. Тщательно перемешиваем.
- 30% раствор сахарозы
- Растворите 15 г сахарозы в 40 мл 1x PBS буфера. Отрегулируйте объем до 50 мл с помощью 1x PBS буфера и перемешайте до полного растворения.
- Раствор вторичного антитела ИГХ
- Разбавьте Alexa Fluor 488-конъюгированное антитело козы против кролика в соотношении 1:300 и DAPI в соотношении 1:2000 с использованием подготовленного блокирующего буфера.
2. Криосекция глазного яблока мыши
- Рассечение глазного яблока
- Обезболите 3-месячную мышь C57Bl/6 (примерно 25 г) путем внутрибрюшинной инъекции 2% триброметанола в дозировке 15 мкл/г массы тела. Принесите мышь в жертву с помощью вывиха шейки матки (в соответствии с утвержденными в учреждении протоколами).
- Отметьте верхнюю сторону глазного яблока синим маркером на склере (рисунок 1А). Удалите глазные яблоки с помощью ножниц.
- Если на поверхности глазного яблока присутствует кровь, аккуратно сотрите ее безворсовой салфеткой. Под препарирующим микроскопом осторожно удаляют экстраокулярные мышцы, прикрепленные к глазным яблокам.
- Фиксация
- Перенесите рассеченные глазные яблоки в микроцентрифужную пробирку объемом 2 мл с круглым дном, содержащую 1 мл 4% PFA. Зафиксируйте глазные яблоки на 10 минут. Впоследствии перенесите глазные яблоки в перевернутую 3- или 6-сантиметровую чашку Петри.
- Под препарирующим микроскопом сделайте небольшой разрез (примерно 1-2 мм) на роговице с помощью тонких щипцов и офтальмологических ножниц. Поместите глазные яблоки обратно в 4% раствор PFA для дополнительной фиксации на льду в течение дополнительных 2 часов (рис. 1B).
- Криозащита
- Снимите фиксатор и трижды промойте глазные яблоки буферным раствором 1x PBS. Перенесите глазные яблоки в микроцентрифужную пробирку с круглым дном объемом 2 мл, содержащую 1 мл 30% раствора сахарозы для криозащиты при температуре 4 °C. Дайте глазным яблокам осесть на дне трубки или оставьте их на ночь.
- Покрытие глазного яблока
- Перенесите глазное яблоко на перевернутую чашку Петри стороной роговицы вверх. Промокните излишки раствора с роговицы с помощью безворсовой салфетки. Окуните отрезок теннисной струны длиной 2-3 см в клей (состоящий из цианоакрилатов), содержащийся в микроцентрифужной пробирке объемом 0,2 мл, затем быстро удалите его.
- Под рассекающим микроскопом прикрепите один конец теннисной струны с остатками суперклея к центру влажной роговицы. Дайте клею застыть в течение 10-20 с. Возьмитесь за другой конец теннисной струны и окуните глазное яблоко в микроцентрифужную трубку объемом 200 мкл, заполненную суперклеем, обеспечив полное погружение склеры примерно на 1 с.
- Быстро извлеките глазное яблоко и погрузите его в PBS (рисунок 1C). Клей на поверхности склеры сразу же застынет.
- Удаление роговицы
- Промокните излишки PBS на поверхности застывшего клея с помощью безворсовой салфетки. Под препарирующим микроскопом удалите роговицу офтальмологическими ножницами, держа прикрепленную теннисную струну.
- Внедрение
- С помощью щипцов осторожно извлеките линзу из наглазника. Впитайте излишки раствора сахарозы, попавшие в наглазник, полоской безворсовой салфетки. Перенесите наглазник в закладную форму, заполненную составом с оптимальной температурой резки (OCT).
- Полностью заполните наглазник OCT. Расположите наглазник так, чтобы он был обращен к боковой стенке закладной формы, следя за тем, чтобы сагиттальная плоскость была параллельна дну формы. Используйте синюю метку на склере в качестве ориентира. Перенесите закладную форму, содержащую наглазник, в морозильную камеру при температуре -80 °C (Рисунок 1D). Наглазник будет заморожен в течение пяти минут.
- Криосекция
- Перенесите замороженный наглазник в криостат, установленный на -20 °C, и дайте ему уравновеситься в камере в течение 30 минут. Разрез наглазника имеет толщину 12 мкм. Установите секции на положительно заряженные стеклянные стекла для последующего использования.
3. Иммуногистохимическое окрашивание
- Выпечка
- Поместите замороженные пряди на предметные стекла и запекайте их в духовке при температуре 37 °C в течение 30-60 минут, чтобы обеспечить правильное сцепление ткани с предметным стеклом.
- Стирка
- С помощью ручки PAP нарисуйте круг вокруг секций на слайде. Погрузите предметное стекло в банку Coplin, содержащую 1x PBS буфер. Поместите банку Coplin на медленный шейкер и промойте секции в течение 2 × 10 минут, чтобы удалить соединение OCT.
- Блокировка и пермеабилизация
- Поместите предметное стекло горизонтально в камеру для увлажнения. Добавьте раствор для блокировки на обведенные участки и дайте для блокировки и пермеабилизации при комнатной температуре в течение 30 минут.
- Первичная инкубация антител
- Осторожно отсадите блокирующий раствор от предметного стекла. Добавьте в срезы первичное антитело, разведенное в блокирующем растворе. Инкубируйте срезы во влажной камере при температуре 4 °C в течение ночи, чтобы обеспечить оптимальное связывание антитела с целевым антигеном.
- Вторичная инкубация антител
- Отсадите первичный раствор антитела и дважды промойте предметное стекло 1x PBS в течение 2 × 10 минут. Добавьте соответствующее вторичное антитело, смешанное с DAPI, и разведенное в блокирующем растворе.
- Инкубируйте срезы в темной влажной камере при комнатной температуре в течение 1 ч, чтобы обеспечить вторичное связывание антител и компенсирование DAPI.
- Установка
- Отсадите вторичный раствор антитела и промойте предметное стекло 1x PBS в течение 2 × 10 минут. С помощью салфетки Kimwipe смойте остатки PBS на предметном стекле.
- Нанесите на секции соответствующее количество монтажной среды, препятствующей выцветанию, и накройте их покровным стеклом. Храните установленные образцы при температуре 4 °C в темноте, чтобы сохранить флуоресценцию и предотвратить фотообесцвечивание.
4. Визуализация
- Получение сигналов флуоресценции от иммуноокрашенных срезов сетчатки с помощью лазерного сканирующего конфокального микроскопа. Отрегулируйте настройки для достижения оптимального разрешения и чувствительности для захвата четких и отчетливых флуоресцентных сигналов.
- Убедитесь, что используются соответствующие фильтры для определения конкретных длин волн флуорофоров, используемых в эксперименте.
Результаты
В соответствии с протоколом, описанным выше, глаза 1-месячных мышей дикого типа C57Bl/6J были зафиксированы с 4% PFA. Затем зафиксированные образцы были введены в ОКТ и подвергнуты криосекции. Срезы иммуноокрашивали антителом к ФДЭ6B и окрашивали DAPI для мечения ядер. PDE6B представляет собой белок фототрансдукции, специфически экспрессируемый в палочковидных фоторецепторных клетках4. По сравнению с традиционными протоколами, этот протокол значительно улучшает как морфологию сетчатки мыши, так и качество иммунофлуоресцентных изображений, обеспечивая большую согласованность. Репрезентативные результаты демонстрируют успешное иммуноокрашивание криорезов сетчатки с использованием анти-PDE6B (рис. 2). Внешние сегменты фоторецепторов были четко помечены анти-PDE6B. Все внешние сегменты фоторецепторов оказались морфологически неповрежденными, а отдельные сегменты были различимы. Отслойки сетчатки в разрезе не наблюдалось. Кроме того, внутренние сегменты и внешний ядерный слой остались неповрежденными.
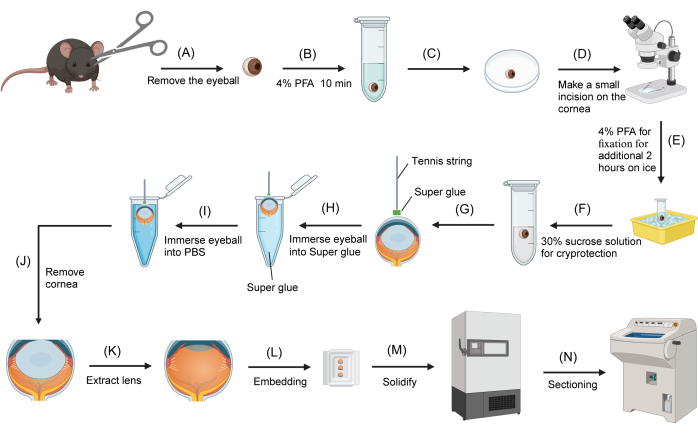
Рисунок 1: Процедура криосекции глаза мыши. (A) Глазные яблоки удаляются у умерщвленных мышей с помощью ножниц. (B) Глазные яблоки переносят в микроцентрифужную пробирку с круглым дном объемом 2 мл, содержащую 4% PFA, и фиксируют на 10 мин. (C) Глазное яблоко переносят на поверхность 3-сантиметровой перевернутой чашки Петри. (D) Под рассекающим микроскопом делается небольшой разрез (примерно 1 мм) на роговице. (E) Глазное яблоко возвращается к 4% фиксатору PFA для дополнительной фиксации на льду в течение 2 ч. (F) Фиксатор заменяется на 30% сахарозу для криозащиты. (G) Теннисная струна погружается в суперклей, а конец прикрепляется к центральной поверхности роговицы. (H) После того, как теннисная струна прочно прикреплена к роговице, другой конец струны удерживается, и глазное яблоко погружается в клей. (I) Глазное яблоко немедленно удаляется из суперклея и погружается в PBS. (J) Глазное яблоко извлекают из PBS, а роговицу отрезают ножницами, удерживая свободный конец теннисной струны. (K) Хрусталик извлекается с помощью щипцов. (L) Наглазник переносится в закладную форму, заполненную OCT. (M) Закладная форма переносится в морозильную камеру при температуре -80 °C. (N) Замороженный блок ОКТ, содержащий наглазник, разрезается с помощью криостата. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Иммунофлуоресцентные изображения срезов сетчатки мыши. Срезы сетчатки подвергали иммуноокрашиванию анти-PDE6B (зеленый) и противоокрашивали DAPI (синий). ОС, внешний сегмент; IS, внутренний сегмент; ONL, внешний ядерный слой. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
На качество срезов тканей влияет ряд факторов, в том числе состав фиксирующего раствора, время фиксации и криопротекции, а также методы встраивания5. При энуклеации глазного яблока у мыши необходимо удалить экстраокулярные мышцы и другую соединительную ткань, прикрепленную к глазному яблоку. При неправильном удалении эти ткани могут вызвать деформацию глазного яблока во время извлечения из глазницы, что потенциально может привести к отслоению сетчатки. В процессе фиксации следует сделать разрез на роговице для сброса внутриглазного давления (ВГД). Без этого разреза глазное яблоко может сжиматься, что приводит к деформации и отслоению сетчатки. Повышенная проницаемость глазного яблока во время фиксации позволяет ВГД форсировать отток водянистой влаги из внутриглазного пространства. При выполнении разреза в роговице снимается внутреннее давление глазного яблока, что помогает предотвратить усадку и позволяет фиксатору более эффективно проникать во внутриглазное пространство для оптимальной фиксации.
Сетчатка состоит из 10 слоев структурно различных и нежных тканей. Чтобы сохранить морфологическую целостность, крайне важно правильно зафиксировать ткань. Раствор PFA обычно используется в качестве фиксатора6, так как его можно только что приготовить. Следует избегать использования заранее приготовленного раствора формалина, так как он склонен к окислению7, что может привести к плохой фиксации и нарушению морфологии сетчатки. Кроме того, фиксация не должна превышать 2 часов, так как длительная фиксация может вызвать чрезмерную аутофлуоресценцию, особенно в клетках пигментного эпителия сетчатки (РПЭ), что может помешать интерпретации результата. Эта проблема часто наблюдается при парафиновых срезах сетчатки, поскольку они обычно готовятся из глазных яблок, которые были зафиксированы в течение длительного периода времени, иногда на ночь или даже дольше.
Ранее мы продемонстрировали, что покрытие глазного яблока слоем суперклея значительно улучшает качество криосекции сетчатки мыши8. Первоначально наконечник пипетки использовался для нанесения суперклея на поверхность склеры; Однако этот метод иногда приводил к тому, что глазное яблоко прилипало к опорной поверхности, такой как чашка Петри. Чтобы решить эту проблему, техника нанесения покрытия была модифицирована путем погружения глазного яблока в клей после прикрепления сегмента теннисной струны к роговице9, как описано в протоколе выше. Прикрепленный сегмент теннисной струны служит ручкой для удобства использования и облегчает последующее разрезание и удаление роговицы.
Распределение фоторецепторов по сетчатке мыши неоднородно. В частности, фоторецепторы S-колбочек преимущественно локализованы на нижней стороне сетчатки C57Bl/6J, в то время как ML-колбочки более равномерно распределены по всей сетчатке10. Поэтому маркировка глазного яблока перед энуклеацией имеет важное значение для обеспечения желаемой ориентации (дорсально-вентральной или носово-височной) во время обработки.
Однако у этого протокола есть ограничения. Мышь не прокалывают перед жертвоприношением. Когда мишенью для мечения является сосудистая сеть сетчатки и используется вторичное антитело против мыши, может произойти неспецифическое мечение сосудистых тканей вторичным антителом. В таких случаях мы рекомендуем провести перфузию мыши перед тем, как пожертвовать, чтобы предотвратить эту проблему.
Таким образом, был описан протокол, который позволяет исследователям последовательно производить высококачественные криосекции сетчатки мыши для иммуноокрашивания. Этот протокол относительно прост в использовании, что делает его особенно полезным для исследователей с ограниченным опытом.
Раскрытие информации
У авторов нет никаких противоречий для раскрытия.
Благодарности
Этот исследовательский проект был поддержан Национальным фондом естественных наук Китая (82371059 (H.Z.), 82102470 (J.W.)), Сычуаньской научно-технической программой (2023JDZH0002 (H.Z.)).
Материалы
| Name | Company | Catalog Number | Comments |
| -80 °C freezer | Haier | DW-86L626 | |
| Adhesion microscope slides | CITOTEST | 80312-3161 | |
| Alexa488-Goat anti-Rabbit | Proteintech | SA00006-2 | |
| C57BL/6J mouse | The Jackson Laboratory | 664 | |
| Cryosection microtome | Leica | N/A | |
| Cryostat | LEICA | N/A | |
| DAPI | Cell Signaling Technology | 4083S | |
| Dissecting microscope | ZEISS | 3943030830 | |
| Donkey serum | Solarbio | S9100 | |
| Embedding molds | Thermo Fisher Scientific | 1841 | |
| Fine dissection scissors | RWD | S13001-10 | |
| Fine forceps | RWD | F11020-11 | |
| Fluoromount aqueous mounting medium | Sigma-Aldrich | F4680 | |
| Incubator | Shanghai Yuejin | N/A | |
| KCl | Sigma-Aldrich | 1049330500 | |
| KH2PO4 | Sigma-Aldrich | 1048771000 | |
| Kimwipes | Thermo Fisher Scientific | FIS-06666 | |
| Laser confocal microscope | ZEISS | N/A | |
| Microscope cover Glass | CITOTEST | 80340-3610 | |
| Na2HPO4 | Sigma-Aldrich | 1065860500 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NaOH | Sigma-Aldrich | 1091371003 | |
| O.C.T compound | Sakura | 4583 | |
| Pap pen | Sigma-Aldrich | Z672548 | |
| PFA | Sigma-Aldrich | 441244 | |
| Rabbit anti-PDE6B | Proteintech | 22063-1-AP | |
| Shaker | SCILOGEX | 8042210200 | |
| Spring scissors | RWD | S11036-08 | |
| Sucrose | BioFroxx | 1245GR500 | |
| Super glue | Deli | 7147S | |
| Tennis string (1.24 mm) | Gosen | TS761 | |
| Tribromoethanol | Macklin | T831042 | |
| Triton X-100 | Solarbio | IT9100 |
Ссылки
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: Revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Vet Pathol. 51 (1), 42-87 (2014).
- Usukura, E., et al. A cryosectioning technique for the observation of intracellular structures and immunocytochemistry of tissues in atomic force microscopy (AFM). Sci Rep. 7 (1), 6462 (2017).
- Park, P. S. Supramolecular organization of rhodopsin in rod photoreceptor cell membranes. Pflugers Arch. 473 (9), 1361-1376 (2021).
- Boonstra, H., Oosterhuis, J. W., Oosterhuis, A. M., Fleuren, G. J. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting. Virchows Arch A Pathol Anat Histopathol. 402 (2), 195-201 (1983).
- Stradleigh, T. W., Ishida, A. T. Fixation strategies for retinal immunohistochemistry. Prog Retin Eye Res. 48, 181-202 (2015).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. J Oral Maxillofac Pathol. 16 (3), 400-405 (2012).
- Li, L., et al. An improved method for preparation of mouse retinal cryosections. Eur J Histochem. 64 (3), 3154 (2020).
- Yang, J., et al. A quick protocol for the preparation of mouse retinal cryosections for immunohistochemistry. Open Biol. 11 (7), 210076 (2021).
- Szel, A., et al. Unique topographic separation of two spectral classes of cones in the mouse retina. J Comp Neurol. 325 (3), 327-342 (1992).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены