Method Article
הקפאה וצביעה חיסונית של רשתית העכבר
* These authors contributed equally
In This Article
Summary
מתואר פרוטוקול להכנת הקפאות רשתית של עכברים וביצוע צביעה חיסונית על קולטני אור. מאמר זה מאפשר לחוקרים לייצר באופן עקבי חלקים קפואים ברשתית של עכברים עם מורפולוגיה שמורה היטב ותוצאות צביעה חיסונית באיכות גבוהה.
Abstract
חתך רקמות ואימונוהיסטוכימיה הן טכניקות חיוניות במחקרים היסטולוגיים ופתולוגיים של מחלות רשתית באמצעות מודלים של בעלי חיים. שיטות אלו מאפשרות בחינה מפורטת של מורפולוגיות רקמות ולוקליזציה של חלבונים ספציפיים בתוך הרקמה, המספקות תובנות חשובות לגבי תהליכי ומנגנוני המחלה. עכברים הם הדגם הנפוץ ביותר למטרה זו. עם זאת, מכיוון שגלגלי העיניים של העכבר קטנים והרשתית של העכבר היא רקמות עדינות ביותר, השגת קטעי רשתית איכותיים ותמונות צביעה חיסונית מגלגלי עיניים של עכבר היא בדרך כלל מאתגרת. מחקר זה מתאר פרוטוקול משופר לכריתת רשתית עכברים וביצוע אימונוהיסטוכימיה. נקודה חיונית בפרוטוקול זה כוללת ציפוי גלגל העין בשכבת דבק סופר, המונעת עיוות של גלגלי העיניים במהלך תהליכי הסרת הקרנית, חילוץ העדשות והטבעה. שלב זה מבטיח ששלמות המורפולוגיה של הרשתית נשמרת היטב. פרוטוקול זה מדגיש שיקולים טכניים קריטיים ואסטרטגיות אופטימיזציה לייצור עקבי של מקטעי רשתית באיכות גבוהה והשגת תוצאות צביעה חיסונית מצוינות.
Introduction
הקפאה ואימונוהיסטוכימיה (IHC) הן טכניקות הכרחיות במחקר ביו-רפואי, במיוחד לחקר מבנים ביולוגיים מורכבים כגון רשתית1. מתודולוגיות מתקדמות אלו הן חלק בלתי נפרד מהבנת ההרכב התאי המורכב והארגון המולקולרי של הרשתית. הם מספקים לחוקרים את היכולת לחקור את תפקוד הרשתית והפתולוגיה ברמה מפורטת, ומציעים תובנות קריטיות לקידום הידע בתחום זה.
הקפאה ממלאת תפקיד חיוני בשמירה על השלמות המורפולוגית של רקמת הרשתית. זה מבטיח שהמבנה העדין של הרשתית יישאר שלם, ומאפשר להשתמש בקטעים במחקרים אימונו-פלואורסצנטיים הבאים עם דיוק ואמינות גבוהים. בהשוואה לשיטות אחרות, כגון הטמעת פרפין, להקפאה יש יתרונות משמעותיים מכיוון שהיא משמרת טוב יותר הן את המורפולוגיה של הרקמות והן את האנטיגניות, מה שהופך אותה למתאימה במיוחד לצביעה אימונוהיסטוכימית2. טכניקת החתך הקפוא מאומצת באופן נרחב לחקר מגוון רקמות מורכבות ואפילו מבנים תאיים עדינים3, ומאפשרת ניתוחים מדויקים של הארכיטקטורה שלהם.
IHC היא טכניקת מעבדה רבת עוצמה ורב-תכליתית המאפשרת הדמיה של לוקליזציה של חלבונים ספציפיים בתוך רקמות. טכניקה זו הפכה לאבן פינה במסגרות קליניות ומחקריות כאחד, שם נעשה בה שימוש נרחב לאבחון, ניטור מחלות וחקירות ביולוגיות. הצלחתו של ניסוי IHC תלויה במידה רבה בהכנת דגימה קפדנית, טיפול זהיר ברקמה ובקרה מדויקת של תנאי צביעה חיסונית. שינויים קטנים בפרוטוקול יכולים להשפיע מאוד על איכות התוצאות, ולהדגיש את החשיבות של סטנדרטיזציה ואופטימיזציה1.
בשילוב, הקפאה ו-IHC מציעים יתרונות שאין שני להם לחוקרים המבקשים לחקור את ההתפלגות המרחבית, רמות הביטוי והאינטראקציות התאיות של חלבונים שונים בתוך הרשתית. מתודולוגיות אלו מאפשרות חקירה מפורטת של המנגנונים המולקולריים העומדים בבסיס התפתחות הרשתית, תפקודה ומחלתה. תובנות כאלה חשובות במיוחד בחקר הפרעות ברשתית, כולל ניוון מקולרי הקשור לגיל, רטינופתיה סוכרתית ורטיניטיס פיגמנטוזה. על ידי הבהרת הפתופיזיולוגיה של מצבים אלה, הקפאה ו-IHC תורמים לזיהוי סמנים ביולוגיים פוטנציאליים ולפיתוח אסטרטגיות טיפוליות חדשות.
למרות התועלת שלה, עבודה עם רשתית עכבר מציבה אתגרים ייחודיים. עכברים נמצאים בשימוש נרחב כמודלים של בעלי חיים במחקר עיניים בשל הדמיון הגנטי שלהם לבני אדם ומבנה הרשתית המאופיין היטב שלהם. עם זאת, השגת הקפאה איכותית היא קשה מטבעה בגלל הגודל הקטן והאופי העדין של רקמת הרשתית של העכבר. מחקר זה מספק מתודולוגיה מפורטת לביצוע הקפאה וביצוע IHC על רשתית עכברים, תוך הדגשת שיקולים טכניים קריטיים והצעת אסטרטגיות אופטימיזציה להתמודדות עם אתגרים אלה. על ידי חידוד טכניקות אלה, חוקרים יכולים להשיג תוצאות עקביות ואיכותיות, ולקדם את חקר הביולוגיה והפתולוגיה של הרשתית.
Protocol
הנוהל עמד בהנחיות שנקבעו על ידי האגודה לחקר הראייה ורפואת העיניים לשימוש בבעלי חיים במחקר. האישור התקבל מהוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של בית החולים העממי של מחוז סצ'ואן. עכברי C57Bl/6J זכרים, בני חודשיים עד שלושה חודשים ומשקלם 25-30 גרם, שימשו לפרוטוקול זה. רשימה מקיפה של הריאגנטים והציוד המשמשים במחקר זה מסופקת בטבלת החומרים.
1. הכנת ריאגנטים
- 1x מאגר PBS
- שקלו 8 גרם NaCl, 1.42 גרם Na2HPO4, 0.42 גרם KH2PO4 ו-0.2 גרם KCl באמצעות משקל. העבירו אותם לכוס והוסיפו כמות מתאימה של מים מזוקקים כפולים (ddH2O) כדי להמיס את הרכיבים. שופכים את התמיסה לבקבוק נפחי של 1 ליטר ומכוונים את הנפח ל -1 ליטר עם ddH2O.
- תמיסת 4% פרפורמלדהיד (PFA)
- הוסף 0.4 גרם אבקת PFA ו-15 מיקרוליטר של 1 M NaOH לצינור חרוטי של 15 מ"ל המכיל 8 מ"ל של מאגר PBS 1x. הנח את הצינור באמבט מים המוגדר ל-60 מעלות צלזיוס כדי להמיס את אבקת ה-PFA לחלוטין. כוונן את עוצמת הקול הסופית ל-10 מ"ל עם 1x PBS.
- פתרון חסימת IHC
- שלב 1 מ"ל של סרום חמור רגיל, 20 מיקרוליטר של 20% NaN3, 200 מיקרוליטר של 20% טריטון X-100 ו-18.78 מ"ל של מאגר PBS 1x. מערבבים היטב.
- תמיסת סוכרוז 30%
- ממיסים 15 גרם סוכרוז ב-40 מ"ל של מאגר PBS 1x. כוונן את עוצמת הקול ל-50 מ"ל עם מאגר PBS 1x וערבב עד להמסה מלאה.
- תמיסת נוגדנים משנית IHC
- לדלל את הנוגדן נגד ארנב עזים מצומד Alexa Fluor 488 ביחס של 1:300 ו-DAPI ביחס של 1:2,000 באמצעות המאגר החוסם המוכן.
2. הקפאת גלגל העין של העכבר
- ניתוח גלגל העין
- להרדים עכבר C57Bl/6 בן 3 חודשים (כ-25 גרם) באמצעות הזרקה תוך-צפקית של 2% טריברומו-אתנול במינון של 15 מיקרוליטר/גרם משקל גוף. להקריב את העכבר באמצעות פריקת צוואר הרחם (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- סמנו את הצד העליון של גלגל העין עם סמן כחול על הסקלרה (איור 1A). הסר את גלגלי העיניים בעזרת מספריים.
- אם יש דם על פני גלגל העין, נגב אותו בעדינות באמצעות מגבון נטול מוך. תחת מיקרוסקופ מנתח, הסר בזהירות את השרירים החוץ-עיניים המחוברים לגלגלי העיניים.
- קיבוע
- העבירו את גלגלי העיניים המנותחים לצינור מיקרו-צנטריפוגה תחתון עגול בנפח 2 מ"ל המכיל 1 מ"ל של 4% PFA. תקן את גלגלי העיניים למשך 10 דקות. לאחר מכן, העבירו את גלגלי העיניים לצלחת פטרי הפוכה בגודל 3 או 6 ס"מ.
- תחת מיקרוסקופ מנתח, בצע חתך קטן (כ 1-2 מ"מ) על הקרנית בעזרת מלקחיים עדינים ומספריים עיניים. הכניסו את גלגלי העיניים בחזרה לתמיסת PFA של 4% למשך שעתיים נוספות של קיבוע על קרח (איור 1B).
- הגנה מפני הקפאה
- הסר את הקיבוע ושטוף את גלגלי העיניים שלוש פעמים עם תמיסת חיץ PBS 1x. העבירו את גלגלי העיניים לצינור מיקרוצנטריפוגה תחתון עגול בנפח 2 מ"ל המכיל 1 מ"ל של תמיסת סוכרוז של 30% להגנה מפני הקפאה ב-4 מעלות צלזיוס. הניחו לגלגלי העיניים להתיישב בתחתית הצינור או השאירו אותם למשך הלילה.
- ציפוי גלגל העין
- העבירו גלגל עין על צלחת פטרי הפוכה כשצד הקרנית פונה כלפי מעלה. כתם את התמיסה העודפת מהקרנית בעזרת מגבון נטול מוך. טובלים קטע של 2-3 ס"מ של חוט טניס לתוך הדבק (המורכב מציאנואקרילטים) הכלול בצינור מיקרו-צנטריפוגה של 0.2 מ"ל, ואז מסירים אותו במהירות.
- תחת מיקרוסקופ מנתח, חבר קצה אחד של חוט הטניס עם דבק סופר שיורי למרכז הקרנית הלחה. אפשר לדבק להתמצק במשך 10-20 שניות. אחוז בקצה השני של חוט הטניס וטבל את גלגל העין בצינור מיקרו-צנטריפוגה של 200 מיקרוליטר מלא בדבק סופר, מה שמבטיח שהסקלרה שקועה לחלוטין למשך כשנייה אחת.
- הסירו במהירות את גלגל העין וטבלו אותו ב-PBS (איור 1C). הדבק על משטח הסקלרה יתמצק מיד.
- הסרת הקרנית
- כתם את עודפי ה- PBS על פני הדבק המוצק באמצעות מגבון נטול מוך. תחת מיקרוסקופ מנתח, הסר את הקרנית בעזרת מספריים עיניים תוך החזקת חוט הטניס המצורף.
- הטבעה
- בעזרת מלקחיים יש לחלץ בזהירות את העדשה מכוס העין. יש לספוג את תמיסת הסוכרוז העודפת הכלואה בתוך גביע העין בעזרת רצועת מגבון נטול מוך. העבירו את גביע העיניים לתבנית הטבעה מלאה בתרכובת טמפרטורת החיתוך האופטימלית (OCT).
- מלאו את העיניים לחלוטין ב-OCT. מקמו את העין כך שהיא פונה לדופן של תבנית ההטבעה, וודאו שהמישור הסגיטלי מקביל לתחתית התבנית. השתמש בסימן הכחול על הסקלרה כהפניה. העבירו את תבנית ההטבעה המכילה את העין למקפיא של -80 מעלות צלזיוס (איור 1D). העיניים תוקפא תוך חמש דקות.
- הקפאה
- העבירו את העין הקפואה לקריוסטט המוגדר ל-20 מעלות צלזיוס והניחו לה להתייצב בתוך החדר למשך 30 דקות. חתכו את העין בעובי של 12 מיקרומטר. התקן את החלקים על מגלשות זכוכית טעונות חיובית לשימוש לאחר מכן.
3. צביעה אימונוהיסטוכימית
- אפייה
- מניחים את החלקים הקפואים על שקופיות ואופים אותם בתנור של 37 מעלות למשך 30-60 דקות כדי להבטיח הידבקות תקינה של הרקמה לשקופית.
- כביסה
- באמצעות עט PAP, צייר עיגול סביב המקטעים בשקופית. טבלו את השקופית בצנצנת קופלין המכילה 1x מאגר PBS. הניחו את צנצנת קופלין על שייקר איטי ושטפו את החלקים במשך 2 × 10 דקות כדי להסיר את תרכובת ה-OCT.
- חסימה וחדירות
- הנח את השקופית אופקית בתא לחות. הוסף את תמיסת החסימה לחלקים המעוגלים ואפשר חסימה וחדירה בטמפרטורת החדר למשך 30 דקות.
- דגירה ראשונית של נוגדנים
- שאפו את תמיסת החסימה בזהירות מהשקופית. הוסף את הנוגדן הראשוני, המדולל בתמיסת החסימה, לחלקים. דגרו את החלקים בתא הלחות בטמפרטורה של 4 מעלות צלזיוס למשך הלילה כדי להבטיח קישור אופטימלי של הנוגדן לאנטיגן המטרה.
- דגירה משנית של נוגדנים
- שאפו את תמיסת הנוגדנים העיקרית ושטפו את השקופית פעמיים עם PBS 1x למשך 2 × 10 דקות. הוסף את הנוגדן המשני המתאים, מעורבב עם DAPI, ומדולל בתמיסת החסימה.
- דגרו את החלקים בתא לחות כהה בטמפרטורת החדר למשך שעה אחת כדי לאפשר קשירת נוגדנים משנית וצביעה נגדית עם DAPI.
- הרכבה
- שאפו את תמיסת הנוגדנים המשנית ושטפו את השקף עם PBS 1x למשך 2 × 10 דקות. השתמש ב- Kimwipe כדי למחוק את כל ה- PBS שנותר בשקופית.
- מרחו כמות מתאימה של אמצעי הרכבה נגד דהייה על החלקים וכסו אותם בכיסוי. אחסן את הדגימות המותקנות ב-4 מעלות צלזיוס בחושך כדי לשמור על הקרינה ולמנוע פוטו-הלבנה.
4. הדמיה
- רכוש אותות פלואורסצנטיים מקטעי הרשתית המוכתמים במערכת החיסון באמצעות מיקרוסקופ קונפוקלי סורק לייזר. התאם את ההגדרות לרזולוציה ורגישות אופטימליות כדי ללכוד אותות פלואורסצנטיים ברורים ומובחנים.
- ודא שנעשה שימוש במסננים מתאימים כדי לזהות את אורכי הגל הספציפיים של הפלואורופורים המשמשים בניסוי.
תוצאות
בהתאם לפרוטוקול המתואר לעיל, עיניים של עכברי בר בני חודש מסוג C57Bl/6J נקבעו ב-4% PFA. הדגימות הקבועות הוטמעו לאחר מכן ב-OCT והוקפאו. החלקים הוכתמו במערכת החיסון בנוגדנים נגד PDE6B ונצבעו ב-DAPI כדי לסמן את הגרעין. PDE6B הוא חלבון פוטוטרנסדוקציה המתבטא במיוחד בתאי קולטני אור מוט4. בהשוואה לפרוטוקולים מסורתיים, פרוטוקול זה משפר משמעותית הן את המורפולוגיה של רשתית העכבר והן את איכות התמונות האימונו-פלואורסצנטיות, ומספק עקביות רבה. התוצאות המייצגות מדגימות צביעה חיסונית מוצלחת של קריוסקציה ברשתית באמצעות אנטי-PDE6B (איור 2). המקטעים החיצוניים של קולטני האור סומנו בבירור עם anti-PDE6B. כל המקטעים החיצוניים של קולטני האור נראו שלמים מבחינה מורפולוגית, וניתן היה להבחין במקטעים בודדים. לא נצפתה היפרדות רשתית בחתך. בנוסף, המקטעים הפנימיים והשכבה הגרעינית החיצונית נותרו שלמים.
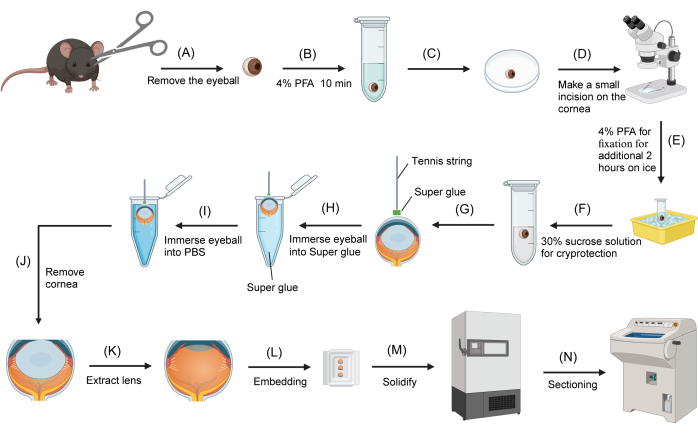
איור 1: הליך הקפאת עין עכבר. (A) גלגלי העיניים מוסרים מעכברים שהוקרבו באמצעות מספריים. (B) גלגלי העין מועברים לצינור מיקרו-צנטריפוגה תחתון עגול בנפח 2 מ"ל שמכיל 4% PFA ומקובעים למשך 10 דקות. (C) גלגל עין מועבר אל פני השטח של צלחת פטרי הפוכה בקוטר 3 סנטימטרים. (D) תחת מיקרוסקופ מנתח מבוצע חתך קטן (כ-1 מילימטר) על הקרנית. (E) גלגל העין מוחזר לקיבוע PFA של 4% לקיבוע נוסף על קרח למשך שעתיים. (F) הקיבוע מוחלף ב-30% סוכרוז להגנה מפני הקפאה. (G) חוט הטניס טובל בדבק-על, והקצה מחובר למשטח המרכזי של הקרנית. (H) אחרי שמיתר הטניס מחובר היטב לקרנית, הקצה השני של המיתר מוחזק, וגלגל העין שקוע בדבק. (I) גלגל העין מוסר מיד מדבק העל וטובל ב-PBS. (J) גלגל העין מוסר מ-PBS, והקרנית נחתכת במספריים, כשהיא מחזיקה את הקצה החופשי של חוט הטניס. (K) העדשה נשלפת באמצעות מלקחיים. (L) העין מועברת לתבנית הטבעה מלאה ב-OCT. (M) תבנית ההטבעה מועברת למקפיא של -80 מעלות צלזיוס. (N) בלוק ה-OCT הקפוא המכיל את גביעונית העין נחתך באמצעות קריוסטט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תמונות אימונו-פלואורסצנטיות של מקטעי רשתית של עכברים. קטעי הרשתית הוכתמו ב-anti-PDE6B (ירוק) ונצבעו ב-DAPI (כחול). מערכת הפעלה, קטע חיצוני; IS, קטע פנימי; ONL, שכבה גרעינית חיצונית. סרגל קנה מידה: 10 מיקרומטר. אנא לחץ כאן לצפייה בגרסה מוגדלת של איור זה.
Discussion
מספר גורמים משפיעים על איכות קטעי הרקמות, כולל הרכב תמיסת הקיבוע, זמן הקיבוע והקפאה ושיטות ההטמעה5. כאשר מוציאים את גלגל העין מהעכבר, חיוני להסיר את השרירים החוץ-עיניים ורקמות חיבור אחרות המחוברות לגלגל העין. אם לא מוסרים כראוי, רקמות אלו עלולות לגרום לעיוות של גלגל העין במהלך העקירה מארובת העין, מה שעלול להוביל להיפרדות רשתית. בתהליך הקיבוע יש לבצע חתך בקרנית כדי לשחרר לחץ תוך עיני (IOP). ללא חתך זה, גלגל העין עלול להתכווץ, וכתוצאה מכך לעיוות והיפרדות רשתית. החדירות המוגברת של גלגל העין במהלך הקיבוע מאפשרת ל-IOP לאלץ את פליטת ההומור המימי מהחלל התוך עיני. על ידי ביצוע חתך בקרנית, הלחץ הפנימי של גלגל העין משוחרר, מה שמסייע במניעת התכווצות ומאפשר לקיבוע לחדור בצורה יעילה יותר לחלל התוך עיני לקיבוע אופטימלי.
הרשתית מורכבת מ-10 שכבות של רקמות עדינות ושונות מבחינה מבנית. כדי לשמור על שלמות מורפולוגית, חיוני לתקן את הרקמה כראוי. תמיסת PFA משמשת בדרך כלל כקיבוע6, מכיוון שניתן להכין אותה טרייה. יש להימנע משימוש בתמיסת פורמלין מוכנה מראש, מכיוון שהיא נוטה לחמצון7, מה שעלול להוביל לקיבוע לקוי ולפגיעה במורפולוגיה של הרשתית. יתר על כן, קיבוע לא יעלה על שעתיים, מכיוון שקיבוע ממושך עלול לגרום לאוטופלואורסצנטיות מוגזמת, במיוחד בתאי אפיתל פיגמנט הרשתית (RPE), מה שעלול להפריע לפירוש התוצאות. בעיה זו נצפית לעתים קרובות בחלקי רשתית פרפין, מכיוון שאלו מוכנים בדרך כלל מגלגלי עיניים שקובעו לתקופות ממושכות, לפעמים בן לילה או אפילו יותר.
הראינו בעבר כי ציפוי גלגל העין בשכבת דבק סופר משפר משמעותית את איכות חתכי הרשתית של העכבר8. בתחילה, קצה פיפטה שימש לפיזור דבק סופר על פני הסקלרה; עם זאת, שיטה זו גרמה מדי פעם לגלגל העין להיצמד למשטח התומך, כמו צלחת הפטרי. כדי לטפל בבעיה זו, טכניקת הציפוי שונתה על ידי טבילת גלגל העין בדבק לאחר הצמדת קטע של חוט טניס לקרנית9, כמתואר בפרוטוקול לעיל. קטע מיתרי הטניס המצורף משמש כידית לטיפול קל ומקל על חיתוך והסרה של הקרנית לאחר מכן.
התפלגות קולטני האור אינה הומוגנית על פני רשתית העכבר. באופן ספציפי, קולטני האור של חרוט S ממוקמים בעיקר בצד התחתון של רשתית C57Bl/6J, בעוד שחרוטי ML מפוזרים באופן שווה יותר בכל הרשתית10. לכן, סימון גלגל העין לפני הוצאת הגרעין חיוני כדי להבטיח את הכיוון הרצוי (גבי-גחוני או אף-טמפורלי) במהלך העיבוד.
עם זאת, ישנן מגבלות לפרוטוקול זה. העכבר אינו מנופף לפני ההקרבה. כאשר היעד לתיוג הוא כלי דם ברשתית, ונעשה שימוש בנוגדנים משניים נגד עכברים, עלול להתרחש תיוג לא ספציפי של רקמות כלי הדם על ידי הנוגדן המשני. במקרים כאלה, אנו ממליצים להקפיץ את העכבר לפני ההקרבה כדי למנוע בעיה זו.
לסיכום, תואר פרוטוקול המאפשר לחוקרים לייצר באופן עקבי חתכי רשתית עכברים באיכות גבוהה לצביעה חיסונית. פרוטוקול זה קל יחסית לביצוע, מה שהופך אותו לשימושי במיוחד עבור חוקרים בעלי ניסיון מוגבל.
Disclosures
למחברים אין קונפליקטים לחשוף.
Acknowledgements
פרויקט מחקר זה נתמך על ידי הקרן הלאומית למדעי הטבע של סין (82371059 (H.Z.), 82102470 (J.W.)), תוכנית המדע והטכנולוגיה של סצ'ואן (2023JDZH0002 (H.Z.)).
Materials
| Name | Company | Catalog Number | Comments |
| -80 °C freezer | Haier | DW-86L626 | |
| Adhesion microscope slides | CITOTEST | 80312-3161 | |
| Alexa488-Goat anti-Rabbit | Proteintech | SA00006-2 | |
| C57BL/6J mouse | The Jackson Laboratory | 664 | |
| Cryosection microtome | Leica | N/A | |
| Cryostat | LEICA | N/A | |
| DAPI | Cell Signaling Technology | 4083S | |
| Dissecting microscope | ZEISS | 3943030830 | |
| Donkey serum | Solarbio | S9100 | |
| Embedding molds | Thermo Fisher Scientific | 1841 | |
| Fine dissection scissors | RWD | S13001-10 | |
| Fine forceps | RWD | F11020-11 | |
| Fluoromount aqueous mounting medium | Sigma-Aldrich | F4680 | |
| Incubator | Shanghai Yuejin | N/A | |
| KCl | Sigma-Aldrich | 1049330500 | |
| KH2PO4 | Sigma-Aldrich | 1048771000 | |
| Kimwipes | Thermo Fisher Scientific | FIS-06666 | |
| Laser confocal microscope | ZEISS | N/A | |
| Microscope cover Glass | CITOTEST | 80340-3610 | |
| Na2HPO4 | Sigma-Aldrich | 1065860500 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NaOH | Sigma-Aldrich | 1091371003 | |
| O.C.T compound | Sakura | 4583 | |
| Pap pen | Sigma-Aldrich | Z672548 | |
| PFA | Sigma-Aldrich | 441244 | |
| Rabbit anti-PDE6B | Proteintech | 22063-1-AP | |
| Shaker | SCILOGEX | 8042210200 | |
| Spring scissors | RWD | S11036-08 | |
| Sucrose | BioFroxx | 1245GR500 | |
| Super glue | Deli | 7147S | |
| Tennis string (1.24 mm) | Gosen | TS761 | |
| Tribromoethanol | Macklin | T831042 | |
| Triton X-100 | Solarbio | IT9100 |
References
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: Revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Vet Pathol. 51 (1), 42-87 (2014).
- Usukura, E., et al. A cryosectioning technique for the observation of intracellular structures and immunocytochemistry of tissues in atomic force microscopy (AFM). Sci Rep. 7 (1), 6462 (2017).
- Park, P. S. Supramolecular organization of rhodopsin in rod photoreceptor cell membranes. Pflugers Arch. 473 (9), 1361-1376 (2021).
- Boonstra, H., Oosterhuis, J. W., Oosterhuis, A. M., Fleuren, G. J. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting. Virchows Arch A Pathol Anat Histopathol. 402 (2), 195-201 (1983).
- Stradleigh, T. W., Ishida, A. T. Fixation strategies for retinal immunohistochemistry. Prog Retin Eye Res. 48, 181-202 (2015).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. J Oral Maxillofac Pathol. 16 (3), 400-405 (2012).
- Li, L., et al. An improved method for preparation of mouse retinal cryosections. Eur J Histochem. 64 (3), 3154 (2020).
- Yang, J., et al. A quick protocol for the preparation of mouse retinal cryosections for immunohistochemistry. Open Biol. 11 (7), 210076 (2021).
- Szel, A., et al. Unique topographic separation of two spectral classes of cones in the mouse retina. J Comp Neurol. 325 (3), 327-342 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved