Method Article
Crioseccionamento e imunocoloração da retina de camundongos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um protocolo para preparar criossecções de retina de camundongos e realizar imunocoloração em fotorreceptores é descrito. Este artigo permite que os pesquisadores produzam consistentemente seções congeladas de retina de camundongos com morfologia bem preservada e resultados de imunocoloração de alta qualidade.
Resumo
O seccionamento de tecidos e a imuno-histoquímica são técnicas essenciais em estudos histológicos e patológicos de doenças da retina utilizando modelos animais. Esses métodos permitem exames detalhados das morfologias do tecido e a localização de proteínas específicas dentro do tecido, que fornecem informações valiosas sobre os processos e mecanismos da doença. Os ratos são o modelo mais utilizado para esse fim. No entanto, como os globos oculares de camundongos são pequenos e as retinas de camundongos são tecidos extremamente delicados, a obtenção de cortes retinianos de alta qualidade e imagens de imunocoloração de globos oculares de camundongos é normalmente um desafio. Este estudo descreve um protocolo aprimorado para criossecção de retinas de camundongos e realização de imuno-histoquímica. Um ponto essencial deste protocolo envolve revestir o globo ocular com uma camada de super cola, que evita a deformação dos globos oculares durante os processos de remoção da córnea, extração do cristalino e incorporação. Esta etapa garante que a integridade das morfologias da retina seja bem preservada. Este protocolo destaca considerações técnicas críticas e estratégias de otimização para produzir consistentemente seções retinianas de alta qualidade e alcançar excelentes resultados de imunocoloração.
Introdução
A criosecção e a imuno-histoquímica (IHQ) são técnicas indispensáveis na pesquisa biomédica, particularmente para o estudo de estruturas biológicas complexas, como a retina1. Essas metodologias avançadas são essenciais para entender a intrincada composição celular e a organização molecular da retina. Eles fornecem aos pesquisadores a capacidade de investigar a funcionalidade e a patologia da retina em um nível detalhado, oferecendo insights críticos para o avanço do conhecimento neste campo.
A criossecção desempenha um papel vital na manutenção da integridade morfológica do tecido retiniano. Ele garante que a delicada estrutura da retina permaneça intacta, permitindo que seções sejam usadas em estudos subsequentes de imunofluorescência com alta precisão e confiabilidade. Em comparação com outros métodos, como a inclusão em parafina, a criosecção tem vantagens significativas, pois preserva melhor a morfologia e a antigenicidade do tecido, tornando-a particularmente adequada para coloração imuno-histoquímica2. A técnica de congelação é amplamente adotada para estudar uma variedade de tecidos complexos e até mesmo estruturas celulares finas3, permitindo análises precisas de sua arquitetura.
A IHC é uma técnica laboratorial poderosa e versátil que permite a visualização da localização de proteínas específicas nos tecidos. Essa técnica tornou-se uma pedra angular em ambientes clínicos e de pesquisa, onde é amplamente utilizada para diagnósticos, monitoramento de doenças e investigações biológicas. O sucesso de um experimento de IHC depende muito da preparação meticulosa da amostra, manuseio cuidadoso do tecido e controle preciso das condições de imunocoloração. Pequenas variações no protocolo podem impactar muito na qualidade dos resultados, ressaltando a importância da padronização e otimização1.
Quando combinados, o criosseccionamento e a IHQ oferecem vantagens incomparáveis para pesquisadores que buscam explorar a distribuição espacial, os níveis de expressão e as interações celulares de várias proteínas na retina. Essas metodologias permitem investigações detalhadas sobre os mecanismos moleculares subjacentes ao desenvolvimento, função e doença da retina. Esses insights são particularmente valiosos no estudo de distúrbios da retina, incluindo degeneração macular relacionada à idade, retinopatia diabética e retinite pigmentosa. Ao elucidar a fisiopatologia dessas condições, a criossecção e a IHQ contribuem para a identificação de potenciais biomarcadores e o desenvolvimento de novas estratégias terapêuticas.
Apesar de sua utilidade, trabalhar com retinas de camundongos apresenta desafios únicos. Os camundongos são amplamente utilizados como modelos animais em pesquisas oftalmológicas devido à sua semelhança genética com os humanos e sua estrutura retiniana bem caracterizada. No entanto, a obtenção de criossecções de alta qualidade é inerentemente difícil devido ao tamanho pequeno e à natureza delicada do tecido retiniano do camundongo. Este estudo fornece uma metodologia detalhada para criosseccionar e realizar IHQ em retinas de camundongos, destacando considerações técnicas críticas e oferecendo estratégias de otimização para enfrentar esses desafios. Ao refinar essas técnicas, os pesquisadores podem obter resultados consistentes e de alta qualidade, avançando no estudo da biologia e patologia da retina.
Protocolo
O procedimento seguiu as diretrizes estabelecidas pela Associação de Pesquisa em Visão e Oftalmologia para o Uso de Animais em Pesquisa. A aprovação foi obtida do Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Hospital Popular da Província de Sichuan. Camundongos C57Bl/6J machos, com idade entre dois e três meses e pesando 25-30 g, foram utilizados para este protocolo. Uma lista abrangente dos reagentes e equipamentos utilizados neste estudo é fornecida na Tabela de Materiais.
1. Preparação do reagente
- 1x tampão PBS
- Pesar 8 g de NaCl, 1,42 g de Na2HPO4, 0,42 g de KH2PO4 e 0,2 g de KCl usando uma balança. Transfira-os para um copo e adicione uma quantidade adequada de água bidestilada (ddH2O) para dissolver os componentes. Deitar a solução num balão volumétrico de 1 l e ajustar o volume para 1 l com ddH2O.
- Solução de paraformaldeído (PFA) a 4%
- Adicione 0,4 g de pó de PFA e 15 μL de NaOH 1 M a um tubo cônico de 15 mL contendo 8 mL de tampão PBS 1x. Coloque o tubo em banho-maria regulado para 60 °C para dissolver completamente o pó de PFA. Ajuste o volume final para 10 mL com 1x PBS.
- Solução de bloqueio de IHC
- Combine 1 mL de soro de burro normal, 20 μL de 20% NaN3, 200 μL de 20% Triton X-100 e 18,78 mL de tampão 1x PBS. Homogeneizar.
- Solução de sacarose a 30%
- Dissolva 15 g de sacarose em 40 mL de tampão PBS 1x. Ajuste o volume para 50 mL com 1x tampão PBS e misture até dissolver totalmente.
- Solução de anticorpos secundários IHC
- Dilua o anticorpo anti-coelho de cabra conjugado com Alexa Fluor 488 na proporção de 1:300 e DAPI na proporção de 1:2.000 usando o tampão de bloqueio preparado.
2. Crioseccionamento do globo ocular do rato
- Dissecação do globo ocular
- Anestesiar um camundongo C57Bl / 6 de 3 meses de idade (aproximadamente 25 g) por meio de injeção intraperitoneal de tribromoetanol a 2% na dosagem de 15 μL / g de peso corporal. Sacrifique o camundongo usando luxação cervical (seguindo protocolos aprovados institucionalmente).
- Marque o lado superior do globo ocular com um marcador azul na esclera (Figura 1A). Remova os globos oculares usando uma tesoura.
- Se houver sangue na superfície do globo ocular, limpe-o suavemente com um pano sem fiapos. Sob um microscópio de dissecação, remova cuidadosamente os músculos extraoculares presos aos globos oculares.
- Fixação
- Transfira os globos oculares dissecados para um tubo de microcentrífuga de fundo redondo de 2 mL contendo 1 mL de PFA a 4%. Fixe os globos oculares por 10 min. Em seguida, transfira os globos oculares para uma placa de Petri invertida de 3 ou 6 cm.
- Sob um microscópio de dissecação, faça uma pequena incisão (aproximadamente 1-2 mm) na córnea usando uma pinça fina e uma tesoura oftálmica. Coloque os globos oculares de volta na solução de PFA a 4% por mais 2 h de fixação no gelo (Figura 1B).
- Crioproteção
- Remova o fixador e lave os globos oculares três vezes com 1x solução tampão PBS. Transfira os globos oculares para um tubo de microcentrífuga de fundo redondo de 2 mL contendo 1 mL de solução de sacarose a 30% para crioproteção a 4 °C. Deixe os globos oculares assentarem no fundo do tubo ou deixe-os durante a noite.
- Revestindo o globo ocular
- Transfira um globo ocular para uma placa de Petri invertida com o lado da córnea voltado para cima. Seque o excesso de solução da córnea usando um pano sem fiapos. Mergulhe um segmento de 2-3 cm de fio de tênis na cola (composta de cianoacrilatos) contida em um tubo de microcentrífuga de 0,2 mL e remova-o rapidamente.
- Sob um microscópio de dissecação, prenda uma extremidade da corda de tênis com super cola residual no centro da córnea úmida. Deixe a cola solidificar por 10-20 s. Segure a outra extremidade da corda do tênis e mergulhe o globo ocular em um tubo de microcentrífuga de 200 μL cheio de super cola, garantindo que a esclera esteja completamente imersa por aproximadamente 1 s.
- Remova rapidamente o globo ocular e mergulhe-o em PBS (Figura 1C). A cola na superfície da esclera solidificará imediatamente.
- Remoção da córnea
- Seque o excesso de PBS na superfície da cola solidificada usando um pano sem fiapos. Sob um microscópio de dissecação, remova a córnea com uma tesoura oftálmica enquanto segura a corda de tênis presa.
- Incorporação
- Usando uma pinça, extraia cuidadosamente a lente da ocular. Absorva qualquer excesso de solução de sacarose preso dentro da ocular com uma tira de lenço umedecido. Transfira a ocular para um molde de incorporação preenchido com o composto de temperatura de corte ideal (OCT).
- Encha a ocular completamente com OCT. Posicione a ocular de forma que fique voltada para a parede lateral do molde de incorporação, garantindo que o plano sagital fique paralelo à parte inferior do molde. Use a marca azul na esclera como referência. Transfira o molde de incorporação contendo a ocular para um freezer a -80 °C (Figura 1D). A ocular será congelada em cinco minutos.
- Crioseccionamento
- Transferir a ocular congelada para um criostato regulado para -20 °C e deixá-la equilibrar no interior da câmara durante 30 min. Corte a ocular com uma espessura de 12 μm. Monte as seções em lâminas de vidro carregadas positivamente para uso posterior.
3. Coloração imuno-histoquímica
- Escaldante
- Coloque as mechas congeladas em lâminas e leve ao forno a 37 °C por 30-60 min para garantir a adesão adequada do tecido à lâmina.
- Lavagem
- Usando uma caneta PAP, desenhe um círculo ao redor das seções do slide. Mergulhe a lâmina em um frasco Coplin contendo 1x tampão PBS. Coloque o frasco Coplin em uma coqueteleira lenta e lave as seções por 2 × 10 min para remover o composto OCT.
- Bloqueio e permeabilização
- Coloque a lâmina horizontalmente em uma câmara de umidade. Adicione a solução de bloqueio às seções circuladas e permita o bloqueio e a permeabilização à temperatura ambiente por 30 min.
- Incubação primária de anticorpos
- Aspire cuidadosamente a solução de bloqueio da lâmina. Adicionar o anticorpo primário, diluído na solução de bloqueio, às secções. Incubar as secções na câmara de humidade a 4 °C durante a noite para garantir a ligação óptima do anticorpo ao antigénio alvo.
- Incubação secundária de anticorpos
- Aspire a solução de anticorpo primário e lave a lâmina duas vezes com 1x PBS por 2 × 10 min. Adicionar o anticorpo secundário adequado, misturado com DAPI e diluído na solução de bloqueio.
- Incube as seções em uma câmara de umidade escura à temperatura ambiente por 1 h para permitir a ligação secundária de anticorpos e a contracoloração com DAPI.
- Montagem
- Aspire a solução de anticorpo secundário e enxágue a lâmina com 1x PBS por 2 × 10 min. Use um Kimwipe para apagar qualquer PBS restante no slide.
- Aplique uma quantidade adequada de meio de montagem antidesbotamento nas seções e cubra-as com uma lamínula. Armazene as amostras montadas a 4 °C no escuro para preservar a fluorescência e evitar o fotobranqueamento.
4. Exames por imagem
- Adquira sinais de fluorescência das seções retinianas imunomarcadas usando um microscópio confocal de varredura a laser. Ajuste as configurações para resolução e sensibilidade ideais para capturar sinais de fluorescência claros e distintos.
- Certifique-se de que filtros apropriados sejam usados para detectar os comprimentos de onda específicos dos fluoróforos empregados no experimento.
Resultados
Seguindo o protocolo descrito acima, os olhos de camundongos C57Bl/6J do tipo selvagem com 1 mês de idade foram fixados em PFA a 4%. As amostras fixadas foram então incluídas em OCT e criosseccionadas. Os cortes foram imunomarcados com um anticorpo anti-PDE6B e contracorados com DAPI para marcar os núcleos. PDE6B é uma proteína de fototransdução especificamente expressa em células fotorreceptoras de bastonetes4. Em comparação com os protocolos tradicionais, este protocolo melhora significativamente a morfologia das retinas de camundongos e a qualidade das imagens imunofluorescentes, proporcionando grande consistência. Os resultados representativos demonstram imunomarcação bem-sucedida de criossecções retinianas usando anti-PDE6B (Figura 2). Os segmentos externos dos fotorreceptores foram claramente marcados com anti-PDE6B. Todos os segmentos externos dos fotorreceptores pareciam morfologicamente intactos e os segmentos individuais eram discerníveis. Nenhum descolamento de retina foi observado na seção. Além disso, os segmentos internos e a camada nuclear externa permaneceram intactos.
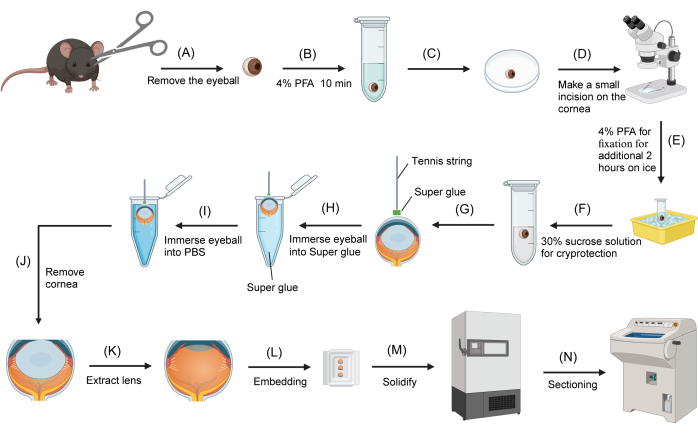
Figura 1: Procedimento de criossecção do olho do camundongo. (A) Os globos oculares são removidos de camundongos sacrificados usando uma tesoura. (B) Os globos oculares são transferidos para um tubo de microcentrífuga de fundo redondo de 2 mL contendo 4% de PFA e fixados por 10 min. (C) Um globo ocular é transferido para a superfície de uma placa de Petri invertida de 3 cm. (D) Sob um microscópio de dissecação, uma pequena incisão (aproximadamente 1 mm) é feita na córnea. (E) O globo ocular é devolvido ao fixador PFA a 4% para fixação adicional no gelo por 2 h. (F) O fixador é substituído por sacarose a 30% para crioproteção. (G) A corda de tênis é mergulhada em super cola e a extremidade é presa à superfície central da córnea. (H) Depois que a corda de tênis está firmemente presa à córnea, a outra extremidade da corda é segurada e o globo ocular é imerso na cola. (I) O globo ocular é imediatamente removido da super cola e imerso em PBS. (J) O globo ocular é removido do PBS e a córnea é cortada com uma tesoura, segurando a extremidade livre da corda do tênis. (K) A lente é extraída com uma pinça. (L) A ocular é transferida para um molde de incorporação preenchido com OCT. (M) O molde de incorporação é transferido para um freezer a -80 °C. (N) O bloco OCT congelado que contém a ocular é seccionado usando um criostato. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens imunofluorescentes de seções de retina de camundongos. Os cortes retinianos foram imunomarcados com anti-PDE6B (verde) e contracorados com DAPI (azul). OS, segmento externo; IS, segmento interno; ONL, camada nuclear externa. Barra de escala: 10 μm. Clique aqui para ver uma versão ampliada desta figura.
Discussão
Vários fatores influenciam a qualidade dos cortes de tecido, incluindo a composição da solução de fixação, o tempo de fixação e crioproteção e os métodos de incorporação5. Ao enuclear o globo ocular do mouse, é essencial remover os músculos extraoculares e outros tecidos conjuntivos ligados ao globo ocular. Se não forem removidos adequadamente, esses tecidos podem causar deformação do globo ocular durante a extração da órbita ocular, potencialmente levando ao descolamento da retina. Durante o processo de fixação, uma incisão deve ser feita na córnea para liberar a pressão intraocular (PIO). Sem essa incisão, o globo ocular pode encolher, resultando em deformação e descolamento de retina. O aumento da permeabilidade do globo ocular durante a fixação permite que a PIO force o efluxo de humor aquoso do espaço intraocular. Ao fazer uma incisão na córnea, a pressão interna do globo ocular é aliviada, o que ajuda a prevenir o encolhimento e permite que o fixador penetre com mais eficácia no espaço intraocular para uma fixação ideal.
A retina consiste em 10 camadas de tecidos estruturalmente distintos e delicados. Para preservar a integridade morfológica, é crucial fixar o tecido adequadamente. A solução de PFA é comumente usada como fixador6, pois pode ser preparada na hora. O uso de uma solução de formalina pré-fabricada deve ser evitado, pois é propenso à oxidação7, o que pode levar a uma má fixação e morfologia retiniana comprometida. Além disso, a fixação não deve exceder 2 h, pois a fixação estendida pode causar autofluorescência excessiva, particularmente nas células do epitélio pigmentar da retina (EPR), o que pode interferir na interpretação do resultado. Esse problema é frequentemente observado em seções retinianas de parafina, pois normalmente são preparadas a partir de globos oculares que foram fixados por longos períodos, às vezes durante a noite ou até mais.
Demonstramos anteriormente que revestir o globo ocular com uma camada de super cola melhora significativamente a qualidade das criossecções retinianas de camundongos8. Inicialmente, uma ponta de pipeta foi usada para espalhar super cola na superfície da esclera; No entanto, esse método ocasionalmente fazia com que o globo ocular aderisse à superfície de suporte, como a placa de Petri. Para resolver esse problema, a técnica de revestimento foi modificada mergulhando o globo ocular na cola após prender um segmento de corda de tênis à córnea9, conforme descrito no protocolo acima. O segmento de corda de tênis anexado serve como uma alça para facilitar o manuseio e facilita o corte e a remoção subsequentes da córnea.
A distribuição dos fotorreceptores não é homogênea na retina do camundongo. Especificamente, os fotorreceptores S-cone estão predominantemente localizados no lado inferior das retinas C57Bl / 6J, enquanto os cones ML são distribuídos de maneira mais uniforme por toda a retina10. Portanto, marcar o globo ocular antes da enucleação é essencial para garantir a orientação desejada (dorsal-ventral ou nasal-temporal) durante o processamento.
No entanto, existem limitações para este protocolo. O rato não é perfundido antes do sacrifício. Quando o alvo da marcação é a vasculatura da retina e um anticorpo secundário anti-camundongo é usado, pode ocorrer marcação não específica dos tecidos vasculares pelo anticorpo secundário. Nesses casos, recomendamos perfundir o mouse antes de sacrificar para evitar esse problema.
Em resumo, foi descrito um protocolo que permite aos pesquisadores produzir consistentemente criossecções retinianas de camundongos de alta qualidade para imunocoloração. Este protocolo é relativamente fácil de seguir, tornando-o particularmente útil para pesquisadores com experiência limitada.
Divulgações
Os autores não têm conflitos a divulgar.
Agradecimentos
Este projeto de pesquisa foi apoiado pela Fundação Nacional de Ciências Naturais da China (82371059 (ZZ), 82102470 (JW)), Programa de Ciência e Tecnologia de Sichuan (2023JDZH0002 (ZZ)).
Materiais
| Name | Company | Catalog Number | Comments |
| -80 °C freezer | Haier | DW-86L626 | |
| Adhesion microscope slides | CITOTEST | 80312-3161 | |
| Alexa488-Goat anti-Rabbit | Proteintech | SA00006-2 | |
| C57BL/6J mouse | The Jackson Laboratory | 664 | |
| Cryosection microtome | Leica | N/A | |
| Cryostat | LEICA | N/A | |
| DAPI | Cell Signaling Technology | 4083S | |
| Dissecting microscope | ZEISS | 3943030830 | |
| Donkey serum | Solarbio | S9100 | |
| Embedding molds | Thermo Fisher Scientific | 1841 | |
| Fine dissection scissors | RWD | S13001-10 | |
| Fine forceps | RWD | F11020-11 | |
| Fluoromount aqueous mounting medium | Sigma-Aldrich | F4680 | |
| Incubator | Shanghai Yuejin | N/A | |
| KCl | Sigma-Aldrich | 1049330500 | |
| KH2PO4 | Sigma-Aldrich | 1048771000 | |
| Kimwipes | Thermo Fisher Scientific | FIS-06666 | |
| Laser confocal microscope | ZEISS | N/A | |
| Microscope cover Glass | CITOTEST | 80340-3610 | |
| Na2HPO4 | Sigma-Aldrich | 1065860500 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NaOH | Sigma-Aldrich | 1091371003 | |
| O.C.T compound | Sakura | 4583 | |
| Pap pen | Sigma-Aldrich | Z672548 | |
| PFA | Sigma-Aldrich | 441244 | |
| Rabbit anti-PDE6B | Proteintech | 22063-1-AP | |
| Shaker | SCILOGEX | 8042210200 | |
| Spring scissors | RWD | S11036-08 | |
| Sucrose | BioFroxx | 1245GR500 | |
| Super glue | Deli | 7147S | |
| Tennis string (1.24 mm) | Gosen | TS761 | |
| Tribromoethanol | Macklin | T831042 | |
| Triton X-100 | Solarbio | IT9100 |
Referências
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Ramos-Vara, J. A., Miller, M. A., et al. When tissue antigens and antibodies get along: Revisiting the technical aspects of immunohistochemistry--the red, brown, and blue technique. Vet Pathol. 51 (1), 42-87 (2014).
- Usukura, E., et al. A cryosectioning technique for the observation of intracellular structures and immunocytochemistry of tissues in atomic force microscopy (AFM). Sci Rep. 7 (1), 6462 (2017).
- Park, P. S. Supramolecular organization of rhodopsin in rod photoreceptor cell membranes. Pflugers Arch. 473 (9), 1361-1376 (2021).
- Boonstra, H., Oosterhuis, J. W., Oosterhuis, A. M., Fleuren, G. J. Cervical tissue shrinkage by formaldehyde fixation, paraffin wax embedding, section cutting and mounting. Virchows Arch A Pathol Anat Histopathol. 402 (2), 195-201 (1983).
- Stradleigh, T. W., Ishida, A. T. Fixation strategies for retinal immunohistochemistry. Prog Retin Eye Res. 48, 181-202 (2015).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. J Oral Maxillofac Pathol. 16 (3), 400-405 (2012).
- Li, L., et al. An improved method for preparation of mouse retinal cryosections. Eur J Histochem. 64 (3), 3154 (2020).
- Yang, J., et al. A quick protocol for the preparation of mouse retinal cryosections for immunohistochemistry. Open Biol. 11 (7), 210076 (2021).
- Szel, A., et al. Unique topographic separation of two spectral classes of cones in the mouse retina. J Comp Neurol. 325 (3), 327-342 (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados