Method Article
Количественный анализ стабилизации мембраны эндоплазматического ретикулума (MAM), ассоциированной с митохондриями, в нейронной модели болезни Альцгеймера (БА)
В этой статье
Резюме
В данной работе мы описываем измерение скорости аксонального транспорта конститутивных стабилизаторов мембран эндоплазматического ретикулума (АМР), ассоциированных с митохондриями, путем увеличения или поддержания выработки нейротоксического β-амилоида (Aβ) из нейронов болезни Альцгеймера (БА) в режиме реального времени, что служит прямой и количественной метрикой для измерения стабилизации MAM и содействия разработке терапевтических средств для лечения болезни Альцгеймера.
Аннотация
Здесь представлен метод количественной оценки стабилизации митохондриально-ассоциированных эндоплазматических мембран ретикулума (MAM) в трехмерной (3D) нейронной модели болезни Альцгеймера (БА). Для начала свежие человеческие нейропрогениторные клетки ReN, экспрессирующие β-амилоидный белок-предшественник (APP), содержащий семейную болезнь Альцгеймера (FAD) или наивные клетки ReN, выращивают в тонких (1:100) тканевых культуральных планшетах, покрытых Матригелем. После того, как клетки достигают конфлюенции, их электропорируют экспрессирующими плазмидами, кодирующими красный флуоресцентный белок (RFP)-конъюгированную митохондрий-связывающую последовательность AKAP1(34-63) (Mito-RFP), которая обнаруживает митохондрии или конститутивные стабилизаторы MAM MAM 1X или MAM 9X, которые стабилизируют плотные (6 нм ± шириной зазора 1 нм) или свободные (24 нм ± шириной зазора 3 нм) MAM соответственно. Через 16-24 ч клетки собирают и обогащают с помощью флуоресцентно-активируемого сортировщика клеток (FACS). Равное количество клеток, обогащенных FACS, засевается в трехмерную матрицу (1:1 по Матригелю) и позволяет им дифференцироваться в зрелые нейроны в течение 10 дней. Изображения живых клеток 10-дневных дифференцированных клеток, экспрессирующих RFP-конъюгированные стабилизаторы MAM, захватываются под флуоресцентным микроскопом, оснащенным камерой для визуализации живых клеток, поддерживающей CO2 (5%), температуру (37 °C) и влажность (~90%). С этой целью мы выполнили визуализацию живых клеток и кимографический анализ для измерения подвижности свободных митохондрий, меченных митохондриями Mito-RFP или ER-связанными митохондриями с узкой или свободной шириной зазора, стабилизированными MAM 1X или MAM 9X соответственно, в наиболее протяженном нейронном отростке каждого нейрона ReN GA длиной не менее 500 нм, рассматривая их как аксоны.
Введение
Новые данные свидетельствуют о том, что специализированные митохондриально-ассоциированные эндоплазматические контакты ретикулума (MERCs), биохимически собранные как митохондриально-ассоциированные мембраны ER, часто называемые MAM 1,2, играют роль в развитии нескольких нейродегенеративных заболеваний, включая AD 3,4. Эти MAM состоят из богатых холестерином липидных рафтоподобных микродоменов в ER и внешней мембране митохондрий, связанных с рядом белков, которые создают структурные и функциональные различия среди MAM 5,6,7. Недавно сформулированная гипотеза MAM утверждает, что увеличение MAM приводит к увеличению продукции Aβ и патогенному каскаду AD, включая образование нейрофибриллярного клубка (NFT), дисгомеостаз кальция и нейровоспаление. Около 5-20% митохондрий вступают в физический контакт с ER, образуяMAMs 9. Ширина зазора MAM определяется гладким и шероховатым ER (sER и rER соответственно). Переменная ширина промежутка между sER-митохондриями (10-50 нм) и rER-митохондриями (50-80 нм) позволяет предположить, что ширина зазора MAM имеет длинный спектр, который колеблется от узкого (~10 нм) до свободного (~80 нм)10,11,12,13. Ширина зазора MAM определяет функции MAM, такие как гомеостаз кальция и транспорт липидов 1,14. Недавнее исследование показало, что MAM, образованные между тесно связанными (~10 нм) ER и митохондриями, называемые полными MAM, являются апоптотическими. Напротив, MAM, образованные между слабо связанными (~25 нм) ER и митохондриями, называемые дефектными или средними MAM, являются антиапоптотическими 14,15,16. Стабилизация МАМ с шириной промежутка 6 нм ± 1 нм увеличивала генерацию Aβ из новой трехмерной (3D) нейронной модели культуры БА. Напротив, стабилизация MAM с шириной зазора 24 нм ± 3 нм не оказывает влияния на Aβ17-го поколения. Это открытие впервые свидетельствует о том, что регулирование степени стабилизации MAM, но не дестабилизация MAM, является ключом к регулированию генерации Aβ. Попытка полностью дестабилизировать МАМ может привести к нежелательным последствиям, поскольку МАМ поддерживают несколько клеточных событий, критически важных для выживания клеток.
Модуляция MAM является новой областью исследований с потенциальными последствиями для различных расстройств, включая рак, метаболические нарушения и нейродегенеративныезаболевания. Несмотря на доступность многих модуляторов MAM, до сих пор не было предпринято серьезных попыток проверить их способность дестабилизировать MAM и снижать патологию болезни Альцгеймера, в первую очередь потому, что структурное разнообразие MAM делает их очень сложной системой для разработки лекарств. Но недавно разработанная структурная системная фармакология, которая учитывает специфические свойства мишеней для лекарств иих окружения, должна преодолеть трудности и разработать высокоэффективные препараты, нацеленные на MAM или MAM-ассоциированные белки при болезни Альцгеймера. Однако поиск эффективного модулятора стабилизации MAM требует методов точной количественной оценки степени стабилизации MAM. Традиционные методы, такие как электронная микроскопия (ЭМ) или микроскопия сверхвысокого разрешения, имеют ограничения в определении стабилизации МАМ. Преодоление этих проблем, вероятно, потребует разработки новых, более динамичных методов визуализации или биохимических анализов, которые могут обеспечить количественные измерения стабилизации MAM в живых клетках. Сфокусированная ионно-лучевая сканирующая электронная микроскопия (FIB-SEM) первичных нейронов показала, что ER имеет тенденцию формировать сеть вокруг митохондрий, что может ограничивать митохондриальную подвижность20,21. Нарушение митохондриальных транспортных систем, либо ретроградное, либо антероградное, либо и то, и другое, оказывало глубокое влияниена синаптическую и нейрональную функцию. Таким образом, новый анализ аксональной скорости ER-связанных митохондрий, основанный на визуализации живых клеток и кимографии, описанный здесь в качестве метрики для количественного измерения стабилизации MAM, облегчит идентификацию модуляторов MAM, которые могут переключать порог стабилизации MAM на тот, который сохраняет или, возможно, понижает, а не увеличивает генерацию Aβ.
протокол
Модели нейронной культуры БА: В этом исследовании использовались нейроны, полученные из человеческих нейронных клеток-предшественников ReN [наивный ReN (Millipore)] или клеток ReN, экспрессирующих семейные мутации AD (fAD) в гене белка-предшественника амилоида (APP) (APPSwe/Lon), клетках ReN GA. Трехмерная (3D) культуральная система ReN-GA повторяет патологию болезни Альцгеймера, а именно нейрофибриллярные клубки, управляемые олигомерами Aβ 23,24. Наивные элементы ReN коммерчески доступны. Линии ReN GA были получены от доктора Ду Й. Кима, доцента Массачусетской больницы общего профиля (MGH)23,24,25.
Экспрессия плазмид: AKP1 (34-63) и ER-таргетная последовательность белков Ubc 6 (283-303), сцепленные непосредственно с RFP (Mito-RFP-ER обозначается как MAM 1X) или содержат линкер из 9 аминокислот (Mito-9X-RFP-ER, обозначаемый как MAM 9X), предназначенный для стабилизации MAM шириной зазора 6 нм ± 1 нм или 24 нм + 3 нм соответственно15,26 (рис. 1A).
1. Электропорация
- Трансфекция клеток стабилизаторами MAM (1-2 ч)
ПРИМЕЧАНИЕ: Следуйте протоколу, описанному производителем набора нуклеофлекторов (Таблица материалов). Прежде чем начать, приготовьте 6-луночные чашки для культуры со стеклянным дном, предварительно покрытые DMEM/F12, содержащим 1% Матригеля (далее именуемый матрицей базальной мембраны [BMM]). Используйте 2 мл BMM для покрытия каждой лунки. Инкубируйте не менее 1 часа при 37 °C. BMM, фильтрующий материал, наконечники для пипеток и пипетки должны быть предварительно охлаждены перед смешиванием, чтобы предотвратить затвердевание BMM.- Аспирируйте BMM смесь. Замените 2 мл DMEM/F12 комнатной температуры (RT) в каждой лунке.
- Комбинируйте Nucleofector с Добавкой 1 в соотношении 4,5:1 (соотношение 82 μL:18 μL Nucleofector/Supplement на 100 μL раствора). Для каждой желаемой трансфекции необходимо 100 μл Nucleofector.
- Вихревая ДНК. Затем добавьте 1-5 г ДНК (за одну обработку) в микроцентрифужные пробирки объемом 1 мл для каждой трансфекции.
- Используйте акустазу, чтобы собрать тарелку здоровых клеток ReN-GA.
ПРИМЕЧАНИЕ: Пластинчатые клетки в расширяющих средах (Таблица 1) в 100 мм чашках для культуры тканей и ждут, пока слияние не достигнет 70-80%.- Отсадите существующую среду и промойте один раз 10 мл PBS.
- Добавьте 1 мл акутазы непосредственно в клетки и инкубируйте в течение 5-10 минут при 37 °C.
- Выбейте ячейки из чашки, слегка постучав по стенке чашки. Проверьте под микроскопом, чтобы убедиться, что клетки ослаблены и свободно текут.
- Нейтрализуйте акутазу с помощью 10 мл DMEM/F12 и перенесите в чистую пробирку объемом 15 мл.
- Центрифугируйте необходимое количество клеток при давлении 274 х г в течение 5 мин и аспирируйте надосадочную жидкость для удаления мертвых клеток. Затем повторно суспендируйте гранулу в 10 мл DMEM/F12.
- Посчитайте ячейки, чтобы определить плотность.
ПРИМЕЧАНИЕ: В этом исследовании для подсчета количества клеток использовался автоматический счетчик клеток. Для одной электропорации требуется 3-5 X 106 клеток (например, для 5 процедур потребуется 15-25 X 106 клеток).- Возьмите 10 μл взвешенных клеток и добавьте к стороне А камеры для подсчета клеток. Затем добавьте 10 μL на сторону B.
ПРИМЕЧАНИЕ: Добавьте клеточную суспензию, наклонив пипетку в сторону. Избегайте образования пузырей, не нажимая дальше первого упора на поршне пипетки. - Поднесите заполненную счетную камеру к счетчику ячеек и вставьте сторону А в основной слот спереди.
- После нажатия кнопки «Измерить» обратите внимание на количество клеток в мл.
- Выньте камеру, переверните ее на сторону В и повторите шаги 1.1.5.2-1.1.5.3.
- Сложите эти два числа, затем разделите на 4 (если не используете Trypan Blue), затем умножьте число на миллилитры жидкости, в которой находятся клетки, чтобы получить общее количество клеток в суспензии.
- Возьмите 10 μл взвешенных клеток и добавьте к стороне А камеры для подсчета клеток. Затем добавьте 10 μL на сторону B.
- Центрифугируйте необходимое количество клеток при давлении 274 х г в течение 5 мин и отсасывайте надосадочную жидкость.
- Суспендировать гранулы в 100 мкл смеси Nucleofector за одну электропорацию. (например, 500 мкл на 5 процедур).
ПРИМЕЧАНИЕ: Оставление клеток в растворе нуклеофектора дольше 15 минут может снизить жизнеспособность клеток и общую эффективность. - Добавьте 100 мкл клеточной суспензии в одну из пробирок, содержащих ДНК, и перемешайте с помощью пипетирования.
- Перелейте смесь ДНК в кювету для электропорации и закройте прилагаемой крышкой. Чтобы избежать образования пузырьков, наклоните кювету вниз и медленно пипеткайте.
- Выберите программу Nucleofector, подходящую для используемого устройства. Для устройства, используемого в этом исследовании, используйте программу A-033 для трансфекции. Для оптимизации попробуйте все 5 программ Nucleofector, чтобы определить наиболее подходящую для каждого типа клеток.
ПРИМЕЧАНИЕ: Подтверждением успешной электропорации является видимая пена в верхней части смеси. - Немедленно, используя прилагаемые стерильные пипетки, добавьте ~500 μL DMEM из предварительно заполненного 6-луночного планшета в кювету. Аккуратно перемешайте один раз, а затем переложите электропорированные элементы и среду в соответствующую лунку.
ПРИМЕЧАНИЕ: После электропорации клетки становятся чрезвычайно чувствительными, поэтому очень важно быстро переносить среду и осторожно пипетировать. - Повторите шаги 1.1.8-1.1.11 для всех оставшихся обработок ДНК.
- Инкубируйте клетки при 37 °C в присутствии CO2 (5%) в течение ночи.
- На следующий день замените среды свежими средами для дифференцировки (табл. 2) и дайте клеткам дифференцироваться в течение 10 дней. Каждые 2-3 дня заменяйте на свежие среды.
2. Визуализация живых клеток
- Подготовка клеток к микроскопии живых клеток (30 мин)
- Подготовка камеры живых клеток (перед перемещением клеток в камеру)
- Убедитесь, что бак CO2 и увлажнитель прикреплены к камере, клапаны открыты, а баки заполнены.
- Установите температуру на 37 °C, CO от2 до 5%, а влажность на 95%. (Для выравнивания уровней может потребоваться некоторое время).
- Поместите в камеру 6-луночный планшет с клетками и отрегулируйте фокус микроскопа до тех пор, пока клетки не станут видимыми.
- Включите лазер (Table of Materials).
- Чтобы захватить RFP-сигнал, возбуждайте флуорофор с помощью лазера с длиной волны 594 нм и используйте излучение с длиной волны 570-640 нм. Для GFP используйте лазер с длиной волны 488 нм для возбуждения и излучения 510-540 нм.
- С помощью встроенного флуоресцентного фильтра отрегулируйте интенсивность сигнала до тех пор, пока фоновый сигнал не рассеется (должен быть почти полностью черным).
- Съемка видео аксонов в реальном времени (всего 10-15 часов)
ПРИМЕЧАНИЕ: Инвертированный конфокальный микроскоп Nikon C2 Eclipse Ti2 использовался для получения флуоресцентных изображений с помощью программного обеспечения NIS Element AR. Используйте 60-кратное увеличение при разрешении 512 пикселей, снимая видео со скоростью 1 кадр в секунду в течение 3 минут, производите более чистые кимографы.- Найти клетку, экспрессирующую RFP биосенсоров. Экспортируйте изображение ячейки для последующего использования перед съемкой видео.
- Обрежьте область сканирования так, чтобы она соответствовала аксону. Использование меньшей области сканирования сокращает время обработки микроскопа и значительно упрощает создание нимографии.
- Отключите все лазеры, чтобы программное обеспечение работало более плавно. Обратите внимание, что при запуске программы со всеми активными лазерами захватываются не все кадры.
ПРИМЕЧАНИЕ: Красный флуоресцентный сигнал от сомы намного ярче, чем в аксоне. Таким образом, сома исключается для увеличения общей интенсивности сигнала в аксоне. Перейдите на вкладку Измерение времени . - Установите интервал 1 кадр в секунду и установите общее время 181 с.
- Нажмите кнопку Выполнить.
- Сохраните этот файл как файл .nds (правильно помеченный) и повторите процесс ~10 раз для каждого стабилизатора MAM (MAM 1X или MAM 9X).
ПРИМЕЧАНИЕ: Мощность лазера иногда приводила к заметному эффекту обесцвечивания сигнала RFP при слишком длительном сканировании. Важно учитывать быструю работу при съемке видео.
3. Постобработка (7 дней)
ПРИМЕЧАНИЕ: Для анализа транспорта и генерации кимографов использовались макросы Fiji ImageJ. Везикулы, которые двигались со скоростью менее 0,1 мм/с, были классифицированы как неподвижные. Частота движения частиц рассчитывалась путем деления количества частиц, движущихся в заданном направлении (антероградных, ретроградных) или не движущихся (неподвижных) на общее количество частиц, анализируемых в кимографе. Время, затраченное каждым везикулой на паузу или движение, рассчитывалось путем усреднения процента времени, проведенного в каждом состоянии для всех везикул в каждом анализируемом нейроне. Частотное распределение скорости и длины прогона было рассчитано с использованием только движущихся везикул для каждого экспериментального условия. Анализ проводили на 100 мм аксональных путях в течение 3 мин.
- Генерация кимографа
- Откройте файл .nds в Fiji ImageJ.
- Перейдите на вкладку Изображение и нажмите Свойства. Запишите соотношение пикселей к микронам. Это нужно для расчета в дальнейшем.
- Нажмите «Файл» > «Сохранить как» > Tiff, чтобы сохранить файл как .tiff в его папку (макрос автоматически сохранит все сгенерированное в эту папку).
- Перетащите макрос Kymo в ImageJ. Код приведен в дополнительном файле кодирования 1. Нажмите кнопку Выполнить.
- Не нажимайте OK. Переключитесь в окно MAX_raw. Вручную щелкните левой кнопкой мыши вдоль аксона и дважды щелкните, чтобы завершить отслеживание.
ПРИМЕЧАНИЕ: Обязательно отслеживайте аксон от сомы до терминала аксона. Таким образом, антероградные и ретроградные расчеты будут правильными. - Нажмите команду T или Добавить в менеджере ROI.
- Теперь нажмите OK. Кимограф будет сгенерирован в ранее созданной папке. (Ось X — длина аксона в микронах, а ось Y — время в секундах).
- Слежение за кимографом
- Перетащите кимограф в Fiji Image J (он должен быть автоматически помещен в папку, сделанную ранее).
- Перетащите макрос «Дорожка» на изображение J.
- В следующем запросе нажмите кнопку ОК. Если вы возобновляете работу с предыдущего этапа, введите числовую точку, с которой нужно продолжить, а затем нажмите клавишу Ok.
- С помощью инструмента «Прямоугольник » на панели « Выделение » выделите область в середине кимографа, которая имеет высоту 60 пикселей и всегда 100 мкм в поперечнике. Для этого разделим 100 на соотношение пикселя к микро, которое было зафиксировано на шаге 3.1.2.
- После выбора области нажмите Ctrl T, чтобы добавить i t к ROI и сохранить ROI в папке, с которой ведется работа (нажмите Еще в меню ROI, а затем Сохранить).
ПРИМЕЧАНИЕ: Инвертирование выделенной области нажатием Ctrl+Shift+I облегчит отслеживание. - Чтобы отследить движение отдельного везикулы, удерживайте клавишу Ctrl и щелкните левой кнопкой мыши сверху вниз.
- Чтобы сделать это, удерживайте Ctrl во время щелчка правой кнопкой мыши, и появится окно, показывающее, где отслеживаются аксоны. Если это выглядит хорошо, нажмите Ok.
- Чтобы продолжить и выбрать другой везикул, нажмите « Да» и повторите процесс, начиная с шагов 3.2.6-3.2.8. После того, как все видимые везикулы будут отслежены, нажмите «Нет». Это автоматически сохранит наложение, отслеживаемое вручную, в ту же папку.
- Измерение данных кимографа
- Создайте новую папку. Перетащите все сгенерированные текстовые файлы в папку.
- Откройте файл кимографа и запишите размеры.
- Перетащите макрос «Измерить» на изображение J.
- Введите соотношение микронов к пикселям, записанное ранее, в PixelScale.
- Измените ограничение скорости на 0,1. (Везикулы, движущиеся ниже этого предела, считаются неподвижными).
- Введите ранее записанные размеры кимографа. Файл сводки будет автоматически сгенерирован в созданной текстовой папке. Каждая суммарная заливка будет содержать % пройденного времени, общую скорость (мкм/с), общее расстояние, среднее пройденное сегмент, количество остановок и количество обращений. Код для генерации, отслеживания и измерения данных кимографа представлен в виде файла дополнительного кодирования 1.
Результаты
Визуализацию живых клеток и кимографический анализ проводили для измерения подвижности свободных митохондрий, меченных Mito-RFP или ER-связанными митохондриями плотных (6 нм ± 1 нм) или рыхлых (24 нм ± 3 нм) ширинами контакта, стабилизированных MAM 1X или MAM 9X, соответственно, в самом длинном нейронном отростке каждого ReN GA (AD) или ReN (наивного) нейрона, длина которого составляет не менее 500 нм. рассматривая его как аксон (Рисунок 1 и Рисунок 2). Частоты движений (общие, ретроградные и антероградные) рассчитывались путем деления количества движущихся или неподвижных RFP-меченых точек (MAM) на общее количество в кимографах (рис. 1A-E). Общая аксональная скорость меченых MAM 1X ER-связанных митохондрий была значительно снижена на ~50% по сравнению с митохондриями, меченными Mito-RFP, или MAM 9X-мечеными митохондриями, связанными с ER (рис. 1B). Количественный анализ также выявил значительные различия между общим и ретроградным движением MAM 1X-стабилизированных ER-связанных митохондрий по сравнению со свободными (Mito-RFP) или MAM 9X-стабилизированными митохондриями, связанными с ER. В то время как 53,82% ± 3,3% митохондрий, свободных от ER (Mito-RFP), были мобильными, только 26,6% ± 3,4% MAM 1X-меченых ER-связанных митохондрий были мобильными, что позволяет предположить, что стабилизация MAM значительно снижает общую подвижность аксонов митохондрий, тесно связанных с ER, по сравнению с митохондриями, не связанными или слабо связанными с ER (44,79% ± 2,6% MAM 9X против 53,82% ± 3,3% Mito RFP, соответственно) (Рисунок 1C). Как правило, как ретроградные, так и антероградные движения меченых MAM 1X ER-связанных митохондрий были значительно ниже по сравнению с мечеными MAM 9X или свободными митохондриями (Mito-RFP) (ретроградные: 12,33% ± 2,55% для MAM 1X против 25,78% ± 2,31% для Mito RFP; антероградные: 14,27% ± 2,81% для MAM 1X против 28,04% ± 2,48% для Mito RFP) (рис. 1D и E). В таблице 3 приведены точные скорости аксонов свободных митохондрий или митохондрий, плотно или слабо связанных с ЭР. Эти значения могут быть использованы в качестве замечательного количественного средства для оценки степени стабилизации MAM в диапазоне между плотными и рыхлыми MAM, что приводит к снижению генерации Ab. Скорость транспорта митохондриальных аксонов при стабилизации плотных и рыхлых MAM в наивных клетках ReN отражала транспортные паттерны, наблюдаемые в нейронах ReN GA (рис. 1F-G). Согласованные результаты между наивными нейронами ReN и нейронами APPSWE/LON, экспрессирующими ReN GA AD, позволяют предположить, что влияние на аксональный транспорт в основном связано с состоянием стабилизации MAM, независимо от наличия APPSwe/Lon или результирующей продукции Aβ.
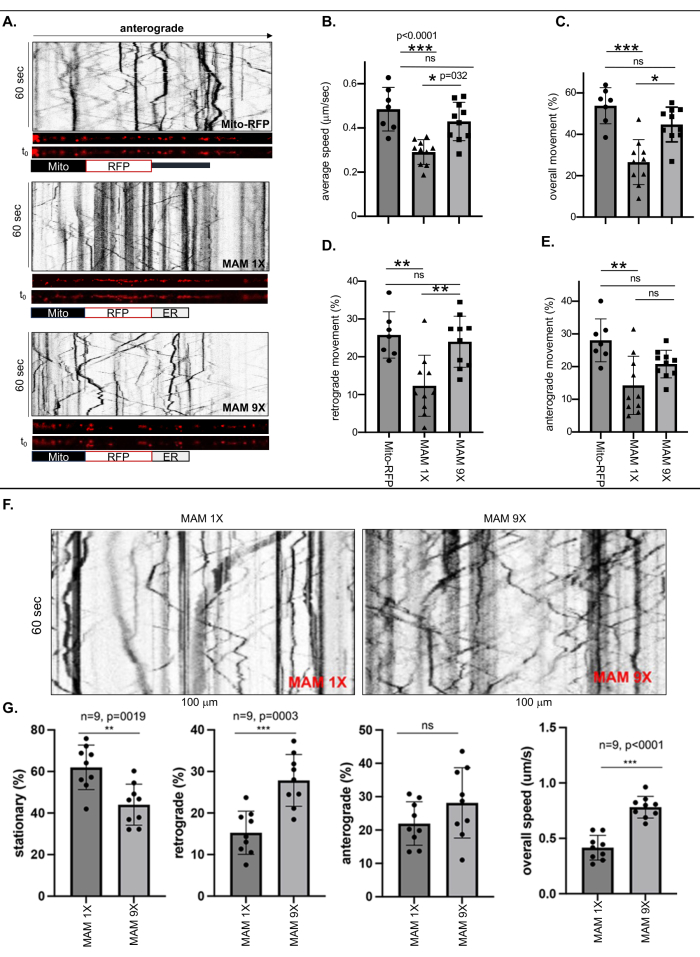
Рисунок 1: Стабилизация MAM с помощью MAM 1X снижает среднюю скорость и движение (общее, ретроградное и антероградное) ER-связанных митохондрий в аксонах дифференцированных ReN GA и наивных клеток ReN. (A) Репрезентативные кимографы меченых RFP точек пропуска, представляющих свободные митохондрии (Mito-RFP) или ER-связанные митохондрии, стабилизированные MAM 1X (плотные MAM, 6 нм ± шириной контакта 1 нм) или MAM 9X (свободные MAM, 24 нм ± шириной контакта 3 нм) внутри аксонов (~100 нм). (В-Е) Количественный анализ (B) средней скорости и движения [(C) в целом, (D) ретроградного и (E) антероградного] Mito-RFP, MAM 1X или MAM 9X внутри аксонов 10-дневных дифференцированных клеток Ren-GA. >7; Был проведен двухсторонний ANOVA. *p < 0,05, **p < 0,001. Представитель трех независимых экспериментов. (F) Репрезентативные кимографы движения MAM 1X или MAM 9X внутри аксонов 10-дневных дифференцированных наивных ReN-клеток. (G) Количественный анализ процента (%) движения (стационарного, ретроградного и антероградного) и общей скорости (микрометр/секунда; мкм/с) MAM 1X- или MAM 9X-стабилизированных MAM внутри аксонов наивных ReN-клеток. n = 9; Был проведен двухсторонний ANOVA. p < 0,0001. Этот рисунок был адаптирован с разрешения Zellmer et al.17. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Изображения живых клеток аксонов наивных ReN-клеток, экспрессирующих MAM 1X или MAM 9X. Репрезентативные видеоизображения живых клеток, демонстрирующие движения MAM, стабилизированных MAM 1X или MAM 9X, внутри аксонов длиной 100 мкм 10-дневных дифференцированных GFP-экспрессирующих ReN клеток. n > 10 изображений из повторяющихся экспериментов. Стрелки указывают на антероградный транспорт. Масштабная линейка: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Реагент | Окончательная концентрация | Количество |
| DMEM с L-глютамином | Н/Д | 500 мл |
| Гепарин | 2 мкг/мл | 0,5 мл |
| В27 | 1x | 10 мл |
| bFGF | 20 нг/мл | 0,4 мл |
| ЭФР | 20 нг/мл | 0,5 мл |
| Пенициллин/стрептомицин | 100 ед./мл | 5 мл |
| Итог | 516,4 мл | |
| Фильтруйте материалы перед добавлением пенициллина/стрептомицина. Хранить при температуре 4 °C до 1 месяца. | ||
Таблица 1: Состав расширительных сред.
| Реагент | Окончательная концентрация | Количество |
| DMEM с L-глютамином | Н/Д | 500 мл |
| Гепарин | 2 мкг/мл | 0,5 мл |
| В27 | 1x | 10 мл |
| Пенициллион/Стрептомицин | 100 ед./мл | 5 мл |
| Итог | 515,5 мл | |
| Фильтруйте материалы перед добавлением пенициллина/стрептомицина. Хранить при температуре 4 °C до 1 месяца | ||
Таблица 2: Состав дифференцировочных сред.
| ReN GA | ReN (наивный) | ReN GA (3D) | |||||
| Общий (%) | Ретроградность (%) | Антероградность (%) | Средняя скорость (мм/с) | Ab40 (pM) | Ab42 (pM) | ||
| Mito-RFP | 53,82 ± 3,3% | 25,78 ± 2,31% | 28,04 ± 2,48% | 0,66 ± 0,03 | 0,69 ± 0,07 | 241.7 ± 26.74 | 13.77 ± 1.52 |
| MAM 1X | 26,6 ± 3,4% *** | 12,33 ± 2,5% *** | 14.27 ± 2.81% *** | 0,3 ± 0,02*** | 0,43 ± 0,04*** | 377,2 ± 76,87* | 26,62 ± 3,86* |
| MAM 9X | 44,79 ± 2,6% нс | 23,99 ± 2,17%нс | 20.80 ± 1.33%нс | 0,59 ± 0,02 нс | 0,62 ± 0,02 нс | 158,8 ± 3,27* | 17.01 ± 2.02* |
Таблица 3: Количественный анализ. Визуализация живых клеток и количественный анализ на основе кимографии средней скорости (скорости) и аксональных движений (общих, ретроградных и антероградных) Mito-RFP, MAM 9X и MAM 1X. Двусторонний ANOVA выполнялся для аксональной скорости или движения (%). n = 9. Для Aβ проводили обычный односторонний ANOVA; n = 3, три независимых эксперимента. Значимость измеряют по сравнению с нетрансфицированными (контрольными) клетками ReN GA. **p < 0,0001; *p < 0,05; Не является значимым (NS). Эта таблица была адаптирована с разрешения Zellmer et al.17.
Файл дополнительного кодирования 1: Код для генерации, отслеживания и измерения данных кимографа. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Ингибирование сигма-1 рецептора (S1R) подавляло стабилизацию MAM в нейрональных процессах и резко снижало (~90%) генерацию Aβ из аксонов, но не из сомы трехмерной (3D) системы культивирования клеток нейронного предшественника человека (ReN), экспрессирующих семейные мутации AD [FAD] в гене белка-предшественника амилоида [APP] (ReN GA)23,24,25,27. Составляющие стабилизаторы MAM (MAM 1X и MAM 9X) с RFP-меткой, предназначенные для стабилизации плотных (6 нм ± 1 нм) и рыхлых (24 нм ± 3 нм) MAM15,26, являются замечательными инструментами для количественного измерения стабилизации MAM. Оба стабилизатора не только демонстрируют одинаковую и стабильную экспрессию в клетках ReN GA, дифференцированных в 3D-матрице в течение ~10 дней, но и обнаруживают MAM в дискретных точках в соме и аксонах. Наиболее важным является то, что в то время как стабильная экспрессия MAM 1X в обогащенном FACS 3D ReN GA значительно увеличивала генерацию Aβ, экспрессия MAM 9X не оказывала никакого влияния17. Мы также проверили действие конститутивного стабилизатора MAM, содержащего 18 аминокислотных линкеров (MAM 18X), который обнаруживает и стабилизирует MAM >25 нм. В отличие от MAM 1X или MAM 9X, MAM 18X имеет эксклюзивную маркировку somal MAMs. Обогащенные FACS нейроны MAM 18X, экспрессирующие ReN GA, снижены Aβ поколения17. Эти результаты свидетельствуют о возможности порога стабильности МАМ, определяемого шириной их промежутка, которая колеблется от патогенных (увеличивающая генерацию Aβ) плотных МАМ до непатогенных (поддерживающих или снижающих генерацию Aβ) свободных МАМ. Поиск эффективного модулятора МАМ и его оптимальной концентрации, которая может обеспечить оптимальную стабилизацию МАМ, необходимую для пересечения порога от патогенных и непатогенных МАМ, откроет замечательный терапевтический путь к снижению аксонального или нейронального Аβ генерации в мозге.
Для разработки модуляторов MAM были использованы три различных подхода: (1) модуляторы, нацеленные на белки-привязи MAM, (2) модуляторы, изменяющие уровни экспрессии MAM-резидентных белков, и (3) модуляторыструктур MAM. Несмотря на эти подходы, основным препятствием на пути поиска эффективных модуляторов стабилизации MAM является отсутствие методов количественного измерения степени стабилизации MAM. Традиционные методы, такие как электронная микроскопия (ЭМ) или микроскопия сверхвысокого разрешения, имеют ограничения в фиксации изменений в реальном времени или обеспечении достаточной детализации для оценки стабилизации MAM (рассмотрено в28).
Описанный здесь метод позволит преодолеть это препятствие и получить ключевое представление о взаимосвязи между стабилизацией MAM и продукцией Aβ. Результаты показывают, что МАМ толщиной от 6 нм ± 1 нм, демонстрирующие общее движение 26,6% ± 3,4% (табл. 3), связаны с генерацией Aβ. Напротив, MAM толщиной от 24 нм ± 3 нм, которые демонстрируют общее движение 44,79% ± 2,6% (табл. 3), не влияют на генерацию Aβ. Общее движение митохондрий (Mito-RFP) составило 53,82% ± 3,3%. Учитывая, что толщина MAM обычно варьируется от 6 нм до 80 нм, эти результаты очерчивают верхнюю и нижнюю границы стабилизации MAM по отношению к продукции Aβ. Следовательно, этот метод может служить руководством для идентификации и оптимизации модулятора (модуляторов) для стабилизации MAM. Цель состоит в том, чтобы изменить общее движение МАМ с 26,6% ± 3,4% до 53,82% ± 3,3% или их среднюю скорость с  0,4 мкм/с до
0,4 мкм/с до  0,7 мкм/с (Таблица 3), позиционируя такие модуляторы как потенциальные терапевтические агенты против продукции Aβ.
0,7 мкм/с (Таблица 3), позиционируя такие модуляторы как потенциальные терапевтические агенты против продукции Aβ.
Использование конститутивных модуляторов MAM, содержащих синтетические линкеры возрастающей длины (0-18 аминокислот), является мощным методом количественного определения порога стабилизации MAM, чтобы переключить стабилизацию MAM на стабилизацию, которая поддерживает или, возможно, понижает, а не увеличивает генерацию Aβ. Однако для оценки эффективности или действенности модуляторов MAM потребуются индуцируемые стабилизаторы MAM. Доступны стабилизаторы MAM на основе индуцируемого резонансного переноса энергии/флуоресцентной визуализационной микроскопии Фёрстера (FRET/FLIM), которые представляют собой экспрессионные плазмиды, кодирующие YFP-слитую OMM-нацеленную последовательность mAKAP1 (34-63) и CFP-слияние ER-нацеленной на фосфатазу Sac1 (521-587). Более того, конститутивные стабилизаторы могут не представлять физиологические MAM, в то время как стабилизаторы FRET/FLIM MAM, с другой стороны, будут обнаруживать физиологические MAM. Также могут быть использованы расщепленные зонды GFP, в которых GFP разделен на два нефлуоресцентных фрагмента, привязанных либо к резидентному ER, либо к митохондриальным белкам ER-GFP (1-10) и Mito-GFP11, которые генерируют биомолекулярную флуоресцентную комплеменцию (BiFC) при образованииMAMs 27. Несмотря на то, что фрагменты GFP склонны к спонтанной сборке, BiFC имеет самое простое считывание, самый четкий сигнал и наименьший анализ, связанный с шумом. Более того, взаимодействие между расщепленными GFP является весьмаобратимым28, при этом их преимущества перевешивают недостатки и делают метод BiFC пригодным для идентификации модуляторов стабилизации MAM.
Благодарности
Мы благодарим доктора Дьёрдя Хайноцкого, профессора Университета Томаса Джефферсона в Филадельфии, за щедрое предоставление нам экспрессионных плазмид, кодирующих RFP-Mito, MAM 1X, MAM 9X и MAM 18X. Особая благодарность доктору Лай Дингу, старшему специалисту по визуализации, Brigham and Women's Hospital, за помощь в написании кода для генерации, отслеживания и измерения данных кимографа. Это исследование было поддержано Фондом лечения Альцгеймера для RB и грантом NIH 5R01NS045860-20 для RET.
Материалы
| Name | Company | Catalog Number | Comments |
| 6 Well Glass Bottom Plate | Cellvis | P06-1.5H-N | |
| B-27 Supplement (50X), serum free | Gibco/Thermo Fisher Scientific | 17504044 | |
| bFGF | R&D System | 233-FB | |
| BSA | Fisher Scientific | 501781532 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| DMEM/F12 with L-glutamine | Gibco/Thermo Fisher Scientific | 11320-033 | |
| EDTA | Life Technologies | 41116134 | |
| EGF | Sigma-Aldrich | 92090408 | |
| Falcon 6 Well Plates | VWR International | 41122107 | |
| GAPDH Polyclonal Antibody | Thermo Fisher Scientific | PA1-988 | |
| Gelatin | VWR International | 9000-70-8 | |
| Graphpad Prism N/A | Prism 9, version 9.5.0 | N/A | |
| Heparin | Sigma-Aldrich | H0200000 | |
| ImageJ Software | ImageJ 1.53a | N/A | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| mCherry Polyclonal Antibody | Invitrogen | PA5-34974 | |
| MS Excel | Microsoft Excel, version 2302 | N/A | |
| Multi-array electrochemiluminescence assay kit | Meso Scale Diagnostics (MSD) | K15200E-2 | V-PLEX Aβ Peptide Panel 1 (6E10) kit |
| NaCl | Fisher Scientific | 7647145 | |
| NuPAGE 4–12% Bis-Tris gel | Invitrogen | NP0321BOX | |
| Penicillin/Streptomycin/Amphotericin B | Lonza | 17-745E | |
| Photoshop | Adobe Photoshop CC 20.0.10 | N/A | |
| Rat Neuron Nucleofector Kit | Lonza | VPG-1003 | |
| StemPro Accutase | Gibco | A1110501 | |
| Tris-HCL, pH 7.6 | Boston BioProducts | 42000000 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Fisher Scientific | 501657287 |
Ссылки
- Giacomello, M., Pellegrini, L. The coming of age of the mitochondria-ER contact: a matter of thickness. Cell Death Differ. 23 (9), 1417-1427 (2016).
- Degechisa, S. T., Dabi, Y. T., Gizaw, S. T. The mitochondrial associated endoplasmic reticulum membranes: A platform for the pathogenesis of inflammation-mediated metabolic diseases. Immun Inflamm Dis. 10 (7), e647 (2022).
- Schon, E. A., Area-Gomez, E. Mitochondria-associated ER membranes in Alzheimer disease. Mol Cell Neurosci. 55, 26-36 (2013).
- Erpapazoglou, Z., Mouton-Liger, F., Corti, O. From dysfunctional endoplasmic reticulum-mitochondria coupling to neurodegeneration. Neurochem Int. 109, 171-183 (2017).
- Sala-Vila, A., et al. Interplay between hepatic mitochondria-associated membranes, lipid metabolism and caveolin-1 in mice. Sci Rep. 6, 27351 (2016).
- Fujimoto, M., Hayashi, T. New insights into the role of mitochondria-associated endoplasmic reticulum membrane. Int Rev Cell Mol Biol. 292, 73-117 (2011).
- Hung, V., et al. Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. eLife. 6, e24463 (2017).
- Area-Gomez, E., Schon, E. A. On the pathogenesis of Alzheimer's disease: The MAM hypothesis. FASEB J. 31 (3), 864-867 (2017).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280 (5370), 1763-1766 (1998).
- Sukhorukov, V. S., et al. Molecular mechanisms of interactions between mitochondria and the endoplasmic reticulum: A new look at how important cell functions are supported. Mol Biol. 56 (1), 59-71 (2022).
- Zhang, P., Konja, D., Zhang, Y., Wang, Y. Communications between Mitochondria and endoplasmic reticulum in the regulation of metabolic homeostasis. Cells. 10 (9), 2195 (2021).
- Ziegler, D. V., Martin, N., Bernard, D. Cellular senescence links mitochondria-ER contacts and aging. Commun Biol. 4 (1), 1323 (2021).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol. 174 (7), 915-921 (2006).
- Cieri, D., et al. SPLICS: a split green fluorescent protein-based contact site sensor for narrow and wide heterotypic organelle juxtaposition. Cell Death Differ. 25 (6), 1131-1145 (2018).
- Carpio, M. A., et al. BOK controls apoptosis by Ca(2+) transfer through ER-mitochondrial contact sites. Cell Rep. 34 (10), 108827 (2021).
- Prudent, J., et al. MAPL SUMOylation of Drp1 stabilizes an ER/mitochondrial platform required for cell death. Mol Cell. 59 (6), 941-955 (2015).
- Zellmer, J. C., Tarantino, M. B., et al. Stabilization of mitochondria-associated endoplasmic reticulum membranes regulates Abeta generation in a three-dimensional neural model of Alzheimer’s disease. Alzheimer’s Dement. , 1-20 (2024).
- Magalhaes Rebelo, A. P., et al. Chemical modulation of mitochondria-endoplasmic reticulum contact sites. Cells. 9 (7), 1637 (2020).
- Berger, S. I., Iyengar, R. Role of systems pharmacology in understanding drug adverse events. Wiley Interdiscip Rev Syst Biol Med. 3 (2), 129-135 (2011).
- Friedman, J. R., Webster, B. M., Mastronarde, D. N., Verhey, K. J., Voeltz, G. K. ER sliding dynamics and ER-mitochondrial contacts occur on acetylated microtubules. J Cell Biol. 190 (3), 363-375 (2010).
- Wu, Y., et al. Contacts between the endoplasmic reticulum and other membranes in neurons. Proc Natl Acad Sci U S A. 114 (24), E4859-E4867 (2017).
- Cagin, U., et al. Mitochondrial retrograde signaling regulates neuronal function. Proc Natl Acad Sci U S A. 112 (44), E6000-E6009 (2015).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Kim, Y. H., et al. A 3D human neural cell culture system for modeling Alzheimer's disease. Nat Protoc. 10 (7), 985-1006 (2015).
- Kwak, S. S., et al. Amyloid-beta42/40 ratio drives tau pathology in 3D human neural cell culture models of Alzheimer's disease. Nat Commun. 11 (1), 1377 (2020).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39 (1), 121-132 (2010).
- Bhattacharyya, R., et al. Axonal generation of amyloid-beta from palmitoylated APP in mitochondria-associated endoplasmic reticulum membranes. Cell Rep. 35 (7), 109134 (2021).
- Tebo, A. G., Gautier, A. A split fluorescent reporter with rapid and reversible complementation. Nat Commun. 10 (1), 2822 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены