Method Article
阿尔茨海默病 (AD) 神经模型中线粒体相关内质网膜 (MAM) 稳定性的定量分析
摘要
在这里,我们描述了通过实时增加或维持阿尔茨海默病 (AD) 神经元的神经毒性 β-淀粉样蛋白 (Aβ) 产生来测量线粒体相关内质网 (ER) 膜 (MAM) 组成型稳定剂的轴突转运率,作为测量 MAM 稳定性和帮助 AD 疗法开发的直接和定量指标。
摘要
这里介绍了一种在阿尔茨海默病 (AD) 的 3 维 (3D) 神经模型中定量线粒体相关内质网膜 (MAM) 稳定性的方法。首先,表达含有家族性阿尔茨海默病 (FAD) 的 β-淀粉样蛋白前体蛋白 (APP) 或幼稚 ReN 细胞的新鲜人神经祖细胞 ReN 细胞在薄 (1:100) 基质胶包被的组织培养板中生长。细胞汇合后,用编码红色荧光蛋白 (RFP) 偶联的线粒体结合序列的 AKAP1(34-63) (Mito-RFP) 表达质粒进行电穿孔,该质粒可检测线粒体或组成型 MAM 稳定剂 MAM 1X 或 MAM 9X,分别稳定紧密(6 nm ± 1 nm 间隙宽度)或松散(24 nm ± 3 nm 间隙宽度)MAM。16-24 小时后,收获细胞并通过荧光激活细胞分选仪 (FACS) 富集。将相同数量的富含FACS的细胞接种在3维基质(1:1基质胶)中,并使其分化为成熟神经元10天。表达 RFP 偶联的 MAM 稳定剂的 10 天分化细胞的活细胞图像在配备活细胞成像培养室的荧光显微镜下捕获,该培养室保持 CO2 (5%)、温度 (37 °C) 和湿度 (~90%)。为此,我们进行了活细胞成像和运动分析,以测量用 Mito-RFP 标记的游离线粒体的运动性,或分别由 MAM 1X 或 MAM 9X 稳定的紧密或松散间隙宽度的 ER 结合线粒体,在每个 ReN GA 神经元的最延伸神经元过程中至少为 500 nm 长,将这些视为轴突。
引言
新出现的证据表明,专门的线粒体相关内质网接触 (MERC),生化收获为线粒体相关 ER 膜,通常称为 MAM 1,2,在包括 AD 3,4 在内的多种神经退行性疾病中发挥作用。这些 MAM 由 ER 中富含胆固醇的脂筏状微结构域和线粒体外膜组成,这些蛋白由一系列蛋白质拴住,这些蛋白质在 MAM 之间产生结构和功能多样性 5,6,7。最近创造的 MAM 假说假设 MAM 的增加导致 Aβ 产生增加和 AD 的致病级联反应,包括神经原纤维缠结 (NFT) 形成、钙稳态障碍和神经炎症 3,8。大约 5%-20% 的线粒体与 ER 进行物理接触以形成 MAMs9。MAM 的间隙宽度由平滑和粗糙的 ER(分别为 sER 和 rER)决定。sER-线粒体 (10-50 nm) 和 rER-线粒体 (50-80 nm) 之间的可变间隙宽度表明 MAM 的间隙宽度具有从紧密 (~10 nm) 到松散 (~80 nm) 之间的长光谱10,11,12,13。MAM 间隙宽度决定了 MAM 功能,例如钙稳态和脂质转运 1,14。最近的一份报告表明,在紧密 (~10 nm) 连接的 ER 和线粒体之间形成的 MAM,称为全 MAM,是凋亡的。相比之下,在松散连接 (~25 nm) ER 和线粒体之间形成的 MAM,称为有缺陷或中等的 MAM,具有抗凋亡作用 14,15,16。间隙宽度为 6 nm ± 1 nm 的 MAM 的稳定增加了 AD 的新型 3 维 (3D) 神经培养模型的 Aβ 生成。相比之下,间隙宽度为 24 nm ± 3 nm 的 MAM 的稳定化对 Aβ 的产生没有影响17。这一发现首次表明,调节 MAM 的稳定程度,而不是破坏 MAM 的稳定性,是调节 Aβ 生成的关键。试图完全破坏 MAM 的稳定性可能会产生不必要的后果,因为 MAM 会维持几个对细胞存活至关重要的细胞事件12。
MAMs 的调节是一个新兴的研究领域,对各种疾病具有潜在影响,包括癌症、代谢紊乱和神经退行性疾病18。尽管有许多 MAM 调节剂可用,但迄今为止尚未采取重大尝试来测试它们破坏 MAM 稳定性和降低 AD 病理学的能力,主要是因为 MAM 的结构多样性使它们成为药物发现的目标高度复杂的系统。但是,新开发的结构系统药理学考虑了药物靶标及其环境18,19 的特定特性,应该克服困难并开发针对 AD 中 MAM 或 MAM 相关蛋白的高效药物。然而,寻找 MAM 稳定的有效调节剂需要精确量化 MAM 稳定程度的方法。电子显微镜 (EM) 或超分辨率显微镜等传统技术在确定 MAM 稳定性方面存在局限性。克服这些挑战可能需要开发新颖的、更具动态性的成像技术或生化分析,这些技术可以提供活细胞中 MAM 稳定性的定量测量。原代神经元的聚焦离子束扫描电子显微镜 (FIB-SEM) 显示,ER 倾向于在线粒体周围形成一个网络,这可能会限制线粒体的运动20,21。线粒体运输系统的破坏,无论是逆行的、顺行的还是两者兼而有之,都对突触和神经元功能产生了深远的影响22。因此,此处描述的 ER 结合线粒体轴突速度的新型活细胞成像和基于运动群分析作为定量测量 MAM 稳定性的指标,将有助于识别可以将 MAM 稳定阈值切换到维持或可能降低而不是增加 Aβ 产生的 MAM 调节剂。
研究方案
AD 神经培养模型: 本研究使用了源自人类神经祖先 ReN 细胞 [初始 ReN (Millipore)] 或表达淀粉样蛋白前体蛋白 (APP) 基因 (APPSwe/Lon) 家族性 AD (fAD) 突变的 ReN 细胞的神经元,ReN GA 细胞。ReN-GA 三维 (3D) 培养系统概括了 AD 病理学,即 Aβ 寡聚体驱动的神经原纤维缠结 (NFT) 23,24。Naive ReN 细胞是市售的。ReN GA 品系购自麻省总医院 (MGH) 副教授 Doo Y. Kim 博士23,24,25。
表达质粒:AKP1 (34-63) 和 Ubc 6 (283-303) 蛋白的 ER 靶向序列直接与 RFP(Mito-RFP-ER 表示为 MAM 1X)或包含一个 9 个氨基酸的连接子(Mito-9X-RFP-ER 表示为 MAM 9X)旨在稳定 6 nm ± 1 nm 或 24 nm + 3 nm 间隙宽度的 MAM,分别为15,26(图 1A)。
1. 电穿孔
- 用 MAM 稳定剂转染细胞(1-2 小时)
注:遵循 nucleofector 试剂盒制造商描述的方案 (材料表).在开始之前,准备 6 孔玻璃底培养皿,预涂有含有 1% 基质胶的 DMEM/F12(以下简称基底膜基质 [BMM])。使用 2 mL BMM 包被每个孔。在 37 °C 下孵育至少 1 小时。BMM、培养基、移液器吸头和移液器在混合前都应预冷,以防止 BMM 凝固。- 吸出 BMM 混合物。在每个孔中更换 2 mL 室温 (RT) DMEM/F12。
- 将 Nucleofector 与补充剂 1 以 4.5:1 的比例混合(100 μL 溶液为 82 μL:18 μL 的 Nucleofector/补充剂比例)。对于每个所需的转染,需要 100 μL 的 Nucleofector。
- 涡旋 DNA。然后,每次转染在 1 mL 微量离心管中加入 1-5 μg DNA(每次处理)。
- 使用acustase收获一板健康的ReN-GA细胞。
注:将细胞铺板在 100 mm 组织培养皿中的扩增培养基(表 1)中,并等待汇合度达到 70-80%。- 吸出现有培养基并用 10 mL PBS 洗涤一次。
- 直接向细胞中加入 1 mL acutase 并在 37 °C 下孵育 5-10 分钟。
- 轻轻敲击培养皿的侧面,将细胞从培养皿中去除。在显微镜下检查以确保细胞松动并自由流动。
- 用 10 mL DMEM/F12 中和切割酶,然后转移到干净的 15 mL 试管中。
- 将所需数量的细胞以 274 x g 离心 5 分钟,然后吸出上清液以去除死细胞。然后,将沉淀重悬于 10 mL DMEM/F12 中。
- 计数细胞以确定密度。
注意:在这项研究中,使用自动细胞计数器来计数细胞数量。每次电穿孔需要 3-5 X 106 个细胞(例如,5 次处理需要 15-25 X 106 个细胞)。- 取 10 μL 悬浮细胞,添加到细胞计数室的 A 侧。然后向 B 侧添加 10 μL。
注:将移液器倾斜到一侧,添加细胞悬液。不要推过移液器柱塞上的第一个挡块,以避免气泡。 - 将装满的计数室带到细胞计数仪,将 A 面插入正面的主插槽中。
- 按下 Measure(测量)后,记下每 mL 的细胞数。
- 取出腔室,翻转到 B 侧,重复步骤 1.1.5.2-1.1.5.3。
- 将这两个数字相加,然后除以 4(如果不使用台盼蓝),然后将该数字乘以细胞悬浮的毫升数,得到悬浮液中的细胞总数。
- 取 10 μL 悬浮细胞,添加到细胞计数室的 A 侧。然后向 B 侧添加 10 μL。
- 将所需数量的细胞以 274 x g 离心 5 分钟,然后吸出上清液。
- 每次电穿孔将沉淀重悬于 100 μL Nucleofector 混合物中。(例如,500 μL 用于 5 次处理)。
注:将细胞置于 Nucleofector 溶液中超过 15 分钟可能会降低细胞活力和整体疗效。 - 将 100 μL 细胞悬液添加到其中一根含有 DNA 的试管中,并通过移液混合。
- 将 DNA 混合物转移到电穿孔比色皿中,并用提供的盖子密封。为避免产生气泡,请向下倾斜比色皿并缓慢移液。
- 选择适合所用设备的 Nucleofector 程序。对于本研究中使用的设备,使用程序 A-033 进行转染。为了进行优化,请尝试所有 5 个 Nucleofector 程序,以确定最适合每种细胞类型的程序。
注:确认电穿孔成功的是混合物顶部可见的泡沫。 - 立即使用提供的无菌移液器,将 ~500 μL DMEM 从预装的 6 孔板中加入到比色皿中。轻轻混合一次,然后将电穿孔的细胞和培养基转移到相应的孔中。
注:电穿孔后,细胞非常敏感,因此快速转移培养基并小心移液至关重要。 - 对所有剩余的 DNA 处理重复步骤 1.1.8-1.1.11。
- 将细胞在 37 °C 下,在 CO2 (5%) 存在下孵育过夜。
- 第二天,用新鲜的分化培养基(表 2)交换培养基,让细胞分化 10 天。每 2-3 天更换一次新鲜培养基。
2. 活细胞成像
- 用于活细胞显微镜检查的细胞制备(30 分钟)
- 活细胞腔室制备(在将细胞移入腔室之前)
- 确保 CO2 罐和加湿器连接到腔室,阀门打开,并且罐已装满。
- 将温度设置为 37 °C,将 CO2 设置为 5%,将湿度设置为 95%。(这可能需要一些时间才能使水平平衡)。
- 将含有细胞的 6 孔板放入腔室中,并调整显微镜的焦距,直到细胞变得可见。
- 打开激光器 (Table of Materials)。
- 要捕获 RFP 信号,请使用 594 nm 激光激发荧光团并使用 570-640 nm 发射。对于 GFP,使用 488 nm 激光激发和 510-540 nm 发射。
- 使用内置的荧光滤光片,调整信号强度,直到背景信号消散(应接近纯黑色)。
- 捕获轴突的实时视频(总共 10 小时-15 小时)
注:使用 Nikon C2 Eclipse Ti2 倒置共聚焦显微镜通过 NIS Element AR 软件捕获荧光图像。使用 60 倍放大倍率,分辨率为 512 像素,以每秒 1 帧的速度拍摄视频 3 分钟,产生更清晰的运动记录仪。- 查找表达 RFP 生物传感器的细胞。在拍摄视频之前,请导出单元格的图像以供以后参考。
- 裁剪扫描区域以适合轴突。使用更小的扫描区域可以减少显微镜的处理时间,并使运动量成像更容易。
- 关闭所有激光器以帮助软件运行更顺畅。请注意,当程序在所有激光器都处于活动状态的情况下运行时,并非所有帧都被捕获。
注意:来自胞体的红色荧光信号比轴突中的要亮得多。因此,排除胞体以增加轴突中的整体信号强度。移至 Time Measurement 选项卡。 - 设置间隔为 1 帧/秒,总时间为 181 秒。
- 单击 Run。
- 将此文件另存为 .nds 文件(正确标记),并对每个 MAM 稳定器(MAM 1X 或 MAM 9X)重复该过程 ~10 次。
注意:如果扫描时间过长,激光的强度有时会对 RFP 信号产生明显的漂白效果。快速捕获视频很重要。
3. 后处理(7 天)
注意:为了分析运输和生成运动记录仪,使用了 Fiji ImageJ 宏。移动速度小于 0.1 mm/s 的囊泡被归类为静止性。粒子运动频率的计算方法是将沿给定方向(顺行、逆行)或不移动(静止)的粒子数除以运动记录仪中分析的粒子总数。每个囊泡暂停或移动的时间是通过平均分析的每个神经元中所有囊泡在每种情况下花费的时间百分比来计算的。在每种实验条件下,仅使用移动囊泡计算速度和运行长度的频率分布。在 100 mm 轴突束上进行分析 3 分钟。
- 生成 kymograph
- 在 Fiji ImageJ 中打开 .nds 文件。
- 前往 图片 选项卡,然后单击 租房.记录像素与微米的比率。这是以后计算所必需的。
- 单击 文件>另存为 > Tiff 将文件作为.tiff保存到其文件夹中(宏会自动将生成的所有内容保存到此文件夹中)。
- 将 Kymo 宏拖到 ImageJ 中。该代码在 补充编码文件 1 中提供。单击 Run。
- 不要打 OK. 切换到 MAX_raw 窗口。沿轴突手动左键单击,然后双击以结束跟踪。
注意:确保从胞体跟踪轴突,以便轴突末端。这样,顺行和逆行的计算将是正确的。 - 按 ROI 管理器上的 命令 T 或 Add。
- 现在点击 OK。将在之前创建的文件夹中生成一个 kymograph。(X 轴是轴突长度,单位为微米,Y 轴是时间,单位为秒)。
- 跟踪运动记录仪
- 将运动图拖到 Fiji Image J 中(它应该会自动放置在之前创建的文件夹中)。
- 将 Track 宏拖动到 Image J 中。
- 在以下提示中,单击 Ok (确定)。 如果从之前继续工作,请输入要继续的数字点,然后按 Ok。
- 使用“选择”面板上的“矩形”工具,选择靠近运动图中间的区域,该区域高度为 60 像素,宽度始终为 100 μm。为此,请将 100 除以步骤 3.1.2 中记录的像素与微米比率。
- 选择一个区域后,按 Ctrl T 将 i t 添加到 ROI 中,并将 ROI 保存到正在处理的文件夹中(按 ROI 菜单中的 More ,然后按 Save)。
注意:按 Ctrl+Shift+I 反转所选区域将使其更易于跟踪。 - 要跟踪单个囊泡的运动,请按住 Ctrl 键,同时从上到下单击鼠标左键。
- 为此,在右键单击时按住 Ctrl 键,将弹出一个窗口,显示轴突的跟踪位置。如果这看起来不错,请按 Ok(确定)。
- 要继续并选择另一个囊泡,请单击 Yes 并重复步骤 3.2.6-3.2.8 中的过程。跟踪每个可见的囊泡后,按 No。这会自动将手部追踪叠加层保存到同一文件夹。
- 测量 kymograph 数据
- 创建新文件夹。将每个生成的文本文件拖到文件夹中。
- 打开 kymograph 文件并记录尺寸。
- 将 Measure 宏拖动到 Image J 中。
- 将之前记录的微米与像素比率输入 到 PixelScale 中。
- 将 Speed Limit Low (速度限制低 ) 更改为 0.1。(低于此限制的囊泡被认为是静止的)。
- 输入之前记录的运动记录仪尺寸。摘要文件将在创建的文本文件夹中自动生成。每个摘要填充将包含 %Time Traveled、Overall Speed (μm/s)、Total Distance (总距离)、Average Segment Traveled、Number of Stopping (停止次数) 和 Number of Turns Reversed(倒车次数)。用于生成、跟踪和测量 kymograph 数据的代码作为 补充编码文件 1 提供。
结果
进行活细胞成像和运动造影分析以测量用 Mito-RFP 标记的游离线粒体的运动性或分别由 MAM 1X 或 MAM 9X 稳定的紧密(6 nm ± 1 nm)或松散(24 nm ± 3 nm)接触宽度的 ER 结合线粒体的运动,在每个 ReN GA (AD) 或 ReN(幼稚)神经元的最长神经元过程中,长度至少为 500 nm, 将其视为轴突(图 1 和图 2)。通过将移动或静止的 RFP 标记的点 (MAM) 的数量除以运动记录仪中的总数来计算运动频率(总体、逆行和顺行)(图 1A-E)。与 Mito-RFP 标记的无 ER 线粒体或 MAM 9X 标记的 ER 结合线粒体相比,MAM 1X 标记的 ER 结合线粒体的总体轴突速度显着降低了 ~50%(图 1B)。定量分析还揭示了与游离 (Mito-RFP) 或 MAM 9X 稳定的 ER 结合线粒体相比,MAM 1X 稳定的 ER 结合线粒体的整体运动和逆行运动之间存在巨大差异。虽然 53.82% ± 3.3% 的无 ER 线粒体 (Mito-RFP) 是可移动的,但只有 26.6% ± 3.4% MAM 1X 标记的 ER 结合线粒体是可移动的,这表明 MAM 的稳定显着降低了线粒体的整体轴突活动度,与 ER 密切相关,与未与 ER 结合的线粒体相比(MAM 9X 的 44.79% ± 2.6% 与 Mito RFP 的 53.82% ± 3.3%, 分别)(图 1C)。一致地,与 MAM 9X 标记的或游离线粒体 (Mito-RFP) 相比,MAM 1X 标记的 ER 结合线粒体的逆行和顺行运动都显着降低(逆行:MAM 1X 为 12.33% ± 2.55%,而 Mito RFP 为 25.78% ± 2.31%;顺行:MAM 1X 为 14.27% ± 2.81%,而 Mito RFP 为 28.04% ± 2.48%)(图 1D 和 E)。表 3 提供了游离线粒体或与 ER 紧密或松散结合的线粒体的精确轴突速度。这些值可以用作一种显著的定量手段,用于评估 MAM 稳定程度,范围在紧密和松散的 MAM 之间,从而减少 Ab 的产生。在幼稚 ReN 细胞中紧密和松散的 MAM 稳定后的线粒体轴突转运速率反映了在 ReN GA 神经元中观察到的转运模式(图 1F-G)。初始 ReN 神经元和表达 APPSwe/Lon 的 ReN GA AD 神经元之间的一致结果表明,对轴突运输的影响主要归因于 MAM 稳定状态,与 APPSwe/Lon 的存在或产生的 Aβ 产生无关。
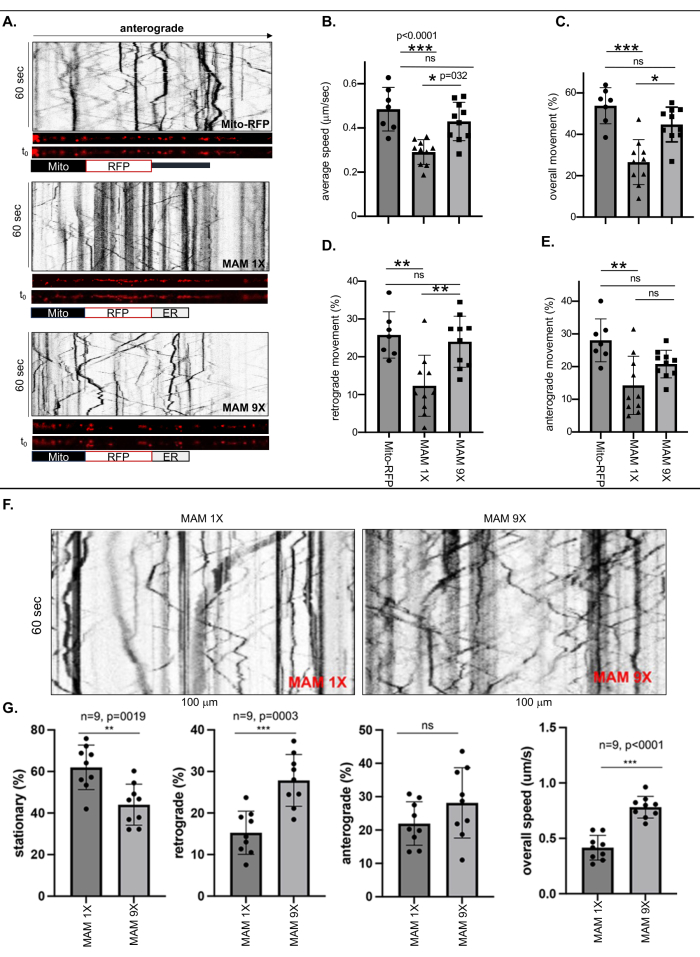
图 1:MAM 1X 稳定 MAM 降低了分化的 ReN GA 和幼稚 ReN 细胞轴突中 ER 结合线粒体的平均速度和运动(总体、逆行和顺行)。 (A) RFP 标记的点的代表性运动图,代表游离线粒体 (Mito-RFP) 或由 MAM 1X(紧密 MAM,6 nm ± 1 nm 接触宽度)或 MAM 9X(松散 MAM,24 nm ± 3 nm 接触宽度)稳定的线粒体轴突内(~100 nm)。(B-E)定量分析 10 天分化 任-GA 细胞轴突内 Mito-RFP、MAM 1X 或 MAM 9X 的 (B) 平均速度和运动 [(C) 整体,(D) 逆行和 (E) 顺行]。第 >7 页;进行双向方差分析。*p < 0.05,**p < 0.001。三个独立实验的代表。(F) MAM 1X 或 MAM 9X 在 10 天分化的幼稚 ReN 细胞轴突内运动的代表性运动照片。(G) 对幼稚 ReN 细胞轴突内 MAM 1X 或 MAM 9X 稳定的 MAM 的百分比 (%) 运动(静止、逆行和顺行)和整体速度(微米/秒;μm/s)进行定量分析。n = 9;进行双向方差分析。p < 0.0001。此图经 Zellmer 等人17 许可改编。请单击此处查看此图的较大版本。

图 2:表达 MAM 1X 或 MAM 9X 的幼稚 ReN 细胞轴突的活细胞图像。 代表性的活细胞视频图像,显示了由 MAM 1X 或 MAM 9X 稳定的 MAM 在 10 天分化的 GFP 表达 ReN 细胞的 100 μm 长轴突内的运动。n > 10 张来自重复实验的图像。箭头表示顺行运输。比例尺:100 μm。 请单击此处查看此图的较大版本。
| 试剂 | 最终浓度 | 量 |
| 含 L-谷氨酰胺的 DMEM | 不适用 | 500 毫升 |
| 肝素 | 2 微克/毫升 | 0.5 毫升 |
| B27型 | 1 倍 | 10 毫升 |
| bFGF | 20 纳克/毫升 | 0.4 毫升 |
| EGF | 20 纳克/毫升 | 0.5 毫升 |
| 青霉素/链霉素 | 100 单位/mL | 5 毫升 |
| 总 | 516.4 毫升 | |
| 在加入青霉素/链霉素之前过滤培养基。在 4 °C 下储存长达 1 个月。 | ||
表 1:扩展介质的组成。
| 试剂 | 最终浓度 | 量 |
| 含 L-谷氨酰胺的 DMEM | 不适用 | 500 毫升 |
| 肝素 | 2 微克/毫升 | 0.5 毫升 |
| B27型 | 1 倍 | 10 毫升 |
| 青霉菌/链霉素 | 100 单位/mL | 5 毫升 |
| 总 | 515.5 毫升 | |
| 在加入青霉素/链霉素之前过滤培养基。在 4 °C 下储存长达 1 个月 | ||
表 2:分化培养基的组成。
| ReN GA | ReN (naïve) | ReN GA (3D) | |||||
| 整体 (%) | 逆行 (%) | 顺行性 (%) | 平均速度 (mm/s) | 抗体40 (pM) | 抗体42 (pM) | ||
| Mito-RFP | 53.82 ± 3.3% | 25.78 ± 2.31% | 28.04 ± 2.48% | 0.66 ± 0.03 | 0.69 ± 0.07 | 241.7 ± 26.74 | 13.77 ± 1.52 |
| MAM 1X | 26.6 ± 3.4% *** | 12.33 ± 2.5% *** | 14.27 ± 2.81% *** | 0.3 ± 0.02*** | 0.43 ± 0.04*** | 377.2 ± 76.87* | 26.62 ± 3.86* |
| MAM 9X 系列 | 44.79 ± 2.6% 纳秒 | 23.99 ± 2.17%ns | 20.80 ± 1.33%纳秒 | 0.59 ± 0.02 纳秒 | 0.62 ± 0.02 纳秒 | 158.8 ± 3.27* | 17.01 ± 2.02* |
表 3:定量分析。 对 Mito-RFP、MAM 9X 和 MAM 1X 的平均速度(速度)和轴突运动(整体、逆行和顺行)进行活细胞成像和基于运动量谱的定量分析。对轴突速度或运动 (%) 进行双向方差分析。n = 9。对于 Aβ,进行普通单向方差分析;n = 3,三个独立实验。针对未转染(对照)ReN GA 细胞测量显著性。**p < 0.0001;*p < 0.05;不显著 (NS)。此表格经 Zellmer 等人许可改编17。
补充编码文件 1: 用于生成、跟踪和测量 kymograph 数据的代码。 请点击此处下载此文件。
讨论
抑制 sigma-1 受体 (S1R) 下调了神经元过程中 MAM 的稳定性,并显着减少了 (~90%) 来自轴突的 Aβ 产生,而不是来自表达淀粉样蛋白前体蛋白 [APP] 基因 (ReN GA) 中家族性 AD [FAD] 突变的人神经祖细胞 (ReN) 的三维 (3D) 培养系统的胞体的 Aβ 产生23,24,25,27.RFP 标记的组成型 MAM 稳定剂(MAM 1X 和 MAM 9X)旨在稳定紧密(6 nm ± 1 nm)和松散(24 nm ± 3 nm)MAM15,26 是定量测量 MAM 稳定性的非凡工具。两种稳定剂不仅在 3D 基质中分化的 ReN GA 细胞中表现出相等且稳定的表达 ~10 天,而且还在胞体和轴突的离散点中检测到 MAM。最重要的是,虽然 MAM 1X 在富含 FACS 的 3D ReN GA 中的稳定表达显着增加了 Aβ 的产生,但 MAM 9X 表达没有影响17。我们还测试了含有 18 个氨基酸接头 (MAM 18X) 的组成型 MAM 稳定剂的效果,该稳定剂可检测和稳定 MAMs >25 nm。与 MAM 1X 或 MAM 9X 不同,MAM 18X 仅标记体体 MAM。富含 FACS 的 MAM 18X 表达 ReN GA 神经元,减少了 Aβ 生成17。这些发现表明,MAM 稳定性阈值的可能性由它们的间隙宽度决定,该间隙宽度介于致病性(增加 Aβ 生成)紧密 MAM 和非致病性(维持或减少 Aβ 生成)松散 MAM 之间。在大脑中产生。
已采用三种不同的方法来开发 MAM 调节剂:(1) 靶向 MAM 栓系蛋白的调节剂,(2) 改变 MAM 驻留蛋白表达水平的调节剂,以及 (3) MAM 结构的调节剂18。尽管有这些方法,但寻找 MAM 稳定的有效调节剂的主要障碍是缺乏定量测量 MAM 稳定程度的方法。电子显微镜 (EM) 或超分辨率显微镜等传统技术在捕获实时变化或提供足够的细节来评估 MAM 的稳定性方面存在局限性(在 28 中已论述)。
此处描述的方法将克服障碍,并为 MAM 稳定与 Aβ 产生之间的关系提供关键见解。结果表明,厚度为 6 nm ± 1 nm 的 MAMs 与 Aβ 的产生有关,总体移动为 26.6% ± 3.4%(表 3)。相比之下,厚度为 24 nm ± 3 nm 的 MAM 表现出 44.79% ± 2.6% 的总体移动(表 3),不会影响 Aβ 的产生。线粒体 (Mito-RFP) 的总体移动为 53.82% ± 3.3%。鉴于 MAM 厚度通常在 6 nm 和 80 nm 之间变化,这些发现描绘了 MAM 稳定与 Aβ 产生相关的上限和下限。因此,该方法可以指导识别和优化用于 MAM 稳定的调制剂。目标是将 MAM 的整体运动从 26.6% ± 3.4% 改变为 53.82% ± 3.3%,或将它们的平均速度从  0. 4 μm/s 改变为
0. 4 μm/s 改变为  0. 7 μm/s(表 3),将此类调节剂定位为对抗 Aβ 产生的潜在治疗剂。
0. 7 μm/s(表 3),将此类调节剂定位为对抗 Aβ 产生的潜在治疗剂。
使用含有长度增加(0-18 个氨基酸)的合成接头的组成型 MAM 调节剂是一种有效的方法,可以定量确定 MAM 稳定阈值,以将 MAM 稳定转换为维持或可能降低而不是增加 Aβ 生成的稳定。然而,为了评估 MAM 调节剂的效率或功效,需要诱导型 MAM 稳定剂。基于诱导型 Förster 共振能量转移/荧光寿命成像显微镜 (FRET/FLIM) 的 MAM 稳定剂是编码 YFP 融合的 mAKAP1 (34-63) 的 OMM 靶向序列和 CFP 融合的 ER 靶向 Sac1 磷酸酶 (521-587) 的表达质粒。此外,组成型稳定剂可能不代表生理性 MAM,而另一方面,FRET/FLIM MAM 稳定剂将检测生理性 MAM。也可以使用分裂的 GFP 探针,其中 GFP 分裂成两个非荧光片段,这些片段与驻留 ER 或线粒体蛋白 ER-GFP (1-10) 和 Mito-GFP11 相连,它们在形成 MAMs27 时产生生物分子荧光互补 (BiFC)。尽管 GFP 片段容易自发组装,但 BiFC 具有最简单的读数、最清晰的信号和最少的噪声相关分析。此外,分裂的 GFP 之间的相互作用是高度可逆的28,因此它们的优点大于缺点,使 BiFC 方法适用于识别 MAM 稳定的调节剂。
致谢
我们感谢费城托马斯杰斐逊大学教授 György Hajnóczky 博士慷慨地为我们提供编码 RFP-Mito、MAM 1X、MAM 9X 和 MAM 18X 的表达质粒。特别感谢布莱根妇女医院高级成像科学家 Lai Ding 博士帮助我们编写生成、跟踪和测量 kymograph 数据的代码。这项研究得到了 RB 的治愈阿尔茨海默病基金和 NIH 向 RET 授予 5R01NS045860-20 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 6 Well Glass Bottom Plate | Cellvis | P06-1.5H-N | |
| B-27 Supplement (50X), serum free | Gibco/Thermo Fisher Scientific | 17504044 | |
| bFGF | R&D System | 233-FB | |
| BSA | Fisher Scientific | 501781532 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| DMEM/F12 with L-glutamine | Gibco/Thermo Fisher Scientific | 11320-033 | |
| EDTA | Life Technologies | 41116134 | |
| EGF | Sigma-Aldrich | 92090408 | |
| Falcon 6 Well Plates | VWR International | 41122107 | |
| GAPDH Polyclonal Antibody | Thermo Fisher Scientific | PA1-988 | |
| Gelatin | VWR International | 9000-70-8 | |
| Graphpad Prism N/A | Prism 9, version 9.5.0 | N/A | |
| Heparin | Sigma-Aldrich | H0200000 | |
| ImageJ Software | ImageJ 1.53a | N/A | |
| Matrigel Basement Membrane Matrix | Corning | 356234 | |
| mCherry Polyclonal Antibody | Invitrogen | PA5-34974 | |
| MS Excel | Microsoft Excel, version 2302 | N/A | |
| Multi-array electrochemiluminescence assay kit | Meso Scale Diagnostics (MSD) | K15200E-2 | V-PLEX Aβ Peptide Panel 1 (6E10) kit |
| NaCl | Fisher Scientific | 7647145 | |
| NuPAGE 4–12% Bis-Tris gel | Invitrogen | NP0321BOX | |
| Penicillin/Streptomycin/Amphotericin B | Lonza | 17-745E | |
| Photoshop | Adobe Photoshop CC 20.0.10 | N/A | |
| Rat Neuron Nucleofector Kit | Lonza | VPG-1003 | |
| StemPro Accutase | Gibco | A1110501 | |
| Tris-HCL, pH 7.6 | Boston BioProducts | 42000000 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Fisher Scientific | 501657287 |
参考文献
- Giacomello, M., Pellegrini, L. The coming of age of the mitochondria-ER contact: a matter of thickness. Cell Death Differ. 23 (9), 1417-1427 (2016).
- Degechisa, S. T., Dabi, Y. T., Gizaw, S. T. The mitochondrial associated endoplasmic reticulum membranes: A platform for the pathogenesis of inflammation-mediated metabolic diseases. Immun Inflamm Dis. 10 (7), e647 (2022).
- Schon, E. A., Area-Gomez, E. Mitochondria-associated ER membranes in Alzheimer disease. Mol Cell Neurosci. 55, 26-36 (2013).
- Erpapazoglou, Z., Mouton-Liger, F., Corti, O. From dysfunctional endoplasmic reticulum-mitochondria coupling to neurodegeneration. Neurochem Int. 109, 171-183 (2017).
- Sala-Vila, A., et al. Interplay between hepatic mitochondria-associated membranes, lipid metabolism and caveolin-1 in mice. Sci Rep. 6, 27351 (2016).
- Fujimoto, M., Hayashi, T. New insights into the role of mitochondria-associated endoplasmic reticulum membrane. Int Rev Cell Mol Biol. 292, 73-117 (2011).
- Hung, V., et al. Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. eLife. 6, e24463 (2017).
- Area-Gomez, E., Schon, E. A. On the pathogenesis of Alzheimer's disease: The MAM hypothesis. FASEB J. 31 (3), 864-867 (2017).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280 (5370), 1763-1766 (1998).
- Sukhorukov, V. S., et al. Molecular mechanisms of interactions between mitochondria and the endoplasmic reticulum: A new look at how important cell functions are supported. Mol Biol. 56 (1), 59-71 (2022).
- Zhang, P., Konja, D., Zhang, Y., Wang, Y. Communications between Mitochondria and endoplasmic reticulum in the regulation of metabolic homeostasis. Cells. 10 (9), 2195 (2021).
- Ziegler, D. V., Martin, N., Bernard, D. Cellular senescence links mitochondria-ER contacts and aging. Commun Biol. 4 (1), 1323 (2021).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol. 174 (7), 915-921 (2006).
- Cieri, D., et al. SPLICS: a split green fluorescent protein-based contact site sensor for narrow and wide heterotypic organelle juxtaposition. Cell Death Differ. 25 (6), 1131-1145 (2018).
- Carpio, M. A., et al. BOK controls apoptosis by Ca(2+) transfer through ER-mitochondrial contact sites. Cell Rep. 34 (10), 108827 (2021).
- Prudent, J., et al. MAPL SUMOylation of Drp1 stabilizes an ER/mitochondrial platform required for cell death. Mol Cell. 59 (6), 941-955 (2015).
- Zellmer, J. C., Tarantino, M. B., et al. Stabilization of mitochondria-associated endoplasmic reticulum membranes regulates Abeta generation in a three-dimensional neural model of Alzheimer’s disease. Alzheimer’s Dement. , 1-20 (2024).
- Magalhaes Rebelo, A. P., et al. Chemical modulation of mitochondria-endoplasmic reticulum contact sites. Cells. 9 (7), 1637 (2020).
- Berger, S. I., Iyengar, R. Role of systems pharmacology in understanding drug adverse events. Wiley Interdiscip Rev Syst Biol Med. 3 (2), 129-135 (2011).
- Friedman, J. R., Webster, B. M., Mastronarde, D. N., Verhey, K. J., Voeltz, G. K. ER sliding dynamics and ER-mitochondrial contacts occur on acetylated microtubules. J Cell Biol. 190 (3), 363-375 (2010).
- Wu, Y., et al. Contacts between the endoplasmic reticulum and other membranes in neurons. Proc Natl Acad Sci U S A. 114 (24), E4859-E4867 (2017).
- Cagin, U., et al. Mitochondrial retrograde signaling regulates neuronal function. Proc Natl Acad Sci U S A. 112 (44), E6000-E6009 (2015).
- Choi, S. H., et al. A three-dimensional human neural cell culture model of Alzheimer's disease. Nature. 515 (7526), 274-278 (2014).
- Kim, Y. H., et al. A 3D human neural cell culture system for modeling Alzheimer's disease. Nat Protoc. 10 (7), 985-1006 (2015).
- Kwak, S. S., et al. Amyloid-beta42/40 ratio drives tau pathology in 3D human neural cell culture models of Alzheimer's disease. Nat Commun. 11 (1), 1377 (2020).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39 (1), 121-132 (2010).
- Bhattacharyya, R., et al. Axonal generation of amyloid-beta from palmitoylated APP in mitochondria-associated endoplasmic reticulum membranes. Cell Rep. 35 (7), 109134 (2021).
- Tebo, A. G., Gautier, A. A split fluorescent reporter with rapid and reversible complementation. Nat Commun. 10 (1), 2822 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。