Method Article
Измерение кинетики жировой ткани in vivo у человека с использованием метода маркировки дейтерием (2H)
В этой статье
Резюме
Здесь представлен протокол измерения кинетики жировой ткани in vivo у человека с использованием метода мечения дейтерием (2H).
Аннотация
Белая жировая ткань является высокопластичным органом, который необходим для поддержания энергетического гомеостаза всего организма. Масса жировой ткани и изменения в жировой массе или распределении регулируются изменениями в синтезе и разрушении (т.е. обороте) жировых клеток и триацилглицеринов. Данные свидетельствуют о том, что способ и величина расширения подкожной жировой ткани (т.е. гипертрофия по сравнению с гиперплазией) и оборот могут влиять на метаболическое здоровье, поскольку адипогенез участвует в патогенезе ожирения и связанных с ним заболеваний. Несмотря на потенциальную роль жирового оборота в здоровье человека, существует недостаток знаний о кинетике жировых клеток in vivo . Отчасти это связано с медленной скоростью обновления клеток в жировой ткани и практической сложностью прямого обозначения их метаболических предшественников in vivo. В данной работе мы описываем методы измерения in vivo кинетики жировой ткани и скорости обмена у людей при потреблении воды, меченной дейтерием (2H). Включение 2H в дезоксирибонуклеотидные фрагменты ДНК в преадипоцитах и адипоцитах обеспечивает точное измерение образования и гибели клеток (жировой оборот). В целом, это инновационный подход к измерению кинетики жировой ткани in vivo и представляет собой существенный отход от других оценок in vitro .
Введение
Ожирение – заболевание, характеризующееся избытком белой жировой ткани (АТ) и являющееся значимым фактором риска развития сахарного диабета II типа и сердечно-сосудистых заболеваний1. Белая АТ является высокопластичным органом, который накапливает энергию в форме триацилглицеринов (ТГ) и необходим для метаболического гомеостаза2. Белая АТ сохраняет способность к расширению, уменьшению и ремоделированию во взросломвозрасте3, а масса АТ определяется динамическими изменениями объема адипоцитов (посредством синтеза и распада ТГ), непрерывным образованием адипоцитов посредством пролиферации и дифференцировки преадипоцитов (т.е. гиперплазией или адипогенезом)и гибелью жировых клеток4.
Данные свидетельствуют о том, что существует важная связь между подкожным оборотом АТ (например, образованием и гибелью адипоцитов) и кардиометаболическим здоровьем 5,6,7,8, а роль адипогенеза в патогенезе расстройств, связанных с ожирением, остается спорной4. Тем не менее, мало что известно об обмене АТ in vivo у людей, отчасти из-за медленной скорости обновления клеточных компонентов АТ и сложности прямой маркировки их метаболических предшественников in vivo. Несмотря на то, что методы in vitro дают некоторое понимание, эти подходы не обеспечивают всесторонней оценки in vivo в естественной среде АТ.
Лабораторией Хеллерштайна 9 был разработан метод оценки оборота АТ in vivo с использованием включения стабильного изотопа дейтерия (2H) из тяжелой воды (2H,2O) в АТ (рис. 1)10. Протокол, который был валидирован на мышах и людях, включает в себя первоначальное увеличение до 2H2O для увеличения обогащения воды организмом на 2H с последующим адекватным ежедневным потреблением для поддержания стабильных значений обогащения, близких к плато. 2H из 2H2O (т.е. тяжелая вода) включается в дезоксирибозный (dR) фрагмент дезоксирибонуклеотидов в ДНК жировых клеток, а обогащение изотопами измеряется в ДНК с помощью масс-спектрометрии и применения анализа распределения массовых изотопомеров (MIDA)9,10,11. Мечение дезоксирибозного фрагмента пуриновых дезоксирибонуклеотидов в ДНК стабильными изотопными предшественниками имеет ряд преимуществ по сравнению с предыдущими методами, такими как те, которые включали мечение пиримидиновыми нуклеотидными основаниями (например, из 3-H-тимидина или бромдезоксиуридина). Следует отметить, что эндогенное повторное включение оснований, особенно пиримидинов, но не dR, в реплицирующуюся ДНК ранее затрудняло интерпретацию инкорпорации меток12. Кроме того, включение метки стабильного изотопа в dR не вызывает генотоксичности, в отличие от включения радиоактивных или генотоксических агентов, таких как 3Н (тритий) или бромдезоксиуридин. Поэтому долгосрочное использование этой методики на животных моделях и людях безопасно.
Измерение синтеза 2-H-меченой ДНК обозначает прохождение клетки через S-фазу клеточного деления и идентифицирует вновь образованные преадипоциты и адипоциты (посредством дифференцировки преадипоцитов) или адипогенез13. Клетки, которые подвергаются быстрому обороту (например, моноциты), быстро заменяют свою ДНК и достигают плато в2H-обогащении, обеспечивая таким образом внутренний эталон для анализа. Соотношение 2H-обогащения ДНК жировых клеток к ДНК моноцитов (референтных клеток) или измерение интегрированного тела 2H2O позволяет рассчитать долю вновь синтезированных жировых клеток. В настоящем протоколе описаны методы измерения скорости обновления жировых клеток (адипогенеза) in vivo у человека с помощью протокола метаболического мечения 2H, включая усовершенствованные методы очистки адипоцитов посредством отрицательного иммунного отбора и обогащения популяции преадипоцитов14.
протокол
Институциональный наблюдательный совет (IRB) Пеннингтонского биомедицинского исследовательского центра одобрил все процедуры (#10039-PBRC), и все люди дали письменное информированное согласие.
1. Восьмая неделя 2Ч2Период О-маркировки
- Вводите аликвоты с содержанием 70% или 99,9% воды, меченной дейтерием (2Н2О) в стерильные пластиковые контейнеры.
- Проинструктируйте участников пить 35 мл доз 99,9% обогащенных 2Н2О или 40 мл 70% обогащенных 2Н2О три раза в день в течение 1 недели (подготовительный период) и пить две дозы 35 мл или 50 мл соответственно в день в течение 2-8 недель.
Примечание: Преходящее головокружение или вертиго являются единственными известными побочными эффектами приема 2Н2О и связаны с быстрыми изменениями в объемном потоке воды, которые воспринимаются волосяными фолликулами внутреннего уха. Следовательно, проинструктируйте участников принимать дозы с интервалом не менее ~2 часов, чтобы избежать редкого возникновения преходящего головокружения или вертиго15. По той же причине не восполняйте пропущенные дозы, удваивая одну дозу. Введение дозы, как описано выше (с интервалом в ≥2 ч), делает этот побочный эффект крайне редким у людей (<1% из нескольких сотен субъектов). - Контролируйте соблюдение нормы потребления 2Н2О с помощью сборов мочи для измерения обогащения 2 Н в воде организма, а также путем еженедельного возврата пустых флаконов для подсчета.
- Очистите образцы мочи с помощью активированного угля и фильтра.
- Добавьте 8 мл мочи в 10 мл пробирки с 1 мл активированного угля.
- Поместите образец на коромысло на 10 минут и центрифугируйте в течение 5 минут при 800 x g , чтобы древесный уголь переместился на дно пробирки. Отфильтруйте образец с помощью шприцевого фильтра 0,2 мкм.
- Измерьте обогащение 2H2O в воде (моче) организма с помощью масс-спектрометрии изотопного отношения (IRMS).
ПРИМЕЧАНИЕ: Обогащение 2H2O может быть проанализировано различными методами, включая газовую хроматографию-масс-спектрометрию16, высокотемпературный конверсионный элементный анализатор (TC/EA) в сочетании с IRMS17, резонаторную кольцевую инфракрасную спектроскопию (IRIS)18 или с помощью H/устройства, прикрепленного к масс-спектрометру (например, IRMS)19. - Используйте среднее значение обогащения 2H2O, измеренное в моче в течение 8-недельного периода мечения, для расчета экспозиции предшественника 2H2O и доли вновь синтезированных клеток АТ (см. раздел 7 и раздел 8 ниже).
- Очистите образцы мочи с помощью активированного угля и фильтра.
ПРИМЕЧАНИЕ: Протокол мечения 2Н2О поддерживает обогащение воды организма на уровне, близком к плато,в диапазоне от 1,0% до 2,5% в течение 8-недельного периода мечения (Рисунок 2)10.
2. Биопсия жировой ткани у людей
- После очищения кожи раствором повидон-йода введите местную анестезию (например, 2% лидокаин/0,5% бупивакаин), сделайте разрез на коже ~0,75 см и соберите подкожные биопсии АТ с помощью техники игольчатой липоаспирации в стерильных условиях13.
- Взвесьте стерильную пробирку объемом 50 мл, содержащую 5 мл буфера комнатной температуры (ОТ) 1 М HEPES, pH 7,3. Немедленно поместите АТ в пробирку с буфером HEPES для обработки.
- Взвесьте 50 мл пробирки, содержащей АТ, и запишите вес.
3. Выделение очищенных адипоцитов
- Добавьте раствор коллагеназы типа 1 /HEPES (2 мг/мл) в 2 г/мл АТ.
- Переваривают АТ путем инкубации на водяной бане с встряхиванием (100 об/мин) в течение 1 ч при 37 °C до получения однородной смеси с несколькими крупными неповрежденными кусочками АТ.
- Центрифугируйте пробирку при давлении 500 x g в течение 8 мин при ЛТ, чтобы отделить адипоциты и стромально-васкулярную фракцию (SVF).
- Аккуратно удалите верхний жировой слой (адипоциты), и переложите его в отдельную пробирку. Не нарушайте расположение гранулы (SVF) на дне трубки.
- Как описано ранее14, очистите адипоциты с помощью иммуномагнитного разделения клеток.
Примечание: Этот важный шаг делается для «очистки» адипоцитов, так как другие типы клеток с быстрым клеточным обновлением, включая гемопоэтические, эндотелиальные и стволовые клетки, могут прилипать к плавающим адипоцитам и влиять на измерения.- Поместите ~400 мкл адипоцитов в пробирку объемом 5 мл для отрицательной иммуноочистки.
- Добавьте антитела, блокирующие FcR (100 мкл/мл).
- Добавьте коктейль биотинилированных антител против маркеров эндотелиальных клеток (античеловеческий CD31; 1:100), гемопоэтических клеток (античеловеческий CD45; 1:400) и мезенхимальных стволовых клеток (античеловеческий CD34; 1:100) в раствор адипоцитов в течение 15 мин в ЛТ.
- Добавьте в раствор адипоцитов отборный биотиновый коктейль (100 μл/мл), хорошо перемешайте и инкубируйте в течение 15 минут при RT с осторожным наклоном/вращением.
- Смешайте магнитные наночастицы с помощью пипетирования вверх и вниз, добавьте частицы (50 мкл/мл) в раствор адипоцитов, хорошо перемешайте и инкубируйте в течение 10 мин при РТ с мягким вращением (10 об/мин).
- Добавьте PBS/2% FBS/1 мМ буфер ЭДТА в раствор адипоцитов в общем объеме 1 мл.
- Поместите трубку в магнит и оставьте на 5 минут.
- Возьмите магнит и одним непрерывным движением переверните магнит, в котором находится тюбик, и вылейте содержимое в новую пробирку объемом 5 мл. Не постукивайте по тюбику во время заливки. Клетки, прикрепленные к антителам, связываются магнитными наночастицами и удаляются, в то время как иммуноочищенные адипоциты сохраняются.
- Очищенные адипоциты мгновенно заморозьте в жидкости N2 и храните при температуре −80 °C до извлечения ДНК.
4. Выделение преадипоцитов
- Чтобы изолировать обогащенную популяцию преадипоцитов, используйте протокол, чтобы использовать их способность прикрепляться к пластику после кратковременного культивирования SVF20.
- В ламинарном проточном колпаке ресуспендировать гранулу SVF в 5 мл буфера для лизиса эритроцитов в течение 5-10 мин при RT (тщательно перемешать) и центрифугировать при 800 x g. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 10% FBS в альфа (α)MEM.
- Поместите клетки на пластиковую чашку для культивирования в течение ~8-12 часов в инкубаторе для тканевых культур при температуре 37 °C и атмосфере 5%CO2 .
- Через ~8-12 ч аккуратно промойте неадгезивные клетки из культурального планшета PBS внутри ламинарного проточного колпака.
- После аспирации PBS добавьте 1-1,5 мл 0,25% трипсина/1 мМ ЭДТА в чашку для культивирования для отделения адгезивных клеток (обогащенной популяции преадипоцитов). Поместите чашку для культивирования в инкубатор при температуре 37 °C на ~5-8 минут, чтобы помочь поднять клетки.
- Добавьте 10% FBS/αMEM в планшет и тщательно промойте планшет, чтобы собрать все элементы с планшета. Перелейте раствор клетки в пробирку объемом 15 мл или 50 мл и центрифугируйте при 800 x g в течение 8 минут.
- Удалите надосадочную жидкость и храните гранулу (преадипоциты) при температуре −80 °C до извлечения ДНК.
5. Выделение моноцитов крови
Моноциты анализируются как представляющие (почти) полностью перевернутую клеточную популяцию, и измерение обогащения 2Н в моноцитах может быть использовано в качестве референсного маркера экспозиции 2Н2О у каждого индивидуума. В качестве альтернативы можно измерить обогащение организма 2H2O и использовать его для расчета экспозиции 2H2O.
- Возьмите свежую цельную кровь человека в вакутайнерные пробирки, содержащие ЭДТА.
- Центрифугируйте кровь при 1000-2000 х г в течение 15 мин при 4 °C.
ПРИМЕЧАНИЕ: Не используйте тормоз. - Снимите верхний слой плазмы. Будьте осторожны, чтобы не задеть белую охристую шерсть прямо под плазмой.
- Отсадите белую охристую шерсть с помощью переводной пипетки и переложите ее в пробирку объемом 50 мл. Добавьте ~10 мл PBS в охристое пальто.
- Аккуратно добавьте 10 мл градиента плотности среднего слоя для слоя охристого слоя.
ПРИМЕЧАНИЕ: Убедитесь, что кончик пипетки касается дна пробирки, и осторожно извлеките пипетку, чтобы на дне был прозрачный слой среды с градиентом плотности. Избегайте образования пузырей. - Центрифугируйте пробирку при давлении 800 x g в течение 30 минут при выключенном тормозе.
- Выведите пипетку (~10 мл) из белого слоя (мононуклеарной фракции), совершая круговые движения кончиком переводной пипетки близко к краю, но не касаясь верхнего слоя. Переложите в новую пробирку объемом 50 мл и добавьте 10 мл PBS. Центрифугируйте при 800 x g в течение 5 минут (не используйте тормоз) и выбросьте надосадочную жидкость.
- Добавьте в гранулу 5 мл буфера для лизиса эритроцитов. Перемешайте и оставьте на 2 минуты на RT.
- Добавьте 5 мл PBS с 0,1% BSA в буфер/гранулированный раствор для лизиса эритроцитов, центрифугируйте при 800 x g в течение 5 минут и выбросьте надосадочную жидкость.
- Выделите моноциты в виде CD14+ клеток с помощью иммуномагнитных шариков. Выполните выделение клеток CD14+ , следуя протоколу производителя.
- Храните выделенные моноциты при температуре −80 °C до экстракции ДНК.
6. Подготовка ДНК (выделение, гидролиз и дериватизация)
- Выделите ДНК из преадипоцитов, адипоцитов и моноцитов крови с помощью набора для экстракции ДНК в соответствии с инструкциями производителя.
- Чтобы высвободить дезоксирибонуклеозиды, ферментативно гидролизуйте ДНК (~200 мкл) в течение ночи (не более 24 ч) при 37 °C в 50 мкл ферментного гидролизного коктейля, содержащего 1 мл S1-нуклеазы, 1 мл фермента фосфатазы и 36,8 мл 5-кратного гидролизного буфера в стеклянных пробирках с завинчивающейся крышкой размером 16 мм x 100 мм (10 мл). Кроме того, включите следующие образцы: заготовку для воды, заготовку для коктейля для гидролиза, заготовку колонки из набора для экстракции ДНК и 500 нг стандартов ДНК.
- Чтобы приготовить 5-кратный буфер для гидролиза, поместите 94 мл чистой воды, пригодной для молекулярной биологии, в стерильный стакан. Взвесьте 3,08 г ацетата натрия и 21,5 мг сульфата цинка, добавьте воды и перемешайте до полного растворения. Отрегулируйте pH до 5,0 с помощью ледяной уксусной кислоты и проверьте с помощью бумаги pH. Добавьте воду до полного объема 100 мл.
- Для приготовления фермента фосфатазы необходимо ресуспендировать флакон кислой фосфатазы в 1 мл чистой воды.
- Для получения фермента нуклеазы S1 в концентрации 0,5 ед/мкл разбавьте 2,5 мкл нуклеазы S1 в 2 мл 1x гидролизного буфера (добавьте 1 мл 5x гидролизного буфера на 4 мл чистой воды).
- Дериватизируйте гидролизаты до производных пентафторбензилгидроксиламина (PFBHA). В частности, добавьте непосредственно к расщепленным образцам ДНК, включая стандарты и заготовки, в пробирках с завинчивающейся крышкой размером 16 мм x 100 мм (10 мл): 100 мкл пентафторбензилгидроксиламина гидрохлорида (PFBHA; 1 мг/мл) и 75 мкл ледяной уксусной кислоты. Вдохните (кратко), закройте флаконы крышками и поместите образцы гидролизата на нагревательный блок, установленный при температуре 100 °C, на 30 минут.
- Извлеките образцы и дайте им остыть в течение ~5 минут до температуры RT. После охлаждения добавьте 2 мл уксусного ангидрида и 100 мкл 1-метилимидазола в каждую пробирку под вытяжным шкафом. Установите трубки на нагревательный блок при температуре 100 °C на 5 минут.
- Извлеките образцы, а затем дайте им остыть в течение ~15-20 минут. Когда остынет, добавьте 3 мл воды молекулярно-биологического качества к каждому образцу, быстро перебейте его и оставьте на 10 минут.
- Добавьте в пробирки 2 мл дихлорметана (DCM) и энергично переведите образцы в течение 15 с, чтобы извлечь производное в органическую фазу.
- Центрифугируйте при давлении 800 x g в течение 5 минут для разделения фаз. Осторожно переложите нижний слой дихлорметана в чистый флакон GC объемом 1,6 мл.
ПРИМЕЧАНИЕ: Не передавайте водную фазу, так как это приведет к увеличению фона. - Выпарить до сухости с азотом в течение ~20 минут, чтобы удалить DCM и остаточную уксусную кислоту, затем высушить ~10 минут в скоростном вакууме при RT, чтобы удалить все следы реагентов.
7. Газовый хромато-масс-спектрометрический анализ (ГХ-МС) анализа ДНК
- После высыхания ресуспендируйте производные PFBHA в 150 мкл этилацетата и колпачк. Затем проведите анализ на предмет включения 2Н в ДНК на приборе для газовой хроматографии (ГХ)/масс-спектрометрии (МС), оснащенном колонкой DB-225, с использованием ионизации метана с отрицательным химическим излучением и сбором ионов в режиме селективного ионного мониторинга в точках m/z 435, m/z 436 и m/z 437 (представляющих массовые изотопомеры M0, M1 и M2 ). соответственно). Следуйте инструкциям производителя для используемого инструмента.
- Установите следующие условия для ГХ: колонна: внутренний диаметр 30 м x 0,25 мм x пленочное покрытие 0,25 мкм; хроматограф: газообразный гелиевый носитель при постоянном расходе 1,0 мл/мин; импульсные бесщеплевые инъектры; температура инжектора: 250 °C; Передаточная линия MS: 325 °C; Условия печи: начальная температура 100 °C, выдержка 2 мин, линейная скорость при 40 °C/мин до температуры 220 °C, выдержка 7,5 мин, вторая линейка при 40 °C/мин до 320 °C, выдержка 1 минута. Общее время выполнения составляет 16,0 мин. Типичное время элюирования dR составляет 10,5 мин и 10,8 мин для первого и второго пиков соответственно.
- Задайте следующие условия МС: источник ионизации метана отрицательного химического вещества с детектированием в режиме мониторинга одиночных ионов; ионы, собранные для dR: m/z 435, m/z 436 и m/z 437 (представляют собой массовые изотопомеры M0, M1 и M2 соответственно).
ПРИМЕЧАНИЕ: Силиконизируйте открытый стеклянный вкладыш с помощью небольшой пробки из силиконизированной стекловаты в нижней части вкладыша. Меняйте этот вкладыш часто (каждые ~100 инъекций).
- Рассчитаем массовое соотношение распространенности изотопомеров M1 в необогащенном (естественном распространении) производном dR следующим образом:
Коэффициент M1 = распространенность M1/(сумма обилий M0, M1 и M2)
Затем вычтите естественные отношения распространенности M1 из отношений M1 в dR меченых образцов, чтобы рассчитать обогащения (избыточное содержание изотопов, или %EM1)21. - Измерьте массовое содержание изотопомеров базовых (необогащенных) стандартов ДНК одновременно в диапазоне содержания ионов M0, которые охватывают диапазон распространенности ионов M0 в анализируемых образцах.
ПРИМЕЧАНИЕ: Этот шаг необходим для коррекции «чувствительности к распространенности» изотопных соотношений, измеренной с помощью GC/MS22. - Постройте график измеренной распространенности ионов M0 в зависимости от измеренных массовых соотношений изотопомеров M1 в немаркированных стандартах, чтобы определить концентрацию образца в колонке, которая является наиболее точной для массового изотопомера M1 (т. е. где она наиболее близка к известному, рассчитанному естественному отношению M1 или «золотой середине»). Коэффициент M1 для этой необогащенной производной dR составляет 0,1669.
- Вводите экспериментальные образцы так, чтобы они находились как можно ближе в области пика M0 к этой «зоне наилучшего восприятия». Используйте квадратичную регрессию отношения М1 необогащенных стандартов по отношению к пиковой площади М0 для оценки «скорректированного естественного изобилия» отношения М1 для каждого образца при его конкретной концентрации М0. Вычтите это из соотношения M1 образца жировой клетки, чтобы получить процент обогащения выше естественного изобилия, или %EM1 (рис. 3)23.
- Рассчитайте теоретическое максимальное обогащениеМ1 (EM1*) в жировых клетках с использованием уравнений24 для анализа распределения массовых изотопомеров (MIDA) на основе интегрированной в организм экспозицииН2Н2О(измеренной в моче) за 8-недельный период (рис. 4) или промежуточного измеренного обогащения моноцитов (шаг 7.5).
8. Расчет доли вновь синтезированных клеток, или адипогенез in vivo
- Рассчитайте долю новых клеток (%), которая является мерой адипогенеза in vivo или образования вновь синтезированных преадипоцитов или адипоцитов, используя следующую формулу:
Доля новых клеток (%) = [(обогащениеМ1 в образце [жировых] клеток)/EM1* (теоретическое максимальное обогащениеМ1 )] х 100
Примечание: *Обогащение моноцитов2 H также может быть использовано в качестве знаменателя уравнения. Это измерение в моноцитах представляет собой референсный клеточный маркер экспозиции 2H2O у каждого индивидуума и может быть использовано для подтверждения расчетов теоретического максимального обогащения M1из измеренных значений тела 2H2O.
Результаты
Протокол мечения 2Н2О (раздел 1) поддерживает обогащение 2 Н в воде организма, близком к плато,в диапазоне от 1,0% до 2,5% в течение 8-недельного периода мечения10, как показано на рисунке 2. В предыдущем исследовании использовался протокол мечения 2H2O для оценки кинетики жировой ткани путем включения 2H в ДНК жировых клеток, как подробно описано в разделах 2-8, и сообщалось, что in vivo адипогенез (как преадипоцитарная пролиферация, так и образование адипоцитов) был выше в подкожной бедренной кости (scFEM) по сравнению с подкожным абдоминальным депо (scABD) у женщин с ожирением (рис. 5)13. Дополнительные данные показали, что скорость образования преадипоцитов и адипоцитов в подкожных депо АТ положительно связана с общим процентным содержанием жира в организме (Рисунок 6)13. В целом, эти опубликованные данные подтверждают, что этот физиологический метод мечения 2Н является инновационным подходом к оценке кинетики АТ in vivo у лиц с различным распределением жировой ткани и содержанием жира в организме13.
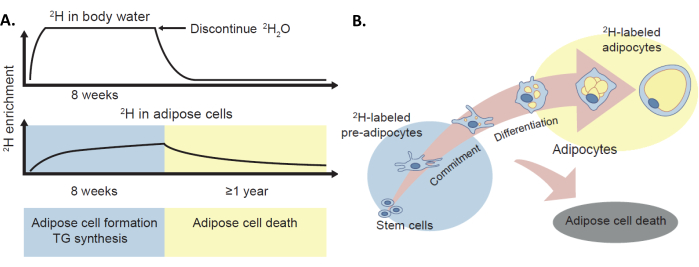
Рисунок 1: Протокол мечения 2Н для оценки обмена жировой ткани in vivo. (A) Метод мечения дейтерием был валидирован для обеспечения in vivo оценки образования жировых клеток, синтеза ТГ и гибели адипоцитов у человека путем включения стабильного изотопа 2H, вводимого в виде 2H2O, в воду и жировую ткань организма. (B) Обогащение 2H в жировой ткани (преадипоцитах и адипоцитах) обеспечивает меру образования жировых клеток. Следует отметить, что этот протокол также может обеспечить измерение гибели жировых клеток через потерю метки 2H, хотя это не является основной темой данной рукописи. Этот рисунок был адаптирован с разрешения Уайта и Равуссина4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
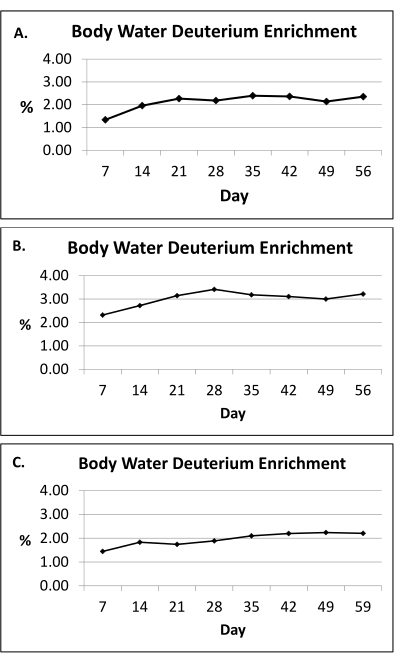
Рисунок 2: Обогащение водой организма дейтерием. (A-C) Здесь представлены репрезентативные измерения обогащения воды организмом дейтерием (моча) в течение 8 недель протокола мечения 2H2O у трех человек. В зависимости от предоставленных доз (раздел 1) протокол мечения 2Н2О поддерживает обогащение воды организма на уровне, близком к плато,в диапазоне от 1,0% до 2,5% (ось y) в течение 8-недельного периода мечения (ось x). Среднее обогащение воды в организме рассчитывается с использованием подхода «площадь под кривой» для всего периода воздействия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
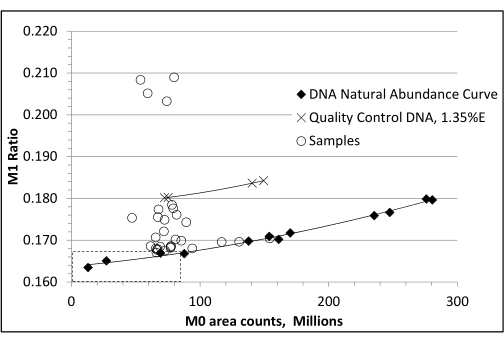
Рисунок 3: Кривая коррекции естественной численности немеченой ДНК. Анализ немеченой ДНК с помощью масс-спектрометрии приводит к увеличению базовой фракционной плотности M1, что ложно предполагает увеличение обогащения с увеличением нагрузки образца на GC-колонку. Непомеченная кривая распространенности необходима для коррекции этой «чувствительности к численности» изотопных соотношений. Это делается путем использования диапазона немеченых стандартных нагрузок ДНК (пиковые области M0) и вычитания измеренной фракционной плотности M1 (отношение M1 = распространенность M1/распространенность M0, M1 и M2), которая соответствует пиковой площади M0 меченого образца. В показанном примере две пары контрольных образцов с обогащением на 1,35% дают правильные результаты только после вычитания каждого соответствующего значения фракционной плотности M1, полученного из немаркированной кривой. Рассчитанный коэффициент M1 для производной dR составляет 0,1669. На этом рисунке коэффициент M1 достигается при 82 млн M0 пиковой площади. В этом примере «скорректированный» коэффициент M1 для необогащенного dR можно рассчитать с помощью следующей регрессии: y = 1,3024e−19x2 + 1,7010e−11x + 0,1650. Этот рисунок был адаптирован с разрешения Mazzarello et al.23 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
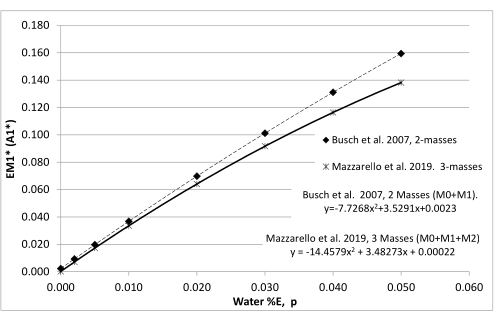
Рисунок 4: Взаимосвязь между обогащением организма водой (p) и максимальным обогащением полностью перевернутой ткани. Построены таблицы распределения изотопомеров по массе, в которых рассчитываются все изотопомеры dR при всех возможных обогащениях воды в организме (p). Затем они используются для определения взаимосвязи между p и максимальным обогащением M1 (EM1*) dR во вновь реплицированной ДНК. Если известно обогащение организма водой, можно рассчитать EM1* и использовать его для расчета фракционного синтеза. Это полезно, когда полностью перевернутая референсная ткань недоступна. Регрессии Busch et al.9 и Mazzarello et al.23 дают сопоставимые результаты дробного синтеза при условии, что во всех измерениях последовательно используются либо две массы, либо три массы при расчете отношений M1 и EM1*. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Более высокая скорость образования преадипоцитов и адипоцитов в депо scFEM по сравнению с депо scABD. Среднее по методу наименьших квадратов, сравнивающее долю новых преадипоцитов и адипоцитов в разных депо, было получено из линейной смешанной модели (n = 25). Разница во фракции новых преадипоцитов между подкожными бедренными (scFEM) и подкожными абдоминальными (scABD) депо составила 3,224 (p = 0,0354), в то время как разница во фракции новых адипоцитов между scFEM и scABD депо составила 2,877 (p = 0,0005)13. Исследуемая популяция включала 25 женщин афроамериканского (n = 14) и европеоидного (n = 11) происхождения, со средним возрастом 31 год ± 6 лет, средним ИМТ 32,6 кг/м2 ± 2,7 кг/м2 и 44,3% ± 4,1% жира в организме. Этот рисунок был адаптирован с разрешения White et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Положительная корреляция между образованием преадипоцитов и адипоцитов в депо scABD и scFEM (C,D) и общим процентом жира в организме. Простые ассоциации между долей новых преадипоцитов или адипоцитов и процентным содержанием жира в организме были проанализированы с использованием корреляции Спирмена (n = 25). (А,Б) Корреляция Спирмена между фракцией новых преадипоцитов (подкожной абдоминальной; scABD) и процентным содержанием жира в организме составила 0,4263 (R2 = 0,2472; p = 0,019), а корреляция Спирмена между фракцией новых адипоцитов (scABD) и процентным содержанием жира в организме составила 0,3291 (R2 = 0,2346; p = 0,026). (К,Г) Корреляция Спирмена между фракцией новых преадипоцитов (подкожных бедренных; scFEM) и процентным содержанием жира в организме составила 0,2761 (R2 = 0,1123; p = 0,092), а корреляция Спирмена между фракцией новых адипоцитов (scFEM) и процентным содержанием жира в организме составила 0,5358 (R2 = 0,2116; p = 0,056)13. Исследуемая популяция включала 25 женщин афроамериканского (n = 14) и европеоидного (n = 11) происхождения, со средним возрастом 31 год ± 6 лет, средним ИМТ 32,6 кг/м2 ± 2,7 кг/м2 и 44,3% ± 4,1% жира в организме. Этот рисунок был адаптирован с разрешения White et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Оценки in vivo необходимы для получения новых знаний о динамике оборота белой АТ и ее роли в ожирении и связанных с ним метаболических заболеваниях, поскольку оценки in vitro не охватывают естественную среду АТ. Несмотря на то, что использование ретроспективного радиоуглеродного датирования для оценки динамики жировой ткани оказалось информативным 7,25, этот подход не подходит для фиксации динамических изменений во время проспективных интервенционных исследований. Метод мечения 2Н был валидирован для обеспечения физиологических измерений образования и оборота жировых клеток in vivo у человека и представляет собой существенный отход от других оценок. В последние годы этот подход был применен для оценки и раскрытия новой кинетики жировой ткани как угрызунов26, так и у человека 13,27,28.
Примечательно, что с помощью этого метода были реализованы дополнительные методы обработки АТ для очистки свежевыделенных адипоцитов и удаления загрязнения из других типов клеток, которые могут прилипать к плавающим адипоцитам и влиять на измерения. Как сообщалось ранее, эти шаги привели к благоприятному повышению точности измерений адипогенеза in vivo , в частности, измерения вновь образованных адипоцитов14. Еще одним дополнительным шагом в этом методе было проведение кратковременного культивирования клеток SVF, чтобы обеспечить эффективное и преимущественное присоединение клеток-предшественников адипоцитов. Было обнаружено, что этот этап культивирования обогащает популяцию преадипоцитов, что приводит к более точным измерениям пролиферации in vivo 14. Чистота интересующих клеток является важным фактором в этом методе, особенно при анализе тканей, содержащих различные типы клеток.
В то время как гибель адипоцитов является важным компонентом оборота АТ8, оценка гибели клеток не была включена в протокол, и, таким образом, смерть адипоцитов не измерялась и не обсуждалась в этом анализе. Тем не менее, здесь сообщается о скорости фракционного синтеза (FSR), или фракции вновь образованных клеток, присутствующих в АТ в течение 8 недель. Абсолютная скорость синтеза (ASR) рассчитывается следующим образом: FSR × размер пула. Размер пула АТ может быть наиболее точно оценен по количеству адипоцитов в ткани, которое может быть определено экспериментально по весу АТ, скорректированному на средний размер адипоцитов. В качестве альтернативы может быть использована оценка размера адипоцитов на основе опубликованных значений, когда это уместно. Важно отметить, что когда размер пула АТ находится в стабильном или близком к равновесному состоянии, что является обычным состоянием даже при таких состояниях, как ожирение (где изменение общей массы АТ тела в течение 8 недель обычно довольно мало по отношению к общей массе АТ), FSR равен скорости фракционной деградации (FDR) или коэффициенту смертности. который напрямую показывает период полураспада клеток: T1/2 = ln 2/FDR = 0,693/FDR9. Следовательно, предполагая, что масса АТ находится в относительно стабильном состоянии в течение 8-недельного периода мечения 2Н2О, образование новых жировых клеток, вероятно, аналогично доле гибели жировых клеток, что обеспечивает меру обновленияили замены жировых клеток. Если в течение периода маркировки происходит изменение размера пула (условия нестационарного состояния), можно использовать коррекцию в нестационарном состоянии, такую как уравнение Стила29, которая требует измерения или оценки изменения размера пула в течение периода маркировки. Следует отметить, что дробный синтез "f" по-прежнему является действительным измерением в нестационарном состоянии, так как значение "f" представляет собой долю вновь разделенных клеток, которые присутствуют. Однако преобразование "f" в константу скорости (FSR или FDR) потребовало бы коррекции в нестационарном состоянии, такой как уравнение Стила. Преимущество протокола мечения 2H2O заключается в том, что его можно применять для количественного измерения гибели жировых клеток, поскольку потери общего обогащения 2H в пуле жировой ткани после прекращения потребления 2H2O происходят только врезультате гибели клеток.
Несмотря на то, что необходимость выделения и очистки интересующих клеток может рассматриваться как ограничение протокола, некоторые из многих преимуществ включают простоту введения2Н2О, пригодность этого подхода для условий свободной жизни, безопасность подхода и тот факт, что он обеспечивает интегративную оценку в естественной среде АТ. который не фиксируется с помощью подходов in vitro. Важно отметить, что протокол 2Н2О является практическим подходом, который может быть применен для оценки кинетики in vivo в различных других типах клеток, тканях и состояниях заболевания9.
Важной частью плана эксперимента является доза и время введения 2Н2О9. В представленном протоколе используется 8-недельный период маркировки, который включает в себя потребление тяжелой воды три раза в день в течение 1-й недели (например, период подготовки к плато обогащения 2H2O в воде организма), за которым следует потребление два раза в день в течение оставшихся 2-8 недель для поддержания относительно постоянного уровня обогащения воды в организме. Соответствующая дозировка и введение важны для обеспечения организму измерений обогащения 2H2O, которые необходимы для оценки соблюдения протокола (раздел 1 протокола) и для расчета доли вновь образованных клеток (раздел 8 протокола). Следует отметить, что 8-недельный период мечения оказался достаточным и подходящим для измерения кинетики АТ, несмотря на медленный оборот этой ткани11,25. Таким образом, преимущество данного подхода заключается в том, что 2Н2О безопасна и пригодна для потребления в течение нескольких недель или месяцев, а доза и время введения 2Н2О могут быть изменены в зависимости от интересующей клетки или ткани, научного вопроса и цели исследования, чтобы обеспечить надлежащее включение метки 2Н.
Есть несколько моментов, которые следует учитывать для проведения последующих исследований. Период полувыведения 2Ч в воде организма составляет ~7-10 дней у человека. После того, как пациент прекращает прием 2H2O, вода в организме 2H достигает исходного уровня через ~4-6 недель (разведение 2H2O соответствует модели экспоненциального распада)9. Хотя это не является фактором для клеток с быстрым оборотом (например, моноцитов), остаточная маркировка 2Н адипоцитов после прекращения потребления 2Н2О является важным фактором при планировании последующих исследований из-за медленного обновления этих клеток. Следует отметить, что отмирание метки (например, гибель адипоцитов) может быть оценено и получить полезную информацию, поскольку потеря метки 2Н в жировых клетках происходит только в случае потери клетокили гибели клеток9. Перед проведением последующих исследований обогащение 2 Н вжировых клетках должно быть измерено до начала периода 2 H-мечения, чтобы установить «базовое» измерение при проведении последующих исследований.
Этапы, описывающие подготовку ДНК, анализ ГХ-МС и расчет вновь образованных клеток (разделы 6-8 протокола), были подробно описаны в работе Busch et al.9. Обогащение 2Н в (почти) полностью замененном типе эталонных ячеек может быть использовано в уравнении для расчета доли вновь образованных представляющих интерес ячеек (раздел 8 протокола). Это референсное значение представляет собой максимально возможное содержание 2H в ДНК, если популяция референсных клеток включает в себя практически все вновь разделенные клетки при одинаковых условиях мечения 2H2O. Следовательно, в этих анализах измерение в моноцитах (почти полностью замененных клетках) представляет собой маркер референсных клеток экспозиции 2H2O, и этот показатель был использован для расчета доли вновь синтезированных жировых клеток. В отсутствие измерения референтных клеток обогащение тела 2H2O может быть использовано для оценки обогащения 2H, соответствующего 100% замещенным клеткам (т.е. теоретического максимума обогащенияM1; Рисунок 2). Следует отметить, что использование измерений моноцитов или других контрольных клеток, 2Н имеет преимущество по сравнению с измерениями воды в организме, поскольку первые измерения объясняют степень неполного обогащения 2Н дезоксирибонуклеозидов из 2Н2О (из-за неполного обмена 1Н/2Н и/или кинетических изотопных эффектов на уровне метаболических предшественников). Измерения эталонной ячейки также служат для подтверждения расчетов с использованием теоретического максимума обогащенияМ1.
В этом протоколе описываются методы измерения in vivo кинетики АТ и скорости обмена у людей с помощью протокола мечения 2H2O. Представленные данные подтверждают, что этот физиологический метод является инновационным подходом к оценке кинетики АТ in vivo и связи с метаболическими исходами здоровья, связанными с ожирением27 у лиц с различным распределением жировой ткани и содержанием жира в организме13, а также в ответ на вмешательства, включая диету, физические упражнения или фармакологическое лечение26,28.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы благодарят Центр масс-спектрометрии в Пеннингтонском биомедицинском исследовательском центре.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-methylimidazole | MilliporeSigma | 336092 | |
| 2H2O | Sigma Aldrich | ||
| Acetic anhydride | Aldridge | 539996 | |
| ACK Lysing Buffer (erythrocyte lysis buffer) | Quality Biological Inc (VWR) | 10128-802 | |
| Agilent 6890/5973 GC/MS | Agilent | ||
| Anti-human CD31 (PECAM-1) Biotin | Invitrogen | 13-0319-82 | |
| Anti-human CD34 Biotin | Invitrogen | 13-0349-82 | |
| Anti-human CD45 | BioLegend | 304004 | |
| Antibiotic Antimycotic Solution | MilliporeSigma | A5955 | |
| Collagenase type 1 | Worthington Biochemical Corporation | LS004196 | |
| Deoxyribose (2-deoxy d-ribose) | MilliporeSigma | 31170 | |
| Deuterium Oxide | MilliporeSigma | 756822 | |
| DB-225 column (30m, 0.25mm, 0.25um) | J&W Scientific | 122-2232 | |
| Dichloromethane (DCM) | MilliporeSigma | 34856 | |
| DNA standard (calf thymus DNA) | MilliporeSigma | D4764 | |
| Dneasy Blood and Tissue Kit (DNA extraction kit) | Qiagen | 69504 | |
| Easy Sep Human Biotin kit | Stem Cell Technologies | 17663 | |
| EasySep Human CD14 Positive Selection Cocktail | Stem Cell Technologies | 18058C | |
| Ethyl acetate | Fisher | EX0241-1 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube | VWR | 60819-295 | |
| Ficoll-Paque Plus | MilliporeSigma | GE17-1440-02 | |
| GC vials (2 mL) | Fisher | C-4011-1W | |
| GC vial inserts | Fisher | C-4011-631; C-4012-530 | |
| Glacial acetic acid | Fisher | AC14893-0010 | |
| Glass tubes (for hydrolysis) | Fisher | 14-959-35AA | |
| HEPES buffer | ThermoFisher | 15630080 | |
| Hyclone Water, molecular biology grade | Thomas Scientific | SH30538.02 | |
| MEM alpha | Fisher Scientific | 32561-037 | |
| PFBHA (o-(2, 3, 4, 5, 6)-penatfluorobenzylhydroxylamin hydrochloride) | MilliporeSigma | 194484 | |
| pH indicator strips | Fisher | 987618 | |
| Phosphatase acid | Calbiochem (VWR) | 80602-592 | |
| S1 nuclease (from Aspergillus oryzae) | MilliporeSigma | N5661 | |
| Sodium sulfate | MilliporeSigma | 23913 |
Ссылки
- Cypess, A. M. Reassessing human adipose tissue. The New England Journal of Medicine. 386 (8), 768-779 (2022).
- Cinti, S. The adipose organ at a glance. Disease Models & Mechanisms. 5 (5), 588-594 (2012).
- Sethi, J. K., Vidal-Puig, A. J. Thematic review series: Adipocyte biology. Adipose tissue function and plasticity orchestrate nutritional adaptation. Journal of Lipid Research. 48 (6), 1253-1262 (2007).
- White, U., Ravussin, E. Dynamics of adipose tissue turnover in human metabolic health and disease. Diabetologia. 62 (1), 17-23 (2019).
- Danforth, E. Failure of adipocyte differentiation causes type II diabetes mellitus. Nature Genetics. 26 (1), 13 (2000).
- Virtue, S., Vidal-Puig, A. Adipose tissue expandability, lipotoxicity and the metabolic syndrome--An allostatic perspective. Biochimica et Biophysica Acta. 1801 (3), 338-349 (2010).
- Arner, E., et al. Adipocyte turnover: relevance to human adipose tissue morphology. Diabetes. 59 (1), 105-109 (2010).
- Cinti, S., et al. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans. Journal of Lipid Research. 46 (11), 2347-2355 (2005).
- Busch, R., Neese, R. A., Awada, M., Hayes, G. M., Hellerstein, M. K. Measurement of cell proliferation by heavy water labeling. Nature Protocols. 2 (12), 3045-3057 (2007).
- Neese, R. A., et al. Measurement in vivo of proliferation rates of slow turnover cells by 2H2O labeling of the deoxyribose moiety of DNA. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15345-15350 (2002).
- Strawford, A., Antelo, F., Christiansen, M., Hellerstein, M. K. Adipose tissue triglyceride turnover, de novo lipogenesis, and cell proliferation in humans measured with 2H2O. American Journal of Physiology. Endocrinology and Metabolism. 286 (4), E577-E588 (2004).
- Macallan, D. C., et al. Measurement of cell proliferation by labeling of DNA with stable isotope-labeled glucose: Studies in vitro, in animals, and in humans. Proceedings of the National Academy of Sciences of the United States of America. 95 (2), 708-713 (1998).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Differences in in vivo cellular kinetics in abdominal and femoral subcutaneous adipose tissue in women. Diabetes. 65 (6), 1642-1647 (2016).
- Tchoukalova, Y. D., et al. In vivo adipogenesis in rats measured by cell kinetics in adipocytes and plastic-adherent stroma-vascular cells in response to high-fat diet and thiazolidinedione. Diabetes. 61 (1), 137-144 (2012).
- Jones, P. J., Leatherdale, S. T. Stable isotopes in clinical research: Safety reaffirmed. Clinical Science. 80 (4), 277-280 (1991).
- Bacchus-Souffan, C., et al. Relationship between CD4 T cell turnover, cellular differentiation and HIV persistence during ART. PLoS Pathogens. 17 (1), e1009214 (2021).
- Simonato, M., et al. Disaturated-phosphatidylcholine and surfactant protein-B turnover in human acute lung injury and in control patients. Respiratory Research. 12 (1), 36 (2011).
- Tremoy, G., et al. Measurements of water vapor isotope ratios with wavelength-scanned cavity ring-down spectroscopy technology: New insights and important caveats for deuterium excess measurements in tropical areas in comparison with isotope-ratio mass spectrometry. Rapid Communications in Mass Spectrometry. 25 (23), 3469-3480 (2011).
- dos Santos, T. H. R., Zucchi, M. D., Lemaire, T. J., de Azevedo, A. E. G., Viola, D. N. A statistical analysis of IRMS and CRDS methods in isotopic ratios of H-2/H-1 and O-18/O-16 in water. Sn Applied Sciences. 1, 664 (2019).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nature Protocols. 4 (1), 102-106 (2009).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Patterson, B. W., Zhao, G., Klein, S. Improved accuracy and precision of gas chromatography/mass spectrometry measurements for metabolic tracers. Metabolism. 47 (6), 706-712 (1998).
- Mazzarello, A. N., Fitch, M., Hellerstein, M. K., Chiorazzi, N. Measurement of leukemic B-cell growth kinetics in patients with chronic lymphocytic leukemia. Methods in Molecular Biology. 1881, 129-151 (2019).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: A technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263, E988-E1001 (1992).
- Spalding, K. L., et al. Dynamics of fat cell turnover in humans. Nature. 453 (7196), 783-787 (2008).
- Allerton, T. D., et al. Exercise reduced the formation of new adipocytes in the adipose tissue of mice in vivo. PLoS One. 16 (1), e0244804 (2021).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Association of in vivo adipose tissue cellular kinetics with markers of metabolic health in humans. The Journal of Clinical Endocrinology and Metabolism. 102 (7), 2171-2178 (2017).
- White, U., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Adipose depot-specific effects of 16 weeks of pioglitazone on in vivo adipogenesis in women with obesity: A randomised controlled trial. Diabetologia. 64 (1), 159-167 (2021).
- Steele, R. Influences of glucose loading and of injected insulin on hepatic glucose output. Annals of the New York Academy of Sciences. 82, 420-430 (1959).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены