Method Article
Medindo a cinética do tecido adiposo in vivo em humanos usando a abordagem de marcação de deutério (2H)
Neste Artigo
Resumo
Apresenta-se aqui um protocolo para medir a cinética do tecido adiposo in vivo em humanos usando o método de marcação com deutério (2H).
Resumo
O tecido adiposo branco é um órgão altamente plástico necessário para manter a homeostase energética de todo o corpo. A massa do tecido adiposo e as mudanças na massa ou distribuição de gordura são reguladas por mudanças na síntese e quebra (ou seja, renovação) de células adiposas e triacilgliceróis. As evidências sugerem que a maneira e a magnitude da expansão do tecido adiposo subcutâneo (ou seja, hipertrofia vs. hiperplasia) e a renovação podem influenciar a saúde metabólica, pois a adipogênese tem sido implicada na patogênese da obesidade e doenças relacionadas. Apesar do papel potencial do turnover adiposo na saúde humana, há uma falta de conhecimento sobre a cinética in vivo das células adiposas. Isso se deve, em parte, à lenta taxa de renovação das células no tecido adiposo e à complexidade prática de rotular diretamente seus precursores metabólicos in vivo. Aqui, descrevemos métodos para medir a cinética adiposa in vivo e as taxas de renovação em humanos por meio do consumo de água marcada com deutério (2H). A incorporação de 2H nas porções de desoxirribonucleotídeos do DNA em pré-adipócitos e adipócitos fornece uma medida precisa da formação e morte celular (renovação adiposa). No geral, esta é uma abordagem inovadora para medir a cinética adiposa in vivo e representa um afastamento substantivo de outras avaliações in vitro .
Introdução
A obesidade é uma doença caracterizada pelo excesso de tecido adiposo branco (TA) e é um fator de risco significativo para o desenvolvimento de diabetes tipo II e doença cardiovascular1. O TA branco é um órgão altamente plástico que armazena energia na forma de triacilgliceróis (TGs) e é essencial para a homeostase metabólica2. O TA branco retém a capacidade de expandir, reduzir e remodelar durante a idade adulta3, e a massa de TA é determinada por mudanças dinâmicas no volume dos adipócitos (via síntese e quebra de TG), formação contínua de adipócitos por meio da proliferação e diferenciação de pré-adipócitos (ou seja, hiperplasia ou adipogênese) e morte celular adiposa4.
As evidências sugerem que existe uma ligação importante entre a renovação subcutânea do TA (por exemplo, formação e morte de adipócitos) e a saúde cardiometabólica 5,6,7,8, e o papel da adipogênese na patogênese dos distúrbios relacionados à obesidade permanece discutível4. No entanto, pouco se sabe sobre a renovação in vivo do AT em humanos devido, em parte, à lenta taxa de renovação dos componentes celulares do AT e à complexidade de rotular diretamente seus precursores metabólicos in vivo. Embora os métodos in vitro tenham fornecido algumas informações, essas abordagens não fornecem uma avaliação abrangente in vivo dentro do ambiente natural do TA.
Um método foi desenvolvido pelo laboratório Hellerstein9 para avaliar in vivo o turnover do TA usando a incorporação do isótopo estável deutério (2H) da água pesada (2H2O) no TA (Figura 1)10. O protocolo, que foi validado em camundongos e humanos, inclui um aumento inicial de 2H2O para aumentar o enriquecimento de 2H da água corporal, seguido de ingestão diária adequada para manter valores de enriquecimento estáveis e próximos ao platô. O 2H do 2H2O (ou seja, água pesada) é incorporado à porção desoxirribose (dR) de desoxirribonucleotídeos no DNA das células adiposas, e o enriquecimento isotópico é medido no DNA por espectrometria de massa e aplicação de análise de distribuição de isotômeros de massa (MIDA) 9 , 10 , 11. A marcação da porção desoxirribose de desoxirribonucleotídeos de purina no DNA com precursores de isótopos estáveis tem várias vantagens em relação aos métodos anteriores, como aqueles que envolviam a marcação com porções de base de nucleotídeos de pirimidina (por exemplo, de 3H-timidina ou bromo-desoxiuridina). É importante notar que a reincorporação endógena de bases, especialmente para pirimidinas, mas não dR, no DNA replicante confundiu anteriormente a interpretação da incorporação do rótulo12. Além disso, a incorporação de um marcador de isótopo estável em dR não causa genotoxicidade, em contraste com a incorporação de agentes radioativos ou genotóxicos, como 3H (trítio) ou bromo-desoxiuridina. Portanto, o uso a longo prazo dessa técnica em modelos animais e humanos é seguro.
A medição da síntese de DNA marcado com 2H denota a passagem de uma célula pela fase S da divisão celular e identifica pré-adipócitos e adipócitos recém-formados (via diferenciação pré-adipócitos) ou adipogênese13. As células que sofrem renovação rápida (por exemplo, monócitos) substituem seu DNA rapidamente e atingem um platô no enriquecimento de 2H, fornecendo assim uma referência interna para o ensaio. A razão entre o enriquecimento de 2H do DNA das células adiposas e o dos monócitos (células de referência) ou a medição de 2H2O do corpo integrado permite o cálculo da fração de células adiposas recém-sintetizadas. Aqui, este protocolo descreve métodos para medir as taxas de renovação de células adiposas in vivo (adipogênese) em humanos por meio do protocolo de marcação metabólica 2H, incluindo técnicas refinadas para purificar os adipócitos por meio de seleção imunológica negativa e enriquecer a população de pré-adipócitos14.
Protocolo
O Conselho de Revisão Institucional (IRB) do Pennington Biomedical Research Center aprovou todos os procedimentos (# 10039-PBRC) e todos os seres humanos deram consentimento informado por escrito.
1. Período de rotulagem de oito semanas 2H2O
- Administre alíquotas de água marcada com deutério a 70% ou 99,9% (2H2O) em recipientes plásticos estéreis.
- Instrua os participantes a beber doses de 35 mL de 2H2O enriquecido a 99,9% ou doses de 40 mL de 2H2O enriquecido a 70% três vezes ao dia na semana 1 (período de preparação) e a beber duas doses de 35 mL ou 50 mL, respectivamente, por dia nas semanas 2-8.
NOTA: Tontura ou vertigem transitória são os únicos efeitos adversos conhecidos da ingestão de 2H2O e estão relacionados a mudanças rápidas no fluxo de água em massa, que são percebidas pelos folículos pilosos do ouvido interno. Portanto, instrua os participantes a tomar as doses com pelo menos ~ 2 h de intervalo para evitar a rara ocorrência de tontura ou vertigem transitória15. Pelo mesmo motivo, não compense as doses esquecidas dobrando uma única dose. A administração da dose descrita acima (separada por ≥2 h) torna este efeito adverso extremamente raro em seres humanos (<1% de várias centenas de indivíduos). - Monitore a adesão à ingestão de 2H2O por meio de coletas de urina para medir o enriquecimento de 2H na água corporal e também pelo retorno semanal dos frascos vazios para contagem.
- Limpe as amostras de urina usando carvão ativado e um filtro.
- Adicione 8 mL de urina a um tubo de 10 mL com 1 mL de carvão ativado.
- Coloque a amostra em um balancim por 10 min e centrifugue por 5 min a 800 x g para que o carvão se mova para o fundo do tubo. Filtrar a amostra com um filtro de seringa de 0,2 μm.
- Meça o enriquecimento de 2H2O na água corporal (urina) por espectrometria de massa de razão isotópica (IRMS).
NOTA: O enriquecimento de 2H2O pode ser analisado por diferentes métodos, incluindo cromatografia gasosa-espectrometria de massa16, analisador elementar de conversão de alta temperatura (TC / EA) acoplado ao IRMS17, espectroscopia de infravermelho de anel de cavidade (IRIS) 18 ou com um H / Dispositivo conectado a um espectrômetro de massa (por exemplo, IRMS) 19 . - Use os enriquecimentos médios de 2H2O medidos na urina durante o período de marcação de 8 semanas para calcular a exposição do precursor 2H2O e a fração de células AT recém-sintetizadas (consulte a seção 7 e a seção 8 abaixo).
- Limpe as amostras de urina usando carvão ativado e um filtro.
NOTA : O protocolode marcação 2 H2O mantém o enriquecimento próximo ao platô de 2H na água corporal dentro da faixa de 1,0% a 2,5% durante o período de rotulagem de 8 semanas (Figura 2)10.
2. Coletas de biópsia de tecido adiposo de seres humanos
- Após a limpeza da pele com solução de iodopovidona, administre anestesia tópica (por exemplo, lidocaína a 2%/bupivacaína a 0,5%), faça uma incisão de ~0,75 cm na pele e colete biópsias subcutâneas de TA por meio da técnica de lipoaspiração com agulha em condições estéreis13.
- Pese um tubo estéril de 50 mL contendo 5 mL de tampão HEPES 1 M à temperatura ambiente (RT), pH 7,3. Coloque imediatamente o AT no tubo com o tampão HEPES para processamento.
- Pese o tubo de 50 mL contendo o AT e registre o peso.
3. Isolamento de adipócitos purificados
- Adicione uma solução de colagenase tipo 1 / HEPES (2 mg / mL) a 2 g / mL AT.
- Digerir o TA incubando em banho-maria com agitação (100 rpm) durante 1 h a 37 °C até obter uma mistura homogénea com alguns pedaços grandes e intactos de AT.
- Centrifugue o tubo a 500 x g por 8 min em RT para separar os adipócitos e a fração estromal-vascular (SVF).
- Remova suavemente a camada superior de gordura (adipócitos) e transfira-a para um tubo separado. Não interrompa o pellet (SVF) no fundo do tubo.
- Como descrito anteriormente14, purifique os adipócitos usando a separação celular imunomagnética.
NOTA: Esta etapa importante é feita para "limpar" os adipócitos, pois outros tipos de células com rápida renovação celular, incluindo hematopoiéticas, endoteliais e células-tronco, podem aderir aos adipócitos flutuantes e impactar as medições.- Coloque ~ 400 μL de adipócitos em um tubo de 5 mL para imunopurificação negativa.
- Adicione o anticorpo bloqueador FcR (100 μL / mL).
- Adicione um coquetel de anticorpos biotinilados contra marcadores de células endoteliais (anti-CD31 humano; 1:100), células hematopoiéticas (anti-CD45 humano; 1:400) e células-tronco mesenquimais (anti-CD34 humano; 1:100) à solução de adipócitos por 15 min em RT.
- Adicione um coquetel de seleção de biotina (100 μL / mL) à solução de adipócitos, misture bem e incube por 15 min em RT com inclinação / rotação suave.
- Misture as nanopartículas magnéticas pipetando para cima e para baixo, adicione as partículas (50 μL / mL) à solução de adipócitos, misture bem e incube por 10 min em RT com rotação suave (10 rpm).
- Adicione PBS / 2% FBS / 1 mM EDTA tampão à solução de adipócito para um volume total de 1 mL.
- Coloque o tubo no ímã e deixe descansar por 5 min.
- Pegue o ímã e, em um movimento contínuo, inverta o ímã que contém o tubo e despeje o conteúdo em um novo tubo de 5 mL. Não bata no tubo durante o despejo. As células ligadas aos anticorpos são ligadas pelas nanopartículas magnéticas e removidas, enquanto os adipócitos imunopurificados são retidos.
- Congele rapidamente os adipócitos purificados em N2 líquido e armazene-os a -80 ° C até a extração do DNA.
4. Isolamento de pré-adipócitos
- Para isolar uma população enriquecida de pré-adipócitos, empregue um protocolo para explorar sua capacidade de se ligar ao plástico após uma cultura de curto prazo do SVF20.
- Em uma capela de fluxo laminar, ressuspenda o pellet SVF em 5 mL de tampão de lise eritrocitária por 5-10 min em RT (misture bem) e centrifugue a 800 x g. Remova o sobrenadante e ressuspenda o pellet em 10% FBS em alfa (α) MEM.
- Coloque as células em uma placa de cultura de plástico por ~ 8-12 h em uma incubadora de cultura de tecidos a 37 ° C e com uma atmosfera de 5% de CO2 .
- Após ~8-12 h, lave suavemente as células não aderentes da placa de cultura com PBS dentro de uma capela de fluxo laminar.
- Após aspirar o PBS, adicione 1-1,5 mL de tripsina a 0,25% / 1 mM de EDTA à placa de cultura para separar as células aderentes (população enriquecida de pré-adipócitos). Coloque a placa de cultura na incubadora a 37 °C por ~5-8 min para ajudar a levantar as células.
- Adicione 10% de FBS / αMEM à placa e lave bem a placa para coletar todas as células da placa. Transfira a solução celular para um tubo de 15 ml ou 50 ml e centrifugue a 800 x g durante 8 min.
- Remova o sobrenadante e armazene o pellet (pré-adipócitos) a -80 ° C até a extração do DNA.
5. Isolamento de monócitos sanguíneos
NOTA: Os monócitos são analisados para representar uma população celular (quase) completamente virada, e a medição do enriquecimento de 2H nos monócitos pode ser usada como um marcador de referência de exposição a 2H2Oem cada indivíduo. Alternativamente, o enriquecimento corporal de 2H2O pode ser medido e usado para calcular a exposição de 2H2O.
- Retire sangue total fresco de seres humanos em tubos vacutainer contendo EDTA.
- Centrifugue o sangue a 1.000-2.000 x g por 15 min a 4 ° C.
NOTA: Não use o freio. - Remova a camada superior de plasma. Tenha cuidado para não tocar na camada branca logo abaixo do plasma.
- Aspire o revestimento branco com uma pipeta de transferência e transfira-o para um tubo de 50 ml. Adicione ~ 10 mL de PBS ao casaco buffy.
- Adicione suavemente 10 mL de um meio gradiente de densidade para colocar a camada buffy.
NOTA: Certifique-se de que a ponta da pipeta toque o fundo do tubo e ejete com cuidado para que haja uma camada clara de meio gradiente de densidade na parte inferior. Evite introduzir bolhas. - Centrifugue o tubo a 800 x g por 30 min com o freio desligado.
- Pipetar (~10 mL) a camada branca (fração mononuclear), fazendo movimentos circulares com a ponta da pipeta de transferência próxima à borda, mas sem tocar a camada superior. Transfira para um novo tubo de 50 mL e adicione 10 mL de PBS. Centrifugue a 800 x g durante 5 min (não utilize o travão) e elimine o sobrenadante.
- Adicione 5 mL de tampão de lise eritrocitária ao pellet. Misture e deixe descansar por 2 min em RT.
- Adicione 5 mL de PBS com BSA a 0,1% à solução tampão de lise eritrocitária/pellet, centrifugue a 800 x g por 5 min e descarte o sobrenadante.
- Isole os monócitos como células CD14 + usando esferas imunomagnéticas. Realizar o isolamento das células CD14+ seguindo o protocolo do fabricante.
- Armazene os monócitos isolados a -80 ° C até a extração do DNA.
6. Preparação de DNA (isolamento, hidrólise e derivatização)
- Isole o DNA dos pré-adipócitos, adipócitos e monócitos do sangue usando um kit de extração de DNA seguindo as instruções do fabricante.
- Para liberar os desoxirribonucleosídeos, hidrolisar enzimaticamente o DNA (~ 200 μL) durante a noite (não mais que 24 h) a 37 ° C em 50 μL de coquetel de hidrólise enzimática contendo 1 mL de nuclease S1, 1 mL de enzima fosfatase e 36,8 mL de tampão de hidrólise 5x em tubos de vidro com tampa de rosca de 16 mm x 100 mm (10 mL). Além disso, inclua as seguintes amostras: um branco de água, um branco de coquetel de hidrólise, um branco de coluna do kit de extração de DNA e 500 ng de padrões de DNA.
- Para preparar o tampão de hidrólise 5x, coloque 94 mL de água pura de grau de biologia molecular em um béquer estéril. Pese 3,08 g de acetato de sódio e 21,5 mg de sulfato de zinco, adicione água e misture até dissolver. Ajuste o pH para 5,0 com ácido acético glacial e teste usando papel de pH. Adicione água até atingir um volume total de 100 mL.
- Para preparar a enzima fosfatase, ressuspenda um frasco de fosfatase ácida em 1 mL de água pura.
- Para preparar a enzima nuclease S1 0,5 U / μL, dilua 2,5 μL de nuclease S1 em 2 mL de tampão de hidrólise 1x (adicione 1 mL de tampão de hidrólise 5x a 4 mL de água pura).
- Derivatizar os hidrolisados em derivados de pentafluorobenzilhidroxilamina (PFBHA). Especificamente, adicione o seguinte diretamente às amostras de DNA digeridas, incluindo os padrões e brancos, em tubos de tampa de rosca de 16 mm x 100 mm (10 mL): 100 μL de cloridrato de pentafluorobenzil hidroxilamina (PFBHA; 1 mg / mL) e 75 μL de ácido acético glacial. Vortex (brevemente), tampe os frascos e coloque as amostras de hidrolisado em um bloco de aquecimento regulado a 100 ° C por 30 min.
- Remova as amostras e deixe-as esfriar por ~ 5 min até RT. Após o resfriamento, adicione 2 mL de anidrido acético e 100 μL de 1-metilimidazol a cada tubo sob uma capela de exaustão. Coloque os tubos em um bloco de calor de 100 °C por 5 min.
- Remova as amostras e deixe-as esfriar por ~ 15-20 min. Depois de esfriar, adicione 3 mL de água de grau de biologia molecular a cada amostra, vortex brevemente e deixe descansar por 10 min.
- Adicione 2 mL de diclorometano (DCM) aos tubos e vortex as amostras vigorosamente por 15 s para extrair o derivado para a fase orgânica.
- Centrifugue a 800 x g por 5 min para separar as fases. Transfira cuidadosamente a camada inferior de diclorometano para um frasco de GC limpo de 1,6 mL.
NOTA: Não transfira nenhuma fase aquosa, pois isso aumentará o fundo. - Evaporar até a secura com nitrogênio por ~ 20 min para remover o DCM e o ácido acético residual, seguido por ~ 10 min de secagem em vácuo rápido em RT para remover todos os vestígios dos reagentes.
7. Análise de cromatografia gasosa acoplada ao DNA (GC-MS)
- Depois de secos, ressuspenda os derivados PFBHA em 150 μL de acetato de etila e tampa. Em seguida, analise a incorporação de 2H no DNA em um instrumento de cromatografia gasosa (GC) / espectrometria de massa (MS) equipado com uma coluna DB-225 usando ionização química negativa de metano e coletando os íons no modo de monitoramento seletivo de íons em m / z 435, m / z 436 e m / z 437 (representando os isótopômeros de massa M0, M1 e M2 , respectivamente). Siga as instruções do fabricante para o instrumento usado.
- Defina as condições de GC da seguinte forma: coluna: revestimento de filme de 30 m x 0,25 mm de diâmetro interno x 0,25 μm; cromatógrafo: gás portador de hélio a 1,0 mL/min de fluxo constante; injeções pulsadas sem divisão; temperatura do injetor: 250 °C; Linha de transferência MS: 325 °C; condições do forno: temperatura inicial de 100 °C, segure 2 min, rampa a 40 °C/min a uma temperatura de 220 °C, segure 7.5 min, segunda rampa a 40 °C/min a 320 °C, segure por 1 min. O tempo total de execução é de 16,0 min. Os tempos típicos de eluição de dR são 10,5 min e 10,8 min para o primeiro e segundo picos, respectivamente.
- Defina as condições de MS da seguinte forma: fonte de ionização química negativa de metano com detecção no modo de monitoramento de íons únicos; íons coletados para dR: m / z 435, m / z 436 e m / z 437 (representando os isotômeros de massa M0, M1 e M2 , respectivamente).
NOTA: Siliconize o revestimento de vidro aberto com um pequeno tampão de lã de vidro siliconizada na parte inferior do revestimento. Troque este forro frequentemente (a cada ~ 100 injeções).
- Calcular as razões M1 da abundância de isótopómeros mássicos na derivada dR não enriquecida (abundância natural) do seguinte modo:
Razão M1 = abundância M1/(soma das abundâncias M0, M1 e M2)
Em seguida, subtraia as razões M1 de abundância natural das razões M1 no dR das amostras marcadas para calcular os enriquecimentos (abundância de isótopos em excesso ou %EM1)21. - Meça as abundâncias de isotômeros de massa dos padrões de DNA de linha de base (não enriquecidos) simultaneamente em uma faixa de abundâncias de íons M0 que abrangem a faixa de abundâncias de íons M0 nas amostras analisadas.
NOTA: Esta etapa é essencial para corrigir a "sensibilidade à abundância" das proporções de isótopos medidas por GC / MS22. - Construa um gráfico da abundância de íons M0 medida versus as razões M1 do isótopo de massa medido nos padrões não rotulados para determinar a concentração da amostra na coluna que é mais precisa para o isótopo de massa M1 (ou seja, onde está mais próximo da razão M1 de abundância natural calculada conhecida, ou o "ponto ideal"). A razão M1 para esta derivada dR não enriquecida é 0,1669.
- Injetar as amostras experimentais de modo a que fiquem o mais próximo possível da zona do pico M0 deste "sweet spot". Use uma regressão quadrática da razão M1 dos padrões não enriquecidos versus a área do pico M0 para estimar uma razão M1 de "abundância natural ajustada" para cada amostra em sua concentração M0 específica. Subtraia isso da proporção M1 da amostra de células adiposas para produzir o enriquecimento percentual acima da abundância natural, ou %EM1 (Figura 3)23.
- Calcule o enriquecimento máximo teórico de M1 (EM1*) nas células adiposas usando as equações de análise de distribuição de massa isotômera (MIDA)24 com base na exposição corporal 2H2O (medida na urina) integrada durante o período de 8 semanas (Figura 4) ou nos enriquecimentos de monócitos medidos interinamente (etapa 7.5).
8. Cálculo da fração de células recém-sintetizadas ou adipogênese in vivo
- Calcular a fração de células novas (%), que é uma medida da adipogénese in vivo ou da formação de pré-adipócitos ou adipócitos recém-sintetizados, utilizando a seguinte fórmula:
Fração de células novas (%) = [(enriquecimento de M1 nas células [adiposas] da amostra)/EM1* (enriquecimento máximo teórico de M1 )] x 100
NOTA: *O enriquecimento de 2H em monócitos também pode ser usado como denominador da equação. Esta medição em monócitos representa um marcador celular de referência da exposição a 2H2O em cada indivíduo e pode ser utilizada para confirmar os cálculos do enriquecimento máximo teórico de M1a partir dos valores medidos de 2H2O no organismo.
Resultados
O protocolo de rotulagem 2H2O (seção 1) mantém o enriquecimento próximo ao platô de 2H na água corporal dentro da faixa de 1,0% a 2,5% durante o período de rotulagem de 8 semanas10, conforme mostrado na Figura 2. Um estudo anterior utilizou o protocolo de marcação 2H2O para avaliar a cinética adiposa por meio da incorporação de 2H no DNA das células adiposas, conforme detalhado nas seções 2-8, e relatou que a adipogênese in vivo (proliferação pré-adipócitos e formação de adipócitos) foi maior no subcutâneo femoral (scFEM) em relação ao depósito subcutâneo abdominal (scTAB) em mulheres com obesidade (Figura 5)13. Dados adicionais mostraram que as taxas de formação de pré-adipócitos e adipócitos nos depósitos subcutâneos de TA foram positivamente associadas ao percentual geral de gordura corporal (Figura 6)13. No geral, esses dados publicados confirmam que esse método fisiológico de marcação 2H é uma abordagem inovadora para avaliar a cinética de TA in vivo em indivíduos com distribuições adiposas e teores de gordura corporalvariados 13.
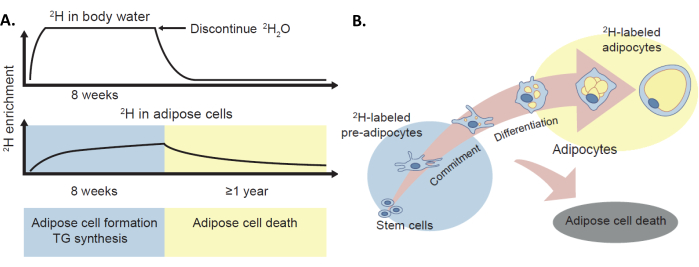
Figura 1: O protocolo de marcação 2 H para avaliar a renovação adiposa in vivo. (A) O método de marcação com deutério foi validado para fornecer estimativas in vivo da formação de células adiposas, síntese de TG e morte de adipócitos em humanos por meio da incorporação do isótopo estável 2H, administrado como 2H2O, na água corporal e no tecido adiposo. (B) O enriquecimento de 2H no tecido adiposo (pré-adipócitos e adipócitos) fornece uma medida da formação de células adiposas. É importante notar que este protocolo também pode fornecer uma medida da morte das células adiposas por meio da perda do marcador de 2H, embora este não seja o tópico principal deste manuscrito. Esta figura foi adaptada com permissão de White e Ravussin4. Clique aqui para ver uma versão maior desta figura.
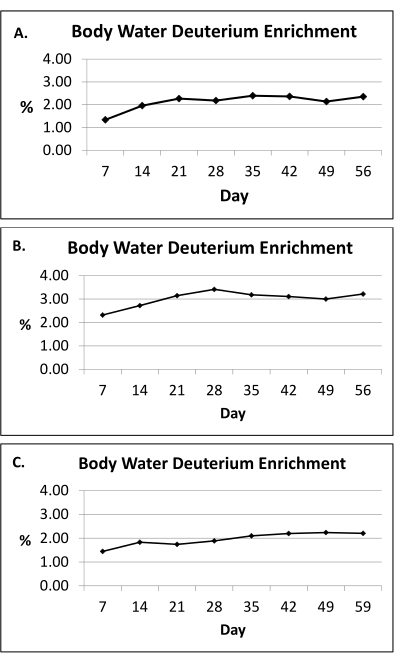
Figura 2: Enriquecimento de deutério na água corporal. (A-C) Apresentamos aqui medições representativas de enriquecimento de deutério na água corporal (urina) durante o protocolo de marcação de 8 semanas 2H2O em três seres humanos. Com base nas doses fornecidas (seção 1), o protocolo de rotulagem 2H2O mantém o enriquecimento próximo ao platô de 2H na água corporal na faixa de 1,0% a 2,5% (eixo y) durante o período de rotulagem de 8 semanas (eixo x). O enriquecimento médio da água corporal é calculado usando uma abordagem de área sob a curva para todo o período de exposição. Clique aqui para ver uma versão maior desta figura.
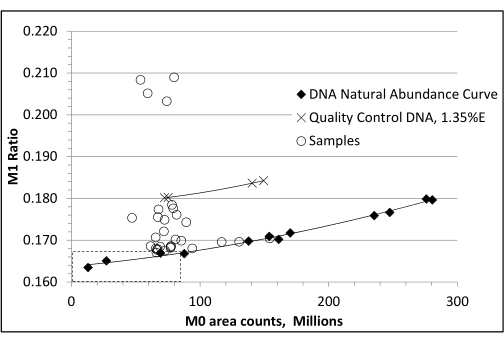
Figura 3: Curva de correção de abundância natural de DNA não marcado. A análise de DNA não marcado por espectrometria de massa resulta em uma abundância fracionária M1 de linha de base crescente, sugerindo falsamente enriquecimento crescente com o aumento da carga de amostra na coluna GC. Uma curva de abundância não rotulada é necessária para corrigir essa "sensibilidade à abundância" das proporções de isótopos. Isso é feito usando uma faixa de cargas padrão de DNA não rotuladas (áreas de pico M0) e subtraindo a abundância fracionária M1 medida (razão M1 = abundância M1 / abundância de M0, M1 e M2) que corresponde à área de pico M0 de uma amostra marcada. No exemplo mostrado, os dois pares de amostras de controle de qualidade enriquecidas a 1,35% só produzem resultados corretos após subtrair cada valor de abundância fracionária M1 apropriado obtido da curva não rotulada. A razão M1 calculada para a derivada dR é 0,1669. Nesta figura, o rácio M1 é atingido em 82 milhões de contagens de áreas de pico M0. Neste exemplo, uma razão M1 "ajustada" para dR não enriquecido pode ser calculada usando a seguinte regressão: y = 1,3024e−19x2 + 1,7010e−11x + 0,1650. Esta figura foi adaptada com permissão de Mazzarello et al.23 Clique aqui para ver uma versão maior desta figura.
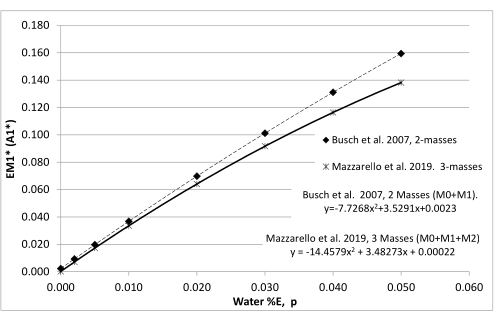
Figura 4: Relação entre o enriquecimento da água corporal (p) e o enriquecimento máximo de um tecido totalmente revolvido. São construídas tabelas de distribuição de massa de isotômeros, que calculam todos os isotômeros de dR em todos os enriquecimentos possíveis da água corporal (p). Estes são então usados para derivar a relação entre p e o enriquecimento máximo de M1 (EM1 *) de dR em DNA recém-replicado. Se o enriquecimento da água corporal for conhecido, o EM1* pode ser calculado e usado para calcular a síntese fracionada. Isso é útil quando um tecido de referência totalmente virado não está disponível. As regressões de Busch et al.9 e Mazzarello et al.23 produzem resultados de síntese fracionária comparáveis, desde que todas as medidas usem consistentemente duas ou três massas no cálculo das razões M1 e EM1*. Clique aqui para ver uma versão maior desta figura.

Figura 5: Taxas de formação mais altas de pré-adipócitos e adipócitos no depósito scFEM em relação ao depósito scABD. As médias dos mínimos quadrados comparando a fração de novos pré-adipócitos e adipócitos em diferentes depósitos foram derivadas do modelo linear misto (n = 25). A diferença na fração de novos pré-adipócitos entre os depósitos femoral subcutâneo (scFEM) e abdominal subcutâneo (scTUB) foi de 3,224 (p = 0,0354), enquanto a diferença na fração de adipócitos novos entre os depósitos scFEM e scABD foi de 2,877 (p = 0,0005)13. A população do estudo incluiu 25 mulheres de ascendência afro-americana (n = 14) e caucasiana (n = 11), com idade média de 31 anos ± 6 anos, IMC médio de 32,6 kg/m2 ± 2,7 kg/m2 e 44,3% ± 4,1% de gordura corporal. Essa figura foi adaptada com permissão de White et al.13. Clique aqui para ver uma versão maior desta figura.

Figura 6: Correlação positiva entre a formação de pré-adipócitos e adipócitos nos depósitos de scABD e scFEM (C,D) e o percentual geral de gordura corporal. Associações simples entre a fração de novos pré-adipócitos ou adipócitos e o percentual de gordura corporal foram analisadas por meio da correlação de Spearman (n = 25). (A, B) A correlação de Spearman entre a fração de novos pré-adipócitos (abdômen subcutâneo; scABD) e o percentual de gordura corporal foi de 0,4263 (R2 = 0,2472; p = 0,019), e a correlação de Spearman entre a fração de adipócitos novos (scABD) e o percentual de gordura corporal foi de 0,3291 (R2 = 0,2346; p = 0,026). (C, D) A correlação de Spearman entre a fração de novos pré-adipócitos (fedor subcutâneo; scFEM) e o percentual de gordura corporal foi de 0,2761 (R2 = 0,1123; p = 0,092), e a correlação de Spearman entre a fração de novos adipócitos (scFEM) e o percentual de gordura corporal foi de 0,5358 (R2 = 0,2116; p = 0,056)13. A população do estudo incluiu 25 mulheres de ascendência afro-americana (n = 14) e caucasiana (n = 11), com idade média de 31 anos ± 6 anos, IMC médio de 32,6 kg/m2 ± 2,7 kg / m2 e 44,3% ± 4,1% de gordura corporal. Essa figura foi adaptada com permissão de White et al.13. Clique aqui para ver uma versão maior desta figura.
Discussão
Avaliações in vivo são necessárias para fornecer novos conhecimentos sobre a dinâmica da renovação do TA branco e seu papel na obesidade e doenças metabólicas relacionadas, já que as avaliações in vitro não abrangem o ambiente natural do TA. Embora o uso de datação retrospectiva por radiocarbono para avaliar a dinâmica adiposa tenha sido informativo 7,25, essa abordagem não é adequada para capturar mudanças dinâmicas durante estudos de intervenção prospectivos. O método de marcação 2H foi validado para fornecer medidas fisiológicas de formação e renovação de células adiposas in vivo em humanos e representa um afastamento substantivo de outras avaliações. Nos últimos anos, essa abordagem tem sido aplicada para avaliar e descobrir novas cinéticas adiposas em roedores26 e humanos 13,27,28.
Notavelmente, com este método, técnicas adicionais de processamento de AT foram implementadas para purificar os adipócitos recém-isolados e remover a contaminação de outros tipos de células que podem aderir aos adipócitos flutuantes e impactar as medições. Como relatado anteriormente, essas etapas resultaram em uma melhora favorável na precisão das medidas de adipogênese in vivo , especificamente a medição de adipócitos recém-formados14. Outra etapa adicional neste método foi realizar uma cultura de curto prazo de células SVF para permitir a ligação eficiente e preferencial de células progenitoras de adipócitos. Descobriu-se que essa etapa de cultura enriquece a população de pré-adipócitos, resultando em medidas mais precisas de proliferação in vivo 14. A pureza das células de interesse é uma consideração importante neste método, especialmente ao analisar tecidos que compreendem vários tipos de células.
Embora a morte de adipócitos seja um componente significativo do turnover de TA8, uma avaliação da morte celular não foi incluída no protocolo e, portanto, a morte de adipócitos não foi medida ou discutida nesta análise. No entanto, a taxa de síntese fracionada (FSR), ou a fração de células recém-formadas presentes no TA ao longo das 8 semanas, foi relatada aqui. A taxa de síntese absoluta (ASR) é calculada da seguinte forma: FSR × tamanho do pool. O tamanho do pool de LA pode ser estimado com mais rigor a partir do número de adipócitos no tecido, que pode ser determinado experimentalmente pelo peso do TA corrigido para o tamanho médio dos adipócitos. Alternativamente, uma estimativa do tamanho do adipócito com base nos valores publicados pode ser usada quando apropriado. É importante notar que quando o tamanho do pool de TA está em um estado estacionário ou quase estacionário, que é o estado usual mesmo em condições como obesidade (onde a mudança na massa total de TA corporal ao longo de 8 semanas é tipicamente muito pequena em relação à massa AT de todo o corpo), o FSR é igual à taxa de degradação fracionada (FDR) ou taxa de mortalidade, que revela diretamente a meia-vida das células: T1/2 = ln 2 / FDR = 0,693 / FDR9. Portanto, supondo que a massa de TA esteja em um estado relativamente estável durante o período de marcação de 8 semanas 2H2O, a formação de novas células adiposas é provavelmente semelhante à fração de mortes de células adiposas, o que fornece uma medida da renovação ou substituição de células adiposas27. Quando há uma mudança no tamanho do pool durante o período de rotulagem (condições de estado não estacionário), uma correção de estado não estacionário, como a equação de Steele29, pode ser usada, o que requer medir ou estimar a mudança no tamanho do pool durante o período de rotulagem. É importante notar que a síntese fracionária "f" ainda é uma medida válida em um estado não estacionário, pois o valor de "f" representa a fração de células recém-divididas que estão presentes. No entanto, a conversão de "f" em uma constante de taxa (FSR ou FDR) exigiria uma correção de estado não estacionário, como a equação de Steele. Um ponto forte do protocolode marcação 2 H2O é que ele pode ser aplicado para medir quantitativamente a morte das células adiposas, pois as perdas no enriquecimento total de 2H no pool de tecido adiposo após a interrupção do consumo de 2H2O ocorrem apenas por morte celular9.
Embora a necessidade de isolar e purificar as células de interesse possa ser vista como uma limitação do protocolo, algumas das muitas vantagens incluem a facilidade de administração de 2H2O, a adequação dessa abordagem para condições de vida livre, a segurança da abordagem e o fato de fornecer uma avaliação integrativa dentro do ambiente natural do AT, que não é capturado usando abordagens in vitro . É importante ressaltar que o protocolo 2H2O é uma abordagem prática que pode ser aplicada para avaliar a cinética in vivo em vários outros tipos de células, tecidos e estados de doença9.
Uma parte crítica do projeto experimental é a dose e o momento da administração de 2H2O9. O protocolo apresentado emprega um período de rotulagem de 8 semanas que envolve o consumo três vezes ao dia de água pesada durante a semana 1 (por exemplo, o período de preparação para se aproximar do platô de enriquecimento de 2H2O na água corporal), seguido pelo consumo duas vezes ao dia nas semanas restantes de 2 a 8 para manter níveis de enriquecimento de água corporal relativamente constantes. A dosagem e administração adequadas são importantes para fornecer ao corpo medições de enriquecimento de 2H2O, que são necessárias para avaliar a conformidade com o protocolo (seção 1 do protocolo) e para calcular a fração de células recém-formadas (seção 8 do protocolo). É importante notar que o período de marcação de 8 semanas mostrou-se suficiente e apropriado para medir a cinética do TA, apesar da lenta renovação desse tecido11,25. Portanto, um benefício dessa abordagem é que 2H2O é seguro e adequado para consumo por um período de semanas ou meses, e a dose e o momento da administração de 2H2O podem ser modificados com base na célula ou tecido de interesse, questão científica e objetivo do estudo para garantir a incorporação adequada do rótulo 2H9.
Existem alguns pontos a serem considerados para realizar estudos de acompanhamento. A meia-vida de 2H na água corporal é de ~ 7-10 dias em humanos. Depois que um indivíduo interrompe a ingestão de 2H2O, a água corporal 2H atinge a linha de base após ~ 4-6 semanas (a diluição de 2H2O se encaixa em um modelo de decaimento exponencial) 9. Embora não seja um fator para células com renovação rápida (por exemplo, monócitos), a marcação residual de 2H de adipócitos após a cessação da ingestão de 2H2O é uma consideração importante ao planejar estudos de acompanhamento devido à lenta renovação dessas células. É importante notar que a morte do rótulo (por exemplo, morte de adipócitos) pode ser avaliada e fornecer informações úteis, pois a perda do marcador 2H nas células adiposas ocorre apenas se houver perda de células ou morte celular9. Antes de realizar estudos de acompanhamento, o enriquecimento de 2H nas células adiposas deve ser medido antes do início de um período de marcação de 2H para estabelecer uma medição de "linha de base" ao realizar estudos de acompanhamento.
As etapas que descrevem a preparação do DNA, a análise de GC-MS e o cálculo de células recém-formadas (seções de protocolo 6-8) foram descritas e relatadas em detalhes extensos em Busch et al.9. O enriquecimento de 2H em um tipo de célula de referência (quase) totalmente substituído pode ser usado na equação para calcular a fração de células recém-formadas de interesse (seção 8 do protocolo). Este valor de referência representa o teor máximo de 2H possível no DNA se a população de células de referência incluir essencialmente todas as células recém-divididas sob as mesmas condições de marcação de 2H2O. Portanto, nessas análises, a medição em monócitos (células quase totalmente substituídas) representa um marcador celular de referência de exposição a 2H2O, e isso foi usado para calcular a fração de células adiposas recém-sintetizadas. Na ausência de uma medida celular de referência, osenriquecimentos corporais 2H2O podem ser usados para estimar o enriquecimento 2 H correspondente a 100% das células substituídas (ou seja, o enriquecimento máximo teórico M1; Figura 2). É importante notar que o uso de medidas de 2H de monócitos, ou outras células de referência, tem uma vantagem sobre as medidas de água corporal, pois as primeiras medidas são responsáveis pela extensão do enriquecimento incompleto de 2H dos desoxirribonucleosídeos de 2H2O (devido à troca incompleta de 1H / 2H e / ou efeitos de isótopos cinéticos no nível dos precursores metabólicos). As medidas da célula de referência também servem para confirmar os cálculos usando o enriquecimento teórico máximo M1.
Este protocolo descreve os métodos para medir a cinética de AT in vivo e as taxas de renovação em humanos por meio do protocolo de marcação 2H2O. Os dados apresentados confirmam este método fisiológico como uma abordagem inovadora para avaliar a cinética do TA in vivo e a associação com resultados de saúde metabólica relacionados à obesidade27 em indivíduos com diferentes distribuições adiposas e conteúdo de gordura corporal13, bem como em resposta a intervenções, incluindo dieta, exercício ou tratamento farmacológico26,28.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Os autores agradecem ao Núcleo de Espectrometria de Massa do Pennington Biomedical Research Center.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-methylimidazole | MilliporeSigma | 336092 | |
| 2H2O | Sigma Aldrich | ||
| Acetic anhydride | Aldridge | 539996 | |
| ACK Lysing Buffer (erythrocyte lysis buffer) | Quality Biological Inc (VWR) | 10128-802 | |
| Agilent 6890/5973 GC/MS | Agilent | ||
| Anti-human CD31 (PECAM-1) Biotin | Invitrogen | 13-0319-82 | |
| Anti-human CD34 Biotin | Invitrogen | 13-0349-82 | |
| Anti-human CD45 | BioLegend | 304004 | |
| Antibiotic Antimycotic Solution | MilliporeSigma | A5955 | |
| Collagenase type 1 | Worthington Biochemical Corporation | LS004196 | |
| Deoxyribose (2-deoxy d-ribose) | MilliporeSigma | 31170 | |
| Deuterium Oxide | MilliporeSigma | 756822 | |
| DB-225 column (30m, 0.25mm, 0.25um) | J&W Scientific | 122-2232 | |
| Dichloromethane (DCM) | MilliporeSigma | 34856 | |
| DNA standard (calf thymus DNA) | MilliporeSigma | D4764 | |
| Dneasy Blood and Tissue Kit (DNA extraction kit) | Qiagen | 69504 | |
| Easy Sep Human Biotin kit | Stem Cell Technologies | 17663 | |
| EasySep Human CD14 Positive Selection Cocktail | Stem Cell Technologies | 18058C | |
| Ethyl acetate | Fisher | EX0241-1 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube | VWR | 60819-295 | |
| Ficoll-Paque Plus | MilliporeSigma | GE17-1440-02 | |
| GC vials (2 mL) | Fisher | C-4011-1W | |
| GC vial inserts | Fisher | C-4011-631; C-4012-530 | |
| Glacial acetic acid | Fisher | AC14893-0010 | |
| Glass tubes (for hydrolysis) | Fisher | 14-959-35AA | |
| HEPES buffer | ThermoFisher | 15630080 | |
| Hyclone Water, molecular biology grade | Thomas Scientific | SH30538.02 | |
| MEM alpha | Fisher Scientific | 32561-037 | |
| PFBHA (o-(2, 3, 4, 5, 6)-penatfluorobenzylhydroxylamin hydrochloride) | MilliporeSigma | 194484 | |
| pH indicator strips | Fisher | 987618 | |
| Phosphatase acid | Calbiochem (VWR) | 80602-592 | |
| S1 nuclease (from Aspergillus oryzae) | MilliporeSigma | N5661 | |
| Sodium sulfate | MilliporeSigma | 23913 |
Referências
- Cypess, A. M. Reassessing human adipose tissue. The New England Journal of Medicine. 386 (8), 768-779 (2022).
- Cinti, S. The adipose organ at a glance. Disease Models & Mechanisms. 5 (5), 588-594 (2012).
- Sethi, J. K., Vidal-Puig, A. J. Thematic review series: Adipocyte biology. Adipose tissue function and plasticity orchestrate nutritional adaptation. Journal of Lipid Research. 48 (6), 1253-1262 (2007).
- White, U., Ravussin, E. Dynamics of adipose tissue turnover in human metabolic health and disease. Diabetologia. 62 (1), 17-23 (2019).
- Danforth, E. Failure of adipocyte differentiation causes type II diabetes mellitus. Nature Genetics. 26 (1), 13 (2000).
- Virtue, S., Vidal-Puig, A. Adipose tissue expandability, lipotoxicity and the metabolic syndrome--An allostatic perspective. Biochimica et Biophysica Acta. 1801 (3), 338-349 (2010).
- Arner, E., et al. Adipocyte turnover: relevance to human adipose tissue morphology. Diabetes. 59 (1), 105-109 (2010).
- Cinti, S., et al. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans. Journal of Lipid Research. 46 (11), 2347-2355 (2005).
- Busch, R., Neese, R. A., Awada, M., Hayes, G. M., Hellerstein, M. K. Measurement of cell proliferation by heavy water labeling. Nature Protocols. 2 (12), 3045-3057 (2007).
- Neese, R. A., et al. Measurement in vivo of proliferation rates of slow turnover cells by 2H2O labeling of the deoxyribose moiety of DNA. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15345-15350 (2002).
- Strawford, A., Antelo, F., Christiansen, M., Hellerstein, M. K. Adipose tissue triglyceride turnover, de novo lipogenesis, and cell proliferation in humans measured with 2H2O. American Journal of Physiology. Endocrinology and Metabolism. 286 (4), E577-E588 (2004).
- Macallan, D. C., et al. Measurement of cell proliferation by labeling of DNA with stable isotope-labeled glucose: Studies in vitro, in animals, and in humans. Proceedings of the National Academy of Sciences of the United States of America. 95 (2), 708-713 (1998).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Differences in in vivo cellular kinetics in abdominal and femoral subcutaneous adipose tissue in women. Diabetes. 65 (6), 1642-1647 (2016).
- Tchoukalova, Y. D., et al. In vivo adipogenesis in rats measured by cell kinetics in adipocytes and plastic-adherent stroma-vascular cells in response to high-fat diet and thiazolidinedione. Diabetes. 61 (1), 137-144 (2012).
- Jones, P. J., Leatherdale, S. T. Stable isotopes in clinical research: Safety reaffirmed. Clinical Science. 80 (4), 277-280 (1991).
- Bacchus-Souffan, C., et al. Relationship between CD4 T cell turnover, cellular differentiation and HIV persistence during ART. PLoS Pathogens. 17 (1), e1009214 (2021).
- Simonato, M., et al. Disaturated-phosphatidylcholine and surfactant protein-B turnover in human acute lung injury and in control patients. Respiratory Research. 12 (1), 36 (2011).
- Tremoy, G., et al. Measurements of water vapor isotope ratios with wavelength-scanned cavity ring-down spectroscopy technology: New insights and important caveats for deuterium excess measurements in tropical areas in comparison with isotope-ratio mass spectrometry. Rapid Communications in Mass Spectrometry. 25 (23), 3469-3480 (2011).
- dos Santos, T. H. R., Zucchi, M. D., Lemaire, T. J., de Azevedo, A. E. G., Viola, D. N. A statistical analysis of IRMS and CRDS methods in isotopic ratios of H-2/H-1 and O-18/O-16 in water. Sn Applied Sciences. 1, 664 (2019).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nature Protocols. 4 (1), 102-106 (2009).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Patterson, B. W., Zhao, G., Klein, S. Improved accuracy and precision of gas chromatography/mass spectrometry measurements for metabolic tracers. Metabolism. 47 (6), 706-712 (1998).
- Mazzarello, A. N., Fitch, M., Hellerstein, M. K., Chiorazzi, N. Measurement of leukemic B-cell growth kinetics in patients with chronic lymphocytic leukemia. Methods in Molecular Biology. 1881, 129-151 (2019).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: A technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263, E988-E1001 (1992).
- Spalding, K. L., et al. Dynamics of fat cell turnover in humans. Nature. 453 (7196), 783-787 (2008).
- Allerton, T. D., et al. Exercise reduced the formation of new adipocytes in the adipose tissue of mice in vivo. PLoS One. 16 (1), e0244804 (2021).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Association of in vivo adipose tissue cellular kinetics with markers of metabolic health in humans. The Journal of Clinical Endocrinology and Metabolism. 102 (7), 2171-2178 (2017).
- White, U., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Adipose depot-specific effects of 16 weeks of pioglitazone on in vivo adipogenesis in women with obesity: A randomised controlled trial. Diabetologia. 64 (1), 159-167 (2021).
- Steele, R. Influences of glucose loading and of injected insulin on hepatic glucose output. Annals of the New York Academy of Sciences. 82, 420-430 (1959).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados