Method Article
Medición de la cinética del tejido adiposo in vivo en humanos mediante el enfoque de marcaje con deuterio (2h)
En este artículo
Resumen
Se presenta un protocolo para medir la cinética del tejido adiposo in vivo en humanos utilizando el método de marcaje con deuterio (2H).
Resumen
El tejido adiposo blanco es un órgano altamente plástico que es necesario para mantener la homeostasis energética de todo el cuerpo. La masa de tejido adiposo y los cambios en la masa o distribución de la grasa están regulados por cambios en la síntesis y descomposición (es decir, recambio) de las células adiposas y los triacilgliceroles. La evidencia sugiere que la forma y la magnitud de la expansión del tejido adiposo subcutáneo (es decir, hipertrofia frente a hiperplasia) y el recambio pueden influir en la salud metabólica, ya que la adipogénesis se ha implicado en la patogénesis de la obesidad y las enfermedades relacionadas. A pesar del papel potencial del recambio adiposo en la salud humana, existe una falta de conocimiento sobre la cinética in vivo de las células adiposas. Esto se debe, en parte, a la lenta tasa de renovación de las células en el tejido adiposo y a la complejidad práctica de etiquetar directamente sus precursores metabólicos in vivo. En este artículo, describimos métodos para medir la cinética adiposa in vivo y las tasas de recambio en humanos a través del consumo de agua marcada con deuterio (2H). La incorporación de 2H en los restos de desoxirribonucleótidos del ADN en preadipocitos y adipocitos proporciona una medida precisa de la formación y muerte celular (recambio adiposo). En general, se trata de un enfoque innovador para medir la cinética adiposa in vivo y representa un cambio sustancial con respecto a otras evaluaciones in vitro .
Introducción
La obesidad es una enfermedad caracterizada por un exceso de tejido adiposo blanco (TA) y es un factor de riesgo importante para el desarrollo de diabetes tipo II y enfermedad cardiovascular1. El AT blanco es un órgano altamente plástico que almacena energía en forma de triacilgliceroles (TG) y es esencial para la homeostasis metabólica2. La AT blanca conserva la capacidad de expandirse, reducirse y remodelarse durante la edad adulta3, y la masa de AT está determinada por cambios dinámicos en el volumen de los adipocitos (a través de la síntesis y descomposición de TG), la formación continua de adipocitos a través de la proliferación y diferenciación de preadipocitos (es decir, hiperplasia o adipogénesis) y la muerte de las células adiposas4.
La evidencia sugiere que existe un vínculo importante entre el recambio subcutáneo de TA (p. ej., formación y muerte de adipocitos) y la salud cardiometabólica 5,6,7,8, y el papel de la adipogénesis en la patogénesis de los trastornos relacionados con la obesidad sigue siendo discutible4. Sin embargo, se sabe poco sobre el recambio de TA in vivo en humanos debido, en parte, a la lenta tasa de recambio de los componentes celulares del TA y a la complejidad de etiquetar directamente sus precursores metabólicos in vivo. Si bien los métodos in vitro han proporcionado cierta información, estos enfoques no proporcionan una evaluación in vivo completa dentro del entorno natural de la TA.
El laboratorio Hellerstein9 desarrolló un método para evaluar in vivo el recambio de AT utilizando la incorporación del isótopo estable deuterio (2H) de agua pesada (2H2O) al AT (Figura 1)10. El protocolo, que ha sido validado en ratones y humanos, incluye un aumento inicial de 2H2O para aumentar el enriquecimiento de 2H del agua corporal, seguido de una ingesta diaria adecuada para mantener valores de enriquecimiento estables y cercanos a la meseta. Los 2H de los 2H2O (es decir, agua pesada) se incorporan a la fracción desoxirribosa (dR) de los desoxirribonucleótidos en el ADN de las células adiposas, y el enriquecimiento de isótopos se mide en el ADN mediante espectrometría de masas y la aplicación del análisis de distribución de isótopos de masas (MIDA)9,10,11. El marcaje de la fracción desoxirribosa de los desoxirribonucleótidos de purina en el ADN con precursores de isótopos estables tiene varias ventajas sobre los métodos anteriores, como los que implicaban el marcaje con restos de base de nucleótidos de pirimidina (por ejemplo, de 3H-timidina o bromo-desoxiuridina). Cabe destacar que la reincorporación endógena de bases, especialmente para pirimidinas, pero no para dR, en la replicación del ADN, confundió previamente la interpretación de la incorporación de la etiqueta12. Además, la incorporación de un marcador de isótopo estable en dR no causa genotoxicidad, a diferencia de la incorporación de agentes radiactivos o genotóxicos como el 3H (tritio) o el bromo-desoxiuridina. Por lo tanto, el uso a largo plazo de esta técnica en modelos animales y humanos es seguro.
La medición de la síntesis de ADN marcada con 2H denota el paso de una célula a través de la fase S de la división celular e identifica los pre-adipocitos recién formados y los adipocitos (a través de la diferenciación de pre-adipocitos) o la adipogénesis13. Las células que experimentan un recambio rápido (por ejemplo, los monocitos) reemplazan su ADN rápidamente y alcanzan una meseta en el enriquecimiento de 2H, proporcionando así una referencia interna para el ensayo. La relación entre el enriquecimiento de 2H del ADN de las células adiposas y el de los monocitos (células de referencia) o la medición integrada de 2H2O permite calcular la fracción de células adiposas recién sintetizadas. En este documento, este protocolo describe métodos para medir las tasas de recambio de células adiposas in vivo (adipogénesis) en humanos a través del protocolo de marcaje metabólico 2H, incluyendo técnicas refinadas para purificar los adipocitos a través de la selección inmune negativa y para enriquecer la población de pre-adipocitos14.
Protocolo
La Junta de Revisión Institucional (IRB, por sus siglas en inglés) del Centro de Investigación Biomédica Pennington aprobó todos los procedimientos (#10039-PBRC) y todos los sujetos humanos dieron su consentimiento informado por escrito.
1. Período de etiquetado O de ocho semanas 2H2
- Administre alícuotas de agua marcada con deuterio al 70% o al 99,9% (2H2O) en recipientes de plástico estériles.
- Indique a los participantes que beban dosis de 35 mL de 2H2O enriquecidas al 99,9% o dosis de 40 mL de 2H2O enriquecidas al 70% tres veces al día en la semana 1 (período de preparación) y que beban dos dosis de 35 mL o 50 mL, respectivamente, por día en las semanas 2-8.
NOTA: Los mareos transitorios o el vértigo son los únicos efectos adversos conocidos de la ingesta de 2H2Oy están relacionados con cambios rápidos en el flujo de agua a granel, que son percibidos por los folículos pilosos del oído interno. Por lo tanto, instruya a los participantes para que tomen las dosis con al menos ~ 2 h de diferencia para evitar la rara aparición de mareos transitorios o vértigo15. Por la misma razón, no compense las dosis olvidadas duplicando una sola dosis. La administración de la dosis descrita anteriormente (separada por ≥2 h) hace que este efecto adverso sea extremadamente raro en sujetos humanos (<1% de varios cientos de sujetos). - Controlar el cumplimiento de la ingesta de 2H2O a través de la recogida de orina para medir el enriquecimiento de 2H en el agua corporal y también mediante la devolución semanal de los viales vacíos para el recuento.
- Limpie las muestras de orina con carbón activado y un filtro.
- Agregue 8 mL de orina a un tubo de 10 mL con 1 mL de carbón activado.
- Coloque la muestra en un balancín durante 10 minutos y centrifugue durante 5 minutos a 800 x g para que el carbón se mueva al fondo del tubo. Filtre la muestra con un filtro de jeringa de 0,2 μm.
- Mida el enriquecimiento de 2H2O en el agua corporal (orina) mediante espectrometría de masas de relación isotópica (IRMS).
NOTA: El enriquecimiento de 2H2O se puede analizar mediante diferentes métodos, incluida la cromatografía de gases-espectrometría de masas16, el analizador elemental de conversión a alta temperatura (TC/EA) junto con IRMS17, la espectroscopia infrarroja de anillo de cavidad (IRIS)18 o con un dispositivo H conectado a un espectrómetro de masas (por ejemplo, IRMS)19. - Utilice la media de los enriquecimientos de 2H2O medidos en la orina durante el período de etiquetado de 8 semanas para calcular la exposición al precursor 2H2O y la fracción de células AT recién sintetizadas (ver sección 7 y sección 8 a continuación).
- Limpie las muestras de orina con carbón activado y un filtro.
NOTA: El protocolo de etiquetado de 2H2O mantiene un enriquecimiento de 2H cercano a la meseta en el agua corporal dentro del rango de 1.0%-2.5% durante el período de etiquetado de 8 semanas (Figura 2)10.
2. Colecciones de biopsias de tejido adiposo de sujetos humanos
- Después de limpiar la piel con una solución de povidona yodada, administrar anestesia tópica (p. ej., lidocaína al 2%/bupivacaína al 0,5%), hacer una incisión de ~0,75 cm en la piel y recoger biopsias subcutáneas de TA mediante la técnica de lipoaspiración con aguja en condiciones estériles13.
- Pesar un tubo estéril de 50 mL que contiene 5 mL de tampón HEPES 1 M a temperatura ambiente (RT), pH 7,3. Coloque inmediatamente el AT en el tubo con el tampón HEPES para su procesamiento.
- Pese el tubo de 50 ml que contiene el AT y registre el peso.
3. Aislamiento de adipocitos purificados
- Añadir una solución de colagenasa tipo 1/HEPES (2 mg/mL) a 2 g/mL de AT.
- Digiera el TA incubando en un baño de agua agitado (100 rpm) durante 1 h a 37 °C hasta que haya una mezcla homogénea con algunos trozos grandes e intactos de AT.
- Centrifugar el tubo a 500 x g durante 8 min a RT para separar los adipocitos y la fracción estromal-vascular (FSV).
- Retire suavemente la capa superior de grasa (adipocitos) y transfiérala a un tubo separado. No rompa el pellet (SVF) en la parte inferior del tubo.
- Como se ha descritoanteriormente 14, purificar los adipocitos mediante separación celular inmunomagnética.
NOTA: Este importante paso se realiza para "limpiar" los adipocitos, ya que otros tipos de células con un rápido recambio celular, incluidas las células hematopoyéticas, endoteliales y madre, pueden adherirse a los adipocitos flotantes y afectar las mediciones.- Coloque ~400 μL de adipocitos en un tubo de 5 mL para una inmunopurificación negativa.
- Añadir anticuerpo bloqueante FcR (100 μL/mL).
- Añadir un cóctel de anticuerpos biotinilados contra marcadores de células endoteliales (anti-CD31 humano; 1:100), células hematopoyéticas (anti-CD45 humano; 1:400) y células madre mesenquimales (anti-CD34 humano; 1:100) a la solución de adipocitos durante 15 min en RT.
- Añadir un cóctel de selección de biotina (100 μL/mL) a la solución de adipocitos, mezclar bien e incubar durante 15 min a RT con una inclinación/rotación suave.
- Mezclar las nanopartículas magnéticas pipeteando hacia arriba y hacia abajo, añadir las partículas (50 μL/mL) a la solución de adipocitos, mezclar bien e incubar durante 10 min a RT con una rotación suave (10 rpm).
- Agregue PBS/2% FBS/1 mM de tampón EDTA a la solución de adipocitos para un volumen total de 1 mL.
- Coloque el tubo en el imán y déjelo reposar durante 5 minutos.
- Levante el imán y, con un movimiento continuo, invierta el imán que contiene el tubo y vierta el contenido en un nuevo tubo de 5 ml. No golpee el tubo mientras vierte. Las células unidas a los anticuerpos se unen a las nanopartículas magnéticas y se eliminan, mientras que los adipocitos inmunopurificados se conservan.
- Congele rápidamente los adipocitos purificados en N2 líquido y guárdelos a -80 °C hasta la extracción del ADN.
4. Aislamiento de preadipocitos
- Para aislar una población enriquecida de preadipocitos, emplee un protocolo para explotar su capacidad de adherirse al plástico después de un cultivo a corto plazo de la SVF20.
- En una campana de flujo laminar, vuelva a suspender el pellet SVF en 5 mL de tampón de lisis eritrocitaria durante 5-10 min a RT (mezcle bien) y centrifugue a 800 x g. Retire el sobrenadante y vuelva a suspender el pellet en FBS al 10% en alfa (α)MEM.
- Coloque las células en una placa de cultivo de plástico durante ~8-12 h en una incubadora de cultivo de tejidos a 37 °C y con una atmósfera de 5% de CO2 .
- Después de ~ 8-12 h, lave suavemente las células no adherentes de la placa de cultivo con PBS dentro de una campana de flujo laminar.
- Después de aspirar el PBS, añadir 1-1,5 mL de tripsina al 0,25%/EDTA al 1 mM a la placa de cultivo para separar las células adherentes (población enriquecida de preadipocitos). Coloque la placa de cultivo en la incubadora a 37 °C durante ~5-8 min para ayudar a levantar las células.
- Agregue un 10% de FBS/αMEM a la placa y lave bien la placa para recoger todas las células de la placa. Transfiera la solución celular a un tubo de 15 mL o 50 mL y centrifugue a 800 x g durante 8 min.
- Retire el sobrenadante y almacene el pellet (preadipocitos) a -80 °C hasta la extracción del ADN.
5. Aislamiento de monocitos sanguíneos
NOTA: Los monocitos se analizan para representar una población celular (casi) completamente renovada, y la medición del enriquecimiento de 2H en los monocitos se puede utilizar como marcador de referencia de la exposición a 2H2O en cada individuo. Alternativamente, se puede medir el enriquecimiento corporal de 2H2O y utilizarlo para calcular la exposición a 2H2O.
- Extraiga sangre fresca y entera de sujetos humanos en tubos vacutainer que contengan EDTA.
- Centrifugar la sangre a 1.000-2.000 x g durante 15 min a 4 °C.
NOTA: No utilice el freno. - Retire la capa superior de plasma. Tenga cuidado de no tocar la capa blanca de leucocitismo justo debajo del plasma.
- Aspire la capa de leucuscolas blancas con una pipeta de transferencia y transfiérala a un tubo de 50 ml. Agregue ~ 10 ml de PBS al pelaje leucocitario.
- Agregue suavemente 10 ml de un medio de gradiente de densidad para cubrir la capa de leucocitario.
NOTA: Asegúrese de que la punta de la pipeta toque la parte inferior del tubo y expulse con cuidado para que haya una capa clara de medio de gradiente de densidad en la parte inferior. Evite introducir burbujas. - Centrifugar el tubo a 800 x g durante 30 min con el freno apagado.
- Pipetear (~10 mL) la capa blanca (fracción mononuclear), realizando movimientos circulares con la punta de la pipeta de transferencia cerca del borde pero sin tocar la capa superior. Transfiera a un nuevo tubo de 50 mL y agregue 10 mL de PBS. Centrifugar a 800 x g durante 5 min (no utilizar el freno) y desechar el sobrenadante.
- Añadir 5 mL de tampón de lisis globular al pellet. Mezcle y déjelo reposar durante 2 minutos a RT.
- Añadir 5 mL de PBS con BSA al 0,1% a la solución tampón/pellet de lisis eritrocitaria, centrifugar a 800 x g durante 5 min y desechar el sobrenadante.
- Aísle los monocitos como células CD14+ utilizando perlas inmunomagnéticas. Realice el aislamiento de las células CD14+ siguiendo el protocolo del fabricante.
- Almacene los monocitos aislados a -80 °C hasta la extracción del ADN.
6. Preparación del ADN (aislamiento, hidrólisis y derivatización)
- Aísle el ADN de los preadipocitos, adipocitos y monocitos sanguíneos utilizando un kit de extracción de ADN siguiendo las instrucciones del fabricante.
- Para liberar los desoxirribonucleósidos, hidrolice enzimáticamente el ADN (~200 μL) durante la noche (no más de 24 h) a 37 °C en 50 μL de cóctel de hidrólisis enzimática que contiene 1 mL de nucleasa S1, 1 mL de enzima fosfatasa y 36,8 mL de tampón de hidrólisis 5x en tubos de vidrio con tapón de rosca de 16 mm x 100 mm (10 mL). Además, incluya las siguientes muestras: un blanco de agua, un blanco de cóctel de hidrólisis, un blanco de columna del kit de extracción de ADN y 500 ng de patrones de ADN.
- Para preparar el tampón de hidrólisis 5x, coloque 94 ml de agua pura de grado de biología molecular en un vaso de precipitados estéril. Pesa 3,08 g de acetato de sodio y 21,5 mg de sulfato de zinc, agrega agua y mezcla hasta que se disuelva. Ajuste el pH a 5.0 con ácido acético glacial y pruebe con papel de pH. Agregue agua hasta alcanzar un volumen total de 100 mL.
- Para preparar la enzima fosfatasa, vuelva a suspender un vial de fosfatasa ácida en 1 ml de agua pura.
- Para preparar la enzima nucleasa S1 de 0,5 U/μL, diluya 2,5 μL de nucleasa S1 en 2 mL de tampón de hidrólisis 1x (agregue 1 mL de tampón de hidrólisis 5x a 4 mL de agua pura).
- Derivatizar los hidrolizados a derivados de pentafluorobencililhidroxilamina (PFBHA). En concreto, añada lo siguiente directamente a las muestras de ADN digeridas, incluidos los patrones y los blancos, en tubos con tapón de rosca de 16 mm x 100 mm (10 mL): 100 μL de clorhidrato de pentafluorobencil hidroxilamina (PFBHA; 1 mg/mL) y 75 μL de ácido acético glacial. Vórtice (brevemente), tape los viales y coloque las muestras de hidrolizado en un bloque calefactor ajustado a 100 °C durante 30 minutos.
- Retire las muestras y déjelas enfriar durante ~ 5 min a RT. Después de enfriar, agregue 2 mL de anhídrido acético y 100 μL de 1-metilimidazol a cada tubo debajo de una campana extractora. Coloque los tubos en un bloque de calor a 100 °C durante 5 minutos.
- Retire las muestras y luego déjelas enfriar durante ~ 15-20 min. Una vez que se enfríe, agregue 3 ml de agua de grado de biología molecular a cada muestra, vórtice brevemente, y déjelas reposar durante 10 minutos.
- Agregue 2 mL de diclorometano (DCM) a los tubos y agite las muestras vigorosamente durante 15 s para extraer el derivado en la fase orgánica.
- Centrifugar a 800 x g durante 5 min para separar las fases. Transfiera con cuidado la capa inferior de diclorometano a un vial limpio de GC de 1,6 mL.
NOTA: No transfiera nada de la fase acuosa, ya que esto aumentará el fondo. - Evaporar hasta la sequedad con nitrógeno durante ~20 min para eliminar el DCM y el ácido acético residual, seguido de un secado de ~10 min en un vacío de velocidad a RT para eliminar todos los rastros de los reactivos.
7. Cromatografía de gases-espectrometría de masas (GC-MS) análisis del ADN
- Una vez secos, resuspender los derivados de PFBHA en 150 μL de acetato de etilo y tapar. A continuación, analice la incorporación de 2H en el ADN en un instrumento de cromatografía de gases (GC)/espectrometría de masas (MS) equipado con una columna DB-225 que utiliza ionización química negativa de metano y recoge los iones en modo de monitorización selectiva de iones a m/z 435, m/z 436 y m/z 437 (que representan los isótopos de masa M0, M1 y M2 , respectivamente). Siga las instrucciones del fabricante para el instrumento utilizado.
- Establezca las condiciones de GC de la siguiente manera: columna: 30 m x 0,25 mm ID x 0,25 μm de recubrimiento de película; cromatógrafo: gas portador de helio a 1,0 mL/min de flujo constante; inyecciones pulsadas sin división; temperatura del inyector: 250 °C; Línea de transferencia MS: 325 °C; Condiciones del horno: temperatura inicial 100 °C, mantener 2 min, rampa a 40 °C/min a una temperatura de 220 °C, mantener 7,5 min, segunda rampa a 40 °C/min a 320 °C, mantener durante 1 min. El tiempo de ejecución total es de 16.0 min. Los tiempos típicos de elución de dR son de 10,5 min y 10,8 min para el primer y segundo pico, respectivamente.
- Establezca las condiciones de MS de la siguiente manera: fuente de ionización química negativa de metano con detección en modo de monitoreo de un solo ion; iones recolectados para dR: m/z 435, m/z 436 y m/z 437 (que representan isótopos de masa M0, M1 y M2 , respectivamente).
NOTA: Sisilicone el revestimiento de vidrio abierto con un pequeño tapón de lana de vidrio siliconada en la parte inferior del revestimiento. Cambie este revestimiento con frecuencia (cada ~ 100 inyecciones).
- Calcule las proporciones de abundancia de isótopos de masa M1 en la derivada dR no enriquecida (abundancia natural) de la siguiente manera:
Relación M1 = abundancia M1/(suma de las abundancias M0, M1 y M2)
Luego, reste las proporciones M1 de abundancia natural de las proporciones M1 en el dR de las muestras marcadas para calcular los enriquecimientos (abundancias de isótopos excesivos, o %EM1)21. - Mida las abundancias de isótopos de masa de los estándares de ADN de referencia (no enriquecidos) simultáneamente en un rango de abundancias de iones M0 que abarcan el rango de abundancias de iones M0 en las muestras analizadas.
NOTA: Este paso es esencial para corregir la "sensibilidad a la abundancia" de las proporciones de isótopos medidas por GC/MS22. - Construya un gráfico de la abundancia de iones M0 medida frente a las proporciones de isótopos de masa M1 medidos en los estándares sin etiquetar para determinar la concentración de muestra en columna que sea más precisa para el isótopo de masa M1 (es decir, donde está más cerca de la relación M1 de abundancia natural conocida y calculada, o el "punto óptimo"). La relación M1 para este derivado dR no enriquecido es 0,1669.
- Inyecte las muestras experimentales de modo que estén lo más cerca posible en el área del pico M0 de este "punto óptimo". Utilice una regresión cuadrática de la relación M1 de los patrones no enriquecidos frente al área máxima M0 para estimar una relación M1 de "abundancia natural ajustada" para cada muestra a su concentración M0 particular. Reste esto de la proporción M1 de la muestra de células adiposas para obtener el porcentaje de enriquecimiento por encima de la abundancia natural, o %EM1 (Figura 3)23.
- Calcule el enriquecimiento máximo teórico de M1 (EM1*) en las células adiposas utilizando las ecuaciones24 del análisis de distribución de isótopos de masa (MIDA) basadas en la exposición corporal a 2H2O (medida en la orina) integrada durante el período de 8 semanas (Figura 4) o los enriquecimientos de monocitos medidos provisionalmente (paso 7.5).
8. Cálculo de la fracción de células recién sintetizadas, o adipogénesis in vivo
- Calcular la fracción de células nuevas (%), que es una medida de la adipogénesis in vivo o de la formación de preadipocitos o adipocitos recién sintetizados, utilizando la siguiente fórmula:
Fracción de células nuevas (%) = [(enriquecimiento M1 en las células [adiposas] de la muestra)/EM1* (enriquecimiento M1 máximo teórico)] x 100
NOTA: *El enriquecimiento de 2H en monocitos también se puede utilizar como denominador de la ecuación. Esta medición en monocitos representa un marcador celular de referencia de la exposición a 2H2O en cada individuo, y puede utilizarse para confirmar los cálculos del enriquecimiento máximo teórico deM1a partir de los valores corporales medidos de 2H2O.
Resultados
El protocolode etiquetado 2 H2O (sección 1) mantiene un enriquecimiento de 2H cercano a la meseta en el agua corporal dentro del rango de 1,0%-2,5% durante la duración del período de etiquetado de 8 semanas10, como se muestra en la Figura 2. Un estudio previo utilizó el protocolo de marcaje 2H2O para evaluar la cinética adiposa a través de la incorporación de 2H en el ADN de las células adiposas, como se detalla en las secciones 2-8, e informó que la adipogénesis in vivo (tanto la proliferación de preadipocitos como la formación de adipocitos) fue mayor en el femoral subcutáneo (scFEM) en relación con el depósito abdominal subcutáneo (scABD) en mujeres con obesidad (Figura 5)13. Datos adicionales mostraron que las tasas de formación de preadipocitos y adipocitos en los depósitos subcutáneos de AT se asociaron positivamente con el porcentaje general de grasa corporal (Figura 6)13. En general, estos datos publicados confirman que este método fisiológico de marcaje 2H es un enfoque innovador para evaluar la cinética de AT in vivo en individuos con diferentes distribuciones adiposas y contenidos de grasa corporal13.
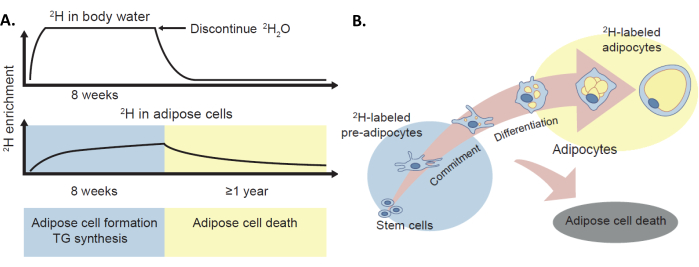
Figura 1: Protocolo de marcaje 2 H para evaluar el recambio adiposo in vivo. (A) El método de marcaje con deuterio ha sido validado para proporcionar estimaciones in vivo de la formación de células adiposas, la síntesis de TG y la muerte de adipocitos en humanos mediante la incorporación del isótopo estable 2H, administrado como 2H2O, en el agua corporal y el tejido adiposo. (B) El enriquecimiento de 2H en el tejido adiposo (pre-adipocitos y adipocitos) proporciona una medida de la formación de células adiposas. Cabe destacar que este protocolo también puede proporcionar una medida de la muerte de las células adiposas a través de la pérdida de etiqueta 2 H, aunque este no es el tema principal de este manuscrito. Esta figura ha sido adaptada con permiso de White y Ravussin4. Haga clic aquí para ver una versión más grande de esta figura.
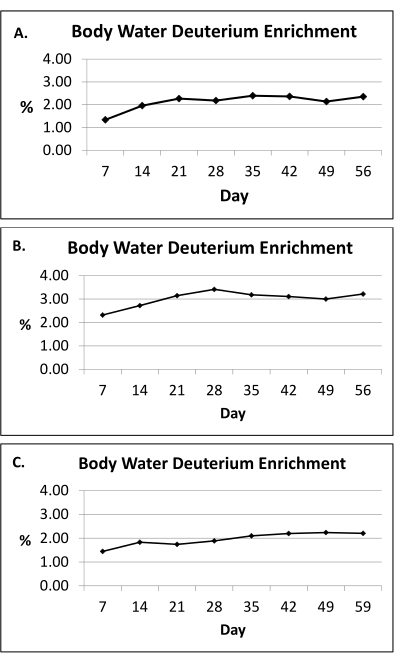
Figura 2: Enriquecimiento de deuterio en agua corporal. (A-C) Aquí se presentan mediciones representativas de enriquecimiento de deuterio en agua corporal (orina) durante el protocolo de etiquetado de 8 semanas 2H2O en tres sujetos humanos. Sobre la base de las dosis proporcionadas (sección 1), el protocolode etiquetado 2 H2O mantiene un enriquecimiento de 2H cercano a la meseta en el agua corporal dentro del rango de 1,0 %-2,5 % (eje y) durante el período de etiquetado de 8 semanas (eje x). El enriquecimiento medio de agua corporal se calcula utilizando un enfoque de área bajo la curva para todo el período de exposición. Haga clic aquí para ver una versión más grande de esta figura.
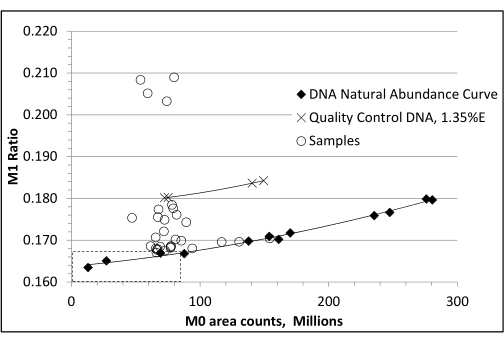
Figura 3: Curva de corrección de abundancia natural de ADN no marcado. El análisis de ADN no marcado por espectrometría de masas da como resultado un aumento de la abundancia fraccional M1 de referencia, lo que sugiere falsamente un aumento del enriquecimiento con el aumento de la carga de muestra en la columna de GC. Es necesaria una curva de abundancia no marcada para corregir esta "sensibilidad a la abundancia" de las proporciones de isótopos. Esto se hace utilizando un rango de cargas estándar de ADN no marcadas (áreas de pico M0) y restando la abundancia fraccional M1 medida (relación M1 = abundancia M1/abundancia de M0, M1 y M2) que corresponde al área pico M0 de una muestra marcada. En el ejemplo mostrado, los dos pares de muestras de control de calidad enriquecidas al 1,35% solo producen resultados correctos después de restar cada valor de abundancia fraccional M1 apropiado obtenido de la curva sin etiquetar. La relación M1 calculada para el derivado dR es de 0,1669. En esta figura, la relación M1 se alcanza en 82 millones de recuentos de área máxima M0. En este ejemplo, se puede calcular una relación M1 "ajustada" para dR no enriquecido utilizando la siguiente regresión: y = 1,3024e−19x2 + 1,7010e−11x + 0,1650. Esta figura ha sido adaptada con permiso de Mazzarello et al.23 Haga clic aquí para ver una versión más grande de esta figura.
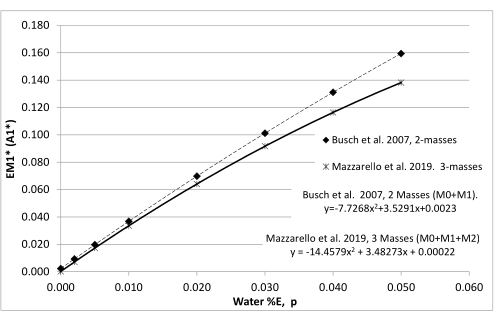
Figura 4: Relación entre el enriquecimiento de agua corporal (p) y el enriquecimiento máximo de un tejido completamente renovado. Se construyen tablas de distribución de isótopos de masa, que calculan todos los isótopos de dR en todos los enriquecimientos de agua corporal posibles (p). A continuación, se utilizan para derivar la relación entre p y el enriquecimiento máximo de M1 (EM1*) de dR en el ADN recién replicado. Si se conoce el enriquecimiento de agua corporal, se puede calcular EM1* y utilizar para calcular la síntesis fraccional. Esto es útil cuando no se dispone de un tejido de referencia completamente volteado. Las regresiones de Busch et al.9 y Mazzarello et al.23 producen resultados de síntesis fraccional comparables siempre y cuando todas las mediciones utilicen sistemáticamente dos o tres masas en el cálculo de las relaciones M1 y EM1*. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Mayores tasas de formación de preadipocitos y adipocitos en el depósito de scFEM en relación con el depósito de scABD. Las medias de mínimos cuadrados que compararon la fracción de nuevos preadipocitos y adipocitos en diferentes depósitos se derivaron del modelo lineal mixto (n = 25). La diferencia en la fracción de nuevos preadipocitos entre los depósitos de femoral subcutáneo (scFEM) y abdominal subcutáneo (scABD) fue de 3,224 (p = 0,0354), mientras que la diferencia en la fracción de nuevos adipocitos entre los depósitos de scFEM y scABD fue de 2,877 (p = 0,0005)13. La población de estudio incluyó 25 mujeres de ascendencia afroamericana (n = 14) y caucásica (n = 11), con una edad promedio de 31 años ± 6 años, un IMC promedio de 32,6 kg/m2 ± 2,7 kg/m2 y 44,3% ± 4,1% de grasa corporal. Esta figura ha sido adaptada con permiso de White et al.13. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Correlación positiva entre la formación de preadipocitos y la formación de adipocitos en los depósitos de scABD y scFEM (C,D) y el porcentaje general de grasa corporal. Las asociaciones simples entre la fracción de nuevos preadipocitos o adipocitos y el porcentaje de grasa corporal se analizaron mediante la correlación de Spearman (n = 25). (A,B) La correlación de Spearman entre la fracción de nuevos preadipocitos (abdominales subcutáneos; scABD) y el porcentaje de grasa corporal fue de 0,4263 (R2 = 0,2472; p = 0,019), y la correlación de Spearman entre la fracción de nuevos adipocitos (scABD) y el porcentaje de grasa corporal fue de 0,3291 (R2 = 0,2346; p = 0,026). (C,D) La correlación de Spearman entre la fracción de nuevos preadipocitos (femoral subcutáneo; scFEM) y el porcentaje de grasa corporal fue de 0,2761 (R2 = 0,1123; p = 0,092), y la correlación de Spearman entre la fracción de nuevos adipocitos (scFEM) y el porcentaje de grasa corporal fue de 0,5358 (R2 = 0,2116; p = 0,056)13. La población de estudio incluyó 25 mujeres de ascendencia afroamericana (n = 14) y caucásica (n = 11), con una edad promedio de 31 años ± 6 años, un IMC promedio de 32,6 kg/m2 ± 2,7 kg/m2 y 44,3% ± 4,1% de grasa corporal. Esta figura ha sido adaptada con permiso de White et al.13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las evaluaciones in vivo son necesarias para proporcionar nuevos conocimientos sobre la dinámica del recambio de TA blanco y su papel en la obesidad y las enfermedades metabólicas relacionadas, ya que las evaluaciones in vitro no abarcan el entorno natural del TA. Aunque el uso de la datación radiocarbónica retrospectiva para evaluar la dinámica adiposa ha sido informativo 7,25, este enfoque no es adecuado para capturar los cambios dinámicos durante los estudios prospectivos de intervención. El método de etiquetado 2H ha sido validado para proporcionar medidas fisiológicas de la formación y el recambio de células adiposas in vivo en humanos y representa una desviación sustancial de otras evaluaciones. En los últimos años, este enfoque se ha aplicado para evaluar y descubrir nuevas cinéticas adiposas tanto en roedores26 como en humanos 13,27,28.
En particular, con este método, se implementaron técnicas adicionales de procesamiento de AT para purificar los adipocitos recién aislados y eliminar la contaminación de otros tipos de células que pueden adherirse a los adipocitos flotantes y afectar las mediciones. Como se informó anteriormente, estos pasos resultaron en una mejora favorable en la precisión de las mediciones de adipogénesis in vivo , específicamente la medición de adipocitos recién formados14. Otro paso adicional en este método fue realizar un cultivo a corto plazo de células SVF para permitir la unión eficiente y preferencial de las células progenitoras de los adipocitos. Se encontró que este paso de cultivo enriquece la población de preadipocitos, lo que resulta en medidas más precisas de la proliferación in vivo 14. La pureza de las células de interés es una consideración importante en este método, especialmente cuando se analizan tejidos que comprenden varios tipos de células.
Si bien la muerte de los adipocitos es un componente importante del recambio de AT8, no se incluyó una evaluación de la muerte celular en el protocolo y, por lo tanto, la muerte de los adipocitos no se midió ni se discutió en este análisis. Sin embargo, aquí se ha informado de la tasa de síntesis fraccional (FSR), o la fracción de células recién formadas presentes en el AT durante las 8 semanas. La tasa de síntesis absoluta (ASR) se calcula de la siguiente manera: FSR × tamaño del grupo. El tamaño de la reserva de AT se puede estimar de manera más rigurosa a partir del número de adipocitos en el tejido, que se puede determinar experimentalmente mediante el peso de AT corregido por el tamaño medio de los adipocitos. Alternativamente, se puede utilizar una estimación del tamaño de los adipocitos basada en los valores publicados cuando sea apropiado. Es importante tener en cuenta que cuando el tamaño de la reserva de AT está en un estado estacionario o casi estacionario, que es el estado habitual incluso en condiciones como la obesidad (donde el cambio en la masa total de AT del cuerpo durante 8 semanas suele ser bastante pequeño en relación con la masa de AT de todo el cuerpo), la FSR es igual a la tasa de degradación fraccional (FDR) o tasa de mortalidad, que revela directamente la vida media de las células: T1/2 = ln 2/FDR = 0,693/FDR9. Por lo tanto, asumiendo que la masa de AT se encuentra en un estado relativamente estable durante el período de marcaje de 8 semanas 2H2O, la formación de nuevas células adiposas es probablemente similar a la fracción de muertes de células adiposas, lo que proporciona una medida del recambio o reemplazo de células adiposas27. Cuando hay un cambio en el tamaño del grupo durante el período de etiquetado (condiciones de estado no estacionario), se puede utilizar una corrección de estado no estacionario, como la ecuación29 de Steele, que requiere medir o estimar el cambio en el tamaño del grupo durante el período de etiquetado. Cabe destacar que la síntesis fraccional "f" sigue siendo una medida válida en un estado no estacionario, ya que el valor de "f" representa la fracción de células recién divididas que están presentes. Sin embargo, la conversión de "f" a una constante de velocidad (FSR o FDR) requeriría entonces una corrección en estado no estacionario, como la ecuación de Steele. Una fortaleza del protocolode marcaje 2H2O es que se puede aplicar para medir cuantitativamente la muerte celular adiposa, ya que las pérdidas en el enriquecimiento total de 2H en el pool de tejido adiposo después de detener el consumo de 2H2O ocurren solo por muerte celular9.
Aunque la necesidad de aislar y purificar las células de interés podría verse como una limitación del protocolo, algunas de las muchas ventajas incluyen la facilidad de administración de 2H2O, la idoneidad de este enfoque para condiciones de vida libre, la seguridad del enfoque y el hecho de que proporciona una evaluación integradora dentro del entorno natural del AT. que no se captura mediante abordajes in vitro . Es importante destacar que el protocolo 2H2O es un enfoque práctico que se puede aplicar para evaluar la cinética in vivo en varios otros tipos de células, tejidos y estados de enfermedad9.
Una parte crítica del diseño experimental es la dosis y el momento de la administración de 2H2O9. El protocolo presentado emplea un período de etiquetado de 8 semanas que implica el consumo tres veces al día de agua pesada durante la semana 1 (por ejemplo, el período de cebado para acercarse a la meseta de enriquecimiento de 2H2O en el agua corporal), seguido de un consumo dos veces al día durante las semanas restantes 2-8 para mantener niveles de enriquecimiento de agua corporal relativamente constantes. La dosificación y la administración adecuadas son importantes para proporcionar al cuerpo mediciones de enriquecimiento de 2H2O, que son necesarias para evaluar el cumplimiento del protocolo (sección 1 del protocolo) y para calcular la fracción de células recién formadas (sección 8 del protocolo). Cabe destacar que el período de marcaje de 8 semanas ha demostrado ser suficiente y adecuado para medir la cinética de la TA, a pesar de la lenta rotación de este tejido11,25. Por lo tanto, un beneficio de este enfoque es que 2H2O es seguro y adecuado para el consumo durante un período de semanas o meses, y la dosis y el momento de la administración de 2H2O se pueden modificar en función de la célula o tejido de interés, la pregunta científica y el objetivo del estudio para garantizar la incorporación adecuada de la etiqueta 2H9.
Hay algunos puntos a tener en cuenta para realizar estudios de seguimiento. La vida media de 2H en agua corporal es de ~7-10 días en humanos. Después de que un sujeto interrumpe la ingesta de 2H2O, el agua corporal 2H alcanza la línea de base después de ~ 4-6 semanas (la dilución de 2H2O se ajusta a un modelo de decaimiento exponencial)9. Aunque no es un factor para las células con un recambio rápido (por ejemplo, monocitos), el marcaje residual de 2H de los adipocitos después del cese de la ingesta de 2H2O es una consideración importante cuando se planifican estudios de seguimiento debido a la lenta recambio de estas células. Cabe destacar que la muerte de la etiqueta (por ejemplo, muerte de los adipocitos) puede evaluarse y proporcionar información útil, ya que la pérdida de la etiqueta 2H en las células adiposas ocurre solo si hay una pérdida de células o muerte celular9. Antes de realizar estudios de seguimiento, se debe medir el enriquecimiento de 2H en las células adiposas antes del inicio de un período de marcaje de 2H para establecer una medición "de referencia" al realizar estudios de seguimiento.
Los pasos que describen la preparación del ADN, el análisis de GC-MS y el cálculo de las células recién formadas (secciones 6-8 del protocolo) se han descrito y descrito con gran detalle en Busch et al.9. El enriquecimiento de 2H en un tipo de celda de referencia (casi) completamente reemplazado se puede utilizar en la ecuación para calcular la fracción de celdas de interés recién formadas (sección 8 del protocolo). Este valor de referencia representa el contenido máximo de 2H posible en el ADN si la población de células de referencia comprende esencialmente todas las células recién divididas bajo las mismas condiciones de marcaje de 2H2O. Por lo tanto, en estos análisis, la medición en monocitos (células casi completamente reemplazadas) representa un marcador celular de referencia de la exposición a 2H2O, y esto se utilizó para calcular la fracción de células adiposas recién sintetizadas. En ausencia de una medida de células de referencia, los enriquecimientos de H2O del cuerpo sepueden utilizar para estimar el enriquecimiento de 2H correspondiente al 100% de las células reemplazadas (es decir, el enriquecimiento máximo teórico de M1; Figura 2). Cabe destacar que el uso de mediciones de monocitos, u otra célula de referencia, 2 H tiene una ventaja sobre las medidas de agua corporal, ya que las mediciones anteriores explican el grado de enriquecimiento incompleto de 2H de los desoxirribonucleósidos de 2H2O (debido al intercambio incompleto de 1H/2H y/o a los efectos cinéticos de los isótopos a nivel de los precursores metabólicos). Las medidas de la celda de referencia también sirven para confirmar los cálculos utilizando el enriquecimiento máximo teórico de M1.
Este protocolo describe los métodos para medir la cinética de AT in vivo y las tasas de recambio en humanos a través del protocolo de marcaje 2H2O. Los datos presentados confirman este método fisiológico como un enfoque innovador para evaluar in vivo la cinética de AT y la asociación con los resultados de salud metabólica relacionados con la obesidad27 en individuos con diferentes distribuciones adiposas y contenidos de grasa corporal13, así como en respuesta a intervenciones, incluida la dieta, el ejercicio o el tratamiento farmacológico26,28.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Los autores agradecen al Núcleo de Espectrometría de Masas del Centro de Investigación Biomédica Pennington.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-methylimidazole | MilliporeSigma | 336092 | |
| 2H2O | Sigma Aldrich | ||
| Acetic anhydride | Aldridge | 539996 | |
| ACK Lysing Buffer (erythrocyte lysis buffer) | Quality Biological Inc (VWR) | 10128-802 | |
| Agilent 6890/5973 GC/MS | Agilent | ||
| Anti-human CD31 (PECAM-1) Biotin | Invitrogen | 13-0319-82 | |
| Anti-human CD34 Biotin | Invitrogen | 13-0349-82 | |
| Anti-human CD45 | BioLegend | 304004 | |
| Antibiotic Antimycotic Solution | MilliporeSigma | A5955 | |
| Collagenase type 1 | Worthington Biochemical Corporation | LS004196 | |
| Deoxyribose (2-deoxy d-ribose) | MilliporeSigma | 31170 | |
| Deuterium Oxide | MilliporeSigma | 756822 | |
| DB-225 column (30m, 0.25mm, 0.25um) | J&W Scientific | 122-2232 | |
| Dichloromethane (DCM) | MilliporeSigma | 34856 | |
| DNA standard (calf thymus DNA) | MilliporeSigma | D4764 | |
| Dneasy Blood and Tissue Kit (DNA extraction kit) | Qiagen | 69504 | |
| Easy Sep Human Biotin kit | Stem Cell Technologies | 17663 | |
| EasySep Human CD14 Positive Selection Cocktail | Stem Cell Technologies | 18058C | |
| Ethyl acetate | Fisher | EX0241-1 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube | VWR | 60819-295 | |
| Ficoll-Paque Plus | MilliporeSigma | GE17-1440-02 | |
| GC vials (2 mL) | Fisher | C-4011-1W | |
| GC vial inserts | Fisher | C-4011-631; C-4012-530 | |
| Glacial acetic acid | Fisher | AC14893-0010 | |
| Glass tubes (for hydrolysis) | Fisher | 14-959-35AA | |
| HEPES buffer | ThermoFisher | 15630080 | |
| Hyclone Water, molecular biology grade | Thomas Scientific | SH30538.02 | |
| MEM alpha | Fisher Scientific | 32561-037 | |
| PFBHA (o-(2, 3, 4, 5, 6)-penatfluorobenzylhydroxylamin hydrochloride) | MilliporeSigma | 194484 | |
| pH indicator strips | Fisher | 987618 | |
| Phosphatase acid | Calbiochem (VWR) | 80602-592 | |
| S1 nuclease (from Aspergillus oryzae) | MilliporeSigma | N5661 | |
| Sodium sulfate | MilliporeSigma | 23913 |
Referencias
- Cypess, A. M. Reassessing human adipose tissue. The New England Journal of Medicine. 386 (8), 768-779 (2022).
- Cinti, S. The adipose organ at a glance. Disease Models & Mechanisms. 5 (5), 588-594 (2012).
- Sethi, J. K., Vidal-Puig, A. J. Thematic review series: Adipocyte biology. Adipose tissue function and plasticity orchestrate nutritional adaptation. Journal of Lipid Research. 48 (6), 1253-1262 (2007).
- White, U., Ravussin, E. Dynamics of adipose tissue turnover in human metabolic health and disease. Diabetologia. 62 (1), 17-23 (2019).
- Danforth, E. Failure of adipocyte differentiation causes type II diabetes mellitus. Nature Genetics. 26 (1), 13 (2000).
- Virtue, S., Vidal-Puig, A. Adipose tissue expandability, lipotoxicity and the metabolic syndrome--An allostatic perspective. Biochimica et Biophysica Acta. 1801 (3), 338-349 (2010).
- Arner, E., et al. Adipocyte turnover: relevance to human adipose tissue morphology. Diabetes. 59 (1), 105-109 (2010).
- Cinti, S., et al. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans. Journal of Lipid Research. 46 (11), 2347-2355 (2005).
- Busch, R., Neese, R. A., Awada, M., Hayes, G. M., Hellerstein, M. K. Measurement of cell proliferation by heavy water labeling. Nature Protocols. 2 (12), 3045-3057 (2007).
- Neese, R. A., et al. Measurement in vivo of proliferation rates of slow turnover cells by 2H2O labeling of the deoxyribose moiety of DNA. Proceedings of the National Academy of Sciences of the United States of America. 99 (24), 15345-15350 (2002).
- Strawford, A., Antelo, F., Christiansen, M., Hellerstein, M. K. Adipose tissue triglyceride turnover, de novo lipogenesis, and cell proliferation in humans measured with 2H2O. American Journal of Physiology. Endocrinology and Metabolism. 286 (4), E577-E588 (2004).
- Macallan, D. C., et al. Measurement of cell proliferation by labeling of DNA with stable isotope-labeled glucose: Studies in vitro, in animals, and in humans. Proceedings of the National Academy of Sciences of the United States of America. 95 (2), 708-713 (1998).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Differences in in vivo cellular kinetics in abdominal and femoral subcutaneous adipose tissue in women. Diabetes. 65 (6), 1642-1647 (2016).
- Tchoukalova, Y. D., et al. In vivo adipogenesis in rats measured by cell kinetics in adipocytes and plastic-adherent stroma-vascular cells in response to high-fat diet and thiazolidinedione. Diabetes. 61 (1), 137-144 (2012).
- Jones, P. J., Leatherdale, S. T. Stable isotopes in clinical research: Safety reaffirmed. Clinical Science. 80 (4), 277-280 (1991).
- Bacchus-Souffan, C., et al. Relationship between CD4 T cell turnover, cellular differentiation and HIV persistence during ART. PLoS Pathogens. 17 (1), e1009214 (2021).
- Simonato, M., et al. Disaturated-phosphatidylcholine and surfactant protein-B turnover in human acute lung injury and in control patients. Respiratory Research. 12 (1), 36 (2011).
- Tremoy, G., et al. Measurements of water vapor isotope ratios with wavelength-scanned cavity ring-down spectroscopy technology: New insights and important caveats for deuterium excess measurements in tropical areas in comparison with isotope-ratio mass spectrometry. Rapid Communications in Mass Spectrometry. 25 (23), 3469-3480 (2011).
- dos Santos, T. H. R., Zucchi, M. D., Lemaire, T. J., de Azevedo, A. E. G., Viola, D. N. A statistical analysis of IRMS and CRDS methods in isotopic ratios of H-2/H-1 and O-18/O-16 in water. Sn Applied Sciences. 1, 664 (2019).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nature Protocols. 4 (1), 102-106 (2009).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis at eight years: theoretical, analytic, and experimental considerations. The American Journal of Physiology. 276 (6), E1146-E1170 (1999).
- Patterson, B. W., Zhao, G., Klein, S. Improved accuracy and precision of gas chromatography/mass spectrometry measurements for metabolic tracers. Metabolism. 47 (6), 706-712 (1998).
- Mazzarello, A. N., Fitch, M., Hellerstein, M. K., Chiorazzi, N. Measurement of leukemic B-cell growth kinetics in patients with chronic lymphocytic leukemia. Methods in Molecular Biology. 1881, 129-151 (2019).
- Hellerstein, M. K., Neese, R. A. Mass isotopomer distribution analysis: A technique for measuring biosynthesis and turnover of polymers. The American Journal of Physiology. 263, E988-E1001 (1992).
- Spalding, K. L., et al. Dynamics of fat cell turnover in humans. Nature. 453 (7196), 783-787 (2008).
- Allerton, T. D., et al. Exercise reduced the formation of new adipocytes in the adipose tissue of mice in vivo. PLoS One. 16 (1), e0244804 (2021).
- White, U. A., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Association of in vivo adipose tissue cellular kinetics with markers of metabolic health in humans. The Journal of Clinical Endocrinology and Metabolism. 102 (7), 2171-2178 (2017).
- White, U., Fitch, M. D., Beyl, R. A., Hellerstein, M. K., Ravussin, E. Adipose depot-specific effects of 16 weeks of pioglitazone on in vivo adipogenesis in women with obesity: A randomised controlled trial. Diabetologia. 64 (1), 159-167 (2021).
- Steele, R. Influences of glucose loading and of injected insulin on hepatic glucose output. Annals of the New York Academy of Sciences. 82, 420-430 (1959).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados