Method Article
Isolamento e cultura de colangiócitos primários de camundongos com doença hepática policística usando um método de digestão em duas etapas
Neste Artigo
Resumo
Este protocolo descreve um método otimizado de digestão em duas etapas para isolar colangiócitos primários de alta pureza e alta viabilidade de camundongos selvagens e camundongos com doença hepática policística.
Resumo
Neste protocolo, otimizamos um método de digestão em duas etapas para isolar colangiócitos primários de alta pureza e alta viabilidade de camundongos selvagens e camundongos com doença hepática policística (PLD). Após anestesiar os camundongos, os fígados foram perfundidos através da veia cava inferior com 50 mL de Solução A, seguido por 30 mL de Solução B a 37 °C para digerir enzimaticamente o tecido hepático. Dissociação mecânica, agitação e microdissecção foram realizadas para remover as células parenquimatosas aderentes, deixando uma árvore biliar intacta. A árvore biliar foi então finamente picada e digerida com agitação por 60 min a 37 °C. A suspensão unicelular resultante foi coletada usando um filtro de células de 70 μm. Os colangiócitos foram purificados por meio de isolamento imunomagnético. A suspensão celular foi incubada com um anticorpo anti-EpCAM sob rotação por 45 min a 4 °C, seguida pela adição de esferas de proteína G e rotação adicional por mais 45 min a 4 °C. Após três lavagens com PBS, os colangiócitos foram coletados usando um separador magnético. Os colangiócitos primários purificados foram ressuspensos em meio de cultura de colangiócitos e semeados em placas de cultura de células revestidas com 1 mg/mL de colágeno de cauda de rato tipo I. A pureza dos colangiócitos foi confirmada por imunomarcação para o marcador específico de colangiócitos citoqueratina-19 (CK19). Embora este estudo tenha se concentrado no isolamento de colangiócitos primários de camundongos do tipo selvagem e PLD, estamos confiantes de que o protocolo também pode ser aplicado a outros modelos de camundongos com doenças. Este método detalhado de digestão em duas etapas facilita estudos in vitro de colangiopatias e o desenvolvimento de terapias direcionadas.
Introdução
Os colangiócitos, as células epiteliais que revestem a árvore biliar intra-hepática, formam uma monocamada e constituem aproximadamente 3-5% da população total de células do fígado1. Essas células se interconectam dentro do fígado para criar uma complexa rede ductal tridimensional2. Em condições normais, os colangiócitos desempenham funções vitais, incluindo secreção, absorção, reparo de lesões e servindo como barreira imunológica, desempenhando assim um papel crítico na fisiologia e patologia do fígado. No entanto, a disfunção colangiocitária pode levar a várias doenças, incluindo PLD, colangite esclerosante primária, colangiocarcinoma e lesão hepática colestática 3,4,5.
Dentre as doenças relacionadas à colangiopatia, a PLD destaca-se como uma doença hereditária marcada pela formação de numerosos cistos cheios de líquido originados de colangiócitos. O aumento progressivo desses cistos diminui significativamente a qualidade de vida dos pacientes6. As opções atuais de tratamento para PLD permanecem insuficientes, oferecendo eficácia limitada, embora muitas vezes associadas a altas taxas de recorrência e complicações7. Isso destaca a necessidade urgente de desenvolver estratégias terapêuticas seguras e eficazes para atender às demandas clínicas não atendidas no gerenciamento de PLD.
A pesquisa sobre os mecanismos das colangiopatias, incluindo PLD, tem sido significativamente prejudicada pela falta de linhagens celulares adequadas. Para resolver essa limitação, o uso de modelos de camundongos com doenças e o isolamento de colangiócitos primários desses modelos para experimentos in vitro provaram ser inestimáveis para descobrir os mecanismos moleculares subjacentes às colangiopatias e identificar possíveis estratégias terapêuticas.
Em nosso estudo recente8, estabelecemos com sucesso um modelo de camundongo PLD usando camundongos Pkd1 nocaute condicional (KO). Os cistos hepáticos foram observados 1 mês após a deleção de Pkd1 e aumentaram progressivamente de tamanho ao longo do tempo. Embora os protocolos para isolamento de colangiócitos de ratos e humanos sejam bem documentados 9,10, o isolamento de colangiócitos primários de camundongos permanece particularmente desafiador devido ao seu pequeno tamanho e à intrincada arquitetura da veia porta e do sistema biliar. Os métodos existentes enfrentam limitações significativas, incluindo baixa pureza celular, baixa viabilidade, procedimentos complexos e altos custos11,12.
Este manuscrito apresenta um protocolo detalhado para isolar colangiócitos primários de alta pureza de camundongos usando um método de digestão em duas etapas. Essa abordagem otimizada visa apoiar estudos in vitro , facilitando a investigação dos mecanismos moleculares subjacentes às colangiopatias e avançando no desenvolvimento de novas estratégias terapêuticas.
Protocolo
Todos os protocolos experimentais e de cuidados com camundongos foram aprovados pelo Comitê de Ética da Universidade Médica de Tianjin (Doc. No: TMUa-MEC 2022016).
1. Preparação de equipamentos e soluções
- Esterilize os instrumentos cirúrgicos (tesouras, pinças e cabos de bisturi) autoclavando pelo menos 1 dia antes do isolamento celular.
- Pelo menos 1 dia antes do isolamento celular, prepare o meio de cultura de colangiócitos usando os reagentes listados na Tabela 1. Esterilize o meio de cultura de colangiócitos filtrando-o através de um filtro de 0,22 μm.
- Pelo menos 1 dia antes do isolamento celular, prepare a Solução A e a Solução B usando os reagentes listados na Tabela 2 para perfusão hepática de camundongos. Esterilize a Solução A e a Solução B autoclavando ou filtrando através de um filtro de 0,22 μm e ajuste seu pH para 7,35 usando NaOH estéril sob agitação suave.
NOTA: O meio de cultura de colangiócitos, a solução A e a solução B podem ser armazenados a 4 ° C por pelo menos um mês. - Antes de iniciar o experimento, adicione o pó de colagenase II à Solução B e misture suavemente para atingir uma concentração final de 0,5 mg / mL. Pré-aqueça a solução A e a solução B em banho-maria a 37 °C antes de usar.
- Imediatamente antes de iniciar o experimento, prepare pratos de 6 cm cheios de PBS estéril e coloque-os no gelo para mantê-los frios durante o procedimento.
2. Perfusão da digestão do tecido hepático
- Anestesie o camundongo usando uma overdose de inalação de isoflurano. Coloque o mouse anestesiado em decúbito dorsal e prenda-o com fita adesiva para facilitar o procedimento.
- Abra a cavidade abdominal do camundongo após esterilizar o abdômen com etanol a 75% e, em seguida, amarre um nó corrediço ao redor da veia cava inferior usando uma agulha estampada. Enxágue um cateter intravenoso de 24 G com a Solução A usando uma seringa de 20 mL.
- Insira o cateter intravenoso na veia cava inferior abaixo do nó corrediço, prenda o nó corrediço e fixe o cateter no lugar com fita adesiva.
- Perfunda o fígado com 50 mL de solução A através da veia cava inferior usando uma seringa de 20 mL e faça uma incisão na veia porta hepática para drenar a solução de perfusão. Mantenha a taxa de perfusão em 10 mL / min.
- Continue a perfusão com 30 mL de solução B contendo colagenase II a uma taxa de fluxo de 3,5 mL / min usando uma bomba peristáltica.
NOTA: Esta etapa destina-se à digestão do tecido hepático. - Remova o tecido hepático perfundido com sucesso e coloque-o em um prato de 6 cm cheio de PBS estéril frio.
3. Isolamento de colangiócitos
NOTA: Como o número de colangiócitos em camundongos normais é relativamente baixo, recomenda-se o uso de um grupo de 2 a 6 camundongos para o procedimento. No entanto, para modelos de doença de camundongo com proliferação anormal de colangiócitos, como PLD, os colangiócitos de um único camundongo são suficientes. A menos que especificado de outra forma, amostras e reagentes precisam sempre ser mantidos em gelo e todos os procedimentos devem ser realizados em uma cabine de segurança biológica.
- Dissocie mecanicamente e agite o tecido hepático usando uma pinça curva. Posteriormente, realizar microdissecção sob microscópio de dissecação para remoção das células parenquimatosas aderentes, deixando uma árvore biliar intacta. Remova o tecido da vesícula biliar antes de prosseguir para a próxima etapa.
Lave o lenço 2x com PBS. - Pique finamente a árvore biliar usando uma lâmina cirúrgica e digeri-la em 3 mL de solução de digestão (Tabela 3) por camundongo com agitação (90 rpm) a 37 ° C por 60 min. Na marca de 30 minutos, pipete suavemente a mistura usando uma ponta de pipeta para misturar bem.
NOTA: A solução de digestão deve ser preparada na hora antes do uso. - Passe a suspensão celular por um filtro de células de 70 μm. Use o êmbolo de uma seringa de 5 mL ou 10 mL para pressionar suavemente a suspensão celular através do filtro. Lave o filtro com PBS.
- Centrifugar a suspensão da célula a 500 x g durante 5 min a 4 °C. Lave as células 3x com meio RPMI.
- Centrifugue novamente a 500 x g por 5 min a 4 °C.
- Rejeitar o sobrenadante e ressuspender as células em 900 μl de meio RPMI contendo 40 U/ml de DNase I. Adicionar 2 μg de anticorpo anti-EpCAM e incubar a suspensão num rotador (20 rpm) a 4 °C durante 45 min.
- Centrifugue a 500 x g durante 5 min a 4 °C.
- Descarte o sobrenadante e ressuspenda as células em 1 mL de meio RPMI contendo 40 U / mL DNase I. Pré-lave as esferas de proteína G com 1 mL de meio RPMI. Adicione 20 μL de grânulos de proteína G à suspensão celular e incube com rotação (20 rpm) a 4 ° C por mais 45 min.
NOTA: O anticorpo anti-EpCAM também pode ser pré-incubado com grânulos de proteína G para criar um complexo de grânulos-anticorpo antes de introduzir a suspensão celular. - Lave as células 3x com PBS usando um separador magnético.
- Realize a contagem de células e a avaliação da viabilidade celular usando a coloração com Trypan Blue (0,04%, 3 min) em um hemocitômetro.
NOTA: Não há necessidade de remover as esferas dos colangiócitos, elas se desprenderão naturalmente assim que a cultura começar e não interferirão na cultura de células.
4. Cultura de colangiócitos
NOTA: Prepare placas frescas de cultura de células revestidas de colágeno de cauda de rato tipo I antes da cultura de colangiócitos. Pré-resfrie todos os reagentes no gelo.
- Seguindo as instruções do fabricante, misture ddHestéril 2O, 10x PBS, 1 N NaOH e colágeno de cauda de rato tipo I para atingir uma concentração final de 1 mg/mL de colágeno de cauda de rato tipo I em 1x PBS. Cubra uniformemente as placas de cultura de células com a mistura e coloque-as em uma incubadora a 37 ° C com 5% de CO2 por 30 min para permitir que o colágeno se solidifique.
- Lave as placas de cultura de células revestidas com colágeno de cauda de rato tipo I com PBS pré-aquecido.
- Ressuspenda os colangiócitos em meio de cultura de colangiócitos pré-aquecido. Semear a suspensão celular em placas de cultura de células revestidas com colagénio de cauda de rato tipo I de 1 mg/ml e incubar a 37 °C com CO2 a 5%. Substitua o meio a cada 2 dias.
5. Passagem e criopreservação de colangiócitos
- Lave os colangiócitos duas vezes com PBS e, em seguida, incube as células em tripsina a 0,25% a 37 ° C por 5-10 min.
- Adicione um volume igual de meio de cultura de colangiócitos para neutralizar a tripsina e, em seguida, centrifugue a 500 x g por 5 min.
- Prepare placas de cultura de células revestidas com colágeno de cauda de rato tipo I conforme descrito na Etapa 4.1.
- Siga as etapas 4.2 e 4.3.
- Se a criopreservação for necessária, ressuspenda os colangiócitos em meio de armazenamento (9:1 FBS: DMSO) e armazene em um freezer a -80 °C ou nitrogênio líquido. Descongele as células conforme necessário para uso futuro.
6. Validação de colangiócitos
NOTA: A pureza dos colangiócitos foi avaliada pela coloração do marcador de colangiócitos CK19.
- Lave os colangiócitos 2x com PBS e, em seguida, fixe as células em paraformaldeído a 4% por 15 min.
- Lave os colangiócitos com PBS e, em seguida, permeabilize as células com Triton X-100 a 1% por 8 min.
- Lave os colangiócitos com PBS e, em seguida, bloqueie as células em 5% de BSA por 1 h.
- Lave os colangiócitos com PBS e, em seguida, incube as células com o anticorpo primário contra CK19 (diluição 1:12 com 2% de BSA) durante a noite a 4 ° C.
- Lave os colangiócitos 2x com PBS e, em seguida, incube as células com anticorpo secundário Alexa Fluor 488 anti-rato de burro (diluição 1:1.000 com PBS) por 1 h em temperatura ambiente.
- Lave os colangiócitos com PBS, cove com 4',6-diamidino-2-fenilindol por 15 min e observe ao microscópio.
Resultados
O diagrama de fluxo de trabalho para o processo de digestão em duas etapas usado para isolar colangiócitos é mostrado na Figura 1. Todo o procedimento leva ~5 h. Primeiro, o fígado é perfundido com a Solução A através da veia cava inferior para remover o sangue, conforme indicado pelo fígado ficando pálido. O fígado é então perfundido com a Solução B contendo colagenase II para iniciar a digestão do tecido. Esta etapa inicial da digestão é sensível ao tempo, e a digestão bem-sucedida é evidenciada pelo tecido se tornar visivelmente macio. Em seguida, a dissociação mecânica e a agitação suave usando pinças curvas ajudam a remover os hepatócitos; A digestão adequada é confirmada quando um grande número de hepatócitos se desprende. Sob um microscópio de dissecação, as células parenquimatosas aderentes remanescentes são cuidadosamente removidas por microdissecção, deixando uma árvore biliar intacta (Figura 2).
Na segunda etapa da digestão, o tecido é dividido em uma suspensão unicelular, que ainda contém alguns hepatócitos e fibroblastos. Finalmente, colangiócitos de alta pureza são obtidos a partir desta suspensão por meio de separação imunomagnética. A avaliação da viabilidade celular foi realizada usando a coloração com Azul de Trypan em um hemocitômetro. Os resultados demonstraram o isolamento bem-sucedido de colangiócitos altamente viáveis (Figura 3). A coloração por imunofluorescência para CK19 (Figura 4) confirmou que esse método produz consistentemente colangiócitos de camundongo de alta pureza.
Os colangiócitos primários tipicamente aderiram à superfície da cultura e formaram uma monocamada em aproximadamente 24 h, exibindo rápida proliferação durante as três primeiras passagens, especialmente em modelos de doença de camundongos com proliferação anormal de colangiócitos, como PLD (Figura 5). No entanto, em passagens posteriores, a taxa de crescimento diminuiu e as células tornaram-se maiores e desenvolveram uma morfologia vacuolizada. Não há necessidade de remover as contas dos colangiócitos, elas se desprenderão naturalmente assim que a cultura começar e não interferirão na cultura de células. A criopreservação e o descongelamento celular não afetaram significativamente a viabilidade celular.

Figura 1: Visão geral esquemática do processo de digestão em duas etapas para isolamento de colangiócitos. Esta figura foi retirada de Ji et al8. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem representativa da árvore biliar isolada de um camundongo com doença hepática policística. Clique aqui para ver uma versão maior desta figura.

Figura 3: Avaliação da viabilidade celular de colangiócitos isolados usando coloração com azul de tripano. Barras de escala = 50 μm. As pequenas partículas pretas ao redor das células e dentro do fundo são contas de proteína G. Clique aqui para ver uma versão maior desta figura.

Figura 4: Avaliação da pureza celular de colangiócitos isolados usando coloração de imunofluorescência para CK19. Barras de escala: = 50 μm [superior] e 10 μm [inferior]. Esta figura foi retirada de Ji et al8. Clique aqui para ver uma versão maior desta figura.
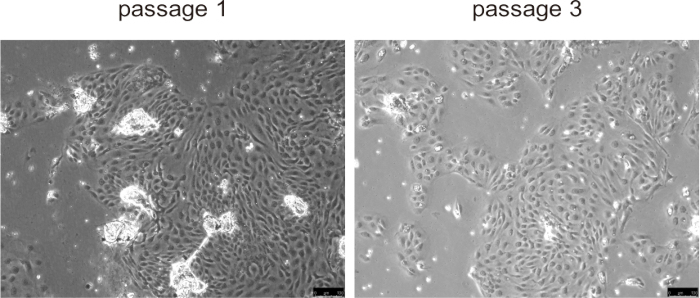
Figura 5: Imagens representativas de colangiócitos isolados na passagem 1 e na passagem 3. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
| Componentes | Quantidade |
| DMEM/F12 (1:1) | 415 mL |
| Soro fetal bovino (FBS) | 50 mL |
| Aminoácidos não essenciais MEM (100x) | 5 ml |
| Insulina-transferrina-selênio (100x) | 5 ml |
| Solução de vitamina MEM (100x) | 5 ml |
| Concentrado lipídico quimicamente definido (100x) | 5 ml |
| Penicilina-estreptomicina (100x) | 5 ml |
| Solução de gentamicina/anfotericina (500x) | 1 mL |
| 100 mM Na Piruvato | 250 μL |
| 10 mg/mL Inibidor de tripsina de soja | 2,5 ml |
| 200 mM L-Glutamina | 5 ml |
| 10 mg/mL de dexametasona | 20 μL |
| 1,7 mg/ml 3,3',5-triiodo-L-tironina | 1 mL |
| 1 mg/mL Fator de crescimento epidérmico | 12,5 μL |
| 20 mM Forscolina | 250 μL |
| Etanolamina | 13 μL |
Tabela 1: Composição do meio de cultura de colangiócitos.
| Componentes | Quantidade | |
| Solução A | NaCl | 4.0908 gramas |
| Kcl | 0.1578 gramas | |
| Na2HPO4 | 0,1072 gramas | |
| HEPES | 2.9789 gramas | |
| 50 mM EGTA (PH = 8) | 5 ml | |
| 1,5 M MgCl2 | 34 μL | |
| ddH2O | 500 mL | |
| NOTA: Ajuste o pH para 7.35 usando NaOH estéril. | ||
| Solução B | NaCl | 4.0908 gramas |
| Kcl | 0.1578 gramas | |
| Na2HPO4 | 0,1072 gramas | |
| HEPES | 2.9789 gramas | |
| 2 M CaCl2 | 1,25 mL | |
| ddH2O | 500 mL | |
| NOTA: Ajuste o pH para 7.35 usando NaOH estéril. O pó de colagenase II deve ser adicionado para atingir uma concentração final de 0,5 mg / mL antes do uso. | ||
Tabela 2: Composição da Solução A e da Solução B.
| Componentes | Quantidade |
| 3,2 mg/mL de colagenase XI | 300 μL |
| 10 mg/mL de hialuronidase | 120 μL |
| 10 U/μL DNase I | 12 μL |
| Penicilina-estreptomicina (100x) | 30 μL |
| RPMI médio | 2.538 mL |
Tabela 3: Composição da solução de digestão.
Discussão
Este protocolo fornece um método detalhado para isolar colangiócitos primários de alta pureza de camundongos usando um processo de digestão em duas etapas, permitindo o estudo dos mecanismos moleculares subjacentes às colangiopatias. Várias etapas críticas são essenciais para garantir o isolamento bem-sucedido dos colangiócitos.
O primeiro passo crítico é garantir perfusão e digestão eficazes usando a Solução A e a Solução B. A perfusão bem-sucedida com a Solução A foi confirmada pelo fígado ficando pálido, e a digestão bem-sucedida com a Solução B foi confirmada pelo tecido hepático tornando-se visivelmente macio. A falha na perfusão impediria a digestão do tecido hepático e comprometeria o isolamento subsequente da árvore biliar. Para aumentar a eficiência da digestão, pode-se aumentar os volumes da Solução A e da Solução B, reduzir a taxa de fluxo de perfusão ou pressionar suavemente o fígado com um cotonete.
A segunda etapa crítica envolve a dissociação mecânica e a agitação suave do tecido hepático com uma pinça curva, seguida de microdissecção sob um microscópio de dissecação para remover as células parenquimatosas aderentes e isolar uma árvore biliar intacta. Esta etapa foi fundamental para a obtenção de colangiócitos de alta pureza. A eficiência pode ser melhorada agarrando ductos biliares maiores com pinças curvas durante a agitação e enxágue com PBS frio. Se o fígado for digerido com sucesso, muitos hepatócitos se desprenderão, tornando a microdissecção relativamente simples. No entanto, se a digestão for incompleta e a amostra for valiosa, o processo de microdissecção exigirá um esforço meticuloso, aumentando a carga de trabalho e potencialmente reduzindo o rendimento e a pureza das células. Assim, garantir a perfusão adequada com a Solução B para a digestão do fígado era fundamental.
A terceira etapa crítica é a segunda digestão da árvore biliar para produzir uma suspensão unicelular. O tempo de digestão deve ser otimizado observando as células ao microscópio: a digestão excessiva pode reduzir a viabilidade celular, enquanto a subdigestão pode levar ao tecido biliar não utilizado. Além disso, incluir antibióticos apropriados em todos os reagentes ajuda a minimizar a contaminação.
Usando este protocolo de digestão otimizado em duas etapas, isolamos com sucesso colangiócitos de alta pureza e altamente viáveis de camundongos. Embora este estudo tenha se concentrado em isolar colangiócitos primários de modelos de camundongos do tipo selvagem e PLD, estamos confiantes de que o protocolo também pode ser aplicado a outros modelos de camundongos com doenças. O processo de digestão inicial do tecido hepático para isolar a árvore biliar, seguido por uma segunda etapa de digestão, melhorou significativamente a eficiência da separação imunomagnética e produziu um maior número de células viáveis. Os colangiócitos isolados foram adequados para experimentos epigenéticos que requerem alta viabilidade, como ATAC-seq, ChIP-seq, ChIP-seq de baixa entrada e CUT&TAG. Além disso, esses colangiócitos primários podem ser cultivados in vitro para vários ensaios funcionais, incluindo crescimento cístico 3D, proliferação celular, apoptose e análise do ciclo celular.
Em um estudo publicado anteriormente8, isolamos colangiócitos primários normais e císticos de camundongos selvagens e PLD de ambos os sexos. O perfil multi-ômico de colangiócitos primários de camundongos PLD machos e fêmeas revelou dinâmica epigenética específica do sexo em colangiócitos durante a cistogênese hepática. Além disso, identificamos uma potencial estratégia terapêutica epigenética para pacientes masculinos com PLD por meio da inibição farmacológica de enzimas modificadoras epigenéticas em modelos de camundongos PLD e experimentos in vitro com colangiócitos primários.
Nossa abordagem oferece várias vantagens notáveis sobre os métodos de isolamento de colangiócitos atualmente publicados. Comparado ao método de Kudira et al.13, que envolve a digestão direta do tecido hepático em uma suspensão unicelular após a digestão da perfusão, seguida de centrifugação gradiente e isolamento imunomagnético, nosso método é mais simples, mais econômico e mais eficiente. Uma vantagem importante é o isolamento da árvore biliar antes do isolamento imunomagnético, o que melhora o processo geral. Além disso, por não exigir a remoção das esferas dos colangiócitos, este método alcança um maior rendimento e maior viabilidade das células isoladas. Em comparação com o método de Ueno et al.14, que dissocia e pica o resíduo do trato portal da perfusão da digestão hepática para cultura 3D, seguido por um período de cultura de 7 dias antes de gerar uma suspensão unicelular, nosso método é mais eficiente em termos de tempo. O isolamento da árvore biliar, seguido pelo isolamento imunomagnético, também aumenta significativamente a pureza celular.
No entanto, apesar dessas vantagens, nossa técnica de digestão em duas etapas ainda tem algumas limitações. É relativamente trabalhoso, permite apenas um número limitado de passagens e requer microdissecção cuidadosa para evitar a contaminação do parênquima.
Em conclusão, desenvolvemos e otimizamos um método de digestão em duas etapas para isolar colangiócitos primários de alta pureza e alta viabilidade de camundongos. Essa abordagem fornece uma ferramenta valiosa para estudar os mecanismos moleculares subjacentes às colangiopatias e oferece uma base para identificar possíveis estratégias terapêuticas.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por doações da Comissão Municipal de Educação de Tianjin (2022ZD054 para L.Z.)
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
Referências
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados