Method Article
בידוד ותרבית של כולנגיוציטים ראשוניים מעכברים עם מחלת כבד פוליציסטית בשיטת עיכול דו-שלבית
In This Article
Summary
פרוטוקול זה מתאר שיטת עיכול דו-שלבית אופטימלית לבידוד כולנגיוציטים ראשוניים בעלי טוהר גבוה וכדאיות גבוהה מעכברים מסוג בר ועכברים עם מחלת כבד פוליציסטית.
Abstract
בפרוטוקול זה, ביצענו אופטימיזציה של שיטת עיכול דו-שלבית כדי לבודד כולנגיוציטים ראשוניים בעלי טוהר גבוה וכדאיות גבוהה מעכברים מסוג בר ועכברים עם מחלת כבד פוליציסטית (PLD). לאחר הרדמת העכברים, הכבדים הוחדרו דרך הווריד הנבוב התחתון עם 50 מ"ל של תמיסה A, ואחריה 30 מ"ל של תמיסה B ב-37 מעלות צלזיוס לעיכול אנזימטי של רקמת הכבד. דיסוציאציה מכנית, טלטול ומיקרודיסקציה בוצעו כדי להסיר תאים פרנכימליים דבקים, והשאירו עץ מרה שלם. לאחר מכן נטחן עץ המרה דק ועוכל בניעור במשך 60 דקות בטמפרטורה של 37 מעלות צלזיוס. התרחיף החד-תאי שהתקבל נאסף באמצעות מסננת תאים של 70 מיקרומטר. כולנגיוציטים טוהרו באמצעות בידוד חיסוני מגנטי. תרחיף התא הודגר עם נוגדן אנטי-EpCAM בסיבוב למשך 45 דקות ב-4 מעלות צלזיוס, ולאחר מכן תוספת של חרוזי חלבון G וסיבוב נוסף למשך 45 דקות נוספות ב-4 מעלות צלזיוס. לאחר שלוש שטיפות עם PBS, הכולנגיוציטים נאספו באמצעות מפריד מגנטי. הכולנגיוציטים הראשוניים המטוהרים הושעו מחדש במדיום תרבית כולנגיוציטים ונזרעו על צלחות תרבית תאים מצופות בקולגן זנב חולדה מסוג 1 מ"ג/מ"ל מסוג I. טוהר הכולנגיוציטים אושר על ידי צביעה חיסונית עבור הסמן הספציפי לכולנגיוציטים ציטוקרטין-19 (CK19). למרות שמחקר זה התמקד בבידוד כולנגיוציטים ראשוניים מעכברי בר ועכברי PLD, אנו בטוחים שניתן ליישם את הפרוטוקול גם על מודלים אחרים של עכברי מחלה. שיטת עיכול דו-שלבית מפורטת זו מקלה על מחקרי מבחנה של כולנגיופתיה ופיתוח טיפולים ממוקדים.
Introduction
כולנגיוציטים, תאי האפיתל המצפים את עץ המרה התוך-כבדי, יוצרים שכבה אחת ומהווים כ-3-5% מכלל אוכלוסיית התאים בכבד1. תאים אלה מתחברים בתוך הכבד ליצירת רשת צינורות תלת מימדית מורכבת2. בתנאים רגילים, כולנגיוציטים מבצעים פונקציות חיוניות, כולל הפרשה, ספיגה, תיקון פציעות ומשמשים כמחסום חיסוני, ובכך ממלאים תפקיד קריטי בפיזיולוגיה ובפתולוגיה של הכבד. עם זאת, תפקוד לקוי של כולנגיוציטים יכול להוביל למחלות שונות, כולל PLD, כולנגיטיס טרשתית ראשונית, כולנגיוקרצינומה ופגיעה בכבד כולסטטי 3,4,5.
בין מחלות הקשורות לכולנגיופתיה, PLD בולטת כהפרעה תורשתית המאופיינת בהיווצרות ציסטות מלאות נוזלים רבות שמקורן בכולנגיוציטים. ההגדלה המתקדמת של ציסטות אלו מפחיתה משמעותית את איכות החיים של החולים6. אפשרויות הטיפול הנוכחיות ב-PLD אינן מספיקות, ומציעות יעילות מוגבלת בעוד שלעתים קרובות קשורות לשיעורי הישנות וסיבוכים גבוהים7. זה מדגיש את הצורך הדחוף בפיתוח אסטרטגיות טיפוליות בטוחות ויעילות כדי להתמודד עם הדרישות הקליניות שלא נענו בניהול PLD.
המחקר על המנגנונים של כולנגיופתיה, כולל PLD, נפגע משמעותית בגלל היעדר קווי תאים מתאימים. כדי להתמודד עם מגבלה זו, השימוש במודלים של עכברי מחלה ובידוד של כולנגיוציטים ראשוניים ממודלים אלה לניסויים במבחנה הוכחו כבעלי ערך רב לחשיפת המנגנונים המולקולריים העומדים בבסיס כולנגיופתיה וזיהוי אסטרטגיות טיפוליות פוטנציאליות.
במחקר האחרון שלנו8, הקמנו בהצלחה מודל עכבר PLD באמצעות עכברי נוקאאוט מותנה (KO) Pkd1. ציסטות בכבד נצפו כבר חודש לאחר מחיקת Pkd1 וגדלו בהדרגה עם הזמן. בעוד שפרוטוקולים לבידוד כולנגיוציטים מחולדות ובני אדם מתועדים היטב 9,10, בידוד כולנגיוציטים ראשוניים מעכברים נותר מאתגר במיוחד בשל גודלם הקטן והארכיטקטורה המורכבת של וריד הפורטל ומערכת המרה. השיטות הקיימות מתמודדות עם מגבלות משמעותיות, כולל טוהר תאים נמוך, כדאיות ירודה, הליכים מורכבים ועלויות גבוהות11,12.
כתב יד זה מציג פרוטוקול מפורט לבידוד כולנגיוציטים ראשוניים בעלי טוהר גבוה מעכברים בשיטת עיכול דו-שלבית. גישה אופטימלית זו נועדה לתמוך במחקרי מבחנה , להקל על חקירת המנגנונים המולקולריים העומדים בבסיס כולנגיופתית ולקדם את הפיתוח של אסטרטגיות טיפוליות חדשות.
Protocol
כל הטיפול בעכברים והפרוטוקולים הניסויים אושרו על ידי הוועדה האתית של האוניברסיטה הרפואית של טיאנג'ין (מס' מסמך: TMUa-MEC 2022016).
1. הכנת ציוד ופתרונות
- עיקור מכשירים כירורגיים (מספריים, מלקחיים וידיות אזמל) על ידי חיטוי לפחות יום אחד לפני בידוד התאים.
- לפחות יום אחד לפני בידוד התאים, הכינו את מדיום תרבית הכולנגיוציטים באמצעות הריאגנטים המפורטים בטבלה 1. עקר את מדיום תרבית הכולנגיוציטים על ידי סינון דרך מסנן של 0.22 מיקרומטר.
- לפחות יום אחד לפני בידוד התאים, הכינו את פתרון A ופתרון B באמצעות הריאגנטים המפורטים בטבלה 2 לזלוף כבד עכבר. עיקור תמיסה A ותמיסה B על ידי חיטוי או סינון דרך מסנן של 0.22 מיקרומטר והתאמת ה-pH שלהם ל-7.35 באמצעות NaOH סטרילי תוך ערבוב עדין.
הערה: ניתן לאחסן את מדיום תרבית הכולנגיוציטים, תמיסה A ותמיסה B בטמפרטורה של 4 מעלות צלזיוס למשך חודש אחד לפחות. - לפני תחילת הניסוי יש להוסיף אבקת קולגנאז II לתמיסה B ולערבב בעדינות עד לקבלת ריכוז סופי של 0.5 מ"ג/מ"ל. יש לחמם מראש את פתרון A ואת תמיסה B באמבט מים של 37 מעלות צלזיוס לפני השימוש.
- מיד לפני תחילת הניסוי, הכינו כלים בגודל 6 ס"מ מלאים ב-PBS סטרילי והניחו אותם על קרח כדי לשמור עליהם קרים במהלך ההליך.
2. זלוף עיכול רקמות כבד
- להרדים את העכבר באמצעות מנת יתר של שאיפת איזופלורן. הנח את העכבר המורדם במצב שכיבה ואבטח אותו עם סרט דבק כדי להקל על ההליך.
- פתח את חלל הבטן של העכבר לאחר עיקור הבטן עם 75% אתנול ולאחר מכן, קשר קשר סביב הווריד הנבוב התחתון באמצעות מחט מחורבנת. שטפו קטטר תוך-ורידי 24 גרם בתמיסה A באמצעות מזרק של 20 מ"ל.
- הכנס את הצנתר התוך-ורידי לתוך הווריד הנבוב התחתון מתחת לקשר, אבטח את הקשר וקבע את הקטטר במקומו בעזרת סרט דבק.
- חדרו את הכבד עם 50 מ"ל של תמיסה A דרך הווריד הנבוב התחתון באמצעות מזרק של 20 מ"ל, וחתכו את וריד שער הכבד כדי לנקז את תמיסת הזלוף. שמור על קצב הזלוף על 10 מ"ל לדקה.
- המשך זלוף עם 30 מ"ל של תמיסה B המכילה קולגנאז II בקצב זרימה של 3.5 מ"ל לדקה באמצעות משאבה פריסטלטית.
הערה: שלב זה מיועד לעיכול רקמת הכבד. - הסר את רקמת הכבד שהוחדרה בהצלחה והניח אותה בכלי בגודל 6 ס"מ מלא ב-PBS סטרילי קר.
3. בידוד כולנגיוציטים
הערה: מכיוון שמספר הכולנגיוציטים בעכברים רגילים נמוך יחסית, מומלץ להשתמש בקבוצה של 2-6 עכברים לצורך ההליך. עם זאת, עבור מודלים של מחלות עכברים עם התפשטות כולנגיוציטים חריגה, כגון PLD, הכולנגיוציטים מעכבר בודד מספיקים. אלא אם צוין אחרת, דגימות וריאגנטים תמיד צריכים להישמר על קרח, ויש לבצע את כל ההליכים בארון בטיחות ביולוגי.
- לנתק ולנער מכנית את רקמת הכבד באמצעות מלקחיים מעוקלים. לאחר מכן, בצע מיקרודיסקציה תחת מיקרוסקופ מנתח כדי להסיר תאים פרנכימליים דבקים, ולהשאיר עץ מרה שלם. הסר את רקמת כיס המרה לפני שתמשיך לשלב הבא.
שטפו את הטישו פעמיים עם PBS. - טוחנים דק את עץ המרה באמצעות להב כירורגי, ומעכלים אותו ב-3 מ"ל של תמיסת עיכול (טבלה 3) לכל עכבר עם ניעור (90 סל"ד) ב-37 מעלות צלזיוס למשך 60 דקות. לאחר 30 דקות, פיפטה בעדינות את התערובת בעזרת קצה פיפטה כדי לערבב היטב.
הערה: יש להכין את תמיסת העיכול לפני השימוש. - העבירו את מתלה התא דרך מסננת תאים של 70 מיקרומטר. השתמש בבוכנה של מזרק של 5 מ"ל או 10 מ"ל כדי ללחוץ בעדינות על מתלה התאים דרך המסננת. שוטפים את המסננת עם PBS.
- צנטריפוגה את מתלה התא ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. שוטפים את התאים פי 3 עם מדיום RPMI.
- שוב צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- השליכו את הסופרנטנט והשעו מחדש את התאים ב-900 מיקרוליטר של מדיום RPMI המכיל 40 U/mL DNase I. הוסיפו 2 מיקרוגרם של נוגדן נגד EpCAM ודגרו את התרחיף על מסובב (20 סל"ד) ב-4 מעלות צלזיוס למשך 45 דקות.
- צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- השליכו את הסופרנטנט והשעו מחדש את התאים ב-1 מ"ל של מדיום RPMI המכיל 40 U/mL DNase I. חרוזי חלבון G לשטיפה מוקדמת עם 1 מ"ל של מדיום RPMI. הוסף 20 מיקרוליטר של חרוזי חלבון G לתרחיף התא ודגירה בסיבוב (20 סל"ד) ב-4 מעלות צלזיוס למשך 45 דקות נוספות.
הערה: ניתן גם לדגור מראש את הנוגדן נגד EpCAM עם חרוזי חלבון G כדי ליצור קומפלקס חרוזים-נוגדנים לפני הכנסת תרחיף התאים. - שטפו את התאים פי 3 עם PBS באמצעות מפריד מגנטי.
- בצע ספירת תאים והערכת כדאיות תאים באמצעות צביעת Trypan Blue (0.04%, 3 דקות) על המוציטומטר.
הערה: אין צורך להוציא את החרוזים מהכולנגיוציטים, הם יתנתקו באופן טבעי עם תחילת התרבות ולא יפריעו לתרבית התאים.
4. תרבות כולנגיוציטים
הערה: הכינו מנות תרבית תאים טריות בציפוי קולגן זנב חולדה מסוג I לפני תרבית כולנגיוציטים. מצננים מראש את כל הריאגנטים על קרח.
- בהתאם להוראות היצרן, ערבבו ddH2O סטרילי, 10x PBS, 1 N NaOH וקולגן זנב חולדה מסוג I כדי להשיג ריכוז סופי של 1 מ"ג/מ"ל קולגן זנב חולדה מסוג I ב-1x PBS. מצפים באופן שווה את כלי תרבית התאים בתערובת, ומניחים את הכלים באינקובטור בחום של 37 מעלות צלזיוס עם 5%CO2 למשך 30 דקות כדי לאפשר לקולגן להתמצק.
- שטפו את כלי תרבית התאים המצופים בקולגן זנב עכברוש מסוג I עם PBS מחומם מראש.
- השעו מחדש את הכולנגיוציטים במדיום תרבית כולנגיוציטים שחומם מראש. זרעו את תרחיף התאים על צלחות תרבית תאים מצופות קולגן של זנב חולדה מסוג I ודגרו בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2. החלף את המדיום כל יומיים.
5. מעבר ושימור בהקפאה של כולנגיוציטים
- שטפו כולנגיוציטים פעמיים עם PBS, ואז דגרו על התאים ב-0.25% טריפסין ב-37 מעלות צלזיוס למשך 5-10 דקות.
- הוסף נפח שווה של מדיום תרבית כולנגיוציטים כדי לנטרל את הטריפסין, ואז צנטריפוגה ב -500 x גרם למשך 5 דקות.
- הכן מנות תרבית תאים מצופות קולגן זנב חולדה מסוג I כמתואר בשלב 4.1.
- בצע את שלבים 4.2 ו-4.3.
- אם נדרש שימור בהקפאה, השעו מחדש את הכולנגיוציטים באמצעי אחסון (9:1 FBS: DMSO) ואחסנו במקפיא של -80 מעלות צלזיוס או בחנקן נוזלי. להפשיר את התאים לפי הצורך לשימוש עתידי.
6. אימות כולנגיוציטים
הערה: טוהר הכולנגיוציטים הוערך על ידי צביעה לסמן כולנגיוציטים CK19.
- שטפו את הכולנגיוציטים פעמיים עם PBS, ואז קבעו את התאים ב-4% פרפורמלדהיד למשך 15 דקות.
- שוטפים את הכולנגיוציטים עם PBS, ואז מחלחלים את התאים עם 1% טריטון X-100 למשך 8 דקות.
- שוטפים את הכולנגיוציטים עם PBS, ואז חוסמים את התאים ב-5% BSA למשך שעה.
- שטפו את הכולנגיוציטים עם PBS, ולאחר מכן דגרו על התאים עם הנוגדן העיקרי נגד CK19 (דילול 1:12 עם 2% BSA) למשך הלילה ב-4 מעלות צלזיוס.
- שטפו את הכולנגיוציטים פעמיים עם PBS, ולאחר מכן דגרו על התאים עם נוגדן משני נגד חולדות חמור Alexa Fluor 488 (דילול 1:1,000 עם PBS) למשך שעה בטמפרטורת החדר.
- שטפו את הכולנגיוציטים עם PBS, צבעו עם 4',6-דיאמידינו-2-פנילינדול למשך 15 דקות, והתבוננו במיקרוסקופ.
תוצאות
דיאגרמת זרימת העבודה עבור תהליך העיכול הדו-שלבי המשמש לבידוד כולנגיוציטים מוצגת באיור 1. ההליך כולו אורך ~5 שעות. ראשית, הכבד מוזרם בתמיסה A דרך הווריד הנבוב התחתון כדי להסיר דם, כפי שמצוין על ידי הכבד מחוויר. לאחר מכן מחדירים לכבד תמיסה B המכילה קולגנאז II כדי להתחיל בעיכול רקמות. שלב עיכול ראשוני זה רגיש לזמן, ועיכול מוצלח מעיד על כך שהרקמה הופכת רכה באופן ניכר. לאחר מכן, דיסוציאציה מכנית וניעור עדין באמצעות מלקחיים מעוקלים מסייעים בהסרת הפטוציטים; עיכול תקין מאושר כאשר מספר רב של הפטוציטים מתנתקים. תחת מיקרוסקופ מנתח, התאים הפרנכימליים הדבקים הנותרים מוסרים בזהירות על ידי מיקרודיסקציה, ומשאירים עץ מרה שלם (איור 2).
בשלב העיכול השני, הרקמה מתפרקת לתרחיף חד-תאי, שעדיין מכיל כמה הפטוציטים ופיברובלסטים. לבסוף, כולנגיוציטים בעלי טוהר גבוה מתקבלים ממתלה זה באמצעות הפרדה אימונומגנטית. הערכת כדאיות התאים בוצעה באמצעות צביעת טריפן בלו על המוציטומטר. התוצאות הדגימו בידוד מוצלח של כולנגיוציטים ברי קיימא (איור 3). צביעה אימונופלואורסצנטית עבור CK19 (איור 4) אישרה ששיטה זו מניבה באופן עקבי כולנגיוציטים של עכברים בטוהר גבוה.
כולנגיוציטים ראשוניים נדבקו בדרך כלל לפני השטח של התרבית ויצרו שכבה חד-שכבתית תוך כ-24 שעות, והפגינו התפשטות מהירה במהלך שלושת המעברים הראשונים, במיוחד במודלים של מחלות עכברים עם התפשטות כולנגיוציטים חריגה, כגון PLD (איור 5). עם זאת, במעברים מאוחרים יותר, קצב הצמיחה פחת, והתאים גדלו ופיתחו מורפולוגיה ואקואולית. אין צורך להסיר את החרוזים מהכולנגיוציטים, הם יתנתקו באופן טבעי עם תחילת התרבות ולא יפריעו לתרבית התאים. שימור והפשרה של תאים לא השפיעו באופן משמעותי על כדאיות התאים.

איור 1: סקירה סכמטית של תהליך העיכול הדו-שלבי עבור בידוד כולנגיוציטים. נתון זה נלקח מ-Ji et al8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תמונה מייצגת של עץ המרה שבודד מעכבר עם מחלת כבד פוליציסטית. אנא לחצו כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: הערכת כדאיות תאים של כולנגיוציטים מבודדים באמצעות צביעת טריפן כחול. פסי קנה מידה = 50 מיקרומטר. החלקיקים השחורים הקטנים המקיפים את התאים ובתוך הרקע הם חרוזי חלבון G. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: הערכת טוהר תאים של כולנגיוציטים מבודדים באמצעות צביעה אימונופלואורסצנטית עבור CK19. פסי קנה מידה: = 50 מיקרומטר [עליון] ו-10 מיקרומטר [תחתון]. נתון זה נלקח מ-Ji et al8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
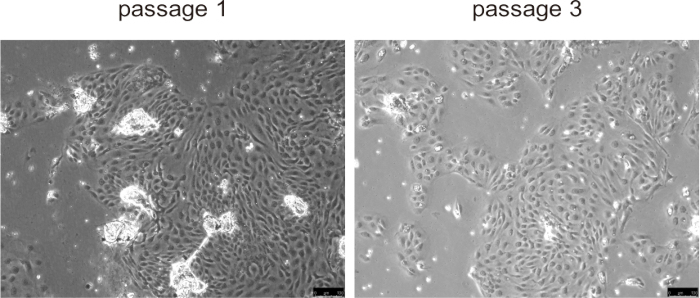
איור 5: תמונות מייצגות של כולנגיוציטים מבודדים במעבר 1 ובמעבר 3. פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| רכיבים | כמות |
| DMEM/F12 (1:1) | 415 מ"ל |
| סרום בקר עוברי (FBS) | 50 מ"ל |
| חומצות אמינו לא חיוניות MEM (פי 100) | 5 מ"ל |
| אינסולין-טרנספרין-סלניום (פי 100) | 5 מ"ל |
| תמיסת ויטמין MEM (פי 100) | 5 מ"ל |
| תרכיז שומנים מוגדר כימית (פי 100) | 5 מ"ל |
| פניצילין-סטרפטומיצין (פי 100) | 5 מ"ל |
| תמיסת גנטמיצין/אמפוטריצין (פי 500) | 1 מ"ל |
| 100 מ"מ עם פירובט | 250 מיקרוליטר |
| 10 מ"ג/מ"ל מעכב טריפסין פולי סויה | 2.5 מ"ל |
| 200 מ"מ L-גלוטמין | 5 מ"ל |
| 10 מ"ג/מ"ל דקסמתזון | 20 מיקרוליטר |
| 1.7 מ"ג/מ"ל 3,3',5-טריודו-L-תירונין | 1 מ"ל |
| 1 מ"ג/מ"ל גורם גדילה אפידרמיס | 12.5 מיקרוליטר |
| 20 מ"מ פורסקולין | 250 מיקרוליטר |
| אתנולמין | 13 מיקרוליטר |
טבלה 1: הרכב מדיום תרבית כולנגיוציטים.
| רכיבים | כמות | |
| פתרון א' | NaCl | 4.0908 גרם |
| KCl | 0.1578 גרם | |
| עד2HPO4 | 0.1072 גרם | |
| הפס | 2.9789 גרם | |
| 50 מ"מ EGTA (PH = 8) | 5 מ"ל | |
| 1.5 מ' MgCl2 | 34 מיקרוליטר | |
| ddH2O | 500 מ"ל | |
| הערה: התאם את ה-pH ל-7.35 באמצעות NaOH סטרילי. | ||
| פתרון ב' | NaCl | 4.0908 גרם |
| KCl | 0.1578 גרם | |
| עד2HPO4 | 0.1072 גרם | |
| הפס | 2.9789 גרם | |
| 2 מטר CaCl2 | 1.25 מ"ל | |
| ddH2O | 500 מ"ל | |
| הערה: התאם את ה-pH ל-7.35 באמצעות NaOH סטרילי. יש להוסיף אבקת קולגנאז II כדי להגיע לריכוז סופי של 0.5 מ"ג/מ"ל לפני השימוש. | ||
טבלה 2: הרכב פתרון A ופתרון B.
| רכיבים | כמות |
| 3.2 מ"ג/מ"ל קולגנאז XI | 300 מיקרוליטר |
| 10 מ"ג/מ"ל היאלורונידאז | 120 מיקרוליטר |
| 10 U/μL DNase I | 12 מיקרוליטר |
| פניצילין-סטרפטומיצין (פי 100) | 30 מיקרוליטר |
| מדיום RPMI | 2.538 מ"ל |
טבלה 3: הרכב תמיסת העיכול.
Discussion
פרוטוקול זה מספק שיטה מפורטת לבידוד כולנגיוציטים ראשוניים בטוהר גבוה מעכברים באמצעות תהליך עיכול דו-שלבי, המאפשר לחקור את המנגנונים המולקולריים העומדים בבסיס כולנגיופתיה. מספר שלבים קריטיים חיוניים כדי להבטיח בידוד מוצלח של כולנגיוציטים.
הצעד הקריטי הראשון הוא הבטחת זלוף ועיכול יעילים באמצעות תמיסה A ותמיסה B. זלוף מוצלח עם תמיסה A אושר על ידי החוורת הכבד, ועיכול מוצלח עם תמיסה B אושר על ידי רכות רקמת הכבד באופן ניכר. כישלון בזלוף יעכב את עיכול רקמת הכבד ויפגע בבידוד הבא של עץ המרה. כדי לשפר את יעילות העיכול, ניתן להגדיל את נפחי תמיסה A ו-B, להפחית את קצב זרימת הזלוף או ללחוץ בעדינות על הכבד בעזרת צמר גפן.
השלב הקריטי השני כולל ניתוק מכני וניעור עדין של רקמת הכבד עם מלקחיים מעוקלים, ולאחר מכן מיקרודיסקציה תחת מיקרוסקופ מנתח כדי להסיר תאים פרנכימליים דבקים ולבודד עץ מרה שלם. שלב זה היה המפתח להשגת כולנגיוציטים בטוהר גבוה. ניתן לשפר את היעילות על ידי אחיזה בצינורות מרה גדולים יותר עם מלקחיים מעוקלים במהלך טלטול ושטיפה עם PBS קר. אם הכבד מתעכל בהצלחה, הפטוציטים רבים יתנתקו, מה שהופך את המיקרודיסקציה לפשוטה יחסית. עם זאת, אם העיכול אינו שלם והדגימה בעלת ערך, תהליך המיקרו-דיסקציה ידרוש מאמץ קפדני, הגדלת עומס העבודה ופוטנציאל להפחתת תפוקת התאים והטוהר. לפיכך, הבטחת זלוף נכון עם תמיסה B לעיכול הכבד הייתה בעלת חשיבות עליונה.
השלב הקריטי השלישי הוא העיכול השני של עץ המרה ליצירת תרחיף חד-תאי. יש לייעל את זמן העיכול על ידי התבוננות בתאים במיקרוסקופ: עיכול יתר עלול להפחית את כדאיות התאים, בעוד שתת עיכול עלול להוביל לרקמת מרה שאינה בשימוש. בנוסף, הכללת אנטיביוטיקה מתאימה בכל הריאגנטים עוזרת למזער את הזיהום.
באמצעות פרוטוקול עיכול דו-שלבי אופטימלי זה, בודדנו בהצלחה כולנגיוציטים בעלי טוהר גבוה ובר קיימא מעכברים. בעוד שמחקר זה התמקד בבידוד כולנגיוציטים ראשוניים ממודלים של עכברים מסוג בר ו-PLD, אנו בטוחים שניתן ליישם את הפרוטוקול גם על מודלים אחרים של עכברי מחלה. תהליך העיכול הראשוני של רקמת הכבד לבידוד עץ המרה, ואחריו שלב עיכול שני, שיפר משמעותית את יעילות ההפרדה האימונומגנטית והניב מספר גבוה יותר של תאים ברי קיימא. הכולנגיוציטים המבודדים התאימו היטב לניסויים אפיגנטיים הדורשים כדאיות גבוהה, כגון ATAC-seq, ChIP-seq, ChIP-seq עם קלט נמוך ו-CUT&TAG. בנוסף, ניתן לתרבת את הכולנגיוציטים הראשוניים הללו במבחנה עבור בדיקות תפקודיות שונות, כולל גידול ציסטי תלת מימדי, התפשטות תאים, אפופטוזיס וניתוח מחזור התא.
במחקר שפורסם בעבר8, בודדנו כולנגיוציטים ראשוניים נורמליים וציסטיים מעכברים מסוג בר ו-PLD משני המינים. פרופיל מולטי-אומיקס של כולנגיוציטים ראשוניים מעכברי PLD זכרים ונקבות חשף דינמיקה אפיגנטית ספציפית למין בכולנגיוציטים במהלך ציסטוגנזה בכבד. יתר על כן, זיהינו אסטרטגיה טיפולית אפיגנטית פוטנציאלית לחולי PLD גברים באמצעות עיכוב פרמקולוגי של אנזימים משנים אפיגנטיים הן במודלים של עכברי PLD והן בניסויים במבחנה עם כולנגיוציטים ראשוניים.
הגישה שלנו מציעה מספר יתרונות בולטים על פני שיטות בידוד כולנגיוציטים שפורסמו כיום. בהשוואה לשיטה של Kudira et al.13, הכוללת עיכול ישיר של רקמת כבד לתרחיף של תא בודד לאחר עיכול זלוף, ואחריו צנטריפוגה שיפוע ובידוד אימונומגנטי, השיטה שלנו פשוטה יותר, חסכונית יותר ויעילה יותר. יתרון מרכזי הוא בידוד עץ המרה לפני בידוד אימונומגנטי, המשפר את התהליך הכולל. בנוסף, על ידי אי דרישה להסרת החרוזים מהכולנגיוציטים, שיטה זו משיגה תשואה גבוהה יותר וכדאיות משופרת של התאים המבודדים. בהשוואה לשיטה של Ueno et al.14, המנתקת וטוחנת את שאריות דרכי הפורטל מזלוף עיכול הכבד לתרבית תלת מימדית, ואחריה תקופת תרבית של 7 ימים לפני יצירת תרחיף של תא בודד, השיטה שלנו חסכונית יותר בזמן. בידוד עץ המרה, ואחריו בידוד אימונומגנטי, משפר משמעותית גם את טוהר התאים.
עם זאת, למרות היתרונות הללו, לטכניקת העיכול הדו-שלבי שלנו עדיין יש כמה מגבלות. הוא עתיר עבודה יחסית, מאפשר רק מספר מוגבל של קטעים, ודורש מיקרו-דיסקציה זהירה כדי למנוע זיהום פרנכימלי.
לסיכום, פיתחנו וביצענו אופטימיזציה של שיטת עיכול דו-שלבית לבידוד כולנגיוציטים ראשוניים בעלי טוהר גבוה וכדאיות גבוהה מעכברים. גישה זו מספקת כלי רב ערך לחקר המנגנונים המולקולריים העומדים בבסיס כולנגיופתיה ומציעה בסיס לזיהוי אסטרטגיות טיפוליות פוטנציאליות.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מוועדת החינוך העירונית של טיאנג'ין (2022ZD054 ל-L.Z.)
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
References
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved