Method Article
多発性嚢胞性肝疾患マウスからの初代胆管細胞の単離と培養
要約
このプロトコールは、野生型マウスおよび多発性嚢胞性肝疾患のマウスから高純度で生存率の高い初代胆管細胞を単離するための最適化された2段階消化法について説明しています。
要約
このプロトコールでは、野生型マウスおよび多発性嚢胞性肝疾患(PLD)マウスから高純度で生存率の高い初代胆管細胞を単離するための2段階消化法を最適化しました。マウスに麻酔をかけた後、肝臓を50mLの溶液Aで下大静脈を通して灌流し、続いて37°Cで30mLの溶液Bを灌流して肝臓組織を酵素的に消化した。機械的解離、振とう、および顕微解剖が行われ、付着した実質細胞が除去され、無傷の胆道樹が残されました。その後、胆道樹を細かく刻み、37°Cで60分間振とうしながら消化しました。 得られたシングルセル懸濁液は、70μmセルストレーナーを使用して回収しました。胆管細胞は免疫磁気分離を用いて精製した。細胞懸濁液を抗EpCAM抗体と4°Cで45分間回転させてインキュベートした後、Protein Gビーズを添加し、さらに4°Cで45分間回転させました。 PBSで3回洗浄した後、磁性セパレーターを使用して胆管細胞を採取しました。精製した初代胆管細胞を胆管細胞培養培地に再懸濁し、1 mg/mL I型ラットテールコラーゲンでコーティングした細胞培養皿に播種しました。胆管細胞の純度は、胆管細胞特異的マーカーサイトケラチン-19(CK19)の免疫染色によって確認されました。この研究は、野生型マウスとPLDマウスからの初代胆管細胞の単離に焦点を当てていますが、このプロトコルは他の疾患マウスモデルにも適用できると確信しています。この詳細な2段階消化法は、胆管症の in vitro 研究と標的療法の開発を促進します。
概要
胆管細胞は、肝内胆道樹の内側を覆う上皮細胞であり、単層を形成し、肝臓の全細胞集団の約3〜5%を占めています1。これらの細胞は肝臓内で相互接続して、複雑な三次元の乳管ネットワークを形成します2。正常な条件下では、胆管細胞は分泌、吸収、損傷修復、免疫バリアなどの重要な機能を果たし、それによって肝臓の生理学と病理学において重要な役割を果たします。しかし、胆管細胞の機能障害は、PLD、原発性硬化性胆管炎、胆管癌、胆汁うっ滞性肝障害など、さまざまな疾患を引き起こす可能性があります3,4,5。
胆管障害関連疾患の中でも、PLDは胆管細胞に由来する多数の液体で満たされた嚢胞が形成されることを特徴とする遺伝性疾患として際立っています。これらの嚢胞の進行性拡大は、患者の生活の質を著しく低下させます6。PLDの現在の治療選択肢は依然として不十分であり、有効性は限られており、多くの場合、高い再発率と合併症に関連しています7。このことは、PLD管理における満たされていない臨床需要に対処するための安全で効果的な治療戦略を開発する緊急の必要性を浮き彫りにしています。
PLDを含む胆管症のメカニズムに関する研究は、適切な細胞株の不足によって大きく妨げられてきました。この制限に対処するために、疾患マウスモデルの使用と、 in vitro 実験のためのこれらのモデルからの初代胆管細胞の単離は、胆管障害の根底にある分子メカニズムを明らかにし、潜在的な治療戦略を特定するために非常に貴重であることが証明されています。
最近の研究8では、Pkd1コンディショナルノックアウト(KO)マウスを用いてPLDマウスモデルを確立することに成功しました。肝嚢胞は、Pkd1欠失の1か月後という早い時期に観察され、時間の経過とともにサイズが徐々に増加しました。ラットやヒトから胆管細胞を単離するためのプロトコルは十分に文書化されています9,10、マウスから初代胆管細胞を単離することは、そのサイズが小さく、門脈と胆道系の複雑な構造のために特に困難です。既存の方法は、細胞純度の低さ、生存率の低下、複雑な手順、高コストなど、大きな制限に直面しています11,12。
この原稿では、2段階の消化法を用いてマウスから高純度初代胆管細胞を単離するための詳細なプロトコールを提示しています。この最適化されたアプローチは、 in vitro 研究をサポートし、胆管症の根底にある分子メカニズムの調査を促進し、新しい治療戦略の開発を進めることを目的としています。
プロトコル
すべてのマウスケアおよび実験プロトコルは、天津医科大学の倫理委員会によって承認されました(文書番号:TMUa-MEC 2022016)。
1. 機器と溶液の準備
- 手術器具(はさみ、鉗子、メスの柄)は、細胞単離の少なくとも1日前にオートクレーブして滅菌します。
- 細胞単離の少なくとも1日前に、 表1 に記載されている試薬を使用してCholangiocyte Culture Mediumを調製します。胆管細胞培養培地を0.22μmフィルターでろ過して滅菌します。
- 細胞単離の少なくとも1日前に、 表2 にリストされている試薬を使用して、マウス肝灌流用の溶液Aおよび溶液Bを調製します。溶液Aと溶液Bをオートクレーブまたは0.22μmフィルターでろ過して滅菌し、穏やかに攪拌しながら滅菌NaOHを使用してpHを7.35に調整します。
注:胆管細胞培養液、溶液A、および溶液Bは、4°Cで少なくとも1ヶ月間保存できます。 - 実験を開始する前に、コラゲナーゼII粉末を溶液Bに加え、穏やかに混合して最終濃度0.5 mg/mLにします。使用前に、溶液Aと溶液Bの両方を37°Cのウォーターバスで予温してください。
- 実験を始める前に、滅菌PBSを充填した6cmの皿を準備し、氷の上に置いて、手順中に冷たく保ちます。
2.肝臓組織消化灌流
- イソフルラン吸入の過剰摂取を使用してマウスに麻酔をかけます。.麻酔をかけたマウスを仰臥位に置き、手技を容易にするために粘着テープで固定します。
- 腹部を75%エタノールで滅菌した後、マウスの腹腔を開き、スエージ針を使用して下大静脈の周りにスリップノットを結びます。20mLシリンジを使用して、24Gの静脈内カテーテルを溶液Aですすいでください。
- スリップノットの下の下大静脈に静脈カテーテルを挿入し、スリップノットを固定し、カテーテルを粘着テープで固定します。
- 20 mLの注射器を使用して、下大静脈から50 mLの溶液Aで肝臓を灌流し、肝門脈を切開して灌流溶液を排出します。.灌流速度を10 mL/minに維持します。
- コラゲナーゼIIを含む30 mLの溶液Bを、ペリスタルティックポンプを使用して3.5 mL/分の流速で灌流を続けます。
注:このステップは、肝臓組織の消化を目的としています。 - 正常に灌流された肝臓組織を取り出し、冷たく滅菌したPBSで満たされた6cmの皿に入れます。
3.胆管細胞の分離
注:正常なマウスの胆管細胞の数は比較的少ないため、手順には2〜6匹のマウスのグループを使用することをお勧めします。しかし、PLDのように胆管細胞の増殖が異常であるマウス疾患モデルでは、1匹のマウスの胆管細胞で十分です。特に指定がない限り、サンプルと試薬は常に氷上に保管する必要があり、すべての手順は生物学的安全キャビネットで実行する必要があります。
- 湾曲した鉗子を使用して肝臓組織を機械的に解離し、振とうします。その後、解剖顕微鏡下で顕微解剖を行い、付着した実質細胞を除去し、無傷の胆道樹を残します。次のステップに進む前に胆嚢組織を取り外してください。
ティッシュをPBSで2回洗います。 - サージカルブレードを使用して胆道樹を細かく刻み、マウス1匹あたり3 mLの消化液(表3)で37°C(90 rpm)で60分間振とうします。30分経過したら、ピペットチップを使用して混合物を静かにピペットで動かし、完全に混合します。
注意: 消化液は、使用前に新たに調製する必要があります。 - 細胞懸濁液を70μmのセルストレーナーに通します。5 mLまたは10 mLシリンジのプランジャーを使用して、細胞懸濁液をストレーナーに優しく押し込みます。ストレーナーをPBSで洗います。
- 細胞懸濁液を500 x g で4°Cで5分間遠心分離します。 細胞をRPMI培地で3回洗浄します。
- 再度、500 x g で4°Cで5分間遠心分離します。
- 上清を捨て、40 U/mL DNase I.を含む900 μLのRPMI培地に細胞を再懸濁し、2 μgの抗EpCAM抗体を加え、懸濁液をローテーター(20 rpm)で4°Cで45分間インキュベートします。
- 500 x g で4°Cで5分間遠心分離します。
- 上清を捨て、40 U/mL DNase I.を含むRPMI培地1 mLに細胞を再懸濁します。プロテインGビーズを1 mLのRPMI培地でプレウォッシュします。20 μLのProtein G Beadsを細胞懸濁液に加え、4°Cで回転(20 rpm)してさらに45分間インキュベートします。
注:抗EpCAM抗体は、細胞懸濁液を導入する前に、Protein Gビーズとプレインキュベートしてビーズ抗体複合体を作製することもできます。 - 磁気セパレーターを使用して細胞をPBSで3回洗浄します。
- 血球計算盤でTrypan Blue染色(0.04%、3分)を使用して、細胞カウントと細胞生存率評価を行います。
注:胆管細胞からビーズを取り除く必要はなく、培養が始まると自然に分離し、細胞培養に支障をきたすことはありません。
4.胆管細胞培養
注:胆管細胞の培養前に、新鮮なI型ラットテールコラーゲンコーティング細胞培養皿を準備してください。すべての試薬を氷上で予冷します。
- 製造元の指示に従って、滅菌済みのddH2O、10x PBS、1 N NaOH、およびI型ラットテールコラーゲンを混合し、1x PBS中に1 mg/mLの最終濃度1 mg/mLを達成します。細胞培養皿を混合物で均一にコーティングし、皿を5%CO2を含む37°Cのインキュベーターに30分間置いて、コラーゲンを固化させます。
- I型ラットテールコラーゲンでコーティングした細胞培養皿を、予め温めたPBSで洗浄します。
- 胆管細胞を予熱した胆管細胞培養培地に再懸濁します。細胞懸濁液を1 mg/mLのI型ラットテールコラーゲンコーティング細胞培養皿に播種し、5% CO2とともに37°Cでインキュベートします。2日ごとにメディウムを交換してください。
5. 胆管細胞の継代と凍結保存
- 胆管細胞をPBSで2回洗浄し、細胞を0.25%トリプシンで37°Cで5〜10分間インキュベートします。
- 等量の胆管細胞培養培地を添加してトリプシンを中和し、500 x g で5分間遠心分離します。
- ステップ4.1で説明したように、I型ラットテールコラーゲンコーティング細胞培養皿を調製します。
- 手順 4.2 と 4.3 に従います。
- 凍結保存が必要な場合は、胆管細胞をStorage Medium(9:1 FBS:DMSO)に再懸濁し、-80°Cの冷凍庫または液体窒素で保存します。将来の使用のために必要に応じてセルを解凍します。
6. 胆管細胞の検証
注:胆管細胞の純度は、胆管細胞マーカーCK19の染色によって評価されました。
- 胆管細胞をPBSで2回洗浄し、細胞を4%パラホルムアルデヒドに15分間固定します。
- 胆管細胞をPBSで洗浄し、1%Triton X-100で細胞を8分間透過処理します。
- 胆管細胞をPBSで洗浄し、次いで細胞を5%BSA中で1時間ブロックする。
- 胆管細胞をPBSで洗浄し、CK19に対する一次抗体(2% BSAで1:12に希釈)と細胞を4°Cで一晩インキュベートします。
- 胆管細胞をPBSで2回洗浄し、ロバ抗ラットAlexa Fluor 488二次抗体(PBSで1:1,000に希釈)と室温で1時間インキュベートします。
- 胆管細胞をPBSで洗浄し、4',6-ジアミジノ-2-フェニルインドールで15分間染色し、顕微鏡で観察します。
結果
胆管細胞の単離に使用される2段階の消化プロセスのワークフロー図を 図1に示します。全体の手順には~5時間かかります。まず、肝臓が青白くなることからわかるように、肝臓に下大静脈を介して溶液Aを灌流して血液を取り除きます。次に、コラゲナーゼIIを含む溶液Bを肝臓に灌流して、組織の消化を開始します。この最初の消化ステップは時間に敏感であり、成功した消化は組織が著しく柔らかくなることによって証明されます。次に、湾曲した鉗子を使用した機械的解離と穏やかな振とうが肝細胞の除去に役立ちます。適切な消化は、多数の肝細胞が分離すると確認されます。解剖顕微鏡下で、残りの付着性実質細胞をマイクロダイセクションによって慎重に除去し、無傷の胆道樹を残します(図2)。
2番目の消化ステップでは、組織は単一細胞懸濁液に分解されますが、これにはまだ一部の肝細胞と線維芽細胞が含まれています。最後に、この懸濁液から免疫磁気分離により高純度の胆管細胞が得られます。細胞生存率の評価は、血球計算盤でのトリパンブルー染色を使用して実施しました。その結果、生存率の高い胆管細胞の単離が成功したことが実証されました(図3)。CK19の免疫蛍光染色(図4)により、この方法で一貫して高純度のマウス胆管細胞が得られることが確認されました。
初代胆管細胞は通常、培養表面に付着し、約24時間以内に単層を形成し、特にPLDなどの異常な胆管細胞増殖を伴うマウス疾患モデルにおいて、最初の3回の継代中に急速な増殖を示しました(図5)。しかし、継代が遅くなると、増殖速度が低下し、細胞が大きくなり、空胞状の形態が発達しました。胆管細胞からビーズを取り除く必要はなく、培養が始まると自然に分離し、細胞培養に支障をきたすことはありません。細胞の凍結保存と融解は、細胞の生存率に大きな影響を与えませんでした。

図1:胆管細胞単離のための2段階の消化プロセスの概略図概要。 この図はJi et al8から引用した。 この図の拡大版を表示するには、ここをクリックしてください。

図2:多発性嚢胞性肝疾患のマウスから分離された胆道樹の代表的な画像。この図の拡大版を表示するには、ここをクリックしてください。

図3:トリパンブルー染色を用いた単離された胆管細胞の細胞生存率評価。スケールバー = 50 μm。 細胞を取り囲み、背景にある小さな黒い粒子がプロテインGビーズです。 この図の拡大版を表示するには、ここをクリックしてください。

図4:CK19の免疫蛍光染色を用いた単離された胆管細胞の細胞純度評価。 スケールバー:= 50 μm [上]および10 μm [下]。この図はJi et al8から引用した。 この図の拡大版を表示するには、ここをクリックしてください。
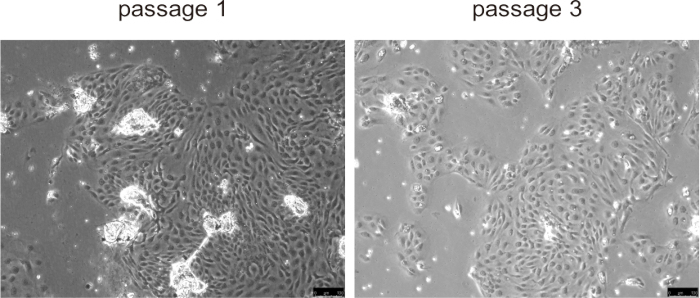
図5:通路1と通路3の単離された胆管細胞の代表的な画像。 スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
| コンポーネント | 量 |
| DMEM/F12 (1:1) | 415ミリリットル |
| ウシ胎児血清(FBS) | 50ミリリットル |
| MEM非必須アミノ酸(100x) | 5ミリリットル |
| インスリン-トランスフェリン-セレン (100x) | 5ミリリットル |
| MEMビタミン溶液(100x) | 5ミリリットル |
| 既知組成脂質濃縮物(100x) | 5ミリリットル |
| ペニシリン-ストレプトマイシン(100x) | 5ミリリットル |
| ゲンタマイシン/アンホテリシン溶液 (500x) | 1 mLの |
| 100 mM Naピルビン酸 | 250μL |
| 10 mg / mL大豆トリプシン阻害剤 | 2.5ミリリットル |
| 200 mM L-グルタミン | 5ミリリットル |
| 10 mg / mLデキサメタゾン。 | 20μL |
| 1.7 mg/mL 3,3',5-トリヨード-L-チロニン | 1 mLの |
| 1 mg / mL上皮成長因子 | 12.5 μL |
| 20 mM フォルスコリン | 250μL |
| エタノールアミン | 13μL |
表1:胆管細胞培養液の組成。
| コンポーネント | 量 | |
| ソリューションA | NaClの | 4.0908 グラム |
| KClの | 0.1578 グラム | |
| Na2HPO4 | 0.1072 グラム | |
| ヘープス | 2.9789 グラム | |
| 50mM EGTA (PH = 8) | 5ミリリットル | |
| 1.5 M MgCl2 | 34μL | |
| ddHの2O | 500ミリリットル | |
| 注:滅菌NaOHを使用してpHを7.35に調整します。 | ||
| ソリューションB | NaClの | 4.0908 グラム |
| KClの | 0.1578 グラム | |
| Na2HPO4 | 0.1072 グラム | |
| ヘープス | 2.9789 グラム | |
| 2 M CaCl2 | 1.25ミリリットル | |
| ddHの2O | 500ミリリットル | |
| 注:滅菌NaOHを使用してpHを7.35に調整します。コラゲナーゼII粉末は、使用前に最終濃度0.5 mg/mLになるように添加する必要があります。 | ||
表2:ソリューションAとソリューションBの組成。
| コンポーネント | 量 |
| 3.2 mg/mLコラゲナーゼXI | 300μL |
| 10 mg/mL ヒアルロニダーゼ | 120μL |
| 10 U/μL DNase I | 12 μL |
| ペニシリン-ストレプトマイシン(100x) | 30μL |
| RPMIミディアム | 2.538ミリリットル |
表3:消化液の組成。
ディスカッション
このプロトコルは、2段階の消化プロセスを使用してマウスから高純度初代胆管細胞を単離するための詳細な方法を提供し、胆管障害の根底にある分子メカニズムの研究を可能にします。胆管細胞の分離を成功させるためには、いくつかの重要なステップが不可欠です。
最初の重要なステップは、溶液Aと溶液Bを使用して効果的な灌流と消化を確保することです.溶液Aによる灌流の成功は肝臓が青白くなることで確認され、溶液Bによる消化の成功は肝臓組織が著しく柔らかくなることで確認されました。灌流に失敗すると、肝臓組織の消化が妨げられ、その後の胆道樹の分離が損なわれます。消化効率を高めるために、溶液Aと溶液Bの量を増やすか、灌流流量を減らすか、綿棒で肝臓を優しく圧迫することができます。
2番目の重要なステップは、湾曲した鉗子で肝臓組織を機械的に解離し、穏やかに振とうし、続いて解剖顕微鏡下でマイクロダイセクションを行い、付着した実質細胞を除去し、無傷の胆道樹を分離することです。このステップは、高純度の胆管細胞を得るための鍵でした。効率は、振とうおよび冷たいPBSですすいだときに湾曲した鉗子でより大きな胆管をつかむことによって改善することができます。肝臓がうまく消化されると、多くの肝細胞が剥離し、マイクロダイセクションが比較的簡単になります。しかし、分解が不完全でサンプルが貴重な場合、マイクロダイセクションプロセスは骨の折れる作業を必要とし、作業負荷が増加し、細胞収量と純度の両方が低下する可能性があります。したがって、肝臓の消化のために溶液Bによる適切な灌流を確保することが最も重要でした。
3番目の重要なステップは、胆道樹の2回目の消化で、単一細胞懸濁液を生成することです。消化時間は、顕微鏡下で細胞を観察することによって最適化されるべきです:過剰消化は細胞の生存率を低下させる可能性があり、消化不足は未使用の胆道組織につながる可能性があります。さらに、すべての試薬に適切な抗生物質を含有させることで、コンタミネーションを最小限に抑えることができます。
この最適化された2段階消化プロトコルを使用して、マウスから高純度で生存率の高い胆管細胞を単離することに成功しました。この研究は、野生型マウスモデルおよびPLDマウスモデルからの初代胆管細胞の単離に焦点を当てていますが、このプロトコルは他の疾患マウスモデルにも適用できると確信しています。胆道樹を単離するための最初の肝臓組織消化のプロセスと、それに続く2番目の消化ステップのプロセスにより、免疫磁気分離の効率が大幅に向上し、より多くの生存細胞が得られました。単離された胆管細胞は、ATAC-seq、ChIP-seq、低インプットChIP-seq、CUT&TAGなど、高い生存率を必要とするエピジェネティックな実験によく適していました。さらに、これらの初代胆管細胞は、3D嚢胞性増殖、細胞増殖、アポトーシス、細胞周期解析など、さまざまな機能アッセイのために in vitro で培養することができます。
以前に発表された研究8では、野生型マウスとPLDマウスの男女両方から正常初代胆管細胞と嚢胞性初代胆管細胞の両方を単離しました。PLDマウスの初代胆管細胞のマルチオミクスプロファイリングにより、肝嚢胞形成期の胆管細胞の性特異的なエピジェネティックダイナミクスが明らかになりました。さらに、PLDマウスモデルと初代胆管細胞を用いた in vitro 実験の両方で、エピジェネティックな修飾酵素の薬理学的阻害を通じて、男性のPLD患者に対する潜在的なエピジェネティックな治療戦略を特定しました。
私たちのアプローチは、現在公開されている胆管細胞の単離方法に比べて、いくつかの注目すべき利点を提供します。灌流消化後に肝臓組織を直接単一細胞懸濁液に消化し、その後に勾配遠心分離と免疫磁気分離を行うKudira et al.13の方法と比較して、私たちの方法はよりシンプルで、費用対効果が高く、効率的です。主な利点は、免疫磁気分離の前に胆道樹を分離することで、全体的なプロセスを改善することです。さらに、胆管細胞からビーズを除去する必要がないため、この方法では、単離された細胞のより高い収率と生存率の向上が達成されます。Ueno et al.14 の方法と比較して、肝臓消化灌流から門脈路残留物を解離してミンチにし、その後 7 日間の培養期間を経てシングルセル懸濁液を生成するため、当社の方法はより時間効率が良いです。胆道樹の単離とそれに続く免疫磁気単離も、細胞の純度を大幅に向上させます。
しかし、これらの利点にもかかわらず、私たちの2段階消化技術にはまだいくつかの制限があります。比較的手間がかかり、限られた数の継代しかできず、実質汚染を避けるためには慎重なマイクロダイセクションが必要です。
結論として、マウスから高純度で生存率の高い初代胆管細胞を単離するための2段階消化法を開発し、最適化しました。このアプローチは、胆管障害の根底にある分子メカニズムを研究するための貴重なツールを提供し、潜在的な治療戦略を特定するための基盤を提供します。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、天津市教育委員会からの助成金(2022ZD054からL.Z.まで)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
参考文献
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved