Method Article
Implante de Eletroencefalograma e Telecardiograma em Kits Neonatais para Coelhos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os mecanismos de morte súbita inesperada na epilepsia (SUDEP) são pouco compreendidos e difíceis de traduzir a partir dos modelos atuais. Coelhos transgênicos podem oferecer informações sobre esses mecanismos. Descrevemos um método para eletroencefalografia contínua de longo prazo e registros eletrocardiográficos em kits de coelhos transgênicos para avaliar eventos graves que podem levar à morte.
Resumo
Variantes patogênicas em genes de canais iônicos estão associadas a uma alta taxa de morte súbita inesperada na epilepsia (SUDEP). Os mecanismos da SUDEP são pouco compreendidos, mas podem envolver disfunção autonômica e arritmias cardíacas, além de convulsões. Alguns genes de canais iônicos são expressos no cérebro e no coração, aumentando potencialmente o risco de SUDEP em pacientes com canalopatias iônicas associadas a epilepsia e arritmias cardíacas. Coelhos transgênicos que expressam variantes de epilepsia fornecem um organismo inteiro para estudar a complexa fisiologia da SUDEP. É importante ressaltar que os coelhos replicam mais de perto a fisiologia cardíaca humana do que os modelos de camundongos. No entanto, os modelos de coelhos têm considerações adicionais de saúde e anestesia quando submetidos a procedimentos de monitoramento invasivos. Desenvolvemos um novo método para implantar cirurgicamente um dispositivo de telemetria para monitoramento simultâneo de eletroencefalograma (EEG) e eletrocardiograma (ECG) de longo prazo em kits de coelhos neonatais. Aqui, demonstramos métodos cirúrgicos para implantar um dispositivo de telemetria em kits P14 (faixa de peso 175-250 g) com atenção detalhada à abordagem cirúrgica, anestesia e monitoramento adequados e cuidados pós-operatórios, resultando em uma baixa taxa de complicações. Este método permite o monitoramento contínuo da eletrofisiologia neural e cardíaca durante pontos críticos no desenvolvimento de arritmias cardíacas, convulsões e potencial SUDEP em modelos de coelhos de epilepsias genéticas ou adquiridas.
Introdução
A morte súbita inesperada na epilepsia (SUDEP) é uma das principais causas de morte em pacientes com epilepsia. Os mecanismos da SUDEP são pouco compreendidos, mas potencialmente envolvem disfunção autonômica, apneia e arritmias cardíacas, além de convulsões 1,2,3,4,5,6,7. Pacientes com epilepsias genéticas ligadas à canalopatia têm uma das taxas mais altas de SUDEP. Por exemplo, a SUDEP ocorre em até 20% dos pacientes com variantes no gene do canal de sódio dependente de voltagem SCN1A8, o gene responsável pela síndrome de Dravet, uma epilepsia genética com início no primeiro ano de vida. Muitos genes de canais iônicos ligados à epilepsia são expressos no cérebro e no coração, com dados laboratoriais e clínicos sugerindo que arritmias cardíacas podem estar presentes em pacientes com epilepsias genéticas ligadas à canalopatia7, 9,10,11,12, aumentando potencialmente o risco de SUDEP devido a uma arritmia cardíaca fatal induzida por convulsão ou ocorrência simultânea de convulsões e arritmias. Avaliar a SUDEP no ambiente laboratorial apresenta inúmeros desafios. Do ponto de vista cardíaco, os potenciais de ação cardíacos em camundongos são muito diferentes dos humanos13, e os modelos de miócitos cardíacos iPSC humanos14 não podem replicar as complexidades de todo o organismo. Modelos transgênicos de epilepsias genéticas em coelhos fornecem um sistema ideal para estudar a SUDEP, pois a fisiologia cardíaca do coelho replica mais de perto a do humano13,15, ao mesmo tempo em que fornece um organismo inteiro para estudar a fisiopatologia complexa. Como a SUDEP pode ocorrer já na primeira convulsão, avaliar esses modelos animais desde o início é essencial para entender o início das convulsões e arritmias cardíacas. A gravação de vídeo durante o período neonatal é um desafio, pois os filhotes de coelhos geralmente ainda estão no ninho. O registro contínuo de eletroencefalograma (EEG) ou eletrocardiograma (ECG) com um sistema tradicional com fio não é possível enquanto os kits estiverem com a barragem. É improvável que o registro intermitente capture eventos terminais raros associados à SUDEP. Portanto, recorremos ao monitoramento de telemetria implantável sem fio para fornecer registro de EEG e ECG de longo prazo, contínuo e simultâneo em kits de coelhos.
As chaves para o sucesso neste protocolo são o suporte anestésico e pós-operatório adequado para esses animais vulneráveis. Os coelhos apresentam um risco muito maior de morte anestésica (1,39%-4,8%) em comparação com cães e gatos (0,17%-0,24%) devido às características anatômicas e fisiológicas únicas16,17. Os principais contribuintes para esse aumento do risco anestésico incluem o manejo subótimo das vias aéreas e complicações pós-operatórias agudas. Múltiplos fatores contribuem para a dificuldade de intubação em coelhos, incluindo boca longa e estreita com língua larga, ângulo agudo entre a boca e a laringe, deslocamento dorsal da epiglote, aumento da suscetibilidade ao trauma laríngeo e aumento da propensão ao laringoespasmo 18,19,20. Após o episódio anestésico imediato, os coelhos correm o risco de desenvolver síndrome de estase gastrointestinal com risco de vida. Este é um problema complexo e multifatorial, e postula-se que a anestesia contribua por meio de efeitos diretos de drogas que inibem a motilidade gástrica e/ou anorexia secundária pós-procedimento por qualquer motivo (dor não aliviada, náusea, etc.)21.
A fisiologia única de recém-nascidos e bebês de coelhos agrava os desafios associados à anestesia e à cirurgia. Os coelhos têm filhotes altriciais nascidos com mecanismos subdesenvolvidos para homeostase fisiológica e considerações anatômicas especiais. O acesso intravenoso e o monitoramento são difíceis, pois a maioria dos produtos comerciais não é otimizada para o pequeno tamanho vascular, alta frequência cardíaca em repouso e pele pigmentada dos kits de coelhos com cinto holandês e cruz branca da Nova Zelândia. Como o débito cardíaco é essencialmente dependente da frequência cardíaca em neonatos22 e, em geral, a depuração do medicamento por via renal ou hepática é diminuída em comparação com adultos23, as considerações para a seleção e dosagem adequadas do medicamento são críticas. Acredita-se que a principal causa de morte anestésica em coelhos seja secundária à depressão respiratória e apneia. Além dos problemas de manejo das vias aéreas já discutidos para todos os coelhos, os neonatos apresentam um impulso respiratório deprimido diante da hipoxemia e hipercapnia, tornando esse aspecto já desafiador da anestesia mais arriscado24.
Neste protocolo, descrevemos um método bem-sucedido para implante de telemetria de EEG e ECG (Figura 1) em um modelo de epilepsia de coelho neonatal com alta taxa de sobrevida cirúrgica e anestésica. Essas informações permitirão que outros pesquisadores enfrentem modelos desafiadores de coelhos neonatais para avançar na pesquisa sobre epilepsia, arritmia cardíaca e distúrbios relacionados ao neurodesenvolvimento.
Protocolo
Todo o trabalho descrito foi revisado e aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Michigan como parte de um protocolo de uso de animais aprovado e está de acordo com as leis e diretrizes federais relevantes, incluindo a Lei de Bem-Estar Animal do USDA e a Política de Serviço de Saúde Pública do NIH. A Universidade de Michigan é uma instituição credenciada pela AAALACi.
1. Preparação animal
- Kits de barbear áspero (idade P14-P19, peso >175 g) 1-2 dias antes do procedimento para minimizar o tempo de anestesia no dia da cirurgia usando tesouras.
- Autoclave ou esterilize a gás todas as ferramentas e materiais cirúrgicos (conforme possível) em preparação para o procedimento.
- Induza a anestesia com cetamina (10 mg/kg IM), buprenorfina HCl (0,01 mg/kg IM) 0,3 mg/mL diluído a 0,03 mg/mL e sevoflurano e oxigênio por meio de máscara de anestesia usando um circuito sem reinalação.
- Coloque um cateter intravenoso (IV) 26 G 3/4" na veia auricular (preferencial) ou na veia cefálica e lave com solução salina heparinizada 10 unidades/mL.
- Depile o abdômen, peito, costas, pescoço e cabeça o mais próximo possível da pele usando uma lâmina #40 ou #50.
- Aplique pomada oftálmica lubrificante não medicamentosa para prevenir a ulceração da córnea.
- Administre analgésicos (carprofeno 4 mg/kg SQ - diluído a 25 mg/mL) e antibiótico perioperatório (cefazolina 20 mg/kg IV diluído a 50 mg/mL). Readministre antibióticos a cada 90-180 minutos de tempo cirúrgico.
2. Preparo cirúrgico (Figura 2)
- Transfira o kit anestesiado para a mesa cirúrgica e coloque-o em decúbito dorsal em uma almofada de aquecimento infravermelho controlada por um termômetro retal.
- Coloque o nariz e a boca em uma máscara facial impressa em 3D personalizada conectada com um conector giratório a um circuito Jackson-Rees sem reinalação (bolsa de 0,5 L) e mantenha a anestesia com sevoflurano (1,5% -7% para efeito) com fluxo de oxigênio a 2 L / min.
- Mantenha a anestesia com sevoflurano e monitore a profundidade da anestesia com um oxímetro de pulso na orelha ou na pata e/ou um Doppler na artéria femoral ou diretamente no coração.
- Ajuste a anestesia durante todo o procedimento para manter a frequência cardíaca (FC) entre 180-260, saturação de oxigênio >85% e frequência respiratória entre 10-50 respirações por minuto (visualização direta de excursões ou movimento da bolsa de reinalação).
NOTA: Tenha medicamentos de emergência disponíveis (glicopirrolato, epinefrina, doxapram). - Prenda o kit à máscara facial colando suavemente os membros dianteiros na máscara.
- Posicione o kit em uma posição ligeiramente lateral direita, prendendo frouxamente a perna traseira esquerda à mesa de operação.
- Prepare todo o abdômen com uma esfoliação cirúrgica aquecida alternando betadina e soro fisiológico estéril.
NOTA: Uma solução cirúrgica adicional pode ser usada para finalizar a esfoliação, se desejado. O cirurgião, usando jalecos dedicados, gorro de cabelo e capas de sapato, esfregará assepticamente e vestirá aventais e luvas estéreis para realizar o procedimento em condições estéreis. - Coloque toalhas cirúrgicas adesivas em ambos os lados do kit e cubra-o com uma grande cortina cirúrgica. Faça um orifício de tamanho apropriado para expor o abdômen e o peito.
- Abra o implante no campo cirúrgico e coloque suturas de âncora não absorvíveis em cada um dos orifícios de ancoragem do implante. Deixe a sutura presa com uma cauda de 5-6 cm (Figura 3A). Coloque o implante em uma tigela de solução salina estéril aquecida.
3. Colocação do implante no abdômen
- Depois de garantir a anestesia adequada, faça uma incisão de 3 cm através da pele ao longo da linha alba com um bisturi.
- Faça uma incisão cuidadosa através do músculo para abrir a cavidade peritoneal.
- Coloque o implante na porção cranial da cavidade abdominal e posicione-o à esquerda da incisão.
- Use um trocarte para tunelar o fio de ECG negativo para fora da cavidade peritoneal e da pele aproximadamente 2 cm à direita da incisão. Encapsule os 3 fios restantes 3-4 cm à esquerda da incisão para permitir que o implante se encaixe confortavelmente dentro da cavidade peritoneal.
- Prenda o implante com os pontos de ancoragem na parede ventral da cavidade peritoneal, garantindo que não haja aprisionamento intestinal (Figura 3B).
- Feche a parede abdominal com uma sutura absorvível em um padrão contínuo.
- Feche a incisão na pele com uma sutura não absorvível em um padrão interrompido.
4. Colocação das derivações de ECG
- Tunelamente a derivação negativa do ECG por via subcutânea para a parte superior direita do tórax, ao nível da primeira costela.
- Disseque sem rodeios uma bolsa subcutânea para enrolar frouxamente aproximadamente 10 cm de fio.
NOTA: Bobinas apertadas sob a pele podem levar à erosão da pele e à exposição do fio. - Corte o excesso de fio e crie um laço com o fio exposto amarrando a extremidade ao fio isolado com uma sutura não absorvível.
- Prenda o laço ao músculo com 2 suturas não absorvíveis.
- Feche o músculo peritoneal à direita ao redor do fio com 1-2 suturas absorvíveis em um padrão interrompido.
- Feche a pele na parte superior direita do tórax e abdômen direito com 2-3 suturas não absorvíveis em um padrão interrompido.
- Tunelamente o eletrodo de ECG positivo para a costela inferior esquerda e repita as etapas acima para prendê-lo ao músculo e fechar a incisão.
- Túnel o EEG leva subcutaneamente para o lado lateral esquerdo, tanto quanto possível no campo cirúrgico.
- Adicione 1 sutura absorvível ao músculo peritoneal à esquerda ao redor dos fios emergentes. Feche a pele com sutura não absorvível em um padrão interrompido.
- Enrole os fios de EEG expostos com papel alumínio estéril.
5. Preparação da superfície dorsal
- Um assistente não estéril removerá a cortina estéril e o laço da perna.
- Vire o kit para a posição de bruços (Figura 2B) enquanto garante que a máscara facial permaneça firmemente no lugar, girando usando o conector giratório entre a máscara facial e o circuito. Ajuste os monitores de oxímetro de pulso e/ou doppler conforme necessário para garantir o monitoramento anestésico contínuo.
- Prepare o campo cirúrgico com uma esfoliação betadina para incluir a cabeça, pescoço e costas inteiras com cuidado para esfregar ao redor da região dos fios de saída no lado esquerdo.
- O cirurgião colocará uma toalha adesiva estéril sob o lado esquerdo enquanto o pacote de fios de papel alumínio é segurado por um assistente não estéril.
- Remova de forma estéril e cuidadosa os fios do pacote de alumínio e coloque-os no campo estéril. Termine de cobrir com toalhas estéreis.
- Cubra com uma cortina estéril e corte uma janela grande o suficiente para expor todo o campo estéril.
6. Colocação de eletrodos de EEG
- Faça uma incisão de 3 cm no couro cabeludo na linha média para expor o crânio.
- Use um trocarte para tunelar subcutaneamente os eletrodos do EEG do lado esquerdo para o crânio.
- Limpe e raspe o periósteo dos ossos parietais expostos usando um bisturi.
- Insira uma broca portátil em uma capa de ultrassom estéril. Insira uma broca de 1.0 mm na broca.
- Faça furos de broca bilaterais nos ossos parietais aproximadamente 0,5 cm anterior à lambda e 0,5 cm lateral à sutura sagital.
NOTA: Cuidado com a quantidade de pressão colocada na parte dorsal do crânio, pois isso pode ocluir as vias aéreas ventrais, portanto, o monitoramento respiratório é fundamental neste ponto do procedimento. Uma queda constante ou significativa na frequência cardíaca pode indicar oclusão respiratória (bradicardia secundária à apneia) e deve levar a uma avaliação e ação imediatas. - Use uma pinça fina para colocar um parafuso no orifício da rebarba. Use a chave de fenda para inserir aproximadamente na metade (Figura 3C).
- Disseque sem rodeios uma bolsa subcutânea ao longo da parte de trás do pescoço para enrolar frouxamente aproximadamente 10 cm de fio.
- Corte o excesso de fio. Descasque o isolamento da ponta e estique o fio.
- Crie um laço na extremidade do fio exposto dando um nó, mantendo um pequeno laço. Coloque o laço sobre o parafuso e aperte o parafuso no crânio, certificando-se de que o fio esteja tocando o parafuso. Coloque o fio terra à esquerda e o fio de gravação à direita.
- Avalie a fidelidade dos sinais de telemetria no software de análise assim que todos os fios estiverem no lugar. O sinal de EEG aparecerá em baixa amplitude enquanto o kit estiver sedado.
- Prenda os parafusos e fios ao crânio com acrílico dental e deixe-o endurecer completamente.
- Feche a pele com uma sutura não absorvível na cabeça e no flanco esquerdo.
- Injete bupivacaína (dose máxima de 2 mg/kg de 5 mg/mL diluída a 2,5 mg/mL) por via subcutânea em cada incisão. Cubra cada incisão com uma pequena quantidade de cola para a pele administrada com uma seringa de tuberculina.
7. Recuperação anestésica
- Desligue a anestesia com sevoflurano e forneça apenas oxigênio por pelo menos 5 minutos enquanto remove a fita restante, o campo e o monitoramento anestésico.
- Verifique os níveis de glicose no sangue usando um glicosímetro e administre fluidos subcutâneos aquecidos a 10% do peso corporal (kg).
- Quando o animal estiver reativo a um estímulo doloroso (pinçamento do dedo do pé), vá para uma incubadora de recuperação ajustada a 37-38 °C.
NOTA: Muitas vezes, a temperatura do kit cairá significativamente durante esta transferência. Pode ser benéfico devolver o kit à almofada de aquecimento infravermelho de biofeedback ou fornecer calor suplementar adicional. - Monitore visualmente continuamente e registre a temperatura retal, leituras do oxímetro de pulso, frequência cardíaca e frequência respiratória a cada 10-15 minutos.
- Quando o animal estiver consistentemente ambulatorial e alerta, remova o cateter intravenoso e aplique pressão no local até que o sangramento pare.
8. Cuidados e monitoramento pós-operatório
- Retorne o kit para a barragem e mate os companheiros de ninhada. Certifique-se de que o material de nidificação e a nutrição suplementar (Tabela de Materiais) estejam disponíveis na gaiola para ajudar na termorregulação e recuperação.
- Verifique o kit diariamente por 7 a 10 dias após a cirurgia, pesando diariamente e fornecendo nutrição suplementar na gaiola.
- Nos primeiros 2 dias após a recuperação (D1 e D2), administre analgésicos adicionais a cada 24 h (carprofeno 4 mg/kg SQ - diluído a 5 mg/mL) e fluidos subcutâneos (5-7 mL).
- Nos primeiros 3 dias após a recuperação (D1, D2 e D3), verifique o kit duas vezes ao dia, avaliando evidências de dor, deambulação, aparência incisional e hidratação. Uma vez por dia durante esse período, meça a temperatura do kit para garantir que não haja evidência de infecção e termorregulação adequada.
- Remova as suturas se as incisões cicatrizarem adequadamente em 7 a 10 dias.
Resultados
O resultado bem-sucedido deste projeto exigiu o desenvolvimento de múltiplos parâmetros no procedimento de implante e no protocolo de registro. A cirurgia de implante foi tentada ou realizada em 16 kits de coelhos, com 14 sobrevivendo com sucesso ao procedimento. Destes, 12 sobreviveram até o desfecho experimental. Os motivos para óbito intra ou pós-operatório são destacados na Tabela 1, juntamente com as modificações do procedimento que permitiram o sucesso futuro no alcance do desfecho experimental. A complicação operatória mais comum foi a depressão respiratória, levando a hipóxia e bradicardia. O protocolo foi modificado para incluir múltiplas modalidades de monitoramento, incluindo 2 oxímetros de pulso e um monitor Doppler. Isso permite o monitoramento de backup se um monitor falhar ou se soltar durante o procedimento cirúrgico. Além disso, os pigmentos da pele em coelhos podem tornar a oximetria de pulso menos confiável, necessitando de monitoramento de vários pontos do corpo. Embora a indução e a recuperação sejam comumente consideradas os períodos mais arriscados da anestesia, observamos depressão respiratória levando à bradicardia em outros pontos ao longo do procedimento, destacando a necessidade de monitoramento vigilante dos sinais vitais em todos os momentos. Como intervenção para essa complicação, monitorização adicional e doxapram foram adicionados ao protocolo após as complicações anestésicas terem sido observadas durante as duas primeiras coortes cirúrgicas de animais (animais 1-4). Os animais 12 e 13 estavam na mesma coorte e receberam doxapram (2-5 mg / kg, IV ou sublingual) devido ao impulso respiratório deficiente. Ambos foram ressuscitados com sucesso de depressão respiratória e apneia no intraoperatório.
As gravações de telemetria podem ser realizadas imediatamente assim que os kits são devolvidos às gaiolas de origem e geralmente mostram sinais de EEG de amplitude relativamente baixa até que o kit esteja totalmente recuperado da anestesia (Figura 4). A morfologia do sinal de ECG pode mudar ligeiramente durante os primeiros dias de registro à medida que a cicatriz se forma, e a localização do fio de ECG é ainda mais segura (Figura 4B). A qualidade do sinal de EEG e ECG é robusta ao longo do tempo sem degradação do sinal, dado que o fio excessivo adequado é deixado enrolado no subcutâneo para permitir o crescimento. Os registros de telemetria podem ser personalizados com base nas necessidades individuais do estudo, pois o implante pode monitorar vários biopotenciais, incluindo temperatura, aceleração e qualidade do sinal, além de EEG e ECG (Figura 5). A análise de dados é realizada offline com o software Emka ECGAuto. Com a coleta de dados de EEG e ECG a 500 Hz, as baterias de implante duram aproximadamente 55 dias. Esse intervalo de tempo pode ser estendido alterando os parâmetros de coleta de dados ou com amostragem intermitente. A programação de software pode ser realizada para auxiliar na detecção de convulsões no ECGAuto (Figura 5). Os coelhos implantados são monitorados quanto a eritema cutâneo, peso e temperatura nos primeiros 7 dias após a cirurgia, pois este é o período de maior risco de infecção. No pós-operatório, os kits de coelhos começam a mostrar ganho de peso 1-3 dias após o procedimento, sugerindo sofrimento mínimo do procedimento. A equipe veterinária realiza exames completos 2 a 3 vezes na primeira semana pós-operatória e examinará em intervalos mais regulares se surgirem preocupações durante a recuperação. Em nossa experiência, a corça não perturba significativamente os locais de sutura quando os kits são devolvidos ao ninho, portanto, a cicatrização de feridas tem sido excelente. Vários kits desenvolveram seromas benignos na incisão craniana (Tabela 1), para os quais receberam mais 3 dias de carprofeno, resultando em resolução do seroma sem complicações adicionais. A longo prazo, os coelhos são observados diariamente em busca de sinais de angústia pelo pessoal do laboratório ou da equipe de criação. A equipe veterinária está prontamente disponível para examinar e tratar coelhos se surgir alguma preocupação. A qualidade do sinal do telémetro é verificada diariamente quanto ao mau funcionamento do dispositivo ou do cabo até que a bateria se esgote.
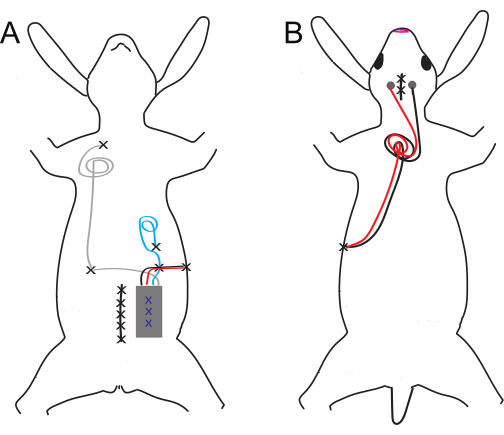
Figura 1: Esquema de colocação de implantes ventrais e dorsais e eletrodos. (A) Implantes ventrais e (B) dorsais. Os locais de sutura são denotados por X pretos, enquanto os X azuis denotam suturas internas do implante abdominal. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fotografias do posicionamento cirúrgico. (A) O animal é parcialmente rodado para permitir o implante abdominal, a colocação de eletrodos de ECG torácico e a tunelização parcial dos fios para o dorso na mesma posição cirúrgica. O nariz é confortavelmente posicionado em uma máscara facial personalizada impressa em 3D (a) e frouxamente colado nos membros anteriores. O monitoramento da SpO2 pode ser intermitente, portanto, várias sondas são utilizadas (antebraço direito (b) e membro posterior direito (g)). Um cateter intravenoso é fixado na orelha direita (c). Outros monitoramentos anestésicos mostrados incluem monitoramento de temperatura por infravermelho por biofeedback (d) e monitoramento Doppler utilizando a artéria femoral direita (e). A respiração é monitorada visualmente pela observação do animal ou da bolsa de reinalação. (B) Após a colocação do implante e do eletrodo de ECG, o campo estéril é quebrado e o coelho é girado para a posição prona. Os fios permanecem estéreis dentro de uma bolsa de alumínio (a*) enquanto a superfície dorsal é preparada para a colocação do eletrodo EEG. Clique aqui para ver uma versão maior desta figura.
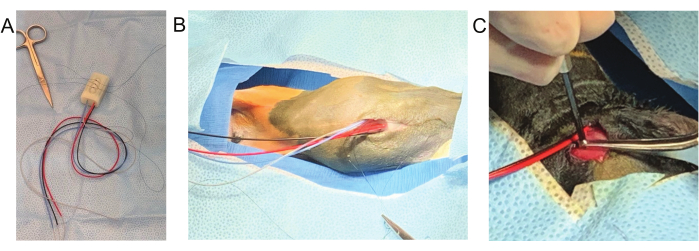
Figura 3: Principais etapas do procedimento cirúrgico. (A) Três suturas são fixadas ao implante antes da incisão na pele. (B) Uma longa cauda permanece para prender o implante à parede ventral da cavidade peritoneal. (C) Os parafusos do crânio são presos com pinças finas enquanto aparafusam no crânio. Clique aqui para ver uma versão maior desta figura.
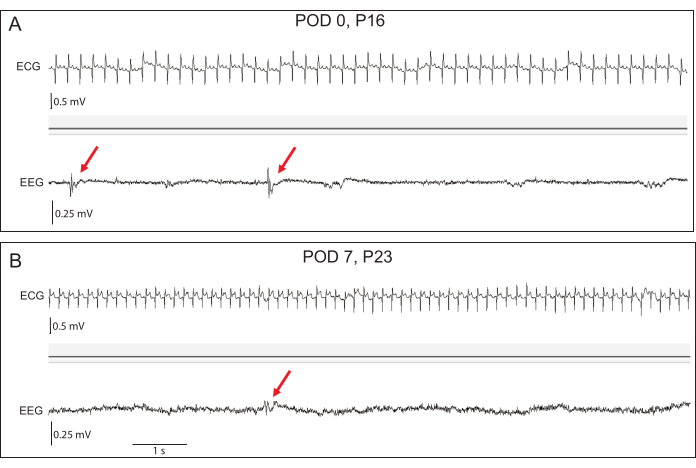
Figura 4: Registros iniciais representativos de EEG e ECG. (A) No dia 0 do pós-operatório (DPO), as amplitudes basais do EEG são baixas, mas descargas epileptiformes interictais (setas vermelhas) podem ser observadas em coelhos transgênicos. (B) No POD 7, as amplitudes do EEG aumentaram. As descargas epileptiformes permanecem aparentes. A fidelidade do sinal de ECG é excelente em ambos os momentos. Clique aqui para ver uma versão maior desta figura.
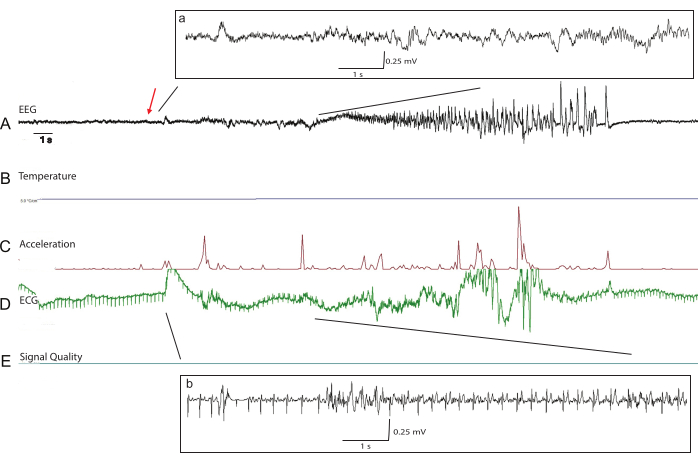
Figura 5: Traçados brutos representativos durante uma convulsão tônico-clônica em um kit de coelho transgênico P66. Os dados telemétricos pré-processados incluem (A) EEG, (B) temperatura, (C) aceleração, (D) ECG e (E) medições de qualidade de sinal para análise offline. A qualidade do sinal de todos os biopotenciais no 52º dia de pós-operatório permanece excelente. O início da convulsão é indicado pela seta vermelha. Os dados de EEG processados (a) com ajuste basal no início da convulsão mostram atenuação do sinal durante a fase tônica da convulsão. Os dados de ECG com uma linha de base processada (b) são visíveis mesmo com artefatos musculares excessivos durante a fase tônica da convulsão. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Resultados cirúrgicos. Complicações cirúrgicas e pós-operatórias levaram a múltiplas modificações no procedimento de colocação do implante. Quatorze dos 16 coelhos (87,5%) sobreviveram ao procedimento cirúrgico e 2 coelhos tiveram complicações pós-operatórias que necessitaram de eutanásia. Os animais são exibidos em ordem cronológica da data da cirurgia. Clique aqui para baixar esta tabela.
Discussão
O protocolo descrito para indução, monitoramento e suporte anestésico equilibra as necessidades de pesquisa para abordagem cirúrgica e facilidade com os padrões ouro de cuidados veterinários. Antes de o laboratório adotar o protocolo descrito como procedimento padrão, vários outros refinamentos potenciais foram testados, incluindo a colocação de implantes subcutâneos dorsais, o uso de um tubo endotraqueal ou máscara laríngea e o uso de um estetoscópio esofágico para monitoramento da frequência cardíaca. No entanto, todos foram abandonados por vários motivos. Embora haja espaço subcutâneo suficiente para a colocação da telemetria, a incapacidade de fechar o espaço morto devido ao corpo da telemetria e ao design de saída do fio, o desafio de posicionar e enrolar os fios para permitir o crescimento do animal e as 2 mudanças posicionais necessárias no intraoperatório para proteger o ECG levam a um tempo cirúrgico significativamente estendido e a desafios logísticos desnecessários. Além disso, embora o uso de anestesia com máscara não seja geralmente recomendado, a falta de MLAs de tamanho adequado e a incapacidade de proteger e manter um tubo endotraqueal após a colocação impediram essas opções. A necessidade de virar o kit no meio da cirurgia e também a necessidade de acessar o pescoço e o dorso da cabeça limitaram as opções para fixar o tubo endotraqueal mesmo após a colocação bem-sucedida com base em uma técnica previamente descrita para intubação neonatal em coelhos25. Também testamos o uso de uma sonda de estetoscópio esofágico para monitoramento da frequência cardíaca após o kit ser drapeado em caso de perda de sinal do oxímetro de pulso ou do Doppler. No entanto, todos os estetoscópios esofágicos disponíveis comercialmente eram muito grandes, presumivelmente causando uma resposta vagal e bradicardia insustentável toda vez que um era colocado.
Os resultados anestésicos provavelmente foram muito aprimorados pela escolha de utilizar sevoflurano em vez de isoflurano para anestesia inalatória. O sevoflurano demonstrou ter menos efeitos vasodilatadores em alguns tecidos de coelhos26 e é amplamente considerado na literatura humana como aumentando a estabilidade cardiovascular27. De particular importância, dados os riscos da anestesia em um ambiente com manejo subótimo das vias aéreas, a rápida indução e emergência do sevoflurano documentada em várias espécies 28,29,30, juntamente com a capacidade de titular a dosagem anestésica, resultaram em episódios anestésicos encurtados e permitiram mudanças rápidas no plano anestésico em um ambiente cirúrgico em rápida evolução. Além disso, o sevoflurano inalatório é considerado significativamente menos aversivo para a indução da máscara, provavelmente contribuindo para uma redução na apneia em coelhos neonatais31. O doxapram em coelhos demonstrou ser um estimulante respiratório eficaz em coelhos adultos32,33, e nós apreciamos uma resposta em nosso modelo de coelho neonatal.
Embora o sucesso deste protocolo seja óbvio, existem caminhos potenciais para refinamento em termos de analgesia e monitoramento anestésico. Como não há estudos indicando diretrizes de dosagem para coelhos neonatais, as dosagens e frequências foram direcionadas para a extremidade inferior das recomendações específicas da espécie. Uma dose adicional de buprenorfina na recuperação e teste de plataformas de monitoramento anestésico específicas para roedores pode aumentar ainda mais a taxa de sobrevivência e melhorar o bem-estar animal neste modelo. A dosagem adicional de buprenorfina pós-recuperação prolongaria os efeitos da analgesia multimodal, minimizando os efeitos documentados de estase respiratória, depressiva e gastrointestinal dependente da dose em coelhos34,35. Todos os animais pós-cirúrgicos apresentaram elevações moderadas a graves na glicemia pós-operatória imediata (250-400 mg/dL) usando um glicosímetro portátil veterinário. Isso pode indicar uma resposta exagerada ao estresse devido à dor pós-operatória periaguda, com base em uma publicação recente ligando níveis elevados de glicose no sangue e a gravidade da doença gastrointestinal em coelhos36. Como todos os animais voltaram a ganhar peso dentro de 3 dias ou menos do procedimento e tiveram atividade normal e ausência de dor no local da incisão dentro de 12-24 h de pós-operatório, não acreditamos que uma administração prolongada de opioides seja indicada para este modelo. Os dispositivos de monitorização anestésica específicos para roedores, que incluem a monitorização respiratória, estão se tornando cada vez mais comuns em produtos disponíveis por vários fabricantes37. É lógico que, se esses sistemas funcionassem com outros animais de tamanho comparável com frequências cardíacas altas semelhantes às dos coelhos neonatais, a utilização de um desses sistemas aumentaria a sobrevida anestésica. Infelizmente, não tivemos acesso a esses produtos ou a capacidade de experimentá-los antes de comprá-los para este estudo.
Os dispositivos de telemetria implantáveis avançaram nos últimos anos para incluir maior vida útil da bateria, implantes menores e a capacidade de medir múltiplos biopotenciais de interesse em roedores, caninos e primatas não humanos, permitindo que os animais se movam livremente, reduzindo o estresse 38,39,40. O uso de dispositivos de telemetria implantáveis para registro simultâneo de EEG e ECG em coelhos oferece vantagens sobre os métodos atuais de amarração41. Com dispositivos implantáveis, os coelhos podem se mover livremente em sua gaiola doméstica sem amarras ou restrições, e os kits podem retornar ao ninho com a corça e a cama, reduzindo o estresse e promovendo o bem-estar animal. Procedimentos cuidadosos de monitoramento pós-operatório para sinais de infecção ou estresse também permitem a intervenção veterinária precoce se surgirem complicações. Os kits de implantação permitem a avaliação do EEG durante períodos críticos do desenvolvimento cerebral, o que pode ser essencial em modelos de epilepsias genéticas sem alterar as práticas de alojamento. Além disso, os dados de telemetria são capturados continuamente durante a vida útil da bateria do implante, permitindo a captura de eventos raros de SUDEP. O surgimento de coelhos transgênicos oferece oportunidades únicas para modelar doenças humanas. Além disso, o uso de modelos de coelhos pode oferecer vantagens significativas sobre outras avaliações de animais de grande porte que são necessárias para aprovações de medicamentos da FDA. Métodos como o apresentado permitirão a avaliação avançada da fisiologia cardíaca e neural nesses modelos, bem como sua alteração por intervenção terapêutica.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem o financiamento do NIH R61NS130070 ao LLI.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 inch elastic wrap - Coban or Vetwrap | 3M | https://www.3m.com/3M/en_US/p/d/b00003186/ | |
| 4-0 PDS monofilament suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| 5-0 Ethilon nylon suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| Acquisition computer | Dell | https://www.dell.com/en-us | |
| Adhesive surgical towels | N/A | N/A | |
| Anesthesia circuit - Jackson-Reevs with 0.5 L rebreathing bag | JorVet | J0248GA | |
| Betadine scrub | N/A | N/A | |
| Bupivicaine (0.5%) | N/A | N/A | Diluted to 2.5 mg/mL prior to administration |
| Buprenorphine (0.3 mg/mL) | N/A | N/A | Diluted to 0.03 mg/mL prior to administration |
| Burr - 1.00 mm | Cell Point Scientific | 60-1000 | to drill skull |
| Cafazolin (1 g lypholized) | N/A | N/A | Diluted to 50 mg/mL |
| Carprofen (50 mg/mL) | MWI Veterinary | Diluted to 25 mg/mL prior to administration | |
| Cotton tipped applicators | N/A | N/A | |
| Custom 3-D printed face mask | N/A | https://www.thingiverse.com/thing:923725 | |
| Dental acrylic | N/A | N/A | |
| Diet Gel Criticare | Clear H2O | 72-05-5042 | Nutritional support |
| Dopper Gel - Aquasonic | Patterson | 07-890-5542 | |
| Doppler - Vet-Dop2 | Patterson | 07-888-8986 | |
| Doxapram (20 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Dumont #5 Fine Forceps | Fine Science Tools | 11254-20 | For holding screws |
| Duraprep | 3M | 8630 | Final skin prep |
| ecgAuto data analysis software | emka technologies | N/A | |
| Epinephrine (1:1000) | MWI Veterinary | N/A | Emergency only |
| Gauze | N/A | N/A | |
| Glucometer ipet Pro | MWI Veterinary | 63867 | Monitor if poor recovery |
| Glycopyrrolate (0.2 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Gram scale | N/A | N/A | |
| Hemostats | Fine Science Tools | 13008-12 | Hold wire loops while tying the loop in place |
| Ideal Micro-drill | Cell Point Scientific | 67-1204 | To drill skull |
| Incubator | DRE-veterinary (Infantia - NB1) | N/A | |
| Induction box | VetEquip | 941444 | |
| Infared heating pad - RightTemp Jr | Kent Scientific Corporation | RT-0502 | |
| IOX2 data acquisition software | emka technologies | N/A | |
| IV Catheter - Covidein Monoject 26 G, 3/4 inch PTFE | Patterson | 07-836-8494 | |
| ketamine (100 mg/mL) | MWI Veterinary | N/A | |
| Medical tape | N/A | N/A | |
| Narrow Pattern Forceps - Straight/12 cm | Fine Science Tools | 11002-12 | |
| Neonatal stethescope | Ultrascope | N/A | |
| Olsen-Hegar Needle holder with scissors - 12 cm | Fine Science Tools | 12002-12 | For suturing |
| Ophthalmic ointment Puralube | MWI Veterinary | N/A | Administered to both eyes during anesthesia |
| Opthalmic Lubricant - Paralube Vet | Patterson | 07-888-2572 | |
| Pulse oximeter (AccuWave Portable ) | Patterson | 07-892-9128 | For prep and recovery; reads HR up to 400 |
| Pulse oximeter (SDI - Vet/Ox plus 4700) | Heska | N/A | Intra-operative; no longer producted |
| Receiver | emka technologies | N/A | 1 receiver for every 4 telemetry implants |
| Rectal thermometer | N/A | N/A | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scissors | Fine Science Tools | 14002-12 | To cut drape |
| Screw driver - 1.0 mm | N/A | N/A | From mini-screwdriver set for electronics |
| Screws 00-96 x 3/32 (2.4 mm) | Protech International | 8L0X3905202F | |
| Sevoflurane | MWI Veterinary | Maintenance anesthesia | |
| Sevoflurane vaporizer and anesthesia machine | N/A | N/A | |
| Skin glue, Gluture | MWI Veterinary | 34207 | Apply sparingly with syringe |
| Small scissors | Fine Science Tools | 14084-08 | |
| Sterile aluminum foil | N/A | N/A | To wrap wires prior to rotating animal |
| Sterile paint brush | N/A | N/A | To apply dental acrylic |
| Sterile Saline | N/A | N/A | |
| Sterile surgical gloves | N/A | N/A | |
| Sterile ultrasound cover | N/A | N/A | To cover the drill |
| Sterile Water | N/A | N/A | For cefazolin reconstitution |
| Surgical blade no. 15 | N/A | N/A | |
| Surgical drape | N/A | N/A | |
| Surgical gown | N/A | N/A | |
| Swivel connector - Jorgensen Labs | Patterson | 07-802-2349 | To connect anesthesia circuit to face mask |
| Telemetry implant | emka technologies | easyTEL+_M1_EETA_B_35 | |
| Trocar | SAI | TRO-10-6 | To tunnel wires |
Referências
- Bagnall, R. D., Crompton, D. E., Semsarian, C. Genetic Basis of Sudden Unexpected Death in Epilepsy. Front Neurol. 8, 348 (2017).
- Surges, R., et al. Pathologic cardiac repolarization in pharmacoresistant epilepsy and its potential role in sudden unexpected death in epilepsy: a case-control study. Epilepsia. 51 (2), 233-242 (2010).
- Surges, R., Thijs, R. D., Tan, H. L., Sander, J. W. Sudden unexpected death in epilepsy: risk factors and potential pathomechanisms. Nat Rev Neurol. 5 (9), 492-504 (2009).
- Shorvon, S., Tomson, T. Sudden unexpected death in epilepsy. Lancet. 378 (9808), 2028-2038 (2011).
- Schuele, S. U., et al. Video-electrographic and clinical features in patients with ictal asystole. Neurology. 69 (5), 434-441 (2007).
- Massey, C. A., Sowers, L. P., Dlouhy, B. J., Richerson, G. B. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. 10 (5), 271-282 (2014).
- Sahly, A. N., Shevell, M., Sadleir, L. G., Myers, K. A. SUDEP risk and autonomic dysfunction in genetic epilepsies. Auton Neurosci. 237, 102907 (2022).
- Cooper, M. S., et al. Mortality in Dravet syndrome. Epilepsy Res. 128, 43-47 (2016).
- Negishi, Y., et al. SCN8A-related developmental and epileptic encephalopathy with ictal asystole requiring cardiac pacemaker implantation. Brain Dev. 43 (7), 804-808 (2021).
- Meisler, M. H., et al. SCN8A encephalopathy: Research progress and prospects. Epilepsia. 57 (7), 1027-1035 (2016).
- Watanabe, H., et al. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest. 118 (6), 2260-2268 (2008).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci Transl Med. 1 (2), 2ra6 (2009).
- Nerbonne, J. M. Mouse models of arrhythmogenic cardiovascular disease: challenges and opportunities. Curr Opin Pharmacol. 15, 107-114 (2014).
- Frasier, C. R., et al. Channelopathy as a SUDEP Biomarker in Dravet Syndrome patient-derived cardiac myocytes. Stem Cell Rep. 11 (3), 626-634 (2018).
- Camacho, P., Fan, H., Liu, Z., He, J. -. Q. Small mammalian animal models of heart disease. Am J Cardiovasc. 6 (3), 70-80 (2016).
- Brodbelt, D. Perioperative mortality in small animal anaesthesia. Vet J. 182 (2), 152-161 (2009).
- Lee, H. W., Machin, H., Adami, C. Peri-anaesthetic mortality and nonfatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases. Vet Anaes Anal. 45 (4), 520-528 (2018).
- Comolli, J., et al. Comparison of endoscopic endotracheal intubation and the v-gel supraglottic airway device for spontaneously ventilating New Zealand white rabbits undergoing ovariohysterectomy. Vet Rec. 187 (10), e84-e84 (2020).
- Grint, N. J., Sayers, I. R., Cecchi, R., Harley, R., Day, M. J. Postanaesthetic tracheal strictures in three rabbits. Lab Anim. 40 (3), 301-308 (2006).
- Phaneuf, L. R., Barker, S., Groleau, M. A., Turner, P. V. Tracheal injury after endotracheal intubation and anesthesia in rabbits. J Am Assoc Lab Anim Sci. 45 (6), 67-72 (2006).
- Quesenberry, K. E., Orcutt, C. J., Mans, C., Carpenter, J. W. Gastrointestinal Diseases of Rabbits. Ferrets, Rabbits, and Rodents. , (2020).
- Desai, A., Macrae, D. . Cardiovascular Physiology in Infants, Children, and Adolescents. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. , (2020).
- Bansal, N., Momin, S., Bansal, R., Venkata, S. K. R. G., Ruser, L., Yusuf, K. Pharmacokinetics of drugs: newborn perspective. Pediatr Med. 7, 19 (2024).
- Trachsel, D., Erb, T. O., Hammer, J., von Ungern-Sternberg, B. S. Developmental respiratory physiology. Paediat Anaesth. 32 (2), 108-117 (2022).
- Benito, S., Hadley, S., Camprubí-Camprubí, M., Sanchez-de-Toledo, J. Blind endotracheal intubation in neonatal rabbits. J Vis Exp. 168, e61874 (2021).
- Okamoto, S., Matsuura, N., Ichinohe, T. Effects of volatile anesthetics on oral tissue blood flow in rabbits: A comparison among isoflurane, sevoflurane, and desflurane. J Oral Maxillofac Surg. 73 (9), 1714.e1-1714.e8 (2015).
- Elshalakany, N. A., Salah, A. M. Comparative study: evaluation of the effect of sevoflurane versus isoflurane in general anesthesia for pediatric patients undergoing cardiac catheterization. Egypt J Anaesth. 38 (1), 409-414 (2022).
- Anjana, R. R., Parikh, P. V., Mahla, J. K., Kelawala, D. N., Patel, K. P., Ashwath, S. N. Comparative evaluation of isoflurane and sevoflurane in avian patients. Vet World. 14 (5), 1067-1073 (2021).
- Johnson, R. A., Striler, E., Sawyer, D. C., Brunson, D. B. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs. Am J Vet Res. 59 (4), 478-481 (1998).
- Campbell, C., Nahrwold, M. L., Miller, D. D. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth. 42 (10), 884-890 (1995).
- TerRiet, M. F., et al. Which is most pungent: isoflurane, sevoflurane, or desflurane. Br J Anaesth. 85 (2), 305-307 (2000).
- Khanna, V. K., Pleuvry, B. J. A study of naloxone and doxapram as agents for the reversal of neuroleptanalgesic respiratory depression in the conscious rabbit. Br J Anaesth. 50 (9), 905-912 (1978).
- Flecknell, P. A., Liles, J. H., Wootton, R. Reversal of fentanyl/fluanisone neuroleptanalgesia in the rabbit using mixed agonist/antagonist opioids. Lab Anim. 23 (2), 147-155 (1989).
- Shafford, H. L., Schadt, J. C. Respiratory and cardiovascular effects of buprenorphine in conscious rabbits. Vet Anaesth Analg. 35 (4), 326-332 (2008).
- Feldman, E. R., Singh, B., Mishkin, N. G., Lachenauer, E. R., Martin-Flores, M., Daugherity, E. K. Effects of cisapride, buprenorphine, and their combination on gastrointestinal transit in New Zealand white rabbits. J Am Assoc Lab Anim Sci. 60 (2), 221-228 (2021).
- Harcourt-Brown, F. M., Harcourt-Brown, S. F. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170 (26), 674-674 (2012).
- Rivera, D. A., Buglione, A. E., Ray, S. E., Schaffer, C. B. MousePZT: A simple, reliable, low-cost device for vital sign monitoring and respiratory gating in mice under anesthesia. PLoS One. 19 (3), e0299047 (2024).
- Nicou, C. M., Passaglia, C. L. Characterization of intraocular pressure variability in conscious rats. Exp Eye Res. 239, 109757 (2024).
- Sadko, K. J., Leishman, D. J., Bailie, M. B., Lauver, D. A. A simple accurate method for concentration-QTc analysis in preclinical animal models. J Pharmacol Toxicol Methods. 128, 107528 (2024).
- Vuong, J. S., Garrett, J. J., Connolly, M. J., York, A. R., Gross, R. E., Devergnas, A. Head mounted telemetry system for seizures monitoring and sleep scoring on non-human primate. J Neurosci Methods. 346, 108915 (2020).
- Bosinski, C., Wagner, K., Zhou, X., Liu, L., Auerbach, D. S. Multi-system monitoring for identification of seizures, arrhythmias and apnea in conscious restrained rabbits. J Vis Exp. (169), e62256 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados