Method Article
Impianto di dispositivi per elettroencefalogramma ed elettrocardiogramma in kit di coniglio neonatale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I meccanismi della morte improvvisa e inaspettata nell'epilessia (SUDEP) sono poco compresi e difficili da tradurre dai modelli attuali. I conigli transgenici possono offrire informazioni su questi meccanismi. Descriviamo un metodo per registrazioni elettroencefalografiche ed elettrocardiografiche continue a lungo termine in kit di coniglio transgenico per valutare eventi gravi che possono portare alla morte.
Abstract
Le varianti patogene nei geni dei canali ionici sono associate a un alto tasso di morte improvvisa inaspettata nell'epilessia (SUDEP). I meccanismi della SUDEP sono poco conosciuti, ma possono coinvolgere disfunzione autonomica e aritmie cardiache oltre alle convulsioni. Alcuni geni dei canali ionici sono espressi sia nel cervello che nel cuore, aumentando potenzialmente il rischio di SUDEP nei pazienti con canalopatie ioniche associate a epilessia e aritmie cardiache. I conigli transgenici che esprimono varianti dell'epilessia forniscono un intero organismo per studiare la complessa fisiologia della SUDEP. È importante sottolineare che i conigli replicano più da vicino la fisiologia cardiaca umana rispetto ai modelli murini. Tuttavia, i modelli di coniglio devono tenere conto di ulteriori considerazioni sulla salute e sull'anestesia quando vengono sottoposti a procedure di monitoraggio invasive. Abbiamo sviluppato un nuovo metodo per impiantare chirurgicamente un dispositivo di telemetria per il monitoraggio simultaneo a lungo termine dell'elettroencefalogramma (EEG) e dell'elettrocardiogramma (ECG) nei kit di conigli neonatali. Qui, dimostriamo i metodi chirurgici per impiantare un dispositivo di telemetria in kit P14 (intervallo di peso 175-250 g) con un'attenzione dettagliata all'approccio chirurgico, all'anestesia e al monitoraggio appropriati e alle cure postoperatorie, con conseguente basso tasso di complicanze. Questo metodo consente il monitoraggio continuo dell'elettrofisiologia neurale e cardiaca durante i punti critici dello sviluppo di aritmie cardiache, convulsioni e potenziali SUDEP in modelli di coniglio di epilessie genetiche o acquisite.
Introduzione
La morte improvvisa e inaspettata nell'epilessia (SUDEP) è una delle principali cause di morte nei pazienti con epilessia. I meccanismi della SUDEP sono poco conosciuti, ma potenzialmente coinvolgono disfunzione autonomica, apnea e aritmie cardiache oltre alle convulsioni 1,2,3,4,5,6,7. I pazienti con epilessie genetiche legate alla canalopatia hanno tra i più alti tassi di SUDEP. Ad esempio, la SUDEP si verifica fino al 20% dei pazienti con varianti nel gene del canale del sodio voltaggio-dipendente SCN1A8, il gene responsabile della sindrome di Dravet, un'epilessia genetica con esordio nel primo anno di vita. Molti geni dei canali ionici legati all'epilessia sono espressi sia nel cervello che nel cuore, con dati di laboratorio e clinici che suggeriscono che le aritmie cardiache possono essere presenti nei pazienti con epilessie genetiche legate alla canalopatia7, 9,10,11,12, aumentando potenzialmente il loro rischio di SUDEP a causa di un'aritmia cardiaca fatale indotta da convulsioni o dell'insorgenza simultanea di convulsioni e aritmie. La valutazione della SUDEP in laboratorio pone numerose sfide. Da un punto di vista cardiaco, i potenziali d'azione cardiaci nei topi sono molto diversi da quelli nell'uomo13 e i modelli di iPSC-miociti cardiaci umani14 non possono replicare le complessità dell'intero organismo. I modelli transgenici di epilessie genetiche di coniglio forniscono un sistema ideale per studiare la SUDEP, poiché la fisiologia cardiaca del coniglio replica più da vicino quella dell'uomo13,15, fornendo al contempo un intero organismo per studiare la fisiopatologia complessa. Poiché la SUDEP può verificarsi già dalla prima crisi, la valutazione di questi modelli animali da un punto temporale precoce è essenziale per comprendere l'insorgenza sia delle convulsioni che delle aritmie cardiache. La registrazione video durante il periodo neonatale è impegnativa, poiché i cuccioli di coniglio sono spesso ancora nel nido. La registrazione continua dell'elettroencefalogramma (EEG) o dell'elettrocardiogramma (ECG) con un sistema cablato tradizionale non è possibile mentre i kit sono con la diga. È improbabile che la registrazione intermittente catturi eventi rari e terminali associati a SUDEP. Ci siamo quindi rivolti al monitoraggio della telemetria impiantabile wireless per fornire registrazioni EEG ed ECG a lungo termine, continue e simultanee nei kit di conigli.
Le chiavi del successo di questo protocollo sono l'anestesia appropriata e il supporto postoperatorio per questi animali vulnerabili. I conigli sono a un rischio molto più elevato di morte per anestesia (1,39%-4,8%) rispetto a cani e gatti (0,17%-0,24%) a causa di caratteristiche anatomiche e fisiologiche uniche16,17. I principali fattori che contribuiscono a questo aumento del rischio anestetico includono una gestione non ottimale delle vie aeree e complicanze postoperatorie acute. Molteplici fattori contribuiscono alla difficoltà dell'intubazione nei conigli, tra cui una bocca lunga e stretta con una lingua larga, un angolo acuto tra la bocca e la laringe, lo spostamento dorsale dell'epiglottide, l'aumento della suscettibilità al trauma laringeo e l'aumento della propensione al laringospasmo 18,19,20. Dopo l'episodio di anestesia immediata, i conigli sono a rischio di sviluppare una sindrome da stasi gastrointestinale pericolosa per la vita. Si tratta di un problema complesso e multifattoriale e si ipotizza che l'anestesia contribuisca attraverso effetti diretti del farmaco che inibiscono la motilità gastrica e/o l'anoressia secondaria post-procedurale per qualsiasi motivo (dolore non alleviato, nausea, ecc.)21.
La fisiologia unica dei neonati e dei neonati di coniglio aggrava le sfide associate all'anestesia e alla chirurgia. I conigli hanno giovani nati altriciali con meccanismi sottosviluppati per l'omeostasi fisiologica e speciali considerazioni anatomiche. L'accesso e il monitoraggio endovenoso sono difficili poiché la maggior parte dei prodotti commerciali non è ottimizzata per le piccole dimensioni vascolari, l'elevata frequenza cardiaca a riposo e la pelle pigmentata dei kit di conigli incrociati con cintura olandese e neozelandese. Poiché la gittata cardiaca è essenzialmente dipendente dalla frequenza cardiaca nei neonati22 e, in generale, la clearance del farmaco per via renale o epatica è ridotta rispetto agli adulti23, le considerazioni per la selezione e il dosaggio appropriati dei farmaci sono fondamentali. Si ritiene che la causa principale della morte per anestesia nei conigli sia secondaria alla depressione respiratoria e all'apnea. Oltre ai problemi di gestione delle vie aeree già discussi per tutti i conigli, i neonati hanno una spinta respiratoria depressa di fronte all'ipossiemia e all'ipercapnia, rendendo più rischioso questo aspetto già impegnativo dell'anestesia24.
In questo protocollo, descriviamo un metodo di successo per l'impianto di telemetria EEG ed ECG (Figura 1) in un modello di epilessia neonatale di coniglio con un alto tasso di sopravvivenza chirurgica e anestesiologica. Queste informazioni consentiranno ad altri ricercatori di affrontare modelli di coniglio neonatale impegnativi per far progredire la ricerca sull'epilessia, l'aritmia cardiaca e i disturbi dello sviluppo neurologico correlati.
Protocollo
Tutto il lavoro descritto è stato esaminato e approvato dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Michigan come parte di un protocollo di utilizzo degli animali approvato ed è in linea con le leggi e le linee guida federali pertinenti, tra cui l'USDA Animal Welfare Act e la politica del servizio sanitario pubblico NIH. L'Università del Michigan è un'istituzione accreditata AAALACi.
1. Preparazione degli animali
- Kit per la rasatura grossolana (età P14-P19, peso >175 g) 1-2 giorni prima della procedura per ridurre al minimo il tempo di anestesia il giorno dell'intervento utilizzando le tosatrici.
- Sterilizzare in autoclave o a gas tutti gli strumenti e i materiali chirurgici (per quanto possibile) in preparazione alla procedura.
- Indurre l'anestesia con ketamina (10 mg/kg IM), buprenorfina HCl (0,01 mg/kg IM) 0,3 mg/mL diluito a 0,03 mg/mL e sevoflurano e ossigeno tramite maschera anestesia utilizzando un circuito non respiratorio.
- Posizionare un catetere endovenoso (IV) da 26 G 3/4" nella vena auricolare (preferibile) o nella vena cefalica e sciacquare con soluzione fisiologica eparinizzata 10 unità/mL.
- Radere l'addome, il petto, la schiena, il collo e la testa il più vicino possibile alla pelle utilizzando una lama #40 o #50.
- Applicare un unguento oftalmico lubrificante non medicato per prevenire l'ulcerazione corneale.
- Somministrare analgesici (carprofene 4 mg/kg SQ - diluito a 25 mg/mL) e antibiotici perioperatori (cefazolina 20 mg/kg EV diluita a 50 mg/mL). Risomministrare gli antibiotici ogni 90-180 minuti di tempo chirurgico.
2. Preparazione chirurgica (Figura 2)
- Trasferire il kit anestetizzato sul tavolo operatorio e posizionarlo supino su un termoforo a infrarossi comandato tramite un termometro rettale.
- Posizionare il naso e la bocca in una maschera facciale stampata in 3D personalizzata collegata con un connettore girevole a un circuito Jackson-Rees non respiratorio (sacca da 0,5 L) e mantenere l'anestesia con sevoflurano (1,5%-7% per effetto) con flusso di ossigeno a 2 L/min.
- Mantenere l'anestesia con sevoflurano e monitorare la profondità dell'anestesia con un pulsossimetro sull'orecchio o sulla zampa e/o un Doppler sull'arteria femorale o direttamente sul cuore.
- Regolare l'anestesia durante la procedura per mantenere la frequenza cardiaca (FC) tra 180 e 260, la saturazione di ossigeno >85% e la frequenza respiratoria tra 10 e 50 respiri al minuto (visualizzazione diretta delle escursioni o del movimento della sacca di respirazione).
NOTA: Avere a disposizione farmaci di emergenza (glicopirrolato, epinefrina, doxapram). - Fissare il kit alla maschera facciale fissando delicatamente gli arti anteriori alla maschera.
- Posizionare il kit in una posizione leggermente laterale destra fissando senza stringere la zampa posteriore sinistra al tavolo operatorio.
- Preparare tutto l'addome con uno scrub chirurgico riscaldato alternando betadina e soluzione fisiologica sterile.
NOTA: Se lo si desidera, è possibile utilizzare una soluzione chirurgica aggiuntiva per completare lo scrub. Il chirurgo, che indossa camici dedicati, cuffie per capelli e copriscarpe, strofina asetticamente e indossa camice e guanti sterili per eseguire la procedura in condizioni sterili. - Posiziona gli asciugamani chirurgici adesivi su entrambi i lati del kit e coprilo con un grande telo chirurgico. Praticare un foro di dimensioni adeguate per esporre l'addome e il torace.
- Aprire l'impianto sul campo chirurgico e posizionare le suture di ancoraggio non assorbibili in ciascuno dei fori di ancoraggio dell'impianto. Lasciare la sutura attaccata con una coda di 5-6 cm (Figura 3A). Posizionare l'impianto in una ciotola di soluzione fisiologica sterile riscaldata.
3. Posizionamento dell'impianto nell'addome
- Dopo aver assicurato un'adeguata anestesia, praticare un'incisione di 3 cm attraverso la pelle lungo la linea alba con un bisturi.
- Praticare un'attenta incisione attraverso il muscolo per aprire la cavità peritoneale.
- Posizionare l'impianto nella porzione cranica della cavità addominale e posizionarlo a sinistra dell'incisione.
- Utilizzare un trocar per incanalare il filo ECG negativo fuori dalla cavità peritoneale e dalla pelle a circa 2 cm a destra dell'incisione. Scavare i restanti 3 fili a 3-4 cm a sinistra dell'incisione per consentire all'impianto di sedersi comodamente all'interno della cavità peritoneale.
- Fissare l'impianto con le suture di ancoraggio alla parete ventrale della cavità peritoneale, assicurandosi che non vi sia intrappolamento intestinale (Figura 3B).
- Chiudere la parete addominale con una sutura riassorbibile in modo continuo.
- Chiudere l'incisione cutanea con una sutura non assorbibile secondo uno schema interrotto.
4. Posizionamento delle derivazioni ECG
- Tunnellare l'elettrocatetere ECG negativo per via sottocutanea fino alla parte superiore destra del torace a livello della prima costola.
- Sezionare senza mezzi termini una tasca sottocutanea per avvolgere liberamente circa 10 cm di filo.
NOTA: Le bobine strette sotto la pelle possono causare l'erosione della pelle e l'esposizione del filo. - Tagliare il filo in eccesso e creare un cappio con il filo esposto legando l'estremità al filo isolato con una sutura non assorbibile.
- Fissare l'anello al muscolo con 2 punti di sutura non assorbibili.
- Chiudere il muscolo peritoneale a destra attorno al filo con 1-2 suture riassorbibili in uno schema interrotto.
- Chiudere la pelle nella parte superiore destra del torace e nell'addome destro con 2-3 punti di sutura non assorbibili in uno schema interrotto.
- Scavare il tunnel dell'elettrocatetere ECG positivo fino alla costola inferiore sinistra e ripetere i passaggi precedenti per fissarlo al muscolo e chiudere l'incisione.
- Tunnel: l'EEG conduce per via sottocutanea al lato sinistro il più lontano possibile in campo chirurgico.
- Aggiungere 1 sutura assorbibile al muscolo peritoneale a sinistra attorno ai fili emergenti. Chiudere la pelle con una sutura non assorbibile in uno schema interrotto.
- Avvolgere i fili EEG esposti con un foglio di alluminio sterile.
5. Preparazione della superficie dorsale
- Un assistente non sterile rimuoverà quindi il telo sterile e la cravatta per le gambe.
- Ruotare il kit in posizione prona (Figura 2B) assicurandosi che la maschera facciale rimanga saldamente in posizione ruotandola utilizzando il connettore girevole tra la maschera facciale e il circuito. Regolare i monitor pulse-ox e/o doppler secondo necessità per garantire un monitoraggio continuo dell'anestesia.
- Preparare il campo chirurgico con uno scrub betadine per includere la testa, il collo e l'intera schiena con cura per strofinare intorno alla regione dei fili in uscita sul lato sinistro.
- Il chirurgo posizionerà quindi un asciugamano adesivo sterile sotto il lato sinistro mentre il pacchetto di fili di alluminio è tenuto da un assistente non sterile.
- Rimuovere sterilemente e delicatamente i fili dalla confezione di alluminio e posizionarli sul campo sterile. Termina il drappeggio con asciugamani sterili.
- Coprire con un telo sterile e tagliare una finestra abbastanza grande da esporre l'intero campo sterile.
6. Posizionamento delle derivazioni EEG
- Fai un'incisione di 3 cm attraverso il cuoio capelluto sulla linea mediana per esporre il cranio.
- Utilizzare un trocar per incanalare sottocutaneamente le derivazioni EEG dal lato sinistro al cranio.
- Pulire e raschiare il periostio dalle ossa parietali esposte utilizzando un bisturi.
- Inserire un trapano portatile in una copertura sterile per ultrasuoni. Inserire una fresa da 1,0 mm nel trapano.
- Praticare dei fori bilaterali nelle ossa parietali a circa 0,5 cm anteriormente alla lambda e 0,5 cm lateralmente alla sutura sagittale.
NOTA: Prestare attenzione alla quantità di pressione esercitata sul cranio dorsale in quanto ciò può occludere le vie aeree ventrali, quindi il monitoraggio respiratorio è fondamentale a questo punto della procedura. Un calo costante o significativo della frequenza cardiaca può indicare un'occlusione respiratoria (bradicardia secondaria all'apnea) e dovrebbe richiedere una valutazione e un'azione immediate. - Usa una pinza fine per posizionare una vite nel foro della fresa. Utilizzare il cacciavite per inserirlo approssimativamente a metà (Figura 3C).
- Sezionare senza mezzi termini una tasca sottocutanea lungo la parte posteriore del collo per avvolgere liberamente circa 10 cm di filo.
- Tagliare il filo in eccesso. Spellare l'isolamento dalla punta e allungare il filo.
- Crea un anello all'estremità del filo esposto facendo un nodo, mantenendo un piccolo anello. Posizionare l'anello sopra la vite e serrare la vite al cranio, assicurandosi che il filo tocchi la vite. Posizionare il cavo di terra a sinistra e il cavo di registrazione a destra.
- Valuta la fedeltà dei segnali di telemetria sul software di analisi una volta che tutti i cavi sono in posizione. Il segnale EEG apparirà a bassa ampiezza mentre il kit è sedato.
- Fissare le viti e i fili al cranio con acrilico dentale e lasciarlo indurire completamente.
- Chiudere la pelle con una sutura non assorbibile sulla testa e sul fianco sinistro.
- Iniettare bupivacaina (dose massima di 2 mg/kg di 5 mg/mL diluita a 2,5 mg/mL) per via sottocutanea ad ogni incisione. Coprire ogni incisione con una piccola quantità di colla per la pelle somministrata utilizzando una siringa di tubercolina.
7. Recupero dell'anestesia
- Spegnere l'anestesia con sevoflurano e fornire solo ossigeno per almeno 5 minuti rimuovendo il nastro rimanente, il drappeggio e il monitoraggio dell'anestesia.
- Controllare i livelli di glucosio nel sangue utilizzando un glucometro e somministrare liquidi sottocutanei riscaldati al 10% del peso corporeo (kg).
- Una volta che l'animale è reattivo a uno stimolo doloroso (pizzicamento delle dita), spostarlo in un'incubatrice di recupero impostata a 37-38 °C.
NOTA: Spesso, la temperatura del kit scende significativamente durante questo trasferimento. Potrebbe essere utile riportare il kit nel termoforo a infrarossi con biofeedback o fornire ulteriore calore supplementare. - Monitora visivamente in modo continuo e registra la temperatura rettale, le letture del pulsossimetro, la frequenza cardiaca e la frequenza respiratoria ogni 10-15 minuti.
- Una volta che l'animale è costantemente deambulante e vigile, rimuovere il catetere endovenoso e applicare pressione sul sito fino a quando l'emorragia non si ferma.
8. Assistenza e monitoraggio postoperatorio
- Restituisci il kit alla diga e ai compagni di cucciolata. Assicurarsi che il materiale di nidificazione e la nutrizione supplementare (Tabella dei materiali) siano disponibili nella gabbia per facilitare la termoregolazione e il recupero.
- Controlla il kit ogni giorno per 7-10 giorni dopo l'intervento, pesandolo quotidianamente e fornendo una nutrizione supplementare nella gabbia.
- Per i primi 2 giorni dopo il recupero (D1 e D2), somministrare ulteriori analgesici ogni 24 ore (carprofene 4 mg/kg SQ - diluito a 5 mg/mL) e liquidi sottocutanei (5-7 mL).
- Per i primi 3 giorni dopo il recupero (D1, D2 e D3), controllare il kit due volte al giorno, valutando l'evidenza di dolore, deambulazione, aspetto incisionale e idratazione. Una volta al giorno durante questo periodo di tempo, misurare la temperatura del kit per garantire l'assenza di segni di infezione e un'adeguata termoregolazione.
- Rimuovere i punti di sutura se le incisioni guariscono in modo appropriato a 7-10 giorni.
Risultati
Il successo di questo progetto ha richiesto lo sviluppo di molteplici parametri nella procedura di impianto e nel protocollo di registrazione. La chirurgia implantare è stata tentata o eseguita su 16 kit di conigli, di cui 14 sono sopravvissuti con successo alla procedura. Di questi, 12 sono sopravvissuti fino al punto finale sperimentale. Le ragioni della morte intraoperatoria o postoperatoria sono evidenziate nella Tabella 1, insieme alle modifiche della procedura che hanno consentito il successo futuro nel raggiungimento dell'endpoint sperimentale. La complicanza operatoria più comune era la depressione respiratoria, che portava a ipossia e bradicardia. Il protocollo è stato modificato per includere più modalità di monitoraggio, tra cui 2 pulsossimetri e un monitor Doppler. Ciò consente il monitoraggio di backup nel caso in cui un monitor dovesse guastarsi o allentarsi durante la procedura chirurgica. Inoltre, i pigmenti della pelle nei conigli possono rendere la pulsossimetria meno affidabile, richiedendo il monitoraggio da più punti del corpo. Mentre l'induzione e il recupero sono comunemente considerati i periodi più rischiosi dell'anestesia, abbiamo osservato la depressione respiratoria che porta alla bradicardia in altri punti durante la procedura, evidenziando la necessità di un monitoraggio vigile dei segni vitali in ogni momento. Come intervento per questa complicanza, sono stati aggiunti al protocollo un ulteriore monitoraggio e doxapram dopo che le complicanze anestetiche sono state osservate durante le prime due coorti chirurgiche di animali (animali 1-4). Gli animali 12 e 13 appartenevano alla stessa coorte e gli è stato somministrato doxapram (2-5 mg/kg, per via endovenosa o sublinguale) a causa di uno scarso impulso respiratorio. Entrambi sono stati rianimati con successo dalla depressione respiratoria e dall'apnea intraoperatoria.
Le registrazioni telemetriche possono essere eseguite immediatamente una volta che i kit vengono restituiti alle gabbie domestiche e spesso mostrano segnali EEG di ampiezza relativamente bassa fino a quando il kit non si riprende completamente dall'anestesia (Figura 4). La morfologia del segnale ECG può cambiare leggermente durante i primi giorni di registrazione quando si formano cicatrici e la posizione del filo ECG è ulteriormente assicurata (Figura 4B). La qualità del segnale EEG ed ECG è robusta nel tempo senza degradazione del segnale, dato che un filo eccessivo viene lasciato arrotolato sottocutaneamente per consentire la crescita. Le registrazioni telemetriche possono essere personalizzate in base alle esigenze individuali dello studio, in quanto l'impianto può monitorare vari biopotenziali, tra cui temperatura, accelerazione e qualità del segnale, oltre a EEG ed ECG (Figura 5). L'analisi dei dati viene eseguita offline con il software Emka ECGAuto. Con la raccolta dei dati EEG ed ECG a 500 Hz, le batterie dell'impianto durano circa 55 giorni. Questo intervallo di tempo può essere esteso modificando i parametri di raccolta dei dati o con il campionamento intermittente. La programmazione del software può essere eseguita per facilitare il rilevamento delle crisi epilettiche in ECGAuto (Figura 5). I conigli impiantati vengono monitorati per eritema cutaneo, peso e temperatura per i primi 7 giorni dopo l'intervento chirurgico, poiché questo è il periodo a più alto rischio di infezione. Dopo l'intervento, i kit per conigli iniziano a mostrare un aumento di peso 1-3 giorni dopo la procedura, suggerendo un disagio minimo dalla procedura. Il personale veterinario esegue esami approfonditi 2-3 volte nella prima settimana postoperatoria ed esaminerà a intervalli più regolari se sorgono dubbi durante il recupero. Nella nostra esperienza, la cerva non disturba in modo significativo i siti di sutura una volta che i kit sono stati restituiti al nido, quindi la guarigione delle ferite è stata eccellente. Diversi kit hanno sviluppato sieromi benigni all'incisione cranica (Tabella 1), per i quali sono stati somministrati altri 3 giorni di carprofene, con conseguente risoluzione del sieroma senza ulteriori complicanze. A lungo termine, i conigli vengono osservati quotidianamente per segni di angoscia dal personale di laboratorio o dal personale di allevamento. Il personale veterinario è prontamente disponibile per esaminare e trattare i conigli in caso di dubbi. La qualità del segnale del telemetro viene controllata quotidianamente per verificare la presenza di malfunzionamenti del dispositivo o del cavo fino all'esaurimento della batteria.
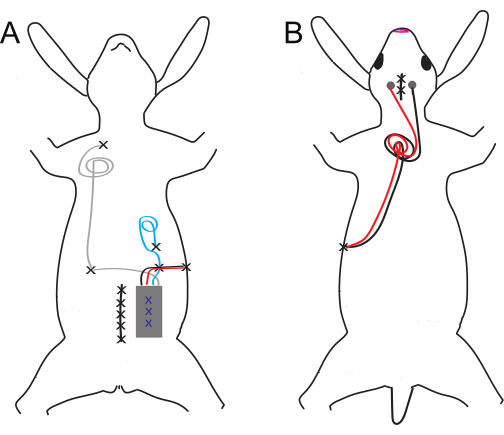
Figura 1: Schema dell'impianto ventrale e dorsale e del posizionamento dell'elettrodo. (A) Impianti ventrali e (B) dorsali. I siti di sutura sono indicati da X nere, mentre le X blu denotano suture di puntamento interne dell'impianto addominale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Fotografie del posizionamento chirurgico. (A) L'animale viene parzialmente ruotato per consentire l'impianto addominale, il posizionamento dell'elettrocatetere ECG toracico e il tunneling parziale dei fili verso il dorso nella stessa posizione chirurgica. Il naso è comodamente posizionato in una maschera facciale personalizzata stampata in 3D (a) e fissato con nastro adesivo agli arti anteriori. Il monitoraggio della SpO2 può essere intermittente, quindi vengono utilizzate più sonde (avambraccio destro (b) e arto posteriore destro (g)). Un catetere endovenoso è fissato nell'orecchio destro (c). Altri monitoraggi anestetici mostrati includono il monitoraggio della temperatura a infrarossi con biofeedback (d) e il monitoraggio Doppler utilizzando l'arteria femorale destra (e). La respirazione è monitorata visivamente dall'osservazione dell'animale o della sacca di respirazione. (B) Dopo l'impianto e il posizionamento dell'elettrocatetere ECG, il campo sterile viene rotto e il coniglio viene ruotato in posizione prona. I fili rimangono sterili all'interno di una sacca di alluminio (a*) mentre la superficie dorsale viene preparata per il posizionamento dell'elettrocatetere EEG. Clicca qui per visualizzare una versione più grande di questa figura.
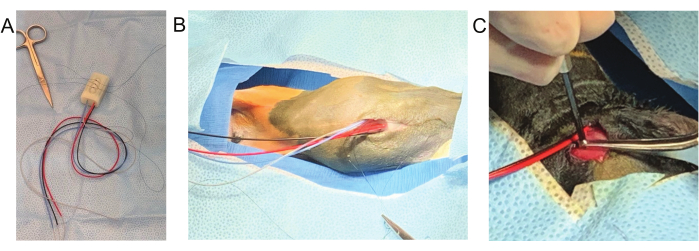
Figura 3: Passaggi chiave della procedura chirurgica. (A) Tre punti di sutura vengono fissati all'impianto prima dell'incisione cutanea. (B) Rimane una lunga coda per fissare l'impianto alla parete ventrale della cavità peritoneale. (C) Le viti del cranio sono tenute con una pinza fine mentre si avvitano nel cranio. Clicca qui per visualizzare una versione più grande di questa figura.
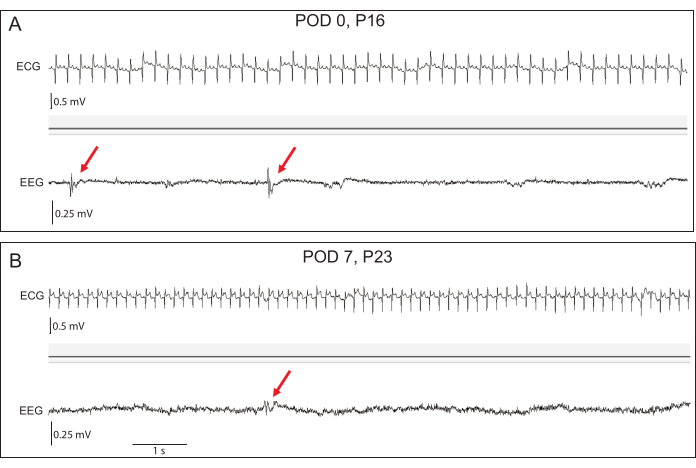
Figura 4: Registrazioni EEG ed ECG precoci rappresentative. (A) Al giorno postoperatorio (POD) 0, le ampiezze EEG al basale sono basse, ma nei conigli transgenici si possono osservare scariche epilettiformi interictali (frecce rosse). (B) Entro il POD 7, le ampiezze EEG sono aumentate. Le secrezioni epilettiformi rimangono evidenti. La fedeltà del segnale ECG è eccellente in entrambi i punti temporali. Clicca qui per visualizzare una versione più grande di questa figura.
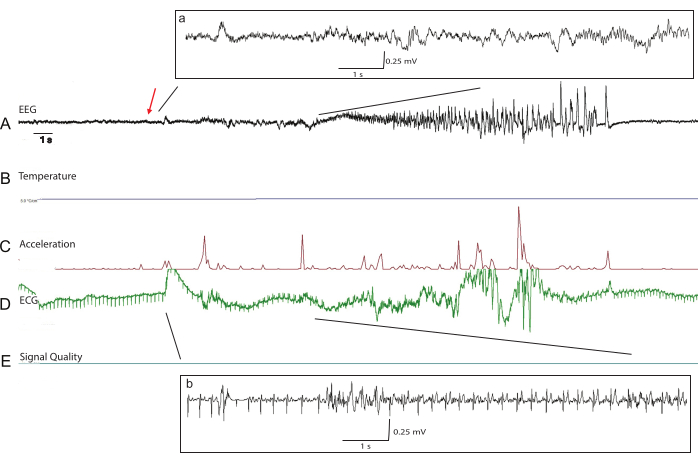
Figura 5: Tracciati grezzi rappresentativi durante una crisi tonico-clonica in un kit di coniglio transgenico P66. I dati pre-elaborati del telemetro includono (A) EEG, (B) temperatura, (C) accelerazione, (D) ECG e (E) misurazioni della qualità del segnale per l'analisi offline. La qualità del segnale di tutti i biopotenziali al giorno 52 postoperatorio rimane eccellente. L'insorgenza delle crisi è indicata dalla freccia rossa. I dati EEG elaborati (a) con aggiustamento basale all'inizio della crisi mostrano un'attenuazione del segnale durante la fase tonica della crisi. I dati ECG con un basale elaborato (b) sono visibili anche con un eccesso di artefatti muscolari durante la fase tonica della crisi. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Esiti chirurgici. Le complicanze chirurgiche e postoperatorie hanno portato a molteplici modifiche della procedura di posizionamento dell'impianto. Quattordici dei 16 conigli (87,5%) sono sopravvissuti alla procedura chirurgica e 2 conigli hanno avuto complicanze postoperatorie che hanno richiesto l'eutanasia. Gli animali sono visualizzati in ordine cronologico di data dell'intervento. Clicca qui per scaricare questa tabella.
Discussione
Il protocollo descritto per l'induzione, il monitoraggio e il supporto dell'anestesia bilancia le esigenze di ricerca per l'approccio chirurgico e la facilità con gli standard di riferimento delle cure veterinarie. Prima che il laboratorio adottasse il protocollo descritto come procedura standard, sono stati sperimentati diversi altri potenziali perfezionamenti, tra cui il posizionamento di un impianto sottocutaneo dorsale, l'uso di un tubo endotracheale o di una maschera laringea per le vie aeree e l'uso di uno stetoscopio esofageo per il monitoraggio della frequenza cardiaca. Tuttavia, alla fine tutti furono abbandonati per vari motivi. Sebbene vi sia spazio sottocutaneo sufficiente per il posizionamento della telemetria, l'incapacità di chiudere lo spazio morto a causa del corpo della telemetria e del design dell'uscita del filo, la sfida del posizionamento e dell'avvolgimento dei fili per consentire la crescita degli animali e i 2 cambi di posizione necessari durante l'intervento intraoperatorio per fissare gli elettrocateteri ECG hanno prolungato significativamente il tempo chirurgico e aggiunto sfide logistiche non necessarie. Inoltre, sebbene l'uso dell'anestesia con maschera non sia generalmente raccomandato, la mancanza di LMA di dimensioni adeguate e l'incapacità di fissare e mantenere un tubo endotracheale dopo il posizionamento hanno precluso queste opzioni. La necessità di capovolgere il kit durante l'intervento chirurgico e anche la necessità di accedere al collo e al dorso della testa limitavano le opzioni per fissare il tubo endotracheale anche dopo un posizionamento riuscito sulla base di una tecnica precedentemente descritta per l'intubazione neonatale del coniglio25. Abbiamo anche sperimentato l'uso di una sonda per stetoscopio esofageo per il monitoraggio della frequenza cardiaca dopo che il kit è stato drappeggiato in caso di perdita di segnale dal pulsossimetro o dal Doppler. Tuttavia, tutti gli stetoscopi esofagei disponibili in commercio erano troppo grandi, causando presumibilmente una risposta vagale e una bradicardia insostenibile ogni volta che ne veniva posizionato uno.
I risultati dell'anestesia sono stati probabilmente notevolmente migliorati dalla scelta di utilizzare il sevoflurano piuttosto che l'isoflurano per l'anestesia inalatoria. Il sevoflurano ha dimostrato di avere meno effetti vasodilatatori in alcuni tessuti di coniglio26 ed è ampiamente considerato nella letteratura umana come un miglioramento della stabilità cardiovascolare27. Di particolare importanza, dati i rischi dell'anestesia in un ambiente con una gestione delle vie aeree non ottimale, la rapida induzione ed emergenza del sevoflurano documentata in diverse specie 28,29,30 insieme alla capacità di titolare il dosaggio dell'anestetico ha portato a episodi anestetici abbreviati e ha consentito rapidi cambiamenti al piano anestetico in un contesto chirurgico in rapida evoluzione. Inoltre, si ritiene che il sevoflurano per via inalatoria sia significativamente meno avversivo all'induzione della maschera, contribuendo probabilmente a una riduzione della trattenuta del respiro nei conigli neonati31. Il doxapram nei conigli ha dimostrato di essere un efficace stimolante respiratorio nei conigli adulti32,33 e abbiamo apprezzato aneddoticamente una risposta nel nostro modello di coniglio neonatale.
Sebbene il successo di questo protocollo sia evidente, ci sono potenziali strade per il perfezionamento in termini di analgesia e monitoraggio anestetico. Poiché non esistono studi che indichino linee guida sul dosaggio per i conigli neonatali, i dosaggi e le frequenze sono stati mirati all'estremità inferiore delle raccomandazioni specie-specifiche. Una dose aggiuntiva di buprenorfina sulle piattaforme di monitoraggio dell'anestetico specifico per il recupero e la sperimentazione di roditori potrebbe aumentare ulteriormente il tasso di sopravvivenza e migliorare il benessere degli animali in questo modello. Un'ulteriore dose post-recupero di buprenorfina prolungherebbe gli effetti dell'analgesia multimodale, riducendo al minimo gli effetti documentati della depressione respiratoria dose-dipendente e della stasi gastrointestinale nei conigli34,35. Tutti gli animali post-chirurgici hanno avuto aumenti da moderati a gravi della glicemia postoperatoria immediata (250-400 mg/dL) utilizzando un glucometro portatile veterinario. Ciò potrebbe indicare una risposta esagerata allo stress dovuta al dolore postoperatorio periacuto sulla base di una recente pubblicazione che collega alti livelli di glucosio nel sangue e la gravità della malattia gastrointestinale nei conigli36. Poiché tutti gli animali sono tornati ad aumentare di peso entro 3 giorni o meno dalla procedura e hanno avuto un'attività normale e assenza di dolore nel sito di incisione entro 12-24 ore dopo l'intervento, non riteniamo che una somministrazione prolungata di oppioidi sia indicata per questo modello. I dispositivi di monitoraggio dell'anestesia specifici per i roditori, che includono il monitoraggio respiratorio, stanno diventando sempre più comuni con prodotti disponibili da vari produttori37. È ovvio che se questi sistemi funzionassero con altri animali di dimensioni comparabili con frequenze cardiache elevate simili come i conigli neonatali, allora l'utilizzo di uno di questi sistemi aumenterebbe la sopravvivenza dell'anestetico. Sfortunatamente, non abbiamo avuto accesso a questi prodotti o la possibilità di provarli prima di acquistarli per questo studio.
I dispositivi di telemetria impiantabili sono avanzati negli ultimi anni per includere una maggiore durata della batteria, impianti più piccoli e la capacità di misurare più biopotenziali di interesse in roditori, canini e primati non umani, consentendo agli animali di muoversi liberamente, riducendo lo stress 38,39,40. L'uso di dispositivi di telemetria impiantabili per la registrazione simultanea di EEG ed ECG nei conigli offre vantaggi rispetto agli attuali metodi legati41. Con i dispositivi impiantabili, i conigli possono muoversi liberamente nella loro gabbia domestica senza legami o restrizioni, e i cuccioli sono in grado di tornare al nido con la cerva e la lettiera, riducendo lo stress e promuovendo il benessere degli animali. Attente procedure di monitoraggio postoperatorio per segni di infezione o stress consentono anche un intervento veterinario precoce in caso di complicanze. I kit di impianto consentono la valutazione dell'EEG durante i periodi critici dello sviluppo cerebrale, che può essere essenziale nei modelli di epilessie genetiche senza alterare le pratiche di stabulazione. Inoltre, i dati di telemetria vengono acquisiti continuamente per tutta la durata della batteria dell'impianto, consentendo l'acquisizione di rari eventi SUDEP. L'emergere di conigli transgenici offre opportunità uniche per modellare le malattie umane. Inoltre, l'uso di modelli di coniglio può offrire vantaggi significativi rispetto ad altre valutazioni di animali di grandi dimensioni necessarie per l'approvazione dei farmaci da parte della FDA. Metodi come quello presentato consentiranno una valutazione avanzata della fisiologia cardiaca e neurale in questi modelli, nonché la loro alterazione mediante intervento terapeutico.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori sono grati per il finanziamento da parte del NIH R61NS130070 a LLI.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 inch elastic wrap - Coban or Vetwrap | 3M | https://www.3m.com/3M/en_US/p/d/b00003186/ | |
| 4-0 PDS monofilament suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| 5-0 Ethilon nylon suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| Acquisition computer | Dell | https://www.dell.com/en-us | |
| Adhesive surgical towels | N/A | N/A | |
| Anesthesia circuit - Jackson-Reevs with 0.5 L rebreathing bag | JorVet | J0248GA | |
| Betadine scrub | N/A | N/A | |
| Bupivicaine (0.5%) | N/A | N/A | Diluted to 2.5 mg/mL prior to administration |
| Buprenorphine (0.3 mg/mL) | N/A | N/A | Diluted to 0.03 mg/mL prior to administration |
| Burr - 1.00 mm | Cell Point Scientific | 60-1000 | to drill skull |
| Cafazolin (1 g lypholized) | N/A | N/A | Diluted to 50 mg/mL |
| Carprofen (50 mg/mL) | MWI Veterinary | Diluted to 25 mg/mL prior to administration | |
| Cotton tipped applicators | N/A | N/A | |
| Custom 3-D printed face mask | N/A | https://www.thingiverse.com/thing:923725 | |
| Dental acrylic | N/A | N/A | |
| Diet Gel Criticare | Clear H2O | 72-05-5042 | Nutritional support |
| Dopper Gel - Aquasonic | Patterson | 07-890-5542 | |
| Doppler - Vet-Dop2 | Patterson | 07-888-8986 | |
| Doxapram (20 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Dumont #5 Fine Forceps | Fine Science Tools | 11254-20 | For holding screws |
| Duraprep | 3M | 8630 | Final skin prep |
| ecgAuto data analysis software | emka technologies | N/A | |
| Epinephrine (1:1000) | MWI Veterinary | N/A | Emergency only |
| Gauze | N/A | N/A | |
| Glucometer ipet Pro | MWI Veterinary | 63867 | Monitor if poor recovery |
| Glycopyrrolate (0.2 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Gram scale | N/A | N/A | |
| Hemostats | Fine Science Tools | 13008-12 | Hold wire loops while tying the loop in place |
| Ideal Micro-drill | Cell Point Scientific | 67-1204 | To drill skull |
| Incubator | DRE-veterinary (Infantia - NB1) | N/A | |
| Induction box | VetEquip | 941444 | |
| Infared heating pad - RightTemp Jr | Kent Scientific Corporation | RT-0502 | |
| IOX2 data acquisition software | emka technologies | N/A | |
| IV Catheter - Covidein Monoject 26 G, 3/4 inch PTFE | Patterson | 07-836-8494 | |
| ketamine (100 mg/mL) | MWI Veterinary | N/A | |
| Medical tape | N/A | N/A | |
| Narrow Pattern Forceps - Straight/12 cm | Fine Science Tools | 11002-12 | |
| Neonatal stethescope | Ultrascope | N/A | |
| Olsen-Hegar Needle holder with scissors - 12 cm | Fine Science Tools | 12002-12 | For suturing |
| Ophthalmic ointment Puralube | MWI Veterinary | N/A | Administered to both eyes during anesthesia |
| Opthalmic Lubricant - Paralube Vet | Patterson | 07-888-2572 | |
| Pulse oximeter (AccuWave Portable ) | Patterson | 07-892-9128 | For prep and recovery; reads HR up to 400 |
| Pulse oximeter (SDI - Vet/Ox plus 4700) | Heska | N/A | Intra-operative; no longer producted |
| Receiver | emka technologies | N/A | 1 receiver for every 4 telemetry implants |
| Rectal thermometer | N/A | N/A | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scissors | Fine Science Tools | 14002-12 | To cut drape |
| Screw driver - 1.0 mm | N/A | N/A | From mini-screwdriver set for electronics |
| Screws 00-96 x 3/32 (2.4 mm) | Protech International | 8L0X3905202F | |
| Sevoflurane | MWI Veterinary | Maintenance anesthesia | |
| Sevoflurane vaporizer and anesthesia machine | N/A | N/A | |
| Skin glue, Gluture | MWI Veterinary | 34207 | Apply sparingly with syringe |
| Small scissors | Fine Science Tools | 14084-08 | |
| Sterile aluminum foil | N/A | N/A | To wrap wires prior to rotating animal |
| Sterile paint brush | N/A | N/A | To apply dental acrylic |
| Sterile Saline | N/A | N/A | |
| Sterile surgical gloves | N/A | N/A | |
| Sterile ultrasound cover | N/A | N/A | To cover the drill |
| Sterile Water | N/A | N/A | For cefazolin reconstitution |
| Surgical blade no. 15 | N/A | N/A | |
| Surgical drape | N/A | N/A | |
| Surgical gown | N/A | N/A | |
| Swivel connector - Jorgensen Labs | Patterson | 07-802-2349 | To connect anesthesia circuit to face mask |
| Telemetry implant | emka technologies | easyTEL+_M1_EETA_B_35 | |
| Trocar | SAI | TRO-10-6 | To tunnel wires |
Riferimenti
- Bagnall, R. D., Crompton, D. E., Semsarian, C. Genetic Basis of Sudden Unexpected Death in Epilepsy. Front Neurol. 8, 348 (2017).
- Surges, R., et al. Pathologic cardiac repolarization in pharmacoresistant epilepsy and its potential role in sudden unexpected death in epilepsy: a case-control study. Epilepsia. 51 (2), 233-242 (2010).
- Surges, R., Thijs, R. D., Tan, H. L., Sander, J. W. Sudden unexpected death in epilepsy: risk factors and potential pathomechanisms. Nat Rev Neurol. 5 (9), 492-504 (2009).
- Shorvon, S., Tomson, T. Sudden unexpected death in epilepsy. Lancet. 378 (9808), 2028-2038 (2011).
- Schuele, S. U., et al. Video-electrographic and clinical features in patients with ictal asystole. Neurology. 69 (5), 434-441 (2007).
- Massey, C. A., Sowers, L. P., Dlouhy, B. J., Richerson, G. B. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. 10 (5), 271-282 (2014).
- Sahly, A. N., Shevell, M., Sadleir, L. G., Myers, K. A. SUDEP risk and autonomic dysfunction in genetic epilepsies. Auton Neurosci. 237, 102907 (2022).
- Cooper, M. S., et al. Mortality in Dravet syndrome. Epilepsy Res. 128, 43-47 (2016).
- Negishi, Y., et al. SCN8A-related developmental and epileptic encephalopathy with ictal asystole requiring cardiac pacemaker implantation. Brain Dev. 43 (7), 804-808 (2021).
- Meisler, M. H., et al. SCN8A encephalopathy: Research progress and prospects. Epilepsia. 57 (7), 1027-1035 (2016).
- Watanabe, H., et al. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest. 118 (6), 2260-2268 (2008).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci Transl Med. 1 (2), 2ra6 (2009).
- Nerbonne, J. M. Mouse models of arrhythmogenic cardiovascular disease: challenges and opportunities. Curr Opin Pharmacol. 15, 107-114 (2014).
- Frasier, C. R., et al. Channelopathy as a SUDEP Biomarker in Dravet Syndrome patient-derived cardiac myocytes. Stem Cell Rep. 11 (3), 626-634 (2018).
- Camacho, P., Fan, H., Liu, Z., He, J. -. Q. Small mammalian animal models of heart disease. Am J Cardiovasc. 6 (3), 70-80 (2016).
- Brodbelt, D. Perioperative mortality in small animal anaesthesia. Vet J. 182 (2), 152-161 (2009).
- Lee, H. W., Machin, H., Adami, C. Peri-anaesthetic mortality and nonfatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases. Vet Anaes Anal. 45 (4), 520-528 (2018).
- Comolli, J., et al. Comparison of endoscopic endotracheal intubation and the v-gel supraglottic airway device for spontaneously ventilating New Zealand white rabbits undergoing ovariohysterectomy. Vet Rec. 187 (10), e84-e84 (2020).
- Grint, N. J., Sayers, I. R., Cecchi, R., Harley, R., Day, M. J. Postanaesthetic tracheal strictures in three rabbits. Lab Anim. 40 (3), 301-308 (2006).
- Phaneuf, L. R., Barker, S., Groleau, M. A., Turner, P. V. Tracheal injury after endotracheal intubation and anesthesia in rabbits. J Am Assoc Lab Anim Sci. 45 (6), 67-72 (2006).
- Quesenberry, K. E., Orcutt, C. J., Mans, C., Carpenter, J. W. Gastrointestinal Diseases of Rabbits. Ferrets, Rabbits, and Rodents. , (2020).
- Desai, A., Macrae, D. . Cardiovascular Physiology in Infants, Children, and Adolescents. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. , (2020).
- Bansal, N., Momin, S., Bansal, R., Venkata, S. K. R. G., Ruser, L., Yusuf, K. Pharmacokinetics of drugs: newborn perspective. Pediatr Med. 7, 19 (2024).
- Trachsel, D., Erb, T. O., Hammer, J., von Ungern-Sternberg, B. S. Developmental respiratory physiology. Paediat Anaesth. 32 (2), 108-117 (2022).
- Benito, S., Hadley, S., Camprubí-Camprubí, M., Sanchez-de-Toledo, J. Blind endotracheal intubation in neonatal rabbits. J Vis Exp. 168, e61874 (2021).
- Okamoto, S., Matsuura, N., Ichinohe, T. Effects of volatile anesthetics on oral tissue blood flow in rabbits: A comparison among isoflurane, sevoflurane, and desflurane. J Oral Maxillofac Surg. 73 (9), 1714.e1-1714.e8 (2015).
- Elshalakany, N. A., Salah, A. M. Comparative study: evaluation of the effect of sevoflurane versus isoflurane in general anesthesia for pediatric patients undergoing cardiac catheterization. Egypt J Anaesth. 38 (1), 409-414 (2022).
- Anjana, R. R., Parikh, P. V., Mahla, J. K., Kelawala, D. N., Patel, K. P., Ashwath, S. N. Comparative evaluation of isoflurane and sevoflurane in avian patients. Vet World. 14 (5), 1067-1073 (2021).
- Johnson, R. A., Striler, E., Sawyer, D. C., Brunson, D. B. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs. Am J Vet Res. 59 (4), 478-481 (1998).
- Campbell, C., Nahrwold, M. L., Miller, D. D. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth. 42 (10), 884-890 (1995).
- TerRiet, M. F., et al. Which is most pungent: isoflurane, sevoflurane, or desflurane. Br J Anaesth. 85 (2), 305-307 (2000).
- Khanna, V. K., Pleuvry, B. J. A study of naloxone and doxapram as agents for the reversal of neuroleptanalgesic respiratory depression in the conscious rabbit. Br J Anaesth. 50 (9), 905-912 (1978).
- Flecknell, P. A., Liles, J. H., Wootton, R. Reversal of fentanyl/fluanisone neuroleptanalgesia in the rabbit using mixed agonist/antagonist opioids. Lab Anim. 23 (2), 147-155 (1989).
- Shafford, H. L., Schadt, J. C. Respiratory and cardiovascular effects of buprenorphine in conscious rabbits. Vet Anaesth Analg. 35 (4), 326-332 (2008).
- Feldman, E. R., Singh, B., Mishkin, N. G., Lachenauer, E. R., Martin-Flores, M., Daugherity, E. K. Effects of cisapride, buprenorphine, and their combination on gastrointestinal transit in New Zealand white rabbits. J Am Assoc Lab Anim Sci. 60 (2), 221-228 (2021).
- Harcourt-Brown, F. M., Harcourt-Brown, S. F. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170 (26), 674-674 (2012).
- Rivera, D. A., Buglione, A. E., Ray, S. E., Schaffer, C. B. MousePZT: A simple, reliable, low-cost device for vital sign monitoring and respiratory gating in mice under anesthesia. PLoS One. 19 (3), e0299047 (2024).
- Nicou, C. M., Passaglia, C. L. Characterization of intraocular pressure variability in conscious rats. Exp Eye Res. 239, 109757 (2024).
- Sadko, K. J., Leishman, D. J., Bailie, M. B., Lauver, D. A. A simple accurate method for concentration-QTc analysis in preclinical animal models. J Pharmacol Toxicol Methods. 128, 107528 (2024).
- Vuong, J. S., Garrett, J. J., Connolly, M. J., York, A. R., Gross, R. E., Devergnas, A. Head mounted telemetry system for seizures monitoring and sleep scoring on non-human primate. J Neurosci Methods. 346, 108915 (2020).
- Bosinski, C., Wagner, K., Zhou, X., Liu, L., Auerbach, D. S. Multi-system monitoring for identification of seizures, arrhythmias and apnea in conscious restrained rabbits. J Vis Exp. (169), e62256 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon