Method Article
Implantation von Elektroenzephalogramm- und Elektrokardiogramm-Telemetriegeräten in Kaninchen-Kits für Neugeborene
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Mechanismen des plötzlichen unerwarteten Todes bei Epilepsie (SUDEP) sind nur unzureichend verstanden und lassen sich nur schwer aus aktuellen Modellen übertragen. Transgene Kaninchen könnten Einblicke in diese Mechanismen geben. Wir beschreiben ein Verfahren für langfristige, kontinuierliche Elektroenzephalographie- und Elektrokardiographie-Aufzeichnungen in transgenen Kaninchen-Kits zur Bewertung schwerwiegender Ereignisse, die zum Tod führen können.
Zusammenfassung
Pathogene Varianten in Ionenkanal-Genen sind mit einer hohen Rate an plötzlichen unerwarteten Todesfällen bei Epilepsie (SUDEP) verbunden. Die Mechanismen von SUDEP sind nur unzureichend verstanden, können aber neben Krampfanfällen auch autonome Dysfunktionen und Herzrhythmusstörungen beinhalten. Einige Ionenkanalgene werden sowohl im Gehirn als auch im Herzen exprimiert, was möglicherweise das Risiko für SUDEP bei Patienten mit Ionenkanalopathien im Zusammenhang mit Epilepsie und Herzrhythmusstörungen erhöht. Transgene Kaninchen, die Epilepsievarianten exprimieren, bieten einen ganzen Organismus, um die komplexe Physiologie von SUDEP zu untersuchen. Wichtig ist, dass Kaninchen die menschliche Herzphysiologie besser nachbilden als Mausmodelle. Bei Kaninchenmodellen sind jedoch zusätzliche gesundheitliche und anästhesietechnische Überlegungen erforderlich, wenn sie sich invasiven Überwachungsverfahren unterziehen. Wir haben eine neuartige Methode entwickelt, um ein Telemetriegerät für die langfristige simultane Überwachung von Elektroenzephalogrammen (EEG) und Elektrokardiogrammen (EKG) in Kaninchen-Kits für Neugeborene chirurgisch zu implantieren. Hier demonstrieren wir chirurgische Methoden zur Implantation eines Telemetriegeräts in P14-Kits (Gewichtsbereich 175-250 g) mit detaillierter Berücksichtigung des chirurgischen Ansatzes, einer angemessenen Anästhesie und Überwachung sowie der postoperativen Versorgung, was zu einer niedrigen Komplikationsrate führt. Diese Methode ermöglicht eine kontinuierliche Überwachung der neuronalen und kardialen Elektrophysiologie während kritischer Punkte in der Entwicklung von Herzrhythmusstörungen, Krampfanfällen und potenziellem SUDEP in Kaninchenmodellen für genetische oder erworbene Epilepsien.
Einleitung
Der plötzliche unerwartete Tod bei Epilepsie (SUDEP) ist eine der häufigsten Todesursachen bei Patienten mit Epilepsie. Die Mechanismen von SUDEP sind nur unzureichend verstanden, umfassen aber möglicherweise autonome Dysfunktion, Apnoe und Herzrhythmusstörungen zusätzlich zu Anfällen 1,2,3,4,5,6,7. Patienten mit kanalopathiebedingten genetischen Epilepsien gehören zu den höchsten SUDEP-Raten. So tritt SUDEP bei bis zu 20 % der Patienten mit Varianten im spannungsgesteuerten Natriumkanal-Gen SCN1A8 auf, dem Gen, das für das Dravet-Syndrom verantwortlich ist, eine genetische Epilepsie, die im ersten Lebensjahr beginnt. Viele epilepsiegebundene Ionenkanalgene werden sowohl im Gehirn als auch im Herzen exprimiert, wobei Labor- und klinische Daten darauf hindeuten, dass Herzrhythmusstörungen bei Patienten mit kanalopathiebedingten genetischen Epilepsien vorliegen können7, 9,10,11,12, was möglicherweise ihr SUDEP-Risiko aufgrund einer anfallsinduzierten tödlichen Herzrhythmusstörung oder des gleichzeitigen Auftretens von Anfällen und Arrhythmien erhöht. Die Evaluierung von SUDEP im Labor bringt zahlreiche Herausforderungen mit sich. Aus kardialer Sicht unterscheiden sich die kardialen Aktionspotentiale bei Mäusen stark von denen beim Menschen13, und humane iPSC-Herzmyozytenmodelle14 können die Komplexität des gesamten Organismus nicht replizieren. Transgene Kaninchenmodelle genetischer Epilepsien bieten ein ideales System zur Untersuchung von SUDEP, da die Herzphysiologie von Kaninchen die des Menschen besser repliziert13,15, während sie gleichzeitig einen ganzen Organismus zur Untersuchung komplexer Pathophysiologie bieten. Da SUDEP bereits beim ersten Anfall auftreten kann, ist die Bewertung dieser Tiermodelle von einem frühen Zeitpunkt an unerlässlich, um das Auftreten von Anfällen und Herzrhythmusstörungen zu verstehen. Die Videoaufzeichnung während der Neugeborenenperiode ist eine Herausforderung, da sich die Kaninchenbabys oft noch im Nest befinden. Eine kontinuierliche Aufzeichnung eines Elektroenzephalogramms (EEG) oder Elektrokardiogramms (EKG) mit einem herkömmlichen kabelgebundenen System ist nicht möglich, solange sich die Kits beim Muttertier befinden. Es ist unwahrscheinlich, dass bei der intermittierenden Aufzeichnung seltene, terminale Ereignisse im Zusammenhang mit SUDEP erfasst werden. Wir haben uns daher der drahtlosen implantierbaren Telemetrieüberwachung zugewandt, um eine langfristige, kontinuierliche, gleichzeitige EEG- und EKG-Aufzeichnung in Kaninchen-Kits zu ermöglichen.
Der Schlüssel zum Erfolg dieses Protokolls ist eine angemessene Anästhesie und postoperative Unterstützung für diese gefährdeten Tiere. Kaninchen haben im Vergleich zu Hunden und Katzen (0,17-0,24%) aufgrund einzigartiger anatomischer und physiologischer Merkmale ein viel höheres Risiko für den Tod an Anästhetika (1,39%-4,8%) 16,17. Zu den Hauptursachen für dieses erhöhte Anästhesierisiko gehören ein suboptimales Atemwegsmanagement und akute postoperative Komplikationen. Mehrere Faktoren tragen zu den Schwierigkeiten der Intubation bei Kaninchen bei, darunter ein langes, schmales Maul mit breiter Zunge, ein spitzer Winkel zwischen Mund und Kehlkopf, eine dorsale Verschiebung der Epiglottis, eine erhöhte Anfälligkeit für Kehlkopftraumata und eine erhöhte Neigung zu Laryngospasmus 18,19,20. Nach der Sofortanästhesieepisode besteht bei Kaninchen das Risiko, ein lebensbedrohliches gastrointestinales Stauungssyndrom zu entwickeln. Dies ist ein komplexes, multifaktorielles Problem, und es wird postuliert, dass die Anästhesie über direkte Arzneimittelwirkungen, die die Magenmotilität und/oder sekundäre Magersucht nach dem Verfahren hemmen, aus irgendeinem Grund (nicht gelinderte Schmerzen, Übelkeit usw.) dazu beiträgt21. Urheberrecht
Die einzigartige Physiologie von Kaninchen-Neugeborenen und Säuglingen verschärft die Herausforderungen, die mit Anästhesie und Operation verbunden sind. Kaninchen haben altriciale Jungtiere, die mit unterentwickelten Mechanismen für physiologische Homöostase und besonderen anatomischen Überlegungen geboren werden. Der intravenöse Zugang und die Überwachung sind schwierig, da die meisten kommerziellen Produkte nicht für die geringe Gefäßgröße, die hohe Ruheherzfrequenz und die pigmentierte Haut von Kaninchen-Kits mit holländischem Gürtel und neuseeländischem Weißkreuz optimiert sind. Da das Herzzeitvolumen bei Neugeborenen im Wesentlichen von der Herzfrequenz abhängt22 und die Arzneimittelclearance über die Nieren oder Leber im Vergleich zu Erwachsenen im Allgemeinen verringert ist23, sind Überlegungen zur geeigneten Arzneimittelauswahl und Dosierung von entscheidender Bedeutung. Es wird angenommen, dass die Hauptursache für den Tod von Anästhetika bei Kaninchen sekundär zu Atemdepression und Apnoe ist. Zusätzlich zu den bereits bei allen Kaninchen diskutierten Problemen des Atemwegsmanagements haben Neugeborene angesichts von Hypoxämie und Hyperkapnie einen verminderten Atemantrieb, was diesen ohnehin schon schwierigen Aspekt der Anästhesie noch riskanter macht24.
In diesem Protokoll beschreiben wir eine erfolgreiche Methode zur Implantation von EEG- und EKG-Telemetrie (Abbildung 1) in einem neonatalen Kaninchenmodell der Epilepsie mit einer hohen chirurgischen und anästhetischen Überlebensrate. Diese Informationen werden es anderen Forschern ermöglichen, anspruchsvolle Kaninchenmodelle für Neugeborene anzugehen, um die Forschung zu Epilepsie, Herzrhythmusstörungen und verwandten neurologischen Entwicklungsstörungen voranzutreiben.
Protokoll
Alle beschriebenen Arbeiten wurden vom Institutional Animal Care and Use Committee der University of Michigan im Rahmen eines genehmigten Tierverwendungsprotokolls überprüft und genehmigt und stehen in Übereinstimmung mit den einschlägigen Bundesgesetzen und -richtlinien, einschließlich des USDA Animal Welfare Act und der NIH Public Health Service Policy. Die University of Michigan ist eine AAALACi-akkreditierte Institution.
1. Vorbereitung der Tiere
- Grobrasur-Sets (Alter P14-P19, Gewicht >175 g) 1-2 Tage vor dem Eingriff, um die Narkosezeit am Tag der Operation mit einer Haarschneidemaschine zu minimieren.
- Autoklavieren oder gassterilisieren Sie alle chirurgischen Instrumente und Materialien (so weit wie möglich) zur Vorbereitung des Eingriffs.
- Induzieren Sie eine Anästhesie mit Ketamin (10 mg/kg IM), Buprenorphin HCl (0,01 mg/kg IM) 0,3 mg/ml, verdünnt auf 0,03 mg/ml, und Sevofluran und Sauerstoff über eine Maskenanästhesie unter Verwendung eines nicht rückatmenden Kreislaufs.
- Legen Sie einen 26 G 3/4" intravenösen (IV) Katheter in die Ohrvene (bevorzugt) oder die Kopfvene und spülen Sie ihn mit heparinisierter Kochsalzlösung 10 Einheiten/ml.
- Rasieren Sie Bauch, Brust, Rücken, Nacken und Kopf mit einer Klinge #40 oder #50 so nah wie möglich an der Haut.
- Tragen Sie eine nicht medikamentöse Gleitsalbe auf, um Hornhautgeschwüre zu verhindern.
- Verabreichen Sie Analgetika (Carprofen 4 mg/kg SQ - verdünnt auf 25 mg/ml) und perioperatives Antibiotikum (Cefazolin 20 mg/kg i.v., verdünnt auf 50 mg/ml). Verabreichen Sie Antibiotika alle 90-180 Minuten der Operationszeit erneut.
2. Chirurgische Vorbereitung (Abbildung 2)
- Bringen Sie das Narkoseset auf den Operationstisch und legen Sie es in Rückenlage auf ein Infrarot-Heizkissen, das über ein Rektalthermometer gesteuert wird.
- Legen Sie Nase und Mund in eine maßgeschneiderte 3D-gedruckte Gesichtsmaske, die mit einem Drehanschluss an einen nicht rebreathenden Jackson-Rees-Kreislauf (0,5-l-Beutel) angeschlossen ist, und halten Sie die Sevofluran-Anästhesie (1,5 %-7 % zur Wirkung) mit einem Sauerstofffluss von 2 l/min aufrecht.
- Halten Sie die Anästhesie mit Sevofluran aufrecht und überwachen Sie die Narkosetiefe mit einem Pulsoximeter entweder am Ohr oder an der Pfote und/oder einem Doppler an der Oberschenkelarterie oder direkt am Herzen.
- Passen Sie die Anästhesie während des gesamten Eingriffs an, um die Herzfrequenz (HF) zwischen 180 und 260, die Sauerstoffsättigung >85 % und die Atemfrequenz zwischen 10 und 50 Atemzügen pro Minute zu halten (direkte Visualisierung von Auslenkungen oder Bewegungen des Atembeutels).
HINWEIS: Halten Sie Notfallmedikamente bereit (Glycopyrrolat, Adrenalin, Doxapram). - Befestigen Sie das Set an der Gesichtsmaske, indem Sie die vorderen Gliedmaßen vorsichtig mit der Maske verbinden.
- Positionieren Sie das Set in einer leicht rechtsseitlichen Position, indem Sie das linke Hinterbein locker auf dem Operationstisch befestigen.
- Bereiten Sie den gesamten Bauch mit einem erwärmten chirurgischen Peeling vor, das abwechselnd Betadin und sterile Kochsalzlösung enthält.
HINWEIS: Auf Wunsch kann eine zusätzliche chirurgische Lösung verwendet werden, um das Peeling zu beenden. Der Chirurg, der spezielle Kittel, Haarhauben und Schuhüberzieher trägt, schrubbt aseptisch und zieht sterile Kittel und Handschuhe an, um den Eingriff unter sterilen Bedingungen durchzuführen. - Legen Sie selbstklebende OP-Tücher auf beide Seiten des Sets und decken Sie es mit einem großen OP-Tuch ab. Schneide ein Loch in geeigneter Größe, um Bauch und Brust freizulegen.
- Öffnen Sie das Implantat auf das Operationsfeld und platzieren Sie nicht resorbierbare Ankernähte in jedes der Implantatankerlöcher. Lassen Sie die Naht mit einem 5-6 cm langen Schwanz befestigt (Abbildung 3A). Legen Sie das Implantat in eine Schüssel mit erwärmter, steriler Kochsalzlösung.
3. Platzierung des Implantats im Bauch
- Nachdem Sie für eine ausreichende Anästhesie gesorgt haben, machen Sie mit einem Skalpell einen 3 cm langen Schnitt durch die Haut entlang der Linea alba.
- Machen Sie einen vorsichtigen Schnitt durch den Muskel, um die Bauchhöhle zu öffnen.
- Platzieren Sie das Implantat in den kranialen Teil der Bauchhöhle und positionieren Sie es links vom Schnitt.
- Verwenden Sie einen Trokar, um den negativen EKG-Draht etwa 2 cm rechts des Schnitts aus der Bauchhöhle und der Haut zu tunneln. Tunneln Sie die restlichen 3 Drähte 3-4 cm links vom Schnitt, damit das Implantat bequem in der Bauchhöhle sitzen kann.
- Befestigen Sie das Implantat mit den Ankernähten an der ventralen Wand der Bauchhöhle, um sicherzustellen, dass kein Darmeinschluss entsteht (Abbildung 3B).
- Verschließen Sie die Bauchdecke mit einer resorbierbaren Naht in einem kontinuierlichen Muster.
- Verschließen Sie den Hautschnitt mit einer nicht resorbierbaren Naht in einem unterbrochenen Muster.
4. Platzierung der EKG-Ableitungen
- Tunneln Sie die negative EKG-Leitung subkutan zur rechten oberen Brust auf Höhe der ersten Rippe.
- Präparieren Sie stumpf eine subkutane Tasche, um etwa 10 cm Draht locker aufzuwickeln.
HINWEIS: Enge Spulen unter der Haut können zu Hauterosion und Drahtfreilegung führen. - Schneiden Sie den überschüssigen Draht ab und erstellen Sie eine Schlaufe mit dem freiliegenden Draht, indem Sie das Ende mit einer nicht resorbierbaren Naht an den isolierten Draht binden.
- Befestigen Sie die Schlaufe mit 2 nicht resorbierbaren Nähten am Muskel.
- Den Bauchfellmuskel rechts um den Draht herum mit 1-2 resorbierbaren Nähten in einem unterbrochenen Muster verschließen.
- Verschließen Sie die Haut an der rechten oberen Brust und am rechten Bauch mit 2-3 nicht resorbierbaren Nähten in einem unterbrochenen Muster.
- Tunneln Sie die positive EKG-Leitung zur linken unteren Rippe und wiederholen Sie die obigen Schritte, um sie am Muskel zu befestigen und den Schnitt zu schließen.
- Tunnel: Das EEG führt subkutan so weit wie möglich zur linken lateralen Seite in das Operationsfeld.
- Fügen Sie dem Peritonealmuskel links um die austretenden Drähte herum 1 resorbierbare Naht hinzu. Verschließen Sie die Haut mit einer nicht resorbierbaren Naht in einem unterbrochenen Muster.
- Wickeln Sie die freiliegenden EEG-Drähte mit steriler Alufolie ein.
5. Vorbereitung der Rückenfläche
- Ein unsteriler Assistent entfernt dann das sterile Abdecktuch und die Beinfessel.
- Drehen Sie das Kit in die Bauchlage (Abbildung 2B) und stellen Sie sicher, dass die Gesichtsmaske sicher an Ort und Stelle bleibt, indem Sie den Drehanschluss zwischen Gesichtsmaske und Schaltung verwenden. Passen Sie die Pulsox- und/oder Dopplermonitore nach Bedarf an, um eine kontinuierliche Anästhesieüberwachung zu gewährleisten.
- Bereiten Sie das Operationsfeld mit einem Betadin-Peeling vor, das den Kopf, den Hals und den gesamten Rücken umfasst, wobei Sie darauf achten, den Bereich der austretenden Drähte auf der linken Seite zu schrubben.
- Der Chirurg legt dann ein steriles Klebetuch unter die linke Seite, während das Aluminiumfolienpaket mit den Drähten von einem unsterilen Assistenten gehalten wird.
- Entfernen Sie steril und vorsichtig die Drähte aus der Aluminiumpackung und legen Sie sie auf das sterile Feld. Zum Schluss mit sterilen Handtüchern drapieren.
- Decken Sie es mit einem sterilen Tuch ab und schneiden Sie ein Fenster aus, das groß genug ist, um das gesamte sterile Feld freizulegen.
6. Platzierung der EEG-Elektroden
- Machen Sie einen 3 cm langen Schnitt durch die Kopfhaut an der Mittellinie, um den Schädel freizulegen.
- Verwenden Sie einen Trokar, um die EEG-Ableitungen von der linken Seite zum Schädel subkutan zu tunneln.
- Reinigen und kratzen Sie das Periost mit einem Skalpell von den freiliegenden Scheitelknochen ab.
- Setzen Sie einen Handbohrer in eine sterile Ultraschallabdeckung ein. Führen Sie einen 1,0 mm Bohrfräser in den Bohrer ein.
- Bohren Sie bilaterale Fräslöcher in die Scheitelknochen etwa 0,5 cm vor dem Lambda und 0,5 cm lateral der sagittalen Naht.
HINWEIS: Vorsicht bei dem auf den dorsalen Schädel ausgeübten Druck, da dies die ventralen Atemwege verschließen kann, daher ist die Atemüberwachung an dieser Stelle des Eingriffs von entscheidender Bedeutung. Ein stetiger oder signifikanter Abfall der Herzfrequenz kann auf einen Atemverschluss (Bradykardie als Folge einer Apnoe) hinweisen und sollte eine sofortige Beurteilung und Maßnahmen erforderlich machen. - Setze mit einer feinen Pinzette eine Schraube in das Fräsloch. Mit dem Schraubendreher etwa zur Hälfte einführen (Abbildung 3C).
- Sezieren Sie stumpf eine subkutane Tasche entlang des Nackens, um etwa 10 cm Draht locker aufzuwickeln.
- Schneiden Sie den überschüssigen Draht ab. Entfernen Sie die Isolierung von der Spitze und dehnen Sie den Draht.
- Erstellen Sie eine Schlaufe am Ende des freiliegenden Drahtes, indem Sie einen Knoten binden und eine kleine Schlaufe aufbewahren. Lege die Schlaufe über die Schraube und ziehe die Schraube am Schädel fest, wobei du darauf achtest, dass der Draht die Schraube berührt. Verlegen Sie das Erdungskabel auf der linken Seite und das Aufzeichnungskabel auf der rechten Seite.
- Bewerten Sie die Telemetriesignale in der Analysesoftware auf Genauigkeit, sobald alle Kabel an Ort und Stelle sind. Das EEG-Signal erscheint mit einer niedrigen Amplitude, während das Kit sediert ist.
- Befestigen Sie die Schrauben und Drähte mit Zahnacryl am Schädel und lassen Sie ihn vollständig aushärten.
- Verschließen Sie die Haut mit einer nicht resorbierbaren Naht am Kopf und an der linken Flanke.
- Injizieren Sie Bupivacain (Höchstdosis 2 mg/kg von 5 mg/ml, verdünnt auf 2,5 mg/ml) subkutan bei jedem Einschnitt. Decken Sie jeden Schnitt mit einer kleinen Menge Hautkleber ab, der mit einer Tuberkulinspritze verabreicht wird.
7. Wiederherstellung der Anästhesie
- Schalten Sie die Sevofluran-Anästhesie aus und geben Sie mindestens 5 Minuten lang nur Sauerstoff, während Sie das restliche Klebeband, das Abdecken und die Anästhesieüberwachung entfernen.
- Überprüfen Sie den Blutzuckerspiegel mit einem Blutzuckermessgerät und verabreichen Sie erwärmte subkutane Flüssigkeiten in einer Menge von 10 % des Körpergewichts (kg).
- Sobald das Tier auf einen schmerzhaften Reiz (Zehenkneifen) reagiert, begeben Sie sich in einen Erholungsinkubator mit 37-38 °C.
HINWEIS: Oft sinkt die Temperatur des Kits während dieser Übertragung erheblich ab. Es kann von Vorteil sein, das Kit wieder in das Biofeedback-Infrarot-Heizkissen zu stecken oder zusätzliche Wärme zuzuführen. - Überwachen Sie kontinuierlich visuell und zeichnen Sie alle 10-15 Minuten die Rektaltemperatur, die Pulsoximeter-Messwerte, die Herzfrequenz und die Atemfrequenz auf.
- Sobald das Tier durchgehend gehfähig und wach ist, entfernen Sie den intravenösen Katheter und üben Sie Druck auf die Stelle aus, bis die Blutung aufhört.
8. Postoperative Pflege und Überwachung
- Geben Sie das Kit an die Mutter und die Wurfgeschwister zurück. Stellen Sie sicher, dass Nistmaterial und zusätzliche Nahrung (Materialtabelle) im Käfig verfügbar sind, um die Wärmeregulierung und Regeneration zu unterstützen.
- Überprüfen Sie das Kit täglich für 7-10 Tage nach der Operation, wiegen Sie täglich und geben Sie zusätzliche Nahrung im Käfig.
- In den ersten 2 Tagen nach der Genesung (D1 und D2) alle 24 Stunden zusätzliche Analgetika (Carprofen 4 mg/kg SQ - verdünnt auf 5 mg/ml) und subkutane Flüssigkeiten (5-7 ml) verabreichen.
- Überprüfen Sie das Kit in den ersten 3 Tagen nach der Genesung (D1, D2 und D3) zweimal täglich und untersuchen Sie es auf Anzeichen von Schmerzen, Gehfähigkeit, Inzisionsaussehen und Flüssigkeitszufuhr. Messen Sie während dieses Zeitraums einmal täglich die Temperatur des Kits, um sicherzustellen, dass keine Anzeichen einer Infektion vorliegen und die Wärmeregulierung angemessen ist.
- Entfernen Sie die Nähte, wenn die Schnitte nach 7-10 Tagen ordnungsgemäß verheilt sind.
Ergebnisse
Das erfolgreiche Ergebnis dieses Projekts erforderte die Entwicklung mehrerer Parameter im Implantatverfahren und im Aufzeichnungsprotokoll. Eine Implantatoperation wurde an 16 Kaninchen-Kits versucht oder durchgeführt, wobei 14 den Eingriff erfolgreich überlebten. Von diesen überlebten 12 bis zum experimentellen Endpunkt. In Tabelle 1 sind die Gründe für den intraoperativen oder postoperativen Tod aufgeführt, zusammen mit Verfahrensmodifikationen, die einen zukünftigen Erfolg beim Erreichen des experimentellen Endpunkts ermöglichten. Die häufigste operative Komplikation war die Atemdepression, die zu Hypoxie und Bradykardie führte. Das Protokoll wurde so modifiziert, dass es mehrere Überwachungsmodalitäten umfasst, darunter 2 Pulsoximeter und einen Dopplermonitor. Dies ermöglicht eine Backup-Überwachung, falls ein Monitor während des chirurgischen Eingriffs ausfallen oder sich lösen sollte. Darüber hinaus können Hautpigmente bei Kaninchen die Pulsoximetrie weniger zuverlässig machen, was eine Überwachung von mehreren Punkten des Körpers aus erforderlich macht. Während Induktion und Genesung allgemein als die riskantesten Anästhesieperioden gelten, beobachteten wir an anderen Stellen des Eingriffs eine Atemdepression, die zu Bradykardie führte, was die Notwendigkeit einer jederzeit wachsamen Überwachung der Vitalparameter unterstreicht. Als Intervention für diese Komplikation wurden dem Protokoll zusätzliche Überwachungen und Doxapram hinzugefügt, nachdem die anästhetischen Komplikationen während der ersten beiden chirurgischen Kohorten von Tieren (Tiere 1-4) beobachtet worden waren. Die Tiere 12 und 13 gehörten zur gleichen Kohorte und erhielten Doxapram (2-5 mg/kg, entweder i.v. oder sublingual) aufgrund eines schlechten Atemantriebs. Beide wurden erfolgreich intraoperativ nach Atemdepression und Apnoe wiederbelebt.
Telemetrieaufzeichnungen können sofort durchgeführt werden, sobald die Kits in ihre Heimatkäfige zurückgebracht werden, und zeigen oft EEG-Signale mit relativ geringer Amplitude, bis sich das Kit vollständig von der Anästhesie erholt hat (Abbildung 4). Die Morphologie des EKG-Signals kann sich in den ersten Tagen der Aufzeichnung leicht ändern, da sich Narben bilden und die Position des EKG-Drahtes weiter gesichert ist (Abbildung 4B). Die Qualität der EEG- und EKG-Signale ist über die Zeit robust, ohne dass sich das Signal verschlechtert, wenn ausreichend überschüssiger Draht subkutan aufgewickelt bleibt, um das Wachstum zu ermöglichen. Telemetrieaufzeichnungen können an die individuellen Bedürfnisse der Studie angepasst werden, da das Implantat neben EEG und EKG auch verschiedene Biopotentiale wie Temperatur, Beschleunigung und Signalqualität überwachen kann (Abbildung 5). Die Datenanalyse wird offline mit der Emka ECGAuto Software durchgeführt. Bei EEG- und EKG-Datenerfassung bei 500 Hz halten die Implantatbatterien ca. 55 Tage. Dieser Zeitbereich kann durch Ändern der Datenerfassungsparameter oder durch intermittierende Stichprobenentnahme erweitert werden. Zur Unterstützung der Anfallserkennung in ECGAuto kann eine Softwareprogrammierung durchgeführt werden (Abbildung 5). Implantierte Kaninchen werden in den ersten 7 Tagen nach der Operation auf Hautrötung, Gewicht und Temperatur überwacht, da dies der Zeitraum mit dem höchsten Infektionsrisiko ist. Postoperativ zeigen Kaninchen-Kits 1-3 Tage nach dem Eingriff eine Gewichtszunahme, was auf eine minimale Belastung durch den Eingriff hindeutet. Das tierärztliche Personal führt in der ersten postoperativen Woche 2-3 Mal gründliche Untersuchungen durch und wird in regelmäßigeren Abständen untersuchen, wenn während der Genesung Bedenken auftreten. Unserer Erfahrung nach stört die Hirschkuh die Nahtstellen nicht wesentlich, sobald die Jungen ins Nest zurückgebracht werden, so dass die Wundheilung hervorragend war. Mehrere Kits entwickelten gutartige Serome am Schädelschnitt (Tabelle 1), für die sie zusätzlich 3 Tage lang Carprofen erhielten, was zu einer Seromauflösung ohne weitere Komplikationen führte. Langfristig werden Kaninchen täglich vom Laborpersonal oder dem Haltungspersonal auf Anzeichen von Stress beobachtet. Tierärztliches Personal steht bereit, um Kaninchen zu untersuchen und zu behandeln, wenn Bedenken auftreten. Die Signalqualität des Telemeters wird täglich auf Fehlfunktionen des Geräts oder des Kabels überprüft, bis die Batterie leer ist.
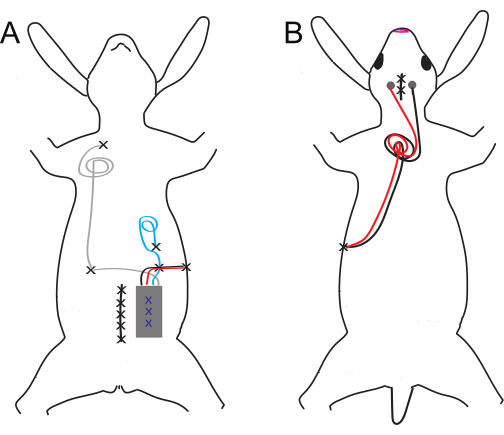
Abbildung 1: Schematische Darstellung des ventralen und dorsalen Implantats und der Elektrodenplatzierung. (A) Ventrale und (B) dorsale Implantate. Die Nahtstellen sind mit schwarzen X gekennzeichnet, während blaue X die inneren Nähte des Bauchimplantats bezeichnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Fotos der chirurgischen Positionierung. (A) Das Tier wird teilweise gedreht, um das Bauchimplantat, die Platzierung der Thorax-EKG-Elektrode und das partielle Tunneln der Drähte zum Rücken in derselben chirurgischen Position zu ermöglichen. Die Nase wird bequem in eine individuell gestaltete 3D-gedruckte Gesichtsmaske (a) gesteckt und locker an den vorderen Gliedmaßen befestigt. Die SpO2-Überwachung kann intermittierend erfolgen, so dass mehrere Sonden verwendet werden (rechter Unterarm (b) und rechte Hintergliedmaße (g)). Ein intravenöser Katheter wird im rechten Ohr befestigt (c). Zu den weiteren gezeigten Anästhesieüberwachungen gehören die Biofeedback-Infrarot-Temperaturüberwachung (d) und die Dopplerüberwachung unter Verwendung der rechten Oberschenkelarterie (e). Die visuelle Überwachung der Atmung erfolgt durch Beobachtung des Tieres oder des Rückatmungsbeutels. (B) Nach dem Einsetzen des Implantats und der EKG-Elektrode wird das sterile Feld unterbrochen und das Kaninchen in die Bauchlage gedreht. Die Drähte bleiben in einem Folienbeutel (a*) steril, da die dorsale Oberfläche für die Platzierung der EEG-Elektrode vorbereitet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
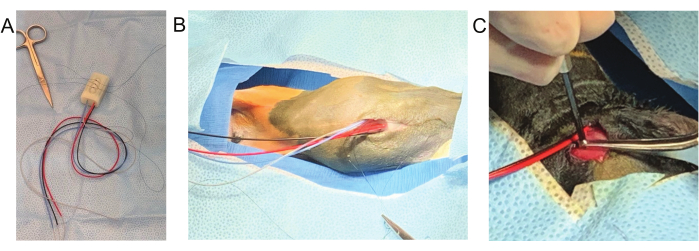
Abbildung 3: Wichtige Schritte des chirurgischen Eingriffs. (A) Vor dem Hautschnitt werden drei Nähte auf dem Implantat befestigt. (B) Es verbleibt ein langer Schwanz, um das Implantat an der ventralen Wand der Bauchhöhle zu befestigen. (C) Schädelschrauben werden beim Einschrauben in den Schädel mit einer feinen Pinzette gehalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
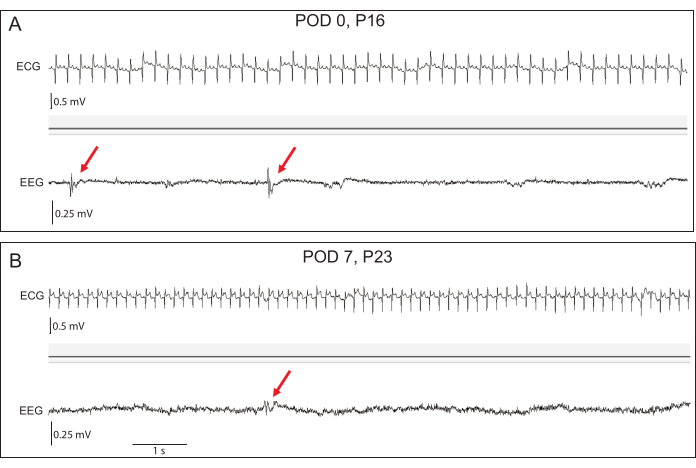
Abbildung 4: Repräsentative frühe EEG- und EKG-Aufzeichnungen. (A) Am postoperativen Tag (POD) 0 sind die EEG-Amplituden zu Studienbeginn niedrig, aber interiktale epileptiforme Entladungen (rote Pfeile) sind bei transgenen Kaninchen zu sehen. (B) Bis POD 7 haben sich die EEG-Amplituden erhöht. Epileptiforme Entladungen bleiben sichtbar. Die Genauigkeit des EKG-Signals ist zu beiden Zeitpunkten hervorragend. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
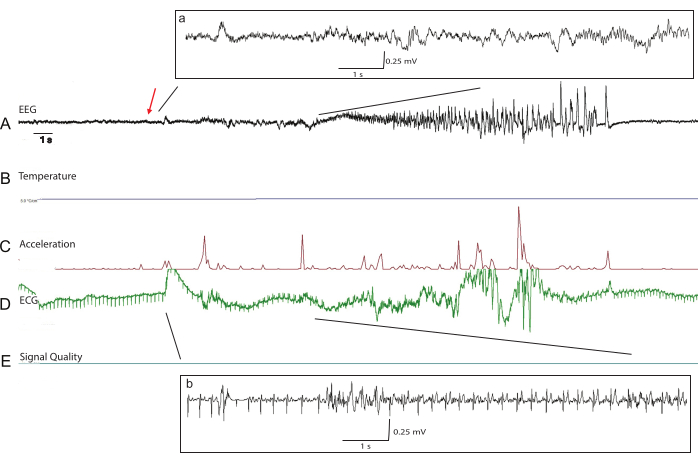
Abbildung 5: Repräsentative Rohspuren während eines tonisch-klonischen Anfalls in einem P66-transgenen Kaninchenkit. Zu den vorverarbeiteten Telemeterdaten gehören (A) EEG, (B) Temperatur, (C) Beschleunigung, (D) EKG und (E) Signalqualitätsmessungen für die Offline-Analyse. Die Signalqualität aller Biopotentiale am postoperativen Tag 52 ist weiterhin ausgezeichnet. Der Beginn des Anfalls wird durch den roten Pfeil angezeigt. Verarbeitete EEG-Daten (a) mit Baseline-Anpassung zu Beginn des Anfalls zeigen eine Signalabschwächung während der tonischen Phase des Anfalls. EKG-Daten mit einem verarbeiteten Ausgangswert (b) sind auch bei übermäßigen Muskelartefakten während der tonischen Phase des Anfalls sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Chirurgische Ergebnisse. Chirurgische und postoperative Komplikationen führten zu mehreren Modifikationen des Implantationsverfahrens. Vierzehn von 16 Kaninchen (87,5%) überlebten den chirurgischen Eingriff, und 2 Kaninchen hatten postoperative Komplikationen, die eine Euthanasie erforderten. Die Tiere werden in chronologischer Reihenfolge des Operationsdatums angezeigt. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das beschriebene Protokoll für die Induktion, Überwachung und Unterstützung von Anästhetika gleicht den Forschungsbedarf an chirurgischen Ansätzen und Leichtigkeit mit den Goldstandards der tierärztlichen Versorgung aus. Bevor das Labor das beschriebene Protokoll als Standardverfahren anwendete, wurden mehrere andere potenzielle Verfeinerungen getestet, einschließlich der dorsalen subkutanen Implantatinsertion, der Verwendung eines Endotrachealtubus oder einer Larynxmaske und der Verwendung eines Ösophagus-Stethoskopaufsatzes zur Herzfrequenzüberwachung. Alle wurden jedoch letztendlich aus verschiedenen Gründen aufgegeben. Es gibt zwar genügend subkutanen Raum für die Telemetrieplatzierung, aber die Unfähigkeit, den Totraum aufgrund des Designs des Telemetriekörpers und des Drahtaustritts zu schließen, die Herausforderung der Positionierung und Wicklung der Drähte, um das Wachstum der Tiere zu ermöglichen, und die erforderlichen 2 Positionsänderungen intraoperativ zur Sicherung des EKGs führten zu einer erheblichen Verlängerung der Operationszeit und zusätzlichen unnötigen logistischen Herausforderungen. Darüber hinaus wird die Verwendung einer Maskenanästhesie zwar im Allgemeinen nicht empfohlen, aber der Mangel an LMAs in geeigneter Größe und die Unfähigkeit, einen Endotrachealtubus nach der Platzierung zu sichern und zu halten, schlossen diese als Optionen aus. Die Anforderung, das Kit während der Operation umzudrehen, und auch die Notwendigkeit, Zugang zum Hals und Rücken des Kopfes zu erhalten, schränkten die Möglichkeiten ein, den Endotrachealtubus auch nach erfolgreicher Platzierung auf der Grundlage einer zuvor beschriebenen Technik für die Intubation von Kaninchen bei Neugeborenenzu sichern 25. Wir testeten auch die Verwendung einer Stethoskopsonde der Speiseröhre zur Herzfrequenzmessung, nachdem das Kit drapiert wurde, falls das Signal des Pulsoximeters oder des Dopplers verloren ging. Alle kommerziell erhältlichen Stethoskope der Speiseröhre waren jedoch zu groß, was vermutlich bei jedem Einsetzen zu einer vagalen Reaktion und einer nicht nachhaltigen Bradykardie führte.
Die anästhetischen Ergebnisse wurden wahrscheinlich durch die Entscheidung, Sevofluran anstelle von Isofluran für die Inhalationsanästhesie zu verwenden, stark verbessert. Es wurde gezeigt, dass Sevofluran in einigen Kaninchengeweben weniger gefäßerweiternde Wirkungen hat26 und in der Humanliteratur weithin als Verbesserung der kardiovaskulären Stabilität angesehenwird 27. Angesichts der Risiken einer Anästhesie in einer Umgebung mit suboptimalem Atemwegsmanagement war die schnelle Induktion und das Auftauchen von Sevofluran, die bei mehreren Spezies dokumentiert wurden 28,29,30, zusammen mit der Fähigkeit, die Anästhesiedosis zu titrieren, zu verkürzten Anästhesieepisoden und ermöglichten schnelle Änderungen der Anästhesieebene in einer sich schnell entwickelnden chirurgischen Umgebung. Darüber hinaus gilt inhalatives Sevofluran als signifikant weniger aversiv für die Maskeninduktion, was wahrscheinlich zu einer Verringerung des Atemanhaltens bei neugeborenen Kaninchen beiträgt31. Doxapram bei Kaninchen hat sich bei erwachsenen Kaninchen als wirksames Atemstimulans erwiesen32,33, und wir schätzten anekdotisch ein Ansprechen in unserem neonatalen Kaninchenmodell.
Während der Erfolg dieses Protokolls offensichtlich ist, gibt es potenzielle Wege zur Verfeinerung in Bezug auf Analgesie und Anästhesieüberwachung. Da es keine Studien gibt, die auf Dosierungsrichtlinien für neugeborene Kaninchen hinweisen, wurden Dosierungen und Häufigkeiten am unteren Ende der artspezifischen Empfehlungen ausgerichtet. Eine zusätzliche Dosis Buprenorphin für die Genesung und die Erprobung nagetierspezifischer Anästhesieüberwachungsplattformen könnten die Überlebensrate weiter erhöhen und den Tierschutz in diesem Modell verbessern. Eine zusätzliche Dosierung von Buprenorphin nach der Genesung würde die Wirkung der multimodalen Analgesie verlängern und gleichzeitig die dokumentierten dosisabhängigen respiratorischen, depressiven und gastrointestinalen Stauungseffekte bei Kaninchen minimieren34,35. Alle postoperativen Tiere wiesen unter Verwendung eines veterinärmedizinischen Handglukometers einen mittelschweren bis starken Anstieg des unmittelbar postoperativen Blutzuckerspiegels (250-400 mg/dl) auf. Dies könnte auf eine übertriebene Stressreaktion aufgrund periakuter postoperativer Schmerzen hindeuten, basierend auf einer kürzlich erschienenen Publikation, die einen Zusammenhang zwischen hohen Blutzuckerspiegeln und der Schwere der Magen-Darm-Erkrankung bei Kaninchen herstellt36. Da alle Tiere innerhalb von 3 Tagen oder weniger nach dem Eingriff wieder an Gewicht zunahmen und innerhalb von 12-24 Stunden nach der Operation eine normale Aktivität und keine Schmerzen an der Inzisionsstelle aufwiesen, glauben wir nicht, dass eine verlängerte Opioid-Verabreichung für dieses Modell indiziert ist. Nagetierspezifische Anästhesieüberwachungsgeräte, zu denen auch die Überwachung der Atemwege gehört, werden bei Produkten verschiedener Hersteller immer häufigereingesetzt 37. Es liegt auf der Hand, dass, wenn diese Systeme mit anderen vergleichbar großen Tieren mit ähnlich hohen Herzfrequenzen wie den neugeborenen Kaninchen funktionieren würden, die Verwendung eines dieser Systeme das Überleben der Anästhesie erhöhen würde. Leider hatten wir keinen Zugang zu diesen Produkten oder hatten nicht die Möglichkeit, sie auszuprobieren, bevor wir sie für diese Studie kauften.
Implantierbare Telemetriegeräte haben sich in den letzten Jahren weiterentwickelt und bieten eine längere Batterielebensdauer, kleinere Implantate und die Möglichkeit, mehrere Biopotentiale von Interesse bei Nagetieren, Hunden und nichtmenschlichen Primaten zu messen, während sich die Tiere frei bewegen können, wodurch Stress reduziert wird 38,39,40. Der Einsatz implantierbarer Telemetriegeräte zur gleichzeitigen EEG- und EKG-Aufzeichnung bei Kaninchen bietet Vorteile gegenüber den derzeitigen angebundenen Methoden41. Mit implantierbaren Geräten können sich Kaninchen ohne Fesseln oder Fesseln frei in ihrem Käfig bewegen, und die Jungtiere können mit dem Reh und der Einstreu zum Nest zurückkehren, was Stress reduziert und das Wohlergehen der Tiere fördert. Eine sorgfältige postoperative Überwachung auf Anzeichen von Infektionen oder Stress ermöglicht auch ein frühzeitiges tierärztliches Eingreifen, wenn Komplikationen auftreten. Implantat-Kits ermöglichen eine EEG-Auswertung in kritischen Phasen der Gehirnentwicklung, was in Modellen genetischer Epilepsien unerlässlich sein kann, ohne die Wohnpraktiken zu verändern. Darüber hinaus werden Telemetriedaten während der gesamten Lebensdauer der Implantatbatterie kontinuierlich erfasst, was die Erfassung seltener SUDEP-Ereignisse ermöglicht. Das Aufkommen transgener Kaninchen bietet einzigartige Möglichkeiten für die Modellierung menschlicher Krankheiten. Darüber hinaus kann die Verwendung von Kaninchenmodellen erhebliche Vorteile gegenüber anderen Großtierbewertungen bieten, die für die FDA-Arzneimittelzulassung erforderlich sind. Methoden wie die vorgestellte ermöglichen eine fortgeschrittene Bewertung der kardialen und neuronalen Physiologie in diesen Modellen sowie deren Veränderung durch therapeutische Interventionen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren sind dankbar für die Finanzierung durch die NIH R61NS130070 an LLI.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 inch elastic wrap - Coban or Vetwrap | 3M | https://www.3m.com/3M/en_US/p/d/b00003186/ | |
| 4-0 PDS monofilament suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| 5-0 Ethilon nylon suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| Acquisition computer | Dell | https://www.dell.com/en-us | |
| Adhesive surgical towels | N/A | N/A | |
| Anesthesia circuit - Jackson-Reevs with 0.5 L rebreathing bag | JorVet | J0248GA | |
| Betadine scrub | N/A | N/A | |
| Bupivicaine (0.5%) | N/A | N/A | Diluted to 2.5 mg/mL prior to administration |
| Buprenorphine (0.3 mg/mL) | N/A | N/A | Diluted to 0.03 mg/mL prior to administration |
| Burr - 1.00 mm | Cell Point Scientific | 60-1000 | to drill skull |
| Cafazolin (1 g lypholized) | N/A | N/A | Diluted to 50 mg/mL |
| Carprofen (50 mg/mL) | MWI Veterinary | Diluted to 25 mg/mL prior to administration | |
| Cotton tipped applicators | N/A | N/A | |
| Custom 3-D printed face mask | N/A | https://www.thingiverse.com/thing:923725 | |
| Dental acrylic | N/A | N/A | |
| Diet Gel Criticare | Clear H2O | 72-05-5042 | Nutritional support |
| Dopper Gel - Aquasonic | Patterson | 07-890-5542 | |
| Doppler - Vet-Dop2 | Patterson | 07-888-8986 | |
| Doxapram (20 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Dumont #5 Fine Forceps | Fine Science Tools | 11254-20 | For holding screws |
| Duraprep | 3M | 8630 | Final skin prep |
| ecgAuto data analysis software | emka technologies | N/A | |
| Epinephrine (1:1000) | MWI Veterinary | N/A | Emergency only |
| Gauze | N/A | N/A | |
| Glucometer ipet Pro | MWI Veterinary | 63867 | Monitor if poor recovery |
| Glycopyrrolate (0.2 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Gram scale | N/A | N/A | |
| Hemostats | Fine Science Tools | 13008-12 | Hold wire loops while tying the loop in place |
| Ideal Micro-drill | Cell Point Scientific | 67-1204 | To drill skull |
| Incubator | DRE-veterinary (Infantia - NB1) | N/A | |
| Induction box | VetEquip | 941444 | |
| Infared heating pad - RightTemp Jr | Kent Scientific Corporation | RT-0502 | |
| IOX2 data acquisition software | emka technologies | N/A | |
| IV Catheter - Covidein Monoject 26 G, 3/4 inch PTFE | Patterson | 07-836-8494 | |
| ketamine (100 mg/mL) | MWI Veterinary | N/A | |
| Medical tape | N/A | N/A | |
| Narrow Pattern Forceps - Straight/12 cm | Fine Science Tools | 11002-12 | |
| Neonatal stethescope | Ultrascope | N/A | |
| Olsen-Hegar Needle holder with scissors - 12 cm | Fine Science Tools | 12002-12 | For suturing |
| Ophthalmic ointment Puralube | MWI Veterinary | N/A | Administered to both eyes during anesthesia |
| Opthalmic Lubricant - Paralube Vet | Patterson | 07-888-2572 | |
| Pulse oximeter (AccuWave Portable ) | Patterson | 07-892-9128 | For prep and recovery; reads HR up to 400 |
| Pulse oximeter (SDI - Vet/Ox plus 4700) | Heska | N/A | Intra-operative; no longer producted |
| Receiver | emka technologies | N/A | 1 receiver for every 4 telemetry implants |
| Rectal thermometer | N/A | N/A | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scissors | Fine Science Tools | 14002-12 | To cut drape |
| Screw driver - 1.0 mm | N/A | N/A | From mini-screwdriver set for electronics |
| Screws 00-96 x 3/32 (2.4 mm) | Protech International | 8L0X3905202F | |
| Sevoflurane | MWI Veterinary | Maintenance anesthesia | |
| Sevoflurane vaporizer and anesthesia machine | N/A | N/A | |
| Skin glue, Gluture | MWI Veterinary | 34207 | Apply sparingly with syringe |
| Small scissors | Fine Science Tools | 14084-08 | |
| Sterile aluminum foil | N/A | N/A | To wrap wires prior to rotating animal |
| Sterile paint brush | N/A | N/A | To apply dental acrylic |
| Sterile Saline | N/A | N/A | |
| Sterile surgical gloves | N/A | N/A | |
| Sterile ultrasound cover | N/A | N/A | To cover the drill |
| Sterile Water | N/A | N/A | For cefazolin reconstitution |
| Surgical blade no. 15 | N/A | N/A | |
| Surgical drape | N/A | N/A | |
| Surgical gown | N/A | N/A | |
| Swivel connector - Jorgensen Labs | Patterson | 07-802-2349 | To connect anesthesia circuit to face mask |
| Telemetry implant | emka technologies | easyTEL+_M1_EETA_B_35 | |
| Trocar | SAI | TRO-10-6 | To tunnel wires |
Referenzen
- Bagnall, R. D., Crompton, D. E., Semsarian, C. Genetic Basis of Sudden Unexpected Death in Epilepsy. Front Neurol. 8, 348 (2017).
- Surges, R., et al. Pathologic cardiac repolarization in pharmacoresistant epilepsy and its potential role in sudden unexpected death in epilepsy: a case-control study. Epilepsia. 51 (2), 233-242 (2010).
- Surges, R., Thijs, R. D., Tan, H. L., Sander, J. W. Sudden unexpected death in epilepsy: risk factors and potential pathomechanisms. Nat Rev Neurol. 5 (9), 492-504 (2009).
- Shorvon, S., Tomson, T. Sudden unexpected death in epilepsy. Lancet. 378 (9808), 2028-2038 (2011).
- Schuele, S. U., et al. Video-electrographic and clinical features in patients with ictal asystole. Neurology. 69 (5), 434-441 (2007).
- Massey, C. A., Sowers, L. P., Dlouhy, B. J., Richerson, G. B. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. 10 (5), 271-282 (2014).
- Sahly, A. N., Shevell, M., Sadleir, L. G., Myers, K. A. SUDEP risk and autonomic dysfunction in genetic epilepsies. Auton Neurosci. 237, 102907 (2022).
- Cooper, M. S., et al. Mortality in Dravet syndrome. Epilepsy Res. 128, 43-47 (2016).
- Negishi, Y., et al. SCN8A-related developmental and epileptic encephalopathy with ictal asystole requiring cardiac pacemaker implantation. Brain Dev. 43 (7), 804-808 (2021).
- Meisler, M. H., et al. SCN8A encephalopathy: Research progress and prospects. Epilepsia. 57 (7), 1027-1035 (2016).
- Watanabe, H., et al. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest. 118 (6), 2260-2268 (2008).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci Transl Med. 1 (2), 2ra6 (2009).
- Nerbonne, J. M. Mouse models of arrhythmogenic cardiovascular disease: challenges and opportunities. Curr Opin Pharmacol. 15, 107-114 (2014).
- Frasier, C. R., et al. Channelopathy as a SUDEP Biomarker in Dravet Syndrome patient-derived cardiac myocytes. Stem Cell Rep. 11 (3), 626-634 (2018).
- Camacho, P., Fan, H., Liu, Z., He, J. -. Q. Small mammalian animal models of heart disease. Am J Cardiovasc. 6 (3), 70-80 (2016).
- Brodbelt, D. Perioperative mortality in small animal anaesthesia. Vet J. 182 (2), 152-161 (2009).
- Lee, H. W., Machin, H., Adami, C. Peri-anaesthetic mortality and nonfatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases. Vet Anaes Anal. 45 (4), 520-528 (2018).
- Comolli, J., et al. Comparison of endoscopic endotracheal intubation and the v-gel supraglottic airway device for spontaneously ventilating New Zealand white rabbits undergoing ovariohysterectomy. Vet Rec. 187 (10), e84-e84 (2020).
- Grint, N. J., Sayers, I. R., Cecchi, R., Harley, R., Day, M. J. Postanaesthetic tracheal strictures in three rabbits. Lab Anim. 40 (3), 301-308 (2006).
- Phaneuf, L. R., Barker, S., Groleau, M. A., Turner, P. V. Tracheal injury after endotracheal intubation and anesthesia in rabbits. J Am Assoc Lab Anim Sci. 45 (6), 67-72 (2006).
- Quesenberry, K. E., Orcutt, C. J., Mans, C., Carpenter, J. W. Gastrointestinal Diseases of Rabbits. Ferrets, Rabbits, and Rodents. , (2020).
- Desai, A., Macrae, D. . Cardiovascular Physiology in Infants, Children, and Adolescents. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. , (2020).
- Bansal, N., Momin, S., Bansal, R., Venkata, S. K. R. G., Ruser, L., Yusuf, K. Pharmacokinetics of drugs: newborn perspective. Pediatr Med. 7, 19 (2024).
- Trachsel, D., Erb, T. O., Hammer, J., von Ungern-Sternberg, B. S. Developmental respiratory physiology. Paediat Anaesth. 32 (2), 108-117 (2022).
- Benito, S., Hadley, S., Camprubí-Camprubí, M., Sanchez-de-Toledo, J. Blind endotracheal intubation in neonatal rabbits. J Vis Exp. 168, e61874 (2021).
- Okamoto, S., Matsuura, N., Ichinohe, T. Effects of volatile anesthetics on oral tissue blood flow in rabbits: A comparison among isoflurane, sevoflurane, and desflurane. J Oral Maxillofac Surg. 73 (9), 1714.e1-1714.e8 (2015).
- Elshalakany, N. A., Salah, A. M. Comparative study: evaluation of the effect of sevoflurane versus isoflurane in general anesthesia for pediatric patients undergoing cardiac catheterization. Egypt J Anaesth. 38 (1), 409-414 (2022).
- Anjana, R. R., Parikh, P. V., Mahla, J. K., Kelawala, D. N., Patel, K. P., Ashwath, S. N. Comparative evaluation of isoflurane and sevoflurane in avian patients. Vet World. 14 (5), 1067-1073 (2021).
- Johnson, R. A., Striler, E., Sawyer, D. C., Brunson, D. B. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs. Am J Vet Res. 59 (4), 478-481 (1998).
- Campbell, C., Nahrwold, M. L., Miller, D. D. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth. 42 (10), 884-890 (1995).
- TerRiet, M. F., et al. Which is most pungent: isoflurane, sevoflurane, or desflurane. Br J Anaesth. 85 (2), 305-307 (2000).
- Khanna, V. K., Pleuvry, B. J. A study of naloxone and doxapram as agents for the reversal of neuroleptanalgesic respiratory depression in the conscious rabbit. Br J Anaesth. 50 (9), 905-912 (1978).
- Flecknell, P. A., Liles, J. H., Wootton, R. Reversal of fentanyl/fluanisone neuroleptanalgesia in the rabbit using mixed agonist/antagonist opioids. Lab Anim. 23 (2), 147-155 (1989).
- Shafford, H. L., Schadt, J. C. Respiratory and cardiovascular effects of buprenorphine in conscious rabbits. Vet Anaesth Analg. 35 (4), 326-332 (2008).
- Feldman, E. R., Singh, B., Mishkin, N. G., Lachenauer, E. R., Martin-Flores, M., Daugherity, E. K. Effects of cisapride, buprenorphine, and their combination on gastrointestinal transit in New Zealand white rabbits. J Am Assoc Lab Anim Sci. 60 (2), 221-228 (2021).
- Harcourt-Brown, F. M., Harcourt-Brown, S. F. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170 (26), 674-674 (2012).
- Rivera, D. A., Buglione, A. E., Ray, S. E., Schaffer, C. B. MousePZT: A simple, reliable, low-cost device for vital sign monitoring and respiratory gating in mice under anesthesia. PLoS One. 19 (3), e0299047 (2024).
- Nicou, C. M., Passaglia, C. L. Characterization of intraocular pressure variability in conscious rats. Exp Eye Res. 239, 109757 (2024).
- Sadko, K. J., Leishman, D. J., Bailie, M. B., Lauver, D. A. A simple accurate method for concentration-QTc analysis in preclinical animal models. J Pharmacol Toxicol Methods. 128, 107528 (2024).
- Vuong, J. S., Garrett, J. J., Connolly, M. J., York, A. R., Gross, R. E., Devergnas, A. Head mounted telemetry system for seizures monitoring and sleep scoring on non-human primate. J Neurosci Methods. 346, 108915 (2020).
- Bosinski, C., Wagner, K., Zhou, X., Liu, L., Auerbach, D. S. Multi-system monitoring for identification of seizures, arrhythmias and apnea in conscious restrained rabbits. J Vis Exp. (169), e62256 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten