Method Article
Transplante de Pulmão de Bioengenharia Usando Pulmões de Camundongos Descelularizados e Células Endoteliais Humanas Primárias
Neste Artigo
Resumo
Este artigo descreve como criar pulmões de camundongos de bioengenharia usando métodos de descelularização e recelularização. Ele também detalha o transplante pulmonar ortotópico subsequente.
Resumo
O transplante de pulmão é um tratamento crítico para pacientes com doenças pulmonares em estágio terminal, como fibrose pulmonar idiopática, mas desafios como escassez de doadores e complicações pós-transplante persistem. Os pulmões de bioengenharia, integrando células específicas do paciente em andaimes animais descelularizados, apresentam uma alternativa promissora. Apesar do progresso no uso de pulmões de bioengenharia em modelos animais, a funcionalidade e a estrutura permanecem imaturas. Este protocolo aborda uma barreira crítica na bioengenharia de órgãos: a necessidade de uma plataforma experimental econômica. Ao usar modelos de camundongos em vez de animais maiores, como ratos ou suínos, os pesquisadores podem reduzir significativamente os recursos necessários para cada experimento, acelerando o progresso da pesquisa.
O protocolo descreve um procedimento detalhado para bioengenharia pulmonar usando blocos coração-pulmão de camundongo e células primárias humanas, com foco na estratégia de isolamento para o bloqueio coração-pulmão de camundongo, descelularização, configuração de biorreator, cultura de órgãos baseada em perfusão e transplante ortotópico de pulmões de bioengenharia. Essa plataforma em escala de camundongo não apenas reduz os custos experimentais, mas também fornece uma estrutura viável para otimizar os tipos e números de células para recelularização, testando diferentes tipos de células usando métodos histológicos e moleculares e garantindo o fluxo sanguíneo pós-transplante. O método tem potencial para amplas aplicações, incluindo o estudo de interações celulares em condições de cultura tridimensionais, interações célula-matriz e modelagem ex vivo do câncer, avançando assim no campo da bioengenharia de órgãos.
Introdução
O transplante pulmonar tem sido a cura decisiva para pacientes com doença pulmonar terminal1, como fibrose pulmonar idiopática, onde o tratamento medicamentoso é ineficaz para interromper a deterioração da função respiratória. Mais pacientes elegíveis aumentam a lista de espera a cada ano; no entanto, o número de doações de órgãos de doadores falecidos tem acompanhado o número crescente de pacientes em espera 2,3. Mesmo após o transplante pulmonar, alguns problemas degradariam a função dos pulmões transplantados, incluindo disfunção de órgãos primários, síndrome alogênica reativa e infecções, o que reduz significativamente a sobrevida em 5 anos dos receptores de transplante de pulmão4.
Existem várias opções para combater os problemas atuais no transplante de órgãos, incluindo a utilização de doadores marginais5, a recuperação de pulmões de doadores em um sistema de perfusão pulmonar ex vivo 6 e o xenotransplante usando suínos editados por genes7. Essas alternativas podem expandir o pool de órgãos de doadores; no entanto, nenhum pode abordar inteiramente a escassez, imunogenicidade e heterogeneidade funcional dos órgãos doadores.
Está longe da realidade, mas os órgãos artificiais de bioengenharia, onde as células específicas do paciente são integradas ao andaime de órgãos animais descelularizados, são uma fonte potencial fascinante de transplante de órgãos sólidos8. Vários estudos pioneiros que demonstraram a utilidade potencial dos pulmões de bioengenharia foram relatados desde 2010 9,10. Nesses estudos, pulmões de ratos ou suínos foram descelularizados por detergentes, células animais ou humanas foram injetadas da traqueia ou vasculatura pulmonar para regenerar o tecido pulmonar no biorreator baseado em perfusão, e algumas delas foram transplantadas ortotopicamente para as cavidades torácicas dos animais 11,12,13,14,15. No entanto, a função e a estrutura dos pulmões de bioengenharia foram prematuras, presumivelmente devido ao número inadequado de células cultivadas no biorreator ou junções intercelulares menos integradas.
Um obstáculo para o avanço da pesquisa em bioengenharia de órgãos é a falta de uma plataforma experimental em pequena escala. Embora ratos ou suínos sejam os animais comumente usados neste campo, eles requerem >108 células pulmonares por pulmão16, o que é altamente caro para os laboratórios acadêmicos. Se os camundongos estiverem disponíveis para pesquisa de bioengenharia de órgãos, poderíamos reduzir drasticamente o custo de cada experimento e acelerar o programa de pesquisa. Embora existam diferenças anatômicas entre pulmões de camundongos e humanos17, a arquitetura básica do pulmão é semelhante entre os mamíferos18. Portanto, os resultados de experimentos em escala de camundongo podem ser aplicados a animais maiores, simplesmente multiplicando o número de acordo com o tamanho do corpo.
Este protocolo tem como objetivo descrever o procedimento experimental detalhado de bioengenharia pulmonar usando blocos coração-pulmão de camundongos e células primárias humanas19. Adotamos o protocolo de descelularização pulmonar de camundongo relatado anteriormente e amplamente utilizado para este estudo 20,21,22. A parte desafiadora da bioengenharia pulmonar é a recelularização da vasculatura capilar descelularizada20; Portanto, células endoteliais da veia do cordão umbilical humano serão utilizadas neste protocolo.
Protocolo
Todos os experimentos seguiram os Regulamentos para Experimentos com Animais e Atividades Relacionadas na Universidade de Tohoku (15ª edição), publicado pela Universidade de Tohoku23. Este estudo foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Tohoku (#2020AcA-041-01).
1. Preparação de materiais para descelularização
- Preparação de soluções de descelularização (formato de 1.000 mL em frasco de vidro autoclavável de 1 L)
- Água desionizada estéril (DI): Adicione 1.000 mL de água destilada ou DI a garrafas de vidro autoclaváveis de 1 L. Autoclave por 20 min a 121 °C.
- Triton X-100: Adicione 1 mL de Triton X-100 a 1.000 mL de água DI estéril em um frasco de vidro autoclavável de 1 L. (Opcional) Adicionar 10 mL de solução de penicilina e estreptomicina (concentração final, 500 unidades/mL de penicilina e 500 μg/mL de estreptomicina).
NOTA: Não autoclave. - Desoxicolato de sódio: Adicione 20 g de pó de desoxicolato de sódio a 1.000 mL de água DI estéril em um frasco de vidro autoclavável de 1 L. Feche a tampa e vire o frasco para solubilizar o pó. (Opcional) Adicione 10 mL de solução de penicilina e estreptomicina.
NOTA: Não autoclave. - 1 M NaCl: Adicione 58,44 g de NaCl a 1.000 mL de água destilada ou DI em um frasco de vidro autoclavável de formato de 1 L. Autoclave por 20 min a 121 °C.
- Solução estoque de DNase I: Diluir a uma concentração de 10 mg / mL em meio A.
- Meio A: Prepare 5 mM de CaCl2 (5 mg de CaCl2 em 9 mL de água DI estéril) e diluição 1:10 com água DI estéril.
- Solução de trabalho DNase I: Adicione 33 μL de solução estoque DNase I a 10 mL de meio B.
- Meio B: Prepare 10x Meio B (155 mg de MgSO4 + 220 mg de CaCl2 em 100 mL de água DI estéril) e diluição 1:10 com água DI estéril.
- Preparo dos cateteres para a artéria pulmonar (AP) e a traqueia (procedimento estéril)
- Corte o cateter PA (cateter para veia jugular de rato) com um comprimento de aproximadamente 15 mm.
- Mova o colar para a extremidade do cateter.
- Insira um conector de cateter no cateter PA e conecte-o a um injetor. Os cateteres PA preparados são apresentados na Figura 1A.
- Armazene o cateter PA em etanol a 70% até o uso.
- Corte o cateter intravenoso de 20 G com um comprimento de aproximadamente 15 mm. Isso é usado para um cateter traqueal.
- Cirurgia em camundongos para coleta de bloqueio coração-pulmão
- Eutanasiar um camundongo macho (C57BL / 6, peso > 28 g) com uma overdose de dióxido de carbono ou isoflurano.
- Coloque o mouse em decúbito dorsal em uma mesa cirúrgica e fixe os membros. Esterilize borrifando etanol a 70% na superfície do tórax e do abdômen.
- Abra a cavidade abdominal na linha mediana até o pescoço com uma tesoura de aço inoxidável e divida o esterno com a tesoura. Ressecção o diafragma da parede torácica, corte a parede torácica ventral para expor totalmente as cavidades torácicas e remova o timo. Ligue a veia cava inferior e a veia cava superior direita com uma seda 4-0 para evitar a regurgitação de PBS na etapa 1.3.5, aumentando assim a lavagem do sangue na vasculatura pulmonar.
- Corte a aorta abdominal com uma tesoura de aço inoxidável para drenagem. Se a aorta abdominal for indiscernível, corte a veia cava inferior e a aorta abdominal juntas.
- Injete 3 mL de PBS estéril do ventrículo direito com uma seringa estéril de 5 mL com uma agulha de 27 G, perfurando a parede do ventrículo direito.
- Enrole o PA principal com uma seda 4-0 usando uma pinça Dumont.
NOTA: O PA principal e a aorta ascendente podem ser enrolados juntos. - Abra uma janela de 2 mm abaixo das válvulas PA cortando a parede do ventrículo direito com uma tesoura de mola.
- Insira o cateter PA pela janela e prenda a seda 4-0 previamente enrolada (Figura 1B).
NOTA: Evite tocar no PA durante este procedimento, o que pode danificar a parede do PA. A AP principal e a aorta ascendente podem ser ligadas e fixadas juntas. - Injete 2 mL de PBS lentamente através do cateter PA com uma seringa estéril de 5 mL. Certifique-se de que ambos os pulmões se expandam ligeiramente enquanto o PBS está sendo injetado.
- Canule a traqueia com um cateter traqueal e amarre com sutura de seda 4-0 (Figura 1C).
- Injete 2 mL de ar lentamente através do cateter traqueal com uma seringa estéril vazia de 5 mL e segure-a por 10 s. Certifique-se de que não haja vazamento de ar dos pulmões.
- Remova o coração e o pulmão em bloco. Pegue a traqueia com a pinça Dumont e com o cateter traqueal dentro, corte o esôfago cervical e disseque-o das vértebras. Corte as veias e artérias subclávias bilaterais. Finalmente, corte o esôfago e a infra veia cava ao nível do diafragma.
NOTA: Não toque na superfície pulmonar com nenhum instrumento. Qualquer leve toque pode resultar em vazamento de ar.
- Descelularização dos pulmões do camundongo (procedimento de 3 dias)
NOTA: Todos os procedimentos na seção 1.4 devem ser realizados em um gabinete de biossegurança limpo.- Dia 1
- Transferir o bloco coração-pulmão ressecado para uma placa de Petri de plástico de 10 cm de diâmetro e incubar os blocos coração-pulmão em água DI estéril durante 1 h a 4 °C.
- Injete 2 mL de água DI estéril através do cateter traqueal 3x e 2 mL de água estéril através do cateter PA com uma seringa estéril de 5 mL. Faça uma pausa após cada injeção para permitir que o líquido saia à medida que o pulmão recua (Figura 1C).
NOTA: Injete água a aproximadamente 0.5 mL / s. - Injete 2 mL de solução de Triton X-100 a 0,1% no cateter traqueal e 2 mL no cateter PA.
- Colocar o bloco coração-pulmão na placa de Petri e incubar estaticamente em solução de Triton X-100 durante a noite a 4 °C.
- Dia 2
- Remova a solução Triton X-100 dos pulmões com água DI estéril, conforme descrito na etapa 1.4.1.2.
- Injete 2 mL de solução de desoxicolato de sódio a 2% no cateter traqueal e 2 mL no cateter PA. Incubar em solução de desoxicolato durante 24 h a 4 °C.
- Dia 3
- Remover a solução de desoxicolato de sódio dos pulmões com água DI estéril, conforme descrito no passo 1.4.1.2.
- Injete 2 mL de solução de NaCl 1 M no cateter traqueal e 2 mL no cateter PA. Incubar em solução de NaCl durante 1 h em RT.
- Remover da solução de NaCl com água DI estéril, conforme descrito no passo 1.4.1.2.
- Injete 2 mL de solução de trabalho DNAse I no cateter traqueal e 2 mL no cateter PA. Incubar na solução de trabalho DNase por 1 h em RT.
- Remover a solução de DNase dos pulmões conforme descrito no passo 1.4.1.2, mas com PBS estéril. Confirme se os pulmões estão brancos e transparentes na borda após o procedimento de descelularização.
NOTA: À medida que o procedimento de descelularização progride, o pulmão torna-se mais frágil. Sempre manuseie o bloqueio coração-pulmão com cuidado e evite tocar na superfície pulmonar. Após a descelularização, os bloqueios coração-pulmão podem ser armazenados em PBS/antibióticos a 4 °C por até 3 semanas.
- Dia 1
2. Cultura de células primárias humanas
- Misture o meio de crescimento de células endoteliais-2 (EGM2) e o kit de balas contendo soro fetal bovino (concentração final, 2%), hidrocortisona (concentração final, 0,2 μg/mL), fator de crescimento de fibroblastos básicos humanos (concentração final, 4 ng/mL), fator de crescimento endotelial vascular (2 ng/mL), fator de crescimento semelhante à insulina R3-1 (concentração final, 5 ng/mL), ácido ascórbico (concentração final, 75 μg/mL), fator de crescimento epidérmico humano (concentração final, 10 ng/mL), gentamicina/anfotericina-1000 (concentração final, gentamicina: 30 μg/mL, anfotericina: 15 ng/mL) e heparina (concentração final, 1 ng/mL).
- Descongelar 2 × 106 células endoteliais da veia do cordão umbilical humano (HUVECs) em frascos congelados em banho-maria a 37 °C.
- Misture as células com EGM2 em um tubo cônico de 15 mL e centrifugue a 500 × g por 5 min.
- Conte as células e subcultive-as em uma densidade celular apropriada (recomenda-se 2,0 x 104 células/cm2 ). Começar com placas de formato de 6 poços e depois transferir para frascos T75.
- Passe as células até obter o número necessário de células.
NOTA: Para cobertura vascular pulmonar completa usando HUVECs, serão necessários 3 ×10 7 HUVECs19.
3. Configuração do biorreator e cultura de órgãos de perfusão
- Preparação de uma câmara de órgão e um reservatório de células
- Faça furos em uma rolha de silicone usando uma broca de cortiça, conforme mostrado na Figura 2A. Os tamanhos dos furos são 5 mm (i, ii e iii) e 7 mm (iv e v). Cada número de furo (i-v) na Figura 2A corresponde aos números de furo na Figura 2B.
- Insira a tubulação da bomba através da rolha de silicone conforme indicado na Figura 2B.
- Corte um orifício de 5 mm em um septo de silicone de uma tampa de rosca aberta usando uma broca de cortiça. Insira um tubo curado com platina L/S 14 no orifício (Figura 2B,C).
- Autoclave os materiais acima, incluindo a rolha de silicone com tubo, o recipiente de vidro, a tampa de rosca GL-45 com tubo, uma garrafa de vidro autoclavável de 250 mL e um tubo L/S 14 com conexões de isca (Tubo B e Tubo C na Figura 3A) por 20 min a 121 °C. Selecione os encaixes de isca adequados para garantir que os tubos B e C façam um laço.
NOTA: O recipiente de vidro é usado para uma câmara de órgão e o frasco de vidro de 250 mL é usado para um reservatório de células.
- Montagem de circuito de biorreator baseado em perfusão
NOTA: Os procedimentos a seguir devem ser realizados em uma bancada limpa.- Adicione 70 mL de meio de cultura ao recipiente de vidro e, em seguida, coloque a rolha de silicone em cima do recipiente de vidro.
- Monte uma rolha de silicone, uma lata de vidro, uma tampa de rosca GL-45 com tubo, uma garrafa de vidro autoclavável de 250 mL e uma tubulação L/S 14 com acessórios de isca usando torneiras de três vias, conforme descrito na Figura 3A. Insira uma agulha de 20 G em um septo de silicone de uma tampa de rosca GL-45.
- Encha a mídia nos tubos A, B e C com uma seringa de 10 mL conectada às torneiras i) e iii) (~ 3-5 mL de mídia serão necessários para encher 1 m de tubo). Repita a injeção e retirada do meio usando uma seringa de 10 mL através de uma torneira de três vias para garantir que não haja bolhas de ar dentro do tubo.
- Conecte o cateter PA do bloco coração-pulmão descelularizado por meio de um encaixe de isca conectado ao tubo C. Evite bolhas de ar no cateter ou no tubo.
- Colha e ressuspenda HUVECs a uma densidade de 0,5-1 × 106 células/mL em EGM2. Adicione a suspensão celular da etapa 2.5 ao reservatório da célula.
NOTA: A suspensão celular é preparada preferencialmente entre as etapas 3.2.4 e 3.2.5. Coloque uma barra de agitação no reservatório da célula.
- Injeção de células endoteliais impulsionada pela gravidade
- Coloque o reservatório de células contendo HUVECs em um agitador magnético. Certifique-se de que o fundo do reservatório da célula esteja 30 cm acima da câmara do órgão (Figura 2D e Figura 3A).
- Ligue o agitador magnético a uma velocidade de aproximadamente 120 rpm.
- Abra a torneira i) e ii) para que a suspensão celular possa ser injetada no andaime descelularizado através do tubo A, tubo C e cateter PA.
NOTA: Ao injetar 3 × 107 células a uma densidade celular de 1 × 106 células/mL, o volume da suspensão celular deve ser de 30 mL. Uma taxa de injeção típica é de 1-2 mL / min. - Depois de injetar totalmente a suspensão da célula, retire o tubo A da torneira ii).
NOTA: A contagem de células pode ser realizada nesta etapa para medir a taxa de retenção de células no andaime descelularizado. A taxa de retenção celular típica é de 80-90%, independentemente do número de células injetadas19.
A qualidade do andaime pulmonar descelularizado determina estritamente a taxa de retenção celular. Qualquer vazamento do pulmão descelularizado (por exemplo, do AP principal, superfície pulmonar) resulta em uma menor taxa de retenção celular. Certifique-se de que não haja vazamento aparente do pulmão descelularizado injetando 2-3 mL de meio de cultura com uma seringa estéril conectada a uma das torneiras no biorreator baseado em perfusão e confirme se os pulmões descelularizados se expandem ligeiramente à medida que o meio é injetado.
- Cultura de órgãos de perfusão
- Coloque a câmara do órgão em uma incubadora de CO2 .
- Fixe a tubulação B a um cabeçote de bomba conectado a uma bomba pulsátil.
- Feche a porta de vidro da incubadora de CO2 . Certifique-se de que a tubulação esteja colocada corretamente entre a porta de vidro e a vedação de borracha (Figura 3B).
- Incubar o andaime descelularizado a 37 °C durante 3 h para permitir que as células endoteliais injetadas se depositem no andaime.
NOTA: Certifique-se de que a bomba pulsátil esteja sempre desligada entre as etapas 3.4.1 e 3.4.4. - Ligue a bomba a uma taxa de 6 rpm, o que resulta em 2 mL/min de perfusão média usando um tubo L/S 14. Observe o pulmão descelularizado sendo ligeiramente expandido com a perfusão média.
- Feche a porta da incubadora (Figura 3C).
- Execute a mudança de mídia através do Stopcock iii). Troque metade da mídia a cada 2 ou 3 dias.
- Pare o acionamento da bomba, coloque uma seringa estéril de 50 mL na torneira iii) e retire 50 mL de meio da câmara.
- Encher outra seringa estéril de 50 ml com 50 ml de meio pré-aquecido e transferir o meio para a câmara através da torneira iii). Troque a torneira adequadamente e ligue a bomba pulsátil.
- Colha o bloco coração-pulmão recelularizado após pelo menos 2 dias de cultura de órgãos de perfusão.
NOTA: Em nosso estudo, 2 dias de cultura de perfusão foram suficientes para revascularizar homogeneamente o arcabouço pulmonar descelularizado usando 3 × 107 HUVECs. Ao usar menos de 3 × 107 HUVECs, uma incubação mais longa pode ser necessária para melhorar a eficiência da recelularização.
4. Transplante ortotópico do pulmão por bioengenharia
- Preparação de medicamentos
- Prepare o agente anestésico combinado MMB misturando midazolam (concentração final, 4 mg / kg), medetomidina (concentração final, 0,75 mg / kg) e tartarato de butorfanol (concentração final, 5 mg / kg) com solução salina normal de grau clínico.
- Prepare a solução de heparina misturando-a com solução salina normal de grau clínico (concentração final, 1000 U / mL).
- Prepare a cefazolina sódica misturando-a com solução salina normal de grau clínico (uma dose, 30 mg / kg).
- Procedimento cirúrgico
- Preparação de manguitos
- Esfregue levemente os três tipos de angiocateter com uma lixa fina para facilitar a permanência dos vasos balonetes.
- Prepare um manguito brônquico a partir de um angiocateter de teflon 20 G com 1 mm de comprimento usando um bisturi # 11. Antes de cortar o angiocateter, use a parte de trás do bisturi #11 para fazer um recuo no angiocateter para amarrar o náilon 10-0.
- Prepare o manguito da veia pulmonar (PV) de um angiocateter de teflon 22 G com 0,8 mm de comprimento e o manguito PA de um angiocateter de teflon 24 G com 0,6 mm de comprimento.
NOTA: Esta preparação pode ser feita antes do dia do experimento.
- Fixação do manguito ao pulmão de bioengenharia
- Coloque o bloco coração-pulmão em um pedaço de gaze estéril umedecida com solução salina fria, coloque outro pedaço de gaze limpa e seca sob ele e coloque uma placa de Petri em uma caixa de isopor cheia de gelo limpo.
NOTA: Colocar a gaze seca evita que o bloqueio coração-pulmão congele acidentalmente. - Coloque um clipe de aneurisma para prender a traqueia e a gaze (Figura 4A). Coloque um pequeno pedaço de gaze no coração, cobrindo também o pulmão direito. Coloque outra gaze no pulmão esquerdo. Ajuste essa retração com a gaze umedecida para expor o hilo esquerdo da forma mais clara possível.
- Disseque cuidadosamente as estruturas hilares umas das outras usando microfórceps retas ou angulares, dependendo da preferência (Figura 4B). Comece a dissecar do ligamento pulmonar ao longo do nervo vago. Incisar a pleura visceral sob a VP e mover a aorta descendente e o nervo vago juntos através da parte posterior do hilo pulmonar esquerdo para o lado cranial.
- Disseque o tronco da coronária esquerda do tronco pulmonar até a borda do pulmão esquerdo (Figura 4C). Em seguida, divida a AP ao nível do tronco pulmonar para obter o comprimento adequado.
- Disseque o VP esquerdo do lado esquerdo do átrio esquerdo até a borda do pulmão esquerdo (Figura 4D). Divida o VP esquerdo ao nível do átrio esquerdo para obter o comprimento adequado.
- Suspenda o manguito PA logo acima do PA usando o grampo de estabilização e insira o PA dentro do manguito (Figura 4E). Dobre o PA sobre o manguito), expondo a superfície endotelial. Prenda ao redor do manguito com uma braçadeira de náilon 10-0 (Figura 4F). Coloque o manguito no PV de maneira idêntica (Figura 4G,H).
- Divida o brônquio esquerdo ao nível da carina. Coloque o manguito no brônquio de maneira idêntica (Figura 4I).
- Coloque o bloco coração-pulmão em um pedaço de gaze estéril umedecida com solução salina fria, coloque outro pedaço de gaze limpa e seca sob ele e coloque uma placa de Petri em uma caixa de isopor cheia de gelo limpo.
- Procedimento para o mouse destinatário
- Anestesiar o camundongo receptor com uma mistura de MMB i.p. com uma agulha de 27 G e intubar inserindo um angiocateter de poliuretano de 20 G sob um microscópio. Coloque o mouse receptor em um aquecedor elétrico com temperatura ajustável na posição de decúbito lateral direita e conecte o angiochatheter ao respirador. Defina a configuração do ventilador da seguinte forma: oxigênio 2 L/min, frequência respiratória 120 bpm, volume corrente 0.5 mL. Esterilize a parede torácica com etanol a 70% e injete a mistura de cefazolina s.c.
- Incise a pele com uma tesoura. Corte o tecido subcutâneo e os músculos com um cautério. Abra o tórax através do3º espaço intercostal e coloque os afastadores torácicos.
NOTA: Embora a toracotomia precise ser grande o suficiente para implantação, não machuque a artéria mamária interna, o que pode levar a sangramento maciço. - Disseque o ligamento pulmonar com um cotonete e uma tesoura de mola grande. Coloque um limpador arterial curvo no pulmão esquerdo do receptor para retrair o pulmão facilmente. Com uma micropinça angulada, disseque a pleura mediastinal ao redor do hilo pulmonar esquerdo.
NOTA: A base da dissecação da pleura é semelhante à ressecção anatômica do pulmão de um ser humano. - Disseque o AP do brônquio usando micropinças curvas do mediastino até a borda do pulmão esquerdo (Figura 5A). Disseque o brônquio da PV de maneira semelhante.
NOTA: A dissecção pode ser realizada facilmente quando a pleura é dissecada na manobra anterior (etapa 4.2.3.3). - Coloque um nó corrediço de seda 10-0 na base do PA para ocluir (Figura 5B). Coloque um clipe aneurismático fino e angular na base do PV e do brônquio (Figura 5C).
- Enrole o náilon 10-0 ao redor do brônquio, PA e PV, deixando solto para prender os punhos nas etapas seguintes.
- Incisar a PA, o brônquio e a VP do receptor na borda do pulmão esquerdo do receptor usando uma tesoura de micromola (Figura 5D). Dilate suavemente o PA e o PV usando uma micropinça reta. Remova o sangue no PA e PV com solução salina usando uma seringa de 1 mL e um angiocathater 24 G.
NOTA: As incisões de PA, brônquios e PV estão a cerca de um terço do caminho. As micropinças retas são suaves e adequadas para dilatação. - Coloque o pulmão de bioengenharia, coberto com gaze umedecida, em cima do pulmão esquerdo do receptor (Figura 5E), o mais próximo possível do mediastino do receptor.
- Inserção do manguito PA doador no PA receptor (Figura 5F).
NOTA: Haverá algum alongamento no PA do doador. Se o tamanho da incisão PA for apropriado, é menos provável que o manguito do doador seja desalojado. Mover o pulmão de bioengenharia para perto do mediastino também impedirá que o manguito do doador seja desalojado. - Prenda ao redor do manguito com uma braçadeira de náilon 10-0 (Figura 5G). De maneira semelhante, insira e prenda o brônquio doador (Figura 5H) e os manguitos PV (Figura 5I,J).
- Remova o clipe de aneurisma de ângulo fino (Figura 5L). Observe que o sangue está refluindo além do manguito PV e remova a gravata de seda no PA para retomar o fluxo sanguíneo anterógrado para o pulmão de bioengenharia.
- Preparação de manguitos
Resultados
Seguindo o protocolo de descelularização, os pulmões dos camundongos são visivelmente brancos e translúcidos (Figura 6A). Os componentes celulares devem ser totalmente removidos, mas a estrutura alveolar permanece intacta na observação histológica (Figura 6B,C). Pulmões de camundongos recelularizados usando 3 × 107 HUVECs com cultura de biorreator baseada em perfusão de 2 dias mostram uma distribuição homogênea de HUVECs ( Figura 7A ). As HUVECs migram para a área alveolar periférica, formando uma rede capilar (Figura 7B). Após o transplante ortotópico e a reperfusão de pulmões de bioengenharia, o fluxo sanguíneo contendo glóbulos vermelhos é observado de forma homogênea nos pulmões de bioengenharia (Figura 8A, B).

Figura 1: Canulação do bloqueio coração-pulmão do camundongo. (A) Cateteres de artéria pulmonar preparados. (B) Esquema de canulação. (C) Imagem representativa após a conclusão da canulação. Barras de escala = 1 cm (A,C). Essa figura foi adotada de Tomiyama et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação da câmara do órgão. (A) Os orifícios são cortados conforme descrito. (B) A tubulação é inserida conforme indicado. (C) Preparação da tampa para um frasco de vidro autoclavável de 250 mL para o reservatório da célula. (D) O frasco de vidro de 250 mL colocado no agitador magnético. Essa figura foi adotada de Tomiyama et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 3: Configuração do biorreator baseado em perfusão. (A) Peças e montagem. (B) Configuração real. Observe que a tubulação é inserida entre uma porta de vidro e uma vedação de borracha. (C) Um instantâneo durante a cultura de órgãos de perfusão acionada por bomba. Essa figura foi adotada de Tomiyama et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 4: Preparação do pulmão de bioengenharia para transplante. (A) Colocação do pulmão projetado. (B) Dissecção do hilo. (C) Dissecção do AP principal. (D) Dissecção do PV. (E) Inserção do PA no manguito. (F) Fixação do PV ao manguito. (G) Inserção do PV no manguito. (H) Fixação do PV ao manguito. (I) Inserção e fixação do brônquio esquerdo ao manguito. Abreviaturas: PA = artéria pulmonar; VP = veia pulmonar. Clique aqui para ver uma versão maior desta figura.
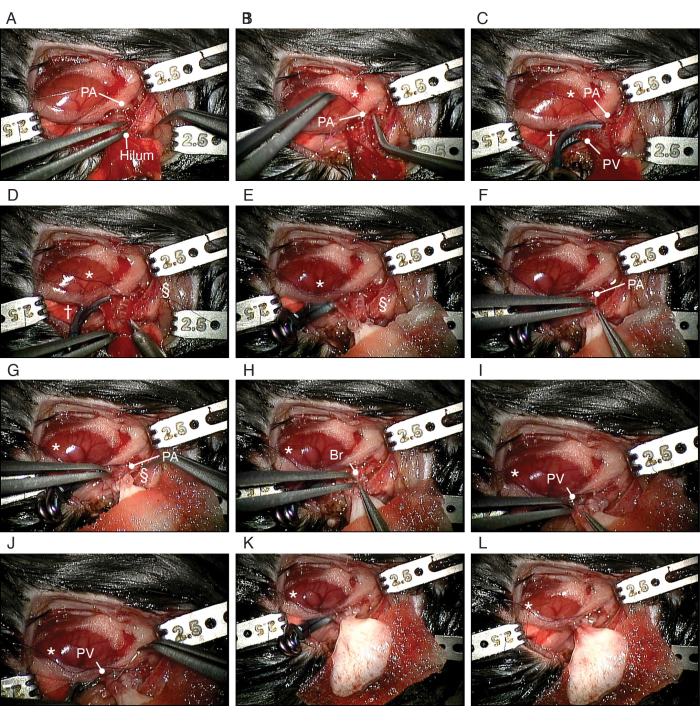
Figura 5: Procedimento de transplante ortotópico do pulmão por bioengenharia. (A) Dissecção do PA do receptor. (B) Fazer um nó corrediço em torno do PA do destinatário. (C) Clipagem do PV e brônquio. (D) Incisar o PA. (E) Colocação do pulmão esquerdo de bioengenharia. (F) Inserção do PA balonetado do pulmão de bioengenharia no PA do receptor. (G) Prendendo o PA ao redor do manguito. (H) Inserção do manguito brônquico do pulmão de bioengenharia no brônquio do receptor. (I) Inserção do PV do pulmão de bioengenharia no PV do receptor. (J) Prendendo o PA ao redor do manguito. Abreviaturas: PA = artéria pulmonar; VP = veia pulmonar; Br = brônquio; * = nó corrediço; † = clipe aneurismático; § = 10-0 gravata de nylon. Clique aqui para ver uma versão maior desta figura.
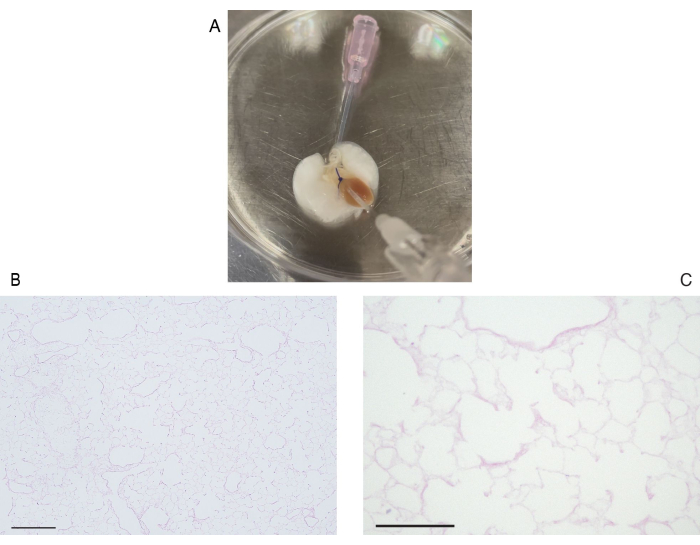
Figura 6: Descelularização do pulmão de camundongo. (A) Imagem macroscópica do pulmão descelularizado. (B) Imagem de baixa potência do pulmão descelularizado (aumento de 100x). (C) Imagem corada com hematoxilina e eosina de alta potência do pulmão descelularizado. Observe que não há componente celular visível (ampliação, 400x). Barras de escala = 100 μm (B), 50 μm (C). Clique aqui para ver uma versão maior desta figura.

Figura 7: Pulmão de camundongo revascularizado usando HUVECs. (A) Imagem corada com hematoxilina e eosina de baixa potência do pulmão revascularizado (aumento, 200x, ladrilhos). (B) Imagem corada com H&E de alta potência do pulmão revascularizado (aumento de 200x). Barras de escala = 1000 μm (A), 100 μm (B). Abreviaturas: HUVECs = células endoteliais da veia do cordão umbilical humano; H&E = hematoxilina e eosina. Clique aqui para ver uma versão maior desta figura.

Figura 8: Imagem pulmonar após transplante e reperfusão sanguínea. (A) Imagem de H&E de baixa potência do pulmão revascularizado após 10 min de reperfusão (aumento, 200x, ladrilhos). (B) Imagem de H&E de alta potência do pulmão revascularizado após 10 min de reperfusão (aumento de 200x). Barras de escala = 1000 μm (A), 100 μm (B). Abreviatura: H&E = hematoxilina e eosina. Clique aqui para ver uma versão maior desta figura.
Discussão
A bioengenharia de órgãos é um empreendimento exigente. O dispendioso processo de triagem tem dificultado o ciclo de pesquisa e desenvolvimento desse campo. Ao usar camundongos como plataforma experimental, o espaço, as células e o meio são significativamente reduzidos em comparação com a plataforma de ratos usada anteriormente. Embora a medição de parâmetros físicos detalhados, como troca gasosa, resistência vascular ou complacência pulmonar, ainda não tenha sido alcançada, o modelo de pulmão de camundongo permite cronogramas de pesquisa acelerados, pois permite a iteração rápida de protocolos experimentais e testes de viabilidade celular, integração e interação de andaimes. Os camundongos se reproduzem rapidamente e estão disponíveis em várias cepas geneticamente modificadas, oferecendo flexibilidade no estudo de várias modificações genéticas e celulares in vivo. Essa capacidade de testar hipóteses rapidamente e otimizar protocolos ajuda a avançar nossa compreensão dos ambientes celulares ideais e técnicas de cultura necessárias para uma bioengenharia pulmonar bem-sucedida. Ao refinar técnicas em modelos de camundongos, os pesquisadores podem estabelecer métodos e protocolos escaláveis que podem ser posteriormente traduzidos para modelos animais maiores e, eventualmente, aplicações humanas.
A etapa crítica do procedimento é a inserção e fixação de um cateter PA. A fixação do cateter PA só é possível utilizando-se um cateter de pequeno diâmetro (<3 Fr) com um colar na ponta. Devido à natureza frágil dos pulmões, a cirurgia deve ser realizada inteiramente com cautela. Nenhum instrumento de metal deve tocar a superfície pulmonar; caso contrário, o pulmão sofreria vazamento significativo. Use um cotonete para manobrar os pulmões quando necessário. Os autores assumem que os pesquisadores podem realizar com eficiência o procedimento de canulação após o treinamento usando 10-15 camundongos.
O protocolo de descelularização aqui descrito é baseado em relatos anteriores 22,24. Outros protocolos usando diferentes conjuntos de detergentes podem ser aplicáveis. O bloqueio coração-pulmão deve sempre ser tratado com cautela. Incidentes típicos durante o procedimento de descelularização incluem a penetração do cateter AP, saída do cateter traqueal e vazamento de ar. Os autores não confirmaram experimentalmente a integridade do andaime descelularizado após armazenamento refrigerado em PBS. Ainda assim, os autores não tiveram problemas com o uso de bloqueios coração-pulmão descelularizados armazenados em PBS por até 4 semanas.
Evitar a contaminação bacteriana é crucial. Todos os equipamentos de vidro, PVDF e peças de silício devem ser autoclavados antes do experimento. As outras peças devem ser usadas apenas uma vez. Para minimizar o risco de contaminação bacteriana, todos os procedimentos devem ser realizados em um gabinete de biossegurança limpo. É desejável incluir antimicóticos e antibióticos na mídia. Mudanças frequentes de meio durante a perfusão aumentam o risco de contaminação. Além disso, bolhas de ar devem sempre ser evitadas na tubulação. Bolhas de ar na tubulação são posteriormente presas no andaime descelularizado, o que pode bloquear a perfusão do meio na área periférica e resultar em distribuição celular heterogênea. Além disso, as células endoteliais devem ser completamente destacadas por tripsinização ou outro meio de dissociação celular apropriado. Os pellets celulares devem ser bem interrompidos para formar uma suspensão homogênea de célula única. Muita densidade celular (por exemplo, >2 milhões de células/mL) pode promover a formação de aglomerados celulares, o que pode resultar em embolia na vasculatura proximal.
Testamos apenas um curto período (2 ou 3 dias) de cultura de biorreator de perfusão. Em nosso estudo anterior, usamos números variados de células endoteliais para revascularizar o andaime pulmonar de camundongo descelularizado e descobrimos que há um limite em que a adição de mais células não melhora a cobertura celular, que foi de ~ 3 × 107 células endoteliais por bloco pulmão-coração de camundongo19. Esperamos que uma duração de cultura mais longa (por exemplo, 14 dias) melhore a cobertura e a maturação da vasculatura recelularizada, conforme descrito nos estudos anteriores de bioengenharia pulmonar 9,10,15,25.
A base da preparação do enxerto pulmonar por bioengenharia é semelhante à de um transplante pulmonar regular de camundongo 26,27. O tecido pulmonar projetado não é tão frágil quanto um enxerto pulmonar comum. O desafio é que o tecido pulmonar, incluindo a estrutura do hilo, é totalmente branco ou quase transparente. Uma compreensão precisa da anatomia local é indispensável para o sucesso do transplante. A técnica estável deve ser obtida usando pulmões nativos. Os autores assumem que os pesquisadores podem realizar confortavelmente o procedimento de transplante após o treinamento usando 100 camundongos.
O transplante do pulmão de bioengenharia usando células derivadas de humanos no camundongo está tecnicamente disponível; no entanto, a rejeição aguda do enxerto é inevitável devido à natureza xenotransplantada desse modelo. Este modelo pode ser usado para testar a eficiência de recelularização de curto prazo dos pulmões de bioengenharia, e a funcionalidade de longo prazo deve ser investigada usando camundongos imunodeficientes.
Embora não tenha sido testada no método atual, a bioengenharia do pulmão inteiro usando células endoteliais e epiteliais não deve ser tecnicamente tão desafiadora, considerando as dificuldades na engenharia vascular pulmonar aqui descritas. Além disso, essa plataforma em escala de camundongo pode ser expandida para outros campos de pesquisa, como a investigação da interação celular em condições de cultura 3D, interação célula-matriz, modelagem de câncer ex-vivo e assim por diante. Em resumo, este método fornece uma plataforma de bioengenharia pulmonar razoável e robusta.
Divulgações
Os autores não têm conflitos de interesse em relação a este manuscrito.
Agradecimentos
Este estudo foi apoiado financeiramente pelo Grant-in-Aid for Scientific Research / KAKENHI (C) #20K09174, #23K08308, o Fundo para a Promoção da Pesquisa Internacional Conjunta (Fostering Joint International Research (B)) #22KK0132 para TS, JSPS KAKENHI Grant Number 21K08877 para TW, prêmio Leave a Nest Grant Ikeda-Rika para FT e o Grant-in-Aid for JSPS Fellows #21J21515 para FT. Agradecemos imensamente à Sra. Maiko Ueda, equipe técnica do Núcleo de Pesquisa Biomédica da Escola de Pós-Graduação em Medicina da Universidade de Tohoku, por seu trabalho intensivo em observação histológica. Também agradecemos o conselho técnico da Sra. Yumi Yoshida e do Sr. Koji Kaji no Centro de Instrumentos de Pesquisa do IDAC, Universidade de Tohoku, por seu suporte ao processamento de imagens.
Materiais
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
Referências
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados