Method Article
탈세포화된 마우스 폐와 1차 인간 내피 세포를 이용한 생체공학적 폐 이식
요약
이 논문은 탈세포화(decellularization) 및 재세포화(recellularization) 방법을 사용하여 생체공학적 마우스 폐를 만드는 방법을 설명합니다. 또한 후속 정소성 폐 이식에 대해서도 자세히 설명합니다.
초록
폐 이식은 특발성 폐 섬유증과 같은 말기 폐 질환 환자에게 중요한 치료법이지만, 기증자 부족 및 이식 후 합병증과 같은 문제는 여전히 남아 있습니다. 환자 특이적 세포를 탈세포화된 동물 골격에 통합하는 생명공학적 폐는 유망한 대안을 제시합니다. 동물 모델에서 생명공학적 폐를 사용하는 데 진전이 있었음에도 불구하고 기능과 구조는 여전히 미성숙합니다. 이 프로토콜은 장기 생명 공학의 중요한 장벽, 즉 비용 효율적인 실험 플랫폼의 필요성을 해결합니다. 쥐나 돼지와 같은 큰 동물 대신 마우스 모델을 사용함으로써 연구원들은 각 실험에 필요한 리소스를 크게 줄여 연구 진행을 가속화할 수 있습니다.
이 프로토콜은 마우스 심장-폐 차단과 인간 일차 세포를 사용한 폐 생명공학에 대한 자세한 절차를 설명하며, 마우스 심장-폐 차단에 대한 분리 전략, 탈세포화, 생물반응기 설정, 관류 기반 장기 배양 및 생명공학 폐의 이정소 이식에 중점을 둡니다. 이 마우스 스케일 플랫폼은 실험 비용을 절감할 뿐만 아니라 재세포화를 위한 세포 유형 및 수를 최적화하고, 조직학적 및 분자적 방법을 사용하여 다양한 세포 유형을 테스트하고, 이식 후 혈류를 보장하기 위한 실행 가능한 프레임워크를 제공합니다. 이 방법은 3차원 배양 조건에서의 세포 상호 작용 연구, 세포-매트릭스 상호 작용 및 생체 외 암 모델링을 포함하여 광범위한 응용 분야에 대한 잠재력을 가지고 있어 장기 생명 공학 분야를 발전시킬 수 있습니다.
서문
폐 이식은 특발성 폐 섬유증과 같은 말기 폐 질환1을 앓고 있는 환자에게 결정적인 치료법이 되어 왔는데, 약물 치료는 호흡 기능의 저하를 막는 데 효과가 없습니다. 매년 더 많은 적격 환자가 대기자 명단에 추가됩니다. 그러나 사망한 기증자의 장기 기증 건수는 대기 환자 수의 증가에 뒤처지고 있다 2,3. 폐 이식을 받은 후에도 원발성 장기 기능 장애, 반응성 동종 증후군, 감염 등 이식된 폐의 기능을 저하시키는 몇 가지 문제가 발생하여 폐 이식 수혜자의 5년 생존율이 현저히 저하된다4.
장기 이식의 현재 문제점에 대처하기 위해 한계 기증자의 활용5, 체외 폐 관류 시스템6에서 기증자의 폐를 회복하는 것, 유전자편집 돼지를 이용한 이종 이식7 등 여러 가지 옵션이 있습니다. 이러한 대안은 기증자 장기 풀을 확장할 수 있습니다. 그러나 어느 것도 기증자 장기의 희소성, 면역원성 및 기능적 이질성을 완전히 해결할 수는 없습니다.
현실과는 거리가 멀지만, 환자 특이적 세포가 탈세포화된 동물 장기 골격에 통합된 생명공학적 인공 장기는 고형 장기 이식의 매력적인 잠재적 공급원입니다8. 2010년 이후 생체공학적 폐의 잠재적 유용성을 입증한 여러 선구적인 연구가 보고되었습니다 9,10. 이 연구에서, 쥐 또는 돼지의 폐는 세제에 의해 탈세포화되었고, 동물 또는 인간 세포는 관류 기반 생물 반응기에서 폐 조직을 재생하기 위해 기관 또는 폐 혈관 구조에서 주입되었으며, 그들 중 일부는 동물 흉강에 정형외과 적으로 이식되었습니다11 , 12 , 13 , 14 , 15. 그러나 생명공학적 폐의 기능과 구조는 시기상조였는데, 아마도 생물반응기에서 배양된 세포의 수가 부족하거나 세포간 접합부가 덜 통합되었기 때문인 것으로 보입니다.
장기 생명공학 연구를 진전시키는 데 방해가 되는 한 가지 장애물은 소규모 실험 플랫폼이 없다는 것입니다. 쥐나 돼지는 이 분야에서 일반적으로 사용되는 동물이지만 폐16당 >108개의 폐 세포가 필요하므로 학술 실험실에 비용이 많이 듭니다. 장기 생명공학 연구에 생쥐를 사용할 수 있다면 각 실험의 비용을 획기적으로 절감하고 연구 프로그램의 속도를 높일 수 있습니다. 쥐의 폐와 인간의 폐 사이에는 해부학적 차이가 존재하지만(17), 폐의 기본 구조는 포유류18 간에 비슷하다. 따라서 쥐 규모 실험의 결과는 단순히 몸 크기에 따라 숫자를 곱함으로써 더 큰 동물에 적용될 수 있습니다.
이 프로토콜은 쥐의 심장-폐 차단과 인간 일차 세포를 사용하여 폐 생명 공학의 상세한 실험 절차를 설명하는 것을 목표로 합니다19. 본 연구를 위해 이전에 보고되고 널리 사용된 쥐의 폐 탈세포화 프로토콜을 채택했다 20,21,22. 폐 생명공학의 어려운 부분은 탈세포화된 모세혈관 혈관 구조의 재세포화입니다20; 따라서 인간 탯줄 정맥 내피 세포가 이 프로토콜에 사용됩니다.
프로토콜
모든 실험은 도호쿠 대학이 발행한 도호쿠 대학의 동물 실험 및 관련 활동에 관한 규정(15판)을 따랐습니다. 이 연구는 도호쿠 대학의 기관 동물 관리 및 사용 위원회(#2020AcA-041-01)의 승인을 받았습니다.
1. 탈세포화를 위한 재료 준비
- 탈세포화 용액 준비(1L 오토클레이브 유리병에 담긴 1,000mL 형식)
- 멸균 탈이온수(DI): 1L 오토클레이브 유리병에 증류수 또는 DI수 1,000mL를 첨가합니다. 121°C에서 20분 동안 오토클레이브합니다.
- Triton X-100: 1L 형식의 오토클레이브 유리병에 1,000mL의 멸균 DI 워터에 Triton X-100 1mL를 추가합니다. (선택 사항) 페니실린 10mL와 스트렙토마이신 용액(최종 농도, 페니실린 500단위/mL 및 스트렙토마이신 500μg/mL)을 추가합니다.
참고: 오토클레이브하지 마십시오. - 소듐데옥시콜레이트: 20L 형식의 오토클레이브 유리병에 1,000mL의 멸균 DI 물에 데옥시콜산나트륨 분말 1g을 첨가합니다. 뚜껑을 닫고 병을 뒤집어 분말을 용해시킵니다. (선택 사항) 페니실린 10mL와 스트렙토마이신 용액을 추가합니다.
참고: 오토클레이브하지 마십시오. - 1M NaCl: 1L 형식의 오토클레이브 유리병에 58.44g의 NaCl을 1,000mL의 증류수 또는 DI수에 첨가합니다. 121°C에서 20분 동안 오토클레이브합니다.
- DNase I 원액: 배지 A에 10mg/mL 농도로 희석합니다.
- 매체 A: 5mM CaCl2 (9mL의 멸균 DI 물에 5mg의 CaCl2 )를 준비하고 멸균 DI 물로 1:10 희석합니다.
- DNase I 작업 용액: 33μL의 DNase I 원액을 10mL의 배지 B에 추가합니다.
- 미디엄 B: 10x 미디엄 B(멸균 DI 물 100mL에 MgSO4 155mg + CaCl2 220mg)를 준비하고 멸균 DI 워터로 1:10 희석합니다.
- 폐동맥(PA) 및 기관(멸균 절차)을 위한 카테터 준비
- PA 카테터(쥐 경정맥용 카테터)를 약 15mm 길이로 자릅니다.
- 칼라를 카테터 끝으로 이동합니다.
- 카테터 커넥터를 PA 카테터에 삽입하고 인젝터에 부착합니다. 준비된 PA 카테터는 그림 1A에 나와 있습니다.
- PA 카테터를 사용할 때까지 70% 에탄올에 보관하십시오.
- 20G iv 카테터를 약 15mm 길이로 자릅니다. 이것은 기관 카테터에 사용됩니다.
- 심폐 차단술을 채취하기 위한 마우스 수술
- 수컷 마우스(C57BL/6, 무게 > 28g)를 이산화탄소 또는 이소플루란을 과다 투여하여 안락사시킵니다.
- 수술 테이블에 마우스를 누운 자세로 놓고 팔다리를 고정합니다. 가슴과 복부 표면에 에탄올을 70% 분사하여 살균합니다.
- 스테인리스 가위로 목까지 정중선의 복강을 열고 가위로 흉골을 나눕니다. 흉벽에서 횡격막을 절제하고, 복부 흉벽을 절단하여 흉강을 완전히 노출시키고, 흉선을 제거합니다. 1.3.5단계에서 PBS의 역류를 방지하기 위해 4-0 실크로 하대정맥과 우측 상대정맥을 결찰하여 폐혈관 내 혈액의 세척을 향상시킵니다.
- 배액을 위해 스테인리스 가위로 복부 대동맥을 자릅니다. 복부 대동맥을 식별할 수 없는 경우 하대정맥과 복부 대동맥을 모두 잘라냅니다.
- 우심실에서 3mL의 멸균 PBS를 5mL 멸균 주사기와 27G 바늘로 우심실 벽을 뚫어 주입합니다.
- Dumont 집게를 사용하여 4-0 실크로 메인 PA를 고리를 만듭니다.
참고: 주 PA와 상행 대동맥은 함께 루프를 만들 수 있습니다. - 스프링 가위로 오른쪽 심실 벽을 절단하여 PA 밸브 아래 2mm 창을 엽니다.
- 창을 통해 PA 카테터를 삽입하고 이전에 고리를 친 4-0 실크를 고정합니다(그림 1B).
알림: 이 절차 중에는 PA 벽이 손상될 수 있으므로 PA를 만지지 마십시오. 주 PA와 상행 대동맥은 함께 결찰하고 고정할 수 있습니다. - 5mL 멸균 주사기로 PA 카테터를 통해 PBS 2mL를 천천히 주입합니다. PBS가 주입될 때 양쪽 폐가 약간 확장되는지 확인하십시오.
- 기관 카테터로 기관을 캐뉼레이션하고 4-0 실크 봉합사로 제자리에 묶습니다(그림 1C).
- 빈 5mL 멸균 주사기로 기관 카테터를 통해 2mL의 공기를 천천히 주입하고 10초 동안 유지합니다. 폐에서 공기가 새지 않는지 확인하십시오.
- 심장과 폐를 일괄적으로 제거하십시오. 뒤몽 겸자와 기관 카테터로 기관을 잡고 경추 식도를 절단하고 척추에서 절개합니다. 양측 쇄골하 정맥과 동맥을 절단합니다. 마지막으로 식도와 대정맥을 횡격막 수준에서 절단합니다.
알림: 기구로 폐 표면을 만지지 마십시오. 조금만 만지면 공기가 누출될 수 있습니다.
- 마우스 폐의 탈세포화(3일 절차)
알림: 섹션 1.4의 모든 절차는 깨끗한 생물 안전 캐비닛에서 수행해야 합니다.- 1일차
- 절제된 심폐 차단장치를 직경 10cm의 플라스틱 페트리 접시에 옮기고 심폐 차단을 4°C에서 1시간 동안 멸균 DI 수에서 배양합니다.
- 5mL 멸균 주사기를 사용하여 기관 카테터 3x를 통해 멸균 DI 워터 2mL와 PA 카테터를 통해 멸균수 2mL를 주입합니다. 폐가 움츠러들 때 액체가 나오도록 각 주입 후에 일시 중지하십시오(그림 1C).
참고: 약 0.5mL/s의 속도로 물을 주입합니다. - 0.1% Triton X-100 용액 2mL를 기관 카테터에 주입하고 2mL를 PA 카테터에 주입합니다.
- 페트리 접시에 심폐 블록을 놓고 Triton X-100 용액에서 4°C에서 밤새 정적으로 배양합니다.
- 2일차
- 1.4.1.2단계에 설명된 대로 멸균 DI 물이 포함된 폐에서 Triton X-100 용액을 제거합니다.
- 2% 나트륨 데옥시콜레이트 용액 2mL를 기관 카테터에 주입하고 2mL를 PA 카테터에 주입합니다. 4 °C에서 24 시간 동안 deoxycholate 용액에서 배양합니다.
- 3일차
- 1.4.1.2단계에 설명된 대로 멸균 DI 물로 폐에서 나트륨 데옥시콜레이트 용액을 제거합니다.
- 1M NaCl 용액 2mL를 기관 카테터에 주입하고 2mL를 PA 카테터에 주입합니다. 실온에서 1시간 동안 NaCl 용액에서 배양합니다.
- 1.4.1.2단계에 설명된 대로 멸균 DI 물과 함께 NaCl 용액에서 제거합니다.
- DNAse I 작업 용액 2mL를 기관 카테터에 주입하고 2mL를 PA 카테터에 주입합니다. RT에서 1시간 동안 DNase 작업 용액에서 배양합니다.
- 1.4.1.2단계에서 설명한 대로 폐에서 DNase 용액을 제거하되 멸균 PBS를 사용합니다. 탈세포화 절차 후 폐가 흰색이고 가장자리가 투명한지 확인합니다.
참고: 탈세포화 절차가 진행됨에 따라 폐는 더 취약해집니다. 심폐 차단은 항상 주의해서 다루고 폐 표면을 만지지 마십시오. 탈세포화 후 심폐 차단은 최대 3주 동안 4°C에서 PBS/항생제에 보관할 수 있습니다.
- 1일차
2. 인간 일차 세포의 배양
- 소 태아 혈청(최종 농도, 2%), 하이드로코르티손(최종 농도, 0.2μg/mL), 인간 염기성 섬유아세포 성장 인자(최종 농도, 4ng/mL), 혈관 내피 성장 인자(2ng/mL), R3-인슐린 유사 성장 인자-1(최종 농도, 5ng/mL), 아스코르브산(최종 농도, 75μg/mL), 인간 표피 성장 인자(최종 농도, 10 ng/mL), 겐타마이신/암포테리신-1000(최종 농도, 겐타마이신: 30 μg/mL, 암포테리신: 15 ng/mL) 및 헤파린(최종 농도, 1 ng/mL).
- 2 × 106 인간 탯줄 정맥 내피 세포(HUVEC)를 37°C의 수조에서 냉동 바이알에 해동합니다.
- 15mL 코니컬 튜브에 EGM2가 포함된 세포를 혼합하고 500 × g 에서 5분 동안 원심분리합니다.
- 세포를 계수하고 적절한 세포 밀도(2.0 x 10,4 cells/cm2 권장)에서 하대배양합니다. 6웰 형식의 플레이트에서 시작하여 T75 플라스크로 옮깁니다.
- 필요한 수의 세포가 얻어질 때까지 세포를 계대파합니다.
참고: HUVEC을 사용하여 완전한 폐혈관 범위를 측정하려면 3 × 107 HUVEC이 필요합니다19.
3. 생물반응기 설정 및 관류 장기 배양
- 장기 챔버 및 세포 저장소의 준비
- 그림 2A와 같이 코르크 천공을 사용하여 실리콘 마개에 구멍을 자릅니다. 구멍 크기는 5mm(i, ii 및 iii) 및 7mm(iv 및 v)입니다. 그림 2A의 각 구멍 번호(i-v)는 그림 2B의 구멍 번호에 해당합니다.
- 그림 2B와 같이 실리콘 스토퍼를 통해 펌프 튜브를 삽입합니다.
- 코르크 천공을 사용하여 상단 개방형 나사 캡의 실리콘 격막에 5mm 구멍을 자릅니다. 구멍에 L/S 14 백금 경화 튜브를 삽입합니다(그림 2B, C).
- 튜빙이 있는 실리콘 스토퍼, 유리 캐니스터, 튜빙이 있는 GL-45 나사 캡, 250mL 오토클레이브 유리병, 루어 피팅이 있는 L/S 14 튜빙( 그림 3A의 튜빙 B 및 튜빙 C)을 포함한 위의 재료를 121°C에서 20분 동안 오토클레이브합니다. 튜빙 B와 C가 루프를 만들 수 있도록 적절한 루어 피팅을 선택하십시오.
참고: 유리 용기는 장기 챔버에 사용되며 250mL 유리병은 세포 저장소로 사용됩니다.
- 관류 기반 생물 반응기 회로의 조립
알림: 다음 절차는 깨끗한 벤치에서 수행해야 합니다.- 유리 용기에 70mL의 배양 배지를 추가한 다음 유리 용기 위에 실리콘 마개를 놓습니다.
- 그림 3A에 설명된 대로 3방향 스톱콕을 사용하여 실리콘 마개, 유리 캐니스터, 튜브가 있는 GL-45 나사 캡, 250mL 오토클레이브 가능 유리병 및 루어 피팅이 있는 L/S 14 튜브를 조립합니다. GL-45 나사 캡의 실리콘 격막에 20G 바늘을 삽입합니다.
- 마개 i) 및 iii)에 연결된 10mL 주사기로 튜브 A, B 및 C의 매체를 채웁니다(1m의 튜브를 채우려면 ~3-5mL의 매체가 필요함). 3방향 스톱콕을 통해 10mL 주사기를 사용하여 배지 주입 및 회수를 반복하여 튜브 내부에 기포가 없는지 확인합니다.
- 튜브 C에 연결된 루어 피팅을 통해 탈세포화된 심폐 차단의 PA 카테터를 부착합니다.카테터 또는 튜브에 기포가 생기지 않도록 합니다.
- EGM2에서 0.5-1 × 106 cells/mL 밀도로 HUVEC을 수확하고 재현탁합니다. 2.5단계의 세포 현탁액을 세포 저장소에 추가합니다.
참고: 세포 현탁액은 3.2.4 단계와 3.2.5 단계 사이에 제조하는 것이 바람직합니다. 세포 저장소에 교반 막대를 넣습니다.
- 내피 세포의 중력 구동 주입
- HUVEC이 들어 있는 세포 저장소를 자기 교반기에 놓습니다. 세포 저장소의 바닥이 장기 챔버에서 30cm 위에 있는지 확인합니다(그림 2D 및 그림 3A).
- 약 120rpm의 속도로 자기 교반기를 켭니다.
- 마개 i) 및 ii)를 열어 세포 현탁액이 Tubing A, Tubing C 및 PA 카테터를 통해 탈세포화된 골격에 주입될 수 있도록 합니다.
참고: 1 × 106 cells/mL의 세포 밀도에서 3 × 107 세포를 주입하는 경우 세포 현탁액의 부피는 30mL여야 합니다. 일반적인 주입 속도는 1-2mL/분입니다. - 세포 현탁액을 완전히 주입한 후 Stopcock ii)에서 Tubing A를 분리합니다.
참고: 이 단계에서 세포 계수를 수행하여 탈세포화된 골격의 세포 유지율을 측정할 수 있습니다. 일반적인 세포 유지율은 주입된 세포의 수에 관계없이 80-90%입니다19.
탈세포화된 폐 골격의 품질은 세포 유지율을 엄격하게 결정합니다. 탈세포화된 폐(예: 주 PA, 폐 표면)에서 누출이 발생하면 세포 유지율이 낮아집니다. 관류 기반 생물반응기의 마개 중 하나에 연결된 멸균 주사기로 2-3mL의 배양 배지를 주입하여 탈세포화된 폐에서 명백한 누출이 없는지 확인하고 배지가 주입될 때 탈세포화된 폐가 약간 팽창하는지 확인합니다.
- 관류 장기 배양
- 장기실을 CO2 인큐베이터에 놓습니다.
- 튜빙 B를 맥동 펌프에 연결된 펌프 헤드에 고정합니다.
- CO2 인큐베이터의 유리문을 닫습니다. 튜브가 유리 도어와 고무 씰 사이에 제대로 배치되었는지 확인합니다(그림 3B).
- 탈세포화된 골격을 37°C에서 3시간 동안 배양하여 주입된 내피 세포가 골격에 정착하도록 합니다.
알림: 3.4.1단계와 3.4.4단계 사이에 박동 펌프가 항상 꺼져 있는지 확인하십시오. - 6rpm의 속도로 펌프를 시작하면 L/S 14 튜빙을 사용하여 2mL/min 매체 관류가 발생합니다. 매체 관류로 탈세포화된 폐가 약간 확장되는 것을 관찰하십시오.
- 인큐베이터 도어를 닫습니다(그림 3C).
- Stopcock iii)을 통해 미디어 변경을 수행합니다. 2일 또는 3일마다 미디어의 절반을 교체합니다.
- 펌프 드라이브를 중지하고 50mL 멸균 주사기를 마개에 부착한 다음 iii)을 사용하여 챔버에서 50mL의 배지를 회수합니다.
- 또 다른 50mL 멸균 주사기에 50mL의 예열된 배지를 채우고 마개 iii)을 통해 배지를 챔버로 옮깁니다. 스톱콕을 적절하게 전환한 다음 박동 펌프를 시작하십시오.
- 최소 2일간의 관류 장기 배양 후 재세포화된 심장-폐 블록을 수확합니다.
참고: 본 연구에서는 2일간의 관류 배양으로 3 × 107 HUVECs를 사용하여 탈세포화된 폐 골격을 균질하게 재혈관화하기에 충분했습니다. 3 × 107 HUVEC 미만을 사용하는 경우 재세포화의 효율성을 향상시키기 위해 더 긴 배양이 필요할 수 있습니다.
4. 생명공학적 폐의 정소성 이식
- 약물 제제
- 미다졸람(최종 농도, 4mg/kg), 메데토미딘(최종 농도, 0.75mg/kg) 및 부토르파놀 타르타르산염(최종 농도, 5mg/kg)을 임상 등급 생리식염수와 혼합하여 MMB 복합 마취제를 제조합니다.
- 헤파린 용액을 임상 등급 생리식염수(최종 농도, 1000 U/mL)와 혼합하여 제조합니다.
- 세파졸린 나트륨을 임상 등급 생리식염수(1회 용량, 30mg/kg)와 혼합하여 준비합니다.
- 수술
- 커프스의 준비
- 세 가지 유형의 혈관 카테터를 고운 사포로 가볍게 문질러 혈관이 커프된 상태를 유지할 수 있도록 합니다.
- #11 메스를 사용하여 길이 1mm 길이의 20G 테프론 혈관 카테터에서 기관지 커프를 준비합니다. 혈관 카테터를 절단하기 전에 #11 메스 뒷면을 사용하여 혈관 카테터에 움푹 들어간 곳을 만들어 10-0 나일론을 묶습니다.
- 길이 0.8mm의 22G 테플론 혈관 카테터에서 폐정맥(PV) 커프를 준비하고 길이 0.6mm의 24G 테플론 혈관 카테터에서 PA 커프를 준비합니다.
참고: 이 준비는 실험일 전에 수행할 수 있습니다.
- 생체공학적 폐에 커프 부착
- 차가운 식염수를 적신 멸균 거즈 조각에 심폐 차단을 놓고 그 아래에 건조하고 깨끗한 거즈를 하나 더 놓고 깨끗한 얼음이 채워진 스티로폼 상자에 페트리 접시를 넣습니다.
알림: 마른 거즈를 놓으면 심폐 차단이 실수로 얼어붙는 것을 방지할 수 있습니다. - 동맥류 클립을 삽입하여 기관과 거즈를 고정합니다(그림 4A). 심장에 작은 거즈 조각을 놓고 오른쪽 폐도 덮습니다. 왼쪽 폐에 다른 거즈를 놓습니다. 적신 거즈로 이 수축을 조정하여 왼쪽 문턱이 가능한 한 명확하게 보이도록 합니다.
- 선호도에 따라 직선 또는 각진 마이크로 집게를 사용하여 힐라 구조를 서로 조심스럽게 해부합니다(그림 4B). 미주신경을 따라 폐인대부터 절개를 시작한다. PV의 밑에 있는 내장 흉막을 절개하고, 하행 대동맥과 미주신경을 함께 좌측 폐 상문 뒤쪽을 통해 두개골 쪽으로 이동시킨다.
- 폐동맥에서 왼쪽 폐의 가장자리까지 왼쪽 주 PA를 절개합니다(그림 4C). 그런 다음 적절한 길이를 얻기 위해 폐 줄기 수준에서 PA를 나눕니다.
- 좌심방의 왼쪽에서 왼쪽 폐의 가장자리까지 왼쪽 PV를 해부합니다(그림 4D). 적절한 길이를 얻기 위해 왼쪽 심방 수준에서 왼쪽 PV를 나눕니다.
- 안정화 cl을 사용하여 PA 바로 위에 PA 커프를 매달아 놓습니다.amp 커프 내부에 PA를 삽입합니다(그림 4E). 팔목 위로 PA를 접음) 내피 표면을 노출시킵니다. 10-0 나일론 넥타이로 커프를 고정합니다(그림 4F). PV에 커프를 동일한 방식으로 놓습니다(그림 4G,H).
- 왼쪽 기관지를 용골 수준으로 나눕니다. 커프를 기관지에 동일한 방식으로 놓습니다(그림 4I).
- 차가운 식염수를 적신 멸균 거즈 조각에 심폐 차단을 놓고 그 아래에 건조하고 깨끗한 거즈를 하나 더 놓고 깨끗한 얼음이 채워진 스티로폼 상자에 페트리 접시를 넣습니다.
- 수신자 마우스에 대한 절차
- 27G 바늘과 MMB i.p.의 혼합물로 수혜자 마우스를 마취하고 현미경 아래에 20G 폴리우레탄 혈관 카테터를 삽입하여 삽관합니다. 수혜자 마우스를 온도 조절이 가능한 전기 워머의 오른쪽 측면 욕창 위치에 놓고 혈관테터를 인공 호흡기에 연결합니다. 인공호흡기 설정을 산소 2L/분, 호흡수 120bpm, 일회량 0.5mL로 설정합니다. 흉벽을 70% 에탄올로 살균하고 세파졸린 혼합물 s.c.를 주입합니다.
- 가위로 피부를 절개합니다. 소작기로 피하 조직과 근육을 절개합니다. 3번째 늑간 공간을 통해 가슴을 열고 흉부 견인기를 놓습니다.
참고: 개흉술은 착상을 할 수 있을 만큼 충분히 커야 하지만 다량의 출혈로 이어질 수 있는 내부 유방 동맥을 손상시키지 마십시오. - 면봉과 큰 용수철 가위로 폐 인대를 절개합니다. 투여자의 왼쪽 폐에 구부러진 동맥 세척제를 놓아 폐를 쉽게 수축시킵니다. 각진 마이크로 집게로 왼쪽 폐골 주위의 종격동 흉막을 절개합니다.
참고: 흉막을 절개하는 기초는 인간의 해부학적 폐 절제술과 유사합니다. - 종격동에서 왼쪽 폐의 가장자리까지 구부러진 미세 집게를 사용하여 기관지에서 PA를 해부합니다(그림 5A). 비슷한 방식으로 PV에서 기관지를 해부합니다.
참고: 이전 조작에서 흉막을 절개할 때 쉽게 해부를 수행할 수 있습니다(단계 4.2.3.3). - PA 바닥에 10-0 실크 슬립매듭을 놓아 닫습니다(그림 5B). PV와 기관지 기저부에 가느다란 각진 동맥류 클립을 놓습니다(그림 5C).
- 기관지, PA 및 PV에 10-0 나일론을 감고 다음 단계에서 커프스를 고정하기 위해 느슨하게 둡니다.
- 마이크로스프링 가위를 사용하여 수혜자의 왼쪽 폐 가장자리에 수혜자의 PA, 기관지 및 PV를 절개합니다(그림 5D). 직선 마이크로 집게를 사용하여 PA와 PV를 부드럽게 확장시킵니다. 1mL 주사기와 24G 혈관포장기를 사용하여 식염수로 PA 및 PV의 혈액을 제거합니다.
참고: PA, 기관지 및 PV의 절개는 약 1/3입니다. 곧은 마이크로 집게는 부드럽고 확장에 적합합니다. - 적신 거즈로 덮인 생체공학적 폐를 수혜자의 왼쪽 폐(그림 5E) 위에 이식자의 종격동에 최대한 가깝게 놓습니다.
- 도너 PA 커프를 수취인 PA에 삽입하는 단계(도 5F).
참고: 기증자 PA에 약간의 스트레칭이 있을 것입니다. PA 절개 크기가 적절하면 기증자의 커프가 빠질 가능성이 줄어듭니다. 생체공학적 폐를 종격동 가까이로 옮기는 것도 기증자의 커프가 빠지는 것을 방지할 수 있습니다. - 10-0 나일론 넥타이로 커프 주위를 고정합니다(그림 5G). 비슷한 방식으로 기증자 기관지(그림 5H)와 PV 커프(그림 5I, J)를 삽입하고 고정합니다.
- 가느다란 각도의 동맥류 클립을 분리합니다(그림 5L). 혈액이 PV 커프 너머로 역류하는 것을 관찰하고 PA의 실크 넥타이를 제거하여 생명 공학적 폐로의 전단계 혈류를 재개합니다.
- 커프스의 준비
결과
탈세포화 프로토콜에 따라 생쥐의 폐는 눈에 띄게 흰색이고 반투명합니다(그림 6A). 세포 성분은 완전히 제거되어야 하지만, 조직학적 관찰에서 폐포 구조는 그대로 유지됩니다(그림 6B,C). 2일 관류 기반 생물반응기 배양과 함께 3 × 107 HUVEC를 사용한 재세포화된 마우스 폐는 HUVEC의 균일한 분포를 보여줍니다(그림 7A). HUVEC은 말초 폐포 영역으로 이동하여 모세혈관 네트워크를 형성합니다(그림 7B). 생명공학 폐의 정소성 이식 및 재관류 후, 적혈구를 포함하는 혈류가 생명공학적 폐에서 균일하게 관찰됩니다(그림 8A, B).

그림 1: 마우스 심폐 차단의 삽관. (A) 폐동맥 카테터를 준비했습니다. (B) 캐뉼레이션의 스키마. (C) 캐뉼레이션 완료 후의 대표 이미지. 눈금 막대 = 1cm(A,C). 이 그림은 Tomiyama et al.19에서 채택한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 장기실의 준비. (A) 구멍은 설명된 대로 절단됩니다. (B) 튜빙이 표시된 대로 삽입됩니다. (C) 세포 저장소용 오토클레이브 유리 250mL 유리병용 캡 준비. (D) 자석 교반기에 놓인 250mL 유리병. 이 그림은 Tomiyama et al.19에서 채택한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 관류 기반 바이오리액터 설정. (A) 부품 및 조립. (B) 실제 설정. 튜브는 유리문과 고무 씰 사이에 삽입됩니다. (C) 펌프에 의한 관류 기관 배양 중 스냅샷. 이 그림은 Tomiyama et al.19에서 채택한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 이식을 위한 생체공학적 폐의 준비. (A) 공학적 폐의 배치. (B) hilum의 해부. (C) 메인 PA의 해부. (D) PV의 해부. (E) 커프에 PA를 삽입하는 단계. (F) PV를 커프에 고정합니다. (G) 커프에 PV를 삽입합니다. (H) PV를 커프에 고정합니다. (I) 왼쪽 기관지를 커프에 삽입 및 고정. 약어: PA = 폐동맥; PV = 폐정맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
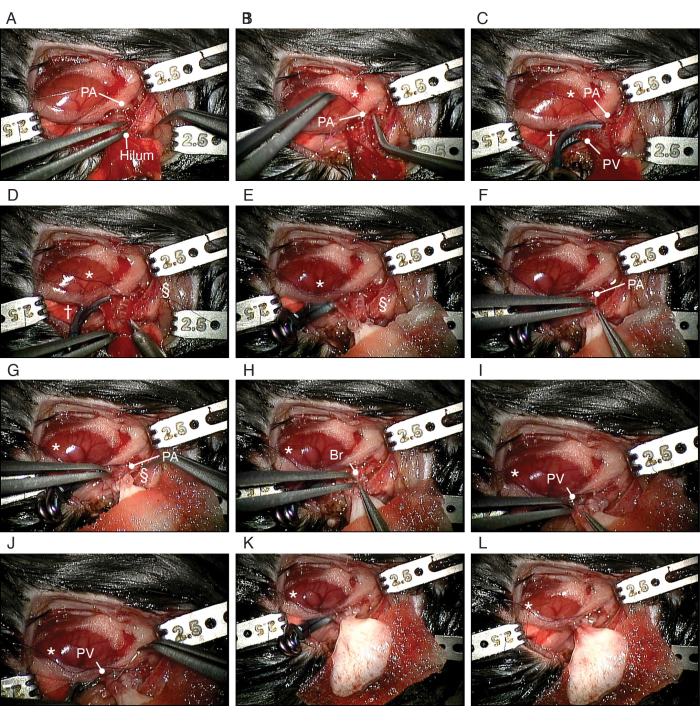
그림 5: 생명공학적 폐의 정소외 이식 절차. (A) 수혜자의 PA 해부. (B) 수신자의 PA 주위에 슬립매듭을 만드는 것. (C) PV와 기관지의 클리핑. (D) PA를 절개하는 행위. (E) 생체공학적 좌측 폐의 배치. (F) 생명공학적 폐의 커프된 PA를 수혜자의 PA에 삽입하는 단계. (G) 커프 주위에 PA를 고정합니다. (H) 생명공학적 폐의 기관지 커프를 수혜자의 기관지에 삽입하는 것. (I) 생명공학적 폐의 PV를 수혜자의 PV에 삽입하는 것. (J) 커프 주위에 PA를 고정합니다. 약어: PA = 폐동맥; PV = 폐정맥; Br = 기관지; * = 슬립매듭; † = 동맥류 클립; § = 10-0 나일론 넥타이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
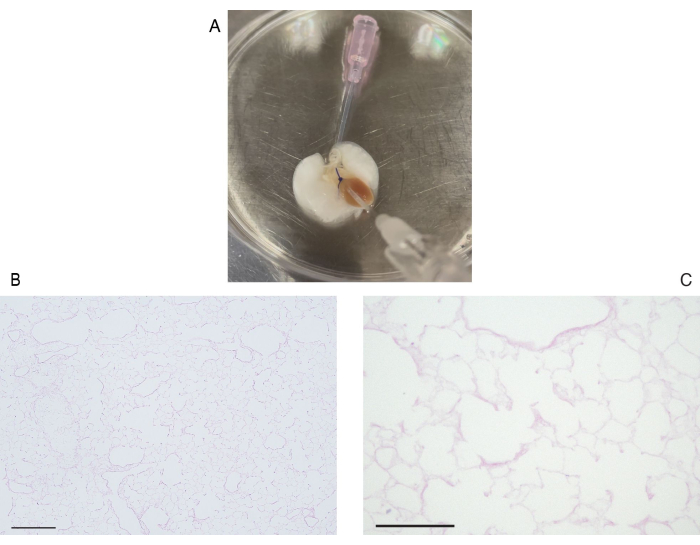
그림 6: 쥐 폐의 탈세포화. (A) 탈세포화된 폐의 거시적 이미지. (B) 탈세포화된 폐의 저배율 이미지(배율, 100배). (C) 탈세포화된 폐의 고출력 헤마톡실린 및 에오신 염색 이미지. 눈에 보이는 세포 구성 요소(배율, 400x)가 없습니다. 스케일 바 = 100μm(B), 50μm(C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: HUVEC을 사용한 혈관 재생된 마우스 폐. (A) 혈관 재생된 폐의 저전력 헤마톡실린 및 에오신 염색 이미지(배율, 200배, 타일링). (B) 혈관재생된 폐의 고출력 H&E 염색 이미지(배율, 200배). 스케일 바 = 1000μm(A), 100μm(B). 약어: HUVECs = 인간 탯줄 정맥 내피 세포; H&E = 헤마톡실린 및 에오신. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 이식 및 혈액 재관류 후의 폐 이미지. (A) 재관류 10분 후 재관화된 폐의 저전력 H&E 이미지(배율, 200배, 타일링). (B) 재관류 10분 후 혈관재생된 폐의 고출력 H&E 이미지(배율, 200배). 스케일 바 = 1000μm(A), 100μm(B). 약어: H&E = hematoxylin 및 eosin. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
장기 생명 공학은 까다로운 사업입니다. 비용이 많이 드는 심사 과정은 이 분야의 연구 개발 주기를 방해하고 있습니다. 마우스를 실험 플랫폼으로 사용함으로써 이전에 사용된 랫드 플랫폼에 비해 공간, 세포 및 배지가 크게 줄었습니다. 가스 교환, 혈관 저항 또는 폐 순응도와 같은 상세한 물리적 매개변수를 측정하는 것은 아직 이루어지지 않았지만, 마우스 폐 모델을 사용하면 실험 프로토콜의 신속한 반복과 세포 생존력, 통합 및 골격 상호 작용의 테스트를 가능하게 하므로 연구 일정을 단축할 수 있습니다. 마우스는 빠르게 번식하고 수많은 유전자 변형 균주에서 사용할 수 있어 생체 내에서 다양한 유전 및 세포 변형을 연구할 수 있는 유연성을 제공합니다. 가설을 신속하게 테스트하고 프로토콜을 최적화하는 이러한 능력은 성공적인 폐 생명 공학에 필요한 최적의 세포 환경 및 배양 기술에 대한 이해를 높이는 데 도움이 됩니다. 연구자들은 생쥐 모델의 기술을 개선함으로써 확장 가능한 방법과 프로토콜을 확립할 수 있으며, 이는 나중에 더 큰 동물 모델로 변환될 수 있으며, 궁극적으로는 인간 애플리케이션으로 변환될 수 있습니다.
절차의 중요한 단계는 PA 카테터를 삽입하고 고정하는 것입니다. PA 카테터의 고정은 끝에 칼라가 있는 작은 직경의 카테터(<3 Fr)를 사용해야만 가능합니다. 폐는 연약하기 때문에 수술은 전적으로 주의해서 시행해야 합니다. 어떤 금속 기구도 폐 표면에 닿아서는 안 됩니다. 그렇지 않으면 폐에 심각한 누출이 발생할 수 있습니다. 필요할 때 면봉을 사용하여 폐를 움직입니다. 저자는 연구자들이 10-15마리의 쥐를 사용하여 훈련한 후 캐럴 절차를 효율적으로 수행할 수 있다고 가정합니다.
여기에 기술된 탈세포화 프로토콜은 이전 보고서22,24를 기반으로 합니다. 다른 세제 세트를 사용하는 다른 프로토콜을 적용할 수 있습니다. 심폐 차단술은 항상 주의해서 다루어야 합니다. 탈세포화 절차 중 일반적인 사고에는 PA 카테터의 침투, 기관 카테터의 이탈 및 공기 누출이 포함됩니다. 저자는 PBS에서 냉장 보관 후 탈세포화된 골격의 무결성을 실험적으로 확인하지 않았습니다. 그럼에도 불구하고 저자는 최대 4주 동안 PBS에 저장된 탈세포화된 심폐 블록을 사용하는 데 문제를 겪지 않았습니다.
박테리아 오염을 피하는 것이 중요합니다. 모든 유리 장비, PVDF 및 실리콘 부품은 실험 전에 고압멸균해야 합니다. 다른 부품은 한 번만 사용해야 합니다. 박테리아 오염의 위험을 최소화하기 위해 모든 절차는 깨끗한 생물 안전 캐비닛에서 수행해야 합니다. 항생제뿐만 아니라 항생제도 매체에 항진균제를 포함하는 것이 바람직합니다. 관류 중 잦은 매체 교체는 오염 위험을 증가시킵니다. 또한 튜브에서 기포를 항상 피해야 합니다. 튜브 내의 기포는 이후 탈세포화된 골격에 갇히게 되며, 이는 주변 영역의 매체 관류를 차단하고 이질적인 세포 분포를 초래할 수 있습니다. 또한, 내피 세포는 트립신화(trypsinization) 또는 기타 적절한 세포 해리 배지에 의해 완전히 분리되어야 합니다. 세포 펠릿은 균질한 단일 세포 현탁액을 만들기 위해 잘 파괴되어야 합니다. 너무 많은 세포 밀도(예: >200만 cells/mL)는 세포 덩어리의 형성을 촉진하여 근위 혈관 구조에서 색전증을 유발할 수 있습니다.
당사는 단기간(2일 또는 3일)의 관류 생물반응기 배양만 테스트했습니다. 이전 연구에서는 탈세포화된 쥐 폐 골격을 재혈관화하기 위해 다양한 수의 내피 세포를 사용했으며, 더 많은 세포를 추가해도 세포 커버리지가 개선되지 않는 임계값이 있음을 발견했는데, 이는 마우스 폐-심장 블록 당 ~3 × 107개의 내피 세포19개였습니다. 우리는 더 긴 배양 기간(예: 14일)이 이전의 폐 생명공학 연구 9,10,15,25에서 설명한 바와 같이 재세포화된 혈관 구조의 적용 범위와 성숙을 향상시킬 것으로 기대합니다.
생체공학적 폐 이식 준비의 기초는 일반 쥐 폐 이식의 기초와 유사합니다26,27. 조작된 폐 조직은 일반 폐 이식편만큼 연약하지 않습니다. 문제는 문골 구조를 포함한 폐 조직이 완전히 하얗거나 거의 투명하다는 것입니다. 성공적인 이식을 위해서는 국소 해부학적 구조에 대한 정확한 이해가 필수적입니다. 안정된 기술은 천연 폐를 사용하여 얻어야 합니다. 저자들은 연구자들이 100마리의 쥐를 사용하여 훈련한 후 이식 절차를 편안하게 수행할 수 있을 것이라고 가정합니다.
마우스에서 인간 유래 세포를 사용하여 생명공학적 폐를 이식하는 것은 기술적으로 이용 가능합니다. 그러나 이 모델의 이종 이식 특성으로 인해 이식편에 대한 급성 거부 반응이 불가피합니다. 이 모델은 생명공학적 폐의 단기적인 재세포화 효율을 테스트하는 데 사용할 수 있으며, 장기적인 기능은 면역 결핍 마우스를 사용하여 조사해야 합니다.
현재 방법에서는 테스트되지 않았지만 내피 세포와 상피 세포를 모두 사용하는 전체 폐 생명 공학은 여기에 설명된 폐 혈관 공학의 어려움을 고려할 때 기술적으로 그다지 어렵지 않아야 합니다. 또한 이 마우스 스케일 플랫폼은 3D 배양 조건에서의 세포 상호 작용 조사, 세포-매트릭스 상호 작용, 생체 외 암 모델링 등과 같은 다른 연구 분야로 확장될 수 있습니다. 요약하면, 이 방법은 합리적이고 강력한 폐 생명공학 플랫폼을 제공합니다.
공개
저자는 이 원고와 관련하여 어떠한 이해 상충도 없습니다.
감사의 말
본 연구는 과학연구를 위한 보조금 / KAKENHI (C) #20K09174, #23K08308, TS #22KK0132 공동국제연구촉진기금(B)), 대만 JSPS KAKENHI 보조금 번호 21K08877, FT를 위한 Leave a Nest Grant Ikeda-Rika 상, FT를 위한 JSPS 펠로우를 위한 Grant-in-Aid #21J21515의 재정 지원을 받았다. 도호쿠 대학 대학원 의과대학 의생명 연구 핵심의 기술 직원인 우에다 마이코 씨의 조직학적 관찰에 대한 집중적인 연구에 감사드립니다. 또한 도호쿠 대학 IDAC의 연구 기기 센터의 Yoshida Yumi 씨와 Koji Kaji 씨의 화상 처리 지원에 대한 기술 조언에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
참고문헌
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유