Method Article
Transplantation einer biotechnologisch hergestellten Lunge unter Verwendung von dezellularisierten Mauslungen und primären humanen Endothelzellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Artikel wird beschrieben, wie biotechnologisch hergestellte Mauslungen mit Hilfe von Dezellularisierungs- und Rezellularisierungsmethoden hergestellt werden können. Es wird auch die anschließende orthotope Lungentransplantation beschrieben.
Zusammenfassung
Die Lungentransplantation ist eine wichtige Behandlung für Patienten mit Lungenerkrankungen im Endstadium wie idiopathischer Lungenfibrose, aber Herausforderungen wie Spendermangel und Komplikationen nach der Transplantation bestehen weiterhin. Eine vielversprechende Alternative stellt die biotechnologisch hergestellte Lunge dar, bei der patientenspezifische Zellen in dezellularisierte Tiergerüste integriert werden. Trotz Fortschritten bei der Verwendung biotechnologisch hergestellter Lungen in Tiermodellen sind Funktionalität und Struktur noch unausgereift. Dieses Protokoll adressiert ein kritisches Hindernis im Organ-Bioengineering: den Bedarf an einer kostengünstigen experimentellen Plattform. Durch die Verwendung von Mausmodellen anstelle von größeren Tieren wie Ratten oder Schweinen können die Forscher den Ressourcenaufwand für jedes Experiment erheblich reduzieren und so den Forschungsfortschritt beschleunigen.
Das Protokoll beschreibt ein detailliertes Verfahren für das Lungen-Bioengineering unter Verwendung von Maus-Herz-Lungen-Blöcken und menschlichen Primärzellen, wobei der Schwerpunkt auf der Isolierungsstrategie für den Herz-Lungen-Block der Maus, der Dezellularisierung, dem Aufbau von Bioreaktoren, der perfusionsbasierten Organkultur und der orthotopen Transplantation von biotechnologisch hergestellten Lungen liegt. Diese Plattform im Mausmaßstab reduziert nicht nur die experimentellen Kosten, sondern bietet auch einen praktikablen Rahmen für die Optimierung von Zelltypen und -zahlen für die Rezellularisierung, das Testen verschiedener Zelltypen mit histologischen und molekularen Methoden und die Sicherstellung des Blutflusses nach der Transplantation. Die Methode birgt das Potenzial für breite Anwendungen, einschließlich der Untersuchung von Zellinteraktionen unter dreidimensionalen Kulturbedingungen, Zell-Matrix-Wechselwirkungen und der Ex-vivo-Krebsmodellierung , wodurch das Gebiet des Organ-Bioengineering vorangebracht wird.
Einleitung
Die Lungentransplantation ist die entscheidende Heilung für Patienten mit Lungenerkrankungen im Endstadium1 wie der idiopathischen Lungenfibrose, bei denen eine medikamentöse Behandlung unwirksam ist, um die Verschlechterung der Atemfunktion zu stoppen. Jedes Jahr kommen mehr geeignete Patienten auf die Warteliste; Die Zahl der Organspenden von verstorbenen Spendern liegt jedoch hinter der steigenden Zahl der wartenden Patienten zurück 2,3. Selbst nach einer Lungentransplantation würden einige Probleme die Funktion der transplantierten Lunge beeinträchtigen, darunter Funktionsstörungen der Primärorgane, reaktives allogenes Syndrom und Infektionen, die das 5-Jahres-Überleben der Empfänger einer Lungentransplantation erheblich verringern4.
Es gibt mehrere Optionen, um den aktuellen Problemen bei der Organtransplantation entgegenzuwirken, darunter die Verwendung von marginalen Spendern5, die Gewinnung von Spenderlungen in einem ex vivo Lungenperfusionssystem6 und die Xenotransplantation mit geneditierten Schweinen7. Diese Alternativen können den Pool an Spenderorganen erweitern; Keines kann jedoch die Knappheit, Immunogenität und funktionelle Heterogenität der Spenderorgane vollständig abdecken.
Es ist weit von der Realität entfernt, aber biotechnologisch hergestellte künstliche Organe, bei denen patientenspezifische Zellen in das dezellularisierte tierische Organgerüst integriert sind, sind eine faszinierende potenzielle Quelle für die Transplantation solider Organe8. Seit 2010 wurden mehrere bahnbrechende Studien veröffentlicht, die den potenziellen Nutzen biotechnologisch hergestellter Lungen belegten 9,10. In diesen Studien wurden Lungen von Ratten oder Schweinen durch Detergenzien dezellularisiert, tierische oder menschliche Zellen wurden aus der Luftröhre oder dem Lungengefäßsystem injiziert, um das Lungengewebe im perfusionsbasierten Bioreaktor zu regenerieren, und einige von ihnen wurden orthotopisch in die tierischen Brusthöhlen transplantiert 11,12,13,14,15. Die Funktion und Struktur der biotechnologisch hergestellten Lungen waren jedoch verfrüht, vermutlich aufgrund der unzureichenden Anzahl der im Bioreaktor kultivierten Zellen oder weniger integrierter interzellulärer Verbindungen.
Ein Hindernis für das Vorantreiben der Forschung im Bereich des Organ-Bioengineerings ist das Fehlen einer kleinen experimentellen Plattform. Obwohl Ratten oder Schweine die am häufigsten verwendeten Tiere in diesem Bereich sind, benötigen sie >108 Lungenzellen proLunge 16, was für akademische Labors sehr kostspielig ist. Wenn Mäuse für die Organ-Bioengineering-Forschung zur Verfügung stehen, könnten wir die Kosten jedes Experiments drastisch senken und das Forschungsprogramm beschleunigen. Obwohl es anatomische Unterschiede zwischen der Lunge von Mäusen und Menschen gibt17, ist die grundlegende Architektur der Lunge bei allen Säugetieren ähnlich18. Daher können die Ergebnisse von Versuchen im Mausmaßstab auf größere Tiere übertragen werden, indem die Anzahl einfach entsprechend der Körpergröße multipliziert wird.
Dieses Protokoll zielt darauf ab, das detaillierte experimentelle Verfahren des Lungen-Bioengineerings unter Verwendung von Herz-Lungen-Blöcken der Maus und menschlichen Primärzellenzu beschreiben 19. Wir haben für diese Studie das zuvor berichtete und weit verbreitete Protokoll zur Dezellularisierung der Mauslungeübernommen 20,21,22. Der herausfordernde Teil des Lungenbioengineerings ist die Rezellularisierung des dezellularisierten Kapillargefäßsystems20; Daher werden in diesem Protokoll humane Endothelzellen aus Nabelschnurvenen verwendet.
Protokoll
Alle Versuche folgten den Vorschriften für Tierversuche und verwandte Aktivitäten an der Tohoku-Universität (15. Auflage), veröffentlicht von der Tohoku-Universität23. Diese Studie wurde vom Institutional Animal Care and Use Committee an der Tohoku University genehmigt (#2020AcA-041-01).
1. Vorbereitung der Materialien für die Dezellularisierung
- Herstellung von Dezellularisierungslösungen (1.000 mL Format in einer 1 L autoklavierbaren Glasflasche)
- Steriles deionisiertes (DI) Wasser: Geben Sie 1.000 mL destilliertes oder DI-Wasser in 1 l autoklavierbare Glasflaschen. 20 min bei 121 °C autoklavieren.
- Triton X-100: Geben Sie 1 ml Triton X-100 auf 1.000 ml steriles DI-Wasser in eine autoklavierbare Glasflasche im 1-l-Format. (Fakultativ) Fügen Sie 10 ml Penicillin und Streptomycin-Lösung hinzu (Endkonzentration, 500 Einheiten/ml Penicillin und 500 μg/ml Streptomycin).
HINWEIS: Nicht autoklavieren. - Natriumdesoxycholat: Geben Sie 20 g Natriumdesoxycholatpulver zu 1.000 ml sterilem DI-Wasser in einer autoklavierbaren Glasflasche im 1-l-Format. Schließen Sie den Verschluss und drehen Sie die Flasche um, um das Pulver zu lösen. (Fakultativ) Fügen Sie 10 ml Penicillin und Streptomycin-Lösung hinzu.
HINWEIS: Nicht autoklavieren. - 1 M NaCl: Geben Sie 58,44 g NaCl zu 1.000 mL destilliertem oder DI-Wasser in eine autoklavierbare Glasflasche im 1-l-Format. 20 min bei 121 °C autoklavieren.
- DNase I Stammlösung: Auf eine Konzentration von 10 mg/ml in Medium A verdünnen.
- Medium A: Bereiten Sie 5 mM CaCl2 (5 mg CaCl2 in 9 mL sterilem DI-Wasser) und eine Verdünnung von 1:10 mit sterilem DI-Wasser vor.
- DNase I-Arbeitslösung: Geben Sie 33 μl DNase I-Stammlösung zu 10 mL Medium B.
- Medium B: Bereiten Sie 10x Medium B (155 mg MgSO4 + 220 mg CaCl2 in 100 mL sterilem DI-Wasser) und 1:10 Verdünnung mit sterilem DI-Wasser vor.
- Aufbereitung der Katheter für die Pulmonalarterie (PA) und die Luftröhre (steriles Verfahren)
- Schneiden Sie den PA-Katheter (Katheter für die Halsvene der Ratte) in einer Länge von ca. 15 mm ab.
- Bewegen Sie den Kragen bis zum Ende des Katheters.
- Stecken Sie einen Katheterkonnektor in den PA-Katheter und befestigen Sie ihn an einem Injektor. Vorbereitete PA-Katheter sind in Abbildung 1A dargestellt.
- Bewahren Sie den PA-Katheter bis zur Verwendung in 70%igem Ethanol auf.
- Schneiden Sie den 20 G i.v. Katheter in einer Länge von ca. 15 mm ab. Dieser wird für einen Trachealkatheter verwendet.
- Mauschirurgie zur Entnahme eines Herz-Lungen-Blocks
- Eine männliche Maus (C57BL/6, Gewicht > 28 g) mit einer Überdosis Kohlendioxid oder Isofluran einschläfern.
- Legen Sie die Maus in Rückenlage auf einen Operationstisch und fixieren Sie die Gliedmaßen. Sterilisieren, indem Sie 70% Ethanol auf die Oberfläche der Brust und des Bauches sprühen.
- Öffnen Sie die Bauchhöhle in der Mittellinie zum Hals mit einer Edelstahlschere und spalten Sie das Brustbein mit der Schere. Trennen Sie das Zwerchfell von der Brustwand, schneiden Sie die ventrale Brustwand, um die Brusthöhlen vollständig freizulegen, und entfernen Sie den Thymus. Lilizieren Sie die untere Hohlvene und die rechte obere Hohlvene mit einer 4-0-Seide, um das Aufstoßen von PBS in Schritt 1.3.5 zu verhindern und dadurch die Auswaschung des Blutes im Lungengefäßsystem zu verbessern.
- Schneiden Sie die Bauchschlagader mit einer Edelstahlschere zur Drainage ab. Wenn die Bauchschlagader nicht erkennbar ist, schneiden Sie die untere Hohlvene und die Bauchschlagader ganz ab.
- Injizieren Sie 3 ml steriles PBS aus dem rechten Ventrikel mit einer sterilen 5-ml-Spritze mit einer 27-g-Nadel, indem Sie die rechte Ventrikelwand punktieren.
- Schlingen Sie die Haupt-PA mit einer 4-0 Seide unter Verwendung einer Dumont-Pinzette.
HINWEIS: Die Haupt-PA und die aufsteigende Aorta können miteinander verschlungen werden. - Öffnen Sie ein 2 mm Fenster unter den PA-Ventilen, indem Sie die rechte Ventrikelwand mit einer Federschere durchschneiden.
- Führen Sie den PA-Katheter durch das Fenster ein und befestigen Sie die zuvor geschlungene 4-0-Seide (Abbildung 1B).
HINWEIS: Vermeiden Sie es, die PA während dieses Vorgangs zu berühren, da dies die PA-Wand beschädigen könnte. Die Haupt-PA und die aufsteigende Aorta können zusammen ligiert und gesichert werden. - Injizieren Sie 2 ml PBS langsam durch den PA-Katheter mit einer sterilen 5-ml-Spritze. Stellen Sie sicher, dass sich beide Lungen leicht ausdehnen, während das PBS injiziert wird.
- Kanülieren Sie die Luftröhre mit einem Trachealkatheter und binden Sie sie mit einer 4-0-Seidennaht fest (Abbildung 1C).
- Injizieren Sie 2 ml Luft langsam durch den Trachealkatheter mit einer leeren sterilen 5-ml-Spritze und halten Sie sie 10 s lang. Stellen Sie sicher, dass keine Luft aus der Lunge austritt.
- Herz und Lunge en bloc entfernen. Fassen Sie die Luftröhre mit der Dumont-Pinzette und dem Trachealkatheter darin, schneiden Sie die zervikale Speiseröhre auf und präparieren Sie sie von den Wirbeln. Schneiden Sie die beidseitigen Venen und Arterien subclavia durch. Zum Schluss schneiden Sie die Speiseröhre und die Hohlvene auf Höhe des Zwerchfells.
HINWEIS: Berühren Sie die Lungenoberfläche nicht mit Instrumenten. Jede leichte Berührung kann zu Luftleckagen führen.
- Dezellularisierung der Lunge der Maus (3-tägiger Eingriff)
HINWEIS: Alle Verfahren in Abschnitt 1.4 sollten in einer sauberen Biosicherheitswerkbank durchgeführt werden.- Tag 1
- Den resezierten Herz-Lungen-Block in eine Petrischale aus Kunststoff mit einem Durchmesser von 10 cm geben und die Herz-Lungen-Blöcke 1 h lang bei 4 °C in sterilem DI-Wasser inkubieren.
- Injizieren Sie 2 mL steriles DI-Wasser durch den Luftröhrenkatheter, 3x und 2 mL steriles Wasser durch den PA-Katheter mit einer 5 mL sterilen Spritze. Nach jeder Injektion ist eine Pause einzulegen, damit die Flüssigkeit austreten kann, wenn die Lunge zurückweicht (Abbildung 1C).
HINWEIS: Injizieren Sie Wasser mit einer Geschwindigkeit von ca. 0,5 ml/s. - Injizieren Sie 2 ml 0,1% ige Triton X-100 Lösung in den Trachealkatheter und 2 ml in den PA-Katheter.
- Legen Sie den Herz-Lungen-Block in die Petrischale und inkubieren Sie ihn über Nacht bei 4 °C statisch in Triton X-100-Lösung.
- Tag 2
- Die Triton X-100-Lösung mit sterilem DI-Wasser aus der Lunge entfernen, wie in Schritt 1.4.1.2 beschrieben.
- Injizieren Sie 2 ml 2%ige Natriumdesoxycholatlösung in den Trachealkatheter und 2 ml in den PA-Katheter. In Desoxycholatlösung 24 h bei 4 °C inkubieren.
- Tag 3
- Die Natriumdesoxycholatlösung wird mit sterilem DI-Wasser aus der Lunge entfernt, wie in Schritt 1.4.1.2 beschrieben.
- Injizieren Sie 2 ml 1 M NaCl-Lösung in den Trachealkatheter und 2 ml in den PA-Katheter. Inkubieren Sie in NaCl-Lösung für 1 h bei RT.
- Aus der NaCl-Lösung mit sterilem DI-Wasser wie in Schritt 1.4.1.2 beschrieben entfernen.
- Injizieren Sie 2 ml DNAse I Arbeitslösung in den Trachealkatheter und 2 ml in den PA-Katheter. Inkubieren Sie in DNase-Arbeitslösung für 1 h bei RT.
- Die DNase-Lösung wie in Schritt 1.4.1.2 beschrieben aus der Lunge entfernen, jedoch mit sterilem PBS. Vergewissern Sie sich, dass die Lunge nach der Dezellularisierung am Rand weiß und transparent ist.
HINWEIS: Mit fortschreitendem Dezellularisierungsverfahren wird die Lunge immer fragiler. Gehen Sie immer vorsichtig mit dem Herz-Lungen-Block um und vermeiden Sie es, die Lungenoberfläche zu berühren. Nach der Dezellularisation können die Herz-Lungen-Blöcke bis zu 3 Wochen in PBS/Antibiotika bei 4 °C gelagert werden.
- Tag 1
2. Kultur menschlicher Primärzellen
- Mischen Sie das Endothelzellwachstumsmedium-2 (EGM2) und das Bullet Kit mit fötalem Rinderserum (Endkonzentration, 2%), Hydrocortison (Endkonzentration, 0,2 μg/ml), humanem basischem Fibroblasten-Wachstumsfaktor (Endkonzentration, 4 ng/ml), vaskulärem endothelialem Wachstumsfaktor (2 ng/ml), R3-insulinähnlichem Wachstumsfaktor-1 (Endkonzentration, 5 ng/ml), Ascorbinsäure (Endkonzentration, 75 μg/ml), humanem epidermalem Wachstumsfaktor (Endkonzentration, 10 ng/ml), Gentamicin/Amphotericin-1000 (Endkonzentration, Gentamicin: 30 μg/ml, Amphotericin: 15 ng/ml) und Heparin (Endkonzentration, 1 ng/ml).
- 2 × 106 Endothelzellen (HUVECs) der menschlichen Nabelschnurvenen-Endothelzellen (HUVECs) in gefrorenen Fläschchen in einem Wasserbad bei 37 °C auftauen.
- Mischen Sie die Zellen mit EGM2 in einem konischen 15-ml-Röhrchen und zentrifugieren Sie sie 5 Minuten lang bei 500 × g .
- Zählen Sie die Zellen und subkultivieren Sie sie bei einer geeigneten Zelldichte (empfohlen werden 2,0 x 10,4 Zellen/cm2 ). Beginnen Sie mit Platten im 6-Well-Format und wechseln Sie dann zu T75-Kolben.
- Lassen Sie die Zellen passieren, bis die erforderliche Anzahl von Zellen erreicht ist.
HINWEIS: Für eine vollständige Abdeckung der Lungengefäße mit HUVECs sind 3 × 107 HUVECs erforderlich19.
3. Aufbau des Bioreaktors und Perfusionsorgankultur
- Vorbereitung einer Organkammer und eines Zellreservoirs
- Schneiden Sie mit einem Korkbohrer Löcher in einen Silikonstopfen, wie in Abbildung 2A gezeigt. Die Lochgrößen betragen 5 mm (i, ii und iii) und 7 mm (iv und v). Jede Bohrungsnummer (i-v) in Abbildung 2A entspricht den Bohrungsnummern in Abbildung 2B.
- Führen Sie den Pumpenschlauch durch den Silikonstopfen, wie in Abbildung 2B gezeigt.
- Schneiden Sie mit einem Korkbohrer ein 5 mm großes Loch in ein Silikonseptum eines oben offenen Schraubverschlusses. Führen Sie einen platingehärteten L/S 14-Schlauch in das Loch ein (Abbildung 2B,C).
- Autoklavieren Sie die oben genannten Materialien, einschließlich des Silikonstopfens mit Schlauch, des Glasbehälters, des GL-45-Schraubverschlusses mit Schlauch, einer autoklavierbaren 250-ml-Glasflasche und eines L/S 14-Schlauchs mit Köderanschlüssen (Schlauch B und Schlauch C in Abbildung 3A) für 20 Minuten bei 121 °C. Wählen Sie die richtigen Köderanschlüsse aus, um sicherzustellen, dass die Schläuche B und C eine Schlaufe bilden.
HINWEIS: Der Glaskanister wird für eine Organkammer und die 250-ml-Glasflasche für ein Zellreservoir verwendet.
- Montage eines perfusionsbasierten Bioreaktorkreislaufs
HINWEIS: Die folgenden Verfahren sollten auf einer sauberen Werkbank durchgeführt werden.- Geben Sie 70 ml Nährmedium in den Glasbehälter und setzen Sie dann den Silikonstopfen auf den Glasbehälter.
- Montieren Sie einen Silikonstopfen, einen Glaskanister, einen GL-45-Schraubverschluss mit Schlauch, eine autoklavierbare 250-ml-Glasflasche und einen L/S 14-Schlauch mit Köderanschlüssen unter Verwendung von Dreiwege-Absperrhähnen, wie in Abbildung 3A beschrieben. Führen Sie eine 20 G Nadel in ein Silikonseptum eines GL-45 Schraubverschlusses ein.
- Füllen Sie das Medium in die Schläuche A, B und C mit einer 10-ml-Spritze, die an die Absperrhähne i) und iii) angeschlossen ist (~3-5 mL Medium werden benötigt, um 1 m Schlauch zu füllen). Wiederholen Sie die Injektion und Entnahme des Mediums mit einer 10-ml-Spritze durch einen Dreiwege-Absperrhahn, um sicherzustellen, dass sich keine Luftblase im Schlauch befindet.
- Befestigen Sie den PA-Katheter des dezellularisierten Herz-Lungen-Blocks über einen Köderanschluss, der mit Schlauch C verbunden ist. Vermeiden Sie Luftblasen im Katheter oder im Schlauch.
- Ernte und resuspendieren Sie HUVECs bei einer Dichte von 0,5-1 × 106 Zellen/ml in EGM2. Geben Sie die Zellsuspension aus Schritt 2.5 in das Zellreservoir.
HINWEIS: Die Zellsuspension wird vorzugsweise zwischen den Schritten 3.2.4 und 3.2.5 hergestellt. Legen Sie einen Rührstab in das Zellreservoir.
- Schwerkraftgetriebene Injektion von Endothelzellen
- Legen Sie das Zellreservoir mit den HUVECs auf einen Magnetrührer. Stellen Sie sicher, dass sich der Boden des Zellreservoirs 30 cm über der Organkammer befindet (Abbildung 2D und Abbildung 3A).
- Schalten Sie den Magnetrührer mit einer Drehzahl von ca. 120 U/min ein.
- Öffnen Sie den Absperrhahn i) und ii), so dass die Zellsuspension über Tubing A, Tubing C und den PA-Katheter in das dezellularisierte Gerüst injiziert werden kann.
HINWEIS: Bei der Injektion von 3 × 107 Zellen mit einer Zelldichte von 1 × 106 Zellen/ml sollte das Volumen der Zellsuspension 30 ml betragen. Eine typische Injektionsrate beträgt 1-2 ml/min. - Nachdem Sie die Zellsuspension vollständig injiziert haben, lösen Sie Schlauch A vom Absperrhahn ii).
HINWEIS: In diesem Schritt kann eine Zellzählung durchgeführt werden, um die Zellretentionrate im dezellularisierten Gerüst zu messen. Die typische Zellretentionsrate beträgt 80-90%, unabhängig von der Anzahl der injiziertenZellen 19.
Die Qualität des dezellularisierten Lungengerüsts bestimmt streng die Zellretentionsrate. Jede Leckage aus der dezellularisierten Lunge (z. B. aus der Haupt-PA, Lungenoberfläche) führt zu einer geringeren Zellretentionsrate. Stellen Sie sicher, dass es keine offensichtliche Leckage aus der dezellularisierten Lunge gibt, indem Sie 2-3 ml Nährmedien mit einer sterilen Spritze injizieren, die mit einem der Absperrhähne im perfusionsbasierten Bioreaktor verbunden ist, und bestätigen Sie, dass sich die dezellularisierte Lunge bei der Injektion des Mediums leicht ausdehnt.
- Kultur von Perfusionsorganen
- Stellen Sie die Organkammer in einen CO2 -Inkubator.
- Befestigen Sie den Schlauch B an einem Pumpenkopf, der mit einer pulsierenden Pumpe verbunden ist.
- Schließen Sie die Glastür des CO2 -Inkubators. Stellen Sie sicher, dass der Schlauch richtig zwischen der Glastür und der Gummidichtung platziert ist (Abbildung 3B).
- Inkubieren Sie das dezellularisierte Gerüst 3 h lang bei 37 °C, damit sich die injizierten Endothelzellen im Gerüst ansiedeln können.
HINWEIS: Stellen Sie sicher, dass die pulsierende Pumpe zwischen den Schritten 3.4.1 und 3.4.4 immer ausgeschaltet ist. - Starten Sie die Pumpe mit einer Geschwindigkeit von 6 U/min, was zu einer Medienperfusion von 2 mL/min mit einem L/S 14-Schlauch führt. Beobachten Sie, wie die dezellularisierte Lunge mit der Medienperfusion leicht erweitert wird.
- Schließen Sie die Inkubatortür (Abbildung 3C).
- Führen Sie den Medienwechsel über den Absperrhahn iii) durch. Wechseln Sie die Hälfte des Mediums alle 2 bis 3 Tage.
- Stoppen Sie den Pumpenantrieb, befestigen Sie eine sterile 50-mL-Spritze am Absperrhahn iii) und entnehmen Sie 50 mL des Mediums aus der Kammer.
- Füllen Sie eine weitere sterile 50-mL-Spritze mit 50 mL vorgewärmtem Medium und überführen Sie das Medium über den Absperrhahn in die Kammer (III). Schalten Sie den Absperrhahn entsprechend und starten Sie dann die pulsierende Pumpe.
- Entnehmen Sie den rezellularisierten Herz-Lungen-Block nach mindestens 2 Tagen Perfusionsorgankultur.
HINWEIS: In unserer Studie reichten 2 Tage Perfusionskultur aus, um das dezellularisierte Lungengerüst mit 3 × 107 HUVECs homogen zu revaskularisieren. Bei Verwendung von weniger als 3 × 107 HUVECs könnte eine längere Inkubation erforderlich sein, um die Effizienz der Rezellularisierung zu verbessern.
4. Orthotope Transplantation der biotechnologisch hergestellten Lunge
- Zubereitung von Medikamenten
- Bereiten Sie das MMB-Kombinationsanästhetikum vor, indem Sie Midazolam (Endkonzentration, 4 mg/kg), Medetomidin (Endkonzentration, 0,75 mg/kg) und Butorphanoltartrat (Endkonzentration, 5 mg/kg) mit normaler Kochsalzlösung in klinischer Qualität mischen.
- Bereiten Sie die Heparinlösung vor, indem Sie sie mit normaler Kochsalzlösung in klinischer Qualität (Endkonzentration, 1000 U/ml) mischen.
- Bereiten Sie Cefazolin-Natrium vor, indem Sie es mit normaler Kochsalzlösung in klinischer Qualität (eine Dosis, 30 mg/kg) mischen.
- Chirurgischer Eingriff
- Vorbereitung der Manschetten
- Reiben Sie die drei Arten von Angiokathetern leicht mit feinem Schleifpapier ab, damit die Gefäße leicht gefesselt bleiben.
- Bereiten Sie eine Bronchialmanschette aus einem 20 g Teflon-Angiokatheter mit einer Länge von 1 mm mit einem Skalpell #11 vor. Bevor du den Angiokatheter durchtrennst, mache mit der Rückseite des Skalpells #11 eine Vertiefung im Angiokatheter, um das 10-0 Nylon abzubinden.
- Bereiten Sie die Lungenvenenmanschette (PV) aus einem 22 g Teflon-Angiokatheter mit einer Länge von 0,8 mm und die PA-Manschette aus einem 24 g Teflon-Angiokatheter mit einer Länge von 0,6 mm vor.
HINWEIS: Diese Vorbereitung kann vor dem Tag des Versuchs erfolgen.
- Befestigung der Manschette an der biotechnologisch hergestellten Lunge
- Legen Sie den Herz-Lungen-Block auf ein Stück sterile Gaze, das mit kalter Kochsalzlösung angefeuchtet ist, legen Sie ein weiteres Stück trockene, saubere Gaze darunter und stellen Sie eine Petrischale in eine mit sauberem Eis gefüllte Styropordose.
HINWEIS: Das Platzieren der trockenen Gaze verhindert, dass der Herz-Lungen-Block versehentlich einfriert. - Legen Sie einen Aneurysmaclip an, um die Luftröhre und die Gaze zu sichern (Abbildung 4A). Lege ein kleines Stück Gaze auf das Herz und bedecke damit auch die rechte Lunge. Legen Sie eine weitere Gaze auf die linke Lunge. Passen Sie diesen Rückzug mit der angefeuchteten Gaze an, um den linken Hilum so deutlich wie möglich freizulegen.
- Trennen Sie die hilaren Strukturen je nach Vorliebe vorsichtig mit einer geraden oder abgewinkelten Mikrozange voneinander (Abbildung 4B). Beginnen Sie mit der Präparierung des Lungenbandes entlang des Vagusnervs. Schneiden Sie die viszerale Pleura unter dem PV ein und bewegen Sie die absteigende Aorta und den Vagusnerv zusammen durch die Rückseite des linken Lungenhilums zur kranialen Seite.
- Präparieren Sie die linke Haupt-PA vom Lungenstamm bis zum äußersten Rand der linken Lunge (Abbildung 4C). Teilen Sie dann den PA auf Höhe des Lungenstamms, um eine ausreichende Länge zu erhalten.
- Präparieren Sie das linke PV von der linken Seite des linken Vorhofs bis zum äußersten Rand der linken Lunge (Abbildung 4D). Teilen Sie den linken PV auf Höhe des linken Vorhofs, um eine ausreichende Länge zu erhalten.
- Hängen Sie die PA-Manschette mit der Stabilisierungsklemme knapp über der PA auf und führen Sie die PA in die Manschette ein (Abbildung 4E). Falten Sie das PA über die Manschette) und legen Sie die Endotheloberfläche frei. Befestigen Sie die Manschette mit einem 10-0-Nylonbinder (Abbildung 4F). Platzieren Sie die Manschette auf identische Weise auf dem PV (Abbildung 4G,H).
- Den linken Bronchus auf Höhe der Carina teilen. Legen Sie die Manschette auf die gleiche Weise auf den Bronchus (Abbildung 4I).
- Legen Sie den Herz-Lungen-Block auf ein Stück sterile Gaze, das mit kalter Kochsalzlösung angefeuchtet ist, legen Sie ein weiteres Stück trockene, saubere Gaze darunter und stellen Sie eine Petrischale in eine mit sauberem Eis gefüllte Styropordose.
- Vorgehensweise für die Empfängermaus
- Die Empfängermaus wird mit einer Mischung aus MMB i.p. mit einer 27 G Nadel betäubt und durch Einführen eines 20 G Polyurethan-Angiokatheters unter dem Mikroskop intubiert. Legen Sie die Empfängermaus auf einen temperaturverstellbaren elektrischen Wärmer in der richtigen seitlichen Dekubitusposition und verbinden Sie den Angiochatheter mit dem Beatmungsgerät. Stellen Sie die Einstellung des Beatmungsgeräts wie folgt ein: Sauerstoff 2 l/min, Atemfrequenz 120 Schläge pro Minute, Atemzugvolumen 0,5 ml. Sterilisieren Sie die Brustwand mit 70% Ethanol und injizieren Sie das Cephazolin-Gemisch s.c.
- Mit einer Schere in die Haut einschneiden. Schneiden Sie das Unterhautgewebe und die Muskeln mit einem Kauter. Öffnen Sie die Brust durch den 3. Interkostalraum und platzieren Sie die Brustretraktoren.
HINWEIS: Obwohl die Thorakotomie groß genug für die Implantation sein muss, verletzen Sie nicht die innere Brustarterie, da dies zu massiven Blutungen führen kann. - Präparieren Sie das Lungenband mit einem Wattestäbchen und einer großen Federschere. Legen Sie einen gebogenen arteriellen Reiniger auf die linke Lunge des Empfängers, um die Lunge leicht zurückzuziehen. Präparieren Sie mit einer abgewinkelten Mikrozange das mediastinale Pleura um den linken Lungenhilus.
HINWEIS: Die Grundlage der Präparierung der Pleura ist ähnlich wie bei der anatomischen Lungenresektion eines Menschen. - Präparieren Sie das PA aus dem Bronchus mit einer gekrümmten Mikrozange vom Mediastinum bis zum äußersten Rand der linken Lunge (Abbildung 5A). Präparieren Sie den Bronchus von PV auf ähnliche Weise.
HINWEIS: Die Dissektion kann leicht durchgeführt werden, wenn die Pleura beim vorherigen Manöver (Schritt 4.2.3.3) präpariert wird. - Legen Sie einen Slipknot aus 10-0 Seide an die Basis des PA, um ihn zu verschließen (Abbildung 5B). Platzieren Sie einen schlanken, abgewinkelten Aneurysmaclip an der Basis des PV und des Bronchus (Abbildung 5C).
- Schlingen Sie 10-0 Nylon um den Bronchus, PA und PV und lassen Sie die Manschetten in den folgenden Schritten locker, um sie zu sichern.
- Schneiden Sie die PA, den Bronchus und den PV des Empfängers am Rand der linken Lunge des Empfängers mit einer Mikrofederschere an (Abbildung 5D). Erweitern Sie PA und PV vorsichtig mit einer geraden Mikrozange. Entfernen Sie das Blut in der PA und PV mit Kochsalzlösung mit einer 1-ml-Spritze und einem 24-G-Angiokathater.
HINWEIS: Die Schnitte von PA, Bronchus und PV betragen etwa ein Drittel des Umwegs. Die gerade Mikropinzette ist schonend und zur Dilatation geeignet. - Platzieren Sie die biotechnologisch hergestellte Lunge, die mit angefeuchteter Gaze bedeckt ist, auf der linken Lunge des Empfängers (Abbildung 5E), so nah wie möglich am Mediastinum des Empfängers.
- Einführen der Spender-PA-Manschette in die PA des Empfängers (Abbildung 5F).
HINWEIS: Die PA des Spenders wird sich etwas dehnen. Wenn die PA-Schnittgröße angemessen ist, ist es weniger wahrscheinlich, dass die Manschette des Spenders verschoben wird. Wenn Sie die biotechnologisch hergestellte Lunge in die Nähe des Mediastinums bewegen, wird auch verhindert, dass sich die Manschette des Spenders löst. - Befestigen Sie die Manschette mit einem 10-0-Nylonband (Abbildung 5G). Führen Sie auf ähnliche Weise den Spenderbronchus (Abbildung 5H) und die PV-Manschetten (Abbildung 5I,J) ein und befestigen Sie sie.
- Entfernen Sie den schlanken Aneurysmaclip (Abbildung 5L). Beobachten Sie, dass das Blut über die PV-Manschette hinaus zurückfließt, und entfernen Sie die Seidenkrawatte an der PA, um den antegraden Blutfluss zur biotechnologisch hergestellten Lunge wieder aufzunehmen.
- Vorbereitung der Manschetten
Ergebnisse
Nach dem Dezellularisierungsprotokoll sind die Lungen von Mäusen sichtbar weiß und durchscheinend (Abbildung 6A). Zelluläre Bestandteile sollten vollständig entfernt werden, aber die Alveolarstruktur bleibt in der histologischen Betrachtung intakt (Abbildung 6B,C). Rezellularisierte Mauslungen mit 3 × 107 HUVECs mit 2-tägiger perfusionsbasierter Bioreaktorkultur zeigen eine homogene Verteilung der HUVECs (Abbildung 7A). HUVECs wandern in den peripheren Alveolarbereich und bilden ein Kapillarnetzwerk (Abbildung 7B). Nach der orthotopen Transplantation und Reperfusion der biotechnologisch hergestellten Lunge wird der Blutfluss mit roten Blutkörperchen in der biotechnologisch hergestellten Lunge homogen beobachtet (Abbildung 8A,B).

Abbildung 1: Kanülierung des Herz-Lungen-Blocks der Maus. (A) Vorbereitete Pulmonalarterienkatheter. (B) Schema der Kanülierung. (C) Repräsentatives Bild nach Abschluss der Kanülierung. Maßstabsleisten = 1 cm (A,C). Diese Zahl wurde von Tomiyama et al.19 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Vorbereitung der Organkammer. (A) Die Löcher werden wie beschrieben geschnitten. (B) Der Schlauch wird wie angegeben eingeführt. (C) Vorbereitung der Kappe für eine autoklavierbare Glasflasche mit 250 ml Glas für das Zellreservoir. (D) Die 250-ml-Glasflasche, die auf den Magnetrührer gestellt wird. Diese Zahl wurde von Tomiyama et al.19 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Aufbau eines perfusionsbasierten Bioreaktors. (A) Teile und Montage. (B) Tatsächliche Einrichtung. Beachten Sie, dass der Schlauch zwischen einer Glastür und einer Gummidichtung eingeführt wird. (C) Eine Momentaufnahme während der pumpengetriebenen Perfusionsorgankultur. Diese Zahl wurde von Tomiyama et al.19 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Vorbereitung der biotechnologisch hergestellten Lunge für die Transplantation. (A) Platzierung der manipulierten Lunge. (B) Sektion des Hilums. (C) Zerlegung der HauptPA. (D) Zerlegung des PV. (E) Einführen des PA in die Manschette. (F) Fixierung des PV an der Manschette. (G) Einführen des PV in die Manschette. (H) Fixierung des PV an der Manschette. (I) Einsetzen und Fixieren des linken Bronchus an der Manschette. Abkürzungen: PA = Lungenarterie; PV = Lungenvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
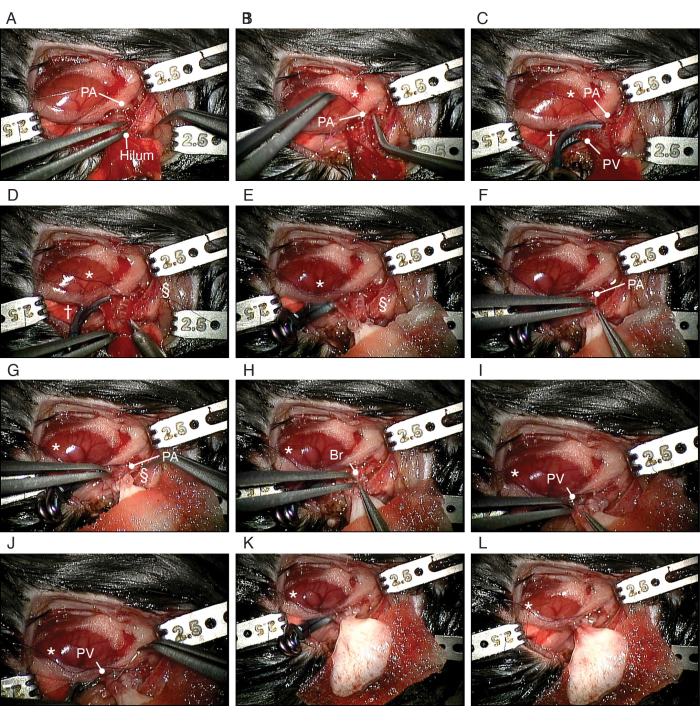
Abbildung 5: Ablauf der orthotopen Transplantation der biotechnologisch hergestellten Lunge. (A) Dissektion der PA des Empfängers. (B) Machen eines Spitzknotens um die PA des Empfängers. (C) Abschneiden des PV und des Bronchus. (D) Einschneiden der PA. (E) Platzierung der biotechnologisch hergestellten linken Lunge. (F) Einführen des mit Cuff versehenen PA der biotechnologisch hergestellten Lunge in das PA des Empfängers. (G) Befestigen Sie das PA um die Manschette. (H) Einführung der Bronchialmanschette der biotechnologisch hergestellten Lunge in den Bronchus des Empfängers. (I) Einsetzen der PV der biotechnologisch hergestellten Lunge in die PV des Empfängers. (J) Befestigen Sie die PA um die Manschette. Abkürzungen: PA = Lungenarterie; PV = Lungenvene; Br = Bronchus; * = Spitzknoten; † = Aneurysma-Clip; § = 10-0 Nylon-Krawatte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
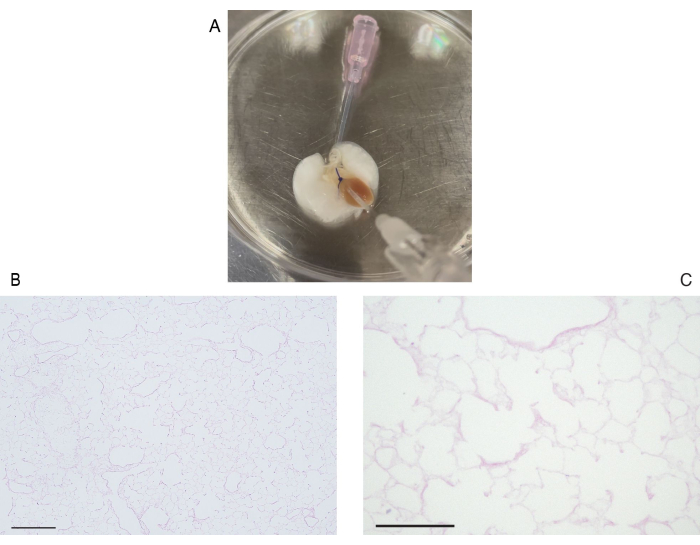
Abbildung 6: Dezellularisierung der Lunge der Maus. (A) Makroskopische Aufnahme der dezellularisierten Lunge. (B) Bild der dezellularisierten Lunge mit geringer Vergrößerung (Vergrößerung, 100x). (C) Hochleistungs-Hämatoxylin- und Eosin-gefärbtes Bild der dezellularisierten Lunge. Beachten Sie, dass es keine sichtbare zelluläre Komponente gibt (Vergrößerung, 400x). Maßstabsleisten = 100 μm (B), 50 μm (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Revaskularisierte Mauslunge mit HUVECs. (A) Hämatoxylin- und Eosin-gefärbtes Bild der revaskularisierten Lunge mit geringer Leistung (Vergrößerung, 200x, Kachelung). (B) Hochleistungs-H&E-gefärbtes Bild der revaskularisierten Lunge (Vergrößerung, 200x). Maßstabsleisten = 1000 μm (A), 100 μm (B). Abkürzungen: HUVECs = humane Nabelschnurvenen-Endothelzellen; H&E = Hämatoxylin und Eosin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Lungenbild nach Transplantation und Blutreperfusion. (A) H&E-Bild der revaskularisierten Lunge mit geringer Leistung nach 10 min Reperfusion (Vergrößerung, 200x, Kachelung). (B) Hochleistungs-H&E-Bild der revaskularisierten Lunge nach 10 min Reperfusion (Vergrößerung, 200x). Maßstabsleisten = 1000 μm (A), 100 μm (B). Abkürzung: H&E = Hämatoxylin und Eosin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das Bioengineering der Organe ist ein anspruchsvolles Unterfangen. Das kostspielige Screening-Verfahren hat den Forschungs- und Entwicklungszyklus in diesem Bereich behindert. Durch die Verwendung von Mäusen als experimentelle Plattform werden Platz, Zellen und Medien im Vergleich zur bisher verwendeten Rattenplattform erheblich reduziert. Obwohl die Messung detaillierter physikalischer Parameter wie Gasaustausch, Gefäßwiderstand oder Lungencompliance noch nicht erreicht wurde, ermöglicht das Mauslungenmodell eine Beschleunigung der Forschungszeitpläne, da es eine schnelle Iteration von experimentellen Protokollen und Tests der Zellviabilität, Integration und Gerüstinteraktion ermöglicht. Mäuse vermehren sich schnell und sind in zahlreichen gentechnisch veränderten Stämmen erhältlich, was Flexibilität bei der Untersuchung verschiedener genetischer und zellulärer Veränderungen in vivo bietet. Diese Fähigkeit, Hypothesen schnell zu testen und Protokolle zu optimieren, trägt dazu bei, unser Verständnis der optimalen zellulären Umgebungen und Kulturtechniken zu verbessern, die für ein erfolgreiches Lungenbioengineering erforderlich sind. Durch die Verfeinerung von Techniken in Mausmodellen können Forscher skalierbare Methoden und Protokolle etablieren, die später auf größere Tiermodelle und schließlich auf menschliche Anwendungen übertragen werden können.
Der kritische Schritt des Eingriffs ist das Einführen und Fixieren eines PA-Katheters. Die Fixierung des PA-Katheters ist nur durch die Verwendung eines Katheters mit kleinem Durchmesser (<3 Fr) mit einem Kragen an der Spitze möglich. Aufgrund der Zerbrechlichkeit der Lunge sollte eine Operation mit Vorsicht durchgeführt werden. Es dürfen keine Metallinstrumente die Lungenoberfläche berühren; Andernfalls würde die Lunge erheblich auslaufen. Verwenden Sie bei Bedarf ein Wattestäbchen, um die Lunge zu manövrieren. Die Autoren gehen davon aus, dass die Forscher das Kanulationsverfahren nach dem Training mit 10-15 Mäusen effizient durchführen könnten.
Das hier beschriebene Dezellularisierungsprotokoll basiert auf früheren Berichten 22,24. Andere Protokolle mit anderen Waschmittelsets können anwendbar sein. Der Herz-Lungen-Block sollte immer mit Vorsicht behandelt werden. Typische Vorfälle während des Dezellularisierungsverfahrens sind das Eindringen des PA-Katheters, das Herauslösen des Trachealkatheters und das Austreten von Luft. Die Autoren haben die Integrität des dezellularisierten Gerüsts nach gekühlter Lagerung in PBS nicht experimentell bestätigt. Dennoch haben die Autoren keine Probleme mit dezellularisierten Herz-Lungen-Blöcken gehabt, die bis zu 4 Wochen lang in PBS gelagert wurden.
Die Vermeidung von bakterieller Kontamination ist entscheidend. Alle Glasgeräte, PVDF- und Silikonteile müssen vor dem Experiment autoklaviert werden. Die anderen Teile sollten nur einmal verwendet werden. Um das Risiko einer bakteriellen Kontamination zu minimieren, sollten alle Eingriffe in einer sauberen Biosicherheitswerkbank durchgeführt werden. Es ist wünschenswert, sowohl Antimykotika als auch Antibiotika in die Medien aufzunehmen. Häufige Medienwechsel während der Perfusion erhöhen das Risiko einer Kontamination. Außerdem müssen Luftblasen in den Schläuchen immer vermieden werden. Luftblasen in den Schläuchen werden anschließend im dezellularisierten Gerüst eingeschlossen, was die Medienperfusion im peripheren Bereich blockieren und zu einer heterogenen Zellverteilung führen könnte. Darüber hinaus sollten Endothelzellen durch Trypsinisierung oder andere geeignete Zelldissoziationsmedien gründlich abgetrennt werden. Zellpellets sollten gut aufgebrochen werden, um eine homogene einzellige Suspension zu erhalten. Eine zu hohe Zelldichte (z. B. >2 Millionen Zellen/ml) kann die Bildung von Zellklumpen fördern, was zu einer Embolie im proximalen Gefäßsystem führen kann.
Wir haben nur einen kurzen Zeitraum (2 oder 3 Tage) der Perfusions-Bioreaktorkultur getestet. In unserer vorherigen Studie verwendeten wir eine unterschiedliche Anzahl von Endothelzellen, um das dezellularisierte Lungengerüst der Maus zu revaskularisieren, und fanden heraus, dass es einen Schwellenwert gibt, bei dem das Hinzufügen weiterer Zellen die Zellabdeckung nicht verbessert, die bei ~3 × 107 Endothelzellen pro Maus-Lungen-Herz-Blocklag 19. Wir erwarten, dass eine längere Kulturdauer (z. B. 14 Tage) die Abdeckung und Reifung von rezellularisierten Gefäßen verbessert, wie in den früheren Lungenbioengineering-Studienbeschrieben 9,10,15,25.
Die Grundlage der biotechnologisch hergestellten Lungentransplantatpräparation ähnelt der einer regulären Lungentransplantation an einer Maus26,27. Das manipulierte Lungengewebe ist nicht so zerbrechlich wie ein normales Lungentransplantat. Die Herausforderung besteht darin, dass das Lungengewebe, einschließlich der Hilumstruktur, vollständig weiß oder fast transparent ist. Ein genaues Verständnis der lokalen Anatomie ist für eine erfolgreiche Transplantation unabdingbar. Die stabile Technik sollte mit nativen Lungen erworben werden. Die Autoren gehen davon aus, dass die Forscher die Transplantation nach dem Training mit 100 Mäusen problemlos durchführen könnten.
Die Transplantation der biotechnologisch hergestellten Lunge mit humanen Zellen in der Maus ist technisch möglich; Eine akute Abstoßung des Transplantats ist jedoch aufgrund des Xenotransplantationscharakters dieses Modells unvermeidlich. Dieses Modell kann verwendet werden, um die kurzfristige Rezellularisierungseffizienz der biotechnologisch hergestellten Lunge zu testen, und die Langzeitfunktionalität sollte an immundefizienten Mäusen untersucht werden.
Obwohl es mit der aktuellen Methode nicht getestet wurde, sollte das Bioengineering der gesamten Lunge, bei dem sowohl Endothel- als auch Epithelzellen verwendet werden, technisch nicht so schwierig sein, wenn man die hier beschriebenen Schwierigkeiten beim pulmonalen Gefäßengineering bedenkt. Darüber hinaus kann diese Plattform im Mausmaßstab auf andere Forschungsbereiche ausgeweitet werden, wie z. B. die Untersuchung der zellulären Interaktion unter 3D-Kulturbedingungen, der Zell-Matrix-Interaktion, der Ex-vivo-Krebsmodellierung und so weiter. Zusammenfassend lässt sich sagen, dass diese Methode eine vernünftige und robuste Lungenbioengineering-Plattform darstellt.
Offenlegungen
Die Autoren haben keine Interessenkonflikte in Bezug auf dieses Manuskript.
Danksagungen
Diese Studie wurde finanziell unterstützt durch den Grant-in-Aid for Scientific Research / KAKENHI (C) #20K09174, #23K08308, den Fund for the Promotion of Joint International Research (Fostering Joint International Research (B)) #22KK0132 for TS, JSPS KAKENHI Grant Number 21K08877 für TW, den Leave a Nest Grant Ikeda-Rika Award für FT und den Grant-in-Aid for JSPS Fellows #21J21515 for FT. Wir danken Frau Maiko Ueda, technische Mitarbeiterin im Biomedizinischen Forschungszentrum der Tohoku University Graduate School of Medicine, für ihre intensive Arbeit in der histologischen Beobachtung. Wir danken auch für die technische Beratung von Frau Yumi Yoshida und Herrn Koji Kaji vom Center of Research Instruments am IDAC der Tohoku Universität für ihre Unterstützung bei der Bildverarbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| DECELLULARIZATION | |||
| 27 G x 1/2 in. BD PrecisionGlide Needle | BD | 305109 | Or equivalent 27 G injection needle |
| BD Insyte IV Catheter 20 GA X 1.8 8IN | BD | 381237 | Or equivalent 20 G IV catheter |
| Blade silk suture (4-0) | Nesco | GA04SB | Or equivalent |
| CaCl2 | Sigma-Aldrich | C5670 | |
| Catheter for rat jugular vein, PU 2Fr 10 cm | Instech | C20PU-MJV1301 | Recommended for mice weighs 30 g and under. |
| Catheter for rat jugular vein, PU 3Fr 10 cm | Instech | C30PU-RJV1307 | Recommended for mice weighs over 30 g. |
| DNase I | Sigma-Aldrich | DN25 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| NaCl | Sigma-Aldrich | S3014 | |
| PinPort injectors | Instech | PNP3M | |
| PinPorts, 22 G | Instech | PNP3F22-50 | Fits C30PU-RJV1307 |
| PinPorts, 25 G | Instech | PNP3F25-50 | Fits C20PU-MJV1301 |
| Sodium deoxycholate | Sigma-Aldrich | D6750 | |
| Sterile syringe, 5 mL | Generic | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| CELL CULTURE | |||
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| HUVEC – Human Umbilical Vein Endothelial Cells | Lonza | C2519A | |
| PERFUSION-BASED BIOREACTOR | |||
| 20 G needle | Generic | ||
| 3-way stopcock | Generic | ||
| Cork borer | Generic | Boring size, 6-10 mm | |
| EasyLoad III pump head | Cole-Parmer | 243934 | |
| Glass canister | Hario | SCN-200T | Inner diameter: 80 mm |
| Heating magnetic stirrer | Generic | ||
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-01 | Female, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-01 | Male, fits tubing with I.D. 1.5 mm (L/S 14) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9965-03 | Female, fits tubing with I.D. 3 mm (L/S 16) |
| Lure fitting, PVDF, For Soft Tube | Nordson Medical | 2-9964-03 | Male, fits tubing with I.D. 3 mm (L/S 16) |
| Magnetic stirring bar | Generic | ||
| Masterflex L/S Digital Precision Modular Drive with Remote I/O and Benchtop Controller | Cole-Parmer | 07557-00 | |
| Masterflex L/S Precision Pump Tubing, PharMed BPT, L/S 16 | Cole-Parmer | 06508-16 | |
| Masterflex L/S Pricision Pump Tubing, Platinum-Cured Silicone, L/S 14 | Cole-Parmer | 96410-14 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Millipore | SLGPR33RS | |
| Pyrex 250 mL grass bottle, GL-45 screw cap | Corning | 1395-250 | |
| Silicon Septa for GL45 Open Top PBT Screw Cap | Corning | 1395-455S | |
| Silicone Light Stopper | IMG | 07763-18 | Upper diameter: 87 mm, Lower diameter: 75 mm |
| Sterile syringe, 10 mL, 50 mL | Generic | ||
| MOUSE SURGERY (Isolation of the heart-lung block | Lung transplantation) | |||
| 10-0 Nylon ties | Kono Seisakusho | N/A | |
| 10-0 Silk ties | Kono Seisakusho | N/A | |
| 4-0 Silk ties | Kono Seisakusho | N/A | |
| Arterial clamp, 45 mm curved, grooved | Natsume seisakusyo | C-17-45 | |
| BD Insyte IV Catheter 24GA | BD | 381512 | Or equivalent 24G i.v. catheter |
| Bulldog Vascular Forceps 45mm curved | Natsume seisakusyo | M2 | |
| Butorphanol tartrate | Meiji Seika Pharma | N/A | |
| Cefazolin Sodium | Otsuka Pharmaceutical | N/A | |
| Dumont forceps #5/45 | Fine Science Tools | 1251-35 | |
| Fine vannas style spring scissors | Fine Science Tools | 15403-08 | 45° tip, 0.01 x 0.06 mm |
| Gemini Cautery Kit | Harvard Apparatus | RS-300 | |
| Halsted-Mosquito clamp curved tip, 125 mm | Bioresearch center | 16181670 | |
| Hegar needle holder, 150 mm | B Braun/Aesculap | BM065R | |
| Heparine solution | Mochida Seiyaku | N/A | |
| Medetomidine | Nippon Zenyaku Kogyo | N/A | |
| Micro forceps straight | B Braun/Aesculap | BD33R | |
| Midazolam | Sandoz | N/A | |
| Mouse Ventilator | Harvard Apparatus | Model 687™ | |
| Normal Saline, Clinical grade | Otsuka Pharmaceutical | N/A | |
| Petri dish, 60 x 15 mm | BD | 351007 | |
| Safelet Cath PU 20 gauge polyurethan catheter | Nipro | 09-031 | |
| Sakaki stainless scissors curved 14 cm | Bioresearch center | 64152034 | |
| Scalpel holder | Bioresearch center | 16101040 | |
| Small animal retraction system | Fine Science Tools | 18200-20 | |
| Spare blade scalpel #11 | Muranaka Medical Instruments | 567-001-03 | |
| Spring scissors, 15 cm | Bioresearch center | PRI13-3736 | |
| Stereomicroscope | Leica Microsystems | M525 | Clinical-grade surgical microscope with a flexible arm system is preferable. |
| Sugita titanium aneurysm clip curved slim, No.98 | Mizuho medical | 17-001-98 | |
| Sugita titanium clip applier, 110 mm | Mizuho medical | 17-013-53 | |
| Temperature-adjustable electric warmer | Generic | ||
| Ultrafine cotton swab | Generic | ||
| VASCULAR AND BRONCHIAL CUFF | |||
| Fine sandpaper | Generic | ||
| Venula 20 gauge Teflon angiocatheter | Top | 1160 | |
| Venula 22 gauge Teflon angiocatheter | Top | 1161 | |
| Venula 24 gauge Teflon angiocatheter | Top | 1124 |
Referenzen
- van der Mark, S. C., Hoek, R. A. S., Hellemons, M. E. Developments in lung transplantation over the past decade. Eur Respir Rev. 29 (157), 190132 (2020).
- Valapour, M., et al. OPTN/SRTR 2022 Annual Data Report: Lung. Am J Transplant. 24 (2S1), S394-S456 (2024).
- Hoffman, T. W. Waiting list dynamics and lung transplantation outcomes after introduction of the lung allocation score in the Netherlands. Transplant Direct. 7 (10), e760 (2021).
- Wilk, A. R., Edwards, L. B., Edwards, E. B. The effect of augmenting OPTN data with external death data on calculating patient survival rates after organ transplantation. Transplantation. 101 (4), 836-843 (2017).
- Neizer, H., Singh, G. B., Gupta, S., Singh, S. K. Addressing donor-organ shortages using extended criteria in lung transplantation. Ann Cardiothorac Surg. 9 (1), 49-50 (2020).
- Oliveira, P., Yamanashi, K., Wang, A., Cypel, M. Establishment of an ex vivo lung perfusion rat model for translational insights in lung transplantation. J Vis Exp. (199), e65981 (2023).
- Anand, R. P. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Shakir, S., Hackett, T. L., Mostaco-Guidolin, L. B. Bioengineering lungs: An overview of current methods, requirements, and challenges for constructing scaffolds. Front Bioeng Biotechnol. 10, 1011800 (2022).
- Ott, H. C. Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 16 (8), 927-933 (2010).
- Petersen, T. H. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Leiby, K. L. Rational engineering of lung alveolar epithelium. NPJ Regen Med. 8 (1), 22 (2023).
- Kitano, K., et al. Orthotopic transplantation of human bioartificial lung grafts in a porcine model: A feasibility study. Semin Thorac Cardiovasc Surg. 34 (2), 752-759 (2022).
- Ohata, K., Ott, H. C. Human-scale lung regeneration based on decellularized matrix scaffolds as a biologic platform. Surg Today. 50 (7), 633-643 (2020).
- Ren, X. Engineering pulmonary vasculature in decellularized rat and human lungs. Nat Biotech. 33 (10), 1097-1102 (2015).
- Doi, R. Transplantation of bioengineered rat lungs recellularized with endothelial and adipose-derived stromal cells. Sci Rep. 7 (1), 8447 (2017).
- Stone, K. C., Mercer, R. R., Gehr, P., Stockstill, B., Crapo, J. D. Allometric relationships of cell numbers and size in the mammalian lung. Am J Respir Cell Mol Biol. 6 (2), 235-243 (1992).
- Basil, M. C., Morrisey, E. E. Lung regeneration: a tale of mice and men. Semin Cell Dev Biol. 100, 88-100 (2020).
- Hsia, C. C., Hyde, D. M., Weibel, E. R. Lung structure and the intrinsic challenges of gas exchange. Compr Physiol. 6 (2), 827-895 (2016).
- Tomiyama, F., et al. Orthotopic transplantation of the bioengineered lung using a mouse-scale perfusion-based bioreactor and human primary endothelial cells. Sci Rep. 14 (1), 7040 (2024).
- Stoian, A., Adil, A., Biniazan, F., Haykal, S. Two decades of advances and limitations in organ recellularization. Curr Issues Mol Biol. 46 (8), 9179-9214 (2024).
- Crabbe, A. Recellularization of decellularized lung scaffolds is enhanced by dynamic suspension culture. PLoS One. 10 (5), e0126846 (2015).
- Daly, A. B. Initial binding and recellularization of decellularized mouse lung scaffolds with bone marrow-derived mesenchymal stromal cells. Tissue Eng Part A. 18 (1-2), 1-16 (2012).
- . Regulations for Animal Experiments and Related Activities Available from: https://www.clag.med.tohoku.ac.jp/clar/en/ (2024)
- Sokocevic, D., et al. The effect of age and emphysematous and fibrotic injury on the re-cellularization of de-cellularized lungs. Biomaterials. 34 (13), 3256-3269 (2013).
- Ren, X., et al. Ex vivo non-invasive assessment of cell viability and proliferation in bio-engineered whole organ constructs. Biomaterials. 52, 103-112 (2015).
- Watanabe, T. Mesenchymal stem cells attenuate ischemia-reperfusion injury after prolonged cold ischemia in a mouse model of lung transplantation: a preliminary study. Surg Today. 47 (4), 425-431 (2017).
- Watanabe, T., et al. Donor IL-17 receptor A regulates LPS-potentiated acute and chronic murine lung allograft rejection. JCI Insight. 8 (21), e158002 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten