Method Article
Estabelecendo um modelo suíno para estudar a preservação dinâmica e o transplante do útero
Neste Artigo
Resumo
Descreve-se um modelo detalhado e reprodutível de útero suíno, desde a captação cirúrgica até o início da perfusão por máquina, permitindo o estudo da preservação do útero no transplante.
Resumo
Até o momento, o transplante de útero é a única opção para mulheres com infertilidade uterina absoluta, como aquelas com síndrome de Rokitansky, experimentarem a gravidez e darem à luz. Apesar do crescente interesse no transplante uterino nos últimos anos, várias questões ainda carecem de mais pesquisas, incluindo a lesão de isquemia-reperfusão e seu impacto na qualidade e rejeição do enxerto. A literatura recente destacou uma taxa de complicações trombóticas de até 20% após o transplante uterino. Esse tipo de complicação pode resultar de danos às células endoteliais induzidos por hipóxia, muitas vezes levando à rejeição do enxerto uterino. A hipóxia é induzida durante o armazenamento estático a frio, que continua sendo o padrão-ouro para a preservação do enxerto no transplante de órgãos sólidos. Recentemente, a preservação dinâmica usando perfusão mecânica demonstrou melhorar o armazenamento a longo prazo de órgãos convencionais e marginais, reduzindo a lesão isquêmica e hipóxica. Neste protocolo, pretendemos descrever todas as etapas cirúrgicas envolvidas na captação e preservação dinâmica do útero suíno, com base em ambos os pedículos uterinos, para permitir a conexão e o início do protocolo de perfusão por máquina.
Introdução
O transplante de útero (UTx) desenvolveu-se significativamente nos últimos dez anos, com várias equipes iniciando programas de pesquisa clínica. Até o momento, a principal indicação de UTx é a infertilidade uterina absoluta devido à agenesia uterina, incluindo a síndrome de Mayer-Rokitansky-Küster-Hauser (MRKH). A síndrome de MRKH é uma doença congênita com prevalência de um em cada 5.000 nascidos vivos do sexo feminino1. A UTx poderia potencialmente abordar causas adicionais de infertilidade, incluindo aquelas resultantes de histerectomia devido a doença maligna, hemorragia pós-parto, miomas uterinos, sequelas infecciosas e várias malformações congênitas. Isso sugere que aproximadamente 1 em cada 500 mulheres pode ser elegível para UTx.
A primeira UTx clínica ocorreu em 2000 na Arábia Saudita2, mas complicações vasculares levaram a uma histerectomia três meses depois. Desde então, vários casos de UTx foram realizados, com base em doadores vivos e falecidos, resultando em mais de 80 nascidos vivos 3,4. Semelhante ao domínio do transplante de órgãos sólidos e alotransplantes compostos vascularizados (VCA), a rejeição imune é um desafio significativo no UTx. 5 Vários fatores podem levar à rejeição do enxerto, incluindo insuficiência microcirculatória e estase venosa, ambos os quais podem levar a complicações trombóticas. Em uma revisão recente que estudou a vascularização uterina no transplante, Kristek e col. relataram até 15% de trombose arterial e 5% de trombose venosa6. Além disso, a isquemia fria e quente são fatores críticos que devem ser abordados para o sucesso do transplante, pois a lesão de isquemia-reperfusão (IRI) pode levar à disfunção do enxerto e rejeição aguda 7,8. Os miócitos respondem ao estresse isquêmico produzindo lactato por até 6 h9, após o qual o dano às células musculares é irreversível. O impacto da isquemia fria no miométrio foi documentado em estudos clínicos, e o uso de solução intracelular da Universidade de Wisconsin durante o armazenamento estático a frio (SCS) demonstrou melhorar a preservação com melhor resposta contrátil à prostaglandina e maiores concentrações de ATP quando comparado à solução de acetato de Ringer10. No entanto, o impacto da isquemia quente e fria permanece pouco explorado na UTx.
O SCS continua sendo o padrão-ouro para a preservação da VCA, incluindo o útero, e para a maioria dos transplantes de órgãos sólidos. No entanto, nos últimos anos, avanços significativos em sistemas de perfusão de máquinas e soluções de preservação levaram a uma mudança de paradigma. Atualmente, existem fortes evidências de que a perfusão dinâmica da máquina pode melhorar e prolongar a preservação de órgãos sólidos saudáveis e marginais 11,12,13,14,15. Essa técnica é comumente utilizada na prática clínica para transplante de pulmão, coração, fígado e rim 14,16,17,18. A preservação dinâmica de órgãos demonstrou múltiplos benefícios, incluindo a minimização de lesões por isquemia fria e hipóxia, fornecendo suprimento contínuo de oxigênio e nutrientes, eliminando metabólitos tóxicos e melhorando a qualidade do enxerto e os parâmetros de viabilidade12,19. Múltiplas modalidades foram desenvolvidas, variando de perfusão hipotérmica a normotérmica por máquina (com ou sem carreadores de oxigênio), com vários perfusados disponíveis, mas apenas alguns foram testados no útero20. Para garantir a contribuição substancial de tais perspectivas de pesquisa, modelos cirúrgicos pré-clínicos relevantes são de importância crucial.
Neste trabalho, a perfusão subnormotérmica por máquina (SNMP) é utilizada como método de preservação dinâmica oxigenada de órgãos à temperatura ambiente (em torno de 20 °C) por meio da circulação de um perfusato através de uma bomba de rolos e um oxigenador. É empregado um modelo suíno que é relevante para estudos sobre UTx e preservação devido às suas semelhanças com o sistema reprodutor humano em termos de anatomia, fisiologia e tamanho do vaso21,22. O útero é obtido após a morte circulatória, proporcionando relevância para a doação após a morte cardíaca e sugerindo a possibilidade de um atraso na captação após todos os outros órgãos sólidos relevantes23,24. Além disso, esse modelo facilita o desenvolvimento de estudos de preservação do útero dentro de laboratórios de transplante estabelecidos com foco em outros órgãos, aplicando os princípios dos "3Rs"25. O objetivo é estabelecer um novo modelo de preservação baseado em pedículos uterinos e avaliar sua confiabilidade para preservação dinâmica. Todas as etapas do procedimento são detalhadas, desde a histerectomia até a preservação, englobando os pontos-chave destacados no uso do SNMP.
O protocolo descrito abaixo precedeu um experimento preliminar baseado em uma única bomba e um sistema de influxo "Y-tubing" para ambas as artérias uterinas (Figura Suplementar 1). Após 4 h-SNMP, o órgão ganhou mais de 50% de seu peso inicial. Fluxo, pressão, resistência e variação de peso são mostrados na Figura Suplementar 2. Um único sistema de perfusão separado em dois influxos não permitiu a modulação de cada vazão para a pressão de cada lado. Nesse caso, o SNMP levou a edema substancial em metade do órgão (Figura 3 suplementar). Este sistema mostrou-se inadequado para o modelo uterino, em parte porque não deveria ser considerado um modelo perfeitamente simétrico. Portanto, dois sistemas de perfusão por máquina foram utilizados neste protocolo, um para cada artéria uterina.
Protocolo
Todos os animais receberam cuidados humanitários seguindo o Guia do Instituto Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório, e os protocolos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Hospital Geral de Massachusetts (IACUC). No geral, 6 miniporcas fêmeas de Yucatán pesando 30-40 kg foram usadas para a obtenção do útero, com quatro úteros submetidos ao SNMP. Todos os animais foram heparinizados com uma dose completa (100 UI/kg) antes da eutanásia. A captação de órgãos ocorreu post-mortem com menos de 60 min de isquemia quente. Outros órgãos poderiam ter sido colhidos do mesmo doador para diferentes estudos, de acordo com os princípios dos "3Rs"25. Consulte a Tabela de Materiais para obter detalhes sobre todos os reagentes e equipamentos usados no protocolo.
1. Preparo pré-operatório (dia anterior à cirurgia)
- Prepare a solução de perfusato. Para a perfusão subnormotérmica da máquina, foi utilizada uma solução Steen+ otimizada para VCA 26,27. Utilizou-se um litro de solução por útero, cuja composição está detalhada na Tabela 1.
NOTA: Uma grande quantidade de hidróxido de sódio é adicionada ao perfusato com o objetivo de atingir um pH de cerca de 7,5-7,6. Este valor é expressamente alto, mas necessário, pois o pH tenderá a cair à medida que a máquina é circulada e oxigenada com uma mistura de carboidratos (95% de oxigênio; 5% de dióxido de carbono). - Configure o sistema de perfusão da máquina (Figura 1). Verifique se há vazamentos e bolhas quando o perfusato estiver circulando.
2. Colheita de útero post mortem
NOTA: Para simular a doação após morte cardíaca e/ou aquisição post-mortem, o animal deve ser sacrificado de acordo com as diretrizes locais da IACUC. A exsanguinação deve ser preferida à injeção intravenosa de pentobarbital para evitar toxicidade que possa interferir no estudo.
- Coloque o animal sacrificado em decúbito dorsal. Esfregue a área abdominal e coloque cortinas estéreis.
- Faça uma incisão infraumbilical mediana de 10 cm com uma lâmina # 20.
- Abra o tecido subcutâneo e a aponeurose com um bisturi elétrico monopolar.
NOTA: Deve-se prestar atenção para não danificar os intestinos abrindo a cavidade abdominal. - Separe o intestino delgado com uma gaze cirúrgica e exponha o útero.
NOTA: A anatomia uterina do modelo utilizado é mostrada na Figura 2A. - Proceda da mesma forma para os lados esquerdo e direito da seguinte forma:
- Identifique os vasos uterinos.
NOTA: A veia uterina está posicionada lateralmente à artéria uterina (Figura 3). - Crie uma abertura no ligamento largo lateralmente à veia uterina com uma pinça em ângulo reto.
- Através desta abertura, insira suturas de gravata de seda 2-0 para ligar os vasos ovarianos e liberar o útero do tecido conjuntivo circundante no ligamento largo usando cauterização.
- Ligue os vasos útero-ovarianos com suturas de gravata de seda 2-0 e remova o ovário e a trompa.
- Esqueletize os vasos uterinos e divida-os o mais próximo possível dos vasos ilíacos internos.
NOTA: Deve-se prestar atenção para manter o pedículo o maior tempo possível para facilitar a canulação e antecipar a retração do pedículo após o corte. - Repita as etapas 2.5.1-2.5.5 no lado oposto.
- Identifique os vasos uterinos.
- Remova o útero cortando o colo do útero com um bisturi elétrico monopolar.
NOTA: Use um longo tempo de contato para garantir a coagulação adequada dos vasos do colo do útero, evitando vazamentos durante a perfusão.
3. Preparação para perfusão
- Em uma mesa lateral, dilate ambas as artérias uterinas usando um dilatador microcirúrgico e insira um angiocateter. Prenda a canulação com laços de seda 3-0 (Figura 2B).
NOTA: Aqui, um angiocateter 18 G foi usado para todas as artérias. Deve-se tomar cuidado para não inserir o cateter muito longe para evitar a canulação seletiva, pois a bifurcação é relativamente próxima. As veias uterinas não são canuladas, pois o fluxo venoso é suficiente para manter o lúmen desses vasos aberto, permitindo fácil coleta. Além de economizar tempo, a canulação traumática pode levar a danos vasculares e potencialmente afetar o fluxo venoso. - Lave lentamente as duas artérias uterinas com 20 mL de solução de heparina de cada lado até que todos os vasos sejam lavados e as saídas estejam limpas.
NOTA: Deve-se prestar atenção para não lavar com alta pressão, o que pode levar a lesões microvasculares e falha de perfusão. - Pese o útero.
4. Perfusão subnormotérmica da máquina
NOTA: Para o útero, são necessários dois sistemas independentes de perfusão por máquina. Cada artéria uterina é conectada a um sistema de perfusão composto por uma bomba de rolo, um oxigenador, uma armadilha de bolhas e um sensor de pressão. O perfusato em um reservatório circula através de tubos de silicone conectados aos elementos listados acima antes de percorrer o órgão através da artéria uterina até a veia uterina de cada lado, onde o perfusato sai e é liberado no mesmo reservatório.
- Conecte o útero aos sistemas de perfusão da máquina conectando as cânulas da artéria uterina ao tubo de entrada (Figura 1).
- Usando a bomba de rolo, ajuste a vazão para baixa (2.5-4.0 mL/min) para manter uma pressão arterial constante entre 25-35 mmHg.
- Avalie os parâmetros de viabilidade em cada ponto de tempo predefinido no fluxo de entrada e saída usando uma seringa de 1 mL e analisando amostras com a máquina do sistema de gases sanguíneos [por exemplo, métricas de gases sanguíneos (pH, pCO2, pO2, lactato, excesso de bases, bicarbonato), glicose, sódio, potássio, cálcio, cloreto].
NOTA: Neste protocolo, a perfusão dura 4 h, e amostras da entrada e da saída são coletadas a cada 30 min. - Pese o útero no final da perfusão.
Resultados
Durante a perfusão, o sistema foi conectado a um sensor de pressão que registrou a pressão durante o experimento. A pressão foi inicialmente registrada para um sistema livre de útero, que foi subtraído dos registros de pressão durante a perfusão uterina para obter a pressão real do órgão. A vazão foi adaptada para manter a pressão dentro da faixa desejada e foi controlada pela bomba de rolo. A resistência foi calculada pela fórmula R = P / Q (R: resistência (mmHg.mL.min-1); P: pressão (mmHg); Q: vazão (mL/min)).
A evolução dos parâmetros de perfusão é mostrada na Figura 4. A taxa de fluxo inicial média foi de 5,2 (min 2,4, max 10,0) mL / min em ambos os lados e não flutuou muito durante o experimento. Com base na literatura e em experimentos anteriores, a pressão alvo foi fixada em 25-35 mmHg. A pressão arterial inicial média foi de 26 (mín 10, máx 36) mmHg no lado esquerdo do útero e 27 (mín 16, máx 39) mmHg no lado direito. Como o fluxo e a pressão foram ligeiramente estáveis e baixos, o perfil de resistência arterial resultante também apresentou uma curva plana ao longo do experimento. A resistência vascular inicial média foi de 8,5 (min 1, max 13,3) mmHg.mL.min-1 em ambos os lados (Figura 4).
A preservação do SNMP foi avaliada de acordo com vários parâmetros metabólicos (Figura 5): depuração de lactato (diferença entre a saída de lactato e a entrada de lactato), mudança de peso, diferença entre a glicose de entrada e a glicose de saída refletindo o consumo de glicose e o consumo de oxigênio. O consumo de oxigênio foi calculado usando a fórmula O2consumo = 0,0314 x Q x (entrada pO2 - saída pO2 ) / W (Q: vazão (mL/min), pO2: pressão parcial de oxigênio (mmHg), W: peso (g) e constante de Henry de 0,0314 em água a 20 °C e 1 atm). A diminuição dos níveis de lactato durante a primeira hora de perfusão indica que a perfusão em máquina permitiu a depuração do lactato após o acúmulo durante a fase isquêmica quente. A mudança de peso mostrou que nenhum dos úteros apresentava edema. A curva destacou que a perda de peso ocorreu principalmente durante as duas primeiras horas e que o peso tendeu a se estabilizar depois. A diferença de glicose entre o fluxo de entrada e o fluxo de saída diminuiu durante a primeira hora de perfusão antes de se estabilizar em valores baixos. O consumo de oxigênio permaneceu constante durante a perfusão.
Após 4 h de SNMP, foi realizada angiografia em cada útero, liberando-se lentamente 20 mL de contraste em cada artéria uterina (Figura 6), o que possibilitou a avaliação da árvore vascular após a fase de preservação. Em todos os órgãos, a microvasculatura foi bem identificada ao longo do colo uterino, corpo uterino e cornos.
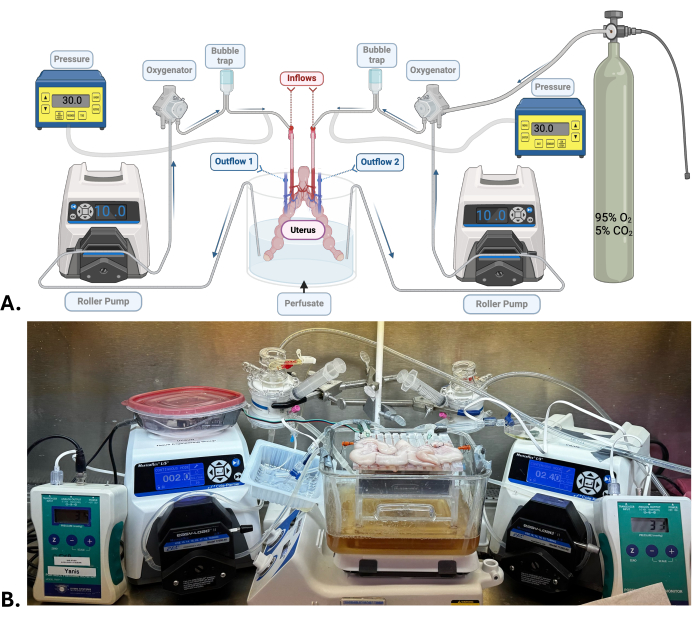
Figura 1: Modelo cirúrgico e sistema de perfusão da máquina. (A) Diagrama do sistema de perfusão da máquina usado para SNMP do útero. (B) Fotografia representativa de um útero suíno submetido a SNMP. Clique aqui para ver uma versão maior desta figura.
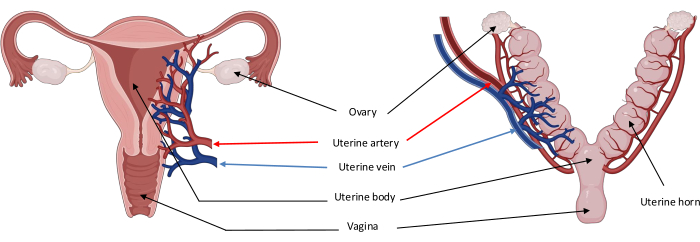
Figura 2: Diagrama da anatomia uterina humana (esquerda) e suína (direita) mostrando a principal vascularização através da artéria uterina. As características anatômicas do útero suíno devem-se principalmente à presença de um pequeno corpo dividido em dois grandes cornos uterinos. Clique aqui para ver uma versão maior desta figura.

Figura 3: Incidências intra e pós-operatórias. (A) Imagem intraoperatória do útero após a identificação dos vasos uterinos. (B) Imagens pós-operatórias do útero após a colheita e lavagem com solução salina. A: corpus; B: cornos uterinos; C: colo uterino; D: artérias uterinas; E: veias uterinas; F: tubo; G: ovário. Clique aqui para ver uma versão maior desta figura.

Figura 4: Perfil dos parâmetros de perfusão durante 4 h de perfusão em máquina em ambos os lados uterinos. (A) Vazão (mL/min). (B) Pressão (mmHg). (C) Resistência Arterial Calculada (mmHg.min.mL-1). As curvas indicam a média de cada lado do útero e as barras de erro indicam o desvio padrão da média. Clique aqui para ver uma versão maior desta figura.
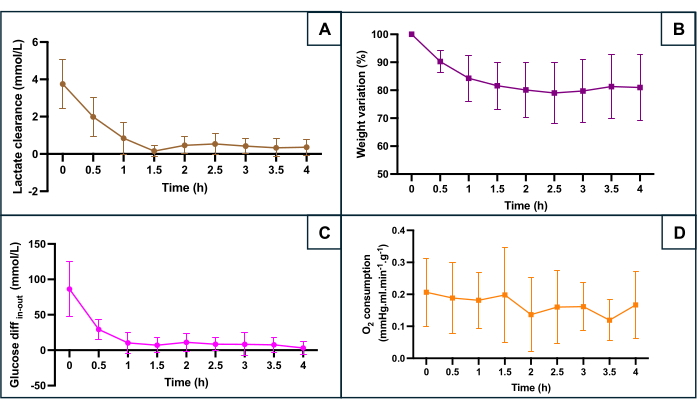
Figura 5: Monitoramento dos principais marcadores de hipóxia durante a perfusão da máquina. (A) Depuração de lactato durante os primeiros 90 minutos de perfusão antes da estabilização. (B) O peso diminui ao longo da perfusão. (C) Diferença entre a concentração de glicose de entrada e saída. (D) Consumo calculado O2 . Os dados representam a média para ambos os lados de cada útero e as barras de erro mostram o desvio padrão da média. Clique aqui para ver uma versão maior desta figura.

Figura 6: Angiografia representativa da árvore vascular uterina após preservação subnormotérmica. (A) Antes da injeção do agente de contraste. (B) Após a injeção do agente de contraste. Clique aqui para ver uma versão maior desta figura.
| Nome do componente | Quantidade | Nome do componente | Quantidade |
| Água desionizada | 1L | Dextrano fração baixa (~75 kDa) | 5 g |
| NaCl | 5.026 gramas | Albumina de soro bovino | 150 gramas |
| Kcl | 0,343 gramas | Hidrocortisona [50 mg/mL] | 0,2 mL |
| CaCl2 . 2H20 | 0,221 gramas | Dexametasona [1,6 g/100 mg] | 4 mL |
| NaH2PO4 | 0,187 gramas | Hidróxido de sódio [1 mol/mL] | 16 mL |
| NaHCO3 | 1,26 gramas | Heparina de baixo peso molecular | 200 UI |
| MgCl2 . 6H2O | 0,244 gramas | Insulina | 200 UI |
| D-glicose | 4,3 gramas | Vancomicina | 1,5 g |
| PEG (35 kDa) | 5 g |
Tabela 1: Composição da solução de Steen+. NaCl: cloreto de sódio; KCl: cloreto de potássio; CaCl2. 2H20: cloreto de cálcio di-hidratado; NaH2PO4: di-hidrogenofosfato de sódio; NaHCO3: bicarbonato de sódio; MgCl2 . 6H2O: cloreto de magnésio hexahidratado; GANCHO; polietilenoglicol.
Figura suplementar 1: Sistema de perfusão baseado em bomba única. (A) Diagrama do "sistema Y" de perfusão da máquina usado para o experimento preliminar. (B) Fotografia representativa da configuração para o experimento preliminar. Clique aqui para baixar este arquivo.
Figura suplementar 2: Perfil dos parâmetros de perfusão durante o 4.5h-SNMP para o experimento preliminar. (A) Taxa de fluxo (mL / min). (B) Pressão (mmHg). (c) Resistência arterial calculada (mmHg.min.mL-1). (D) Aumento de peso ao longo da perfusão. Clique aqui para baixar este arquivo.
Figura suplementar 3: Fotografia do útero no final do experimento preliminar (4,5 h-SNMP). Uma distribuição assimétrica do edema é evidente, principalmente no chifre direito (à direita da imagem). Clique aqui para baixar este arquivo.
Discussão
O transplante de útero, muitas vezes considerado parte da ACV, desenvolveu-se rapidamente nos últimos anos. Paralelamente, a perfusão de máquina começou a ser explorada na ACV, uma vez que demonstrou evidências robustas na melhoria da preservação de órgãos sólidos. A perfusão mecânica hipotérmica e subnormotérmica permitiu a preservação por até 24 h em modelos suínos de ACV miocutânea e óssea 26,27,28. Uma vez que o útero apresenta desafios comparáveis à VCA contendo osso e pele, é fundamental explorar técnicas semelhantes para UTx para melhorar a qualidade da preservação e os resultados a longo prazo29. Além de melhorar a qualidade dos órgãos, um benefício potencial da preservação dinâmica usando perfusão por máquina é expandir o número de doadores30. A recuperação do útero de doadoras vivas impõe riscos substanciais, como lesão ureteral durante a dissecção do pedículo uterino, mas também ruptura hormonal e todos os riscos potenciais associados à menopausa precoce devido à ovariectomia que pode ser realizada31,32. O objetivo de melhorar a qualidade dos órgãos de doadores falecidos evitaria a necessidade de tal cirurgia em procedimentos de colheita de doadores vivos. O objetivo final seria permitir a obtenção de útero em doadores vivos e falecidos, a fim de atender às necessidades de mulheres com infertilidade uterina absoluta33.
Este artigo fornece um modelo reprodutível para aquisição e preservação do útero suíno usando perfusão por máquina. Melhorar a qualidade e a duração da preservação é relevante para a expansão do pool de doadores, permitindo que doadores com morte cerebral sejam fontes confiáveis para a aquisição do útero. Clinicamente, a maioria dos UTx foi realizada com base em doadores vivos, principalmente familiares ou amigos próximos. O tempo de isquemia é um fator crítico na viabilidade final do órgão, particularmente em doadores em morte encefálica. A IRI é definida por danos celulares causados por uma sucessão de isquemia (interrupção da circulação sanguínea na árvore vascular do órgão) e reperfusão (retorno do suprimento de oxigênio), muitas vezes associada a um aumento da temperatura, contribuindo para os danos celulares. Essa cascata de eventos produz espécies reativas de oxigênio, levando eventualmente à inflamação crônica, apoptose, liberação de antígenos e rejeição do enxerto 7,8,34. Os tempos de isquemia quente (WIT) e fria são fatores críticos no processo de IRI, mas apenas alguns autores estudaram no útero. Em um estudo que explorou o efeito da preservação de SCS a longo prazo em camundongos UTx, o transplante foi realizado após 24 h de SCS, com gestações bem-sucedidas desenvolvidas em cinco dos seis animais. No entanto, após 48 h de SCS, todos os transplantes demonstraram necrose35. Em outro estudo comparando UTx em 14 ovelhas após 3 h de SCS (n = 7) e 24 h de SCS (n = 7), apenas 7 animais estavam vivos 8 dias após o transplante, com 35% dos úteros considerados viáveis em relação ao edema e necrose, 2 úteros no grupo 3 h SCS e 3 úteros no grupo 24 h SCS36. Curiosamente, a contração do miométrio foi mantida em úteros viáveis, mas a avaliação do método não foi especificada. Isso destaca a importância crítica de considerar que um transplante uterino bem-sucedido envolve não apenas um enxerto viável, mas também uma menstruação funcional e uma gravidez bem-sucedida. Nesse sentido, a diminuição do IRI e suas consequências negativas é primordial para permitir a melhoria da qualidade do enxerto e melhores taxas de sucesso de nascidos vivos. Para garantir a consistência, fizemos a colheita de todos os órgãos após WIT comparável. Todos os vasos dentro do ligamento largo foram coagulados ou ligados para garantir a medida de pressão relevante e perfusão capilar adequada para todo o órgão. O cateterismo é outro ponto crucial em que se deve prestar atenção para fixar a cânula, evitando danos aos vasos.
O experimento preliminar com um "sistema Y" levou à otimização de dois sistemas de perfusão independentes, abordando cada artéria uterina separadamente. De fato, um dos parâmetros críticos é a taxa de fluxo e a pressão de perfusão26,27, que levam à adaptação da taxa de fluxo, refletindo a resistência vascular geral do órgão. O influxo bilateral otimizado permitiu a depuração do lactato de cada lado do órgão, conforme destacado em nossos resultados (Figura 5), bem como medidas contínuas de diferença arteriovenosa para todos os parâmetros metabólicos. Na temperatura subnormotérmica, a reoxigenação celular por perfusão mecânica permite a eliminação de lactatos acumulados durante a fase metabólica anaeróbia associada à hipóxia e hipoperfusão durante a captação e canulação, mantendo a atividade metabólica baixa e evitando o rebote do lactato. Resultados semelhantes foram encontrados em membros posteriores de ratos19. Em outro modelo anatômico, Dion et al. mostraram uma abordagem diferente ao retirar o útero com a aorta em seu estudo de perfusão hipotérmica37. Seria de grande interesse para estudos futuros comparar adequadamente a perfusão única baseada na aorta com o modelo desenvolvido em nosso protocolo.
Embora um modelo reprodutível para perfusão mecânica do útero suíno seja descrito aqui, uma grande preocupação é a adequação para transplantes adicionais. Para confirmar a eficácia dos protocolos de preservação, o transplante é crucial, pois reproduz o cenário clínico. Isso requer anastomoses microcirúrgicas arteriais e venosas. Vários estudos têm demonstrado que a veia útero-ovariana pode ser utilizada na UTx clínica quando a veia uterina é de calibre insuficiente para garantir a drenagem venosa38,39. Uma limitação desse modelo é a falta de preservação da veia útero-ovariana. No entanto, nenhum edema importante foi registrado após 4 h SNMP em todas as réplicas incluídas, e fluxo venoso contínuo foi observado de todas as veias uterinas. Isso sugere uma diferença entre os modelos humano e suíno com uma potencial simplificação dos procedimentos de UTx em miniporcos de Yucatán. Estudos adicionais devem incluir a extensão do tempo de perfusão além de 4 h para determinar os limites da preservação dinâmica. Para concluir, este artigo descreve um modelo de útero suíno reprodutível para estudar a preservação baseada em perfusão por máquina e fornece um recurso valioso para direcionar o IRI com o objetivo de aumentar o número total de órgãos disponíveis para UTx.
Divulgações
Todos os autores não têm interesse financeiro a declarar.
Agradecimentos
Este trabalho foi parcialmente financiado pelo Instituto Nacional de Saúde sob o prêmio nº R01AR082825 (BEU) e Shriners Children's 84308 (YB). HO e YB receberam financiamento da Fondation des Gueules Cassées. O apoio da Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, França) e CHU de Rennes (França) à YB é muito reconhecido.
Materiais
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Referências
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados