Method Article
Établissement d’un modèle porcin pour étudier la préservation dynamique de l’utérus et la transplantation
Dans cet article
Résumé
Un modèle détaillé et reproductible d’utérus porcin est décrit, de l’approvisionnement chirurgical à l’initiation de la perfusion en machine, permettant l’étude de la préservation de l’utérus lors de la transplantation.
Résumé
À ce jour, la transplantation d’utérus est la seule option pour les femmes atteintes d’infertilité utérine absolue, telles que celles atteintes du syndrome de Rokitansky, pour vivre une grossesse et accoucher. Malgré l’intérêt croissant pour la transplantation d’utérus ces dernières années, plusieurs questions nécessitent encore des recherches supplémentaires, notamment les lésions d’ischémie-reperfusion et leur impact sur la qualité et le rejet du greffon. La littérature récente a mis en évidence un taux de complications thrombotiques allant jusqu’à 20 % après une transplantation d’utérus. Ce type de complication peut résulter de lésions des cellules endothéliales induites par l’hypoxie, conduisant souvent au rejet du greffon utérin. L’hypoxie est induite lors de l’entreposage frigorifique statique, qui reste l’étalon-or pour la préservation des greffons dans la transplantation d’organes solides. Récemment, il a été démontré que la préservation dynamique à l’aide de la perfusion mécanique améliore le stockage à long terme des organes conventionnels et marginaux en réduisant les lésions ischémiques et hypoxiques. Dans ce protocole, nous visons à décrire chaque étape chirurgicale impliquée dans l’obtention de l’utérus porcin et la préservation dynamique, en fonction des deux pédicules utérins, afin de permettre la connexion et l’initiation du protocole de perfusion de la machine.
Introduction
La transplantation d’utérus (UTx) s’est considérablement développée au cours des dix dernières années, avec plusieurs équipes démarrant des programmes de recherche clinique. À ce jour, la principale indication de l’UTx est l’infertilité utérine absolue due à l’agénésie utérine, y compris le syndrome de Mayer-Rokitansky-Küster-Hauser (MRKH). Le syndrome MRKH est une maladie congénitale dont la prévalence est d’une naissance vivante chez 5 000 chez les femmes1. UTx pourrait potentiellement traiter d’autres causes d’infertilité, notamment celles résultant d’une hystérectomie due à une maladie maligne, d’une hémorragie post-partum, de fibromes utérins, de séquelles infectieuses et de diverses malformations congénitales. Cela suggère qu’environ 1 femme sur 500 pourrait être éligible à l’UTx.
La toute première UTx clinique a eu lieu en 2000 en Arabie saoudite2, mais des complications vasculaires ont conduit à une hystérectomie trois mois plus tard. Depuis lors, plusieurs cas d’UTx ont été réalisés, sur des donneurs vivants et décédés, entraînant plus de 80 naissances vivantes 3,4. À l’instar de la transplantation d’organes solides et des allogreffes composites vascularisées (AVC), le rejet immunitaire est un défi important dans l’UTx. 5 Plusieurs facteurs peuvent conduire au rejet du greffon, notamment l’insuffisance microcirculatoire et la stase veineuse, qui peuvent toutes deux entraîner des complications thrombotiques. Dans une revue récente portant sur la vascularisation utérine lors de la transplantation, Kristek et al. ont signalé jusqu’à 15 % de thrombose artérielle et 5 % de thrombose veineuse6. De plus, l’ischémie froide et chaude sont des facteurs critiques qui doivent être pris en compte pour une transplantation réussie, car les lésions d’ischémie-reperfusion (IRI) peuvent entraîner un dysfonctionnement du greffon et un rejet aigu 7,8. Les myocytes réagissent au stress ischémique en produisant du lactate jusqu’à 6 h9, après quoi les dommages aux cellules musculaires sont irréversibles. L’impact de l’ischémie froide sur le myomètre a été documenté dans des études cliniques, et il a été démontré que l’utilisation d’une solution intracellulaire de l’Université du Wisconsin pendant le stockage à froid statique (SCS) améliore la conservation avec une meilleure réponse contractile à la prostaglandine et des concentrations d’ATP plus élevées par rapport à la solution d’acétate de Ringer10. Cependant, l’impact de l’ischémie chaude et froide reste peu exploré dans UTx.
La SCS reste la référence en matière de préservation de l’ACV, y compris l’utérus, et pour la plupart des greffes d’organes solides. Cependant, ces dernières années, des progrès significatifs dans les systèmes de perfusion mécanique et les solutions de conservation ont conduit à un changement de paradigme. Il existe maintenant des preuves solides soutenant que la perfusion mécanique dynamique peut améliorer et prolonger la préservation d’organes solides sains et marginaux 11,12,13,14,15. Cette technique est maintenant couramment utilisée dans la pratique clinique pour les transplantations pulmonaires, cardiaques, hépatiques et rénales 14,16,17,18. La préservation dynamique des organes a démontré de multiples avantages, notamment la minimisation des lésions d’ischémie par le froid et d’hypoxie en fournissant un apport continu en oxygène et en nutriments, l’élimination des métabolites toxiques et l’amélioration des paramètres de qualité et de viabilité des greffes12,19. De multiples modalités ont été développées, allant de l’hypothermie à la perfusion machine normothermique (avec ou sans transporteurs d’oxygène), avec plusieurs perfusats disponibles, mais seuls quelques-uns ont été testés sur l’utérus20. Pour garantir la contribution substantielle de telles perspectives de recherche, des modèles chirurgicaux précliniques pertinents sont d’une importance cruciale.
Dans ce travail, la perfusion machine subnormothermique (SNMP) est utilisée comme méthode de conservation dynamique d’organes oxygénés à température ambiante (environ 20 °C) en faisant circuler un perfusat à travers une pompe à rouleaux et un oxygénateur. Un modèle porcin est utilisé qui est pertinent pour les études sur l’UTx et la préservation en raison de ses similitudes avec le système reproducteur humain en termes d’anatomie, de physiologie et de taille des vaisseaux21,22. L’utérus est obtenu après la mort circulatoire, ce qui rend pertinent le don après la mort cardiaque et suggère la possibilité d’un délai d’approvisionnement après tous les autres organes solides pertinents23,24. De plus, ce modèle facilite le développement d’études de préservation de l’utérus au sein de laboratoires de transplantation établis en se concentrant sur d’autres organes, en appliquant les principes des « 3R »25. L’objectif est d’établir un nouveau modèle de conservation basé sur les pédicules utérins et d’évaluer sa fiabilité pour une conservation dynamique. Toutes les étapes de la procédure sont détaillées, de l’hystérectomie à la conservation, en mettant en évidence les points clés de l’utilisation de SNMP.
Le protocole décrit ci-dessous a précédé une expérience préliminaire basée sur une seule pompe et un système d’entrée en « tube en Y » pour les deux artères utérines (figure supplémentaire 1). Après 4 h-SNMP, l’organe a repris plus de 50 % de son poids initial. Le débit, la pression, la résistance et la variation de poids sont illustrés à la figure supplémentaire 2. Un seul système de perfusion séparé en deux entrées ne permettait pas de moduler chaque débit à la pression de chaque côté. Dans ce cas, le SNMP a entraîné un œdème important dans la moitié de l’organe (figure supplémentaire 3). Ce système s’est avéré inadapté au modèle utérin, en partie parce qu’il ne devait pas être considéré comme un modèle parfaitement symétrique. Par conséquent, deux systèmes de perfusion machine ont été utilisés dans ce protocole, un pour chaque artère utérine.
Protocole
Tous les animaux ont reçu des soins sans cruauté conformément au Guide du National Institute of Health pour le soin et l’utilisation des animaux de laboratoire, et les protocoles ont été approuvés par le Massachusetts General Hospital Institutional Animal Care and Use Committee (IACUC). Au total, 6 miniporcs femelles du Yucatan pesant 30 à 40 kg ont été utilisés pour l’approvisionnement de l’utérus, et quatre utérus ont subi une SNMP. Tous les animaux ont été héparinisés avec une dose complète (100 UI/kg) avant l’euthanasie. Le prélèvement d’organes a eu lieu post-mortem avec moins de 60 minutes d’ischémie chaude. D’autres organes auraient pu être prélevés sur le même donneur pour des études différentes, selon les principes des « 3R »25. Voir le tableau des matériaux pour plus de détails sur tous les réactifs et équipements utilisés dans le protocole.
1. Préparation préopératoire (la veille de l’intervention)
- Préparez la solution de perfusat. Pour la perfusion subnormothermique de la machine, une solution Steen+ optimisée pour le VCA a été utilisée26,27. Un litre de solution par utérus a été utilisé, et la composition est détaillée dans le tableau 1.
REMARQUE : Une grande quantité d’hydroxyde de sodium est ajoutée au perfusat dans le but d’atteindre un pH d’environ 7,5-7,6. Cette valeur est expressément élevée mais nécessaire car le pH aura tendance à baisser lorsque la machine circule et est oxygénée avec un mélange de carbogène (95 % d’oxygène ; 5 % de dioxyde de carbone). - Configurez le système de perfusion de l’appareil (Figure 1). Vérifiez qu’il n’y a pas de fuites et de bulles lorsque le perfusat circule.
2. Prélèvement post-mortem de l’utérus
REMARQUE : Pour simuler le don après une mort cardiaque et/ou un prélèvement post-mortem, l’animal doit être euthanasié conformément aux directives locales de l’IACUC. L’exsanguination doit être préférée à l’injection intraveineuse de Pentobarbital afin d’éviter une toxicité qui pourrait interférer avec l’étude.
- Placez l’animal euthanasié en position couchée. Frottez la région abdominale et placez des champs stériles.
- Faites une incision infra-ombilicale médiane de 10 cm avec une lame #20.
- Ouvrez le tissu sous-cutané et l’aponévrose avec un scalpel électrique monopolaire.
REMARQUE : Il faut faire attention à ne pas endommager les intestins en ouvrant la cavité abdominale. - Écartez l’intestin grêle avec une gaze chirurgicale et exposez l’utérus.
REMARQUE : L’anatomie utérine du modèle utilisé est illustrée à la figure 2A. - Procédez de la même manière pour les côtés gauche et droit comme suit :
- Identifiez les vaisseaux utérins.
REMARQUE : La veine utérine est positionnée latéralement à l’artère utérine (Figure 3). - Créez une ouverture dans le ligament large latéralement à la veine utérine avec une pince à angle droit.
- À travers cette ouverture, insérez des sutures en soie 2-0 pour ligaturer les vaisseaux ovariens et libérer l’utérus du tissu conjonctif environnant dans le ligament large à l’aide d’une cautérisation.
- Lister les vaisseaux utéro-ovariens avec des sutures en soie 2-0 et retirer l’ovaire et le tube.
- Squelettez les vaisseaux utérins et divisez-les aussi près que possible des vaisseaux iliaques internes.
REMARQUE : Il faut veiller à ce que le pédicule soit conservé le plus longtemps possible afin de faciliter la canulation et d’anticiper la rétraction du pédicule après sa section. - Répétez les étapes 2.5.1 à 2.5.5 du côté opposé.
- Identifiez les vaisseaux utérins.
- Retirez l’utérus en coupant à travers le col de l’utérus avec un scalpel électrique monopolaire.
REMARQUE : Utilisez un temps de contact long pour assurer une bonne coagulation des vaisseaux du col de l’utérus, évitant ainsi les fuites pendant la perfusion.
3. Préparation à la perfusion
- Sur une table d’appoint, dilater les deux artères utérines à l’aide d’un dilatateur microchirurgical et insérer un angiocathéter. Fixez la canulation à l’aide de 3-0 liens en soie (Figure 2B).
REMARQUE : Ici, un angiocathéter de 18 G a été utilisé pour toutes les artères. Il faut veiller à ne pas insérer le cathéter trop loin pour éviter la canulation sélective, car la bifurcation est relativement proche. Les veines utérines ne sont pas canulées, car l’écoulement veineux est suffisant pour maintenir la lumière de ces vaisseaux ouverte, ce qui permet une collecte facile. En plus de faire gagner du temps, la canulation traumatique peut entraîner des lésions vasculaires et potentiellement affecter le flux veineux. - Rincez lentement et manuellement les deux artères utérines avec 20 ml de solution d’héparine de chaque côté jusqu’à ce que tous les vaisseaux soient lavés et que les écoulements soient dégagés.
REMARQUE : Attention à ne pas rincer à haute pression, ce qui peut entraîner des lésions microvasculaires et une défaillance de la perfusion. - Pesez l’utérus.
4. Perfusion de machine subnormothermique
REMARQUE : Pour l’utérus, deux systèmes indépendants de perfusion mécanique sont nécessaires. Chaque artère utérine est reliée à un système de perfusion composé d’une pompe à rouleau, d’un oxygénateur, d’un piège à bulles et d’un capteur de pression. Le perfusat dans un réservoir circule à travers des tubes en silicone reliés aux éléments énumérés ci-dessus avant de traverser l’organe via l’artère utérine jusqu’à la veine utérine de chaque côté, où le perfusat sort et est libéré dans le même réservoir.
- Connectez l’utérus aux systèmes de perfusion de la machine en connectant les canules de l’artère utérine dans la tubulure d’entrée (Figure 1).
- À l’aide de la pompe à rouleau, réglez le débit à faible (2,5-4,0 mL/min) pour maintenir une pression artérielle constante entre 25-35 mmHg.
- Évaluer les paramètres de viabilité à chaque point temporel prédéfini dans l’entrée et la sortie à l’aide d’une seringue de 1 mL et en analysant les échantillons avec l’appareil du système des gaz du sang [p. ex., paramètres des gaz du sang (pH, pCO2, pO2, lactate, excès de bases, bicarbonate), glucose, sodium, potassium, calcium, chlorure].
REMARQUE : Dans ce protocole, la perfusion dure 4 h et des échantillons de l’entrée et de la sortie sont prélevés toutes les 30 minutes. - Pesez l’utérus à la fin de la perfusion.
Résultats
Pendant la perfusion, le système a été connecté à un capteur de pression qui a enregistré la pression pendant l’expérience. La pression a d’abord été enregistrée pour un système sans utérus, qui a été soustrait des enregistrements de pression pendant la perfusion utérine pour obtenir la pression réelle de l’organe. Le débit a été adapté pour maintenir la pression dans la plage souhaitée et a été contrôlé par la pompe à rouleaux. La résistance a été calculée à l’aide de la formule R = P / Q (R : résistance (mmHg.mL.min-1) ; P : pression (mmHg) ; Q : débit (mL/min)).
L’évolution des paramètres de perfusion est illustrée à la figure 4. Le débit initial moyen était de 5,2 (min 2,4, max 10,0) mL/min des deux côtés et n’a pas beaucoup fluctué pendant l’expérience. Sur la base de la littérature et d’expériences antérieures, la pression cible a été fixée à 25-35 mmHg. La pression artérielle initiale moyenne était de 26 (min 10, max 36) mmHg sur le côté gauche de l’utérus et de 27 (min 16, max 39) mmHg sur le côté droit. Comme le débit et la pression étaient légèrement stables et faibles, le profil de résistance artérielle résultant a également montré une courbe plate tout au long de l’expérience. La résistance vasculaire initiale moyenne était de 8,5 (min 1, max 13,3) mmHg.mL.min-1 des deux côtés (Figure 4).
La conservation du SNMP a été évaluée en fonction de plusieurs paramètres métaboliques (Figure 5) : la clairance du lactate (différence entre l’écoulement et l’entrée de lactate), la variation de poids, la différence entre le glucose entrant et le glucose sortant reflétant la consommation de glucose, et la consommation d’oxygène. La consommation d’oxygène a été calculée à l’aide de la formule O2consommation = 0,0314 x Q x (pO2 entrant - pO2 sortant) / W (Q : débit (mL/min), pO2 : pression partielle d’oxygène (mmHg), W : poids (g) et 0,0314 constante de Henry dans l’eau à 20 °C et 1 atm). La diminution des taux de lactate au cours de la première heure de perfusion indique que la perfusion mécanique a permis l’élimination du lactate après accumulation pendant la phase ischémique chaude. Le changement de poids a montré qu’aucun utérus n’avait d’œdème. La courbe a mis en évidence que la perte de poids se produisait principalement au cours des deux premières heures et que le poids avait tendance à se stabiliser par la suite. La différence de glucose entre l’entrée et la sortie a diminué au cours de la première heure de perfusion avant de se stabiliser à de faibles valeurs. La consommation d’oxygène est restée constante pendant la perfusion.
Après 4 h de NMMP, une angiographie a été réalisée dans chaque utérus, en rinçant lentement 20 mL d’agent de contraste dans chaque artère utérine (Figure 6), ce qui a permis d’évaluer l’arbre vasculaire après la phase de préservation. Dans tous les organes, la microvascularisation était bien identifiée le long du col de l’utérus, du corps utérin et des cornes.
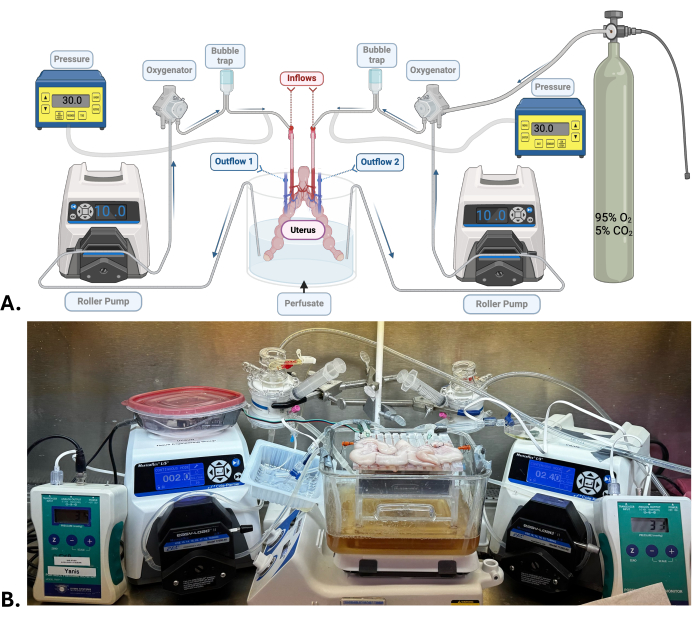
Figure 1 : Modèle chirurgical et système de perfusion de la machine. (A) Schéma du système de perfusion de la machine utilisé pour le SNMP de l’utérus. (B) Photographie représentative d’un utérus porcin subissant un SNMP. Veuillez cliquer ici pour voir une version agrandie de cette figure.
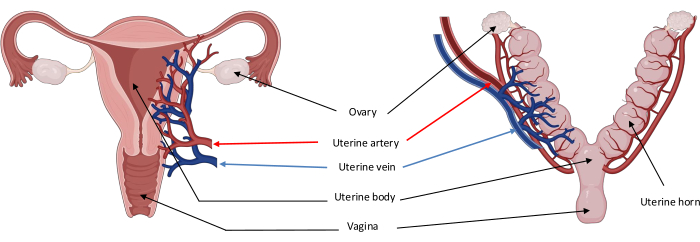
Figure 2 : Schéma de l’anatomie utérine de l’homme (à gauche) et du porc (à droite) montrant la vascularisation principale par l’artère utérine. Les caractéristiques anatomiques de l’utérus porcin sont principalement dues à la présence d’un petit corps divisé en deux grandes cornes utérines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Vues intra et postopératoires. (A) Image peropératoire de l’utérus après identification des vaisseaux utérins. (B) Images postopératoires de l’utérus après prélèvement et rinçage d’héparine-solution saline. A : corpus ; B : cornes utérines ; C : col de l’utérus ; D : artères utérines ; E : veines utérines ; F : tube ; G : ovaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Profil des paramètres de perfusion pendant 4 h de perfusion à l’appareil sur les deux côtés utérins. (A) Débit (mL/min). (B) Pression (mmHg). (c) Résistance artérielle calculée (mmHg.min.mL-1). Les courbes indiquent la moyenne de chaque côté de l’utérus et les barres d’erreur indiquent l’écart-type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
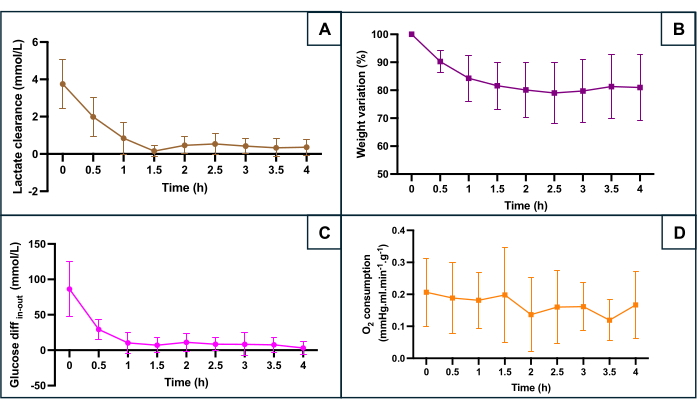
Figure 5 : Surveillance des principaux marqueurs d’hypoxie pendant la perfusion de l’appareil. (A) Clairance du lactate pendant les 90 premières minutes de perfusion avant la stabilisation. (B) Le poids diminue tout au long de la perfusion. (C) Différence entre la concentration de glucose à l’entrée et à la sortie. (D) Consommation calculée de O2. Les données représentent la moyenne des deux côtés de chaque utérus, et les barres d’erreur montrent l’écart-type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Angiographie représentative de l’arbre vasculaire utérin après préservation subnormothermique. (A) Avant l’injection de l’agent de contraste. (B) Après l’injection d’agent de contraste. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom du composant | Quantité | Nom du composant | Quantité |
| Eau désionisée | 1L | Dextran faible fraction (~75 kDa) | 5 grammes |
| NaCl | 5,026 grammes | Albumine sérique bovine | 150 grammes |
| Kcl | 0,343 g | Hydrocortisone [50 mg/mL] | 0,2 mL |
| CaCl2 . 2H20 | 0,221 gramme | Dexaméthasone [1,6 g/100 mg] | 4 ml |
| NaH2PO4 | 0,187 g | Hydroxyde de sodium [1 mol/mL] | 16 ml |
| NaHCO3 | 1,26 g | Héparine de bas poids moléculaire | 200 UI |
| MgCl2 . 6H2O | 0,244 gramme | Insuline | 200 UI |
| D-Glucose | 4,3 grammes | Vancomycine | 1,5 g |
| PEG (35 kDa) | 5 grammes |
Tableau 1 : Composition de la solution Steen+. NaCl : chlorure de sodium ; KCl : chlorure de potassium ; CaCl2. 2H20 : chlorure de calcium dihydraté ; NaH2PO4 : dihydrogénophosphate de sodium ; NaHCO3 : bicarbonate de sodium ; MgCl2 . 6H2O : chlorure de magnésium hexahydraté ; CHEVILLE; polyéthylène glycol.
Figure supplémentaire 1 : Système de perfusion à pompe unique. (A) Schéma du « système Y » de perfusion de la machine utilisé pour l’expérience préliminaire. (B) Photographie représentative de la mise en place de l’expérience préliminaire. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Profil des paramètres de perfusion pendant 4,5h-SNMP pour l’expérience préliminaire. (A) Débit (mL/min). (B) Pression (mmHg). (c) Résistance artérielle calculée (mmHg.min.mL-1). (D) Augmentation du poids tout au long de la perfusion. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Photographie de l’utérus à la fin de l’expérience préliminaire (4,5 h-SNMP). Une distribution asymétrique de l’œdème est évidente, principalement dans la corne droite (à droite de l’image). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La transplantation d’utérus, souvent considérée comme faisant partie de l’AVC, s’est rapidement développée au cours des dernières années. En parallèle, la perfusion mécanique a commencé à être explorée dans le VCA car elle a démontré des preuves solides dans l’amélioration de la préservation des organes solides. La perfusion mécanique hypothermique et subnormothermique a permis jusqu’à 24 h de conservation chez les porcs de VCA myocutané et contenant des os 26,27,28. Étant donné que l’utérus présente des défis comparables à ceux du VCA contenant des os et de la peau, il est essentiel d’explorer des techniques similaires pour l’UTx afin d’améliorer la qualité de conservation et les résultats à long terme29. Au-delà de l’amélioration de la qualité des organes, un avantage potentiel de la préservation dynamique à l’aide de la perfusion mécanique est l’élargissement du bassin de donneurs30. Le prélèvement d’utérus sur des donneuses vivantes présente des risques importants, tels que des lésions urétérales lors de la dissection du pédicule utérin, mais aussi des perturbations hormonales et tous les risques potentiels associés à la ménopause précoce en raison de l’ovariectomie qui peut être réalisée31,32. L’objectif d’améliorer la qualité des organes de donneurs décédés permettrait d’éviter la nécessité d’une telle intervention chirurgicale dans les procédures d’obtention de donneurs vivants. L’objectif ultime serait de permettre l’obtention d’utérus chez les donneuses vivantes et décédées afin de répondre aux besoins des femmes atteintes d’infertilité utérine absolue33.
Cet article fournit un modèle reproductible pour l’obtention et la conservation de l’utérus porcin à l’aide de la perfusion machine. L’amélioration de la qualité et de la durée de conservation est pertinente pour l’expansion du bassin de donneurs en permettant aux donneurs en état de mort cérébrale d’être des sources fiables pour l’obtention d’utérus. Cliniquement, la plupart des UTx ont été réalisées sur des donneurs vivants, principalement des membres de la famille ou des amis proches. Le temps d’ischémie est un facteur critique dans la viabilité de l’organe final, en particulier chez les donneurs en état de mort cérébrale. L’IRI est définie par des lésions cellulaires causées par une succession d’ischémie (interruption de la circulation sanguine dans l’arbre vasculaire de l’organe) et de reperfusion (retour de l’apport en oxygène), souvent associées à une augmentation de la température, contribuant aux lésions cellulaires. Cette cascade d’événements produit des espèces réactives de l’oxygène, conduisant finalement à une inflammation chronique, à l’apoptose, à la libération d’antigènes et au rejet du greffon 7,8,34. Les temps d’ischémie chauds (WIT) et froids sont des facteurs critiques dans le processus IRI, mais seuls quelques auteurs l’ont étudié dans l’utérus. Dans une étude explorant l’effet de la préservation à long terme de la SCS chez la souris UTx, la transplantation a été réalisée après 24 heures de SCS, avec des grossesses réussies développées chez cinq animaux sur six. Cependant, après 48 h de SCS, toutes les greffes ont montré une nécrose35. Dans une autre étude comparant UTx chez 14 brebis après 3 h de SCS (n = 7) et 24 h de SCS (n = 7), seuls 7 animaux étaient en vie 8 jours après la transplantation, avec 35 % de l’utérus considéré comme viable concernant l’œdème et la nécrose, 2 utérus dans le groupe SCS 3 h et 3 utérus dans le groupeSCS 36 de 24 h. Il est intéressant de noter que la contraction du myomètre a été maintenue dans l’utérus viable, mais l’évaluation de la méthode n’a pas été précisée. Cela souligne l’importance cruciale de considérer qu’une greffe d’utérus réussie implique non seulement un greffon viable, mais aussi des menstruations fonctionnelles et une grossesse réussie. À cet égard, la diminution des IRI et de leurs conséquences négatives est primordiale pour permettre une amélioration de la qualité des greffons et de meilleurs taux de réussite des naissances vivantes. Pour assurer la cohérence, nous nous sommes assurés de prélever tous les organes après un WIT comparable. Tous les vaisseaux du ligament large ont été coagulés ou ligaturés pour assurer une mesure de pression pertinente et une perfusion capillaire adéquate à l’ensemble de l’organe. Le cathétérisme est un autre point crucial où une attention particulière doit être portée pour sécuriser la canule tout en évitant d’endommager les vaisseaux.
L’expérience préliminaire avec un « système Y » a conduit à l’optimisation de deux systèmes de perfusion indépendants, s’adressant à chaque artère utérine séparément. En effet, l’un des paramètres critiques est le débit et la pression de perfusion26,27, qui conduisent à adapter le débit, reflétant la résistance vasculaire globale de l’organe. L’afflux bilatéral optimisé a permis la clairance du lactate de chaque côté de l’organe, comme le mettent en évidence nos résultats (Figure 5), ainsi que des mesures continues de la différence artério-veineuse pour tous les paramètres métaboliques. À température subnormothermique, la réoxygénation cellulaire par perfusion mécanique permet l’élimination des lactates accumulés pendant la phase métabolique anaérobie associée à l’hypoxie et à l’hypoperfusion lors de l’approvisionnement et de la canulation, en maintenant l’activité métabolique faible et en évitant le rebond du lactate. Des résultats similaires ont été trouvés chez les membres postérieurs du rat19. Dans un autre modèle anatomique, Dion et al. ont montré une approche différente en prélevant l’utérus avec l’aorte dans leur étude de perfusion hypothermique37. Il serait d’un grand intérêt pour les études futures de comparer correctement la perfusion unique basée sur l’aorte au modèle développé dans notre protocole.
Bien qu’un modèle reproductible de perfusion mécanique de l’utérus porcin soit décrit ici, l’une des principales préoccupations est l’aptitude à une transplantation ultérieure. Afin de confirmer l’efficacité des protocoles de conservation, la transplantation est cruciale puisqu’elle reproduit le cadre clinique. Cela nécessite des anastomoses microchirurgicales artérielles et veineuses. Plusieurs études ont montré que la veine utéro-ovarienne peut être utilisée dans les UTx cliniques lorsque la veine utérine est d’un calibre insuffisant pour assurer le drainage veineux38,39. L’une des limites de ce modèle est le manque de préservation de la veine utéro-ovarienne. Cependant, aucun œdème majeur n’a été enregistré après 4 h de SNMP chez toutes les répétitions incluses, et un écoulement veineux continu a été noté dans toutes les veines utérines. Cela suggère une différence entre les modèles humains et porcins avec une simplification potentielle des procédures UTx chez les miniporcs du Yucatan. D’autres études devraient inclure l’extension du temps de perfusion au-delà de 4 h pour déterminer les limites de la préservation dynamique. Pour conclure, cet article décrit un modèle d’utérus porcin reproductible pour l’étude de la préservation basée sur la perfusion automatique et fournit une ressource précieuse pour cibler l’IRI dans le but d’augmenter le nombre total d’organes disponibles pour l’UTx.
Déclarations de divulgation
Tous les auteurs n’ont aucun intérêt financier à déclarer.
Remerciements
Ce travail a été partiellement financé par l’Institut national de la santé dans le cadre du prix n° R01AR082825 (BEU) et du Shriners Children’s 84308 (YB). HO et YB ont reçu un financement de la Fondation des Gueules Cassées. Le soutien de la Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, France) et du CHU de Rennes (France) à YB est grandement reconnu.
matériels
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Références
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon