Method Article
子宮の動的保存と移植を研究するためのブタモデルの確立
要約
外科的調達から機械灌流の開始まで、詳細で再現性のある豚の子宮モデルが説明されており、移植における子宮保存の研究が可能になります。
要約
今日まで、子宮移植は、ロキタンスキー症候群の女性など、絶対的な子宮不妊症の女性が妊娠を経験して出産するための唯一の選択肢です。近年、子宮移植への関心が高まっているにもかかわらず、虚血再灌流障害や移植片の品質や拒絶反応への影響など、いくつかの問題が依然としてさらなる研究を必要としています。最近の文献では、子宮移植後の血栓性合併症の発生率が最大 20% であることが強調されています。このタイプの合併症は、低酸素症による内皮細胞の損傷に起因する可能性があり、多くの場合、子宮移植片の拒絶反応につながります。低酸素症は静的な冷蔵中に誘発され、これは依然として固形臓器移植における移植片保存のゴールドスタンダードです。最近、機械灌流を使用した動的保存は、虚血性および低酸素性損傷を減らすことにより、従来の臓器および辺縁臓器の長期保存を改善することが示されています。このプロトコルでは、両方の子宮茎に基づいて、ブタの子宮調達と動的保存に関与するすべての外科的ステップを説明し、機械灌流プロトコルの接続と開始を可能にすることを目指しています。
概要
子宮移植(UTx)は過去10年間で大幅に発展し、いくつかのチームが臨床研究プログラムを開始しました。今日まで、UTxの主な適応症は、Mayer-Rokitansky-Küster-Hauser(MRKH)症候群を含む子宮無形成による絶対的な子宮不妊症です。MRKH症候群は、女性の出生5,000人に1人が罹患している先天性疾患です1。UTxは、悪性疾患による子宮摘出術、分娩後出血、子宮筋腫、感染性後遺症、およびさまざまな先天性奇形に起因するものを含む、不妊症のその他の原因に対処できる可能性があります。これは、約500人に1人の女性がUTxの資格がある可能性があることを示唆しています。
史上初の臨床UTxは2000年にサウジアラビアで行われましたが2、血管合併症により3か月後に子宮摘出術が行われました。それ以来、生存しているドナーと死亡したドナーの両方に基づいて、UTxのいくつかのケースが行われ、80人以上の出生が行われています3,4。固形臓器移植や血管新生複合同種移植(VCA)の領域と同様に、UTxでは免疫拒絶反応が大きな課題となっています。5 移植片拒絶反応を引き起こす可能性のあるいくつかの要因には、微小循環不全や静脈うっ血などがあり、どちらも血栓性合併症を引き起こす可能性があります。移植における子宮血管新生を研究した最近のレビューで、Kristek et al. は最大 15% の動脈血栓症と 5% の静脈血栓症を報告しました6.さらに、虚血再灌流障害 (IRI) は移植片の機能不全と急性拒絶反応につながる可能性があるため、低温虚血と温性虚血は移植を成功させるために対処しなければならない重要な要素です 7,8。筋細胞は、最大6時間9時間乳酸を生成することにより虚血性ストレスに応答し、その後、筋細胞の損傷は不可逆的になります。低温虚血が子宮筋層に与える影響は臨床研究で文書化されており、静的低温貯蔵 (SCS) 中にウィスコンシン大学の細胞内様溶液を使用すると、プロスタグランジンに対する収縮反応が良く、リンガーの酢酸溶液10 と比較して、より高い ATP 濃度で保存が改善されることが示されています。しかし、温冷虚血の影響は、UTxでは十分に調査されていません。
SCSは、子宮を含むVCAの保存、およびほとんどの固形臓器移植のゴールドスタンダードであり続けています。しかし、近年、機械灌流システムと保存ソリューションの大幅な進歩により、パラダイムシフトが起こっています。現在、動的機械灌流が健康で辺縁の固形臓器の保存を改善し、延長できることを裏付ける強力な証拠があります11,12,13,14,15。この技術は、現在、肺、心臓、肝臓、および腎臓の移植14,16,17,18の臨床診療で一般的に使用されています。動的臓器保存は、継続的な酸素と栄養素の供給を提供することによる寒冷虚血と低酸素症の損傷を最小限に抑え、有毒な代謝物を除去し、移植片の品質と生存率パラメータを改善するなど、複数の利点を示しました12,19。低体温から常温性機械灌流(酸素キャリアの有無にかかわらず)に至るまで、複数のモダリティが開発されており、いくつかの灌流剤が利用可能であるが、子宮でテストされたのはごくわずかである20。このような研究の視点の実質的な貢献を確保するためには、関連する前臨床手術モデルが非常に重要です。
この研究では、ローラーポンプと酸素化装置を介して灌流液を循環させることにより、室温(約20°C)で酸素化された動的臓器保存法として、非正常温機械灌流(SNMP)が使用されます。解剖学、生理学、および血管サイズの点でヒトの生殖器系との類似性により、UTxおよび保存に関する研究に関連するブタモデルが採用されている21,22。子宮は循環器死後に調達され、心臓死後の提供との関連性を提供し、他のすべての関連する固形臓器23,24の後に調達遅延の可能性を示唆している。さらに、このモデルは、「3R」の原則25を適用して、他の臓器に焦点を当てた確立された移植研究所内での子宮保存研究の開発を促進します。子宮茎に基づく新しい保存モデルを確立し、動的保存のための信頼性を評価することを目的としています。子宮摘出術から保存まで、すべての手順手順が詳細に説明されており、SNMPの使用に関する強調表示された重要なポイントが含まれています。
以下に説明するプロトコルは、単一のポンプと両方の子宮動脈の「Yチューブ」流入システムに基づく予備実験に先行していました(補足図1)。4時間後のSNMPで、臓器は初期重量の50%以上増加しました。流量、圧力、抵抗、および重量の変動を 補足図2に示します。1つの灌流システムを2つの流入に分けると、各流量を各側の圧力に調整することはできませんでした。この場合、SNMPは臓器の半分にかなりの浮腫を引き起こしました(補足図3)。このシステムは、完全に対称的なモデルと見なすべきではないという理由もあり、子宮モデルには適していないことが証明されました。したがって、このプロトコルでは、各子宮動脈に1つずつ、2つの機械灌流システムが使用されました。
プロトコル
すべての動物は、国立衛生研究所の実験動物の世話と使用に関するガイドに従って人道的なケアを受け、プロトコルはマサチューセッツ総合病院の施設用動物管理および使用委員会(IACUC)によって承認されました。全体として、体重30〜40 kgの6匹のユカタンの雌のミニブタが子宮調達に使用され、4匹の子宮がSNMPを受けました。すべての動物は、安楽死の前に1回の全用量(100 IU / kg)でヘパリン化されました。.臓器調達は、温性虚血が60分未満で死後に行われました。他の臓器は、「3R」の原則25に従って、異なる研究のために同じドナーから摘出された可能性があります。プロトコールで使用されるすべての試薬と機器の詳細については、 Table of Materials を参照してください。
1. 術前準備(手術前日)
- 灌流液を準備します。非正常温熱マシン灌流には、VCA用に最適化されたSteen+溶液が使用されました26,27。子宮当たり1リットルの溶液を使用し、組成を表1に詳述する。
注:灌流液には、pHが約7.5〜7.6になるように、大量の水酸化ナトリウムを添加します。この値は明示的に高いですが、機械がカルボゲン混合物(95%酸素、5%二酸化炭素)で循環および酸素化されるとpHが低下する傾向があるため、必要です。 - 機械灌流システムを設定します(図1)。灌流液を循環させると、漏れや気泡がないか確認します。
2. 死後の子宮調達
注:心臓死後および/または死後の調達後の提供をシミュレートするには、動物は地元のIACUCガイドラインに従って安楽死させる必要があります。投与は、研究を妨げる可能性のある毒性を避けるために、静脈内ペントバルビタール注射よりも優先されるべきです。.
- 安楽死させた動物を仰臥位に置きます。腹部をこすり洗いし、滅菌ドレープを置きます。
- #20ブレードで10cmの中央下臍下切開を行います。
- 皮下組織と腱膜を単極電気メスで開きます。
注:腹腔を開けて腸を傷つけないように注意する必要があります。 - 手術用ガーゼで小腸を脇に置き、子宮を露出させます。
注:使用したモデルの子宮の解剖学的構造を 図2Aに示します。 - 左側と右側についても、次のように同様に進めます。
- 子宮血管を特定します。
注:子宮静脈は子宮動脈に対して横方向に配置されています(図3)。 - 直角鉗子を使用して、子宮静脈に対して横方向に広い靭帯に開口部を作ります。
- この開口部を通して、2-0シルクタイ縫合糸を挿入して卵巣血管を結紮し、焼灼を使用して広靭帯の周囲の結合組織から子宮を解放します。
- 子宮卵巣血管を2-0シルクタイ縫合糸で結紮し、卵巣とチューブを切除します。
- 子宮血管をスケルトン化し、それらを内部腸骨血管にできるだけ近づけて分割します。
注:カニューレ挿入を容易にし、切断後の椎弓根の収縮を予測するために、椎弓根をできるだけ長く保持することに注意を払う必要があります。 - 反対側で手順2.5.1〜2.5.5を繰り返します。
- 子宮血管を特定します。
- モノポーラ電気メスで子宮頸部を切開して子宮を摘出します。
注:接触時間を長くして、子宮頸部血管の適切な凝固を確保し、灌流中の漏れを防ぎます。
3.灌流の準備
- サイドテーブルで、顕微手術用拡張器を使用して両方の子宮動脈を拡張し、血管カテーテルを挿入します。カニューレを3-0シルクタイで固定します(図2B)。
注:ここでは、すべての動脈に18Gの血管カテーテルを使用しました。分岐部が比較的近いため、選択的カニューレ挿入を避けるために、カテーテルをあまり挿入しないように注意する必要があります。子宮静脈はカニューレ挿入されておらず、静脈の流出はこれらの血管の内腔を開いたままにするのに十分であり、簡単に収集できます。外傷性カニューレ挿入は、時間を節約するだけでなく、血管の損傷を引き起こし、静脈の流れに影響を与える可能性があります。 - すべての血管が洗い流され、流出が明確になるまで、両側に20 mLのヘパリン溶液で両方の子宮動脈をゆっくりと手動で洗い流します。
注:微小血管の損傷や灌流不全につながる可能性のある高圧で洗い流さないように注意する必要があります。 - 子宮の重さを量ります。
4.サブノーマルサーミックマシン灌流
注:子宮には、2つの独立した機械灌流システムが必要です。各子宮動脈は、ローラーポンプ、酸素供給器、バブルトラップ、および圧力センサーで構成される灌流システムに接続されています。リザーバー内の灌流液は、上記の要素に接続されたシリコンチューブを通って循環し、子宮動脈を介して臓器を通って両側の子宮静脈に流れ込み、そこで灌流液は同じリザーバーに放出されます。
- 子宮動脈カニューレを流入チューブに接続して、子宮を機械灌流システムに接続します(図1)。
- ローラーポンプを使用して、流量を低(2.5〜4.0 mL / min)に調整し、動脈圧を25〜35 mmHgの間で一定に保ちます。
- 1 mL シリンジを使用し、血液ガス システム マシンでサンプルを分析する [血液ガス メトリクス (pH、pCO2、pO2、乳酸、塩基過剰、重炭酸塩)、グルコース、ナトリウム、カリウム、カルシウム、塩化物] を使用して、流入と流出の両方の事前定義された各時点での生存率パラメーターを評価します。
注:このプロトコルでは、灌流は4時間持続し、流入および流出からのサンプルは30分ごとに採取されます。 - 灌流の終わりに子宮の重さを量ります。
結果
灌流中、システムは実験中の圧力を記録する圧力センサーに接続されました。圧力は当初、子宮のないシステムについて記録され、子宮灌流中の圧力記録から差し引かれて、実際の臓器圧が得られました。流量は、圧力を所望の範囲内に維持するように適合され、ローラーポンプによって制御されました。抵抗は、式R = P / Q(R:抵抗(mmHg.mL.min-1)を使用して計算しました。P:圧力(mmHg);Q:流量(mL/min))。
灌流パラメータの推移を図4に示します。平均初期流量は両側で 5.2 mL/分 (最小 2.4、最大 10.0) mL/分で、実験中に大きな変動はありませんでした。文献と以前の実験に基づいて、目標圧力は25〜35mmHgに設定されました。平均初期動脈圧は、子宮の左側で26(最小10、最大36)mmHg、右側で27(最小16、最大39)mmHgでした。流量と圧力がわずかに安定しており、低かったため、結果として生じる動脈抵抗プロファイルも実験全体を通して平坦な曲線を示しました。平均初期血管抵抗は、両側で 8.5 (最小 1、最大 13.3) mmHg.mL.min-1 でした (図 4)。
SNMPの保存は、いくつかの代謝パラメータ(図5)に従って評価されました:乳酸クリアランス(乳酸流出と乳酸流入の差)、体重変化、流入グルコースとグルコース消費量を反映した流出グルコースとの差、および酸素消費量。酸素消費量は、式O2消費量 = 0.0314 x Q x (pO2 流入 - pO2 流出) / W (Q: 流量 (mL/min)、pO2: 部分酸素圧 (mmHg)、W: 重量 (g)、および 0.0314 ヘンリー定数 20 °C および 1 気圧の水中で計算しました。灌流の最初の1時間における乳酸レベルの減少は、機械灌流が温虚血期の蓄積後に乳酸クリアランスを可能にしたことを示しています。体重の変化は、どの子宮にも浮腫がないことを示しました。この曲線は、体重減少が主に最初の2時間に発生し、その後体重が安定する傾向があることを強調しています。流入と流出の間のグルコース差は、灌流の最初の1時間で減少し、その後、低い値で安定します。灌流中の酸素消費量は一定に保たれました。
SNMPの4時間後、各子宮で血管造影を行い、各子宮動脈に20mLの造影剤をゆっくりと流し(図6)、保存段階後の血管樹の評価を可能にしました。すべての臓器で、子宮頸部、子宮体、および角に沿って微小血管系がよく特定されました。
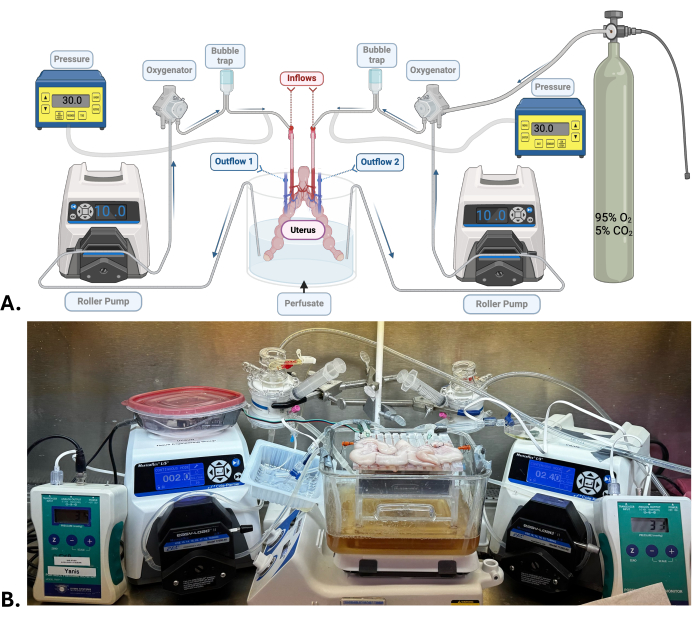
図1:手術モデルと機械灌流システム(A)子宮SNMPに使用される機械灌流システムの図。(B)SNMPを受けているブタの子宮の代表的な写真。この図の拡大版を表示するには、ここをクリックしてください。
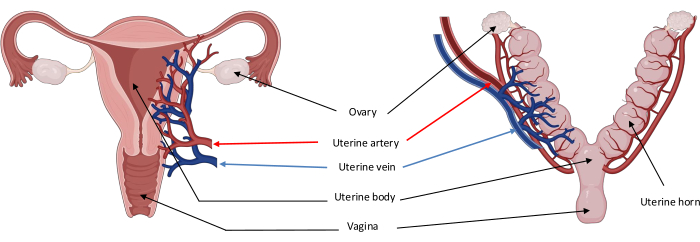
図2:子宮動脈を介した主な血管新生を示すヒト(左)とブタ(右)の子宮の解剖学的構造の図。 ブタの子宮の解剖学的特徴は、主に2つの大きな子宮角に分割された小さな体の存在によるものです。 この図の拡大版を表示するには、ここをクリックしてください。

図3:術中および術後のビュー。 (A) 子宮血管を特定した後の子宮の術中画像。(B)調達後の子宮の術後画像とヘパリン生理食塩水フラッシュ。A:コーパス;B:子宮角;C:子宮頸部;D:子宮動脈;E:子宮静脈;F:チューブ;G:卵巣。 この図の拡大版を表示するには、ここをクリックしてください。

図4:子宮両側での4時間の機械灌流中の灌流パラメータのプロファイル(A)流量(mL/分)。(B)圧力(mmHg)。(C)計算された動脈抵抗(mmHg.min.mL-1)。曲線は子宮の各側の平均を示し、エラーバーは平均の標準偏差を示します。この図の拡大版を表示するには、ここをクリックしてください。
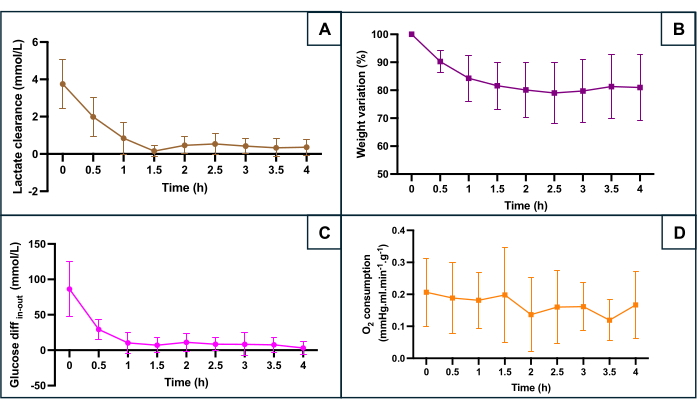
図5:機械灌流中の主な低酸素マーカーのモニタリング。 (A)安定化前の灌流の最初の90分間の乳酸クリアランス。.(B)灌流全体で重量が減少します。(C)流入と流出のグルコース濃度の違い。(D)計算されたO2 消費量。データは各子宮の両側の平均を表し、エラーバーは平均の標準偏差を示します。 この図の拡大版を表示するには、ここをクリックしてください。

図6:正常体温以下の保存後の子宮血管樹の代表的な血管造影。 (A)造影剤の注入前。(B)造影剤の注入後。 この図の拡大版を表示するには、ここをクリックしてください。
| コンポーネント名 | 量 | コンポーネント名 | 量 |
| 脱イオン水 | 1L | デキストラン低分画 (~75 kDa) | 5グラム |
| NaClの | 5.026 グラム | ウシ血清アルブミン | 150グラム |
| KClの | 0.343グラム | ヒドロコルチゾン [50mg/mL] | 0.2ミリリットル |
| CaCl2 。2H20 | 0.221グラム | デキサメタゾン [1.6 g/100 mg] | 4ミリリットル |
| NaH2PO4 | 0.187 グラム | 水酸化ナトリウム [1 mol/mL] | 16ミリリットル |
| NaHCO3 | 1.26 グラム | 低分子量ヘパリン | 200 IUの |
| MgCl2 です。 6H2O | 0.244 グラム | インスリン | 200 IUの |
| D-グルコース | 4.3グラム | バンコマイシン | 1.5グラム |
| PEG(35 kDa) | 5グラム |
表1:Steen+溶液の組成。 NaCl:塩化ナトリウム;KCl:塩化カリウム;CaCl2。2H20:塩化カルシウム二水和物;NaH2PO4:リン酸二水素ナトリウム;NaHCO3:重炭酸ナトリウム;MgCl2 です。6H2O:塩化マグネシウム六水和物;ペッグ;ポリエチレング。
補足図1:シングルポンプベースの灌流システム。 (A)予備実験に用いた機械灌流「Y系」の図。(B)予備実験のセットアップの代表的な写真。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:予備実験のための4.5h-SNMP中の灌流パラメータのプロファイル。 (A)流量(mL / min)。(B)圧力(mmHg)。(C)計算された動脈抵抗(mmHg.min.mL-1)。(D)灌流全体で重量が増加します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:予備実験(4.5 h-SNMP)終了時の子宮の写真。 浮腫の非対称的な分布は、主に右角(画像の右側)で明らかです。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
子宮移植は、VCAの一部と見なされることが多く、ここ数年で急速に発展しています。並行して、VCAでは、固形臓器の保存を改善する確固たる証拠が示されたため、機械灌流が検討され始めました。低体温および非正常体温機械灌流により、筋皮膚および骨含有VCA 26,27,28のブタモデルで最大24時間の保存が可能になりました。子宮は骨および皮膚含有VCAに匹敵する課題を提示するため、保存品質と長期的な結果を向上させるために、UTxの同様の技術を探求することが重要である29。臓器の質を向上させるだけでなく、機械灌流を用いた動的保存の潜在的な利点は、ドナーのプールを拡大することである30。生体ドナーからの子宮回収は、子宮茎の解剖中の尿管損傷などのかなりのリスクを課すだけでなく、ホルモンの混乱や、実施される可能性のある卵巣摘出術による早期閉経に関連するすべての潜在的なリスクも課します31,32。死亡したドナー臓器の質を向上させる目的は、生体ドナー調達手続きにおけるそのような手術の必要性を回避するであろう。最終的な目標は、絶対的な子宮不妊症の女性のニーズを満たすために、存命のドナーと死亡したドナーの両方で子宮調達を可能にすることであろう33。
この記事では、機械灌流を使用したブタの子宮の調達と保存の再現可能なモデルを提供します。保存の質と期間の改善は、脳死ドナーが子宮調達の信頼できる供給源となることによるドナープールの拡大に関連しています。臨床的には、ほとんどのUTxは生体ドナー(主に家族や親しい友人)に基づいて実施されました。虚血時間は、特に脳死ドナーにおいて、最終的な臓器生存率の重要な要素です。IRIは、虚血(臓器血管樹の血液循環の中断)と再灌流(酸素供給の回復)の連続によって引き起こされる細胞損傷によって定義され、多くの場合、温度の上昇に関連し、細胞の損傷に寄与します。この一連の事象は活性酸素種を産生し、最終的には慢性炎症、アポトーシス、抗原放出、および移植片拒絶反応を引き起こす7,8,34。温存(WIT)および低温虚血の時間は、IRIプロセスの重要な要素ですが、子宮内でそれを研究した著者はごくわずかです。マウスUTxにおけるSCSの長期保存の効果を調査した研究では、SCSの24時間後に移植が行われ、6匹中5匹で妊娠が成功しました。しかし、SCSの48時間後、すべての移植は壊死を示しました35。SCSの3時間後(n = 7)とSCSの24時間後(n = 7)の14頭の雌羊のUTxを比較した別の研究では、移植後8日で生存していたのはわずか7匹で、子宮の35%が浮腫と壊死に関して生存可能であり、3時間のSCSグループでは2つの子宮、24時間のSCSグループでは3つの子宮が生存可能と見なされました36。興味深いことに、子宮内膜の収縮は生存子宮内で維持されていましたが、方法の評価は特定されていませんでした。このことは、子宮移植の成功には、生存可能な移植片だけでなく、機能的な月経と妊娠の成功も含まれることを考慮することの決定的な重要性を浮き彫りにしています。この点で、IRIとその悪影響を減らすことは、移植片の品質を改善し、出生成功率を向上させるための根本的なものです。一貫性を確保するために、同等のWITの後にすべての臓器を採取するようにしました。広靭帯内のすべての血管は、臓器全体に対する適切な圧力測定と適切な毛細血管灌流を確保するために凝固または結紮されました。カテーテル法は、血管の損傷を避けながらカニューレを固定するために注意を払わなければならないもう一つの重要なポイントです。
「Yシステム」による予備実験により、各子宮動脈に別々に対処する2つの独立した灌流システムの最適化が実現しました。実際、重要なパラメータの1つは、流量と灌流圧26,27であり、これは、臓器の全体的な血管抵抗を反映して、流量を適応させることにつながります。最適化された両側流入により、結果(図5)で強調されているように、臓器の両側からの乳酸クリアランスが可能になり、すべての代謝パラメータの動静脈差が連続的に測定されました。正常体温以下の温度では、機械灌流による細胞再酸素化により、調達およびカニューレ挿入中の低酸素および低灌流に関連する嫌気性代謝段階で蓄積された乳酸の排除が可能になり、代謝活性を低く保ち、乳酸のリバウンドを回避できます。同様の結果は、ラットの後肢でも見出されている19。別の解剖学的モデルでは、Dionらは、低体温灌流研究37で、大動脈で子宮を摘出するという異なるアプローチを示しました。大動脈ベースの単一灌流を私たちのプロトコルで開発されたモデルと適切に比較することは、将来の研究にとって非常に興味深いでしょう。
ここでは、ブタ子宮の機械灌流の再現可能なモデルについて説明していますが、1つの主要な懸念事項は、さらなる移植への適合性です。保存プロトコルの有効性を確認するためには、臨床現場を再現する移植が重要です。これには、動脈および静脈の顕微手術吻合が必要です。いくつかの研究は、子宮卵巣静脈が静脈ドレナージを確保するための不十分な口径である場合に、臨床UTxで使用できることを示している38,39。このモデルの1つの制限は、子宮卵巣静脈の保存の欠如です。しかし、4時間のSNMP後には、含まれるすべての反復で大きな浮腫は記録されず、すべての子宮静脈から継続的な静脈流出が認められました。これは、ユカタンのミニブタにおけるUTx手順の潜在的な簡素化を伴う、ヒトモデルとブタモデルの違いを示唆しています。さらなる研究には、動的保存の限界を決定するために、灌流時間を4時間を超えて延長することを含める必要があります。結論として、この記事では、機械灌流ベースの保存を研究するための再現性のあるブタ子宮モデルについて説明し、UTxで利用可能な臓器の総数を増やすことを目標にIRIを標的とするための貴重なリソースを提供します。
開示事項
すべての著者は、宣言する金銭的利益を持っていません。
謝辞
この研究は、国立衛生研究所(National Institute of Health)から、No R01AR082825(BEU)およびShriners Children's 84308(YB)に一部資金提供されました。HOとYBは、Fondation des Gueules Casséesから資金提供を受けました。Société Française de Chirurgie Plastique、Reconstructrice et Esthétique(SOFCPRE、フランス)、CHU de Rennes(フランス)からYBへの支援は高く評価されています。
資料
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
参考文献
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved