Method Article
시상하부-뇌하수체-고환 축을 통해 쥐의 희소점무정자증을 치료하는 Shu-Mu 뇌-신장 경혈의 메커니즘
요약
본 연구는 쥐의 희소고정정자증에 대한 Shu-Mu Brain-Kidney 경혈의 치료 효과를 검증하고, 시상하부-뇌하수체-고환(HPT) 축을 통해 그 기전을 살펴보는 것을 목적으로 한다.
초록
올리goasthenospermia는 남성 불임의 흔한 원인입니다. 시상하부-뇌하수체-고환(HPT) 축은 생식 호르몬 합성 및 방출을 통해 생식선 분화와 성숙을 조절하여 남성 생식력에 중요한 역할을 합니다. HPT 축 안정성이 방해를 받으면 정자 생산이 손상되어 정액의 질이 저하됩니다. 전기침술이 HPT 축 조절에 미치는 영향을 조사하면 희박혈 정자증 치료에 대한 통찰력을 얻을 수 있습니다. 50마리의 8주 된 수컷 SD 쥐를 무작위로 블랭크(blank), 모델(model), 슈무(Shu-Mu) 뇌-신장(Shu-Mu Brain-Kidney), 비경혈(non-acupoint) 및 L-카르니틴 그룹(그룹당 n = 10명)으로 나누었습니다. 블랭크 그룹을 제외하고, 쥐는 모델을 확립하기 위해 28일 동안 아데닌을 위장내로 투여받았다. 모델링 후, Shu-Mu Brain-Kidney 그룹은 지정된 경혈에서 전기 침술을 받았고, 경혈이 없는 그룹은 매일 30분 동안 가짜 치료를 받았습니다. L-카르니틴 그룹은 L-카르니틴(10mL/kg)을 1일 1회 위장내로 투여받았습니다. 치료는 28일 동안 계속되었습니다. 일반적인 상태, 장기 계수 및 정액의 질을 평가했습니다. HE 염색은 조직 형태를 분석했고, ELISA는 혈청 호르몬 변화를 감지했습니다. 모델 그룹과 비교했을 때, Shu-Mu Brain-Kidney, L-carnitine 그룹은 체중 증가와 함께 정신, 식단 및 배변 활동에서 유의한 개선을 보인 반면, 경혈이 없는 그룹은 유의한 변화를 보이지 않았습니다. 신장 장기 계수는 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 크게 감소했지만 비경혈 그룹에서는 변하지 않았습니다. 고환 장기 계수는 치료 그룹 간에 유의한 차이를 보이지 않았다. 정자 수, 밀도, 생존율 및 운동성은 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 유의하게 개선되었지만, 비경혈 그룹에서는 그렇지 않았습니다. H&E 염색 결과 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 신장 및 고환 조직 손상이 개선된 것으로 나타났습니다. ELISA는 이들 그룹에서 T, GnRH 및 INHB가 증가하고 LH, FSH, E2 및 PRL 수치가 감소했으며(p < 0.001), 비경혈 그룹에서는 유의한 변화가 없었다. 이러한 결과는 Shu-Mu Brain-Kidney 경혈 요법이 HPT 축을 조절하여 정자의 질을 향상시켜 희소고정정자증에 대한 잠재적인 치료법을 제공한다는 것을 나타냅니다.
서문
"올리고스정자증(oligospermia)"과 "무안정정자증(asthenospermia)"으로 나뉘는 올리고무스템정자증(oligoasthenospermia)은 남성 불임의 흔한 유형 중 하나로, 남성 불임 사례의 약 75%를 차지하는 발병률이 있습니다1. 올리고안정정자증(oligoasthenospermia)은 주로 고환의 정자 밀도와 운동성 감소를 특징으로 하며, 대부분 임상적으로 정자 형성 장애(spermatogenesis disorder), 정자 수 감소(sperm count 감소), 낮은 정자 운동성(sperm motility)으로 나타납니다 2,3. 최근 몇 년 동안 희박종무정자증의 발병률은4년마다 증가하고 있습니다. 효과적인 치료가 이루어지지 않으면 환자의 신체적, 정신적 건강은 물론 가족의 화목에도 장기적으로 악영향을 미칠 수 있다5. 연구에 따르면 유전적 문제6, 생식 내분비 장애7, 비뇨생식기 감염8 및 화학 약물9이 정자 생산과 성숙에 영향을 미쳐 정액의 질을 저하시킬 수 있다고 한다. 현재 손상된 정자의 질을 개선하는 것은 의료 분야에서 어려운 과제가 되었습니다.
시상하부-뇌하수체-고환(HPT) 축은 신체의 생식 조절의 주요 경로로, 시상하부, 뇌하수체, 고환과 관련된 생식 호르몬의 합성과 분비를 자극하여 생식선의 분화와 성숙을 조절할 수 있으며, 정상적인 남성 생식 기능을 유지하는 데 중요한 역할을 한다10. HPT 축 기능의 안정성이 중단되면 고환 분비가 테스토스테론의 생리적 농도에 도달하기에 충분하지 않아 고환 내 정자의 수와 질이 저하됩니다11. 따라서 올리고안정정자증의 치료는 주로 HPT 축의 기능을 조절하고 관련 내분비 호르몬의 균형을 유지하여 정액 내 정자 수를 늘리고 정자 활성을 향상시키며 정액의 질을 향상시키는 목적을 달성하는 것을 목표로 합니다.
올리고아스테노스정자증의 임상적 치료에서 현대의학은 주로 수술 및 항산화 약물과 같은 방법을 채택하고 정자 운동성을 향상시키는 반면,전기침술 요법은 전통 중국 침술과 현대 의학 생체 전기를 결합합니다. 빠르고 정확하며, 명백한 치료 효과가 있고, 부작용이 적고, 적합한 질병이 다양하고, 치료 비용이 저렴하며, 희소고정정자증에 대한 우수한 치료 효과가 있다는 장점이 있습니다14,15. "등은 양이고 복부는 음입니다." 슈-무 경혈 조합은 슈 포인트와 뮤 포인트를 결합하며, 하나는 앞쪽에, 다른 하나는 뒤쪽에, 하나는 음과 양이 함께 작용하며, 이를 앞뒤 경혈 조합 방법이라고도 합니다. 중국 전통 의학(TCM)은 신장이 태아 진액의 뿌리이며 질병은 신장에 있다고 믿습니다. 신장의 Front-mu 지점 인 Jingmen (GB25)과 Back-shu 지점 인 Shenshu (BL23)가 선택되며, 이는 신장을 따뜻하게하고, 양을 돕고, 음16,17 내에서 양을 찾는 효과가 있습니다. 신장은 본질을 저장하고 골수 생산을 관장하며, 뇌는 골수의 바다이자 모든 양의 만남의 장소이며, Taixi (KI3)는 간과 신장을 조절하고 강화하며 음에 영양을 공급하고 골수를 생성 할 수있는 발 Shaoyin 신장 자오선의 근원 점입니다18. Epangsanxian(MS4)과 결합하여 신장과 뇌를 연결하여 TCM19의 "Shu-Mu 뇌-신장 경혈 조합"이라는 아이디어를 반영하며 치료 효과는 일반 침술보다 더 분명합니다.
정액의 질에 대한 현재의 치료 연구는 주로 고환 구조와 기능을 개선하는 데 초점을 맞추고 있는 반면, 시상하부-뇌하수체-고환(HPT) 축20의 다양한 조직에 걸친 혈청 호르몬 수치 조절에 대한 연구는 제한적이다. 예비 연구에서는 RNA 염기서열분석(RNA-Seq)을 사용하여 건강한 쥐와 아데닌 유도 올리고정자증 모델 쥐의 시상하부, 뇌하수체 및 고환 조직 내에서 정액의 품질 조절에 관여하는 후보 유전자 및 조절 경로를 식별했습니다21. 또한 두 그룹 모두에서 정액 품질 검사 및 고환 조직의 조직학적 분석이 수행되었습니다. 이러한 발견은 아데닌 유도 oligoasthenospermia 쥐의 정액 품질의 기저에 있는 분자 메커니즘에 대한 통찰력을 제공했습니다. 원거리-근사(distant-approximal acupoint)를 이용한 전기침술요법은 HPT 축을 조절함으로써 희박식정자증(oligoasthenospermia) 쥐의 정자 질을 향상시킬 수 있으며, 그 효과는 산화 스트레스 과정과 관련이 있다22. 그러나 Shu-Mu Brain-Kidney 경혈이 HPT 축을 조절하여 쥐의 정액의 질을 향상시킬 수 있는지는 알려져 있지 않습니다. 본 연구는 희소고정정자증 쥐의 정액질 개선에 대한 조절 기전과 효과적인 치료 방법을 추가로 탐구하기 위해 아데닌 유도 쥐 모델을 사용하여 희석고정정자증의 아데닌 유도 경혈을 사용하고 Epangsanxian, Shenshu, Jingmen 및 Taixi의 4개 경혈을 선택하여 HPT 축 측면에서 쥐의 희소고정정자증에 대한 Shu-Mu Brain-Kidney 경혈의 치료 효과의 관련 메커니즘을 탐색했습니다. 임상 치료를 위한 보다 과학적인 근거를 제공합니다.
프로토콜
모든 동물 실험은 닝샤 의과대학 동물윤리위원회(승인 번호: IACUC-NYLAC-2021-130)의 검토 및 승인을 받았습니다. 이 연구는 동물 실험에 대한 ARRIVE 가이드라인 2.0에 따라 엄격하게 수행되었으며 NIH Guide for the Care and Use of Laboratory Animals에 설명된 동물 복지 원칙을 준수했습니다. 이 무작위 대조 동물 연구는 분산의 일원 분석을 사용했으며 2023년 3월부터 5월까지 닝샤 의과대학 동물 실험 센터에서 수행되었습니다. 이 연구에는 180-220g의 8주 된 SPF 등급 수컷 SD 쥐가 사용되었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 동물모델 수립 및 치료 절차
- 실험 동물 및 그룹
- 180-220g의 8주 된 SPF 등급 수컷 SD 쥐 50마리를 얻습니다.
- 모든 쥐를 표준 조건에서 수용하고 실내 온도를 22-25 °C, 습도 50%-60%로 유지하고 표준 설치류 사료와 물을 자유롭게 이용할 수 있도록 합니다.
- 적응 일주일 후, 무작위 숫자 테이블 방법을 사용하여 쥐를 공백 그룹(B) 그룹(n = 10)과 모델링 그룹(n = 40)으로 무작위로 나눕니다. blank 그룹에는 생리식염수를 투여하고 경구 위장에 의한 모델링 그룹에는 아데닌을 투여합니다.
- 28일 후, 모델링 그룹을 모델(M) 그룹, Shu-Mu 뇌-신장(S) 그룹, 비경혈(N) 그룹 및 L-카르니틴(L) 그룹(그룹당 n = 10)으로 무작위로 나눕니다. 모델 그룹을 처리하지 않고 그대로 둡니다.
- Shu-Mu Brain-Kidney 경혈 일치 방법을 사용하여 Shu-Mu Brain-Kidney 그룹에 전기 침술 중재를 적용합니다. 비경혈 그룹에는 비경혈 치료를 투여하고 L-카르니틴 그룹에는 가스에 의한 L-카르니틴 경구액을 투여합니다. 28일 동안 모든 그룹을 지속적으로 치료하십시오.
- 모델 구성
참고: 연구에 따르면 고용량의 아데닌은 쥐의 고환 기능에 영향을 미쳐 비정상적인 성호르몬 분비, HPT 축의 기능적 안정성 파괴, 정자의 질 저하를 유발할 수 있다23. 따라서 아데닌은 일반적으로 수컷 동물 불임 모델을 확립하는 데 사용됩니다.- 경구 위절제를 통해 블랭크 그룹에는 생리식염수(1mL/체중 100g)를, 모델 그룹에는 아데닌(체중 20mg/100g)을 투여합니다(그림 1A).
- 아데닌 침전과 개배지 바늘의 막힘을 방지하기 위해 개배지 중 지속적인 교반을 보장하십시오. 28일 동안 하루에 한 번 트리트먼트를 투여합니다.
- 1.3 치료 절차
- Shu-Mu 뇌-신장 그룹
- 모델링 후 첫 번째 날부터 개입을 시작합니다. 양측 지점에 일회용 멸균 침술로 침술을 시행합니다. 쥐를 고친 후 침술 부위를 노출시키고 소독합니다.
- 왼손으로 침 부위의 피부를 고정하고 오른손에는 일회용 멸균 침으로 경혈을 빠르게 찌릅니다. 전기 자극기를 연결합니다. 전기 침술 빈도 2Hz, 자극 강도 1.5mA, 국소 근육의 약간의 떨림으로 팽창파를 적용합니다.
- 28일 연속으로 하루에 한 번씩 30분 동안 전기침술을 실시한다(그림 1B).
참고: Yong Tang의 Experimental Acupuncture and Moxibustion Science, 부록 II, "Acupuncture Points Commonly Used in Experimental Animals"를 참조하여 쥐의 경혈을 비교 해부학적 점 선택방법 19과 결합하여 선택합니다. 다음 지점이 선택되었습니다 : (1) Epangsanxian (MS4) : Touwei 지점 아래 3mm, 외부 4mm에 위치합니다. 작동 : 찌르기 1-2 mm 스트레이트; (2) Shenshu (BL23) : 두 번째 요추의 아래쪽 가시 돌기 양쪽의 척추 부위에 위치하며 정중 등쪽 선 옆 6mm에 위치합니다. 작동 : 찌르기 6mm 직선; (3) Jingmen (GB25) : 아래쪽 13 번째 갈비뼈의 자유 끝에있는 측면 허리에 위치합니다. 작동 : 찌르기 1-2 mm 스트레이트; (4) Taixi (KI3) : 발 안쪽, 내측 발목의 높은 지점과 아킬레스 건의 뒤쪽 가장자리 사이의 함몰부에 위치합니다. 작동 : 3mm 직선으로 찌르십시오.
- 비경혈 그룹
- Shu-Mu Brain-Kidney 그룹과 동일한 방식으로 비경혈 1, 2, 3을 선택하고 조작합니다(그림 1B).
참고: 비경혈은 경락을 따라 점 선택의 원리를 따르지 않기 때문에, 그리고 전통 중국 의학(Traditional Chinese Medicine, TCM) 이론과 장기간의 임상 관찰에 따르면, 이 세 가지 경혈은 희박자증 환자에게 치료 효과가 거의 없다24. (1) 비경혈 1: 팔꿈치 끝과 팔꿈치 안쪽 겨드랑이 사이의 선의 중간 지점에 위치합니다. 작동 : 찌르기 1-2 mm 스트레이트; (2) Non-acupoint 2: 상완골의 내측 상과와 척골 손목 사이의 중간 지점, 척골 가장자리에 위치합니다. 작동 : 찌르기 1-2 mm 스트레이트; (3) 비경혈 3: 팔 안쪽의 전방 삼각근과 이두근의 교차점에 위치합니다. 작동: 1-2mm 직선으로 찌르십시오.
- Shu-Mu Brain-Kidney 그룹과 동일한 방식으로 비경혈 1, 2, 3을 선택하고 조작합니다(그림 1B).
- L-카르니틴기
- 레보카르니틴 경구액을 1일 1회 연속 28일 동안 체중 10mL/kg의 용량으로 경구 위장으로 투여합니다(그림 1A).
- Shu-Mu 뇌-신장 그룹
- 안락사
- 처리 후에, 모든 쥐가 24 시간 동안 단식하는 것을 허용하고, 2% 펜토바르비탈 나트륨 (40 mg/kg 체중, 기관으로 승인되는 의정서에 따름)의 복강 내 주입에 의하여 그(것)들을 마취하고, 처분할 수 있는 정맥 주사 바늘을 사용하여 심장의 정점에서 혈액을 모으십시오21,24.
- 참수로 사망한 후 부고환의 한쪽 면을 제거하여 정액의 질을 측정합니다. 신장과 고환 조직을 적출하고, 무게를 측정하고 기록한 후 파라핀에 삽입하기 전에 실온에서 48시간 동안 파라포름알데히드 고정제로 고정합니다24.
2. 관측 지수
- 일반적인 관찰: 쥐의 정신 상태, 식단 및 배변 활동을 관찰하고 매일 체중을 모니터링합니다.
- 장기 계수: 사망 후 신장과 고환 조직 모두에서 표면 지방과 결합 조직을 조심스럽게 제거하고 일반 식염수로 헹구고 여과지로 건조시킨 다음 저울에 올려 무게를 측정하고 장기 계수 계산을 위한 측정값을 기록합니다. 장기 계수(%) = (장기 중량[g] / 체중[g]) x 100%.
- 정액의 질
- 과도한 지방을 제거한 후 각 쥐의 부고환 한쪽을 제거하고 37°C의 항온 수조에 5분 동안 놓습니다. 그런 다음 자르고, 여과하고, 부드럽게 불어 샘플을 잘 섞습니다.
- 희석된 정자 현탁액의 10μL 분취액을 예열된 계수판의 커버 유리 가장자리에 떨어뜨려 정자 현탁액이 계수실로 자동으로 침투할 수 있도록 합니다.
- CASA(Computer-Assisted Semen Analysis) 시스템을 사용하여 정자 수, 밀도, 생존율 및 운동성을 측정합니다21.
- Hematoxylin 및 Eosin (H&E) 염색
참고: 절차에 대한 자세한 내용은 Yang, N. et al.21을 참조하십시오.- 고정된 조직을 흐르는 물로 헹구고 탈수시킨 다음 삽입하십시오.
- 마이크로톰을 사용하여 파라핀 절편(5μm 두께)을 자르고 65°C에서 4시간 동안 굽습니다.
- 섹션을 디왁스하고 물로 다시 수화하십시오.
- 헤마톡실린 염색 용액으로 섹션을 3분 동안 염색한 다음 흐르는 물로 헹굽니다.
- 95% 에탄올로 단면을 1분 동안 탈수한 다음 에오신 용액으로 2분 동안 염색합니다.
- 슬라이드를 밀봉한 후 슬라이드 스캐너를 사용하여 스캔을 수행하고 이미지를 수집 및 분석합니다.
- 효소 결합 면역흡착 분석법(ELISA)
참고: 절차에 대한 자세한 내용은 Yang, N. et al.21을 참조하십시오.- 혈청을 준비하려면 해당 농도의 표준 물질과 혈청을 측정할 표준 물질 웰과 샘플 웰에 추가한 다음 효소 표지 시약을 추가합니다.
- 배양, 세척, 발색 및 종료 단계를 수행합니다.
- 효소 표지 기기를 사용하여 450nm 파장에서 흡광도를 측정하고 테스토스테론(T), 성선 자극 호르몬 방출 호르몬(GnRH), 인히빈 B(INHB), 황체 형성 호르몬(LH), 난포 자극 호르몬(FSH), 에스트라디올(E2) 및 프로락틴(PRL)의 발현 수준을 계산합니다.
3. 통계 분석
- 통계 소프트웨어를 사용하여 실험 데이터를 분석하고 각 그룹의 결과를 평균 ± 표준 편차(평균 ± SD)로 제시합니다.
- 일원 분산 분석(One-way ANOVA)을 사용하여 정규성과 분산의 동질성 가정을 충족하는 여러 그룹 간의 표본 평균을 비교합니다.
- 두 그룹 간의 비교에는 t-검정 을 사용하고, 위의 가정을 충족하지 않는 데이터에 대해서는 비모수 검정을 사용합니다.
- p가 0.05일 때 통계적으로 유의< 차이를 고려합니다.
결과
모델 평가
모델링 후 쥐의 무기력증, 웅크린 자세, 차가워진 팔다리, 먹는 것을 꺼리는 경감, 체중 감소, 소변량 증가, 묽은 변 및 일반적으로 신장 양 결핍 증후군과 일치하는 기타 증상을 관찰합니다.
해부 후 신장이 질기고 하얗고 무거운지 관찰한다. H&E 염색 결과 모델 쥐의 신장과 고환 조직이 심각하게 손상되어 불규칙한 사구체 모양, 신장 세뇨관 간질 염증, 많은 수의 상피 세포가 퇴행과 섬유증을 겪고 있음을 알 수 있습니다. 고환에 있는 더 많은 정액 세뇨관은 위축되고 변형되며, 무질서하거나 심지어 정자 생성 세포가 없는데(그림 2), 이는 성공적인 모델 확립을 나타냅니다.
쥐의 일반적인 상태
빈 그룹에서 쥐들은 좋은 정신, 민감한 반응, 윤기 나는 머리카락, 정상적인 식사와 배변을 보였습니다. 해부 후 그들의 신장은 적갈색으로 부드러워 보였습니다. 모델 그룹에서 쥐는 무기력, 웅크리고 있는 등, 몸이 차가워지고, 식욕 부진, 체중 감소(p < 0.001), 배뇨 증가, 묽은 변을 보였다. 해부 후 신장이 단단해졌고 "크고 하얀 신장"이 관찰되었습니다(그림 2A). 모델군과 비교했을 때, 위의 증상은 Shu-Mu Brain-Kidney 그룹에서 유의하게 개선되었고, 비경혈 그룹에서는 유의하게 개선되지 않았으며, L-카르니틴 그룹에서도 유의하게 개선되었다. 그룹 간의 체질량 비교는 그림 3에 나와 있습니다.
신장 및 고환 장기 계수
그림 4에서 볼 수 있듯이, 블랭크 그룹에 비해 모델 그룹에서 쥐의 신장 기관 계수는 유의하게 증가한 반면(p < 0.01), 양측 고환 장기 계수(p > 0.05)에서는 유의한 차이가 발견되지 않았는데, 이는 모델링 후 두 고환의 질이 모두 감소했음을 나타냅니다. 모델군과 비교했을 때, Shu-Mu Brain-Kidney 및 L-carnitine 군의 신장 장기 계수는 유의하게 감소하였으나(p < 0.05), 비경혈 군에서는 유의한 차이가 없었다(p > 0.05). Shu-Mu Brain-Kidney, L-carnitine, non-acupoint 그룹 간의 양측 고환 장기 계수는 모델 그룹(p > 0.05)과 비교하여 유의한 차이가 발견되지 않았는데, 이는 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 양측 고환 질량이 증가한 반면, 비경혈 그룹에서는 유의한 변화가 관찰되지 않았음을 나타냅니다.
정액 품질 분석
그림 5에서 볼 수 있듯이, blank 그룹에 비해 모델 그룹에서 정자 수, 밀도, 생존율 및 운동성이 유의하게 감소했습니다(p < 0.001). 모델군과 비교했을 때, Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 정자 수, 정자 밀도, 생존율 및 운동성이 유의하게 증가했으나(p < 0.001), 비경혈 그룹에서는 유의한 차이가 나타나지 않았다.
신장의 형태학적 변화
그림 6에서 볼 수 있듯이, 블랭크 그룹에 있는 쥐의 신장 조직은 완전한 구조와 정상적인 모양을 가지고 있었습니다. 사구체는 둥글고 꽉 차 있었고 신낭에 단단히 묶여 있었고 신세뇨관은 규칙적이고 깔끔하게 배열되어 있었습니다. 블랭크 그룹에 비해 모델 그룹은 심각한 신장 조직 손상, 불규칙한 사구체 형태, 위축, 감소, 심각한 신세뇨관 간질성 염증, 수많은 상피 세포의 변성 및 심각한 섬유증을 보였습니다. 모델 그룹과 비교했을 때, Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 신장 조직 손상 정도가 유의하게 개선되었으며, 사구체 모양이 더 규칙적이고, 신낭에서 약간 분리되며, 일부 세뇨관 상피 세포의 변성, 경미한 신장 세뇨관 간질 세포 침투 및 섬유증이 발생했습니다. 모델 그룹과 비교했을 때, 신장 조직 손상의 정도는 비경혈 그룹에서 덜 뚜렷했으며, 더 규칙적인 사구체 모양, 신장 캡슐로부터의 분리, 신장 세뇨관 상피 세포의 더 많은 변성 및 무질서, 사구체 주위 및 신장 세뇨관 간질의 중등도 염증 세포 침투, 더 많은 섬유증이 있었습니다.
고환의 형태학적 변화
그림 7에서 볼 수 있듯이, 블랭크 그룹에 있는 쥐의 고환은 완전한 조직 구조, 정상적인 형태, 깔끔한 정세관 및 규칙적인 정자 생성 세포를 가지고 있었습니다. 블랭크 그룹에 비해 모델 그룹에서 고환 조직 손상이 심각했으며, 정액 세뇨관의 위축과 변형이 더 심했으며, 정자 생성 세포가 무질서하거나 아예 없었습니다. 모델 그룹과 비교했을 때, Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 고환 조직 손상 정도가 유의하게 개선되었으며, 대부분의 정액 세뇨관이 깔끔하게 배열되어 있고 정자 생성 세포가 규칙적으로 배열되어 있었습니다. 모델 그룹과 비교했을 때, 비경혈 그룹에서는 고환 조직 손상 정도가 크게 감소하지 않았으며, 일부 정액 세뇨관은 위축 및 변형, 세포 괴사, 액포, 무질서하거나 부재한 정자 생성 세포를 보였다.
혈청 호르몬 수치 비교
그림 8에서 볼 수 있듯이, 혈청 내 테스토스테론(T), 성선 자극 호르몬 방출 호르몬(GnRH), 인히빈 B(INHB) 수치는 모델 그룹(p < 0.001)에서 감소한 반면, 황체 형성 호르몬(LH), 난포 자극 호르몬(FSH), 에스트라디올(E2) 및 프로락틴(PRL)은 증가(p < 0.001)했습니다. 모델 그룹과 비교했을 때, T, GnRH, INHB는 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 증가한 반면(p < 0.001), LH, FSH, E2, PRL 수치는 감소했지만(p < 0.001), 비경혈 그룹에서는 유의한 차이가 없었다.

그림 1: 실험 방법. (A) 구강 위장 절차. (B) 전기침술을 포함한 치료 방법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
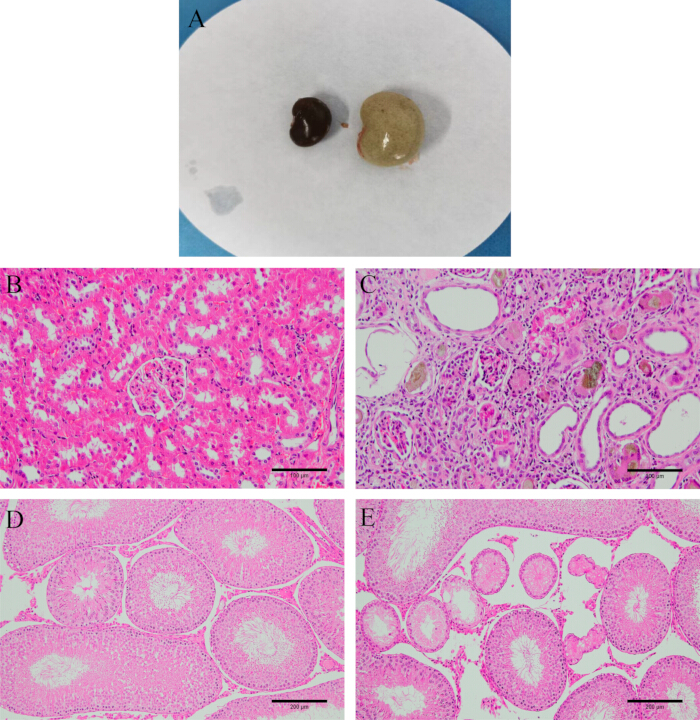
그림 2: 모델 검증. (A) 모델링 전과 후의 신장 모양. (B) 정상 신장 조직. (C) 모델링 후 신장 조직(HE 염색, 200x, 스케일 바: 100μm). (D) 정상 고환 조직. (E) 모델링 후 고환 조직(HE 염색, 100x, 스케일 바: 200μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 그룹 간 체질량 비교. B: 블랭크 그룹, M: 모델 그룹, S: Shu-Mu 뇌-신장 그룹, N: 비경혈 그룹, L: L-카르니틴 그룹. 데이터는 평균 ± 표준 편차(n = 3)로 표시됩니다. AP < 0.05, BP < 0.01, CP < 0.001, NSP > 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 그룹 간 신장 및 고환 장기 계수 비교. (A) 좌측 신장 장기 계수. (B) 우측 신장 기관 계수. (C) 좌측 고환 장기 계수. (D) 우측 고환 장기 계수. B: 블랭크 그룹, M: 모델 그룹, S: Shu-Mu 뇌-신장 그룹, N: 비경혈 그룹, L: L-카르니틴 그룹. 장기 계수(%) = 장기 중량(g) / 체중(g) × 100%. 데이터는 평균 ± 표준 편차(n = 3)로 표시됩니다. ap < 0.05, bp < 0.01, cp < 0.001, nsp > 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 그룹 간 정자의 질 비교. (A) 정자 수. (B) 정자 밀도. (C) 정자 생존율. (D) 정자 활동 비율. B: 블랭크 그룹, M: 모델 그룹, S: Shu-Mu 뇌-신장 그룹, N: 비경혈 그룹, L: L-카르니틴 그룹. 정자 생존율(%) = 운동성 정자 수 / 총 정자 수 × 100%. 데이터는 평균 ± 표준 편차(n = 3)로 표시됩니다. ap < 0.05, bp < 0.01, cp < 0.001, nsp > 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 각 그룹에서 신장의 형태학적 변화. (HE 염색, 200×, 스케일 바: 100μm). 검은색 화살표는 사구체, 녹색 화살표는 신세뇨관, 노란색 화살표는 염증 세포, 파란색 화살표는 섬유증을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
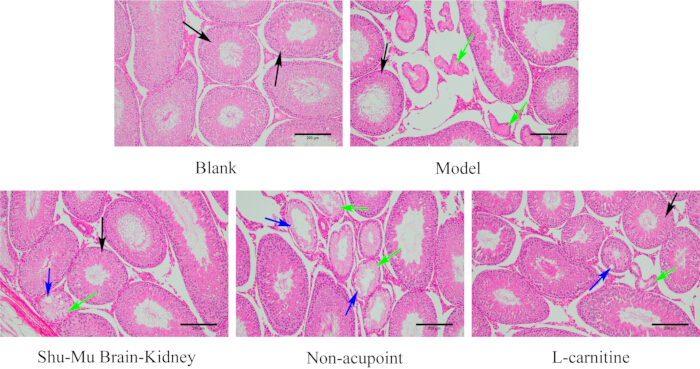
그림 7: 각 그룹의 고환에서 형태학적 변화. (HE 염색, 100×, 스케일 바 : 200 μm). 검은색 화살표는 정상적인 정세관을 나타내고, 녹색 화살표는 괴사를 나타내고, 파란색 화살표는 액포를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 그룹 간 혈청 호르몬 수치 비교. (A) 혈청 테스토스테론(T) 수치. (B) 혈청 GnRH 수치. (C) 혈청 LH 수치. (D) 혈청 FSH 수치. (E) 혈청 E2 수치. (F) 혈청 INHB 수치. (G) 혈청 PRL 수치. B: 블랭크 그룹, M: 모델 그룹, S: Shu-Mu 뇌-신장 그룹, N: 비경혈 그룹, L: L-카르니틴 그룹. 데이터는 평균 ± 표준 편차(n = 3)로 표시됩니다. ap < 0.05, bp < 0.01, cp < 0.001, nsp > 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
한의학의학에서 "신장(kidney)"은 현대 의학에서 비뇨기계의 기능을 지칭하는 "내부 신장(inner kidney)"과 시상하부-뇌하수체-생식선(hypothalamic-druitary-donnadal axis) 및 해부학적 외부 생식 기관을 의미하는 "외부 신장(outer kidney)"으로 구성된다25. 남성의 정낭은 "바깥쪽 신장(outer kidney)"에 속하며, 그 구성 요소에는 고환(testes), 부고환(epididymides), 정낭(seminal vesicles) 등이 포함된다26. 한의학은 진액을 인체의 물질적 근간으로 간주하며, '신장 진액'은 부모로부터 물려받은 '태아기 진액'과 비장과 위장에서 수분과 곡물 진액이 변형되어 생성되는 '산후 진액'을 의미하며, 이 진액은 5개의 내장과 6개의 장에 영양을 공급하는 데 사용됩니다. 그 중에서도 태아의 본질은 배아를 구성하는 본래의 물질이며 생명의 기초입니다. 산후 진액은 5개의 내장과 6개의 장의 진액을 풍부하게 하고 나머지 부분은 신장에 저장됩니다. 이 둘은 상호 의존적이며 신장에서 밀접하게 결합되어 "신장 에센스"를 형성합니다. 신장 정수가 불충분하면, 즉 정낭이 가득 찰 수 없으면 "올리고스페르미아"로 이어집니다. 생식 정수가 정상적으로 배출될 수 있다면, 즉 정낭이 정자를 생산, 저장 및 배출하는 기능을 발휘할 수 있다면, 그것은 신장의 떫은맛과 신장의 양(陽)의 흥분성 성질이 상호 조화를 이룬 결과입니다. 신장양이 결핍되고 약하면 수렴 기능이 과도하게 수행되고 흥분 기능이 불충분하여 냉증과 "무안정정자증"이 발생합니다. 따라서 희박종무정자증의 증상은 한의학의학 증후군의 유형인 "신장 본질 결핍 및 신장 양 결핍"에 해당합니다. 이 실험에서 모델링된 모든 쥐는 기본적으로 신장-양 결핍형 희소무안정정자증의 징후를 충족했으며, 치료는 "신장을 강화하고, 양을 돕고, 진수를 채우고, 골수에 영양을 공급"하는 데 중점을 두어야 합니다. Shu-Mu Brain-Kidney Acupoint를 위한 Epangsanxian, Shenshu, Jingmen 및 Taixi의 조합은 음과 양을 조정하고 신장과 뇌를 연결하여 궁극적으로 "음양 균형"의 목적을 달성할 수 있습니다.
정자형성은 HPT 축의 내분비 활성에 의해 조절되며, HPT 축의 조절은 주로 시상하부, 뇌하수체 및 고환에서 발현되는 관련 호르몬 및 수용체 유전자에 의존합니다27, 이는 주로 시상하부에서 GnRH의 박동 방출에 의해 지배됩니다. 이것은 뇌하수체 전엽을 자극하여 LH, FSH 및 PRL11을 분비하도록 합니다. 그 중에서도 GnRH는 HPT 축의 가장 중요한 조절자이며, 그 수준은 HPT 축의 상태와 고환의 정자 생산 능력을 간접적으로 반영할 수 있습니다28. LH는 고환 기질 세포에서 T의 방출을 매개하며, 정자의 발생은 T의 자극에 따라 달라집니다. T 분비가 부족하면 정자의 수와 질이 떨어집니다29. FSH는 Sertoli 세포 표면의 수용체에 결합하여 T와 함께 작용하여 정자 형성의 증식을 촉진하고 정자 형성을 유지하기 위해 INHB를 생성합니다30. 고환 세르톨리 세포와 생식 세포에서 합성된 당단백질인 INHB는 남성 생식선의 중요한 조절자이며, 이는 차례로 뇌하수체를 활성화하여 FSH를 생성하고 FSH와 상호 작용하여 HPT 축 31,32,33을 공동으로 조절할 수 있습니다. 그러나 PRL은 정자 운동성에 영향을 미치는 중요한 요인이다34. 과도한 PRL은 생식선 축의 분비를 억제하여 정자 형성을 억제할 수 있다35. E2는 생식선과 뇌에서 분비되며 LH 및 FSH에 부정적인 피드백 효과가 있습니다36. 높은 E2 수치는 세르톨리 세포와 고환 간질 세포를 손상시키고, 주변 결합 조직의 지방증을 유발하며, 남성 정액 세뇨관의 직경을 축소시켜 환자의 생식 능력을 손상시킨다37. Tripterygium wilfordii에 의해 유도된 올리가스테노스페르미아 쥐에서 FSH 및 LH의 혈청 수치가 모델링 후 유의하게 증가한 것으로 밝혀졌습니다. Qilin Pill로 60일 동안 치료한 후 이 두 호르몬의 수치는 모델 그룹38에 비해 크게 감소했으며 이는 본 연구의 결과와 일치했습니다. 다른 연구에서는 아데닌에 의해 신장 양 결핍 증후군이 있는 쥐에서 HPT 축 기능 장애가 발생하며, 관련 성호르몬 분비 수치도 변화한다는 것을 보여주었다39.
이 연구에서 블랭크 그룹에 비해 모델 그룹의 쥐는 일반적으로 상태가 좋지 않았고 정액의 질이 현저히 떨어졌습니다(p < 0.001). H&E 염색 결과 신장과 고환 조직이 심각하게 손상되었는데, 이는 아데닌 조절 쥐가 희소고정정자증의 기준을 충족한다는 것을 나타냅니다. 모델 그룹과 비교했을 때, 위의 조건은 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 유의하게 개선된 반면(p < 0.05), 비경혈 그룹에서는 개선이 유의하지 않았는데, 이는 Shu-Mu Brain-Kidney 및 L-carnitine 그룹에서 정자의 질과 장기 형태 및 구조가 개선되었음을 나타냅니다. 블랭크 그룹과 비교했을 때, 모델 그룹에서 T, GnRH 및 INHB가 감소(p < 0.001)했는데, 이는 성공적인 모델링 후 희소점정자증 쥐에서 T, GnRH 및 INHB를 분비하는 능력이 감소했음을 나타냅니다. LH, FSH, E2 및 PRL이 모두 증가했는데(p < 0.001), 이는 성공적인 모델링 후 LH, FSH, E2 및 PRL의 분비가 증가하여 고환 정자 생성 기능이 약화되었음을 나타냅니다. 모델군과 비교했을 때, Shu-Mu Brain-Kidney 및 L-carnitine 투여군에서는 T, GnRH, INHB< INHB가 증가한 반면(p < 0.001), LH, FSH, E2 및 PRL 분비 수치는 감소했으나(p 0.001), 비경혈 투여군에서는 유의한 차이가 발견되지 않았다. 이는 전기침술과 L-카르니틴이 모두 쥐의 HPT 축의 호르몬 수치를 조절할 수 있고 쥐의 희소점정자증을 개선하는 데 좋은 효과를 발휘할 수 있음을 보여줍니다.
L-카르니틴은 세포 에너지 대사에 참여하고 정자의 항산화 손상을 줄일 수 있는 포유류의 천연 항산화제입니다40. 수많은 연구에서 L-카르니틴이 정자 운동성, 형태 및 농도를 크게 개선하는 동시에 HPT 축 관련 호르몬 수치를 증가시킬 수 있다는 사실이 입증되었습니다41. 이 실험에서 L-카르니틴은 Shu-Mu Brain-Kidney 그룹과 비교하기 위해 양성 약물 대조군으로 사용되었습니다. 실험 데이터는 두 그룹 간의 다양한 지표 비교에서 큰 차이가 없음을 보여주었으며, "Epangsanxian, Shenshu, Jingmen 및 Taixi"에서의 전기 침술이 희박고무정자증 쥐에게 좋은 영향을 미쳤음을 확인했습니다. 더욱이, 침술은 내장의 음과 양을 조정하고 신체의 건강한 기를 강화하여 병원성 기에 저항할 수 있으므로 안전하고 효과적이며 독성이 적고 부작용이 적습니다. 전기침술은 일반 침술보다 치료 효과를 더 높일 수 있으며, 희석고정정자증의 임상적 관리를 위한 안전하고 효과적인 치료를 제공할 수 있습니다. 경혈이 없는 그룹의 쥐는 경락을 따라 점 선택의 원리를 따르지 않았기 때문에 다양한 실험 데이터가 Shu-Mu Brain-Kidney 그룹의 데이터와 크게 달랐으며, "Epangsanxian, Shenshu, Jingmen, Taixi"의 4가지 점의 호환성의 중요성을 확인했습니다.
요약하면, "Epangsanxian, Shenshu, Jingmen 및 Taixi"의 4개 지점에서의 전기 침술은 관련 호르몬 수준을 조절하여 쥐의 HPT 축의 기능을 향상시킬 수 있으며, 이를 통해 쥐의 정자 품질을 개선하고 궁극적으로 희소고정정자증 치료의 목적을 달성할 수 있습니다. 그것은 oligonasthenospermia의 임상 관리를 위한 또 다른 안전하고 효과적인 치료법을 제공합니다.
그러나 기술과 자금이 부족하여 본 연구는 HPT 축의 혈청 호르몬 수치 연구에 국한되었고 검출 방법도 제한적이었습니다. 향후 실험에서는 크로마토그래피와 같은 다양한 수단을 사용하여 호르몬 수치의 변화를 추가로 검증하고 전사체학 또는 대사체학을 사용하여 유전자 수준 및 그 이상에서 전기 침술에 의한 HPT 축 조절에 대한 추가 연구를 수행하는 것을 고려할 것입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 닝샤 후이족자치구의 핵심 연구 개발 프로젝트(2021BEG02041), 남성 생식 기능 장애 치료에서 "시상하부-뇌하수체-고환 축"을 조절하는 침술 요법의 경혈 호환성에 대한 증거 기반 평가 및 임상 연구의 지원을 받았습니다. 프로젝트 리더: Huisheng Ma; 2024 일급 분야 건설 프로젝트(ZY0019110305), 프로젝트 리더: Huisheng Ma; 중국의학원(YZ-202128), 프로젝트 리더: Huisheng Ma.
자료
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
참고문헌
- Punab, M., et al. Causes of male infertility: A 9-year prospective monocentre study on 1737 patients with reduced total sperm counts. Hum Reprod. 32 (1), 18-31 (2017).
- Nordkap, L., Joensen, U. N., Blomberg Jensen, M., Jørgensen, N. Regional differences and temporal trends in male reproductive health disorders: Semen quality may be a sensitive marker of environmental exposures. Mol Cell Endocrinol. 355 (2), 221-230 (2012).
- Daneshmandpour, Y., et al. MicroRNAs association with azoospermia, oligospermia, asthenozoospermia, and teratozoospermia: A systematic review. J Assist Reprod Genet. 37 (4), 763-775 (2020).
- Cipriani, S., et al. Trend of change of sperm count and concentration over the last two decades: A systematic review and meta-regression analysis. Andrology. 11 (6), 997-1008 (2023).
- Agarwal, A., et al. Male infertility. Lancet. 397 (10271), 319-333 (2021).
- Jensen, C. F. S., Fode, M., Østergren, P. B., Sønksen, J. A refined view on the association between y-chromosome microdeletions and sperm concentration. Eur Urol. 76 (5), 637-638 (2019).
- Pivonello, R., et al. Metabolic disorders and male hypogonadotropic hypogonadism. Front Endocrinol (Lausanne). 10, 345(2019).
- Guiton, R., Drevet, J. R. Viruses, bacteria and parasites: Infection of the male genital tract and fertility. Basic Clin Androl. 33 (1), 19(2023).
- Beeder, L. A., Samplaski, M. K. Effect of antidepressant medications on semen parameters and male fertility. Int J Urol. 27 (1), 39-46 (2020).
- Babalola, A. A., et al. Attenuation of doxorubicin-induced hypothalamic-pituitary-testicular axis dysfunction by diphenyl diselenide involves suppression of hormonal deficits, oxido-inflammatory stress and caspase 3 activity in rats. J Trace Elem Med Biol. 79, 127254(2023).
- Yang, Y., et al. Nickel chloride induces spermatogenesis disorder by testicular damage and hypothalamic-pituitary-testis axis disruption in mice. Ecotoxicol Environ Saf. 225, 112718(2021).
- Alahmar, A. T., Naemi, R. Predictors of pregnancy and time to pregnancy in infertile men with idiopathic oligoasthenospermia pre- and post-coenzyme q10 therapy. Andrologia. 54 (5), e14385(2022).
- Seiler, F., Kneissl, P., Hamann, C., Jünemann, K. P., Osmonov, D. Laparoscopic varicocelectomy in male infertility: Improvement of seminal parameters and effects on spermatogenesis. Wien Klin Wochenschr. 134 (1-2), 51-55 (2022).
- Cui, T. W., et al. Effect of electroacupuncture on spermatogenesis in rats with oligozoospermia of insufficiency of shen (kidney) essence syndrome. Chin J Integr Med. 25 (4), 292-297 (2019).
- Wang, Z., et al. Efficacy and safety of nonpharmacological strategies for the treatment of oligoasthenospermia: A systematic review and bayesian network meta-analysis. Eur J Med Res. 28 (1), 6(2023).
- Chuang, H. -N., et al. Effect of injecting adipose stem cells combined with platelet-rich fibrin released at Shenshu acupoint (BL23) on acute kidney injury in rabbits. Front Pharmacol. , 16(2025).
- Fu, C., et al. Acupuncture improves peri-menopausal insomnia: A randomized controlled trial. Sleep. 40 (11), (2017).
- Li, C. R., et al. Effects of acupuncture at taixi acupoint (ki3) on kidney proteome. Am J Chin Med. 39 (4), 687-692 (2011).
- Ma, L. Acupuncture treatment of kidney deficiency and essence deficiency based on the theory of kidney storing essence' clinical study of oligoasthenospermia. , (2023).
- Sheng, W., Xu, W., Hu, H., Xiao, D., He, Q. Effects of tortoise-shell glue on rat oligoasthenospermia model. Chin Med J (Engl). 135 (6), 732-734 (2022).
- Yang, N., et al. Transcriptomic analysis of the HPT axis in a model of oligoasthenozoospermia induced by adenine in rats. Exp Mol Pathol. 141, 104948(2025).
- Hongyu, L., et al. Assessment of electroacupuncture therapy with distant-approximal acupoints based on the HPT axis in rats with oligoasthenospermia through transcriptomic analysis. Reprod Sci. , (2025).
- Adachi, Y., et al. Influence of adenine-induced chronic renal failure on testicular function in the rat. Andrologia. 30 (2), 115-118 (1998).
- Zhao, Z., et al. Regulatory mechanism of electroacupuncture on hypothalamic-pituitary-testicular axis in oligospermic rats. Chin J Tissue Eng Res. 29 (26), 5563-5571 (2025).
- Chen, Y., Han, Z., Sun, Z., Huang, F. Analysis of male reproduction based on the "inner kidney and outer kidney" theory advanced by nation-famous Chinese medicine Professor XU Fu-song. Nat J Androl. 30 (02), 163-166 (2024).
- Ma, D., et al. Biological basis of premature ejaculation based on Theory of "Brain-heart-kidney-semen Chamber" Axis. Ch J Exp Tradit Med Formul. 30 (10), 203-209 (2024).
- Qi, L., et al. Toxic effects of ketamine on reproductive system via disrupting hypothalamic-pituitary-testicular axis. Eur Rev Med Pharmacol Sci. 21 (8), 1967-1973 (2017).
- Ryan, G. E., et al. Androgen receptor positively regulates gonadotropin-releasing hormone receptor in pituitary gonadotropes. Mol Cell Endocrinol. 530, 111286(2021).
- Jasuja, R., et al. Modulation of circulating free testosterone fraction by testosterone, dihydrotestosterone, and estradiol during testosterone replacement therapy. Andrology. 13 (3), 439-436 (2024).
- Dimmick, H., Kumar, T. R. Follicle-stimulating hormone. Trends Endocrinol Metab. 35 (9), 848-849 (2024).
- Negri, F., et al. The importance of discordant follicle stimulating hormone and inhibin b levels in primary infertile men: Findings from a cross-sectional study. World J Mens Health. 43 (1), 134-141 (2025).
- Li, J., et al. Development of a nomogram to predict fertilisation rate of infertile males with borderline semen by using semen parameters combined with AMH and INHB. Andrologia. 53 (9), e14182(2021).
- Liu, L., et al. Relationship between semen parameters, serum INHB, and insl-3 levels, and the degree of varicocele. Clinics (Sao Paulo). 79, 100339(2024).
- Akhigbe, R. E., Hamed, M. A., Odetayo, A. F. Haart and anti-koch's impair sexual competence, sperm quality, and offspring quality when used singly and in combination in male Wistar rats. Andrologia. 53 (2), e13951(2021).
- Liu, Y., Wang, G., Zhang, F., Dai, L. Correlation between serum levels of reproductive hormones and testicular spermatogenic function in men with azoospermia. Andrologia. 54 (10), e14182(2022).
- Russell, N., Grossmann, M. Mechanisms in endocrinology: Estradiol as a male hormone. Eur J Endocrinol. 181 (1), R23-R43 (2019).
- Leavy, M., et al. Effects of elevated β-estradiol levels on the functional morphology of the testis - new insights. Sci Rep. 7, 39931(2017).
- Jiao, W., et al. Improvement of qilin pills on male reproductive function in tripterygium glycoside-induced oligoasthenospermia in rats. Andrologia. 53 (4), e13923(2021).
- Zeng, Y., et al. Effects of Haima Duobian pill in a rat model of kidney yang deficiency syndrome. Evid Based Complement Alternat Med. 2021, 6696234(2021).
- Kooshesh, L., Nateghian, Z., Aliabadi, E. Evaluation of l-carnitine potential in improvement of male fertility. J Reprod Infertil. 24 (2), 69-84 (2023).
- Ma, L., Sun, Y. Comparison of l-carnitine vs. Coq10 and vitamin E for idiopathic male infertility: A randomized controlled trial. Eur Rev Med Pharmacol Sci. 26 (13), 4698-4704 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유