Method Article
Shu-Mu 脑肾穴位 经 下丘脑-垂体-睾丸轴治疗大鼠少弱精症的机制
摘要
本研究旨在验证淑睑脑肾穴对大鼠少弱精症的治疗效果,并通过下丘脑-垂体-睾丸 (HPT) 轴探讨其潜在机制。
摘要
少弱精症是男性不育症的常见原因。下丘脑-垂体-睾丸 (HPT) 轴通过生殖激素的合成和释放来调节性腺分化和成熟,在男性生育能力中起着至关重要的作用。破坏 HPT 轴稳定性会损害精子的产生,从而降低精液质量。研究电针对 HPT 轴调节的影响可能为治疗少弱精症提供见解。将 50 只 8 周龄雄性 SD 大鼠随机分为空白组、模型组、Shu-Mu 脑肾组、非穴位组和 L-肉碱组 (每组 n = 10)。除空白组外,大鼠胃内接受腺嘌呤 28 d 建立模型。造模后,Shu-Mu 脑肾组在指定穴位接受电针治疗,非穴位组每天接受 30 min 的假治疗。左旋肉碱组接受左旋肉碱 (10 mL/kg) 灌胃,每日 1 次。治疗持续 28 天。评估一般情况、器官系数和精液质量。HE 染色分析组织形态,ELISA 检测血清激素变化。与模型组相比,Shu-Mu Brain-Kidney 和 L-carnitine 组在精神、饮食和排便方面表现出显着改善,体重增加,而非穴位组没有显着变化。Shu-Mu 脑肾组和 L-肉碱组肾器官系数显著降低,但非穴位组保持不变。睾丸器官系数显示治疗组间无显著差异。Shu-Mu 脑肾组和 L-肉碱组的精子数量、密度、存活率和活力率显着提高,但非穴位组没有。H&E 染色显示 Shu-Mu 脑肾和 L-肉碱组的肾脏和睾丸组织损伤得到改善。ELISA 显示这些组 T 、 GnRH 和 INHB 升高,LH 、 FSH 、 E2 和 PRL 水平降低 (p < 0.001),非穴位组无显著变化。这些发现表明,Shu-Mu 脑肾穴位疗法通过调节 HPT 轴来提高精子质量,为少弱精子症提供了潜在的治疗方法。
引言
少弱精症分为“少精症”和“弱精症”,是男性不育症的常见类型之一,发病率约占男性不育病例的 75%1。少弱精症的主要特征是睾丸中精子密度和活力降低,临床上主要表现为精子发生障碍、精子数量减少和精子活力低下 2,3。近年来,少弱精症的发病率逐年增加4 年。如果不进行有效治疗,将对患者的身心健康甚至家庭和谐产生长期的不利影响5。研究表明,遗传问题6(genetic problems)、生殖内分泌失调7(reproductive endocrine disorders)、泌尿生殖道感染8(urogenital tract infections)和化学药物9(chemical drugs)会影响精子的产生和成熟,导致精液质量下降。目前,提高受损精子的质量已成为医学领域的一个具有挑战性的问题。
下丘脑-垂体-睾丸 (HPT) 轴是体内生殖调节的主要途径,可通过刺激下丘脑、垂体和睾丸相关的生殖激素的合成和释放来调节性腺的分化和成熟,在维持正常的男性生殖功能方面发挥着重要作用10.如果 HPT 轴功能的稳定性被破坏,将导致睾丸分泌不足,无法达到生理浓度的睾丸激素,导致睾丸中精子的数量和质量下降11。因此,少弱精子症的治疗主要目的是调节 HPT 轴的功能,达到维持相关内分泌激素平衡的目的,从而增加精液中精子的数量,增强精子活性,提高精液质量。
在少弱精子症的临床治疗中,现代医学主要采用手术和抗氧化、增强精子活力的药物等方法12,13,而电针疗法则结合了传统中医针灸和现代医学生物电。它具有快速准确、疗效明显、不良反应少、适用疾病范围广、治疗费用低等优点,对少弱精子症有很好的治疗效果14,15。“背是阳,腹是阴。”蜀木穴组合将蜀穴与穆穴相结合,一前一后,一阴一阳,共同作用,又称前后穴位组合法。中医 (TCM) 认为肾脏是产前精华的根,疾病位于肾脏。选择肾前牟穴荆门(GB25)和后蜀穴(BL23),具有暖肾、助阳、阴内寻阳的作用16,17;肾储精支配骨髓生产,大脑是骨髓的海洋和所有阳的交汇处,太溪(KI3)是足少阴肾经的源点,可以调理补肝补肾,养阴,生成骨髓18。与益散仙 (MS4) 结合,连肾健脑,体现了中医19 中“淑木脑肾穴结合”的思路,治疗效果比普通针灸更明显。
目前关于精液质量的治疗研究主要集中在改善睾丸结构和功能上,而对下丘脑-垂体-睾丸 (HPT) 轴20 不同组织中血清激素水平的调节进行了有限的研究。在初步研究中,使用 RNA 测序 (RNA-Seq) 鉴定健康大鼠和腺嘌呤诱导的少精症模型大鼠下丘脑、垂体和睾丸组织内参与精液质量调节的候选基因和调控途径21。此外,对两组进行精液质量检测和睾丸组织组织学分析。这些发现为腺嘌呤诱导的少弱精症大鼠精液质量的分子机制提供了见解。远近穴位电针治疗可通过调节 HPT 轴改善少弱精症大鼠精子质量,其效果与氧化应激过程有关22。然而,尚不清楚 Shu-Mu 脑肾穴是否可以通过调节 HPT 轴来提高大鼠的精液质量。为进一步探讨改善少弱精症大鼠精液质量的调控机制及有效治疗方法,本研究采用腺嘌呤诱导的少弱精症大鼠模型,选取散三仙、神书、荆门、太溪4个穴位,从HPT轴方面探讨蜀木脑肾穴对大鼠少弱精症治疗作用的相关机制, 为临床治疗提供更科学的依据。
研究方案
所有动物实验均由宁夏医科大学动物伦理委员会审核通过(批准号:IACUC-NYLAC-2021-130)。该研究严格按照 ARRIVE 动物实验指南 2.0 进行,并遵守 NIH 实验动物护理和使用指南中描述的动物福利原则。这项随机对照动物研究采用单因素方差分析,于 2023 年 3 月至 5 月在宁夏医科大学动物实验中心进行。本研究采用体重 180-220 g 的 8 周龄 SPF 级雄性 SD 大鼠。所用试剂和设备的详细信息列在 材料表中。
1. 动物模型的建立和处理程序
- 实验动物和群体
- 获得 50 只体重为 180-220 克的 8 周龄 SPF 级雄性 SD 大鼠。
- 在标准条件下饲养所有大鼠,保持 22-25 °C 的室温,50%-60% 的湿度,并免费提供标准啮齿动物饲料和水。
- 适应一周后,使用随机数字表方法将大鼠随机分为空白 (B) 组 (n = 10) 和建模组 (n = 40)。空白组给予生理盐水,通过口服强饲法给予腺嘌呤给建模组。
- 28 天后,将建模组随机分为模型 (M) 组、Shu-Mu 脑肾 (S) 组、非穴位 (N) 组和 L-肉碱 (L) 组 (每组 n = 10)。不处理模型组。
- 使用 Shu-Mu 脑肾穴位匹配方法对 Shu-Mu 脑肾组进行电针干预。对非穴位组进行非穴位治疗,对左旋肉碱组进行管饲法给予左旋肉碱口服液。连续治疗所有组 28 天。
- 模型构建
注意:研究表明,高剂量的腺嘌呤会影响大鼠的睾丸功能,导致性激素分泌异常,破坏 HPT 轴的功能稳定性,以及精子质量下降23。因此,腺嘌呤通常用于建立雄性动物不育模型。- 通过口服强饲法向空白组施用生理盐水(1 mL/100 g 体重),向模型组施用腺嘌呤(20 mg/100 g 体重)(图 1A)。
- 确保在管饲过程中持续搅拌,以防止腺嘌呤沉淀和管饲针堵塞。每天一次治疗,持续 28 天。
- 1.3 处理程序
- Shu-Mu 脑肾组
- 在建模后的第一天开始干预。使用一次性无菌针灸针对双侧穴位进行针刺。固定大鼠后,对穴位进行暴露和消毒。
- 左手固定穴位皮肤,右手用一次性无菌针灸针快速刺穿穴位。连接电刺激器。以 2 Hz 的电针频率、1.5 mA 的刺激强度和局部肌肉的轻微震颤施加扩张波。
- 每次进行电针治疗 30 分钟,每天一次,连续 28 天(图 1B)。
注:参考唐勇的 《实验针灸科学》附录 II,“实验动物常用的穴位”,结合比较解剖穴位选择法19 选择大鼠的穴位。选择以下点:(1) Epangsanxian (MS4):位于头尾点下方 3 mm 和外侧 4 mm。作:直刺 1-2 mm;(2) 神书 (BL23):位于脊柱区,第二腰椎下棘突两侧,正中背线旁 6 mm。作:直刺 6 mm;(3)荆门(GB25):位于侧腰部,下侧第 13 肋的自由端。作:直刺 1-2 mm;(4) 太西 (KI3):位于足内侧,踝内侧高点与跟腱后缘之间的凹陷处。作:直刺 3 mm。
- 非穴位组
- 以与 Shu-Mu 脑肾组相同的方式选择和作非穴位 1、2 和 3(图 1B)。
注:由于非穴位不遵循沿经络择点的原则,根据中医理论和长期临床观察,这三个穴位对弱精子症患者治疗效果不大24。(1) 非穴位 1:位于肘部内侧肘尖和腋窝之间的线的中点。作:直刺 1-2 mm;(2) 非穴位 2:位于肱骨内上髁和尺骨腕部之间的中点,尺骨边缘。作:直刺 1-2 mm;(3) 非穴位 3:位于手臂内侧三角肌前肌和二头肌的交汇处。作:直刺 1-2 毫米。
- 以与 Shu-Mu 脑肾组相同的方式选择和作非穴位 1、2 和 3(图 1B)。
- 左旋肉碱基团
- 通过口服强饲法以 10 mL/kg 体重的剂量施用左旋肉碱口服液,每天一次,连续 28 天(图 1A)。
- Shu-Mu 脑肾组
- 安乐死
- 治疗后,让所有大鼠禁食 24 小时,通过腹膜内注射 2% 戊巴比妥钠 (40 mg/kg 体重,遵循机构批准的方案) 麻醉它们,并使用一次性静脉采血针从心尖采集血液21,24。
- 斩首死亡后,去除附睾的一侧以测量精液质量。收获肾脏和睾丸组织,称重并记录,并在室温下用多聚甲醛固定剂固定 48 小时,然后将它们包埋在石蜡24 中。
2. 观测指数
- 一般观察:观察大鼠的精神状态、饮食和排便情况,并每天监测它们的体重。
- 器官系数:死后,小心地去除肾脏和睾丸组织的表面脂肪和结缔组织,用生理盐水冲洗,用滤纸擦干,在天平上称重,并记录测量值以计算器官系数。器官系数 (%) =(器官重量 [g] / 体重 [g]) x 100%。
- 精液质量
- 去除多余的脂肪后,取出每只大鼠的附睾一侧并将其置于 37 °C 的恒温水浴中 5 分钟。然后,切割、过滤、轻轻吹动并充分混合样品。
- 取 10 μL 稀释的精子悬液等分试样,将其滴到预热的计数板的盖玻片边缘,让精子悬液自动渗透到计数室中。
- 使用 CASA(计算机辅助精液分析)系统测量精子数量、密度、存活率和活力率21。
- 苏木精和伊红 (H&E) 染色
注:有关该程序的详细信息,请参阅 Yang, N. et al.21。- 用流水冲洗固定的组织,脱水,然后包埋。
- 使用切片机切下石蜡切片(5 μm 厚),并在 65 °C 下烘烤 4 小时。
- 对切片脱蜡并用水重新水化。
- 用苏木精染色液对切片染色 3 分钟,然后用流水冲洗。
- 用 95% 乙醇将切片脱水 1 分钟,然后用伊红溶液染色 2 分钟。
- 密封载玻片后,使用载玻片扫描仪进行扫描,并收集和分析图像。
- 酶联免疫吸附测定 (ELISA)
注:有关该程序的详细信息,请参阅 Yang, N. et al.21。- 为了制备血清,将相应浓度的标准物质和血清加入到标准物质孔和待测样品孔中,然后加入酶标记试剂。
- 执行孵育、洗涤、显色和终止步骤。
- 使用酶标记仪器测定 450 nm 波长处的吸光度,并计算睾酮 (T)、促性腺激素释放激素 (GnRH)、抑制素 B (INHB)、黄体生成素 (LH)、卵泡刺激素 (FSH)、雌二醇 (E2) 和催乳素 (PRL) 的表达水平。
3. 统计分析
- 使用统计软件分析实验数据,并将每组的结果表示为平均值±标准差 (平均值± SD)。
- 使用单因子方差分析可以比较满足方差正态性和同质性假设的多个组之间的样本均值。
- 使用 t 检验 进行两组之间的比较,对不满足上述假设的数据使用非参数检验。
- 当 p < 0.05 时,考虑具有统计显著性的差异。
结果
模型评估
造模后观察大鼠有无嗜睡、蹲伏姿势、四肢冰冷、不愿进食、体重减轻、尿量增加、稀便等症状,这些症状通常与肾阳虚证相符。
解剖后,观察肾脏坚韧、洁白且较重。H&E 染色显示模型大鼠的肾脏和睾丸组织损伤严重,肾小球形状不规则,肾小管间质炎症,大量上皮细胞变性甚至纤维化。睾丸中更多的生精小管萎缩和变形,生精细胞无序甚至缺失(图 2),表明模型建立成功。
大鼠的一般情况
空白组大鼠精神好,反应敏感,毛发有光泽,进食排便正常。解剖后,他们的肾脏呈红棕色且柔软。在模型组中,大鼠表现出嗜睡、蹲背、身体冰冷、食欲不振、体重减轻 (p < 0.001)、排尿增加和稀便。解剖后,他们的肾脏很坚韧,观察到“大白肾”外观(图 2A)。与模型组相比,Shu-Mu 脑肾组上述症状明显改善,非穴位组无明显改善,左旋肉碱组也有明显改善。各组之间的体重比较如图 3 所示。
肾和睾丸器官系数
如图 4 所示,与空白组相比,模型组大鼠的肾器官系数显著增加 (p < 0.01),而双侧睾丸器官系数无显著差异 (p > 0.05),表明造模后两个睾丸的质量下降。与模型组相比,Shu-Mu Brain-Kidney 和 L-肉碱组的肾器官系数显著降低 (p < 0.05),但非穴位组未发现显著差异 (p > 0.05)。与模型组相比,Shu-Mu 脑肾组、L-肉碱组和非穴位组的双侧睾丸器官系数无显著差异 (p > 0.05),表明Shu-Mu 脑肾组和 L-肉碱组双侧睾丸质量增加,而非穴位组未观察到显着变化。
精液质量分析
如图 5 所示,与空白组相比,模型组的精子数量、密度、存活率和活力率显着降低 (p < 0.001)。与模型组相比,Shu-Mu 脑肾组和 L-肉碱组的精子数量、精子密度、存活率和活力率显著增加 (p < 0.001),但在非穴位组中未发现显着差异。
肾脏的形态变化
如图 6 所示,空白组大鼠的肾组织结构完整,形状正常。肾小球圆而饱满,与肾包膜紧密结合,肾小管规则且排列整齐。与空白组相比,模型组表现为严重的肾组织损伤、肾小球形态不规则、萎缩、缩小、严重的肾小管间质炎症、大量上皮细胞变性、严重纤维化。与模型组相比,Shu-Mu Brain-Kidney 和 L-carnitine 组肾组织损伤程度显著改善,肾小球形状更规则,与肾包膜轻微分离,少数肾小管上皮细胞变性,肾小管间质细胞浸润和纤维化轻度。与模型组相比,非穴位组肾组织损伤程度不太明显,肾小球形状更规则,与肾包膜分离,肾小管上皮细胞变性和无序性增多,肾小球周围和肾小管间质内有中度炎性细胞浸润,纤维化较多。
睾丸的形态变化
如图 7 所示,空白组大鼠睾丸组织结构完整,形态正常,生精小管整齐,生精细胞规则。与空白组相比,模型组睾丸组织损伤严重,生精小管萎缩变形较多,生精细胞紊乱甚至缺失。与模型组相比,Shu-Mu 脑肾组和 L-肉碱组睾丸组织损伤程度明显改善,大多数生精小管排列整齐,生精细胞排列规则。与模型组相比,非穴位组睾丸组织损伤程度未显著降低,部分生精小管出现萎缩变形、细胞坏死、空泡、生精细胞无序缺失。
血清激素水平的比较
如图 8 所示,与空白组相比,模型组血清中睾酮 (T)、促性腺激素释放激素 (GnRH) 和抑制素 B (INHB) 水平降低 (p < 0.001),而黄体生成素 (LH)、卵泡刺激素 (FSH)、雌二醇 (E2) 和催乳素 (PRL) 升高 (p < 0.001)。与模型组相比,Shu-Mu 脑肾组和 L-肉碱组的 T、GnRH 和 INHB 增加 (p < 0.001),而 LH、FSH 、 E2 和 PRL 水平降低 (p < 0.001),但在非穴位组中未发现显着差异。

图 1:实验方法。 (A) 口服灌胃程序。(B) 涉及电针的治疗方法。 请单击此处查看此图的较大版本。
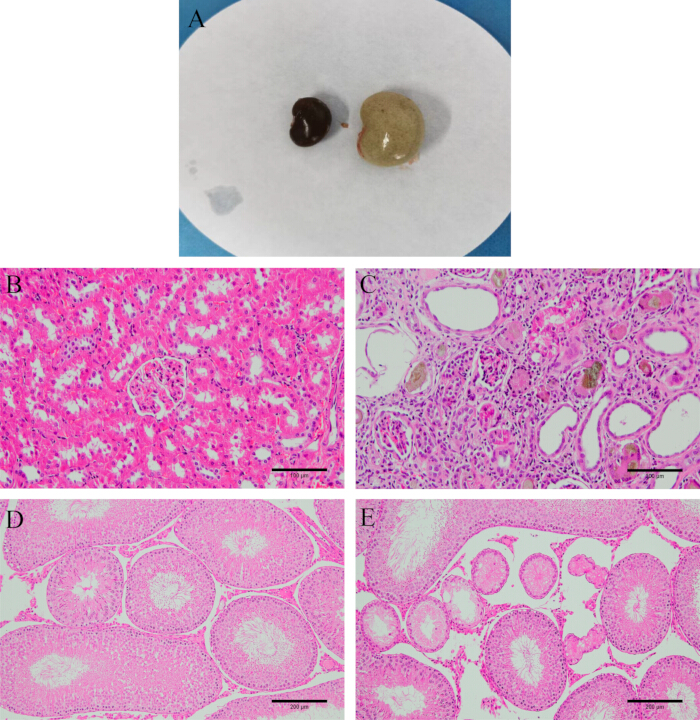
图 2:模型验证。 (A) 建模前后的肾脏外观。(B) 正常的肾组织。(C) 建模后的肾组织(HE 染色,200 倍,比例尺:100 μm)。(D) 正常的睾丸组织。(E) 建模后的睾丸组织(HE 染色,100 倍,比例尺:200 μm)。 请单击此处查看此图的较大版本。

图 3:各组体重比较。 B: 空白组,M: 模型组,S: 舒牟脑肾组,N: 非穴位组,L: 左旋肉碱组。数据以平均值±标准差 (n = 3) 表示。AP < 0.05,B P < 0.01,C P < 0.001,NS P > 0.05。请单击此处查看此图的较大版本。

图 4:各组间肾器官和睾丸器官系数的比较。(A) 左肾器官系数。(B) 右肾器官系数。(C) 左睾丸器官系数。(D) 右睾丸器官系数。B: 空白组,M: 模型组,S: 舒牟脑肾组,N: 非穴位组,L: 左旋肉碱组。器官系数 (%) = 器官重量 (g) / 体重 (g) × 100%。数据以平均值±标准差 (n = 3) 表示。AP < 0.05,B P < 0.01,C P < 0.001,NS P > 0.05。请单击此处查看此图的较大版本。

图 5:各组精子质量的比较。(A) 精子数量。(B) 精子密度。(C) 精子存活率。(D) 精子活性比。B: 空白组,M: 模型组,S: 舒牟脑肾组,N: 非穴位组,L: 左旋肉碱组。精子存活率 (%) = 活动精子数量 / 精子总数 × 100%。数据以平均值±标准差 (n = 3) 表示。AP < 0.05,B P < 0.01,C P < 0.001,NS P > 0.05。请单击此处查看此图的较大版本。

图 6:每组肾脏的形态变化。 (HE 染色,200×,比例尺:100 μm)。黑色箭头表示肾小球,绿色箭头表示肾小管,黄色箭头表示炎症细胞,蓝色箭头表示纤维化。 请单击此处查看此图的较大版本。
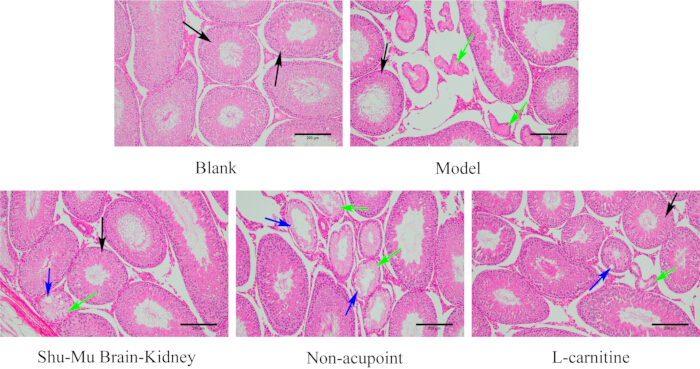
图 7:每组睾丸的形态变化。 (HE 染色,100×,比例尺:200 μm)。黑色箭头表示正常的生精小管,绿色箭头表示坏死,蓝色箭头表示空泡。 请单击此处查看此图的较大版本。

图 8:各组血清激素水平的比较。 (A) 血清睾酮 (T) 水平。(B) 血清 GnRH 水平。(C) 血清 LH 水平。(D) 血清 FSH 水平。(E) 血清 E2 水平。(F) 血清 INHB 水平。(G) 血清 PRL 水平。B: 空白组,M: 模型组,S: 舒牟脑肾组,N: 非穴位组,L: 左旋肉碱组。数据以平均值±标准差 (n = 3) 表示。AP < 0.05,B P < 0.01,C P < 0.001,NS P > 0.05。请单击此处查看此图的较大版本。
讨论
在中医中,“肾”由“内肾”和“外肾”组成,前者是指现代医学中泌尿系统的功能,后者是指下丘脑-垂体-性腺轴和解剖学上的外部生殖器官25。雄性精囊属于“外肾”,其组成部分包括睾丸、附睾、精囊等26。中医认为精是人体的物质基础,“肾精”包括从父母那里继承的“产精”和脾胃转化水粮精产生的“产精”,用于养五脏六肠。其中,产精是构成胚胎的原始物质,是生命的基础;产后丰富了五脏六肠的,剩余部分储存在肾脏中。两者在肾脏中相互依存并紧密结合形成“肾精”。如果肾精不足,即精囊不能充盈,就会导致“少精症”;如果生殖精华能正常排出,即精囊能发挥产生、储存、排出精子的功能,那就是肾阴的涩性和肾阳的兴奋性相互协调的结果。如果肾阳虚弱,则收敛功能过度,而兴奋功能不足,导致寒精和“弱精症”。因此,少弱精症的表现与“肾精虚、肾阳虚”的中医证候类型相对应。本实验中,所有建模大鼠基本满足肾阳虚型少弱精症的表现,治疗应以“补肾、助阳、补精、养髓”为主。蜀木脑肾穴位结合散散仙、神书、荆门、太溪穴,可以协调阴阳,连接肾脑,最终达到“阴阳平衡”的目的。
精子发生受 HPT 轴的内分泌活性调节,HPT 轴的调节主要依赖于下丘脑、垂体和睾丸中表达的相关激素和受体基因27,其中主要以下丘脑 GnRH 的脉冲性释放为主。这会刺激垂体前叶分泌 LH、FSH 和 PRL11。其中,GnRH 是 HPT 轴最关键的调节因子,其水平可以间接反映 HPT 轴的状态和睾丸产生精子的能力28。LH 介导睾丸基质细胞释放 T,精子的发生取决于 T 的刺激。如果 T 分泌不足,精子的数量和质量就会下降29。FSH 与支持细胞表面的受体结合,并与 T 一起作用,促进精原细胞的增殖并产生 INHB 以维持精子发生30。INHB 是一种在睾丸支持细胞和生殖细胞中合成的糖蛋白,是男性性腺的重要调节因子,反过来可以激活垂体产生 FSH,并与 FSH 相互作用共同调节 HPT 轴31、32、33。然而,PRL 是影响精子活力的重要因素34。过量的 PRL 会抑制性腺轴的分泌,从而抑制精子发生35。E2 由性腺和大脑分泌,对 LH 和 FSH36 有负反馈作用。高 E2 水平会损害支持细胞和睾丸间质细胞,导致周围结缔组织脂肪变性,并缩小男性生精小管的直径,导致患者的生育能力受损37。研究发现,雷公藤诱导的少精症大鼠血清FSH和LH水平在建模后显著升高。用麒麟丸治疗 60 天后,与模型组38 相比,这两种激素的水平显着下降,这与本研究的结果一致。其他研究表明,腺嘌呤引起的肾阳虚证大鼠出现HPT轴功能障碍,相关性激素分泌水平也发生变化39。
在本研究中,与空白组相比,模型组大鼠普遍状况不佳,精液质量显著降低 (p < 0.001)。H&E 染色显示肾脏和睾丸组织严重损伤,表明腺嘌呤调制大鼠符合少鼻精症的标准。与模型组相比,Shu-Mu 脑肾组和 L-肉碱组上述情况显著改善 (p < 0.05),而非穴位组改善不显著,表明Shu-Mu 脑肾组和 L-肉碱组精子质量和器官形态和结构改善。与空白组相比,模型组 T 、 GnRH 和 INHB 降低 (p < 0.001),表明建模成功后少弱精症大鼠分泌 T 、 GnRH 和 INHB 的能力降低。LH 、 FSH 、 E2 和 PRL 均升高 (p < 0.001),表明建模成功后 LH 、 FSH 、 E2 和 PRL 的分泌增加,导致睾丸生精功能减弱。与模型组相比,Shu-Mu 脑肾组和 L-肉碱组的 T 、 GnRH 和 INHB 增加 (p < 0.001),而 LH、FSH、E2 和 PRL 分泌水平降低 (p < 0.001),但在非穴位组中未发现显着差异。这说明电针和左旋肉碱都可以调节大鼠 HPT 轴的激素水平,对改善大鼠少鼻精症有很好的效果。
左旋肉碱是哺乳动物中的一种天然抗氧化剂,可以参与细胞能量代谢并减少精子的抗氧化损伤40。大量研究证明,左旋肉碱可以显着改善精子活力、形态和浓度,同时增加 HPT 轴相关激素的水平41。在本实验中,以 L-肉碱为阳性药物对照组,与 Shu-Mu 脑肾组进行比较。实验数据显示,两组各项指标比较差异无统计学意义,验证了“鹅庞三县、神树县、荆门、太溪县”电针对少弱精症大鼠有较好疗效。此外,针灸可以协调内脏的阴阳,增强身体的健康气以抵抗病原气,使其安全、有效、毒性小、副作用少。电针比普通针灸更能增强疗效,为少弱精症的临床管理提供安全有效的治疗方法。由于非穴位组大鼠没有遵循沿经络择点的原则,因此各种实验数据与蜀木脑肾组存在显著差异,验证了“蜀三仙、神书、荆门、太溪”四个穴位相容的显著性。
综上所述,“散三仙、神书、荆门、太溪”四个穴位的电针可以通过调节相关激素的水平来改善大鼠 HPT 轴的功能,从而提高大鼠的精子质量,最终达到治疗少弱精症的目的。它为少鼻神经精症的临床管理提供了另一种安全有效的治疗方法。
但由于缺乏技术和资金,本研究仅限于 HPT 轴上血清激素水平的研究,检测方法有限。在未来的实验中,我们将考虑使用各种手段,例如色谱法,以进一步验证激素水平的变化,并使用转录组学或代谢组学在基因水平及更远的地方对电针对 HPT 轴的调节进行进一步研究。
披露声明
作者没有什么可披露的。
致谢
本研究由宁夏回族自治区重点研发项目(2021BEG02041)支持,针灸治疗调节“下丘脑-垂体-睾轴”治疗男性生殖功能障碍的穴位相容性循证评价和临床研究,项目负责人:马慧生;2024 年度一等学科建设项目(ZY0019110305),项目负责人:马慧生;中国中医科学院(YZ-202128),项目负责人:马慧生。
材料
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
参考文献
- Punab, M., et al. Causes of male infertility: A 9-year prospective monocentre study on 1737 patients with reduced total sperm counts. Hum Reprod. 32 (1), 18-31 (2017).
- Nordkap, L., Joensen, U. N., Blomberg Jensen, M., Jørgensen, N. Regional differences and temporal trends in male reproductive health disorders: Semen quality may be a sensitive marker of environmental exposures. Mol Cell Endocrinol. 355 (2), 221-230 (2012).
- Daneshmandpour, Y., et al. MicroRNAs association with azoospermia, oligospermia, asthenozoospermia, and teratozoospermia: A systematic review. J Assist Reprod Genet. 37 (4), 763-775 (2020).
- Cipriani, S., et al. Trend of change of sperm count and concentration over the last two decades: A systematic review and meta-regression analysis. Andrology. 11 (6), 997-1008 (2023).
- Agarwal, A., et al. Male infertility. Lancet. 397 (10271), 319-333 (2021).
- Jensen, C. F. S., Fode, M., Østergren, P. B., Sønksen, J. A refined view on the association between y-chromosome microdeletions and sperm concentration. Eur Urol. 76 (5), 637-638 (2019).
- Pivonello, R., et al. Metabolic disorders and male hypogonadotropic hypogonadism. Front Endocrinol (Lausanne). 10, 345(2019).
- Guiton, R., Drevet, J. R. Viruses, bacteria and parasites: Infection of the male genital tract and fertility. Basic Clin Androl. 33 (1), 19(2023).
- Beeder, L. A., Samplaski, M. K. Effect of antidepressant medications on semen parameters and male fertility. Int J Urol. 27 (1), 39-46 (2020).
- Babalola, A. A., et al. Attenuation of doxorubicin-induced hypothalamic-pituitary-testicular axis dysfunction by diphenyl diselenide involves suppression of hormonal deficits, oxido-inflammatory stress and caspase 3 activity in rats. J Trace Elem Med Biol. 79, 127254(2023).
- Yang, Y., et al. Nickel chloride induces spermatogenesis disorder by testicular damage and hypothalamic-pituitary-testis axis disruption in mice. Ecotoxicol Environ Saf. 225, 112718(2021).
- Alahmar, A. T., Naemi, R. Predictors of pregnancy and time to pregnancy in infertile men with idiopathic oligoasthenospermia pre- and post-coenzyme q10 therapy. Andrologia. 54 (5), e14385(2022).
- Seiler, F., Kneissl, P., Hamann, C., Jünemann, K. P., Osmonov, D. Laparoscopic varicocelectomy in male infertility: Improvement of seminal parameters and effects on spermatogenesis. Wien Klin Wochenschr. 134 (1-2), 51-55 (2022).
- Cui, T. W., et al. Effect of electroacupuncture on spermatogenesis in rats with oligozoospermia of insufficiency of shen (kidney) essence syndrome. Chin J Integr Med. 25 (4), 292-297 (2019).
- Wang, Z., et al. Efficacy and safety of nonpharmacological strategies for the treatment of oligoasthenospermia: A systematic review and bayesian network meta-analysis. Eur J Med Res. 28 (1), 6(2023).
- Chuang, H. -N., et al. Effect of injecting adipose stem cells combined with platelet-rich fibrin released at Shenshu acupoint (BL23) on acute kidney injury in rabbits. Front Pharmacol. , 16(2025).
- Fu, C., et al. Acupuncture improves peri-menopausal insomnia: A randomized controlled trial. Sleep. 40 (11), (2017).
- Li, C. R., et al. Effects of acupuncture at taixi acupoint (ki3) on kidney proteome. Am J Chin Med. 39 (4), 687-692 (2011).
- Ma, L. Acupuncture treatment of kidney deficiency and essence deficiency based on the theory of kidney storing essence' clinical study of oligoasthenospermia. , (2023).
- Sheng, W., Xu, W., Hu, H., Xiao, D., He, Q. Effects of tortoise-shell glue on rat oligoasthenospermia model. Chin Med J (Engl). 135 (6), 732-734 (2022).
- Yang, N., et al. Transcriptomic analysis of the HPT axis in a model of oligoasthenozoospermia induced by adenine in rats. Exp Mol Pathol. 141, 104948(2025).
- Hongyu, L., et al. Assessment of electroacupuncture therapy with distant-approximal acupoints based on the HPT axis in rats with oligoasthenospermia through transcriptomic analysis. Reprod Sci. , (2025).
- Adachi, Y., et al. Influence of adenine-induced chronic renal failure on testicular function in the rat. Andrologia. 30 (2), 115-118 (1998).
- Zhao, Z., et al. Regulatory mechanism of electroacupuncture on hypothalamic-pituitary-testicular axis in oligospermic rats. Chin J Tissue Eng Res. 29 (26), 5563-5571 (2025).
- Chen, Y., Han, Z., Sun, Z., Huang, F. Analysis of male reproduction based on the "inner kidney and outer kidney" theory advanced by nation-famous Chinese medicine Professor XU Fu-song. Nat J Androl. 30 (02), 163-166 (2024).
- Ma, D., et al. Biological basis of premature ejaculation based on Theory of "Brain-heart-kidney-semen Chamber" Axis. Ch J Exp Tradit Med Formul. 30 (10), 203-209 (2024).
- Qi, L., et al. Toxic effects of ketamine on reproductive system via disrupting hypothalamic-pituitary-testicular axis. Eur Rev Med Pharmacol Sci. 21 (8), 1967-1973 (2017).
- Ryan, G. E., et al. Androgen receptor positively regulates gonadotropin-releasing hormone receptor in pituitary gonadotropes. Mol Cell Endocrinol. 530, 111286(2021).
- Jasuja, R., et al. Modulation of circulating free testosterone fraction by testosterone, dihydrotestosterone, and estradiol during testosterone replacement therapy. Andrology. 13 (3), 439-436 (2024).
- Dimmick, H., Kumar, T. R. Follicle-stimulating hormone. Trends Endocrinol Metab. 35 (9), 848-849 (2024).
- Negri, F., et al. The importance of discordant follicle stimulating hormone and inhibin b levels in primary infertile men: Findings from a cross-sectional study. World J Mens Health. 43 (1), 134-141 (2025).
- Li, J., et al. Development of a nomogram to predict fertilisation rate of infertile males with borderline semen by using semen parameters combined with AMH and INHB. Andrologia. 53 (9), e14182(2021).
- Liu, L., et al. Relationship between semen parameters, serum INHB, and insl-3 levels, and the degree of varicocele. Clinics (Sao Paulo). 79, 100339(2024).
- Akhigbe, R. E., Hamed, M. A., Odetayo, A. F. Haart and anti-koch's impair sexual competence, sperm quality, and offspring quality when used singly and in combination in male Wistar rats. Andrologia. 53 (2), e13951(2021).
- Liu, Y., Wang, G., Zhang, F., Dai, L. Correlation between serum levels of reproductive hormones and testicular spermatogenic function in men with azoospermia. Andrologia. 54 (10), e14182(2022).
- Russell, N., Grossmann, M. Mechanisms in endocrinology: Estradiol as a male hormone. Eur J Endocrinol. 181 (1), R23-R43 (2019).
- Leavy, M., et al. Effects of elevated β-estradiol levels on the functional morphology of the testis - new insights. Sci Rep. 7, 39931(2017).
- Jiao, W., et al. Improvement of qilin pills on male reproductive function in tripterygium glycoside-induced oligoasthenospermia in rats. Andrologia. 53 (4), e13923(2021).
- Zeng, Y., et al. Effects of Haima Duobian pill in a rat model of kidney yang deficiency syndrome. Evid Based Complement Alternat Med. 2021, 6696234(2021).
- Kooshesh, L., Nateghian, Z., Aliabadi, E. Evaluation of l-carnitine potential in improvement of male fertility. J Reprod Infertil. 24 (2), 69-84 (2023).
- Ma, L., Sun, Y. Comparison of l-carnitine vs. Coq10 and vitamin E for idiopathic male infertility: A randomized controlled trial. Eur Rev Med Pharmacol Sci. 26 (13), 4698-4704 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。