Method Article
임플란트 주위염 치료에 사용되는 기계적 방법이 임플란트 표면 오염 제거 및 거칠기에 미치는 영향
요약
본 프로토콜은 임상적 의사 결정에 기여하기 위해 체외 임플란트 표면 오염 제거 및 거칠기 연구에 사용할 수 있는 잉크 염색을 기반으로 하는 실험 모델을 설명합니다.
초록
치과용 임플란트 표면의 오염을 제거하기 위해 다양한 기계적 방법이 제안되었으며 다양한 성공을 거두었습니다. 이 시험관 내 연구는 주사 전자 현미경(SEM)을 사용하여 에리스리톨 분말, 폴리에테르-에테르-케톤(PEEK) 초음파 팁 및 티타늄 큐렛(TIT)을 사용한 공기 마모(AA) 시스템의 오염 제거 효율과 임플란트 표면 지형에 미치는 영향을 평가했습니다. 총 60개의 임플란트를 영구적인 빨간색 잉크로 염색하고 3D 프린팅된 Class 1A 및 Class 1B 임플란트 주위염 결손부위에 배치하여 결함 유형 및 치료 프로토콜에 따라 6개 그룹(그룹당 n=10개)을 형성했습니다. 추가로, 하나의 양성 대조군 임플란트와 하나의 음성 대조군 임플란트가 사용되었습니다. 에리스리톨 분말, PEEK 초음파 팁 및 티타늄 큐렛을 Class 1A 결함에 2분, Class 1B 결함에 3분 동안 적용했습니다. 잔류 적색 잉크 영역은 디지털 소프트웨어로 정량화하고 임플란트 표면 변화는 SEM 및 EDS를 사용하여 분석했습니다. 어떤 방법도 완전한 오염 제거를 달성하지 못했습니다. 그러나 에리스리톨 분말이 가장 효과적이었으며 잔류 잉크 비율은 24% ± 6%(p < 0.001)로 유지되었습니다. PEEK 초음파 팁은 41%± 4%의 잉크 잔류를 보였고, 티타늄 큐렛은 55%± 3%의 잉크를 남겼습니다. 모든 방법에서 유의한 차이가 관찰되었습니다. 오염 제거 효율에서 Class 1A와 Class 1B 결함 간에 유의한 차이는 발견되지 않았습니다. SEM 분석은 에리스리톨 분말과 PEEK 팁이 최소한의 표면 손상을 일으킨 반면, 티타늄 큐렛은 중등도에서 중증의 손상을 일으켰습니다. 오염 제거 효율과 표면 보존을 기반으로 하는 에리스리톨 파우더와 PEEK 팁은 임플란트 주위염 치료를 위한 안전하고 효과적인 옵션인 반면, 티타늄 큐렛은 효과가 떨어지고 상당한 표면 손상을 일으킵니다. 이러한 결과는 임상의가 임플란트 주위염 치료 계획을 세우는 데 도움이 될 수 있습니다.
서문
치과 임플란트 치료는 전 세계적으로 누락된 치아를 대체하기 위해 가장 일반적이고 선호되는 프로토콜입니다. 장기간의 추적 연구는 완전 또는 부분 무치악 치료에 임플란트 지지 수복물을 사용하면 예측 가능한 결과와 생존 측면에서 높은 성공률을 제공한다는 것을 보여주었습니다. 그러나, 경조직과 연조직에 영향을 미치는 다양한 합병증이 임플란트의 외과적 식립 및 수복 후에 발생할 수 있다1. 2017년, 세계 치주 및 임플란트 주위 질환 및 질환 분류에 관한 워크숍(World Workshop on the Classification of Periodontal and Peri-implant Diseases and Conditions)은 임플란트 주위 조직에 영향을 미치는 질병에 대한 정의와 감별 진단을 도입했습니다2. 이 정의에 따르면, 임플란트 주위염은 프로빙 및/또는 화농 시 출혈, 프로빙 깊이 증가 및/또는 임플란트 주위 점막의 점막 가장자리 후퇴 및/또는 지지골2의 방사선학적 소실을 포함한 염증의 임상 징후를 특징으로 하는 비가역적 병리학적 상태입니다. 임플란트 주위 질환의 병인은 여러 요인에 따라 다르며, 일부 개인은 다른 사람보다 이 질환에 더 취약합니다. 개인의 특정 소인은 임플란트 주위 질환의 발병 위험을 증가시킬 수 있으며, 이는 임플란트 손실로 이어질 수 있습니다. 임플란트 주위 질환의 병인에 중요한 역할을 하는 다른 요인은 환자 관련 요인(흡연, 전신 질환, 치주 질환 병력, 구강 위생)입니다. 각질화된 점막의 상태, 임플란트 부위의 뼈 및 연조직의 양과 질; 임플란트 및 주변 조직에 가해지는 힘; 임플란트 식립 중 발생하는 합병증; 외과 및 보철 치료를 수행하는 의사의 경험과 기술2. 또한 최근 새로운 위험 평가 및 치료 개념인 임플란트 질환 위험 평가 도구(Implant Disease Risk Assessment Tool, IDRA)3가 도입되었습니다. 이 도구는 8개의 매개변수로 구성된 기능 다이어그램으로 개발되었으며, 각 매개변수는 임플란트 주위염과 관련이 있습니다. 팔각형의 벡터는 치주염의 병력, 프로빙 시 출혈이 있는 임플란트 및 치아 부위의 비율(BoP), 프로빙 포켓 깊이가 5mm≥ 치아/임플란트의 수, 치주골 소실률(환자의 연령과 관련된 방사선 사진), 치주염에 대한 감수성, 지지 치주 요법(SPT)의 빈도 및 보철물의 설계입니다.
최근의 체계적 문헌고찰에 따르면 임플란트 주위염의 유병률은 환자 수준에서 19.53%, 임플란트 수준에서 12.53%입니다3. 전 세계적으로 매년 약 500만 개 이상의 임플란트가 시립되고 시장 규모가 40억 달러 이상인 것과 관련하여 임플란트 주위염은 인구의 주요 건강 문제를 나타냅니다. 임플란트 주위염을 치료하지 않고 방치하면 영향을 받은 임플란트와 임플란트가 지지되는 보철물을 잃게 되어 치과 의사와 환자 모두에게 큰 고통을 초래합니다.
임플란트 주위 질환의 치료는 비수술적 접근법과 외과적 접근법으로 나눌 수 있습니다. 치주염4 치료에서 종점의 성공에 대한 합리적인 기대가 있지만, 임플란트 주위염 치료에 대한 유사한 근거는 여전히 부족하다. 그러므로, 임플란트 주위염에 대한 단계적 접근법과 비수술적 요법의 근거는 치료 침습성을 증가시키기 전에 비교적 간단한 접근법으로 생물막 및 염증 조절을 시도하고, 더 나은 생물막 및 위험 인자 조절이 달성되었을 때 수술 단계를 수행하는 것입니다. 여기에는 OH 지침 및 동기 부여, 위험 요인 제어, 생물막 유지 요인 제어, 보철물 구성 요소 평가, 초한계 및 하위 변연 기구, 필요한 경우 동반 치주 치료를 포함한 보철물 세척/제거/수정이 포함됩니다. 따라서 비수술적 치료는 항상 첫 번째 단계가 되어야 한다5. 초기 임플란트 주위염의 경우 위험 요인을 줄이고 비수술적 치료를 받는 것으로 충분할 수 있지만, 뼈 손실 후 깊은 주머니에서 생물막을 완전히 제거하는 것은 종종 어려운 일입니다. 비수술적 치료 후 재평가 단계에서 지속적인 포켓 깊이(≥ 6mm) 및 프로빙 시 출혈(BoP)은 임플란트 주위염의 잠재적 진행을 나타냅니다. 이러한 징후가 나타나면 외과적 개입이 권장된다6. 임플란트 주위염의 외과적 치료에는 (i) 개피막 괴사조직 제거, (ii) 절제 피판 수술, (iii) 재건 접근법을 이용한 임플란트 주위 골 결손 관리, (iv) 임플란트 표면 오염 제거를 위한 추가 방법 및 (v) 국소/전신 항생제의 보조 사용7.
임플란트 주위염의 주요 병인학적 요인은 임플란트 표면에 군락화된 병원성 생물막입니다6. 이 생물막을 제거하는 것은 기계적, 화학적 및 레이저 오염 제거 방법을 포함하는 모든 처리 프로토콜의 주요 원칙이자 목표입니다7.
기계적 괴사조직 제거는 플라스틱, 탄소 및 티타늄 큐렛, 플라스틱 및 금속 팁이 있는 초음파 장치, 티타늄 브러시 및 다양한 분말이 있는 공기 연마(AA) 시스템을 사용합니다. 생물막을 완전히 제거하는 것은 어렵지만 이러한 치료법은 임상적 이점을 제공합니다. 방부제를 사용하거나 사용하지 않는 기계적 괴사조직 제거 프로토콜8, 항생제9, 절제 및 재생 수술10을 포함한 다양한 임상적 중재가 사용되어 다양한 임상적 성공의 정도를 거두었다. 그러나 그들은 또한 임플란트 표면의 화학적 및 물리적 특성의 변화를 유도하여 새로운 뼈 형성 및 재골 유착을 복잡하게 만들 수 있습니다.
기계적 방법 중 다른 분말 조성물을 사용하는 AA 절차는 최고의 세척 효능을 보여주었습니다 11,12,13. 그러나 잔류 입자의 존재는 표면 지형을 변경하고 생체 적합성을 감소시킬 수 있습니다14. 글리신(Glycine)과 중탄산나트륨(sodium bicarbonate)은 AA 시스템에서 가장 많이 사용되는 분말입니다8. 최근에는 에리스리톨(14μm)과 같은 작은 공기 연마성 입자가 표면 손상을 줄이면서 효과적인 오염 제거에 대한 관심을 받고 있습니다9. 스틸 팁보다 표면 손상이 적은 티타늄 및 플라스틱 큐렛은 생물막 오염 제거에 효과적입니다15. 폴리-에테르-에테르-케톤(PEEK)으로 만든 초음파 스케일러 팁은 또한 표면 손상을 최소화하면서 박테리아 부하를 줄입니다10. 오염 제거 방법은 임플란트 표면의 높은 거칠기를 고려해야 하며 심각한 표면 손상을 일으키지 않고 박테리아 생물막을 제거하는 것을 목표로 해야 합니다. 광범위한 시험관내(in vitro), 생체 내(in vivo) 및 임상 연구가 수행되었지만, 현재까지 임플란트 주위염 치료에 대한 합의와 황금 표준 프로토콜은 없습니다. 수많은 치과 임플란트로 인한 임플란트 주위 질환의 유병률이 증가함에 따라 오염된 표면을 처리하기 위한 증거 기반의 예측 가능한 접근 방식이 필요하게 되었습니다. 이 연구는 임플란트 표면 오염 제거에 대한 공기 연마제(AA) 시스템, PEEK 초음파 팁 및 티타늄 큐렛과 같은 다양한 오염 제거 방법의 효과를 평가하고 SEM 분석을 통해 임플란트 표면 거칠기에 미치는 영향을 평가하는 것을 목표로 합니다.
프로토콜
연구 프로토콜은 터키 안탈리아에 있는 Akdeniz University의 윤리 위원회(TBAEK-363)의 승인을 받았습니다. 이 연구는 Akdeniz University Research Fund(프로젝트 번호: TDH-2024-6676)의 지원을 받았습니다. 이 연구는 칼라에서 1.7mm 크기의 마이크로 스레드 디자인을 특징으로 하는 4.2mm x 11mm 크기의 나사 모양의 치과 임플란트(PrimeTaper EV Implant)를 사용했습니다. 잘 정의된 OsseoSpeed 표면을 얻기 위해 희석된 불산을 사용한 샌드블라스팅 및 산 에칭을 통한 표면 처리.
1. 실험적 임플란트주위염 모델 준비
참고: 세 가지 오염 제거 기계적 처리 방법(공기 연마제(AA), 폴리에테르에테르케톤(PEEK) 초음파 및 티타늄 큐렛; 재료 표) 두 가지 다른 임플란트 주위 결함 유형에서11 유형(클래스 1A 및 클래스 1B)을 분석했습니다. 따라서 6개의 실험 그룹이 있었습니다(그림 1). 총 62개의 임플란트가 사용되었으며, 이 중 1개는 양성 대조군 임플란트와 1개의 음성 대조군 임플란트가 포함되었습니다. Sharhmann et al.16에 의해 처음 개발된 이 체외 연구 설계는 문헌에서 다양한 연구자들에 의해 수정되었습니다12,13,14,15,16,17,18). 그룹 간 생물막 제거 효능의 차이가 10%라고 가정할 때, G*power, 효과 크기 0.50, Type I 오차 5% 및 80% power를 가진 6개 그룹에 대해 샘플 크기를 60(각 그룹당 10개)으로 결정했습니다.

그림 1: 실험 그룹의 순서도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 교육용 하악 팬텀 모델에서 첫 번째 어구치 하나를 제거합니다. 플라스틱 이빨은 나사로 이 팬텀 모델에 고정됩니다. 첫 번째 어금니의 나사를 풀고 소켓에서 나사산을 제거합니다. 부드러운 실리콘 소재를 성형하여 소켓을 덮어 소켓을 채워 평평한 폐포 융기를 만듭니다.
참고: 무치악 영역에 배치된 임플란트의 시뮬레이션이 생성되었습니다. - 실험실 스캐너에서 준비된 모델을 스캔하여 디지털 디자인을 만듭니다.
- 3D Class 1A 및 Class 1B11 임플란트 주위 뼈 결손을 디지털 방식으로 생성합니다. Exocad 소프트웨어 프로그램을 엽니다. 스캔한 모델 파일을 업로드합니다. 그런 다음 디자인을 클릭하고 전문가 모드를 선택합니다. Edit Mesh 옵션으로 불규칙한 영역을 제거합니다. 그런 다음 마우스 오른쪽 버튼을 클릭하고 컴퓨터의 관련 폴더에서 파일로 스캔 저장을 선택합니다.
- Tools > Add / Remove Mesh 옵션을 선택하고 Wax Scanning> Upload File을 선택한 다음 폴더에 방금 저장 한 파일을 선택합니다. 그런 다음 오른쪽의 마법사 모드를 클릭합니다.
- 그 결과로 생성된 새 STL 모델에서 톱니 소켓에 결함 시뮬레이션을 생성합니다. 이렇게 하려면 왼쪽의 추가/제거 를 클릭합니다. 타원형 브러시 크기를 선택합니다. 그런 다음 shift와 마우스 왼쪽 버튼을 동시에 사용하여 모델에 결함을 만듭니다. 클래스 1A 결함의 경우 임플란트의 협측 표면에서 결함의 길이를 5mm로, 너비를 4.2mm(임플란트의 직경에 해당)로 조정하고 클래스 1B 결함의 경우 5-5-5mm로 조정합니다.
- 결함의 수평 너비를 좁히려면 왼쪽의 Anatomy를 클릭하고 결함의 전정 너비를 안쪽으로 좁혀 Cusps를 선택합니다. 그런 다음 마우스 오른쪽 버튼을 클릭하고 장면을 파일로 저장합니다.
- 최종 모델을 만들려면 프로그램을 다시 시작하고 저장된 폴더를 다시 로드하십시오. 그런 다음 오른쪽에서 Wizard Mode and Model Alignment 옵션을 선택합니다. 왼쪽에서 모델 유형을 디지털 왁스업 모델로 선택합니다. 왼쪽의 모델 디자인 섹션이 나타날 때까지 다음을 여러 번 클릭합니다. 전체 모델 옵션을 선택하고 다음을 두 번 클릭합니다. 모델 파일이 완성되면 탐색기로 열면 인쇄할 준비가 된 것입니다.
- 설계된 모델의 STL 파일을 3D 프린터로 전달합니다. 모델 레진을 사용하여 생성된 디지털 모델을 인쇄합니다.
- 실험 모델을 96% 에탄올로 5-10분 동안 헹굽니다. 세척 과정이 끝나면 모델을 발광 경화 장치에 넣고 제조업체의 지침에 따라 용량 설정에서 5분 동안 빛으로 경화합니다.
참고: 임플란트 드릴링에 적합한 높은 인장, 굴곡 및 압축 강도를 가진 수지 모델을 사용하십시오. 제조업체의 지침에 따라 인쇄된 모델을 알코올 기반 용액으로 세척하고 적절하게 광경화되었는지 확인하십시오.
2. 임플란트의 염색
- 테스트 임플란트를 점성이 있는 방수 빨간색 잉크에 담그십시오. 임플란트 표면의 모든 부분이 15초 동안 잉크로 완전하고 균일하게 덮여 있는지 확인합니다. 손 접촉 없이 운전자 핸드피스 또는 인상 포스트를 사용하여 멸균 용기에서 임플란트를 제거합니다.
참고: 이 염색은 사진 분석을 위해 광학적으로 보이는 생물막 대리물을 시뮬레이션합니다. - 잉크가 고르게 분산되도록 치과 유닛 공기 주사기로 염색된 임플란트를 자연 건조합니다. 염색된 임플란트를 실온에서 24시간 동안 더 건조시킵니다. 임플란트를 핸드피스와 함께 손에 닿지 않게 단독으로 건조시킵니다.
3. 염색된 보형물의 식립
- 치과 물리 디스펜서의 설정을 다음과 같이 조정합니다: 식염수 세척 없이 800rpm, 40N 토크.
- 실험 모델에 외과용 임플란트 드릴로 임플란트 소켓을 만들어 길이 11mm, 너비 4.2mm의 임플란트를 배치합니다. 두 가지 유형의 결함이 있는 모델(클래스 1A 및 1B 결함 모델)에 대해 동일한 임플란트 소켓을 준비합니다.
- 1차 안정성을 달성하기 위해 제조업체의 지침에 따라 임플란트 드릴을 순차적으로 사용하십시오. 공기-물 주사기로 드릴링한 후 남은 파편을 청소한 다음 임플란트를 놓습니다. 임플란트의 미세 이동을 방지하고 모델의 미세 균열을 방지하기 위해 클램프로 작업 플랫폼에서 실험용 임플란트염 모델을 안정화합니다.
- 캐리어 핸드피스가 있는 임플란트를 소켓에 삽입합니다. 협측 표면에 노출된 영역을 5mm로 남겨 둡니다. 임플란트가 모델의 설측 골능선에서 동일한 높이로 잠겨 있는지 확인합니다. 얼룩진 임플란트 표면을 만지지 마십시오.
4. 임플란트의 오염 제거
- 실험용 1A 및 1B 결함 모델에서 임플란트를 제거하지 않고 그룹으로 임플란트의 오염 제거를 시작합니다.
- 공기 연마 시스템: 14μm 에리스리톨 분말로 물 관개로 장치를 최대 전력으로 설정합니다. 장치의 끝을 임플란트 표면에서 2-3mm 떨어진 곳에 잡고 노출된 임플란트 주위 결손부에 분말을 고르게 바릅니다. 작업 시간을 1A 결함의 경우 2분, 1B 결함의 경우 3분으로 제한합니다.
- 폴리에테르에테르케톤(PEEK) 초음파 팁: 최대 물 관개로 장치를 8전력(80%)으로 설정합니다. 초음파 사용에 적합한 방식으로 PEEK 핸드피스를 잡습니다. 선형 및 평행 운동으로 임플란트 표면에서 오염 제거를 수행합니다. 디자인이 허용하는 한 스레드 사이에 PEEK 팁을 적용합니다. 작업 시간을 1A 결함의 경우 2분, 1B 결함의 경우 3분으로 제한합니다.
- 티타늄 큐렛: 노출된 5mm 임플란트 표면에 약 0.75N의 힘으로 60°-90°의 일정한 압력으로 1A 결함의 경우 2분, 1B 결함의 경우 3분 동안 임플란트 표면에 연속 접촉을 적용합니다.
- 오염 제거 후 손이 닿지 않도록 드라이버 피스를 사용하여 임플란트를 제거합니다. 오염 제거 후 모델이 변형되면 백업 모델로 진행합니다. 클램프를 사용하여 작업 플랫폼에서 실험용 임플란트주위염 모델을 안정화합니다.
참고: 모든 방법은 한 명의 연구원이 보정하고 적용해야 합니다.
5. 사진 이미징
- 호환되는 임플란트 드라이버 피스를 사용하여 모델에서 임플란트를 제거합니다. 임플란트를 20초 동안 자연 건조하여 표면의 느슨한 입자/잔여물을 제거합니다.
- 맞춤 설계된 아크릴 사진 모델에 임플란트를 배치하여 평면 뷰, 30° 정점 뷰, 30° 코로나 뷰를 촬영하여 임플란트 표면에 있는 실의 정점 및 코로나 부분을 평가합니다.
- 카메라를 삼각대에 놓고 카메라 설정(거리 15cm, ISO 160, 조리개 f/16, 노출 시간 1/250초)을 표준화합니다. 방의 조명이 적절한지 확인하십시오. 삼각대로 카메라를 고정해야 합니다.
- 플래시로 RAW 형식의 디지털 사진을 촬영합니다. Class1A 결함에 대한 총 90개의 협측 사진(각 임플란트 표면에 대해 1개의 평면, 1개의 30° 정점 및 1개의 30° 관상동맥)과 Class 1B 결함에 대한 270개의 사진(각 임플란트의 각 협측, 근심 및 원위면에서 평면, 30° 정점 및 30° 관상동맥)을 얻습니다. 추가 이미지 분석을 위해 모든 디지털 사진 파일을 하드 디스크에 보관합니다.
6. 이미지 분석
- 디지털 이미지 소프트웨어(ImageJ)에서 모든 분석을 수행합니다. 분석하기 전에 Photoshop 프로그램(Photoroom)을 사용하여 사진의 배경을 검은색으로 만들어 이미지에서 임플란트만 보이도록 합니다. 응용 프로그램을 연 다음 갤러리에서 각 이미지를 추가합니다. 이미지에서 배경을 제거하고 옵션에서 검은색 배경을 선택합니다.
- ImageJ에 이미지를 끌어다 놓습니다. 이미지에 사각형을 그려 임플란트에 5mm 관상을 덮습니다. 그런 다음 표준화를 위해 Image > Crop(이미지 자르기 )을 클릭합니다. 각 이미지에 대해 동일한 과정을 반복합니다.
- 이미지 ˃ 유형 ˃ 8비트를 클릭하여 이미지를 8비트 형식으로 변환하고 이미지 ˃ 영역 계산을 위한 임계값 조정을 클릭하여 임계값을 조정합니다.
- 전체 임플란트 표면적과 붉은 색 잔여물 면적을 Analyze ˃ Measure ˃ Area를 클릭하여 계산합니다.
- 얻은 픽셀 영역을 스프레드시트 파일에 기록합니다. 원시 이미지 데이터를 기록하기 위해 별도의 스프레드시트 파일을 만듭니다.
- 붉은 색 잔여물의 백분율을 얻으려면 빨간색으로 표시된 영역에 100을 곱하고 총 임플란트 표면적으로 나눕니다.
7. SEM 분석
- 모든 임플란트는 분석 당일까지 멸균 상자에 보관하십시오.
- SEM 분석 전에 각 처리 그룹에서 하나의 대표 샘플을 무작위로 선택합니다. 각 그룹에서 선택한 샘플 외에도 멸균 임플란트 1개를 추가하고 잉크로 완전히 덮인 임플란트만 추가합니다. 따라서 SEM 분석을 위해 총 8개의 임플란트 샘플을 준비합니다.
- SEM 분석 전에 임플란트 표면의 미세 분말을 제거하기 위해 가스 건을 사용하여 질소 가스를 20초 동안 분사합니다.
알림: 장치의 고급 기술로 인해 추가 금 코팅이 적용되지 않았습니다. - 전도성 탄소 접착 디스크가 있는 SEM 스터브에 각 임플란트를 장착하여 손 오염 제거 없이 협측 평면을 분석할 수 있습니다. 그룹의 혼동을 피하기 위해 번호순으로 정렬하십시오.
- 기기에 배치된 임플란트에서 영역을 선택하고 다양한 배율로 이미지를 캡처합니다. 임플란트 표면의 다른 영역(근심 또는 원위)에 대해 동일한 절차를 반복합니다. 100mm의 평균 작동 거리로 10-30kV에서 작동하는 SEM 장치를 사용하여 이미지에 100배, 1000배 및 5000배 배율을 사용합니다.
참고: SEM 분석 중 표준화를 보장하기 위해 각 임플란트에 대해 칼라 영역의 두 번째 미세가닥과 신체의 두 번째 거대가닥을 선택했습니다. 일부 이미지의 경우 비교를 위해 이미징 중에 원소 분석(EDS)을 수행하는 것이 좋습니다.

그림 2: 연구의 순서도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 통계 분석
- 범주형 변수를 숫자와 백분율로 표현하고 계량형 변수를 평균과 표준 편차로 표현합니다. Shapiro-Wilk 검정을 사용하여 계량형 변수에 대한 분포의 정규성을 확인합니다.
- 결함 그룹 간의 계량형 변수를 비교하려면 스튜던트 t-검정을 사용합니다. 세 개 이상의 그룹을 비교하려면 통계적 가설이 충족되었는지 여부에 따라 일원 분산 분석 또는 Kruskal Wallis 검정을 사용합니다.
- 분산의 동질성과 관련하여 정규 분포 데이터의 경우 그룹의 다중 비교를 위해 Tukey 검정을 사용하십시오. 비정규 분포 데이터의 경우, Bonferroni 조정 Mann-Whitney U 검정을 사용하여 그룹을 여러 번 비교합니다. 모든 통계 분석은 IBM SPSS 20을 사용하여 수행되었습니다. 모든 테스트에 대한 통계적 유의수준은 0.05로 간주되었습니다.
결과
임플란트 표면의 오염 제거를 분석하기 위해 여기에 설명된 실험 프로토콜은 다양한 처리 절차 간에 상당한 차이를 보여주었습니다. 또한 치료 후 SEM 프로토콜은 연구 그룹마다 정도가 다르며 임플란트 표면에서 상당한 변화를 보여주었습니다.
오염 제거 후 임플란트 수준 비교(총 임플란트 평균)
임플란트 수준 비교는 각 임플란트의 일반적인 방법(클래스 1A 결함의 협측 표면 측정 평균과 클래스 1B 결함의 협측, 근심 및 원위 표면 측정 평균)을 비교하여 수행되었습니다. 따라서, 1A 결함(0.19 ± 0.02)에서 AA로 가장 효과적인 오염 제거를 얻을 수 있었습니다(p < 0.001). 그 뒤를 AA-1B(0.29± 0.04), PI-1B(0.38± 0.04), PI-1A(0.43± 0.03)가 순으로 기록했다. TIT-1A(0.53 ± 0.03) 및 TIT-1B(0.56 ± 0.03) 그룹에서 오염 제거가 가장 적었습니다. 티타늄 큐렛 그룹(1A-1B) 간에는 유의한 차이가 없었지만, 다른 모든 그룹의 쌍별 비교는 통계적으로 유의했습니다(p < 0.001; 표 1; 그림 3).
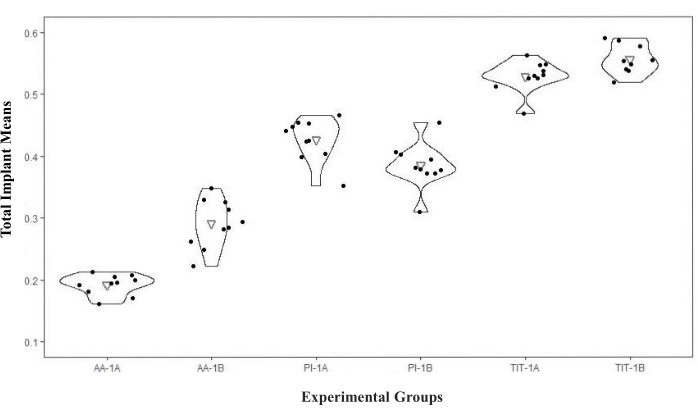
그림 3: 실험 그룹 및 총 임플란트 평균의 바이올린 플롯. 약어 : AA = 공기 연마제, PI = PEEK 팁, TIT = 티타늄 큐렛. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
오염 제거 후 임플란트 표면 수준 비교
임플란트 수준 비교와 유사하게, 공기 연마제(AA)는 PI 및 TIN(p < 0.001)에 비해 모든 샘플(1A + 1B)의 협측 표면에서 통계적으로 가장 효과적인 오염 제거를 제공했습니다. 협측 표면에서 TIT보다 PI로 더 나은 오염 제거가 이루어졌지만(p < 0.001), TIT 1A와 1B 협측 그룹 간에 차이는 감지되지 않았습니다.
1B 결함의 근심 표면에서 가장 효과적인 오염 제거는 PI 및 TIT에 비해 AA에 의해 제공되었으며 모든 그룹 간의 차이는 통계적으로 유의했습니다(p < 0.001). AA 및 PI 프로토콜은 1B 결함의 원위 표면에서 유사하게 효과적인 것으로 밝혀졌으며(p ˃ 0.05), 두 그룹 모두 TIT 그룹보다 더 효과적인 것으로 관찰되었습니다(p < 0.001; 표 1).
오염 제거 후 처리 프로토콜 수준 비교
결함 그룹에 관계없이 치료 프로토콜 비교를 통해 AA(0.24 ± 0.06)가 PI 및 TIT에 비해 임플란트 표면 오염 제거에 통계적으로 유의하게 더 효과적< 것으로 나타났습니다. 또한 PI 측정치(0.41 ± 0.04)가 TIT보다 통계적으로 우수했다(0.55 ± 0.03; p < 0.001; 표 1).
오염 제거 후 결함 수준 비교
치료 프로토콜에 관계없이, 결함 유형 비교는 Class 1A 및 Class 1B 임플란트 주위 결함 유형이 유사한 오염 제거 효율을 가져왔다는 것을 보여주었습니다(p ˃ 0.388). 반면에, Class 1B 결함에서 치료 프로토콜의 효과는 말단 표면(±p ˃ 0.388; 표 1).
표 1: 잉크 잔량 비율과 오염 제거 결과를 처리 그룹 및 결함 유형에 따른 비교. 이 표를 다운로드하려면 여기를 클릭하십시오.
오염 제거 후 사진 분석 각도 비교
정면 90°(F-90°), 정점 30°(A-30°), 코로나 30°(C-30°)의 사진을 비교했을 때, A-30°와 C-30° 사이에는 그룹 간의 차이가 감지되지 않았다. AA 그룹의 협측 표면의 C-30° 및 F-90° 사진 샘플, PI 그룹의 A-30° 및 C-30° 사진 샘플, TIT 그룹의 협측 및 근심 F-90° 사진 샘플에서 보다 효과적인 오염 제거가 기록되었습니다 (표 2).
표 2: 사진 각도에 따른 잉크 잔량 비율과 오염 제거 결과를 비교합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
오염 제거 후 SEM 결과 및 EDS 분석
대표 샘플의 SEM 분석은 모든 치료 방식이 임플란트 표면에 영향을 미쳤음을 보여주었습니다. AA 처리는 결함 그룹에 관계없이 협측 부위의 micro-thread 및 macro-thread 구조 모두에서 무시할 수 있는 변화를 일으켰습니다(그림 4, 그림 5). 그러나 1B 결함 그룹의 근심 및 원위 영역에서는 협측 영역에 비해 실 아래에서 더 많은 잉크 잔류물이 발견되었습니다 (그림 5). 또한, 1B 결함 그룹의 협측 미세실 부위에서 분말 입자가 관찰되었습니다 (그림 6). 플라스틱/탄소 PEEK 초음파 팁은 결함 그룹에 관계없이 AA 방법에 비해 협측 부위의 지형 구조를 경증에서 중등도의 평탄화를 일으켰습니다. 또한, PEEK 그룹에서는 특히 마이크로 스레드 사이에 남아 있는 잉크 잔여물로 인해 거친 구조와 다른 더 흐릿하고 구멍이 뚫린 모양이 관찰되었습니다 (그림 4, 그림 5). 그러나 PEEK 처리는 1000x 및 5000x 배율에서 1B 결함 그룹의 근심 및 원위 영역에서 AA와 유사한 결과를 나타냈습니다 (그림 5). 또한 PEEK 그룹에서 이물질이 발견되지 않았습니다. 반면에 티타늄 큐렛은 다른 방법에 비해 표면에 광범위한 변화를 일으켰습니다. 1A 결함 그룹에서는 오염 제거가 불량하여 협측 영역의 미세 나사산 구조에서 거친 구조를 구별할 수 없었습니다 (그림 4). 다른 현장에서는 평탄화 및 세로/수평 긁힘이 감지되었습니다 (그림 4, 그림 5). 1B 결함 그룹의 근심 및 원위 부위에서 거친 구조가 사라지고 긁힌 부분이 증가했습니다 (그림 5). 또한 멸균 기준 임플란트의 원소 분석(EDS)을 수행하여 99.2%의 티타늄 함량을 밝혔습니다(그림 7). 다른 그룹의 눈에 띄는 구조(블랙홀)와 완전히 잉크로 덮인 처리되지 않은 임플란트 표면에 대해서도 원소 분석이 수행되었으며, 아마도 잉크의 기화로 인해 해당 영역에서 탄소가 우세한 결과를 보여주었습니다 (그림 8 A-C).

그림 4: Class 1A 결함 그룹의 임플란트 샘플의 SEM 이미지. (A) 100A 협측 결손의 미세실의 100배, 1000배, 5000배 배율 이미지. (B) 100A 협측 결손의 매크로 스레드의 100x, 1000x, 5000x 배율 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: Class 1B 결함 그룹의 임플란트 샘플의 SEM 이미지.(A) 1B 협측 결손의 마이크로스레드의 100x, 1000x, 5000x 배율 이미지. (나) 100배, 1000배 및 5000배 배율의 1B 협측 결손의 매크로 스레드의 이미지. (씨) 100배, 1000배, 5000배 배율의 이미지, 1B 결함의 근심 부위 이미지. (D) 1B 결함의 말단 부위의 100배, 1000배, 5000배 배율 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 임플란트 칼라 부위에서 인식된 에리스리톨 분말 입자 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 멸균 및 처리되지 않은 참조 임플란트 샘플의 EDS 분석.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: EDS 분석. (A) 잉크로 코팅된 처리되지 않은 임플란트 샘플의 EDS 분석. (B) PEEK 그룹(그룹 4)의 임플란트 샘플에 대한 EDS 분석. (C) 티타늄 큐렛의 임플란트 샘플에 대한 EDS 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
임플란트 주위 질환의 영향을 받는 치과 임플란트의 체외 표면 분석 방법론은 임플란트의 거친 표면에서 발생하는 병원성 메커니즘의 염증 및 박테리아 특성으로 인해 항상 까다로웠습니다. 몇 가지 우려 사항에는 샘플 재료 선택, 표면의 생물막 모방, 임플란트 주위 결함 유형 선택, 체외 시술 중 임상 상태를 나타내는 것, 오염 제거 절차의 변형, 오염 제거량을 결정하는 방법 및 임플란트 표면의 거칠기에 대한 절차의 영향 등이 있습니다. 각 임플란트 브랜드는 금속 유형(티타늄, 지르코늄), 표면 거칠기 특성, 표면 자유 에너지, 습윤성, 나사산 깊이, 너비 및 길이와 같은 고유한 표면 특성을 가지고 있으며, 이 모든 것은 오염 제거 프로토콜의 효능에 직접적인 영향을 미칩니다. 이러한 우려를 극복하기 위해 일부 연구에서는 보형물 대신 얼룩이 지거나 오염된 디스크를 사용했습니다. 그러나, 나사형 특징물(임플란트)과 비교하여 평평한 표면(디스크)에서 박테리아 생물막을 제거하는 능력은 실제 임상 상황을 나타내지 않을 것입니다16,20. 다양한 임플란트 브랜드의 오염 제거 효능이 문헌21에서 평가되었지만, 본 연구에서는 표준 및 고급 기능을 갖춘 임플란트가 사용되었습니다.
이 연구에 사용된 영구 잉크 모델은 임플란트 13,14,15,16,17,19,22의 생물막을 모방하는 가장 일반적인 방법입니다. 그러나 잉크를 사용하면 작업자가 쉽게 볼 수 있기 때문에 편향이 나타날 수 있으며, 이는 임상 조건과 모순됩니다. 또한, 이 시뮬레이션된 생물막은 천연 생물막과 같은 방식으로 임플란트 표면에 부착되지 않고 석회화되지 않아 실제 임상 환경보다 물리적 괴사조직 제거가 더 쉽습니다. 인공 치석(23)으로 임플란트 표면을 코팅하는 것이 이에 대한 해결책이 될 수 있지만, 균일하고 균일한 치석의 두께를 달성하는 것은 여전히 한계를 나타낼 수 있다. 여러 연구에서는 직접 생존 가능한 치주 병원성 박테리아 invivo 24 또는 in vitro25 오염을 사용하여 티타늄 표면을 오염시켰습니다. 임플란트 주위염은 복잡한 다세균 질환이기 때문에 표면에 단일균 생물막 또는 다중 박테리아 생물막을 사용하면 오염 제거 절차의 결과에 영향을 미칠 수 있습니다26. 또한, 다른 임플란트 표면 재료(지르코니아, 티타늄)에 부착하는 박테리아의 친화도는 표면 거칠기와 표면이 없는 에너지로 인해 다를 수 있습니다26. 이러한 한계 내에서 잉크 염색 방법은 잉크 잔여물을 디지털 방식으로 직접 측정하고 오염 제거 방법 간의 정량적 비교를 가능하게 하는 것과 같은 몇 가지 이점을 제공합니다.
임플란트 주위 결손의 유형과 결손벽의 존재가 기계적 괴사조직 제거 프로토콜 15,18,27의 효과에 영향을 미치는 것으로 보고되었습니다. 다양한 각도를 가진 상부 또는 원주 결손은 이전의 시험관 내 연구에서 사용되었다15,28. 이러한 결함 모델의 주요 문제점은 기기 제작 중 임플란트 표면에 대한 접근이 모든 영역에서 동일하다는 것입니다. 그러나 이것은 임상적 결함을 반영하지 않습니다. 본 연구에서는 가장 흔한 유형의 임플란트 주위 결손인 Class 1A 및 Class 1B 골내 결손18이 사용되었다. 또한, 본 연구에서는 EFP 가이드라인5에서 권장하는 대로 수술 환경을 시뮬레이션했으며, 임상적으로 보철 상부 구조를 제거하고 임플란트 주위 결손을 직접 볼 수 있도록 점막골 피판을 높였습니다.
임플란트 표면 오염 제거 프로토콜의 성공 여부는 임플란트 나사산의 거친 내부 표면에 접근할 수 있는 능력에 달려 있습니다. 현재까지 여러 오염 제거 방법이 조사되어 다양한 정도의 성공을 거두었습니다. 이 중 공기 연마 시스템, 티타늄 브러시 및 큐렛이 가장 효과적인 치료 프로토콜로 보고되었습니다8. 그러나 이러한 모든 처리는 질감 및 산화물 층 두께의 변화와 같은 임플란트 표면 거칠기의 변화를 유도합니다. 이러한 미시적 지형학적 변화는 결국 부정적인 임상적 영향을 미칠 수 있습니다. 따라서 임플란트 표면에 대한 최적의 오염 제거 방법은 아직 결정되지 않았습니다. 특정 결함 유형 및 죠 모델 시뮬레이션으로 인해 현재 결과를 이전 연구와 직접 비교할 수는 없지만 골내 구성 요소의 유사성을 지적할 수 있습니다. 본 연구의 결과는 문헌과 일치하며, AA는 임플란트 표면에 90° 각도로 수직으로 적용되는 협측 표면에서 더 효과적인 반면, 골내 구성 요소가 각진 적용을 필요로 하는 근심 및 원위 표면에서는 그 효능이 감소한다는 것을 나타냅니다 14,16,17,29. 또한, 이것은 201130 년 Petersilka가 설명한 도탄 효과로 설명 할 수 있으며, 이는 가압 분말과 물의 원리에 따라 작동하는 AA가 표면에 적용될 때 발생합니다.
AA 시술에 사용되는 분말 유형의 효과는 많은 연구에서 조사되었습니다. 글리신은 현재까지 임상 및 체외 연구에서 가장 일반적으로 사용되는 분말이지만, 다른 유형으로는 중탄산나트륨, 중탄산칼슘, 인산삼칼슘, 에리스리톨7 등이 있습니다. 그러나 입자 크기가 더 큰 분말은 임플란트 표면에 보다 효과적인 오염 제거를 제공하는 동시에 거시적 구조 변경 및 긁힘 증가와 같은 더 많은 표면 변화를 유발하는 것으로 관찰되었습니다 13,31. Pujarern 등9의 최근 체외 연구에서는 임플란트 표면의 에리스리톨과 중탄산나트륨 분말 간의 생물막 오염 제거 효능에 차이가 없음을 보여주었습니다. 또한, 작은 입자는 공기-물 혼합물에 더 쉽게 용해되어 큰 입자에 비해 표면 손상의 위험을 줄이고 좁은 실 공간으로의 침투를 용이하게 하는 것으로 보고되었습니다13. 임플란트 표면에서 생물막을 제거하는 효과적인 방법, 표면 손상 최소화, 연조직 외상 감소, 낮은 수술 후 환자 이환율 등 공기 연마 시스템의 장점에도 불구하고 몇 가지 제한 사항에 유의해야 합니다. 여기에는 석회화된 침전물 또는 잘 부착된 박테리아 축적을 제거하는 데 어려움이 있는 경우32, 후방 및 설측/구개 부위에서 적절한 각도를 이루는 데 어려움이 있는 경우, 시술 중 가압된 공기로 인한 피하 폐기종의 위험33이 포함된다. 따라서 공기 연마 시스템5의 일상적인 사용을 뒷받침하기 위해 추가 증거가 필요합니다.
공기 연마성 분말 시스템을 사용할 수 없는 상황에서는 티타늄 브러시, 금속 큐렛 또는 초음파 팁과 같은 대안이 보조 처리로 선호되거나 필요할 수 있습니다21. 그러나 기계적 오염 제거에 사용되는 금속 기기는 티타늄 표면을 긁어 표면을 거칠게 만들 수 있으며, 잠재적으로 미생물 접착 및 플라크 축적을 촉진할 수 있습니다. 따라서 테프론, 플라스틱 및 PEEK 코팅 기기와 같은 대안을 활용하고 추가로 조사해야 합니다. 본 연구에서는 임플란트 표면을 위해 특별히 설계된 최근에 개발된 초음파 PEEK/카본 팁의 효능을 평가했습니다. 우리의 방법론과 일치하는 최근 연구에서, 음파 및 초음파 PEEK 플라스틱 팁과 공기 연마 분말 시스템은 다양한 임플란트 표면에서 최상의 결과를 얻었습니다12,34. 이번 연구에서 사용된 PI MAX 팁은 탄소가 30% 함유되어 있고 더 얇고 유연한 디자인을 가지고 있다는 점에서 제조업체의 이전 PEEK 팁과 다릅니다. 이 새로운 설계에 대해 사용할 수 있는 제한된 데이터는 현재 연구에서 가장 널리 연구된 두 가지 방법(공기 마모 및 티타늄 큐렛)과 비교하는 것이 중요하다는 점을 강조합니다.
오늘날 널리 사용되며 치주 치료에서 기계적 괴사조직 제거의 황금 표준으로 간주되는 금속 큐렛은 치과 임플란트 주변에서도 일반적으로 사용됩니다. 많은 제조업체들이 임플란트 표면을 손상시키지 않고 생물막 및 기타 잔류물을 제거하도록 특별히 설계된 티타늄 큐렛을 개발했습니다35. 시험관 시뮬레이션은 반복적인 기계 기기가 임플란트 표면 거칠기의 누적적 변화로 이어지지 않는다는 결론을 내렸습니다36. 그러나 경우에 따라 티타늄 큐렛은 경화되거나 광물화된 침전물을 제거하는 데 효과가 제한적일 수 있습니다. 또한 수동 티타늄 큐렛을 사용한 세척은 시간이 많이 소요될 수 있으며 작업자의 기술 수준37에 따라 달라질 수 있습니다. 현재의 증거에 기초하여, 임플란트 미시적 및 거시적 설계의 높은 이질성으로 인해 이러한 연구의 결과를 임상 실습으로 전환하는 것은 어렵습니다.
치과 임플란트가 많이 배치됨에 따라 임플란트 주위 질환의 유병률이 증가함에 따라 오염된 표면을 처리하기 위해 증거 기반 데이터로 뒷받침되는 예측 가능한 접근 방식이 필요합니다. 오염 제거 방법은 가장 일반적으로 사용되는 임플란트 표면이 골유착을 촉진하는 높은 정도의 거칠기를 나타내며, 심각한 표면 손상을 일으키지 않고 박테리아 생물막의 정량화 및 후속 제거가 표준화되어야 한다는 점을 고려해야 합니다8. 치과 재료의 나노 지형과 임플란트 표면의 거칠기를 평가하는 데 사용되는 가장 일반적인 시험관 내 방법은 정량 분석을 위한 기계 및 3D 광학(접촉 및 비접촉) 형상 측정과 정성 평가를 위한 주사 전자 현미경(SEM)입니다 12,38,40. 임플란트의 표면 거칠기를 측정하고 연구하는 것이 복잡한 이유는 정확한 가시적 패턴이 없는 공극과 결함의 존재 때문입니다41.
본 연구의 SEM 결과는 AA 처리가 가벼운 표면 변화를 일으킨다는 이전 연구 결과와 일치한 반면, 17,31 티타늄 큐렛으로 표면 지형의 상당한 평탄화가 관찰되었습니다23. SEM은 더 큰 피사계 심도와 더 큰 배율로 더 큰 시야를 사용하여 동적 범위를 제공합니다. 지형적 질감 및 재료 대비와 같은 표면 세부 사항은 나노미터 해상도까지 평가할 수 있습니다. 그러나 SEM은 그 자체로 정량적 기법이 아니며 형상 측정법이 가장 일반적인 방법인 다른 정량 기법과 결합할 때 보다 신뢰할 수 있는 데이터를 얻을 수 있습니다. 최근에는 3D 입체 사진 측량42 및 혁신적인 AI 기반 이미지 분석 소프트웨어43 가 직접 SEM 정량 측정에 사용되고 있습니다.
결론적으로, 한계 내에서, 연구 결과는 임상요법을 위한 오염 제거 방법의 선택은 임플란트 주위염 치료의 궁극적인 목표에 따라 결정되어야 함을 시사한다. 따라서, 공기 연마제 에리스리톨 파우더 시스템은 재생 요법에서 임플란트 표면에 더 부드러운 옵션으로 보이며 보다 효과적인 접근성과 오염 제거를 제공하는 반면, 표면을 평평하게 하는 티타늄 큐렛은 임플란트 주위 연조직 육아의 괴사조직 제거 및 임플란트 표면이 구강 환경에 노출된 상태로 두는 절제 요법에 권장될 수 있습니다. 초음파 PEEK 팁은 또한 임플란트 실 볏과 매끄러운 경점막 표면의 석회화된 침전물을 제거하는 데 권장됩니다. 단독으로 사용하는 것보다 사용 가능한 오염 제거 방법을 함께 사용하는 것이 가장 효과적인 접근 방식일 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
연구에 사용된 임플란트는 Dentsply Sirona의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
참고문헌
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유