Method Article
체적 근육 손실(VML) 손상의 외과적 생성 후 쥐 마세터 근육의 생체 내 기능 평가
요약
체적 근육 손실(VML) 손상은 내인성 재생 능력을 초과하여 영구적인 기능 결손을 초래합니다. 현재 VML 연구는 주로 사지 및 몸통 근육에 초점을 맞추고 있습니다. VML에 대한 기계론적 연구를 두개안면 근육으로 확장하기 위해 이 기사에서는 VML 손상 전후 교근 기능의 종단 평가를 위한 생체 내 방법을 설명합니다.
초록
체적 근육 손실(VML)은 민간인과 군인 집단에서 널리 퍼져 있으며 신체의 자연 재생 능력을 능가하는 쇠약해지는 골격근 손상을 나타냅니다. 이러한 손상은 근섬유뿐만 아니라 신경, 혈관 및 세포외 기질도 파괴하여 골격근의 재생 능력을 압도하고 심각한 섬유증과 근육 구조 및 기능의 영구적인 결핍을 초래합니다. 현재의 임상관리는 많은 한계를 가지고 있으며, 이에 따라 보다 효과적인 치료법을 개발하기 위한 연구가 진행되고 있습니다. 그러나 주목할 만한 점은 VML 손상에 대한 전임상적 강조의 상당 부분이 두개안면 근육에 대한 조사가 제한적으로 사지 및 몸통 근육에 초점을 맞추고 있다는 것입니다. 두개안면근육과 사지/몸통 근육 간의 발달 생물학 및 재생 능력의 차이는 더 많은 부상 특이적 VML 치료 옵션을 유도하는 중요한 통찰력을 제공할 수 있습니다. 또한, 기능적 회복에 대한 평가는 치료 효능을 확립하는 데 매우 중요합니다. 이와 관련하여, 경피적 신경 자극을 통한 근육 수축에 대한 생체 내 검사는 동일한 동물을 대상으로 연구 기간 동안 반복적인 기능 평가를 할 수 있는 최소 침습적 방법입니다. 이러한 고려 사항에 비추어, 본 논문은 VML 손상 전후에 랫드 교근의 근육 기능을 생체 내에서 평가하는 방법을 설명합니다. 이 프로토콜은 쥐에서 생물학적으로 관련된 두개안면 VML 손상의 생성 및 기능 평가를 자세히 설명하는 최초의 발표된 사례입니다.
서문
골격근과 관련된 연조직의 외상성 및 외과적 부상은 민간인과 부상병 모두에게 조직 재건에 있어 가장 큰 도전 중 하나로 남아 있다1. 실제로, 전장에서 발생하는 부상의 거의 20%는 부상당한 전사의 두개안면 부위(머리와 얼굴)에서도 발생합니다2. 포괄적으로, 사지 외상과 두경부 부상은 최근 분쟁에서 발생하는 전투 부상의 >80%를 차지한다2. 골격근이 부상 후 복구, 재생 및 리모델링할 수 있는 능력은 잘 알려져 있지만, 근육 조직의 상당 부분을 잃는 이러한 더 심각한 부상은 자체적으로 치유할 수 없으며 체적 근육 손실(VML) 부상이라고 합니다. 정의에 따르면, VML은 손상된 근육 또는 근육 단위3의 영구적인 미적 및 기능적 결함을 초래합니다.
흥미롭게도, 두개안면 VML 손상의 유병률에도 불구하고 2,4, 현재까지 대부분의 연구는 사지 5,6,7,8 및 몸통 9,10,11 근육에 초점을 맞추고 있으며, 두개안면 근육의 VML 손상에 대한 보고는 소수에 불과합니다 12,13,14. 현존하는 문헌에 따르면 두개안면근과 사지 및 몸통 근육 사이에 재생 능력뿐만 아니라 발달 생물학에 상당한 차이가 있음을 시사하기 때문에 이는 잠재적으로 중요한 중개 연구 격차를 나타냅니다15,16. 실제로 얼굴의 양쪽에는 20개 이상의 근육이 있는데, 이는 두개안면 부위가 눈을 깜빡이고, 삼키고, 씹는 것과 같은 다양한 필수 작업을 수행하는 데 관여한다는 사실을 반영합니다15. 또한 두개안면 근육 사이에서도 재생 능력에 관해서는 차이가 발생합니다. 예를 들어, 안구 외 근육은 사지 근육보다 더 빨리 재생되는 것으로 보인다17. 대조적으로, 교근은 경골 전방(TA)보다 느린 재생 반응을 보입니다18. 이러한 차이는 적어도 부분적으로는 근육의 기원이 branchiomeric 또는 somite-derived 중 어느 것인지에 기인할 수 있으며, 그 결과 위성 세포의 양이 다를 뿐만 아니라 상주 위성 세포 집단의 뚜렷한 유전자 발현 프로파일이 생성됩니다19. 사지 및 몸통 근육과 관련된 두개안면 근육의 독특한 특징을 고려하면 근육 특이적 VML 부상을 다루는 맞춤형 치료 옵션의 치료 개발을 개선하기 위한 중요한 기계론적 통찰력을 얻을 수 있습니다. 이러한 근육 특이적 차이는 두경부 재건 수술을 위한 기증자 근육 조직 전달 옵션으로서 광배근(latissimus dorsi)과 같은 시트형 근육의 알려진 한계를 설명할 수도 있습니다 20,21,22.
VML 부상의 위치에 관계없이 현재 완전한 형태와 기능을 회복할 수 있는 치료법은 없습니다. 황금 표준 임상 관리에는 자가 조직 이식 및 재활이 포함됩니다. 그러나 전자는 일반적으로 강도를 향상시키지 않고 기증자 부위 이환율을 유발할 수 있는 반면, 후자는 근육의 기능 회복 또는 수축 강도의 회복에 최소한의 영향을 미치면서 운동 범위를 개선합니다 1,6. 이러한 모든 이유로, VML 손상 후 기능적 근육 조직의 재생을 위한 보다 효과적인 치료 접근법을 개발하기 위한 연구가 진행 중입니다. 최근 분석에서는 VML 손상을 입힌 쥐 모델에 대한 전임상 연구가 VML 복구를 위한 재생 기술 솔루션을 발전시키는 데 매우 중요하다는 점을 강조했습니다1.
이전 연구 5,8,9,10,24,25 에서 언급했듯이 VML 후 기능 회복을 평가하는 것은 치료 개입의 효과를 평가하는 데 중요합니다. 특히, 상처 치유 및 볼륨 회복이 VML 복구의 주요 기능이지만, 부상 및 치료 후 힘 회복을 측정하면 VML 결핍의 원인이 되는 다중 스케일 생체 역학적 메커니즘과 기능 회복을 주도하는 메커니즘을 밝히는 데 도움이 됩니다. 따라서 조직 복구, 볼륨 회복 및 향상된 근력 사이의 연관성을 확립하는 것은 VML 복구를 위한 가장 효과적인 재생 솔루션을 식별하기 위한 절대적인 요구 사항입니다9.
이와 관련하여 기능 측정을 수행하는 세 가지 주요 방법이 있습니다: (1) 시험관 내, (2) 현장 테스트, (3) 생체 내 테스트이며, 각각 고유한 장점과 단점이 있습니다8. 예를 들어, 체외 검사는 살아있는 유기체 외부의 고립된 근육 기능을 검사하는 것을 포함하며, 근육 흥분성 및 수축에 영향을 미치는 다양한 약물 및 화학 물질로 근육 자극을 보다 직접적/구체적으로 조작할 수 있는 기회를 제공합니다26. 이 방법은 근육 기능과 회복의 세포 및 분자적 측면에 대한 자세한 조사를 가능하게 하지만(27), 혈액 공급과 신경 분포를 제거하여 실제 근육 기능을 얼마나 잘 요약할 수 있는지를 제한한다 8,26. 현장 검사는 근육이 여전히 자연적인 해부학적 위치에 있지만 주변 조직과 분리되어 있는 동안 근육 기능을 평가합니다25,28. 이 방법은 신경 분포와 혈액 공급을 유지하지만, 근육의 분리는 여전히 생체 내 환경에 대한 연구 결과의 적용 가능성을 제한할 수 있습니다. 또한, 아마도 가장 중요한 것은 현장 및 체외 테스트 모두 종단 테스트를 배제하는 최종 절차라는 것입니다. 이와는 대조적으로, 본래의 환경에서 근육 기능을 평가하는 생체 내 검사는 생리학적 맥락에서 근육 기능을 보다 완벽하게 이해할 수 있게 해준다29. 생체 내 연구는 또한 가장 침습성이 적은 기술이며 연구 과정에 걸쳐 반복적으로 수행할 수 있습니다29. 경피적 전기 신경 자극을 사용하면 힘줄, 혈관 구조 및 신경 분포는 그대로 유지하면서 특정 근육의 기능 측정값을 수집할 수 있습니다30. 이러한 종단적 평가는 동일한 동물의 여러 치유 단계에서 발생하는 미묘하지만 중요한 변화에 대한 통찰력을 제공할 수 있습니다. 이 방법은 일반적으로 작은 설치류 모델 8,31,32,33에 사용됩니다. 그러나 돼지30과 개34의 더 큰 동물 모델에도 사용되었습니다.
현재 두개안면 VML 손상 후 기능 회복 평가에 대한 3건의 발표된 연구가 있습니다. Rodriguez 등은 양 접합 주요 근육에서 두개안면 VML 손상 모델을 복구하는 방법에 대해 보고합니다. 그들의 방법은 최종 연구 시점에서만 구현될 수 있는 현장 테스트 프로토콜을 자세히 설명하므로 단일 동물13 내에서 종단 평가를 허용하지 않습니다. Kim et al.은 VML 손상 후 마우스 저작의 연속 근전도 데이터를 추적하기 위해 나노멤브레인 전자 장치를 사용하는 방법을 설명합니다. 그들은 대조군에 비해 부상당한 쥐의 신호가 현저히 낮다고 보고했지만, 모션 아티팩트가 신호 분석에 영향을 미치고 쥐가 때때로 회로를 긁어내려고 시도한다는 점도 지적했습니다. 또한, 나노멤브레인을 피부에 안전하게 부착할 수 있도록 무흉선, 누드 마우스를 사용했으며, 이는 현재 더 일반적으로 사용되는(그리고 비용 효율적인) 동물 모델에서 이 방법의 광범위한 활용을 방해합니다12. 마지막으로, Zhao 등은 체중 증가의 현저한 감소에 반영된 바와 같이 동물의 영양 공급을 손상시키는 마우스 교근의 심각한 크기의 VML 결함을 기능적 결과로 설명합니다14. 이러한 연구를 염두에 두고, 이 논문은 피하 전극으로 삼차 신경을 자극하여 VML 손상 전후에 쥐 턱의 수축 기능을 생체 내에서 종적으로 평가하기 위한 다재다능하고 최소 침습적인 방법을 설명합니다. 테스트가 일련의 증가하는 시뮬레이션 주파수(20-200Hz)를 통해 실행됨에 따라 변환기는 근육의 생성된 힘을 측정합니다. 이러한 측정을 통해 근육 경직과 최대 파상풍을 결정할 수 있습니다. 아래 프로토콜은 외상성 VML 부상 후 동측 교합력의 기능적 회복을 평가하기 위해 고안되었으며, 따라서 검증된 VML 손상의 외과적 생성을 위한 프로토콜도 포함합니다. 이 방법은 다양한 쥐와 생쥐에 쉽게 구현할 수 있으며, 적절한 장비 수정을 통해 더 큰 동물 모델 및 VML 부상에도 적용할 수 있습니다30.
프로토콜
모든 동물 취급 및 절차는 버지니아 대학교 기관 동물 관리 및 사용 위원회(IACUC) 지침에 따라 승인 및 수행되었습니다. 이 실험에 사용된 쥐는 12-14주 된 수컷 루이스 쥐였으며 수술 당시 체중이 324.8g ± 12.72g이었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 교근의 VML 손상
- 장비 준비
- 수술 전에 수술용 드레이프, 메스, 집게, 마이크로가위, 지혈기, 봉합사 및 거즈 등 필요한 모든 기구가 적절하게 멸균되었는지 확인하십시오.
- 가열된 플랫폼의 전원을 켜고 37°C로 설정합니다.
- 마취 시 안구 건조를 방지하기 위해 양쪽 눈에 멸균 안과 연고를 바르십시오. 동물을 마취 유도실에 넣고 2%-3% 이소플루란을 전달합니다(기관에서 승인한 프로토콜에 따름).
- VML 부상의 외과적 생성
- 동물을 챔버에서 꺼내기 전에 동물이 제대로 마취되었는지 확인하십시오.
참고: 이것은 동물이 발가락 꼬집기에 반응하지 않는지 확인할 수 있습니다. - 동물의 무게를 측정하여 왼쪽 측면 위치에 있는 수술 보드에 놓고 코를 콧방울에 단단히 고정하여 이소플루란을 계속 투여할 수 있도록 합니다.
- 적절한 진통제를 투여하고, 얼굴 오른쪽을 면도하고, 요오드와 알코올 면봉을 세 번 갈아서 해당 부위를 소독하여 동물이 수술을 받을 수 있도록 준비합니다. 이 연구에서는 진통제에 서방형 부프레노르핀(체중 0.65mg)을 사용했습니다.
- 쥐의 협측 부위를 따라 약 2cm를 절개하여 수술을 시작합니다. 절개 부위는 동물의 코와 귀와 일직선이 되어야 합니다. 둔기 박리를 사용하여 피부와 근막을 분리합니다.
- 근막을 따라 유사한 절개를 만들고 아래에 있는 교근에서 부드럽게 절개합니다.
- 협측 신경과 가장자리 신경을 찾습니다(그림 1A). 멸균 수술 마커와 자를 사용하여 제거할 영역을 표시합니다. 영역은 안면 신경 사이에 있는 노출된 교근 중앙의 10mm x 5mm 직사각형이어야 합니다(그림 1B).
- 마이크로 가위를 조심스럽게 사용하여 조직 제거를 시작하십시오. 최종 부상이 절제된 조직 150mg으로 약 4mm 깊이에 도달하도록 합니다(그림 1C). 제거된 조직은 표재성 교근의 전체 두께에서 나오며 부분적으로 깊은 교근으로 들어갑니다.
참고: 이 실험에서 제거된 조직의 평균 질량은 146.1mg ±1.16mg이었습니다. - 흡수성(6-0) 및 비흡수성(5-0) 단속 봉합사를 각각 사용하여 근막과 피부를 봉합합니다.
- 동물을 챔버에서 꺼내기 전에 동물이 제대로 마취되었는지 확인하십시오.
- 정리 및 모니터링
- 봉합 후에는 마취 가스를 끄고 가열된 표면에 동물을 두어 의식 회복을 모니터링합니다. 쥐가 의식을 되찾기 시작하면 동물을 다시 우리에 넣고 깨어나 보행할 수 있을 때까지 계속 모니터링합니다.
- 수술 후 3일 동안 동물을 확인하고 통증이나 불편함의 징후가 있는지 평가합니다.
- 수술 후 7일 동안 턱에 가해지는 부담을 줄이고 동물에게 충분한 수분과 먹이를 줄 수 있도록 부드러운 음식을 제공하십시오.
- 수술 후 7-10일 후에 중단된 봉합사를 제거하고 제거하기 전에 상처가 완전히 봉합되었는지 확인하십시오.
- 연구의 마지막 시점 이후, IACUC 지침에 따라 동물을 안락사시킵니다. 교근을 이식하고 액체 질소 또는 액체 질소 냉각 이소펜탄에 담그면 급속 동결됩니다.
참고: 냉동 조직 샘플은 향후 조직학적 평가를 위해 -80°C에서 장기간 보관할 수 있습니다.
2. 턱의 생체 내 기능 평가
- 장비 준비
- 모든 장비의 올바른 연결을 확인하고 확인하십시오.
- 순서대로 (1) 컴퓨터, (2) 이중 위상 자극기, (3) 이중 모드 레버 시스템, (4) 가열된 플랫폼의 전원을 켜서 37°C까지 가열합니다.
알림: 사용 설명서에는 정확한 판독을 생성하기 위해 자극기와 레버 시스템의 예열 시간이 1분이라고 명시되어 있습니다. 또한 동물을 테스트하기 전에 플랫폼이 완전히 가열될 때까지 10-15분 정도 기다립니다. - 마취 상태에서 안구 건조를 방지하기 위해 양쪽 눈에 멸균 안연 연고를 바르십시오. 마취 유도실에 실험할 동물을 놓고 2%-3% 이소플루란을 공급합니다.
- 폴리테트라플루오로에틸렌 코팅된 전극 팁을 70% 에탄올에 넣어 멸균합니다.
- DMC(Dynamic Muscle Control) 소프트웨어를 찾아 엽니다. 이는 기능 평가를 수행하는 데 필요합니다.
- 소프트웨어 설정
- DMC 소프트웨어의 설정 메뉴에서 Instant Stim 을 찾아 매개변수를 원하는 값으로 변경합니다. 이 연구에서는 사전 설정에서 매개변수가 변경되지 않습니다(그림 2A).
- 설정 메뉴에서 데이터를 저장할 자동 저장 폴더를 만들고 선택합니다.
- 소프트웨어 화면 아래쪽에서 Autosave Base라는 상자를 찾습니다. 예를 들어 "rat#-timepoint"와 같이 테스트 대상 동물에 특정한 제목으로 변경합니다(그림 2B).
- 소프트웨어 화면 상단에서 Sequencer 를 선택합니다. 새 창이 열리면 화면 아래쪽에 있는 Open Sequence(시퀀스 열기 )를 선택합니다. 열리는 파일 탐색기에서 미리 만들어진 시퀀스를 선택합니다. 이렇게 하면 Sequence 창이 주파수, 자극 지속 시간 및 휴식 시간과 같은 매개변수 목록으로 채워집니다(그림 2C).
- Load Sequence를 클릭한 다음 Close Window를 클릭합니다.
참고: 이 프로토콜에 사용된 시퀀스는 9단계(트위치, 20Hz, 40Hz, 50Hz, 60Hz, 80Hz, 100Hz, 150Hz, 200Hz)로 구성되며 각 단계 사이에 20초의 휴식이 있습니다. 트위치 자극을 제외하고 모든 단계의 지속 시간은 500ms입니다. 염기서열 프로토콜은 각 실험실의 특정 테스트 목표에 맞게 조정되어야 합니다.
- Load Sequence를 클릭한 다음 Close Window를 클릭합니다.
- 새 창을 열고 실시간 데이터 수집을 보려면 파일 > 라이브 데이터 모니터를 선택합니다.
- 라이브 데이터 모니터 창에서 날짜 표시줄, y 값 최소값 및 y 값 최대값을 수동으로 설정하거나 확인란을 선택하여 자동 크기 조정을 사용하도록 설정합니다.
- 동물 준비
- 동물을 마취실에서 꺼내기 전에 동물이 적절한 마취 상태에 있는지 확인하십시오.
- 동물을 콧방울 안에 코를 단단히 물고 누운 자세로 눕힌 자세로 눕혀 이소플루란을 계속 투여할 수 있도록 합니다. 쥐의 턱 위쪽 절반에 고정 고리를 놓아 코를 플랫폼에 단단히 고정합니다.
- 턱의 실험 쪽에서 동물의 목과 얼굴을 면도하십시오.
- 동물의 팔과 가슴에 끈을 놓고 고정하여 동물의 상반신을 고정합니다.
- 리그의 플랫폼 근처에 있는 세 개의 회전 손잡이를 사용하여 바이트 레버 위치를 조정하여 X, Y 및 Z 평면을 제어합니다(그림 3A). 상단 손잡이를 사용하여 물린 레버를 동물 쪽으로 내리고 다른 두 개의 손잡이를 사용하여 레버 끝을 동물의 턱 바로 위에 오도록 조정합니다.
- 핀셋을 사용하여 동물의 아래쪽 이빨에 걸린 고리를 걸어 머리를 고정하고 움직이지 않도록 합니다(그림 3B).
알림: 루프는 힘 변환기에서 3cm 떨어진 바이트 레버에 뚫린 구멍을 통해 위치합니다. 시스템을 처음 사용하기 전에 보정해야 합니다. - 레버의 높이를 조정하여 턱의 장력을 높입니다. 이 실험에 사용된 재현 가능한 기준선 장력은 ~0.5N이었습니다.
- 전극 배치
- 동물의 턱을 촉진하고 하악골의 뒤쪽 모서리를 찾습니다. 모서리 양쪽에 전극을 약 2-3mm 간격으로 피하로 배치합니다. 전극은 3-5mm 깊이에 삽입해야 합니다. 앨리게이터 클립을 사용하고 스탠드를 사용하여 전극을 제자리에 고정합니다.
- Live Data Monitor(라이브 데이터 모니터) 창에서 Instant Stim(인스턴트 스팀)이라고 표시된 큰 주황색 버튼을 클릭하여 활성화합니다.
- 모니터는 각 자극 중에 위쪽 스파이크를 표시하기 시작해야 합니다. 필요에 따라 손잡이를 사용하여 전극 배치와 레버 암 위치를 조정합니다. 턱의 동측 측면의 활성화만 관찰해야 합니다(그림 4).
- 고출력 바이페이즈 자극기의 중앙 근처에는 "Range"와 "Adjust"라고 표시된 두 개의 손잡이가 있습니다. 범위 노브를 돌려 암페어를 조절하기 시작합니다. 암페어가 증가함에 따라 순간 자극 피크는 정체될 때까지 크기가 증가하기 시작하며, 이는 세 번의 연속 자극이 동일한 수축 반응을 초래하는 수준으로 결정됩니다.
- 암페어를 너무 높게, 즉 최대 피크가 관찰된 암페어보다 20% 이상 높지 않게 돌리지 마십시오 — 이는 주변 근육의 동원과 부정확한 힘 판독값을 초래할 수 있으므로 합니다.
- 조정 노브를 돌려 백분율을 조절합니다.tage 턱을 자극하는 데 사용되는 현재 "범위"의 e. 경련 반응을 최적화하기 위해 전류의 증가 또는 감소가 필요할 수 있습니다.
- 전극이 여전히 제자리에 단단히 고정되어 있는지 확인하고 순간 자극을 중지합니다.
- 라이브 데이터 모니터의 주황색 "인스턴트 자극제" 버튼 아래에서 회색 시작 시퀀스 버튼을 찾아 클릭합니다.
- 자극 프로토콜이 지속되는 동안 곡선을 계속 모니터링합니다. 자극 주파수가 증가함에 따라 생성되는 최대 힘도 증가합니다. 파상풍에 도달하면 힘 곡선이 안정됩니다(그림 5A).
- 정리
- 기능적 자극 시퀀스가 완료되면 전극을 제거하고 70% 에탄올로 깨끗이 닦습니다. 이것이 마지막으로 테스트할 동물인 경우 전극을 덮개에 다시 넣을 수 있습니다.
- 마취 가스를 끄되 동물을 가열된 표면에 두어 의식이 돌아오는 것을 모니터링합니다. 쥐가 의식을 되찾기 시작하면 쥐를 다시 우리에 넣고 동물이 깨어나 보행할 수 있을 때까지 계속 모니터링하십시오.
- 데이터 수집에 사용되는 장비를 끄고 모든 표면을 닦습니다.
3. 데이터 분석
참고: 이 방법은 이전에 랫트 TA8의 생체 내 기능 테스트를 위한 방법을 문서화하는 것으로 설명되었습니다. 데이터 분석은 이 연구의 의도를 파악하기 위해 고안되었으며 프로토콜은 사용자의 목표에 따라 변경될 수 있습니다.
- Dynamic Muscle Analysis 소프트웨어를 찾아 엽니다.
- High Throughput 메뉴를 클릭하고 Force Frequency Analysis를 선택하여 여러 샘플을 동시에 분석합니다.
- 파일 선택을 선택하고 분석을 위해 원하는 만큼 데이터 파일을 강조 표시합니다. "폴더 선택" 버튼은 파일 시스템 내에서 샘플의 이름이 명확하게 지정된 경우에도 사용할 수 있습니다.
- Remove Baseline(베이스라인 제거) 확인란을 선택합니다. 이렇게 하면 각 시도에 대해 기록된 최대 힘에서 기준 힘이 자동으로 제거되어 절대 최대값이 제공됩니다.
- 분석 버튼을 클릭한 다음 데이터를 스프레드시트로 저장할 수 있는 Excel로 테이블 내보내기를 클릭합니다. "Start Cursor" 및 "End Cursor" 값이 자극의 타임스탬프를 정확하게 캡처하는지 확인합니다. 필요한 경우 이러한 값을 수동으로 설정할 수 있습니다.
- 저장된 스프레드시트를 엽니다.
참고: "최대" 열을 사용하여 사용자는 모든 주파수에서 생성되는 최대 힘을 계산할 수 있습니다. 힘-주파수 곡선도 생성할 수 있습니다(그림 5).
결과
이전 간행물에서 설명한 바와 같이, 테타닉 곡선은 최적 결과와 최적이 아닌 결과를 구별하는 데 사용할 수 있습니다8. 이상적인 결과는 근육이 최대한의 힘으로 자극되고 파탄적 수축이 지속되는 동안 그 최대치를 유지할 때 얻어집니다. 개별 경련을 파탄적 곡선으로 합치는 것은 일반적으로 100Hz 또는 그 이후에 나타나기 시작합니다. 그림 5A 는 150Hz에서 이상적인 곡선이 자극 시작 시 급격한 상승, 최소한의 진동으로 최대 힘 값에서 평평한 고원 위상, 자극이 중단될 때 급격한 수직 하향 스윙을 갖기 때문에 이 점을 보여줍니다. 이상적이지 않은 파탄 곡선은 고원 단계에서 진동을 보일 수 있으며 음의 또는 양의 기울기를 나타낼 수 있습니다(그림 5C, D).
이 기능 테스트 프로토콜의 결과는 연구자의 목표와 연구를 위한 실험 설계에 따라 다르게 표현될 수 있습니다. 이 프로토콜의 경우, 절대 최대 힘은 모든 자극 주파수에서 경험적으로 결정되고 테스트를 위해 각 시점에서 그래프로 표시됩니다. 이를 통해 교근에서 설명된 VML 손상이 생성된 후 4주마다 기준선 최대 힘 생성과 최대 힘 생성을 비교할 수 있습니다(그림 1D). 비교를 위해 다치지 않은 동물 코호트(n = 4)도 각 시점에서 테스트했습니다(그림 1E). 각 시점의 동물 체중도 비교했습니다(그림 1F). VML 후 4주, 8주 및 12주에 쥐는 각각 7.958 N ± 1.797 N, 7.183 N ±1.450 N 및 7.823 N ± 0.626 N의 평균 최대 힘을 생성했습니다. Fisher's Least Significant Difference (LSD) 사후 쌍별 비교를 사용한 편도 반복 측정 분산 분석(ANOVA)은 VML 손상 후 어느 시점에서나 이러한 값 간에 통계적으로 유의미한 차이가 없음을 확인했습니다. 그러나 모두 평균 기준선 힘인 10.031N ±0.564N과 크게 달랐습니다.
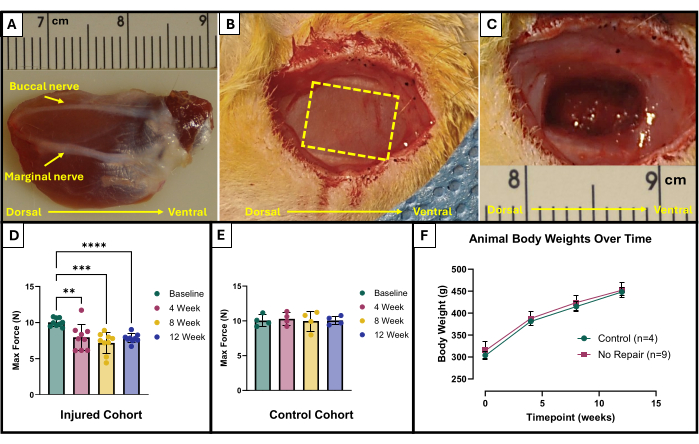
그림 1: VML 손상 교근에 대한 수술 도식 및 기능적 결과. 해부학적 방향과 부상 생성을 위한 신경 랜드마크를 보여주는 이식된 교근(Explanted masseter muscle)입니다(A). (B) 전과 (C) VML 부상 생성 후 수술 중 동물. 이미지는 모두 (A)와 같은 방향의 근육으로 표시됩니다. 노란색 점선은 근육을 절제할 부위를 나타냅니다. 교근(D)에 VML 손상(n = 9)을 입은 쥐와 부상을 입지 않은 연령 일치 대조군 쥐(n = 4)(E)에서 기준선 및 시간 경과에 따른 최대 힘 생산. 시간 경과에 따른 쥐의 체중 그래프(F). (D)는 Fisher의 LSD 사후 쌍별 비교를 사용한 일원 반복 측정 ANOVA를 나타내며, 여기서 **= p < 0.01, ***= p < 0.001, ****= p < 0.0001입니다. (A)와 (C)의 눈금자는 센티미터 단위이며 눈금은 밀리미터 단위입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 기능 테스트를 위한 소프트웨어 초기화. DMC 소프트웨어에 대한 매개변수 설정. 인스턴트 자극을 원하는 값으로 설정(A). 소프트웨어 그래픽 사용자 인터페이스 및 자동 저장 기본 설정 상자의 위치(B). 테스트(C)에 사용되는 9단계 프로토콜 시퀀스 선택. 여기에 표시된 값은 이 연구에 사용된 예제 값이지만 다른 사용 사례의 특정 사용 사례에 따라 최적화 및 조정해야 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 동작의 기능적 리그 축과 적절한 동물 위치. 개략도는 기능 테스트 장비에 있는 세 개의 조정 휠 각각과 레버 암(A)에 대한 해당 이동 축 간의 관계를 보여줍니다. 기능 테스트를 받고 있는 쥐의 예시 이미지로, 플랫폼에서 동물의 적절한 누운 자세와 기타 중요한 리그 구성 요소를 보여줍니다(B). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 테스트 중 편측 및 양측 턱 활성화의 예. (A)는 자극 전에 쥐의 턱이 정지해 있는 것을 보여줍니다. 전극을 부적절하게 삽입하면 노란색 화살표(B)로 표시된 것처럼 양측 턱 수축이 발생할 수 있으며, 전극을 적절하게 삽입하면 원하는 동측 수축(C)이 발생합니다. 노란색 화살표는 턱의 수축 지점을 나타냅니다. 또한 양측(D) 및 편측(E) 근육 활성화를 위한 150Hz에서의 힘-시간 곡선의 예도 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
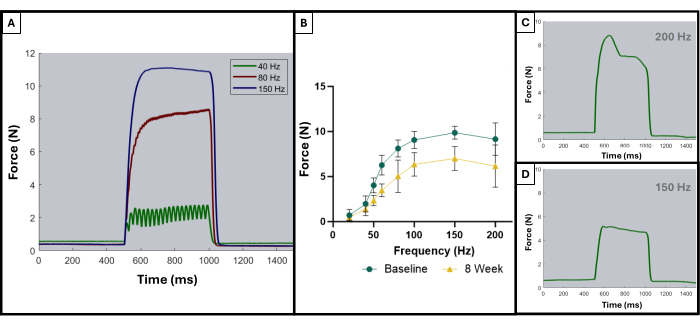
그림 5: 허용 가능한 임상시험과 허용되지 않는 임상시험에 대한 대표 자극-반응 곡선. 40, 80 및 150Hz(A)에서 자극 곡선을 예로 들어 파탄 수축으로 이어지는 동안 무엇을 찾아야 하는지 보여줍니다. 자극 주파수가 증가함에 따라 기록된 최대 장력도 더 높으며, 이는 기준선 및 VML 생성 후 8주에서 부상당한 동물의 평균(n = 9)을 보여주는 힘-주파수 곡선(B)에서 관찰할 수 있습니다. (C,D)는 부적절한 파상풍으로 인한 전극 조정의 필요성을 나타내는 힘 반응의 형태의 대표적인 예를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 쥐의 턱에서 생성되는 동측 무는 힘의 생체 내 기능 테스트를 위한 간단하고 신뢰할 수 있는 방법을 설명합니다. 또한 쥐 교근에서 VML 손상을 외과적으로 생성하는 방법에 대해서도 설명합니다. 이러한 방법들을 조합하여 외상성 두개안면 손상 전후의 기능 회복에 대한 종단 평가를 수행하기 위해 생물학적으로 관련된 동물 모델을 제공합니다. 시험관내(in vitro) 및 현장(in situ)과 같은 다른 검사 방법도 귀중한 정보를 제공할 수 있지만, 힘줄을 분리하고 원래 환경에서 조직을 제거해야 하므로 생체 내 기능적 결과를 더 잘 이해할 수 있는 적용 가능성이 제한됩니다 8,25,26,27,28 . 적절한 훈련과 연습을 통해 연구자는 실험을 위해 동물을 신속하게 배치하고 최대 근육 힘 생산을 달성하기 위해 필요한 조정을 할 수 있습니다.
적절한 전극 배치와 자극을 보장하기 위해 각 동물에 대해 검증해야 하는 기술적 세부 사항이 있습니다. 먼저, 랫의 머리가 가열된 플랫폼에 완전히 닿도록 위쪽 앞니를 고정해야 합니다. 이것은 또한 흡입 마취제의 지속적인 투여를 위해 쥐의 코를 콧방울에 놓을 것입니다. 헤드가 적절한 위치에 유지되지 않으면 기준선 장력이 벗어남에 따라 힘 판독값에 불일치가 있습니다. 또한 동물의 몸은 누워있어야 하고 척추는 곧아야 합니다. 동물을 적절한 위치에 유지하면 올바른 위치에서 전극을 배치하고 유지 관리하는 데 도움이 됩니다. 마지막으로, 전극의 배치는 턱의 실험적인 면만 자극하기 위해 적절한 깊이와 간격으로 배치되어야 하기 때문에 어려울 수 있습니다. 경계와 연습은 재현 가능하고 신뢰할 수 있는 결과를 위해 전극 배치에 능숙해지는 것과 관련이 있습니다. 전극은 다소 빨리 무뎌 지므로 자주 교체해야합니다. 잘못된 전극 배치의 특징은 액세서리 근육의 활성화, 양/음으로 기울어진 힘 판독값(자극 중 전극의 이동) 또는 융합되지 않은/진동하는 파탄파파형 8입니다(그림 5C,D).
또한 이 방법에는 이 시스템의 향후 응용 프로그램에서 언급하고 고려해야 하는 몇 가지 제한 사항이 있습니다. 첫째, 이 연구에서 이루어진 측정에는 충분하지만 위턱을 고정하는 데 사용되는 루프는 가장 견고한 시스템이 아닐 수 있습니다. 대신, 이어바를 사용하는 입체적 접근 방식은 쥐의 위턱을 더 잘 잡을 수 있습니다. 또한, 이 방법으로 테스트하기 위한 설정 위치로 수동 장력 값이 사용되었으며, 이는 근육이 최적의 길이(Lo)로 위치할 경우 얻을 수 있는 최대 힘 생성을 초래하지 않을 수 있습니다. 사실상,L-o는 본원에 기재된 바와 같이 동물을 위치시키고, 이어서 경련 자극을 실행하면서 조-폐색을 작은(0.5-1mm) 증분으로 조작함으로써 결정될 수 있다 -L-o는 최대 경련력이 생성된 최적의 시험 위치로서 결정된다. 그러나, 교근은 다소 독특한 기하학과 운동(35,36)을 가지고 있으며, 따라서 예를 들어 사지근(일반적으로 Lo 주변에서 작동)의 특성보다 훨씬 더 넓은 범위의 길이에 걸쳐 작동한다. 그러나 씹는 것은 무는 것에 비해 좁은 범위에서 발생합니다. 따라서 이 문제에 대한 완벽한 접근 방식은 없습니다. 따라서 기준선 장력을 설정하는 것이 이 문제에 접근하는 유일한 방법은 아니지만, 턱 근육의 최적 길이는 턱의 자연스러운 개방을 넘어서기 때문에 그렇게 하는 것에 대한 논리적이고 과학적인 근거가 있습니다. 그럼에도 불구하고, 주어진 수동적 장력에서 최대 힘은 Lo에서의 최대 힘과 다르더라도 여전히 기능의 측면에 대한 중요한 통찰력을 제공합니다. 분명히, 교근의 힘-길이 관계에 대한 추가 조사가 필요합니다. 마지막으로, 이 방법은 쥐의 삼차 신경의 자극을 살펴보며, 이는 V1-V3의 세 가지로 나뉩니다. V3 또는 하악 신경은 운동 구성 요소가 있는 유일한 가지이지만 교근, 측두근, 익상편 및 mylohyoid37을 포함한 여러 근육에 신경을 분포시킵니다. 이는 이 방법이 다른 연구 조사와 관련될 수 있는 교근 힘을 독점적으로 보고하지 않는다는 것을 의미하기 때문에 고려하는 것이 중요합니다.
이러한 기술적 측면과 한계에도 불구하고 이 방법은 강력하고 일관된 것으로 입증되었습니다. 본 명세서에서는 동측 검사만 기술되어 있지만, 프로토콜은 턱의 다른 쪽에 대한 추가 검사를 포함하도록 쉽게 수정될 수 있습니다. 교근 수축/기능에 대한 양측성 검사를 통해 단일 동물 내에서 건강/손상 비교를 할 수 있으며, 아마도 손상 및/또는 대조 측(손상되지 않은 쪽)에서 중요한 보상 변화를 설명할 수 있습니다. 전반적으로 이 모델은 최소 침습적 방식으로 종방향 근육 기능과 기능 회복을 평가하기 위한 강력한 도구를 제공합니다. 따라서 이 시스템은 VML 매개 기능 결함에 수반되는 생체 역학적 메커니즘을 평가하고 두개안면 영역의 VML 손상 복구를 위한 다양한 치료법의 효능을 테스트하는 데 적용할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
기능 평가를 수행하는 데 사용되는 장비를 공유해 주신 Myologica LLC. 이 간행물에 보고된 연구는 미국 국립보건원(National Institutes of Health)의 국립 치과 및 두개안면 연구소(National Institute of Dental & Craniofacial Research)의 지원을 받았으며 수상 번호는 U24 DE029463입니다. 이 내용은 전적으로 저자의 책임이며 반드시 미국 국립보건원(National Institutes of Health)의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
참고문헌
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유