Method Article
In vivo Funktionsbeurteilung des Kaumuskels von Ratten nach chirurgischer Entstehung einer Verletzung durch volumetrischen Muskelverlust (VML)
In diesem Artikel
Zusammenfassung
Verletzungen des volumetrischen Muskelverlusts (VML) übersteigen die endogene Regenerationsfähigkeit, was zu dauerhaften funktionellen Defiziten führt. Die aktuelle VML-Forschung konzentriert sich vor allem auf die Gliedmaßen- und Rumpfmuskulatur. Um mechanistische Studien von VML auf kraniofaziale Muskeln auszudehnen, wird in diesem Artikel eine in vivo Methode zur longitudinalen Beurteilung der Funktion der Kaumuskulatur vor und nach einer VML-Verletzung beschrieben.
Zusammenfassung
Volumetrischer Muskelabbau (VML) ist in der zivilen und militärischen Bevölkerung weit verbreitet und stellt eine schwächende Verletzung der Skelettmuskulatur dar, die die natürliche Regenerationsfähigkeit des Körpers übersteigt. Diese Verletzungen stören nicht nur die Muskelfasern, sondern auch Nerven, Blutgefäße und die extrazelluläre Matrix, was die Regenerationsfähigkeit der Skelettmuskulatur überfordert und zu schwerer Fibrose und dauerhaften Mängeln in der Muskelstruktur und -funktion führt. Das derzeitige klinische Management hat viele Einschränkungen, und daher wird an der Entwicklung wirksamerer Therapieansätze geforscht. Bemerkenswert ist jedoch, dass sich ein Großteil des präklinischen Schwerpunkts auf VML-Verletzungen auf die Gliedmaßen- und Rumpfmuskulatur konzentriert hat, während die kraniofazialen Muskeln nur begrenzt untersucht wurden. Unterschiede in der Entwicklungsbiologie und der Regenerationsfähigkeit zwischen kraniofazialen und Gliedmaßen-/Rumpfmuskeln können entscheidende Erkenntnisse liefern, die zu verletzungsspezifischeren VML-Behandlungsoptionen führen. Darüber hinaus ist die Bewertung der funktionellen Wiederherstellung entscheidend für die Feststellung der therapeutischen Wirksamkeit. In diesem Zusammenhang ist die In-vivo-Testung der Muskelkontraktion mit perkutaner Nervenstimulation eine minimalinvasive Methode, die eine wiederholte funktionelle Beurteilung im Laufe einer Studie - am selben Tier - ermöglicht. Vor dem Hintergrund dieser Überlegungen wird in dieser Arbeit eine Methode zur in vivo Beurteilung der Muskelfunktion im Kaumuskel der Ratte vor und nach einer VML-Verletzung beschrieben. Dieses Protokoll ist die erste veröffentlichte Instanz, die die Entstehung und funktionelle Bewertung einer biologisch relevanten kraniofazialen VML-Verletzung bei der Ratte detailliert beschreibt.
Einleitung
Traumatische und chirurgische Verletzungen des Weichgewebes, die die darunterliegende Skelettmuskulatur betreffen, sind nach wie vor eine der größten Herausforderungen für die Geweberekonstruktion sowohl für Zivilisten als auch für verwundete Krieger1. Tatsächlich ereignen sich fast 20 % der Verletzungen auf dem Schlachtfeld auch in den kraniofazialen Regionen verwundeter Krieger (Kopf und Gesicht)2. Einschließlich Extremitätentraumata sowie Kopf- und Nackenverletzungen machen >80 % der Kampfverletzungen in den jüngsten Konflikten aus2. Trotz der recht bekannten Fähigkeit der Skelettmuskulatur, nach Verletzungen zu reparieren, zu regenerieren und umzubauen, sind diese schwereren Verletzungen, die mit dem Verlust eines erheblichen Teils des Muskelgewebes einhergehen, nicht in der Lage, von selbst zu heilen und werden als Verletzungen des volumetrischen Muskelverlusts (VML) bezeichnet. Per Definition kommt es bei der VML zu dauerhaften ästhetischen und funktionellen Defiziten entweder des verletzten Muskels oder der Muskeleinheit3.
Interessanterweise konzentriert sich trotz der Prävalenz von kraniofazialen VML-Verletzungen 2,4 ein Großteil der bisherigen Forschung auf die Muskeln der Gliedmaßen 5,6,7,8 und des Rumpfes 9,10,11, wobei es nur eine Handvoll Berichte über VML-Verletzungen in der kraniofazialen Muskulaturgibt 12,13,14 . Dies stellt eine potenziell wichtige translationale Forschungslücke dar, da die vorhandene Literatur darauf hindeutet, dass es signifikante Unterschiede sowohl in der Entwicklungsbiologie als auch in der Regenerationsfähigkeit zwischen kraniofazialen und Gliedmaßen- und Rumpfmuskulatur gibt15,16. Tatsächlich gibt es mehr als 20 Muskeln auf jeder Seite des Gesichts – was die Tatsache widerspiegelt, dass die kraniofaziale Region an der Ausführung vieler so unterschiedlicher Aufgaben wie Blinzeln, Schlucken und Kauen beteiligt ist15. Darüber hinaus ergeben sich auch unter den kraniofazialen Muskeln Unterschiede in Bezug auf die Regenerationsfähigkeit. Zum Beispiel scheinen sich extraokulare Muskeln schneller zu regenerieren als die Gliedmaßenmuskeln17. Im Gegensatz dazu zeigt der Kaumuskel eine langsamere Regenerationsreaktion als der Tibialis anterior (TA)18. Diese Unterschiede könnten zumindest teilweise darauf zurückzuführen sein, ob die Ursprünge der Muskeln branchiomer oder von Somiten abstammen – was sowohl zu unterschiedlichen Mengen an Satellitenzellen als auch zu unterschiedlichen Genexpressionsprofilen der ansässigen Satellitenzellpopulationen führt19. Die Berücksichtigung der einzigartigen Merkmale der kraniofazialen Muskulatur sowie der Gliedmaßen- und Rumpfmuskulatur kann wichtige mechanistische Erkenntnisse für eine verbesserte therapeutische Entwicklung maßgeschneiderter Behandlungsoptionen zur Behandlung muskelspezifischer VML-Verletzungen liefern. Diese muskelspezifischen Unterschiede könnten auch bekannte Einschränkungen von blattartigen Muskeln, wie dem Latissimus dorsi, als Spendermuskelgewebetransferoptionen für rekonstruktive Operationen am Kopf und Hals erklären 20,21,22.
Unabhängig von der Lokalisation der VML-Verletzung gibt es derzeit keine Behandlungen, die die volle Form und Funktion wiederherstellen können. Das klinische Goldstandard-Management umfasst sowohl den autologen Gewebetransfer als auch die Rehabilitation; Ersteres verbessert jedoch in der Regel nicht die Kraft und kann zu einer Morbidität an der Spenderstelleführen 3,23, während letzteres den Bewegungsumfang verbessert, mit minimalen Auswirkungen auf die funktionelle Wiederherstellung oder die Rückkehr der kontraktilen Kraft im Muskel 1,6. Aus all diesen Gründen wird daran geforscht, effektivere Therapieansätze für die Regeneration von funktionellem Muskelgewebe nach einer VML-Verletzung zu entwickeln. Eine kürzlich durchgeführte Analyse unterstrich die entscheidende Bedeutung präklinischer Studien an Rattenmodellen für VML-Verletzungen für die Weiterentwicklung regenerativer Technologielösungen für die VML-Reparatur1.
Wie in früheren Arbeiten 5,8,9,10,24,25 erwähnt, ist die Beurteilung der funktionellen Erholung nach VML entscheidend für die Bewertung der Wirksamkeit therapeutischer Interventionen. Während die Wundheilung und die Volumenwiederherstellung Schlüsselmerkmale der VML-Reparatur sind, hilft die Messung der Kraftwiederherstellung nach Verletzung und Behandlung, die mehrskaligen biomechanischen Mechanismen, die für VML-Defizite verantwortlich sind, sowie die Mechanismen, die die funktionelle Wiederherstellung vorantreiben, zu beleuchten. Daher ist die Herstellung eines Zusammenhangs zwischen Gewebereparatur, Volumenwiederherstellung und verbesserter Muskelkraft eine absolute Voraussetzung, um die wirksamsten regenerativen Lösungen für die VML-Reparaturzu identifizieren 9.
In diesem Zusammenhang gibt es drei Hauptmethoden für diese funktionellen Messungen: (1) In-vitro-, (2) In-situ- und (3) In-vivo-Tests – wobei jede ihre eigenen Vor- und Nachteile bietet8. Zum Beispiel beinhalten In-vitro-Tests die Untersuchung isolierter Muskelfunktionen außerhalb des lebenden Organismus und bieten die Möglichkeit, die Muskelstimulation mit einer Vielzahl von Medikamenten und Chemikalien, die die Erregbarkeit und Kontraktion der Muskeln beeinflussen, direkter/spezifischer zu manipulieren26. Obwohl diese Methode detaillierte Untersuchungen der zellulären und molekularen Aspekte der Muskelfunktion und -regeneration ermöglicht27, entfernt sie die Blutversorgung und -innervation, was die Reprise der wahren Muskelfunktion einschränkt 8,26. In-situ-Tests beurteilen die Muskelfunktion, während sich der Muskel noch an seiner natürlichen anatomischen Stelle, aber isoliert vom umgebenden Gewebe befindet25,28. Während bei dieser Methode die Innervation und Blutversorgung erhalten bleiben, kann die Trennung des Muskels die Anwendbarkeit der Befunde auf die in vivo-Umgebung einschränken. Darüber hinaus, und das ist vielleicht am wichtigsten, handelt es sich sowohl bei In-situ- als auch bei In-vitro-Tests um terminale Verfahren, die Längsschnitttests ausschließen - die notwendig sind, um die funktionelle Wiederherstellung im Laufe der Zeit am selben Tier verfolgen zu können. Im Gegensatz dazu ermöglichen In-vivo-Tests, bei denen die Muskelfunktion in ihrer natürlichen Umgebung bewertet wird, ein vollständigeres Verständnis der Muskelleistung in einem physiologischen Kontext29. In-vivo-Studien sind auch die am wenigsten invasive Technik und können im Laufe einer Studie wiederholt durchgeführt werden29. Mit Hilfe der perkutanen elektrischen Nervenstimulation kann man funktionelle Messungen in bestimmten Muskeln durchführen, während Sehnen, Gefäße und Innervation intakt bleiben30. Diese Längsschnittuntersuchungen können Einblicke in subtile, aber wichtige Veränderungen geben, die in verschiedenen Stadien der Heilung bei ein und demselben Tier auftreten. Diese Methode wird häufig bei kleinen Nagetieren derModelle 8,31,32,33 angewendet; Es wurde jedoch auch in größeren Tiermodellen von Schwein30 und Hund34 verwendet.
Derzeit gibt es drei veröffentlichte Studien zur Beurteilung der funktionellen Erholung nach kraniofazialen VML-Verletzungen. Rodriguez et al. berichten über eine Methode zur Reparatur eines kraniofazialen VML-Verletzungsmodells im Musculus zygomaticus major des Schafs. Ihre Methode beschreibt ein In-situ-Testprotokoll , das nur zum Zeitpunkt der Endstudie implementiert werden kann und daher keine Längsschnittbewertung innerhalb eines einzelnen Tieres zulässt13. Kim et al. beschreiben eine Methode zur Verwendung von Nanomembranelektronik zur Verfolgung kontinuierlicher Elektromyogrammdaten des Kauens von Mäusen nach einer VML-Verletzung. Sie berichteten über ein signifikant geringeres Signal von verletzten Mäusen im Vergleich zur Kontrolle, stellten jedoch auch fest, dass Bewegungsartefakte die Signalanalyse beeinflussten und dass die Mäuse gelegentlich versuchten, den Schaltkreis abzukratzen. Zusätzlich wurden athyme Nacktmäuse verwendet, um eine sichere Befestigung der Nanomembran an der Haut zu ermöglichen, was derzeit eine breitere Anwendung dieser Methode in gebräuchlicheren (und kostengünstigeren) Tiermodellen verhindert12. Schließlich beschreiben Zhao et al. als funktionelles Ergebnis einen kritisch großen VML-Defekt im Mausmasseter, der die Ernährung der Tiere beeinträchtigt, was sich in einer signifikant verringerten Körpergewichtszunahme widerspiegelt14. Vor dem Hintergrund dieser Studien wird in diesem Artikel eine vielseitige und minimal-invasive Methode zur in vivo longitudinalen Beurteilung der kontraktilen Funktion im Rattenkiefer vor und nach einer VML-Verletzung durch Stimulation des Nervus trigeminus mit subkutanen Elektroden beschrieben. Während der Test eine Reihe von ansteigenden Simulationsfrequenzen (20-200 Hz) durchläuft, misst ein Wandler die erzeugte Kraft des Muskels. Diese Messungen können unter anderem die Bestimmung der Muskelsteifigkeit und des maximalen Tetanus ermöglichen. Das folgende Protokoll dient der Beurteilung der funktionellen Wiederherstellung der ipsilateralen Bisskraft nach einer traumatischen VML-Verletzung und enthält daher auch ein Protokoll für die chirurgische Herstellung einer validierten VML-Verletzung. Diese Methode lässt sich leicht an einer Vielzahl von Ratten und Mäusen anwenden – und ist mit entsprechenden Gerätemodifikationen auch auf größere Tiermodelle und VML-Verletzungen anwendbar30.
Protokoll
Der Umgang mit den Tieren und die Verfahren wurden in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee (IACUC) der University of Virginia genehmigt und durchgeführt. Bei den Ratten, die in diesen Experimenten verwendet wurden, handelte es sich um 12 bis 14 Wochen alte männliche Lewis-Ratten, die zum Zeitpunkt der Operation 324,8 g ± 12,72 g wogen. Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. VML-Verletzung des Kaumuskels
- Vorbereitung der Ausrüstung
- Stellen Sie vor der Operation sicher, dass alle erforderlichen Instrumente ordnungsgemäß sterilisiert wurden: OP-Abdecktücher, Skalpell, Pinzette, Mikroschere, Hämostaten, Nähte und Gaze.
- Schalten Sie eine beheizte Plattform ein und stellen Sie sie auf 37 °C ein.
- Tragen Sie eine sterile Augensalbe auf beide Augen auf, um Augentrockenheit unter Narkose zu verhindern. Setzen Sie das Tier in die Anästhesie-Induktionskammer und verabreichen Sie 2%-3% Isofluran (gemäß institutionell anerkannten Protokollen).
- Chirurgische Entstehung von VML-Verletzungen
- Stellen Sie sicher, dass das Tier ordnungsgemäß betäubt ist, bevor Sie es aus der Kammer nehmen.
HINWEIS: Dies kann festgestellt werden, wenn das Tier nicht auf ein Zehenkneifen reagiert. - Wiegen Sie das Tier und legen Sie es in der seitlichen Position auf der linken Seite auf ein Operationsbrett, wobei die Nase fest im Nasenkonus liegt, um eine fortgesetzte Verabreichung von Isofluran zu ermöglichen.
- Bereiten Sie das Tier auf die Operation vor, indem Sie das geeignete Analgetikum verabreichen, die rechte Gesichtshälfte rasieren und den Bereich durch drei Jod- und Alkoholtupfer sterilisieren. Für diese Studien wurde Buprenorphin mit verlängerter Freisetzung zur Analgesie (0,65 mg/kg Körpergewicht) verwendet.
- Beginnen Sie die Operation mit einem etwa 2 cm langen Schnitt entlang der bukkalen Region der Ratte. Der Schnitt sollte in einer Linie mit der Nase und dem Ohr des Tieres erfolgen. Verwenden Sie eine stumpfe Dissektion, um die Haut und die Faszien zu trennen.
- Machen Sie einen ähnlichen Schnitt entlang der Faszie und präparieren Sie ihn vorsichtig vom darunter liegenden Kaumuskel weg.
- Lokalisieren Sie den bukkalen und marginalen Nerv (Abbildung 1A). Verwenden Sie einen sterilen chirurgischen Marker und ein Lineal, um den zu entfernenden Bereich zu markieren. Der Bereich sollte ein 10 mm x 5 mm großes Rechteck in der Mitte des freiliegenden Kaumuskels sein, der zwischen den Gesichtsnerven liegt (Abbildung 1B).
- Verwenden Sie vorsichtig eine Mikroschere, um mit der Gewebeentnahme zu beginnen. Stellen Sie sicher, dass die endgültige Verletzung mit 150 mg exzidiertem Gewebe eine Tiefe von ca. 4 mm erreicht (Abbildung 1C). Das entnommene Gewebe wird aus der vollen Dicke des oberflächlichen Kaumuskels entnommen und teilweise in den tiefen Kaumuskel übertragen.
HINWEIS: Die durchschnittliche Masse des in diesen Experimenten entfernten Gewebes betrug 146,1 mg ±1,16 mg. - Verschließen Sie die Faszie und die Haut mit resorbierbaren (6-0) bzw. nicht resorbierbaren (5-0) unterbrochenen Nähten.
- Stellen Sie sicher, dass das Tier ordnungsgemäß betäubt ist, bevor Sie es aus der Kammer nehmen.
- Aufräumen und Überwachen
- Schalten Sie nach dem Nähen das Narkosegas aus und halten Sie das Tier auf der erhitzten Oberfläche, um seine Rückkehr zum Bewusstsein zu überwachen. Sobald die Ratte wieder zu Bewusstsein kommt, setzen Sie das Tier zurück in den Käfig und setzen Sie die Überwachung fort, bis es wach und gehfähig ist.
- Untersuchen Sie das Tier 3 Tage lang nach der Operation und untersuchen Sie es auf Anzeichen von Schmerzen oder Beschwerden.
- Geben Sie dem Tier 7 Tage lang nach der Operation weiches Futter, um die Belastung des Kiefers zu verringern und die Tiere gut mit Flüssigkeit zu versorgen.
- Entfernen Sie die unterbrochenen Nähte 7-10 Tage nach der Operation und stellen Sie sicher, dass die Wunde vor der Entfernung vollständig verschlossen ist.
- Nach dem Endpunkt der Studie die Tiere gemäß den IACUC-Richtlinien einschläfern. Explantieren Sie die Kaumuskeln und frieren Sie sie ein, indem Sie in flüssigen Stickstoff oder flüssigstickstoffgekühltes Isopentan eintauchen.
HINWEIS: Gefrorene Gewebeproben können für eine zukünftige histologische Beurteilung langfristig bei -80 °C gelagert werden.
2. In-vivo-Funktionsbeurteilung des Kiefers
- Vorbereitung der Ausrüstung
- Überprüfen und stellen Sie sicher, dass alle Geräte ordnungsgemäß angeschlossen sind.
- Schalten Sie in dieser Reihenfolge (1) den Computer, (2) den biphasigen Stimulator, (3) das Dual-Mode-Hebelsystem und schließlich (4) eine beheizte Plattform ein, um ihn auf 37 °C zu erwärmen.
HINWEIS: In der Bedienungsanleitung wird eine Aufwärmzeit von 1 Minute angegeben, damit das Stimulator- und Hebelsystem genaue Messwerte erzeugt. Lassen Sie außerdem 10-15 Minuten warten, bis sich die Plattform vollständig aufgeheizt hat, bevor Sie Tiere testen. - Tragen Sie sterile Augensalbe auf beide Augen auf, um Augentrockenheit unter Narkose zu verhindern. Legen Sie das zu testende Tier in die Anästhesie-Induktionskammer und geben Sie 2%-3% Isofluran.
- Sterilisieren Sie die mit Polytetrafluorethylen beschichteten Elektrodenspitzen, indem Sie sie in 70%iges Ethanol legen.
- Suchen und öffnen Sie die Dynamic Muscle Control (DMC) Software. Dies ist erforderlich, um die Funktionsbewertung durchzuführen.
- Software-Einrichtung
- Suchen Sie in der DMC-Software im Setup-Menü nach Instant Stim und ändern Sie die Parameter auf die gewünschten Werte. In dieser Studie werden keine Parameter von ihren Voreinstellungen verändert (Abbildung 2A).
- Erstellen Sie im Menü "Setup " einen Ordner zum Speichern der Daten, und wählen Sie ihn aus.
- Suchen Sie am unteren Rand des Softwarebildschirms ein Feld mit dem Titel Autosave Base. Ändern Sie dies in einen Titel, der für das zu testende Tier spezifisch ist, z. B. "rat#-timepoint" (Abbildung 2B).
- Wählen Sie oben auf dem Software-Bildschirm die Option Sequencer aus. Wählen Sie im neuen Fenster, das sich öffnet, unten auf dem Bildschirm die Option Sequenz öffnen aus. Wählen Sie die vorgefertigte Sequenz im sich öffnenden Datei-Explorer aus. Dadurch wird das Sequenzfenster mit einer Liste von Parametern wie Häufigkeit, Dauer der Stimuli und Ruhezeit gefüllt (Abbildung 2C).
- Klicken Sie auf Ladesequenz und dann auf Fenster schließen.
HINWEIS: Die in diesem Protokoll verwendete Sequenz besteht aus 9 Schritten (Twitch, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) mit jeweils 20 s Pause. Abgesehen von der Twitch-Stimulation sind alle Schritte 500 ms lang. Das Sequenzprotokoll sollte an die spezifischen Testziele jedes Labors angepasst werden.
- Klicken Sie auf Ladesequenz und dann auf Fenster schließen.
- Um ein neues Fenster zu öffnen und die Anzeige der Echtzeit-Datenerfassung zu aktivieren, wählen Sie Datei > Live Data Monitor aus.
- Legen Sie im Fenster Live Data Monitor die Zeitskala, das Y-Wert-Minimum und das Y-Wert-Maximum manuell fest oder aktivieren Sie das Kontrollkästchen, um die automatische Skalierung zu aktivieren.
- Zubereitung von Tieren
- Stellen Sie sicher, dass sich das Tier in der richtigen Anästhesieebene befindet, bevor Sie es aus der Anästhesiekammer nehmen.
- Bringen Sie das Tier in Rückenlage mit der Nase fest in den Nasenkonus, um eine weitere Verabreichung von Isofluran zu ermöglichen. Legen Sie eine Sicherungsschlaufe über die obere Hälfte des Kiefers der Ratte, um ihre Nase sicher auf der Plattform zu halten.
- Rasieren Sie den Hals und das Gesicht des Tieres auf der Versuchsseite des Kiefers.
- Sichern Sie die obere Hälfte des Tieres, indem Sie einen Gurt über seine Arme und Brust legen und befestigen.
- Stellen Sie die Position des Bisshebels mit den drei Drehknöpfen in der Nähe der Plattform des Bohrgeräts ein, um die X-, Y- und Z-Ebenen zu steuern (Abbildung 3A). Bringen Sie den Beißhebel mit dem oberen Knopf nach unten in Richtung des Tieres und stellen Sie mit den anderen beiden Knöpfen das Ende des Hebels so ein, dass es sich knapp über dem Kinn des Tieres befindet.
- Haken Sie die Aufhängeschlaufe mit einer Pinzette um die unteren Zähne des Tieres ein, um den Kopf zu sichern und zu verhindern, dass er sich bewegt (Abbildung 3B).
HINWEIS: Die Schlaufe befindet sich durch ein Loch, das 3 cm vom Kraftaufnehmer entfernt in den Bisshebel gebohrt wurde. Das System sollte vor dem ersten Gebrauch kalibriert werden. - Stellen Sie die Höhe des Hebels ein, um die Spannung auf den Kiefer zu erhöhen. Die reproduzierbare Ausgangsspannung, die in diesen Experimenten verwendet wurde, betrug ~0,5 N.
- Platzierung der Elektroden
- Palpieren Sie den Kiefer des Tieres ab und lokalisieren Sie die hintere Ecke des Unterkiefers. Positionieren Sie die Elektroden subkutan um beide Seiten der Ecke in einem Abstand von ca. 2-3 mm. Die Elektroden sollten in einer Tiefe von 3-5 mm eingeführt werden. Verwenden Sie eine Krokodilklemme und einen Ständer, um die Elektroden in Position zu halten.
- Klicken Sie im Live Data Monitor-Fenster auf die große orangefarbene Schaltfläche mit der Bezeichnung Instant Stim , um es zu aktivieren.
- Der Monitor sollte bei jeder Stimulation Aufwärtsspitzen anzeigen. Passen Sie die Elektrodenplatzierung und die Position des Hebelarms mit den Knöpfen nach Bedarf an. Es sollte nur eine Aktivierung der ipsilateralen Seite des Kiefers beobachtet werden (Abbildung 4).
- Auf dem leistungsstarken Bi-Phasen-Stimulator befinden sich in der Mitte zwei Knöpfe, die mit "Range" und "Adjust" beschriftet sind. Beginnen Sie mit dem Drehen des Range-Reglers, um die Stromstärke zu modulieren. Mit zunehmender Stromstärke nehmen die Instant-Stim-Spitzen zu, bis sie ein Plateau erreichen - bestimmt als das Niveau, bei dem drei aufeinanderfolgende Stimulationen zu identischen kontraktilen Reaktionen führen.
- Vermeiden Sie es, die Stromstärke zu hoch zu drehen, d. h. nicht mehr als 20 % über der Stromstärke, bei der maximale Spitzen beobachtet wurden, da dies zur Rekrutierung benachbarter Muskeln und ungenauen Kraftmesswerten führen kann.
- Drehen Sie den Einstellknopf , um den Prozentsatz des aktuellen "Bereichs" zu modulieren, der zur Stimulation des Kiefers verwendet wird. Eine Erhöhung oder Abnahme des Stroms kann erforderlich sein, um die Twitch-Reaktion zu optimieren.
- Vergewissern Sie sich, dass die Elektroden noch fest an ihrem Platz sind, und stoppen Sie die sofortige Stimulation.
- Suchen Sie unter dem orangefarbenen "Instant Stim"-Button im Live-Datenmonitor den grauen Button "Startsequenz " und klicken Sie darauf.
- Überwachen Sie die Kurven während der gesamten Dauer des Stimulationsprotokolls. Mit zunehmender Stimulationsfrequenz steigt auch die maximal erzeugte Kraft. Sobald Tetanus erreicht ist, erreichen die Kraftkurven ein Plateau (Abbildung 5A).
- Aufputzend
- Entfernen Sie nach Beendigung der funktionellen Stimulationssequenz die Elektroden und wischen Sie sie mit 70%igem Ethanol sauber. Wenn dies das letzte Tier ist, das getestet wird, können die Elektroden wieder in ihre Abdeckungen eingesetzt werden.
- Schalten Sie das Narkosegas aus, aber halten Sie das Tier auf der erhitzten Oberfläche, um seine Rückkehr ins Bewusstsein zu überwachen. Sobald die Ratte wieder zu Bewusstsein kommt, setzen Sie sie wieder in den Käfig und setzen Sie die Überwachung fort, bis das Tier wach und gehfähig ist.
- Schalten Sie die für die Datenerfassung verwendeten Geräte aus und wischen Sie alle Oberflächen ab.
3. Datenanalyse
HINWEIS: Diese Methode wurde bereits als Dokumentation eines Verfahrens zur In-vivo-Funktionsprüfung der Ratte TA8 beschrieben. Die Datenanalyse dient dazu, die Absichten dieser Studie zu bestimmen, und die Protokolle können sich je nach den Zielen des Benutzers ändern.
- Suchen und öffnen Sie die Software für die dynamische Muskelanalyse .
- Klicken Sie auf das Menü "Hoher Durchsatz" und wählen Sie "Kraft-Frequenz-Analyse ", um mehrere Proben gleichzeitig zu analysieren.
- Wählen Sie Dateien auswählen und markieren Sie so viele Datendateien wie gewünscht für die Analyse. Die Schaltfläche "Ordner auswählen" kann auch verwendet werden, wenn Samples innerhalb des Dateisystems eindeutig benannt sind.
- Aktivieren Sie das Kontrollkästchen zum Entfernen der Baseline. Dadurch wird die Basiskraft automatisch von der maximalen Kraft entfernt, die für jeden Versuch aufgezeichnet wurde, und es werden die absoluten Maximalwerte bereitgestellt.
- Klicken Sie auf die Schaltfläche Analysieren und dann auf Tabelle nach Excel exportieren , wo die Daten als Tabelle gespeichert werden können. Stellen Sie sicher, dass die Werte "Start Cursor" und "End Cursor" den Zeitstempel der Stimulation genau erfassen. Diese Werte können bei Bedarf manuell festgelegt werden.
- Öffnen Sie die gespeicherte Tabelle.
HINWEIS: In der Spalte "Maximum" kann der Benutzer die maximale Kraft berechnen, die über alle Frequenzen erzeugt wird. Auch die Kraft-Frequenz-Kurve kann erstellt werden (Abbildung 5).
Ergebnisse
Wie in einer früheren Veröffentlichung beschrieben, können die tetanischen Kurven verwendet werden, um optimale von suboptimalen Ergebnissen zu unterscheiden8. Ein ideales Ergebnis wird erzielt, wenn der Muskel bis zu seiner maximalen Kraft stimuliert wird und dieses Maximum während der gesamten Dauer der tetanischen Kontraktion beibehält. Die Summierung der einzelnen Zuckungen in tetanische Kurven beginnt in der Regel bei oder nach 100 Hz. Abbildung 5A zeigt diesen Punkt, da die ideale Kurve bei 150 Hz zu Beginn der Stimulation einen starken Aufschwung, eine flache Plateauphase beim maximalen Kraftwert mit minimaler Oszillation und einen scharfen, vertikalen Abschwung aufweist, wenn die Stimulation aufhört. Nicht-ideale tetanische Kurven können während der Plateauphase Oszillationen zeigen und eine negative oder positive Steigung aufweisen (Abbildung 5C,D).
Die Ergebnisse dieses Funktionstestprotokolls können je nach den Zielen der Forscher und dem Versuchsdesign für die Studie unterschiedlich dargestellt werden. Im Falle dieses Protokolls wird die absolute Maximalkraft aus allen Stimulationsfrequenzen empirisch bestimmt und zu jedem Zeitpunkt für die Prüfung grafisch dargestellt. Dies ermöglicht einen Vergleich der maximalen Kraftproduktion zu Studienbeginn mit der maximalen Kraftproduktion alle 4 Wochen nach der Entstehung der beschriebenen VML-Verletzung im Kaumuskel (Abbildung 1D). Zum Vergleich wurde zu jedem Zeitpunkt auch eine Kohorte von unverletzten Tieren (n = 4) getestet (Abbildung 1E). Die Tiergewichte zu jedem Zeitpunkt wurden ebenfalls verglichen (Abbildung 1F). 4, 8 bzw. 12 Wochen nach der VML erzeugten die Ratten eine durchschnittliche maximale Kraft von 7,958 N ±1,797 N, 7,183 N ±1,450 N und 7,823 N ± 0,626 N. Die einseitige Analyse der Varianz (ANOVA) mit der Fisherschen Kleinwertdifferenz (LSD) nach paarweisen Vergleichen ergab, dass es zu keinem Zeitpunkt nach der VML-Verletzung statistisch signifikante Unterschiede zwischen diesen Werten gab. sie unterschieden sich jedoch alle signifikant von der durchschnittlichen Ausgangskraft von 10,031 N ±0,564 N.
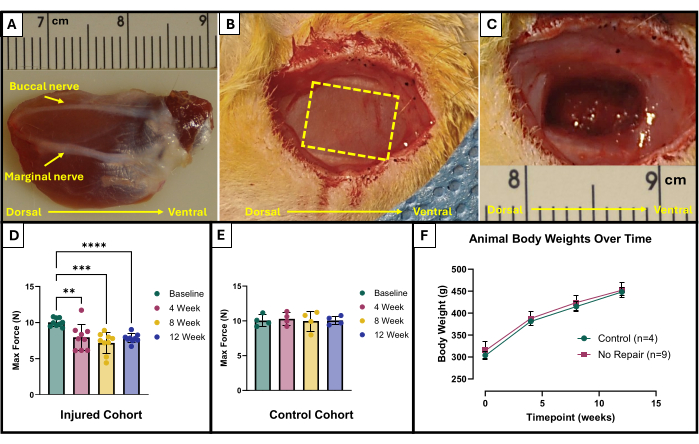
Abbildung 1: Chirurgisches Schema und funktionelle Ergebnisse des VML-verletzten Kaumuskels. Explantierter Kaumuskel mit anatomischer Orientierung sowie Nervenorientierungspunkten für die Entstehung von Verletzungen (A). Tier während der Operation vor (B) und nach (C) VML-Verletzungsentstehung. Die Bilder werden alle mit Muskeln in der gleichen Ausrichtung wie (A) dargestellt. Die gelbe gestrichelte Linie zeigt den Bereich an, in dem der Muskel exzidiert werden soll. Maximale Kraftproduktion zu Studienbeginn und über die Zeit bei Ratten, die eine VML-Verletzung (n = 9) am Kaumuskel erlitten haben (D), sowie bei altersgleichen Kontrollratten, die unverletzt blieben (n = 4) (E). Ein Diagramm des Körpergewichts von Ratten im Zeitverlauf (F). (D) stellt eine unidirektionale ANOVA mit wiederholten Messungen mit Fishers LSD-Post-hoc-Paarvergleichen dar, wobei **= p < 0,01, ***= p < 0,001, ****= p < 0,0001 beträgt. Lineale in (A) und (C) sind in Zentimetern angegeben, mit Abstufungen in Millimetern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Software-Initialisierung für Funktionstests. Parametereinstellung für die DMC-Software. Einrichten von Instant Stim auf die gewünschten Werte (A). Grafische Benutzeroberfläche der Software und Position des Einstellfelds für die AutoSave-Basis (B). Auswahl der 9-stufigen Protokollsequenz, die für die Prüfung (C) verwendet wird. Bei den hier angezeigten Werten handelt es sich um Beispielwerte, die für diese Studie verwendet wurden, aber sie müssen je nach den spezifischen Anwendungsfällen anderer möglicherweise optimiert und angepasst werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Funktionale Bewegungsachsen des Rigs und korrekte Positionierung der Tiere. Die Darstellung veranschaulicht schematisch den Zusammenhang zwischen den drei Einstellrädern auf dem Funktionsprüfstand und den entsprechenden Bewegungsachsen für den Hebelarm (A). Beispielbild einer Ratte, die einem Funktionstest unterzogen wird, das die korrekte Positionierung des Tieres in Rückenlage auf der Plattform und anderen wichtigen Komponenten des Bohrgeräts zeigt (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Beispiel für eine einseitige und beidseitige Kieferaktivierung während des Versuchs. (A) zeigt den Kiefer der Ratte in Ruhe vor jeder Stimulation. Unsachgemäß platzierte Elektroden können zu einer beidseitigen Kieferkontraktion führen, wie durch die gelben Pfeile (B) angezeigt, während richtig platzierte Elektroden zu der gewünschten ipsilateralen Kontraktion führen (C). Gelbe Pfeile zeigen Kontraktionspunkte im Kiefer an. Ebenfalls gezeigt sind beispielhafte Kraft-Zeit-Kurven bei 150 Hz für die bilaterale (D) und unilaterale (E) Muskelaktivierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
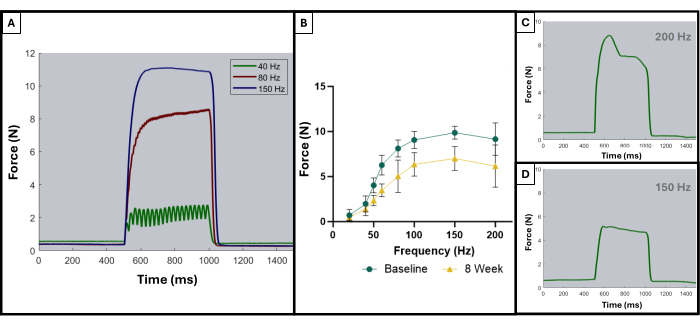
Abbildung 5: Repräsentative Stimulations-Reaktions-Kurven für akzeptable und inakzeptable Studien. Beispiele für Stimulationskurven bei 40, 80 und 150 Hz (A), um zu zeigen, worauf man vor und während einer tetanischen Kontraktion achten sollte. Mit zunehmender Stimulationsfrequenz ist auch die aufgezeichnete Spitzenspannung höher, was in den Kraft-Frequenz-Kurven (B) zu sehen ist, die den Durchschnitt der verletzten Tiere (n = 9) zu Studienbeginn und 8 Wochen nach der VML-Bildung zeigen. (C, D) demonstrieren repräsentative Beispiele für die Form einer Kraftreaktion, die auf die Notwendigkeit einer Elektrodeneinstellung aufgrund eines unsachgemäßen Tetanus hinweisen würde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt ein einfaches und zuverlässiges Verfahren zur in vivo Funktionsprüfung der im Kiefer der Ratte erzeugten ipsilateralen Bisskraft. Ebenfalls beschrieben wird ein Verfahren zur chirurgischen Herstellung einer VML-Verletzung im Ratten-Kaumuskel. In Kombination bieten diese Methoden ein biologisch relevantes Tiermodell, um eine longitudinale Bewertung der funktionellen Erholung vor und nach einer traumatischen kraniofazialen Verletzung durchzuführen. Während andere Testmethoden, wie z. B. in vitro und in situ, ebenfalls wertvolle Informationen liefern können, erfordern sie jedoch die Isolierung der Sehne und die Entfernung des Gewebes aus seiner natürlichen Umgebung, was ihre Anwendbarkeit auf ein besseres Verständnis der funktionellen Ergebnisse in vivo einschränkt 8,25,26,27,28. Mit dem richtigen Training und der richtigen Übung wird ein Forscher in der Lage sein, ein Tier schnell für Tests zu positionieren und die notwendigen Anpassungen vorzunehmen, um eine maximale Muskelkraftproduktion zu erreichen.
Es gibt technische Details, die für jedes Tier überprüft werden sollten, um die richtige Platzierung und Stimulation der Elektrode zu gewährleisten. Zunächst sollten die oberen Schneidezähne so gesichert werden, dass der Rattenkopf vollständig mit der beheizten Plattform in Kontakt steht. Dadurch bleibt auch die Nase der Ratte im Nasenkegel platziert, um eine kontinuierliche Verabreichung des Inhalationsanästhetikums zu ermöglichen. Wenn der Kopf nicht in der richtigen Position gehalten wird, kommt es zu Inkonsistenzen in den Kraftmesswerten, da die Grundspannung abweicht. Darüber hinaus sollte der Körper des Tieres in Rückenlage liegen und seine Wirbelsäule gerade sein. Wenn Sie das Tier in der richtigen Position halten, hilft dies bei der Platzierung und Wartung der Elektrode an der richtigen Stelle. Schließlich kann die Platzierung der Elektroden schwierig sein, da sie in der richtigen Tiefe und im richtigen Abstand platziert werden müssen, um nur die experimentelle Seite des Kiefers zu stimulieren. Wachsamkeit und Übung sind unerlässlich, um bei der Elektrodenplatzierung für reproduzierbare und zuverlässige Ergebnisse zu geübt zu werden. Die Elektroden werden ziemlich schnell stumpf, daher ist es notwendig, sie häufig zu wechseln. Die Kennzeichen einer schlechten Elektrodenplatzierung sind die Aktivierung der akzessorischen Muskeln, positiv / negativ geneigte Kraftmesswerte (Bewegung der Elektroden während der Stimulation) oder eine nicht fusionierte/oszillierende tetanische Wellenform8 (Abbildung 5C, D).
Darüber hinaus gibt es einige Einschränkungen bei dieser Methode, die es rechtfertigen, bei zukünftigen Anwendungen dieses Systems erwähnt und in Betracht gezogen zu werden. Erstens, obwohl sie für die in dieser Studie durchgeführten Messungen ausreichend ist, ist die Schlaufe, die zur Sicherung des Oberkiefers verwendet wird, möglicherweise nicht das steifste System. Stattdessen könnte ein stereotaktischer Ansatz mit Ohrstangen einen besseren Halt des Oberkiefers der Ratte schaffen. Zusätzlich wurde ein passiver Spannungswert als Sollposition für den Test mit dieser Methode verwendet, der möglicherweise nicht zu der maximalen Krafterzeugung führt, die erzielt würde, wenn der Muskel in seiner optimalen Länge (Lo) positioniert würde. Tatsächlich könnte das Lo bestimmt werden, indem das Tier wie hierin beschrieben positioniert und dann der Kieferverschluss in kleinen (0,5 bis 1 mm) Schritten manipuliert wird, während Twitch-Stimulationen durchgeführt werden - wobei Lo als die optimale Testposition bestimmt wird, in der die maximale Twitch-Kraft erzeugt wurde. Der Kaumuskel hat jedoch eine ziemlich einzigartige Geometrie und Fortbewegung35,36 und arbeitet daher über einen viel größeren Längenbereich, als dies beispielsweise für die Gliedmaßenmuskulatur charakteristisch ist (die typischerweise um Lo herum arbeitet). Allerdings findet das Kauen im Vergleich zum Beißen in einem engen Bereich statt. Daher gibt es keinen perfekten Ansatz für dieses Problem. Auch wenn das Einstellen einer Grundspannung nicht die einzige Möglichkeit ist, dieses Problem anzugehen, gibt es eine logische wissenschaftliche Begründung dafür, da die optimale Länge der Kiefermuskulatur über die natürliche Öffnung des Kiefers hinausgeht. Unabhängig davon gibt die maximale Kraft bei einer gegebenen passiven Spannung immer noch wichtige Einblicke in Aspekte der Funktion - auch wenn sie sich von der maximalen Kraft bei Lo unterscheiden. Es liegt auf der Hand, dass eine weitere Untersuchung des Kraft-Längen-Verhältnisses des Kaumuskels gerechtfertigt ist. Schließlich befasst sich diese Methode mit der Stimulation des Trigeminusnervs bei der Ratte, der in drei Äste unterteilt ist: V1-V3. Während V3 oder der Nervus mandibularis der einzige Ast mit einer motorischen Komponente ist, innerviert er mehrere Muskeln, einschließlich des Kaumuskels, der Temporalis, der Pterygoide und des Mylohyoides37. Dies ist wichtig zu berücksichtigen, da es bedeutet, dass diese Methode nicht ausschließlich die Kaukraft erfasst, was für andere Forschungsuntersuchungen relevant sein kann.
Trotz dieser technischen Aspekte und Einschränkungen erweist sich diese Methode als robust und konsistent. Obwohl hierin nur die ipsilaterale Testung beschrieben wird, könnte das Protokoll leicht modifiziert werden, um zusätzliche Tests der anderen Seite des Kiefers einzubeziehen. Bilaterale Tests der Kaumuskelkontraktion/-funktion würden es ermöglichen, gesunde/verletzte Vergleiche innerhalb eines einzelnen Tieres durchzuführen und möglicherweise wichtige kompensatorische Veränderungen auf der verletzten und/oder Kontrollseite (unverletzte Seite) aufzuklären. Insgesamt bietet dieses Modell ein leistungsfähiges Instrument, um die longitudinale Muskelfunktion sowie die funktionelle Wiederherstellung auf minimalinvasive Weise zu beurteilen. Als solches wird dieses System sowohl zur Bewertung biomechanischer Mechanismen, die mit VML-vermittelten funktionellen Defiziten einhergehen, als auch zur Prüfung der Wirksamkeit verschiedener Therapeutika zur Reparatur von VML-Verletzungen im kraniofazialen Bereich anwendbar sein.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Myologica LLC für die gemeinsame Nutzung der Geräte, die zur Durchführung von Funktionsbewertungen verwendet werden. Die in dieser Veröffentlichung berichtete Forschung wurde vom National Institute of Dental & Craniofacial Research der National Institutes of Health unter der Fördernummer U24 DE029463 unterstützt. Der Inhalt liegt ausschließlich in der Verantwortung der Autoren und gibt nicht unbedingt die offizielle Meinung der National Institutes of Health wieder.
Materialien
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Referenzen
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten