Method Article
Evaluación funcional in vivo del músculo masetero de ratas después de la creación quirúrgica de una lesión de pérdida muscular volumétrica (VML)
En este artículo
Resumen
Las lesiones por pérdida muscular volumétrica (VML) superan la capacidad regenerativa endógena, lo que resulta en déficits funcionales permanentes. La investigación actual de VML se centra principalmente en los músculos de las extremidades y el tronco. Para extender los estudios mecanicistas de la VML a los músculos craneofaciales, este artículo describe un método in vivo para la evaluación longitudinal de la función del músculo masetero antes y después de la lesión de la VML.
Resumen
La pérdida muscular volumétrica (VML, por sus siglas en inglés) es prevalente en poblaciones civiles y militares y representa una lesión debilitante del músculo esquelético que supera la capacidad regenerativa natural del cuerpo. Estas lesiones alteran no solo las fibras musculares, sino también los nervios, los vasos sanguíneos y la matriz extracelular, abrumando la capacidad regenerativa del músculo esquelético y provocando fibrosis grave y deficiencias permanentes en la estructura y función muscular. El manejo clínico actual tiene muchas limitaciones y, por lo tanto, se están realizando investigaciones para desarrollar enfoques terapéuticos más efectivos. Sin embargo, cabe destacar que gran parte del énfasis preclínico en las lesiones de VML se ha centrado en los músculos de las extremidades y el tronco, con una investigación limitada sobre los músculos craneofaciales. Las diferencias en la biología del desarrollo y la capacidad regenerativa entre los músculos craneofaciales y los músculos de las extremidades/tronco pueden proporcionar información crucial que impulse opciones de tratamiento de VML más específicas para la lesión. Además, la evaluación de la recuperación funcional es fundamental para establecer la eficacia terapéutica. En este sentido, las pruebas in vivo de la contracción muscular con estimulación nerviosa percutánea son un método mínimamente invasivo que permite una evaluación funcional repetida a lo largo de un estudio, en el mismo animal. A la luz de estas consideraciones, este artículo describe un método para la evaluación in vivo de la función muscular en el músculo masetero de rata antes y después de una lesión VML. Este protocolo es el primer caso publicado que detalla la creación y evaluación funcional de una lesión craneofacial VML biológicamente relevante en la rata.
Introducción
Las lesiones traumáticas y quirúrgicas de los tejidos blandos que involucran el músculo esquelético subyacente siguen siendo uno de los mayores desafíos para la reconstrucción de tejidos, tanto para los civiles comopara los guerreros heridos. De hecho, casi el 20% de las lesiones en el campo de batalla también ocurren en las regiones craneofaciales de los guerreros heridos (cabeza y cara)2. De manera inclusiva, los traumatismos en las extremidades y las lesiones en la cabeza y el cuello representan el >80% de las lesiones en combate en conflictos recientes2. A pesar de la capacidad bastante conocida del músculo esquelético para reparar, regenerar y remodelar después de una lesión, estas lesiones más graves, que implican la pérdida de una parte sustancial del tejido muscular, no son capaces de curarse por sí solas y se denominan lesiones de pérdida muscular volumétrica (VML). Por definición, la LMV da lugar a déficits estéticos y funcionales permanentes del músculo lesionado o de la unidad muscular3.
Curiosamente, a pesar de la prevalencia de la lesión craneofacial de la VML 2,4, gran parte de la investigación hasta la fecha se centra en los músculos de la extremidad 5,6,7,8 y del tronco 9,10,11, con solo un puñado de informes sobre lesiones de la VML en los músculos craneofaciales 12,13,14. Esto presenta un vacío potencialmente importante en la investigación traslacional, ya que la literatura existente sugiere que existen diferencias significativas tanto en la biología del desarrollo como en la capacidad regenerativa entre los músculos craneofaciales y de las extremidades y el tronco15,16. De hecho, hay más de 20 músculos a cada lado de la cara, lo que refleja el hecho de que la región craneofacial está involucrada en la realización de muchas tareas esenciales tan diversas como parpadear, tragar ymasticar. Además, incluso entre los músculos craneofaciales, surgen diferencias con respecto a la capacidad regenerativa. Por ejemplo, los músculos extraoculares parecen regenerarse más rápidamente que los músculos de las extremidades17. Por el contrario, el masetero muestra una respuesta regenerativa más lenta que el tibial anterior (TA)18. Estas diferencias pueden deberse, al menos en parte, a si los orígenes de los músculos son branquiómeros o derivados de los somitos, lo que da lugar a diferentes cantidades de células satélite, así como a distintos perfiles de expresión génica delas poblaciones de células satélite residentes. La consideración de las características únicas entre los músculos craneofaciales, así como en relación con los músculos de las extremidades y el tronco, puede arrojar información mecanicista importante para mejorar el desarrollo terapéutico de opciones de tratamiento personalizadas que aborden las lesiones musculares específicas de la VML. Estas diferencias específicas del músculo también pueden explicar las limitaciones conocidas de los músculos en forma de lámina, como el dorsal ancho, como opciones de transferencia de tejido muscular donante para cirugías reconstructivas de cabeza y cuello 20,21,22.
Independientemente de la ubicación de la lesión VML, actualmente no existen tratamientos que puedan restaurar la forma y la función completas. El tratamiento clínico de referencia incluye la transferencia de tejido autólogo, así como la rehabilitación; Sin embargo, el primero no suele mejorar la fuerza y puede dar lugar a morbilidad en la zona donante 3,23, mientras que el segundo mejora la amplitud de movimiento, con un impacto mínimo en la recuperación funcional o en el retorno de la fuerza contráctil en el músculo 1,6. Por todas estas razones, se está investigando para desarrollar enfoques terapéuticos más efectivos para la regeneración del tejido muscular funcional después de una lesión de VML. Un análisis reciente puso de manifiesto la importancia crítica de los estudios preclínicos en modelos de lesiones por VML en ratas para el avance de las soluciones de tecnología regenerativa para la reparación de VML1.
Como se señaló en trabajos previos 5,8,9,10,24,25, la evaluación de la recuperación funcional después de la VML es crítica para evaluar la efectividad de las intervenciones terapéuticas. Específicamente, si bien la cicatrización de heridas y la recuperación del volumen son características clave de la reparación de VML, la medición de la recuperación de la fuerza después de la lesión y el tratamiento ayuda a arrojar luz sobre los mecanismos biomecánicos multiescala responsables de los déficits de VML, así como los mecanismos que impulsan la recuperación funcional. Como tal, establecer un vínculo entre la reparación de tejidos, la recuperación de volumen y la mejora de la fuerza muscular es un requisito absoluto para identificar las soluciones regenerativas más eficaces para la reparación de VML9.
A este respecto, existen tres métodos principales para realizar estas mediciones funcionales: (1) in vitro, (2) in situ y (3) pruebas in vivo, cada uno de los cuales ofrece sus propias ventajas y desventajas8. Por ejemplo, las pruebas in vitro implican el examen de la función muscular aislada fuera del organismo vivo y brindan la oportunidad de manipular de manera más directa / específica la estimulación muscular con una variedad de medicamentos y productos químicos que afectan la excitabilidad y contracción muscular26. Aunque este método permite investigaciones detalladas sobre los aspectos celulares y moleculares de la función muscular y la recuperación27, elimina el suministro de sangre y la inervación, lo que limita la capacidad de recapitulación de la verdadera función muscular 8,26. Las pruebas in situ evalúan la función muscular mientras el músculo aún se encuentra en su ubicación anatómica natural, pero aislado de los tejidos circundantes25,28. Si bien este método mantiene la inervación y el suministro de sangre, la separación del músculo aún puede limitar la aplicabilidad de los hallazgos al entorno in vivo. Además, y quizás lo más importante, tanto las pruebas in situ como las in vitro son procedimientos terminales que excluyen las pruebas longitudinales, que son necesarias para permitir el seguimiento de la recuperación funcional a lo largo del tiempo en el mismo animal. Por el contrario, las pruebas in vivo, que implican la evaluación de la función muscular en su entorno nativo, permiten una comprensión más completa del rendimiento muscular en un contexto fisiológico29. Los estudios in vivo son también la técnica menos invasiva y pueden realizarse repetidamente a lo largo de un estudio29. Mediante la estimulación nerviosa eléctrica percutánea, se pueden recoger medidas funcionales en músculos específicos dejando intactos los tendones, la vasculatura y la inervación30. Estas evaluaciones longitudinales pueden proporcionar información sobre cambios sutiles, pero importantes, que ocurren durante las diferentes etapas de curación en el mismo animal. Este método se emplea comúnmente en modelos de roedores pequeños 8,31,32,33; sin embargo, también se ha utilizado en modelos animales más grandes de cerdo30 y perro34.
Actualmente hay tres estudios publicados sobre la evaluación de la recuperación funcional después de lesiones craneofaciales de VML. Rodríguez et al. informan sobre un método para reparar un modelo de lesión craneofacial VML en el músculo cigomático mayor ovino. Su método detalla un protocolo de pruebas in situ que solo puede implementarse en el punto de tiempo de estudio terminal y, por lo tanto, no permite la evaluación longitudinal dentro de un solo animal13. Kim et al. describen un método para el uso de la electrónica de nanomembranas para rastrear datos de electromiograma continuos de la masticación del ratón después de una lesión VML. Informaron una señal significativamente menor de los ratones lesionados en comparación con el control, sin embargo, también notaron que los artefactos de movimiento afectaban el análisis de la señal y que los ratones ocasionalmente intentaban rascar el circuito. Además, se utilizaron ratones atímicos y desnudos para permitir la fijación segura de la nanomembrana a la piel, lo que actualmente impide una utilización más amplia de este método en modelos animales más utilizados (y rentables)12. Finalmente, Zhao et al. describen un defecto VML de tamaño crítico en el masetero de ratón, que perjudica la nutrición en los animales, como resultado funcional reflejado en una disminución significativa de la ganancia de peso corporal14. Teniendo en cuenta estos estudios, este artículo describe un método versátil y mínimamente invasivo para la evaluación longitudinal in vivo de la función contráctil en la mandíbula de rata antes y después de una lesión de VML mediante la estimulación del nervio trigémino con electrodos subcutáneos. A medida que la prueba se ejecuta a través de una serie de frecuencias de simulación crecientes (20-200 Hz), un transductor mide la fuerza generada por el músculo. Estas mediciones pueden permitir determinar la rigidez muscular y el tétanos máximo, entre otros. El siguiente protocolo está diseñado para evaluar la recuperación funcional de la fuerza de mordida ipsilateral después de una lesión traumática de VML y, como tal, también incluye un protocolo para la creación quirúrgica de una lesión VML validada. Este método se puede implementar fácilmente en una amplia variedad de ratas y ratones y, con las modificaciones adecuadas en el equipo, también es aplicable a modelos de animales más grandes y lesiones por VML30.
Protocolo
Todo el manejo y los procedimientos de los animales fueron aprobados y realizados de acuerdo con las pautas del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Virginia (IACUC). Las ratas utilizadas en estos experimentos eran ratas Lewis macho de 12 a 14 semanas de edad, con un peso de 324,8 g ± 12,72 g en el momento de la cirugía. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Lesión VML del músculo masetero
- Preparación de equipos
- Antes de la cirugía, asegúrese de que todos los instrumentos necesarios se hayan esterilizado adecuadamente: paños quirúrgicos, bisturí, fórceps, microtijeras, hemostáticos, suturas y gasas.
- Encienda una plataforma calefactada y ajústela a 37 °C.
- Aplique ungüento oftálmico estéril en ambos ojos para prevenir la sequedad ocular bajo anestesia. Colocar al animal en la cámara de inducción de anestesia y administrar isoflurano al 2%-3% (siguiendo los protocolos aprobados institucionalmente).
- Creación quirúrgica de la lesión VML
- Asegúrese de que el animal esté debidamente anestesiado antes de sacarlo de la cámara.
NOTA: Esto se puede determinar si el animal no responde a un pellizco en el dedo del pie. - Pese y coloque al animal en una tabla de cirugía en posición lateral sobre su lado izquierdo, con la nariz firmemente en el cono de la nariz para permitir la administración continua de isoflurano.
- Prepare al animal para la cirugía administrando el analgésico adecuado, afeitando el lado derecho de la cara y esterilizando el área mediante tres cambios de yodo e hisopos con alcohol. Para estos estudios, se utilizó buprenorfina de liberación prolongada para la analgesia (0,65 mg/kg de peso corporal).
- Comience la cirugía haciendo una incisión de aproximadamente 2 cm a lo largo de la región bucal de la rata. La incisión debe estar en línea con la nariz y la oreja del animal. Use una disección roma para separar la piel y la fascia.
- Haga una incisión similar a lo largo de la fascia y diseccione suavemente para separarla del masetero subyacente.
- Localice los nervios bucal y marginal (Figura 1A). Utilice un marcador quirúrgico estéril y una regla para marcar el área que se va a extirpar. El área debe ser un rectángulo de 10 mm x 5 mm en el centro del masetero expuesto, que se encuentra entre los nervios faciales (Figura 1B).
- Use cuidadosamente las microtijeras para comenzar la extracción de tejido. Asegúrese de que la lesión final alcance una profundidad de aproximadamente 4 mm con 150 mg de tejido extirpado (Figura 1C). El tejido extraído será de todo el espesor del masetero superficial y se introducirá parcialmente en el masetero profundo.
NOTA: La masa media de tejido extraído en estos experimentos fue de 146,1 mg ±1,16 mg. - Cierre la fascia y la piel con suturas interrumpidas reabsorbibles (6-0) y no absorbibles (5-0), respectivamente.
- Asegúrese de que el animal esté debidamente anestesiado antes de sacarlo de la cámara.
- Limpieza y monitoreo
- Después de la sutura, apague el gas anestésico y mantenga al animal en la superficie caliente para monitorear su regreso a la conciencia. Una vez que la rata comience a recuperar la conciencia, vuelva a colocar al animal en la jaula y continúe monitoreando hasta que esté despierto y ambulatorio.
- Durante los 3 días posteriores a la cirugía, revise al animal y evalúe si hay signos de dolor o molestias.
- Durante los 7 días posteriores a la cirugía, proporcione al animal alimento blando para reducir la tensión en la mandíbula y mantener a los animales bien hidratados/alimentados.
- Retire las suturas interrumpidas de 7 a 10 días después de la cirugía, asegurándose de que la herida esté completamente cerrada antes de la extracción.
- Después del punto de tiempo terminal del estudio, eutanasiar a los animales de acuerdo con las pautas de IACUC. Explante los músculos maseteros y congele rápidamente sumergiéndolos en nitrógeno líquido o isopentano enfriado por nitrógeno líquido.
NOTA: Las muestras de tejido congelado pueden almacenarse a largo plazo a -80 °C para futuras evaluaciones histológicas.
2. Evaluación funcional in vivo de la mandíbula
- Preparación de equipos
- Verifique y asegure la conexión correcta de todos los equipos.
- Para ello, encienda (1) el ordenador, (2) el estimulador bifásico, (3) el sistema de palanca de modo dual y, por último, (4) una plataforma calefactada para calentarlo a 37 °C.
NOTA: El manual del usuario establece un tiempo de calentamiento de 1 minuto para que el estimulador y el sistema de palanca produzcan lecturas precisas. Además, espere de 10 a 15 minutos para que la plataforma se caliente por completo antes de probar a los animales. - Aplique ungüento oftalmológico estéril en ambos ojos para prevenir la sequedad ocular bajo anestesia. Colocar el animal a examinar en la cámara de inducción de anestesia y suministrar isoflurano al 2%-3%.
- Esterilice las puntas de los electrodos recubiertas de politetrafluoroetileno colocándolas en etanol al 70%.
- Localice y abra el software Dynamic Muscle Control (DMC). Esto será necesario para realizar la evaluación funcional.
- Configuración del software
- En el software DMC, busque Instant Stim en el menú de configuración y cambie los parámetros a los valores deseados. En este estudio, no se cambia ningún parámetro de sus ajustes preestablecidos (Figura 2A).
- En el menú Configuración , cree y seleccione una carpeta de guardado automático para almacenar los datos.
- Cerca de la parte inferior de la pantalla del software, ubique un cuadro titulado Autosave Base. Cambie esto a un título específico para el animal que se está probando, por ejemplo, "rata#-punto de tiempo" (Figura 2B).
- Seleccione Secuenciador en la parte superior de la pantalla del software. En la nueva ventana que se abre, seleccione Abrir secuencia en la parte inferior de la pantalla. Seleccione la secuencia predefinida en el explorador de archivos que se abre. Esto llenará la ventana de secuencia con una lista de parámetros como la frecuencia, la duración de los estímulos y el tiempo de descanso (Figura 2C).
- Haga clic en Secuencia de carga seguido de Cerrar ventana.
NOTA: La secuencia utilizada en este protocolo consta de 9 pasos (contracción, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) con 20 s de descanso entre cada uno. Aparte de la estimulación de las contracciones, todos los pasos tienen una duración de 500 ms. El protocolo de secuencia debe ajustarse a los objetivos específicos de las pruebas de cada laboratorio.
- Haga clic en Secuencia de carga seguido de Cerrar ventana.
- Para abrir una nueva ventana y habilitar la visualización de la adquisición de datos en tiempo real, seleccione File > Live Data Monitor.
- En la ventana Monitor de datos en directo , establezca la escala de tiempo, el valor y el valor mínimo y el valor y máximo manualmente o marcando la casilla para habilitar el escalado automático.
- Preparación animal
- Asegúrese de que el animal esté en el plano adecuado de anestesia antes de retirarlo de la cámara de anestesia.
- Coloque al animal en posición supina con la nariz firmemente en el cono de la nariz para permitir la administración continua de isoflurano. Coloca un lazo de seguridad sobre la mitad superior de la mandíbula de la rata para mantener su nariz firmemente en la plataforma.
- Afeita el cuello y la cara del animal en el lado experimental de la mandíbula.
- Asegure la mitad superior del animal colocando y sujetando una correa a través de sus brazos y pecho.
- Ajuste la posición de la palanca de mordida usando las tres perillas giratorias ubicadas cerca de la plataforma del equipo para controlar los planos X, Y y Z (Figura 3A). Usando la perilla superior, lleve la palanca de mordida hacia el animal y use las otras dos perillas para ajustar el extremo de la palanca para que quede justo sobre la barbilla del animal.
- Use pinzas para enganchar el lazo para colgar alrededor de los dientes inferiores del animal para asegurar la cabeza y evitar que se mueva (Figura 3B).
NOTA: El bucle se encuentra a través de un orificio perforado en la palanca de mordida a 3 cm del transductor de fuerza. El sistema debe calibrarse antes del primer uso. - Ajuste la altura de la palanca para aumentar la tensión en la mordaza. La tensión de base reproducible utilizada en estos experimentos fue de ~0,5 N.
- Colocación de electrodos
- Palpar la mandíbula del animal y localizar la esquina posterior de la mandíbula. Coloque los electrodos subcutáneamente alrededor de cada lado de la esquina a una distancia aproximada de 2-3 mm. Los electrodos deben insertarse a una profundidad de 3-5 mm. Use una pinza de cocodrilo y un soporte para mantener los electrodos en su posición.
- En la ventana del Monitor de datos en vivo , haga clic en el botón naranja grande con la etiqueta Instant Stim para activarlo.
- El monitor debe comenzar a mostrar picos ascendentes durante cada estimulación. Ajuste la ubicación del electrodo y la posición del brazo de la palanca usando las perillas según sea necesario. Solo se debe observar la activación del lado ipsilateral de la mandíbula (Figura 4).
- En el estimulador bifásico de alta potencia, hay dos perillas cerca del centro, etiquetadas como "Rango" y "Ajuste". Comience a girar la perilla de rango para modular el amperaje. A medida que aumenta el amperaje, los picos de estimulación instantánea comenzarán a aumentar en magnitud hasta que se estabilicen, determinado como el nivel en el que tres estimulaciones consecutivas dan como resultado respuestas contráctiles idénticas.
- Evite girar el amperaje demasiado alto, es decir, no más del 20% por encima del amperaje donde se observaron los picos máximos, ya que esto puede resultar en el reclutamiento de músculos vecinos y lecturas de fuerza inexactas.
- Gire la perilla de ajuste para modular el porcentaje del "rango" actual que se usa para estimular la mandíbula. Es posible que se requiera un aumento o disminución de la corriente para optimizar la respuesta de contracción.
- Confirme que los electrodos aún estén bien colocados y detenga el estímulo instantáneo.
- Debajo del botón naranja "Instant Stim" en el monitor de datos en vivo, ubique el botón gris Secuencia de inicio y haga clic en él.
- Continúe monitoreando las curvas durante toda la duración del protocolo de estimulación. A medida que aumenta la frecuencia de estimulación, también lo hará la fuerza máxima producida. Una vez que se alcanza el tétanos, las curvas de fuerza se estabilizarán (Figura 5A).
- Limpieza
- Una vez finalizada la secuencia de estimulación funcional, retire los electrodos y límpielos con etanol al 70%. Si este es el último animal en ser examinado, los electrodos se pueden volver a colocar en sus cubiertas.
- Apague el gas de anestesia, pero mantenga al animal en la superficie caliente para monitorear su regreso a la conciencia. Una vez que la rata comience a recuperar la conciencia, colóquela nuevamente en la jaula y continúe monitoreando hasta que el animal esté despierto y ambulatorio.
- Apague el equipo utilizado para la adquisición de datos y limpie todas las superficies.
3. Análisis de datos
NOTA: Este método ha sido descrito previamente como un método para la prueba funcional in vivo de la rata TA8. El análisis de datos está diseñado para determinar las intenciones de este estudio, y los protocolos pueden cambiar dependiendo de los objetivos del usuario.
- Localice y abra el software de Análisis Muscular Dinámico .
- Haga clic en el menú High Throughput (Alto rendimiento) y seleccione Force Frequency Analysis (Forzar análisis de frecuencia ) para analizar varias muestras simultáneamente.
- Seleccione Seleccionar archivos y resalte tantos archivos de datos como desee para el análisis. El botón "Seleccionar carpeta" también se puede utilizar si las muestras están claramente nombradas dentro del sistema de archivos.
- Marque la casilla Eliminar línea base. Esto eliminará automáticamente la fuerza de referencia de la fuerza máxima registrada para cada prueba, proporcionando los valores máximos absolutos.
- Haga clic en el botón Analizar y luego haga clic en Exportar tabla a Excel donde los datos se pueden guardar como una hoja de cálculo. Asegúrese de que los valores "Cursor de inicio" y "Cursor de finalización" capturen con precisión la marca de tiempo de la estimulación. Estos valores se pueden establecer manualmente si es necesario.
- Abre la hoja de cálculo guardada.
NOTA: Usando la columna "Máximo", el usuario puede calcular la fuerza máxima producida en todas las frecuencias. También se puede generar la curva fuerza-frecuencia (Figura 5).
Resultados
Como se describió en una publicación anterior, las curvas tetánicas se pueden utilizar para distinguir los resultados óptimos de los resultados subóptimos8. Un resultado ideal se obtiene cuando el músculo es estimulado a su fuerza máxima y la mantiene al máximo durante toda la duración de la contracción tetánica. La suma de las contracciones individuales en curvas tetánicas generalmente comenzará a aparecer a 100 Hz o después. La Figura 5A muestra este punto, ya que la curva ideal a 150 Hz tiene un repunte brusco al comienzo de la estimulación, una fase de meseta plana al valor máximo de fuerza con una oscilación mínima, y un descenso brusco y vertical cuando cesa la estimulación. Las curvas tetánicas no ideales pueden mostrar oscilaciones durante la fase de meseta y pueden mostrar una pendiente negativa o positiva (Figura 5C, D).
Los resultados de este protocolo de pruebas funcionales pueden representarse de manera diferente dependiendo de los objetivos de los investigadores y el diseño experimental del estudio. En el caso de este protocolo, la fuerza máxima absoluta se determina empíricamente a partir de todas las frecuencias de estimulación y se grafica en cada punto de tiempo para la prueba. Esto permite comparar la producción de fuerza máxima basal con la producción de fuerza máxima cada 4 semanas después de la creación de la lesión VML descrita en el masetero (Figura 1D). A modo de comparación, también se probó una cohorte de animales no heridos (n = 4) en cada punto de tiempo (Figura 1E). También se compararon los pesos de los animales en cada punto de tiempo (Figura 1F). A las 4, 8 y 12 semanas después de la VML, respectivamente, las ratas produjeron una fuerza máxima promedio de 7.958 N ±1.797 N, 7.183 N ±1.450 N y 7.823 N ± 0.626 N. Las comparaciones post hoc por pares del Análisis de Varianza de Medidas Repetidas de Un Factor (ANOVA) con la Diferencia Mínima Significativa (LSD) de Fisher determinaron que no hubo diferencias estadísticamente significativas entre estos valores en ningún momento posterior a la lesión por VML. sin embargo, todos fueron significativamente diferentes de la fuerza de referencia promedio de 10.031 N ±0.564 N.
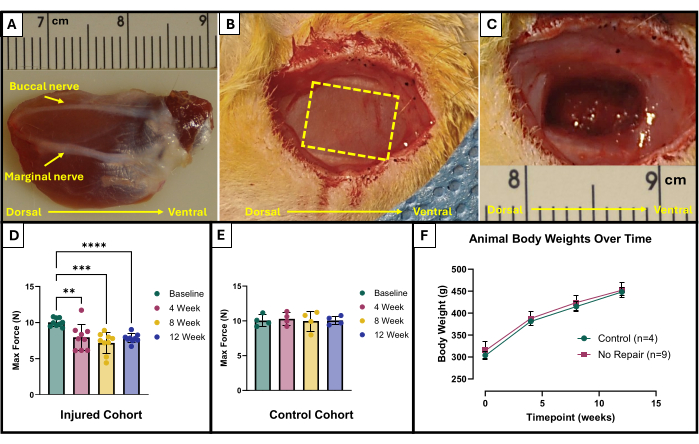
Figura 1: Esquema quirúrgico y resultados funcionales para el músculo masetero lesionado por VML. Músculo masetero explantado que muestra orientación anatómica, así como puntos de referencia nerviosos para la creación de lesiones (A). Animal durante la cirugía antes (B) y después de (C) la creación de una lesión VML. Todas las imágenes se presentan con músculos en la misma orientación que (A). La línea discontinua amarilla indica la región donde se va a extirpar el músculo. Producción máxima de fuerza al inicio y a lo largo del tiempo en ratas que recibieron una lesión VML (n = 9) en el masetero (D), así como en ratas de control de la misma edad que no sufrieron lesiones (n = 4) (E). Un gráfico del peso corporal de las ratas a lo largo del tiempo (F). (D) representa un ANOVA de medidas repetidas de un solo factor con comparaciones por pares post hoc de LSD de Fisher, donde **= p < 0.01, ***= p < 0.001, ****= p < 0.0001. Las reglas en (A) y (C) están en centímetros, con graduaciones en milímetros. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Inicialización de software para pruebas funcionales. Configuración de parámetros para el software DMC. Configuración de Instant Stim a los valores deseados (A). Interfaz gráfica de usuario del software y ubicación del cuadro de configuración de AutoSave Base (B). Selección de la secuencia de protocolo de 9 pasos utilizada para las pruebas (C). Los valores que se muestran aquí son valores de ejemplo utilizados para este estudio, pero es posible que deban optimizarse y ajustarse en función de los casos de uso específicos de otros. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejes de movimiento funcionales del aparejo y posicionamiento adecuado de los animales. El esquema ilustra la relación entre cada una de las tres ruedas de ajuste en el banco de pruebas funcionales y sus correspondientes ejes de movimiento para el brazo de palanca (A). Imagen de ejemplo de una rata sometida a pruebas funcionales, que muestra la posición supina adecuada del animal en la plataforma y otros componentes importantes del aparejo (B). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ejemplo de activación unilateral y bilateral de la mandíbula durante la prueba. (A) muestra la mandíbula de la rata en reposo antes de cualquier estimulación. Los electrodos colocados incorrectamente pueden provocar una contracción bilateral de la mandíbula, como indican las flechas amarillas (B), mientras que los electrodos colocados correctamente darán lugar a la contracción ipsilateral deseada (C). Las flechas amarillas indican puntos de contracción en la mandíbula. También se muestran ejemplos de curvas fuerza-tiempo a 150 Hz para la activación muscular bilateral (D) y unilateral (E). Haga clic aquí para ver una versión más grande de esta figura.
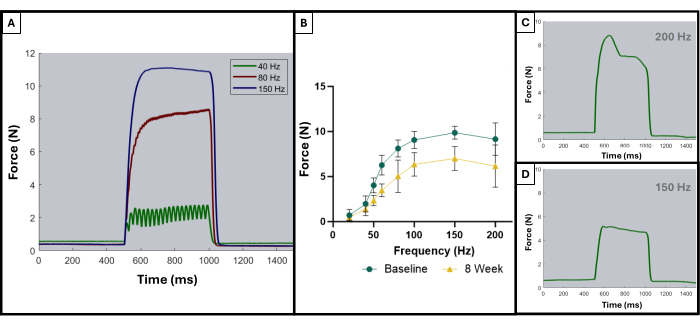
Figura 5: Curvas representativas de estimulación-respuesta para ensayos aceptables e inaceptables. Ejemplos de curvas de estimulación a 40, 80 y 150 Hz (A) para demostrar qué buscar antes y durante una contracción tetánica. A medida que aumenta la frecuencia de estimulación, la tensión máxima registrada también es mayor, lo que se puede observar en las curvas fuerza-frecuencia (B) que muestran el promedio de los animales lesionados (n = 9) al inicio y a las 8 semanas después de la creación de VML. (C,D) muestran ejemplos representativos de la forma de una respuesta de fuerza que indicaría la necesidad de un ajuste del electrodo debido a un tétanos inadecuado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un método sencillo y fiable para la prueba funcional in vivo de la fuerza de mordida ipsilateral producida en la mandíbula de rata. También se describe un método para la creación quirúrgica de una lesión VML en el músculo masetero de rata. En combinación, estos métodos proporcionan un modelo animal biológicamente relevante para realizar una evaluación longitudinal de la recuperación funcional antes y después de una lesión craneofacial traumática. Si bien otros métodos de prueba, como in vitro e in situ, también pueden proporcionar información valiosa, requieren el aislamiento del tendón y la extracción del tejido de su entorno nativo, lo que limita su aplicabilidad para una mejor comprensión de los resultados funcionales in vivo 8,25,26,27,28 . Con el entrenamiento y la práctica adecuados, un investigador podrá posicionar un animal rápidamente para las pruebas y hacer los ajustes necesarios para lograr la máxima producción de fuerza muscular.
Existen detalles técnicos que deben verificarse para cada animal para garantizar la correcta colocación y estimulación de los electrodos. Primero, los incisivos superiores deben asegurarse de modo que la cabeza de la rata esté completamente en contacto con la plataforma calentada. Esto también mantendrá la nariz de la rata colocada en el cono de la nariz para la administración continua de anestésico inhalado. Si la cabeza no se mantiene en la posición adecuada, habrá inconsistencias en las lecturas de fuerza a medida que la tensión base se desvíe. Además, el cuerpo del animal debe estar en decúbito supino y su columna vertebral debe estar recta. Mantener al animal en la posición correcta ayudará con la colocación y el mantenimiento de los electrodos en la ubicación correcta. Finalmente, la colocación de los electrodos puede ser difícil, ya que deben colocarse a la profundidad y el espacio adecuados para estimular solo el lado experimental de la mandíbula. La vigilancia y la práctica son pertinentes para convertirse en un experto en la colocación de electrodos para obtener resultados reproducibles y confiables. Los electrodos se desafilarán con bastante rapidez, por lo que es necesario cambiarlos con frecuencia. Las características distintivas de la mala colocación de electrodos son la activación de los músculos accesorios, las lecturas de fuerza con pendiente positiva / negativa (movimiento de los electrodos durante la estimulación) o una forma de onda tetánica no fusionada / oscilante8 (Figura 5C, D).
Además, existen algunas limitaciones de este método que merecen ser mencionadas y consideradas en futuras aplicaciones de este sistema. En primer lugar, si bien es suficiente para las mediciones realizadas en este estudio, el asa utilizada para asegurar la mandíbula superior puede no ser el sistema más rígido. En cambio, un enfoque estereotáxico con barras en los oídos podría crear una mejor sujeción de la mandíbula superior de la rata. Además, se utilizó un valor de tensión pasiva como posición establecida para la prueba con este método, lo que puede no resultar en la generación de fuerza máxima que se obtendría si el músculo se colocara en su longitud óptima (Lo). De hecho, el Lo pudo determinarse posicionando al animal como se describe en este documento y luego manipulando la oclusión de la mandíbula en pequeños incrementos (0,5-1 mm) mientras se ejecutaban estimulaciones de contracción, con Lo determinado como la posición de prueba óptima donde se generó la fuerza máxima de contracción. Sin embargo, el músculo masetero tiene una geometría y una locomoción bastante únicas35,36 y, por lo tanto, opera en un rango de longitudes mucho más amplio que el característico de, por ejemplo, los músculos de las extremidades (que normalmente operan alrededor de L o). Sin embargo, masticar ocurre en un rango estrecho en comparación con morder. Como tal, no existe un enfoque perfecto para este problema. Por lo tanto, aunque establecer una tensión basal no es la única forma de abordar este problema, existe una justificación científica lógica para hacerlo, ya que la longitud óptima de los músculos de la mandíbula está más allá de la apertura natural de la mandíbula. De todos modos, la fuerza máxima a una tensión pasiva dada todavía proporciona información importante sobre los aspectos de la función, incluso si son diferentes de la fuerza máxima a Lo. Claramente, se justifica una mayor investigación de la relación fuerza-longitud del músculo masetero. Por último, este método se centra en la estimulación del nervio trigémino en la rata, que se divide en tres ramas: V1-V3. Si bien V3, o el nervio mandibular, es la única rama con un componente motor, inerva múltiples músculos, incluidos el masetero, el temporal, el pterigoideo y el milohioideo37. Es importante tener esto en cuenta, ya que significa que este método no informa exclusivamente de la fuerza del masetero, lo que puede ser relevante para otras investigaciones de investigación.
A pesar de estos aspectos técnicos y limitaciones, este método demuestra ser robusto y consistente. Si bien en este documento solo se describen las pruebas ipsilaterales, el protocolo podría modificarse fácilmente para incluir pruebas adicionales del otro lado de la mandíbula. Las pruebas bilaterales de la contracción/función del masetero permitirían hacer comparaciones entre sanos y lesionados dentro de un solo animal, tal vez dilucidando cambios compensatorios importantes en el lado lesionado y/o del control (lado no lesionado). En general, este modelo proporciona una poderosa herramienta para evaluar la función muscular longitudinal, así como la recuperación funcional, de una manera mínimamente invasiva. Como tal, este sistema será aplicable para evaluar los mecanismos biomecánicos que atienden a los déficits funcionales mediados por VML, así como para probar la eficacia de diversas terapias para la reparación de lesiones VML en la región craneofacial.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Myologica LLC por compartir el equipo utilizado para realizar evaluaciones funcionales. La investigación reportada en esta publicación fue apoyada por el Instituto Nacional de Investigación Dental y Craneofacial de los Institutos Nacionales de Salud bajo el número de premio U24 DE029463. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Referencias
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados