Method Article
インビトロ チタンシリンダーに用いるEr,Cr:YSGGおよびダイオードレーザーの効果評価
要約
この研究では、Er、Cr:YSGG、およびダイオードレーザーを、合計96個の特別に設計されたチタンシリンダーの平面に別々に適用しました。もう一方の表面に熱電対を置き、温度を測定しました。表面粗さは、プロファイラー(表面形状測定機)、SEM、AFMで分析されます。
要約
インプラント周囲疾患は、歯科インプラントに関連する重要な問題です。この研究の目的は、非外科的インプラント周囲疾患の治療において、ダイオードとエルビウム、クロムドープイットリウム-スカンジウム-ガリウム-ガーネット(Er、Cr:YSGG)レーザーをチタンシリンダーに適用したときの表面粗さと温度変化を評価することでした。940nmのダイオード(0.8 W-1.3 W-1.8 W)とEr,Cr:YSGG(1.5 W-2.5 W-3.5 W)レーザーを20 s/Wと40 s/Wの6つの出力モードで、対照群を含む計13グループを形成 し、各グループで8本のチタンシリンダーを処理した。このプロセスでは、初期温度と最終温度をシリンダーの頂端スロットに配置した熱電対で記録しました。適用後、すべてのディスクの粗さ(Ra)をプロフィロメーターで測定しました。表面は、走査型電子顕微鏡(SEM)と原子間力顕微鏡(AFM)によってスキャンされ、2次元および3次元の表面検査が行われました。チタンボンベの照射時の温度変化を評価したところ、ダイオードレーザーを40秒間照射したシリンダーは、20秒間照射したシリンダーよりも有意に高かった。Er,Cr:YSGG処理シリンダーでは、一部のサンプルで温度が低下し、一部のサンプルで最小限に上昇しました。プロファイラー(表面形状測定機)の値(Ra)は、すべてのグループの粗さの点で統計的に有意ではありませんでした。しかし、SEM画像では、処理された表面の融解と微細孔の数の増加が示されました。この in vitro 研究の限界により、Er、Cr:YSGG、およびダイオードの適用は、特に熱安全性の観点から、インプラント周囲炎の管理のための安全なアプローチと見なすことができます。表面粗さは変わりませんが、これらのレーザーを使用すると、Tiシリンダートポグラフィーに溶融変化と微細孔が発生しました。これらのレーザー設定が細菌の減少とオッセオインテグレーションにどのように影響するかを明らかにするには、さらなる研究が必要です。
概要
歯科インプラントは、失われた歯の交換のための一般的に受け入れられている治療オプションです1,2。インプラント周囲粘膜炎とインプラント周囲炎は、インプラント周囲疾患として分類されます。インプラント周囲粘膜炎は軟部組織に限定されており、生理学的な骨のリモデリングを除いて、骨量の減少の証拠はありません。インプラント周囲炎は、歯垢に関連し、歯科インプラントを取り巻く組織に影響を与える病的状態です。これは、インプラント周囲粘膜の炎症と、その結果としての支持骨の喪失の増加によって区別されます3。障害の開始と進行の主な病因は、インプラント周囲プラークバイオフィルム4の破壊です。インプラント周囲疾患に関する多数の研究は、インプラント周囲粘膜炎 (PIM) の有病率が 9.7% から 64.6% の範囲であるのに対し、インプラント周囲炎 (P) の有病率は 4.7% から 45% の間で変動することを示しています5。
プラークの蓄積はインプラント周囲炎を引き起こす主な病因ですが、その治療はインプラントの多様な地形的特徴によって複雑になります。非外科的インプラント周囲炎治療の基礎は、インプラント表面の創面切除と付着したバイオフィルムの除去による感染管理であり、細菌負荷を病気の原因となる閾値 6,7 未満に減少させます。チタン界面と骨欠損の解剖学的構造の複雑なミクロトポグラフィーとマクロトポグラフィーは、表面の除染を制限します。さまざまな機械的 (キュレット、超音波装置、エアパウダー摩耗、チタンブラシ)、化学的 (クエン酸、クロルヘキシジン、抗菌)、および物理的 (レーザー、光線力学療法) の除染技術の有効性が、組み合わせて評価されています8。現在の研究では、インプラント周囲炎に対する非外科的介入技術の併用は、創面切除単独よりも効果的であることが示唆されています9。化学抗菌剤または局所/全身性抗生物質の機械的治療への組み込みは、有意な有効性を示しています。それにもかかわらず、これらの介入は、起こりうる悪影響をもたらす可能性があります10.レーザー技術が進歩するにつれて、歯科用レーザーは、その抗感染性、解毒性、およびインプラント表面10,11へのユーザーフレンドリーな効果のためにますます人気が高まっています。
吸収ピーク、デバイスの動作モード、および組織特性は、レーザー照射中の熱増加に影響を与えます。重要な前臨床調査により、温度が50°Cに1分間上昇すると血管の損傷を引き起こし、60°Cに上昇すると血流が停止し、その後の骨壊死につながることが明らかになりました12。 in vitro の研究では、ダイオードレーザーをわずか10秒間照射した後、インプラント表面が骨の安全性閾値(10°C)よりも高い温度に達する可能性があることがわかりました。骨の生存率は、わずか10°Cの温度上昇によって損なわれる可能性があります13。
最近の多くの研究は、この領域におけるレーザーの有益な影響を調べることに集中しています14,15,16,17,18。さまざまなレーザー波長は、適切なパラメータが適用されると、インプラント表面に大きな抗菌効果と安全性を示します。強度、周波数、波長など、多くの変数がレーザー治療の有効性に影響を与えます。いくつかの研究は、CO2、Er:YAG、Er、Cr:YSGGおよびさまざまなダイオードレーザーを含むさまざまなレーザー波長の殺菌効果を実証しており、インプラント周囲炎の治療におけるさまざまなレーザーの有益な効果を特定することができます。青木ら 19,20,21.彼らのレビューから、レーザーの適用は、再生治療を含む非外科的および外科的インプラント周囲治療の両方で表面洗浄を容易にし、周囲の組織細胞を活性化することによって治癒を促進すると結論付けました22。
ダイオードレーザーは、インプラントの表面パターンに影響を与えることなく、インプラント表面に殺菌効果を発揮する能力を持っています。インプラント周囲炎の治療に関しては、ダイオードレーザーは歯周組織の治癒を促進するため、進むべき道かもしれません23,24,25。
エルビウム、クロムドープ:イットリウム、スカンジウム、ガリウム、ガーネット(Er、Cr:YSGG)レーザーは、バイオフィルムの除去とインプラント表面の除染に効果的な特性を示します11。強力な殺菌効果と骨再生特性は、エルビウムレーザーによって機械的損傷を引き起こすことなく、その水力特性のおかげで実証されました11,14。
チタンインプラントへのレーザー照射による変化については、データが不足しています。さらに、チタン表面の照射に関する決定的な方法論は、出力や印加時間などのレーザーパラメータを網羅する未だに定義されていません。以前の研究では、Er、Cr:YSGGレーザー16の適用は温度変化に影響を与えなかったことが示されましたが、ダイオードレーザーの研究は13を超え、臨界値の16,26を超えませんでした。チタン表面のRa値に対するレーザー処理の影響の異なる結果は、文献18,27で利用可能である。この研究の帰無仮説は、Er、Cr:YSGGレーザーとダイオードレーザーの間に、チタン表面の温度と粗さの変化の点で違いはないというものです。この研究は、Er、Cr:YSGG、およびダイオードレーザーを使用して、さまざまな時間と出力の設定でチタン材料の表面粗さと温度変化を監視することにより、安全な動作パラメータを決定することを目的としています。温度変化の評価は熱電対で行い、表面粗さはプロファイラー(表面形状測定機)で評価し、表面変化はSEMおよびAFM技術で分析しました。
プロトコル
注:従来のインプラントと同じ材料で作られ、SLA技術でインプラント表面を再現するように設計されたチタンシリンダーは、高さ10mm、直径5mmを特徴としています。円柱の中央には、深さ7mm、幅3mmの空洞が配置されています(図2)。3mmの幅は、最も深いところで1mmに縮小されます。プロフィロメータで標準的なインプラントの表面粗さを測定することは現実的ではありません。メーカーが設計したチタンシリンダーの上部にある直径5mmの平面にレーザーを当てた場合、インプラント表面をシミュレートするのと同じ材料を使用して、レーザーの効果を評価することができました。また、シリンダーの中心からの温度変化を測定するために、チタンシリンダーの底面の中心から、熱電対の先端を配置するシリンダーの深さに向かって、深さ7mm、幅3mmの溝が作られました。この溝により、処理面の温度変化を外面に依存するのではなく、シリンダー内から評価することができます。3次元のビジュアルは、原子間力顕微鏡(AFM)を使用して特別に製造されたチタンシリンダーの平面を分析することにより得られました。940 nmのダイオード(0.8 W28、1.3 W29、1.8 W30)と2.780 nm Er、Cr:YSGG(1.5 W31、2.5 W31、3.5 W32)レーザーを、会社の推奨に従って3つの異なるワット数で使用し、それぞれ20秒と40秒の印加時間で12のグループを形成しました。適用後、粗さ評価のための対照群を追加しました。フィンガーサポート付きのスタンドは、塗布中にTiシリンダーを安定させるために、3次元プリンターから印刷されました(材料表)。
1.サンプルサイズ
- G*Powerプログラムのパワー解析を使用してサンプルサイズを計算します。各グループの最小サンプル数は、効果サイズd:0.6906、標準偏差16.8、検出力:0.80、α:0.05の温度変化について、n=8サンプルとして決定されました。
注:この研究では、直径300μmのチップ(e3チップ)と360°の発射弾性RFPT5-14チップ(直径580μm、長さ14mm)を備えた940nmダイオードレーザーを搭載したEr、Cr:YSGGレーザーをレーザーシステムとして使用しました(図1)。

図1:使用した機器・機器(A)ダイオードレーザー、(B)Er,Cr:YSGGレーザー、(C)E3チップ、(D)RPTF5-14チップこの図の拡大版を表示するには、ここをクリックしてください。
2. ワーキンググループの決定
- インプラント周囲粘膜炎のポケット内アプリケーションのためのレーザーの推奨ワットを理想的な使用条件として取ってください。さらに、推奨されるワットに対して低い値と高い値を 1 つずつ研究グループに含めます。ここで使用される値は、Er、Cr:YSGG が 1.5 W と 3.5 W、ダイオード レーザーが 0.8 W と 1.8 W です。
- アプリケーション時間を 20 秒と 40 秒と決定して、動作時間が温度変化に及ぼす影響を評価します。学習グループを 表1に示します。
| グループ名 | レーザータイプ | サンプル数(n) | ワット (W) | 時間 (秒) |
| E1 | えー、Cr:YSGG | 8 | 1.5 W | 20 |
| E2の | 8 | 2.5 W | 20 | |
| E3 | 8 | 3.5 W | 20 | |
| E4 | 8 | 1.5 W | 40 | |
| E5 | 8 | 2.5 W | 40 | |
| E6の | 8 | 3.5 W | 40 | |
| D1 | ダイオード | 8 | 0.8 W | 20 |
| D2 | 8 | 1.3 W | 20 | |
| D3 | 8 | 1.8 W | 20 | |
| D4 | 8 | 0.8 W | 40 | |
| D5 の | 8 | 1.3 W | 40 | |
| D6 | 8 | 1.8 W | 40 | |
| C | コントロール | 8 |
表1:研究グループの情報。
3. 実験装置の準備
- Rhinoceros(3Dグラフィックスおよびデザイン)プログラムを使用して、直径10 mm、厚さ5 mmのわずかに空洞を持つシリンダースタンドを3Dで設計します。
- アプリを開きます。直径10mmの円を描きます。円を1つの軸から50%減らして楕円を作成します。Extuder を押して、楕円を 3 次元で上げます。
- 指で支えるために、もう一度円を描きます。エクストルーダーキーで3次元の2番目の円を上げます。高さを最初の円より小さくします。
- 楕円図面に10 mmの穴をあけます。熱電対のサポートには、Sweep 1コマンドでL字型の線を作成し、3次元を作成します。
- 正方形を描き、extruderコマンドで3次元に拡大し、ベースを作成します。デザインを印刷した後、Tiシリンダーが来る穴の周りにシリコンを塗布して乾燥させます。これにより、レーザーが照射されている間、シリンダーが所定の位置に保たれます。
- エアコン付きの密閉された部屋を27°Cの温度にしてください。 シリンダーを固定するスタンドをプラスチックの浴槽の中央に両面テープで固定します。
注意: Tiシリンダーを挿入し、表面に空気を絞ります。 - 温度計の熱電対を、スタンドのスロットに配置されたTiシリンダーの中空部分に置きます。
- 適用時間を追跡するためのクロノメーターを準備します。3人目の観測者による度数を記録し、ストップウォッチで時間を追跡します。
4. 実験手順
- レーザー照射中は、施術者の安全のために保護メガネを着用してください。RPTF5-14チップをEr、Cr:YSGGレーザーに挿入します。ダイオードレーザー用のチップE3を挿入します。
- Er、Cr:YSGGレーザーをオンにします。 Perio Closed Modeを選択します。1.5 W、2.5 W、3.5 Wのレーザーをそれぞれ20秒と40秒に適用します。レーザーが印加された96本のTiシリンダーがあります。Tiシリンダーにレーザータイプ1種類、1ワット、1回だけ照射します。
- ダイオードレーザーをオンにします。 Perio Pocket Modeを選択します。0.8 W、1.3 W、1.8 Wのレーザーをそれぞれ20秒と40秒に適用します。
- レーザーが始まったら、3人目のオブザーバーにタイマーをスタートさせます。時間切れになったら警告してください。
- レーザーチップを表面に対して15°の角度で接触させ、計画された時間だけ表面全体をジグザグに動かします。
- アプリケーション中の初期温度と最終温度の値に注意してください。終了温度値から開始温度値を減算します。温度変化を計算します。
注意: 合計 12 グループ、6 Er、Cr:YSGG、および 6 つのダイオード レーザー グループの温度変化値に注意してください。 - サンプルは、グループ番号が書かれた透明な袋に保管してください。
5.材料の2次元および3次元イメージング
- 走査型電子顕微鏡(SEM)および原子間力顕微鏡(AFM)分析を実施して、Tiシリンダー表面の形態の変化を評価および実証します。
注:FEI Quanta FEG 250装置を使用しました。 - SEMに入れる前にサンプルをコーティングしないでください。1つの対照グループ、6つのダイオードレーザーグループ、および6つのEr、Cr:YSGGレーザーグループを含む13のグループがあります。対照群は処理を行わず、AFMとSEMによる表面画像のみ撮影します。
- 13の研究グループのそれぞれから1つのシリンダーをランダムに選択します。それらをSEMデバイスに挿入します。サンプルの混在を避けるために、プラットフォーム上の場所とサンプルコードに注意してください。
- Tiシリンダーを平らな面を上にしてSEMデバイスに配置します。低真空モードを使用して解析を実行します。分析中はチャンバー圧力を60Paに設定します。
- デバイスの準備が完全に整ったら、平面上のランダムな点から250倍、1000倍、5000倍の倍率で画像を記録します。すべてのサンプルについてこの手順を繰り返します。
注意: SEMデバイスが掃除機をかけると、画像収集の準備が整います。 - AFM測定の場合は、各スタディグループから1つのTiシリンダーをランダムに選択します。タッピングモードで測定を行います。
- TiシリンダーをAFM装置に配置します。装置の先端がサンプルにくるようにトップカバーを置きます。機器の窓からの赤い光が、画像化する表面にあることを確認します。
- 電圧を2に設定します。Auto landボタンでチップをサンプルに近づけます。 [スキャンの開始 ]ボタンを押してスキャンを開始します。
- 各サンプルについて5 μm x 5 μmのデジタル画像を撮影し、低速のスキャン速度(1 Hz)で記録します。AFM装置で撮影したTiシリンダーの平面からの画像を記録します。AFM装置は25μm2の領域を視覚化します。
6. 表面粗さの測定
注:ここでは、Surftest SJ 201、東京、ミツトヨのデバイスを使用しました。
- プロファイラー(表面形状測定機)の分解能を0.01 mm、横方向の長さを3.0 mm、ダイヤモンド記録ピン先端の直径を5 μmに設定します。測定速度を0.5mm/sに設定して、Ra値を求めます。
- Tiシリンダーをホルダーで固定し、プレセルを使用し、Tiシリンダーを側面から保持して固定します。プロフィロメータの針をTi表面に接触させます。
- スタートボタンを押します。見つかった Ra 値を保存します。各シリンダーの平らな面で、測定を異なる方向に5回繰り返します(図2)。さまざまな方向を達成するために、プリセルの助けを借りてTiシリンダーをそれ自体の周りで動かします。Tiシリンダーの全長についても繰り返します。
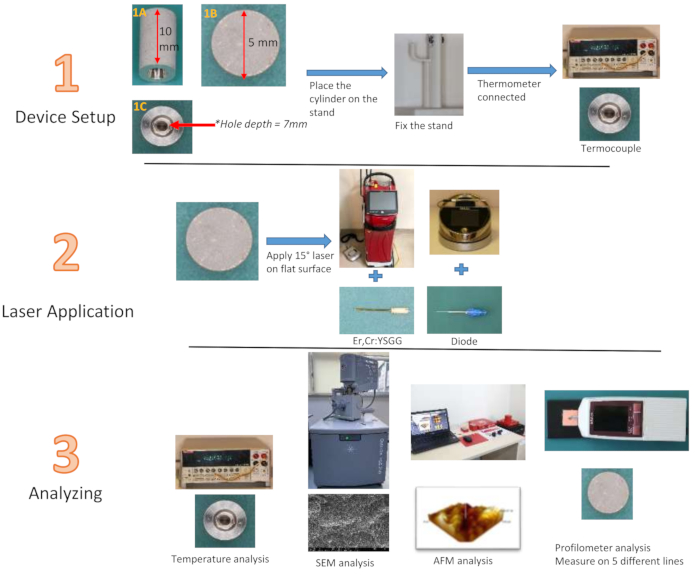
図2:研究グループのフローチャート。 (1A)Tiシリンダー側面図、(1B)上面図、(1C)底面図この 図の拡大版を表示するには、ここをクリックしてください。
7. 統計解析
- SPSS-Windows 統計パッケージ・プログラムを使用して統計分析を実行し、Kruskal-Wallis 検定と Mann-Whitney 検定を適用します。統計的信頼水準を 95% (α = 0.05) に設定します。
結果
20秒と40秒の塗布時間で評価したところ、統計学的に有意な差が認められました。40秒レーザーを適用したTiシリンダー表面の温度変化は、適用した20秒レーザーの温度変化よりも大きいことが観察されました(p = 0.037; 図3)。
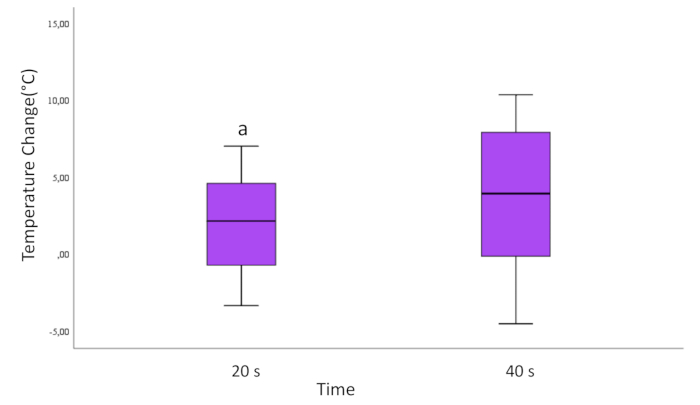
図3:すべてのサンプルの時間による温度変化。 ボックスから上下に伸びる線は、データの最小値と最大値を示しています。ボックス内の水平線は、データの中央値を表します。丸いマークは外れ値です。
a=40 sグループと比較して統計的に有意な差。0<0,05頁)
この図の拡大版を表示するには、ここをクリックしてください。
温度変化をレーザーの種類(Er,Cr:YSGGとダイオード)の2つのグループに分類して解析しました。ダイオードレーザーを用いたTiシリンダーの温度変化は、Er,Cr:YSGGレーザーを用いたシリンダーの温度変化よりも大きいことが観察された。結果は統計的に有意です(p = 0.001; 図4を参照)。ダイオードレーザーアプリケーションのみでテストされたTiシリンダーの評価では、結果は、40秒のダイオードレーザーアプリケーションが、すべてのワット値(p < 0.001; 図4)。図のボックス内の赤い線は中央値を示しています。上部と下部のバーは、最高温度と最低温度の値を示しています。

図4:すべてのサンプルのレーザーの種類と時間による温度変化。 ボックスから上下に伸びる線は、データの最小値と最大値を示しています。ボックス内の水平線は、データの中央値を表します。丸いマークは外れ値です。
a=ダイオード群と比較して統計的に有意な差。0<0,05頁)
b= ダイオードレーザーと比較して統計的に有意な差 40 秒 (p<0,05)
この図の拡大版を表示するには、ここをクリックしてください。
温度変化の最新の統計的評価は、ワット値に基づいて行われました。Er,Cr:YSGGレーザーを使用したグループで、ワット値(p < 0.001)とワット時間(p < 0.001)パラメータのみを調査した場合、有意差が観察されました。Er,Cr:YSGGレーザの応用では、時間自体は温度変化に大きな影響を与えないことが観察されました(p = 0.959)。ダイオードレーザーに曝露されたすべてのTiシリンダーの温度変化を評価したところ、ワット、時間、およびワット時間の変数を考慮して、統計的に有意な差が観察されました(p < 0.05)。Tiシリンダー表面に1.8ワットを印加したダイオードレーザーグループの温度範囲は、0.8ワットを印加したダイオードレーザーグループの温度範囲よりも著しく大きかった(p = 0.006; 図 5)。
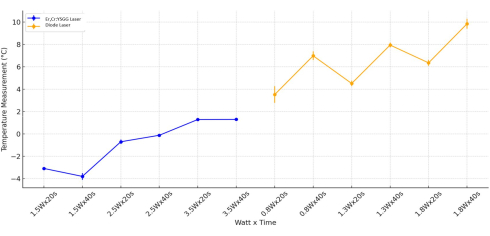
図5:複合温度解析。 分析は、Er、Cr:YSGG、およびダイオードレーザータイプについて、ワットと時間で行われました。 この図の拡大版を表示するには、ここをクリックしてください。
イメージング解析
SEM画像では、すべてのグループでミクロンサイズの多孔質構造が観察されましたが、これはサンドブラストされ、酸で粗くなったインプラント表面の予想される外観です。5000倍の倍率で、レーザー処理されたチタン表面は、対照群と比較してミクロンサイズの細孔の目に見える拡大を示しました(赤い丸)。250倍と1000倍の倍率で、Er、Cr:YSGG、およびダイオードレーザーで40秒間処理したチタン表面は、20秒間処理した表面よりも融解が大きかった(図6)。AFM画像では、対照群の表面くぼみの分布は、レーザー処理群よりも均一でした(図7、図8)。AFM像では、チタンシリンダーの平面の25μm2という非常に小さな面積しか可視化できなかったため、全体の表面について詳細な結果を得ることができませんでした。

図6:すべての研究グループのSEM画像。 6つのダイオードレーザーグループにはD1-D6とラベル付けされ、6つのEr、Cr:YSGGレーザーグループにはE1-E6とラベル付けされています。画像は250倍、1000倍、5000倍、倍率で撮影されます。 この図の拡大版を表示するには、ここをクリックしてください。

図7:コントロールグループのAFM画像。この図の拡大版を見るには、ここをクリックしてください。

図8:すべての研究グループのAFM画像。 6つのダイオードレーザーグループにはD1-D6とラベル付けされ、6つのEr、Cr:YSGGレーザーグループにはE1-E6とラベル付けされています。 この図の拡大版を表示するには、ここをクリックしてください。
表面粗さの結果
粗さパラメータは、変数のレーザータイプ(p = 0.841)、ワット(p = 0.900)、時間(p = 0.399)、およびレーザータイプ、ワット、および時間変数の評価(p = 0.924; 図9)。

Figure 9: Roughness analysis by laser type, watt, and time. この図の拡大版を見るには、ここをクリックしてください。
これらの結果を考慮すると、Er、Cr:YSGG、およびダイオードレーザーは、インプラント周囲疾患のチタン表面の除染に安全であると結論付けることができます。温度変動は10°C未満であり、パラメータが安全範囲内にあることを示しています。同時に、プロファイラー(プロファイラー)の値は大きく変化しておらず、表面粗さの点で不利な点がないことを示しています。画像解析では顔の変化が検出されましたが、これはラフネス解析では裏付けられませんでした。この研究の結果は、使用されたレーザーパラメータが安全範囲内にあることを裏付けています。
a=ダイオード群と比較して統計的に有意な差。0<0,05頁)
b= ダイオードレーザーと比較して統計的に有意な差 40 秒 (p<0,05)
ディスカッション
インプラント周囲炎の治療におけるインプラント表面の除染の最適な方法について、重要な議論が進行中です。以前の出版物では、局所または全身の医薬品の利用、レーザー応用、機械的および/または化学的洗浄、およびインプラント形成術が提案されています。私たちの調査結果は、すべての測定された温度が10°Cの重大な安全しきい値を下回っていることを明らかにしました13。しかし、これは in vitro 研究であり、常に臨床状態を再現できるとは限らないことを念頭に置いて、Er、Cr:YSGGレーザーおよびダイオードレーザーの使用により、インプラントトポグラフィーの溶融変化と微細孔が引き起こされ、表面粗さは変化しないことが観察されました。
Ho:YAGおよびNd:YAG33レーザーの除染への使用は、表面効果のために不適切であると報告されました。しかし、Er,Cr:YSGGレーザ34及びダイオードレーザ18は、この目的に有効であることがわかった。ダイオードレーザーは、TGF-β1シグナル伝達によって刺激されるHBD-2発現を介して、周辺組織の治癒を促進します。この研究では、チタン表面35にEr,Cr:YSGGレーザーをジグザグ運動で適用した後、線維芽細胞の生存率と骨芽細胞の分化の増加とともに、表面粗さとP.ジンジバリスのコロニー形成が明らかになった。この研究の結果、Er,Cr:YSGGレーザーは、最大3.5 Wから40秒までのエネルギー設定でチタン表面に熱損傷を引き起こさなかったことが示されました。この発見は、Smeo et al.36によって発表された文献レビューと相関しており、エルビウムレーザーは、正しいレーザーパラメータで利用された場合、臨界温度しきい値を超えることなく抗菌効果を発揮できると決定しました。
この調査における940nmのダイオードレーザーのパラメータは、0.8W、1.3W、および1.8Wであり、これには異なる出力と20秒と40秒13の照射時間が含まれていました。チタン表面でのダイオードレーザーの使用を評価した2つの異なる研究では、20秒37と40秒38が適用時間として使用されました。同様に、チタンと歯の表面に適用されたEr、Cr:YSGGレーザーは、20秒39および40秒40の印加時間で使用されました。ある研究では、ダイオードレーザーが18秒で臨界温度を超えました13。ダイオードレーザーの用途では、パルプへの熱損傷を防ぐために、根の表面に長時間さらされることを避けることが推奨されています(臨界閾値5.6°C)28,41。チタン表面の温度変化に対するさまざまなレーザーの使用の影響を評価した研究では、Er:YAG、CO2、Nd:YAGおよびダイオードレーザーは、水タンク内の10°Cの臨界温度変化を超えなかったと報告されました42。同様に、この研究では、940 nmダイオードレーザーのグループで、大幅に速い温度上昇が発生しました。ただし、最終的な温度値は臨界しきい値を下回っていました。940nmのダイオードレーザーのアプリケーションでは、出力を下げ、照射時間を最小限に抑えることで、温度の上昇を抑えることができます。これらの結果は、水冷がない場合の電力/エネルギー密度の増加13,43,44と温度上昇との間に正の関係があることを示しており、Er,Cr:YSGGレーザー16,45のような照射中の水冷の重要性を強調しています。
機械的および3D光学的(接触および非接触)プロフィロメトリーは、歯科材料のナノトポグラフィーおよびインプラント表面粗さを定量的に測定するための最も一般的なin vitro方法であり、SEM画像は定性的評価のゴールドスタンダードである31。接触式プロファイラー(表面形状測定機)で粗さを測定すると、表面が損傷し、不正確な測定につながる可能性があります46。SEMイメージングではサンプルの定量的および定性的な分析を容易にすることができませんでしたが、AFM画像は表面粗さと3D深度の観点から定量的情報を提供することができました47。レーザー治療後のインプラント表面には、対照群と比較して、微細孔径の増加、形態の融解、および孔食した微細孔の有病率の増加を特徴とする形態学的変化が認められました。これらの実験条件下では、SEM分析中のTiシリンダーの表面は表面の変化を明らかにしました。さらに、これらの変更は、レーザーの種類、使用される電力、およびレーザー照射に費やされる時間によって影響を受けました。著者らは、ダイオード18とEr,Cr:YSGG21,48レーザーの両方における表面損傷のレベルと時間が出力の増加と相関しているという結論に同意しました。さらなる研究により、これらの修飾が治療上の意味を持つかどうかを調べる必要があります。
歯科インプラントの表面粗さは、マイクロトポグラフィーとも呼ばれ、オッセオインテグレーションに影響を与える重要な要素です。最近の研究では、チタン表面は4つの異なるプロトコルで処理されました。チタン表面および間葉系幹細胞はレーザー処理された表面に保存され、幹細胞接着結果は他の技術(Ti-Niブラシ、エアフロー、および歯科用バー)よりも良好であった49。検査したTiシリンダーのすべてのRa値は、レーザー照射中に減少しました。しかし、放射線照射前と照射後に統計的に有意な差は見られませんでした。ダイオードレーザーの照射は、より高い出力レベルが使用されたときにTi表面を溶かすことにより、表面粗さを低減しました。これらの知見は、Stübingerら50による以前の研究と一致しており、810nmのダイオードレーザーを使用してインプラント表面を除染し、表面に大きな影響を示さなかった一方で、Kim et al.51およびRezeka et al.17が実施した研究結果(2Wおよび3Wのパワーで処理した場合に940nmの波長を使用し、レーザーの適用による表面粗さの増加を観察した)と矛盾しています。
この研究は、細胞および微生物学的検査が不足しているため、制限されています。現在の研究は、ダイオードに続くTiシリンダーとEr、Cr:YSGGレーザー照射の地形変化を評価することを目的としています。それにもかかわらず、さまざまな治療法の生物学的な意味合いには、 さらにin vitro および in vivo での研究が必要です。別の制限は、この研究で行われた表面粗さの統計分析には、プロファイラー(表面形状測定機)のデータのみが含まれることです。AFMアプローチは、歯科で頻繁に利用される2種類のレーザーの有効性を評価するのに効果的であることが証明されました。
結論
私たちの調査では、温度上昇はいずれも生理学的閾値である10°Cを超えていませんでした。 その結果、統計的に有意な温度差は臨床的に無関係であると考えられました。レーザーの種類と出力はRAに有意な影響を与えませんでした。そのため、0.8W、1.3W、1.8WのダイオードレーザーとEr,Cr:YSGGレーザーに1.5W、2.5W、3.5Wを20秒、40秒照射することで、Ti表面をダメージなく洗浄することができます。それにもかかわらず、これらの調査結果はin vitroで実施されたものであり、この研究の結果を検証するには臨床試験が必要です。現在の研究では、インプラント創面切除の臨床シナリオをシミュレートするさまざまな技術を調査しました。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究で使用されたチタンシリンダーは、Naxis Implantによって製造されました。
資料
| Name | Company | Catalog Number | Comments |
| Atomic Force Microscopy | ezAFM | Compact AFM Model | |
| Diode | Biolase | Epic 10, 940 nm Wavelength | |
| E3 Tip | Fiber Diameter: 300 µm, Fiber Length: 9 mm | ||
| Er,Cr:YSGG Laser | Iplus | 2780 nm Wavelength | |
| Profilometer | Mitutoyo | Surftest SJ-201 Model | |
| RFPT-14 Tip | Outer Tip Diameter: 580 µm, Tip Length: 14 mm | ||
| Scanning Electron Microscope | FEI | Quanta FEG 250 Model | |
| Stand | Custom Design | Rhinoceros application, Flamix PLA filament, Bambulab X1C Device | |
| Thermometer | Keithley | 2000 Series Model, K tip termokulp | |
| Titanium Cylinder | Naxis | 10 mm height, 5 mm diameter, SLA Surface, Titanium |
参考文献
- Guillaume, B. Dental implants: A review. Morphologie. 100 (331), 189-198 (2016).
- Henry, P. J. Tooth loss and implant replacement. Aust Dent J. 45 (3), 150-172 (2000).
- Berglundh, T., Armitage, G., Araujo, M. G., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 89 (1), S313-S318 (2018).
- Herrera, D., Berglundh, T., Schwarz, F., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Guarnieri, R., Reda, R., Di Nardo, D., Pagnoni, F., Zanza, A., Testarelli, L. Prevalence of Peri-Implant Mucositis, Peri-Implantitis and Associated Risk Indicators of Implants with and without Laser-Microgrooved Collar Surface: A Long-Term (≥20 Years) Retrospective Study. J Pers Med. 14 (4), (2024).
- Figuero, E., Graziani, F., Sanz, I., Herrera, D., Sanz, M. Management of peri‐implant mucositis and peri‐implantitis. Periodontology 2000. 66 (1), 255-273 (2014).
- Tomasi, C., Wennström, J. L. Full-mouth treatment vs. the conventional staged approach for periodontal infection control. Periodontology 2000. 51 (1), 45-62 (2009).
- Baima, G., Citterio, F., Romandini, M., et al. Surface decontamination protocols for surgical treatment of peri‐implantitis: A systematic review with meta‐analysis. Clin Oral Implants Res. 33 (11), 1069-1086 (2022).
- Subramani, K., Wismeijer, D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. , Accessed August 4, 2024 (2012).
- Świder, K., Dominiak, M., Grzech-Leśniak, K., Matys, J. Effect of different laser wavelengths on periodontopathogens in peri-implantitis: A review of in vivo studies. Microorganisms. 7 (7), 189(2019).
- Mizutani, K., Aoki, A., Coluzzi, D., Yukna, R., Wang, C. Y., Pavlic, V., Izumi, Y. Lasers in minimally invasive periodontal and peri‐implant therapy. Periodontology 2000. 71 (1), 185-212 (2016).
- Eriksson, R. A., Albrektsson, T. The effect of heat on bone regeneration: An experimental study in the rabbit using the bone growth chamber. J Oral Maxillofac Surg. 42 (11), 705-711 (1984).
- Geminiani, A., Caton, J. G., Romanos, G. E. Temperature change during non-contact diode laser irradiation of implant surfaces. Lasers Med Sci. 27 (2), 339-342 (2012).
- Alpaslan Yayli, N. Z., Talmac, A. C., Keskin Tunc, S., Akbal, D., Altindal, D., Ertugrul, A. S. Erbium, chromium-doped: yttrium, scandium, gallium, garnet and diode lasers in the treatment of peri‐implantitis: Clinical and biochemical outcomes in a randomized-controlled clinical trial. Lasers Med Sci. 37 (1), 665-674 (2022).
- Peters, N., Tawse-Smith, A., Leichter, J., Tompkins, G. Laser therapy: The future of peri-implantitis management. J Periodontol. 22 (1), 1(2012).
- Alhaidary, D., Franzen, R., Hilgers, R. D., Gutknecht, N. First investigation of dual-wavelength lasers (2780 nm Er,Cr:YSGG and 940 nm diode) on implants in a simulating peri-implantitis situation regarding temperature changes in an in vitro pocket model. Photobiomodul Photomed Laser Surg. 37 (8), 508-514 (2019).
- Rezeka, M. A., Metwally, N. A., Abd El Rehim, S. S., Khamis, M. M. Evaluation of the effect of diode laser application on the hydrophilicity, surface topography, and chemical composition of titanium dental implant surface. J Prosthodont. 2024, 1-8 (2025).
- Khalil, M. I., Sakr, H. Implant surface topography following different laser treatments: An in vitro study. Cureus. 15 (5), e38731(2023).
- Tosun, E., Tasar, F., Strauss, R., Kivanc, D. G., Ungor, C. Comparative evaluation of antimicrobial effects of Er:YAG, diode, and CO2 on titanium discs: An experimental study. J Oral Maxillofac Surg. 70 (5), 1064-1069 (2012).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Park, J., Heo, S., Koak, J., Kim, S. K., Han, C. H., Lee, J. H. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 27 (6), Accessed September 22, 2024 1215-1221 (2012).
- Aoki, A., Mizutani, K., Schwarz, F., et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 68 (1), 217-269 (2015).
- Roncati, M., Lucchese, A., Carinci, F. Non-surgical treatment of peri-implantitis with the adjunctive use of an 810-nm diode laser. J Indian Soc Periodontol. 17 (6), 812-817 (2013).
- Romanos, G. E., Gutknecht, N., Dieter, S., Schwarz, F., Crespi, R., Sculean, A. Laser wavelengths and oral implantology. Lasers Med Sci. 24 (6), 961-970 (2009).
- Hauser-Gerspach, I., Stübinger, S., Meyer, J. Bactericidal effects of different laser systems on bacteria adhered to dental implant surfaces: An in vitro study comparing zirconia with titanium. Clin Oral Implants Res. 21 (3), 277-283 (2010).
- Hafeez, M., Calce, L., Hong, H., Hou, W., Romanos, G. E. Thermal effects of diode laser-irradiation on titanium implants in different room temperatures in vitro. Photobiomodul Photomed Laser Surg. 40 (8), 554-558 (2022).
- Koopaie, M., Kia Darbandsari, A., Hakimiha, N., Kolahdooz, S. Er,Cr:YSGG laser surface treatment of gamma titanium aluminide: Scanning electron microscopy-energy-dispersive X-ray spectrometer analysis, wettability and Eikenella corrodens and Aggregatibacter actinomycetemcomitans bacteria count - in vitro study. Proc Inst Mech Eng H. 234 (8), 769-783 (2020).
- Kayar, N. A., Hatipoǧlu, M. Could we set a convenient irradiation time to reduce the possibility of thermal pulp damage during diode laser as an adjunct to periodontal treatment? An in vitro analysis. Photobiomodul Photomed Laser Surg. 39 (7), 480-485 (2021).
- Barrak, H., Mahdi, S. S., Alkurtas, S. A., Size, P. Clinical applications of a 940 nm diode laser for laser troughing versus conventional method: A preliminary study. Iraqi J Laser. 23 (2), (2024).
- Beer, F., Körpert, W., Passow, H., et al. Reduction of collateral thermal impact of diode laser irradiation on soft tissue due to modified application parameters. Lasers Med Sci. 27 (5), 917-921 (2012).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an erbium, chromium-doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Al-Omari, W. M., Palamara, J. E. The effect of Nd:YAG and Er,Cr:YSGG lasers on the microhardness of human dentin. Lasers Med Sci. 28 (1), 151-156 (2013).
- Kreisler, M., Götz, H., Duschner, H., d’Hoedt, B. Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAlAs laser irradiation on surface properties of endosseous dental implants. Int J Oral Maxillofac Implants. 17 (5), 202-209 (2002).
- Kottmann, L., Franzen, R., Conrads, G., Wolfart, S., Marotti, J. Effect of Er,Cr:YSGG laser with a side-firing tip on decontamination of titanium disc surface: An in vitro and in vivo study. Int J Implant Dent. 9 (1), 7(2023).
- Yao, W. L., Lin, J. C. Y., Salamanca, E., et al. Er,Cr:YSGG laser performance improves biological response on titanium surfaces. Materials. 13 (3), 756(2020).
- Smeo, K., Nasher, R., Gutknecht, N. Antibacterial effect of Er,Cr:YSGG laser in the treatment of peri-implantitis and their effect on implant surfaces: A literature review. Lasers Dent Sci. 2 (2), 63-71 (2018).
- Fletcher, P., Linden, E., Cobb, C., Zhao, D., Rubin, J., Planzos, P. Efficacy of removal of residual dental cement by laser, ultrasonic scalers, and titanium curette: An in vitro study. Compend Contin Educ Dent. , (2025).
- Lollobrigida, M., Fortunato, L., Serafini, G., et al. The prevention of implant surface alterations in the treatment of peri-implantitis: Comparison of three different mechanical and physical treatments. Int J Environ Res Public Health. 17 (8), 2624(2020).
- Arora, S., Lamba, A. K., Faraz, F., Tandon, S., Ahad, A. Evaluation of the effects of Er,Cr:YSGG laser, ultrasonic scaler and curette on root surface profile using surface analyser and scanning electron microscope: An in vitro study. J Lasers Med Sci. 7 (4), 243-249 (2016).
- Jin, S. H., Lee, E. M., Park, J. B., Kim, K. K., Ko, Y. Decontamination methods to restore the biocompatibility of contaminated titanium surfaces. J Periodontal Implant Sci. 49 (3), 193-204 (2019).
- Kayar, N. A., Hatipoǧlu, M. Can we determine an appropriate timing to avoid thermal pulp hazard during gingivectomy procedure? An in vitro study with diode laser. Photobiomodul Photomed Laser Surg. 39 (2), 94-99 (2021).
- Monzavi, A., Fekrazad, R., Chinipardaz, Z., Shahabi, S., Behruzi, R., Chiniforush, N. Effect of various laser wavelengths on temperature changes during peri-implantitis treatment: An in vitro study. Implant Dent. 27 (3), 311-316 (2018).
- Valente, N. A., Calascibetta, A., Patianna, G., Mang, T., Hatton, M., Andreana, S. Thermodynamic effects of 3 different diode lasers on an implant-bone interface: An ex-vivo study with review of the literature. J Oral Implantol. 43 (2), 94-99 (2017).
- Leja, C., Geminiani, A., Caton, J., Romanos, G. E. Thermodynamic effects of laser irradiation of implants placed in bone: An in vitro study. Lasers Med Sci. 28 (6), 1435-1440 (2013).
- Strever, J. M., Lee, J., Ealick, W., et al. Erbium, chromium:yttrium-scandium-gallium-garnet laser effectively ablates single-species biofilms on titanium disks without detectable surface damage. J Periodontol. 88 (5), 484-492 (2017).
- Bourauel, C., Fries, T., Drescher, D., Plietsch, R. Surface roughness of orthodontic wires via atomic force microscope, laser specular reflectance, and profilometry. Eur J Orthod. 20 (1), Accessed February 13, 2025 79-92 (1998).
- Choi, S., Kim, J. H., Kim, N. J., et al. Morphological investigation of various orthodontic lingual bracket slots using scanning electron microscopy and atomic force microscopy. Microsc Res Tech. 79 (12), 1193-1199 (2016).
- Huang, H. H., Chuang, Y. C., Chen, Z. H., Lee, T. L., Chen, C. C. Improving the initial biocompatibility of a titanium surface using an Er,Cr:YSGG laser-powered hydrokinetic system. Dent Mater. 23 (4), 410-414 (2007).
- Furtsev, T. V., Koshmanova, A. A., Zeer, G. M., et al. Laser cleaning improves stem cell adhesion on the dental implant surface during peri-implantitis treatment. Dent J. 11 (2), 30(2023).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Kim, H. K., Park, S. Y., Son, K., et al. Alterations in surface roughness and chemical characteristics of sandblasted and acid-etched titanium implants after irradiation with different diode lasers. Appl Sci. 10 (12), 4167(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved