Method Article
In vitro Évaluation des effets des lasers Er,Cr :YSGG et à diode utilisés sur cylindre en titane
Dans cet article
Résumé
Dans cette étude, les lasers Er,Cr :YSGG et à diode ont été appliqués séparément sur la surface plane d’un total de 96 cylindres en titane spécialement conçus. Un thermocouple placé sur l’autre surface et la température a été mesurée. Rugosité de surface analysée par profilomètre, MEB et AFM.
Résumé
Les maladies péri-implantaires sont des problèmes importants associés aux implants dentaires. Le but de cette étude était d’évaluer la rugosité de surface et les changements de température lorsque des lasers à diode et à l’erbium, au chrome Yttrium-Scandium-Gallium-Garnet (Er,Cr :YSGG) sont appliqués sur des cylindres en titane dans le traitement des maladies péri-implantaires non chirurgicales. Au total, 13 groupes, y compris le groupe témoin, ont été formés avec des lasers à diode 940 nm (0,8 W-1,3 W-1,8 W) et Er,Cr :YSGG (1,5 W-2,5 W-3,5 W) dans 6 modes de puissance différents, 20 s/W et 40 s/W, et huit cylindres en titane ont été traités dans chaque groupe. Au cours du processus, les températures initiale et finale ont été enregistrées à l’aide d’un thermocouple placé dans la fente apicale du cylindre. Après l’application, la rugosité (Ra) de tous les disques a été mesurée par un profilomètre. Les surfaces ont été balayées au microscope électronique à balayage (MEB) et au microscope à force atomique (AFM) pour un examen de surface bidimensionnel et tridimensionnel. Lorsque les changements de température des cylindres en titane pendant l’irradiation ont été évalués, les cylindres irradiés avec un laser à diode pendant 40 s étaient significativement plus élevés que ceux irradiés pendant 20 s. Dans les cylindres traités Er,Cr :YSGG, la température a diminué dans certains échantillons et a augmenté de manière minime dans certains échantillons. Les valeurs du profilomètre (Ra) n’étaient pas statistiquement significatives en termes de rugosité pour tous les groupes. Cependant, les images MEB ont montré une fusion et une augmentation du nombre de micropores sur les surfaces traitées. Compte tenu des limites de cette étude in vitro , l’application de l’Er,Cr :YSGG et de la diode peut être considérée comme une approche sûre pour la prise en charge de la péri-implantite, notamment en termes de sécurité thermique. Bien que la rugosité de la surface reste inchangée, l’utilisation de ces lasers a entraîné des changements de fusion et des micropores sur la topographie du cylindre de Ti. Pour déterminer comment ces paramètres laser affectent la diminution bactérienne et l’ostéointégration, des recherches supplémentaires sont nécessaires.
Introduction
Les implants dentaires sont une option de traitement couramment acceptée pour le remplacement des dents perdues 1,2. La mucite péri-implantaire et la péri-implantite sont classées comme des maladies péri-implantaires. La mucite péri-implantaire est limitée aux tissus mous et il n’y a aucun signe de perte osseuse, à l’exception d’un remodelage osseux physiologique. La péri-implantite est une affection pathologique associée à la plaque dentaire et qui affecte les tissus entourant les implants dentaires. Il se distingue par l’inflammation de la muqueuse péri-implantaire et la perte croissante de l’os de soutien3 qui en résulte. Le principal facteur étiologique de l’initiation et de la progression de la maladie est la perturbation du biofilm de la plaque péri-implantaire4. De nombreuses études sur les maladies péri-implantaires indiquent que la prévalence de la mucite péri-implantaire (MIP) varie de 9,7 % à 64,6 %, tandis que la prévalence de la mucite péri-implantaire (P) varie entre 4,7 % et 45 %5.
Alors que l’accumulation de plaque est le principal facteur étiologique à l’origine de la péri-implantite, son traitement est compliqué par les diverses caractéristiques topographiques des implants. La base du traitement non chirurgical de la péri-implantite est la gestion de l’infection par le débridement de la surface de l’implant et l’élimination du biofilm adhérent pour réduire la charge bactérienne en dessous du seuil pathogène 6,7. La micro et macro-topographie complexe des interfaces en titane et de l’anatomie des défauts osseux limite la décontamination des surfaces. L’efficacité de différentes techniques de décontamination mécanique (curettes, appareils à ultrasons, abrasion à l’air poudre, brosses en titane), chimique (acide citrique, chlorhexidine, antimicrobiens) et physique (laser, thérapie photodynamique) a été évaluée en combinaison8. Les recherches actuelles suggèrent que l’utilisation combinée de techniques d’intervention non chirurgicales pour la péri-implantite est plus efficace que le débridement seul9. L’incorporation d’agents chimiques antimicrobiens ou d’antibiotiques locaux/systémiques dans la thérapie mécanique a démontré une efficacité significative ; Néanmoins, ces interventions pourraient avoir des conséquences néfastes10. Au fur et à mesure que la technologie laser a progressé, les lasers dentaires sont devenus de plus en plus populaires en raison de leurs effets anti-infectieux, détoxifiants et conviviaux sur les surfaces des implants10,11.
Le pic d’absorption, le mode de fonctionnement de l’appareil et les propriétés tissulaires affectent l’augmentation de la chaleur lors de l’irradiation laser. Une étude préclinique cruciale a révélé qu’une élévation de la température à 50 °C pendant 1 minute provoquait des lésions vasculaires, tandis qu’une élévation à 60 °C entraînait l’arrêt du flux sanguin et une nécrose osseuseultérieure12. Une étude in vitro a révélé qu’après seulement 10 secondes d’irradiation au laser à diode, les surfaces de l’implant pouvaient atteindre des températures supérieures au seuil de sécurité osseuse (10 °C). La viabilité osseuse pourrait être compromise par une augmentation de la température de seulement 10 °C13.
De nombreuses études récentes se sont concentrées sur l’examen de l’impact bénéfique des lasers dans ce domaine 14,15,16,17,18. Différentes longueurs d’onde laser démontrent un impact antibactérien significatif et une sécurité sur les surfaces de l’implant lorsque des paramètres appropriés sont appliqués. Un certain nombre de variables, notamment l’intensité, la fréquence et la longueur d’onde, influencent l’efficacité des traitements au laser. Plusieurs études ont démontré l’effet bactéricide de différentes longueurs d’onde laser, notamment CO2, Er :YAG, Er, Cr :YSGG et divers lasers à diode, ce qui nous permet d’identifier les effets bénéfiques de différents lasers dans le traitement de la péri-implantite. Aoki et al 19,20,21. ont conclu de leur examen que l’application du laser facilite le nettoyage des surfaces dans les traitements péri-implantaires non chirurgicaux et chirurgicaux, y compris la thérapie régénérative, et favorise la guérison en activant les cellules tissulaires environnantes22.
Les lasers à diode ont la capacité d’exercer un effet bactéricide sur les surfaces de l’implant sans affecter le motif de la surface de l’implant. Lorsqu’il s’agit de traiter la péri-implantite, le laser à diode peut être la voie à suivre car il favorise la cicatrisation des tissus parodontaux 23,24,25.
Les lasers à l’erbium, au chrome : yttrium, scandium, gallium, grenat (Er,Cr :YSGG) présentent des propriétés efficaces pour l’élimination du biofilm et la décontamination des surfaces des implants11. De forts effets bactéricides et des propriétés de régénération osseuse ont été démontrés par les lasers à l’erbium sans causer de dommages mécaniques grâce à leurs propriétés hydrauliques11,14.
Il y a un manque de données concernant les altérations causées par l’irradiation laser sur les implants en titane. De plus, une méthodologie définitive pour l’irradiation des surfaces en titane doit encore être définie, englobant des paramètres laser tels que la puissance et le temps d’application. Des études antérieures ont montré que l’application du laser Er,Cr :YSGG16 n’avait aucun effet sur le changement de température, cependant, les études au laser à diode ont dépassé13 et n’ont pas dépassé16,26 la valeur critique. Différents résultats de l’effet du traitement laser sur la valeur Ra de la surface du titane sont disponibles dans la littérature18,27. L’hypothèse nulle de l’étude est qu’il n’y aura pas de différence entre les lasers Er,Cr :YSGG et les lasers à diode en termes de changement de température et de rugosité des surfaces en titane par utilisation. Cette étude visait à déterminer des paramètres de fonctionnement sûrs en surveillant la rugosité de surface et les variations de température sur le titane à l’aide de lasers Er, Cr :YSGG et à diode à divers réglages de temps et de puissance. L’évaluation des changements de température a été effectuée à l’aide d’un thermocouple, la rugosité de surface a été évaluée à l’aide d’un profilomètre et les altérations de surface ont été analysées à l’aide de techniques MEB et AFM.
Protocole
REMARQUE : Les cylindres en titane, fabriqués à partir du même matériau que les implants conventionnels et conçus pour reproduire la surface de l’implant avec la technologie SLA, présentent une hauteur de 10 mm et un diamètre de 5 mm. Une cavité de 7 mm de profondeur et 3 mm de largeur est située au centre des cylindres (Fig. 2). La largeur de 3 mm se réduit à 1 mm au point le plus profond. Il n’est pas possible de mesurer la rugosité de surface d’implants standard à l’aide d’un profilomètre. Il a été possible d’évaluer l’efficacité du laser appliqué sur une surface plane de 5 mm de diamètre au sommet du cylindre en titane conçu par le fabricant, en utilisant le même matériau qui simule la surface de l’implant. De plus, afin de mesurer les changements de température à partir du centre du cylindre, une rainure de 7 mm de profondeur et 3 mm de large a été créée à partir du centre de la surface inférieure du cylindre en titane vers les profondeurs du cylindre, où la pointe du thermocouple sera placée. Cette rainure permet d’évaluer le changement de température de la surface traitée à partir de l’intérieur du cylindre, plutôt que de dépendre de la surface extérieure. Des images tridimensionnelles ont été obtenues en analysant les surfaces planes de cylindres en titane spécialement produits à l’aide d’un microscope à force atomique (AFM). Une diode de 940 nm (0,8 W28, 1,3 W29, 1,8 W30) et des lasers Er,Cr :YSGG de 2,780 nm (1,5 W31, 2,5 W31, 3,5 W32) ont été utilisés à trois puissances différentes selon les recommandations de l’entreprise, et 12 groupes ont été formés avec un temps d’application de 20 s et 40 s chacun. Après l’application, un groupe témoin a été ajouté pour l’évaluation de la rugosité. Un support avec un support de doigt a été imprimé à partir d’une imprimante tridimensionnelle pour maintenir la stabilité du cylindre de Ti pendant l’application (Table des matériaux).
1. Taille de l’échantillon
- Calculez la taille de l’échantillon à l’aide de l’analyse de puissance du programme G*Power. Le nombre minimal d’échantillons pour chaque groupe a été déterminé comme suit : n = 8 échantillons pour le changement de température avec une taille d’effet d : 0,6906, un écart-type de 16,8, une puissance : 0,80 et une α : 0,05.
REMARQUE : Dans cette étude, un laser Er,Cr :YSGG équipé d’un laser à diode de 940 nm avec une pointe de 300 μm de diamètre (pointe e3) et d’une pointe RFPT5-14 élastique de tir à 360° (580 μm de diamètre et 14 mm de long) a été utilisé comme système laser (Figure 1).

Figure 1 : Instruments et équipements utilisés. (A) Laser à diode, (B) Laser Er,Cr :YSGG, (C) Pointe E3, (D) Pointe RPTF5-14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Détermination des groupes de travail
- Prenez le watt recommandé des lasers pour une application dans la poche dans la mucite péri-implantaire comme condition idéale d’utilisation. De plus, incluez une valeur inférieure et une valeur supérieure dans les groupes d’étude par rapport au watt recommandé. Les valeurs utilisées ici sont de 1,5 W et 3,5 W pour Er,Cr :YSGG, et de 0,8 W et 1,8 W pour le laser à diode.
- Déterminer le temps d’application à 20 s et 40 s pour évaluer l’effet du temps de fonctionnement sur le changement de température. Les groupes d’étude sont présentés dans le tableau 1.
| Nom du groupe | Laser Type | Nombre d’échantillons (n) | Watt (W) | Temps(s) |
| E1 | Er,Cr :YSGG | 8 | 1,5 W | 20 |
| E2 | 8 | 2,5 W | 20 | |
| E3 | 8 | 3,5 W | 20 | |
| E4 | 8 | 1,5 W | 40 | |
| E5 | 8 | 2,5 W | 40 | |
| E6 | 8 | 3,5 W | 40 | |
| J1 | Diode | 8 | 0,8 W | 20 |
| J2 | 8 | 1,3 W | 20 | |
| J3 | 8 | 1,8 W | 20 | |
| D4 | 8 | 0,8 W | 40 | |
| J5 | 8 | 1,3 W | 40 | |
| J6 | 8 | 1,8 W | 40 | |
| C | Contrôle | 8 |
Tableau 1 : Informations sur les commissions d’étude.
3. Préparation du dispositif expérimental
- Avec le programme Rhinoceros (graphisme 3D et design), concevez un support cylindrique en 3D avec une cavité légèrement d’un diamètre de 10 mm et d’une épaisseur de 5 mm.
- Ouvrez l’application. Dessinez un cercle de 10 mm de diamètre. Réduisez le cercle de 50 % par rapport à un axe pour créer une ellipse. Appuyez sur Extuder et soulevez l’ellipse dans la troisième dimension.
- Dessinez à nouveau un cercle pour soutenir les doigts. Soulevez le deuxième cercle dans la troisième dimension avec la clé de l’extrudeuse. Faites en sorte que la hauteur soit inférieure au premier cercle.
- Percez un trou de 10 mm dans le dessin elliptique à l’aide de la commande booléenne. Pour le support du thermocouple, faites une ligne en forme de L avec la commande Sweep 1 et créez la 3ème dimension.
- Dessinez un carré, agrandissez-le dans la 3ème dimension avec la commande extrudeur et créez la base. Après avoir imprimé le motif, appliquez du silicone autour du trou où le cylindre de Ti viendra le sécher et séchez-le. Cela maintiendra le cylindre en place pendant l’application du laser.
- Amenez une pièce fermée avec climatisation à une température de 27 °C. Fixez le support sur lequel les cylindres seront fixés au milieu d’une baignoire en plastique avec du ruban adhésif double face.
REMARQUE : Insérez le cylindre Ti, pressez l’air sur la surface. - Placez le thermocouple du thermomètre dans la partie creuse du cylindre Ti placé dans sa fente sur le support.
- Préparez un chronomètre pour suivre le temps d’application. Enregistrez les degrés par le 3ème observateur et suivez l’heure avec le chronomètre.
4. Procédure expérimentale
- Lors de l’application laser, portez des lunettes de protection pour la sécurité du praticien. Insérez la pointe RPTF5-14 pour laser Er,Cr :YSGG. Insérez l’embout E3 pour le laser à diode.
- Allumez le laser Er,Cr :YSGG. Sélectionnez le mode fermé Perio. Appliquez des lasers de 1,5 W, 2,5 W et 3,5 W pendant 20 s et 40 s chacun. Il y a 96 cylindres Ti avec application laser. Irradiez un cylindre de Ti avec un seul type de laser, un watt et une seule fois.
- Allumez le laser à diode. Sélectionnez le mode Perio Pocket. Appliquez un laser de 0,8 W, 1,3 W et 1,8 W pendant 20 s et 40 s chacun.
- Demandez au 3ème observateur de démarrer le chronomètre lorsque le laser démarre. Prévenez-le lorsque le temps est écoulé.
- Appliquez la pointe laser à un angle de 15° par rapport à la surface, en contact, en zigzaguant sur toute la surface pendant le temps prévu.
- Notez les valeurs de température initiales et finales lors de l’application. Soustrayez la valeur de température de début de la valeur de température de fin. Calculez le changement de température.
REMARQUE : Notez les valeurs de changement de température pour un total de 12 groupes, 6 groupes Er, Cr :YSGG et 6 groupes laser à diode. - Conservez les échantillons dans des sacs transparents sur lesquels sont inscrits les numéros de groupe.
5. Imagerie bidimensionnelle et tridimensionnelle des matériaux
- Effectuer des analyses au microscope électronique à balayage (MEB) et au microscope à force atomique (AFM) pour évaluer et démontrer les changements dans la morphologie de la surface du cylindre de Ti.
REMARQUE : L’instrument FEI Quanta FEG 250 a été utilisé. - Ne pas enduire les échantillons avant de les placer dans le MEB. Il y a 13 groupes, dont 1 groupe de contrôle, 6 groupes de laser à diode et 6 groupes de laser Er,Cr : YSGG. Pour le groupe témoin, n’effectuez aucun traitement, prenez uniquement des images de surface par AFM et MEB.
- Choisissez au hasard un cylindre dans chacun des 13 groupes d’étude. Insérez-les dans le dispositif MEB. Notez l’emplacement sur la plateforme et le code de l’échantillon pour éviter de mélanger les échantillons.
- Placez le cylindre de Ti dans le dispositif MEB avec la surface plane vers le haut. Effectuez des analyses en utilisant le mode Low Vacuum. Réglez la pression de la chambre à 60 Pa pendant l’analyse.
- Une fois que l’appareil est entièrement prêt, enregistrez des images à un grossissement de 250x, 1000x et 5000x à partir d’un point aléatoire sur la surface plane. Répétez cette procédure pour tous les échantillons.
REMARQUE : Lorsque le périphérique SEM a fini d’aspirer, il est prêt pour la collecte d’images. - Pour la mesure AFM, sélectionnez au hasard une bouteille de Ti dans chaque groupe d’étude. Effectuez la mesure en mode taraudage.
- Placez la bouteille de Ti dans l’instrument AFM. Placez le capot supérieur de manière à ce que la pointe de l’instrument soit sur l’échantillon. Vérifiez que la lumière rouge de la fenêtre de l’instrument se trouve sur la surface à imager.
- Réglez la tension sur 2. Rapprochez la pointe de l’échantillon à l’aide du bouton d’atterrissage automatique. Démarrez l’analyse en appuyant sur le bouton Démarrer l’analyse.
- Prenez une image numérique de 5 μm x 5 μm pour chaque échantillon et enregistrez à une fréquence de balayage lente (1 Hz). Enregistrez des images prises avec l’instrument AFM à partir des surfaces planes des cylindres de Ti. L’instrument AFM visualise une zone de 25 μm2 .
6. Mesure de la rugosité de surface
REMARQUE : L’appareil Surftest SJ 201, Mitutoyo, Tokyo, Japon, a été utilisé ici.
- Réglez la résolution du profilomètre sur 0,01 mm, la longueur transversale sur 3,0 mm et le diamètre de la pointe de la goupille d’enregistrement en diamant sur 5 μm. Réglez la vitesse de mesure sur 0,5 mm/s pour déterminer la valeur Ra.
- Fixez le cylindre de Ti à l’aide d’un support, utilisez le presel et fixez le cylindre de Ti en le tenant par la surface latérale. Placez l’aiguille du profilomètre en contact avec la surface Ti.
- Appuyez sur le bouton Démarrer. Enregistrez la valeur Ra trouvée. Répétez la mesure 5 fois dans différentes directions sur la surface plane de chaque cylindre (Figure 2). Pour obtenir les différentes directions, déplacez le cylindre Ti sur lui-même à l’aide d’une prévente. Répétez l’opération sur toute la longueur du cylindre de Ti.
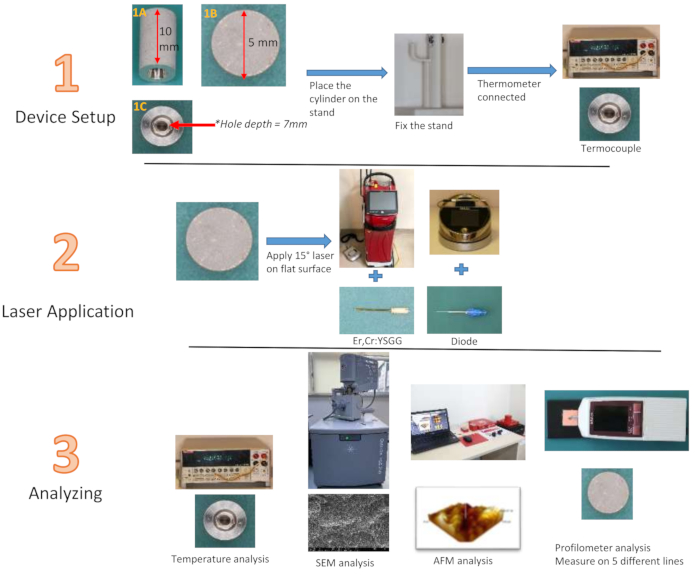
Figure 2 : Organigramme des groupes d’étude. (1A) Vue latérale du cylindre Ti, (1B) vue de dessus, (1C) vue de dessous Veuillez cliquer ici pour voir une version plus grande de cette figure.
7. Analyse statistique
- Effectuez des analyses statistiques à l’aide du progiciel statistique SPSS-Windows et appliquez les tests de Kruskal-Wallis et de Mann-Whitney. Définissez le niveau de confiance statistique à 95 % (α = 0,05).
Résultats
Lors de l’évaluation basée sur les temps d’application de 20 secondes et 40 secondes, une différence statistiquement significative a été observée. On a observé que la variation de température sur les surfaces cylindriques de Ti appliquées au laser de 40 s était supérieure à celle des surfaces des cylindres de Ti appliquées au laser de 20 s (p = 0,037 ; Figure 3).
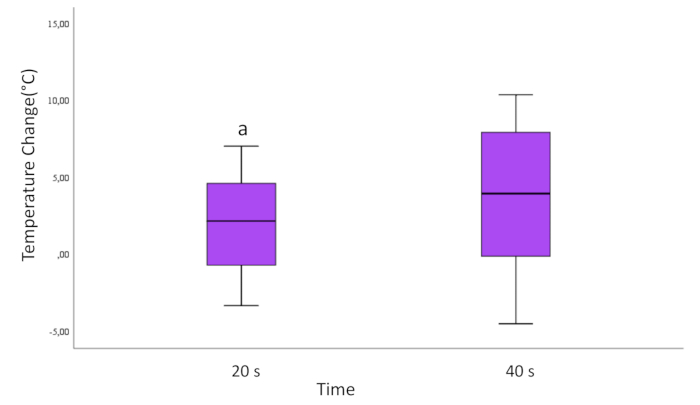
Figure 3 : Changement de température en fonction du temps pour tous les échantillons. Les lignes qui montent et descendent à partir de la boîte indiquent les valeurs minimale et maximale des données. La ligne horizontale à l’intérieur de la boîte représente la médiane des données. Les marques rondes sont des valeurs aberrantes.
a=Différence statistiquement significative par rapport au groupe de 40 s. (p<0,05)
Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous avons analysé le changement de température en les classant en deux groupes basés sur les types de lasers (Er, Cr :YSGG et diode). On a observé que le changement de température dans les cylindres de Ti utilisant un laser à diode était supérieur à celui des cylindres utilisant le laser Er,Cr :YSGG. Les résultats sont statistiquement significatifs (p = 0,001 ; voir figure 4). Dans l’évaluation des cylindres de Ti testés uniquement pour l’application laser à diode, les résultats ont indiqué que l’application laser à diode 40 s a donné des résultats significativement plus élevés par rapport à l’application 20 s pour toutes les valeurs de watt (p < 0,001 ; Figure 4). La ligne rouge à l’intérieur de la case de la figure indique la valeur médiane. Les barres en haut et en bas indiquent les valeurs de température maximale et minimale.

Figure 4 : Variation de température selon les types de laser et le temps pour tous les échantillons. Les lignes qui montent et descendent à partir de la boîte indiquent les valeurs minimale et maximale des données. La ligne horizontale à l’intérieur de la boîte représente la médiane des données. Les marques rondes sont des valeurs aberrantes.
a=Différence statistiquement significative par rapport au groupe de diodes. (p<0,05)
b= Différence statistiquement significative par rapport au laser à diode 40 s. (p<0,05)
Veuillez cliquer ici pour voir une version agrandie de cette figure.
La dernière évaluation statistique du changement de température a été réalisée sur la base de la valeur du watt. Des différences significatives ont été observées en examinant uniquement les valeurs de watt (p < 0,001) et les paramètres watt-temps (p < 0,001) dans les groupes qui ont utilisé le laser Er,Cr :YSGG. Dans l’application du laser Er,Cr :YSGG, il a été observé que le temps en lui-même n’avait pas d’impact significatif sur le changement de température (p = 0,959). Lors de l’évaluation du changement de température dans tous les cylindres de Ti exposés au laser à diode, en tenant compte des variables Watt, temps et Watt-temps, une différence statistiquement significative a été observée (p < 0,05). La plage de température des groupes de lasers à diode avec 1,8 Watt appliqué aux surfaces des cylindres Ti était nettement supérieure à celle des groupes de lasers à diode avec 0,8 Watt appliqué (p = 0,006 ; Figure 5).
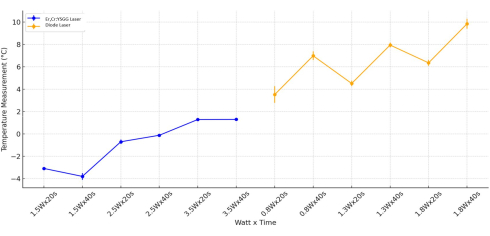
Figure 5 : Analyse combinée de la température. L’analyse a été effectuée pour les types Er, Cr :YSGG et Diode Laser par Watt et Temps. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Analyse d’imagerie
Sur les images MEB, une structure poreuse de la taille d’un micron a été observée dans tous les groupes, ce qui correspond à l’apparence attendue des surfaces d’implants sablées et rugueuses à l’acide. À un grossissement de 5000x, les surfaces en titane traitées au laser ont montré une expansion visible des pores de l’ordre du micron par rapport au groupe témoin (cercles rouges). À des grossissements de 250x et 1000x, les surfaces en titane traitées avec des lasers Er,Cr :YSGG et à diodes pendant 40 s ont montré plus de fusion que celles traitées pendant 20 s (Figure 6). Dans les images AFM, la distribution des indentations de surface dans le groupe témoin était plus homogène que dans les groupes traités au laser (Figure 7, Figure 8). Étant donné que les images AFM n’ont visualisé qu’une très petite zone de 25μm2 de la surface plane du cylindre en titane, nous n’avons pas pu obtenir un résultat détaillé sur toute la surface.

Figure 6 : Images MEB de toutes les commissions d’études. Les 6 groupes de lasers à diodes sont étiquetés D1-D6, tandis que les 6 groupes de lasers Er,Cr : YSGG sont étiquetés E1-E6. Les images sont prises à un grossissement de 250x, 1000x, 5000x. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Image AFM du groupe témoin. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Images AFM de toutes les commissions d’études. Les 6 groupes laser à diodes sont étiquetés D1-D6 tandis que les 6 groupes laser Er,Cr : YSGG sont étiquetés E1-E6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats de rugosité de surface
Le paramètre de rugosité n’a pas montré de différence statistiquement significative dans les variables type de laser (p = 0,841), Watt (p = 0,900), temps (p = 0,399), et dans l’évaluation du type de laser, du Watt et des variables temporelles ensemble (p = 0,924 ; Figure 9).

Figure 9 : Analyse de rugosité par type de laser, watt et temps. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Compte tenu de ces résultats, nous pouvons conclure que les lasers Er, Cr :YSGG et à diode sont sans danger pour décontaminer la surface du titane dans les maladies péri-implantaires. La variation de température était inférieure à 10 °C, ce qui indiquait que les paramètres se situaient dans la plage de sécurité. Dans le même temps, la valeur du profilomètre n’a pas changé de manière significative, ce qui indique qu’il n’y a pas d’inconvénients en termes de rugosité de surface. Des modifications faciales ont été détectées lors de l’analyse d’imagerie, mais cela n’a pas pu être soutenu par l’analyse de rugosité. Les résultats de l’étude confirment que les paramètres laser utilisés se situent dans la plage de sécurité.
a=Différence statistiquement significative par rapport au groupe de diodes. (p<0,05)
b= Différence statistiquement significative par rapport au laser à diode 40 s. (p<0,05)
Discussion
Une discussion importante est en cours sur la méthode optimale de décontamination des surfaces d’implants dans le traitement de la péri-implantite. Des publications antérieures ont proposé l’utilisation de médicaments locaux ou systémiques, l’application au laser, le nettoyage mécanique et/ou chimique et l’implantoplastie. Les résultats de notre étude ont révélé que toutes les températures mesurées passent en dessous du seuil de sécurité critique de 10 °C13. Cependant, en gardant à l’esprit qu’il s’agit d’une étude in vitro et qu’elle ne peut pas toujours reproduire les conditions cliniques, il a été observé que l’utilisation du laser Er,Cr :YSGG et du laser à diode provoquait des changements de fusion et des micropores dans la topographie de l’implant, tandis que la rugosité de la surface ne changeait pas.
L’utilisation des lasers Ho :YAG et Nd :YAG33 pour la décontamination a été signalée comme inappropriée en raison des effets de surface ; cependant, les lasers Er,Cr :YSGG34 et les lasers à diode18 se sont avérés efficaces à cette fin. Le laser à diode améliore la cicatrisation dans les tissus environnants via l’expression de HBD-2 stimulée par la signalisation TGF-β1. L’étude a révélé une réduction de la rugosité de surface et de la colonisation par P. gingivalis, ainsi qu’une augmentation de la viabilité des fibroblastes et de la différenciation des ostéoblastes, suite à l’application du laser Er,Cr :YSGG dans un mouvement en zigzag sur la surface en titane35. Les résultats de cette étude ont montré que le laser Er,Cr :YSGG n’a causé aucun dommage thermique aux surfaces en titane à des réglages d’énergie allant jusqu’à 3,5 W jusqu’à 40 s. Cette constatation est en corrélation avec une revue de la littérature publiée par Smeo et al.36, qui a déterminé que les lasers au erbium peuvent exercer un impact antibactérien sans dépasser le seuil de température critique lorsqu’ils sont utilisés avec les paramètres laser corrects.
Les paramètres du laser à diode de 940 nm dans cette étude étaient de 0,8 W, 1,3 W et 1,8 W, ce qui comprenait une puissance de sortie différente et des temps d’irradiation de 20 s et 40 s13. Dans deux études différentes évaluant l’utilisation de lasers à diodes sur des surfaces en titane, 20 s37 et 40 s38 ont été utilisés comme temps d’application. De même, les lasers Er,Cr :YSGG appliqués sur le titane et les surfaces des dents ont été utilisés avec des temps d’application de 20 s39 et 40 s40. Dans une étude, un laser à diode a dépassé la température critique en 18 secondes13. Dans les applications laser à diode, il a été recommandé d’éviter une exposition prolongée à la surface de la racine afin d’éviter des dommages thermiques à la pulpe (seuil critique de 5,6 °C)28,41. Une étude évaluant l’effet de l’utilisation de divers lasers sur le changement de température des surfaces en titane a révélé que les lasers Er :YAG, CO2, Nd :YAG et à diode ne dépassaient pas le changement de température critique de 10°C dans un réservoir d’eau42. De même, dans cette étude, les groupes de lasers à diodes de 940 nm ont généré une élévation de température nettement plus rapide ; Cependant, les valeurs de température finales étaient inférieures au seuil critique. Dans l’application d’un laser à diode de 940 nm, l’augmentation de la température peut être diminuée en sélectionnant une puissance de sortie réduite et en minimisant le temps d’irradiation. Ces résultats indiquent une relation positive entre l’augmentation de la densité de puissance/énergie 13,43,44 et la température élevée en l’absence de refroidissement par eau, soulignant l’importance du refroidissement par eau pendant l’irradiation comme le laser Er,Cr :YSGG 16,45.
La profilométrie mécanique et 3D-optique (avec et sans contact) sont les méthodes in vitro les plus populaires pour la mesure quantitative de la nanotopographie des matériaux dentaires et de la rugosité de surface des implants, tandis que les images MEB sont la référence pour l’évaluation qualitative31. La mesure de la rugosité à l’aide d’un profilomètre à contact peut endommager la surface et entraîner des mesures inexactes46. Alors que l’imagerie MEB n’a pas permis de faciliter l’analyse quantitative et qualitative des échantillons, les images AFM ont pu fournir des informations quantitatives en termes de rugosité de surface et de profondeur 3D47. Des altérations morphologiques ont été notées sur les surfaces de l’implant après le traitement au laser, caractérisées par une augmentation du diamètre des micropores, une morphologie fondue et une prévalence accrue de micropores piqués par rapport au groupe témoin. Dans ces conditions expérimentales, la surface du cylindre de Ti lors de l’analyse MEB a révélé des altérations de surface. De plus, ces altérations ont été affectées par le type de laser, la puissance utilisée et le temps consacré à l’irradiation laser. Les auteurs sont d’accord avec la conclusion selon laquelle les niveaux de dommages de surface et de temps dans les lasers à diode18 et Er,Cr :YSGG 21,48 sont corrélés avec l’augmentation de la puissance. D’autres recherches devraient permettre d’examiner si ces modifications ont des implications thérapeutiques.
La rugosité de surface des implants dentaires, également connue sous le nom de microtopographie, est un facteur crucial influençant l’ostéointégration. Dans une étude récente, les surfaces en titane ont été traitées avec quatre protocoles différents. La surface en titane et les cellules souches mésenchymateuses ont été préservées sur la surface traitée au laser et les résultats d’adhésion des cellules souches étaient meilleurs que ceux d’autres techniques (brosse Ti-Ni, flux d’air et fraise dentaire)49. Toutes les valeurs Ra du cylindre de Ti examiné ont été réduites pendant l’irradiation laser ; Cependant, aucune différence statistiquement significative n’a été observée avant et après l’irradiation. L’irradiation laser à diode réduisait la rugosité de surface en faisant fondre la surface Ti lorsque des niveaux de puissance plus élevés étaient utilisés. Ces résultats sont cohérents avec une étude antérieure de Stübinger et al.50, dans laquelle un laser à diode de 810 nm a été utilisé pour décontaminer la surface de l’implant et n’a montré aucun effet significatif sur la surface, tout en étant contradictoire avec les résultats de l’étude menée par Kim et al.51 et Rezeka et al.17, en utilisant une longueur d’onde de 940 nm lorsqu’elle était traitée avec des puissances de 2 et 3 W et en observant une rugosité de surface accrue avec l’application du laser.
Cette étude est limitée par le manque de tests cellulaires et microbiologiques. L’étude actuelle vise à évaluer les changements topographiques du cylindre Ti après l’irradiation par diode et laser Er,Cr :YSGG ; Néanmoins, les implications biologiques des différents traitements nécessitent des investigations in vitro et in vivo plus approfondies. Une autre limite est que l’analyse statistique de la rugosité de surface effectuée dans cette étude ne porte que sur des données de profilomètre. L’approche AFM s’est avérée efficace pour évaluer l’efficacité de deux types de lasers fréquemment utilisés en dentisterie.
Conclusions
Dans notre enquête, aucune des augmentations de température n’a dépassé le seuil physiologique de 10 °C. Par conséquent, les différences de température statistiquement significatives ont été considérées comme cliniquement non pertinentes. Le type et la puissance du laser n’ont pas affecté de manière significative l’AR ; par conséquent, l’irradiation d’un laser à diode de 0,8, 1,3 et 1,8 W et d’un laser Er,Cr :YSGG de 1,5 W, 2,5 W et 3,5 W pendant 20 s et 40 s peut nettoyer la surface Ti sans l’endommager. Néanmoins, ces résultats ont été menés in vitro, et des essais cliniques seront nécessaires pour vérifier les résultats de cette étude. La présente étude a examiné diverses techniques simulant un scénario clinique de débridement implantaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les cylindres en titane utilisés dans l’étude ont été produits par Naxis Implant.
matériels
| Name | Company | Catalog Number | Comments |
| Atomic Force Microscopy | ezAFM | Compact AFM Model | |
| Diode | Biolase | Epic 10, 940 nm Wavelength | |
| E3 Tip | Fiber Diameter: 300 µm, Fiber Length: 9 mm | ||
| Er,Cr:YSGG Laser | Iplus | 2780 nm Wavelength | |
| Profilometer | Mitutoyo | Surftest SJ-201 Model | |
| RFPT-14 Tip | Outer Tip Diameter: 580 µm, Tip Length: 14 mm | ||
| Scanning Electron Microscope | FEI | Quanta FEG 250 Model | |
| Stand | Custom Design | Rhinoceros application, Flamix PLA filament, Bambulab X1C Device | |
| Thermometer | Keithley | 2000 Series Model, K tip termokulp | |
| Titanium Cylinder | Naxis | 10 mm height, 5 mm diameter, SLA Surface, Titanium |
Références
- Guillaume, B. Dental implants: A review. Morphologie. 100 (331), 189-198 (2016).
- Henry, P. J. Tooth loss and implant replacement. Aust Dent J. 45 (3), 150-172 (2000).
- Berglundh, T., Armitage, G., Araujo, M. G., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 89 (1), S313-S318 (2018).
- Herrera, D., Berglundh, T., Schwarz, F., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Guarnieri, R., Reda, R., Di Nardo, D., Pagnoni, F., Zanza, A., Testarelli, L. Prevalence of Peri-Implant Mucositis, Peri-Implantitis and Associated Risk Indicators of Implants with and without Laser-Microgrooved Collar Surface: A Long-Term (≥20 Years) Retrospective Study. J Pers Med. 14 (4), (2024).
- Figuero, E., Graziani, F., Sanz, I., Herrera, D., Sanz, M. Management of peri‐implant mucositis and peri‐implantitis. Periodontology 2000. 66 (1), 255-273 (2014).
- Tomasi, C., Wennström, J. L. Full-mouth treatment vs. the conventional staged approach for periodontal infection control. Periodontology 2000. 51 (1), 45-62 (2009).
- Baima, G., Citterio, F., Romandini, M., et al. Surface decontamination protocols for surgical treatment of peri‐implantitis: A systematic review with meta‐analysis. Clin Oral Implants Res. 33 (11), 1069-1086 (2022).
- Subramani, K., Wismeijer, D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. , Accessed August 4, 2024 (2012).
- Świder, K., Dominiak, M., Grzech-Leśniak, K., Matys, J. Effect of different laser wavelengths on periodontopathogens in peri-implantitis: A review of in vivo studies. Microorganisms. 7 (7), 189(2019).
- Mizutani, K., Aoki, A., Coluzzi, D., Yukna, R., Wang, C. Y., Pavlic, V., Izumi, Y. Lasers in minimally invasive periodontal and peri‐implant therapy. Periodontology 2000. 71 (1), 185-212 (2016).
- Eriksson, R. A., Albrektsson, T. The effect of heat on bone regeneration: An experimental study in the rabbit using the bone growth chamber. J Oral Maxillofac Surg. 42 (11), 705-711 (1984).
- Geminiani, A., Caton, J. G., Romanos, G. E. Temperature change during non-contact diode laser irradiation of implant surfaces. Lasers Med Sci. 27 (2), 339-342 (2012).
- Alpaslan Yayli, N. Z., Talmac, A. C., Keskin Tunc, S., Akbal, D., Altindal, D., Ertugrul, A. S. Erbium, chromium-doped: yttrium, scandium, gallium, garnet and diode lasers in the treatment of peri‐implantitis: Clinical and biochemical outcomes in a randomized-controlled clinical trial. Lasers Med Sci. 37 (1), 665-674 (2022).
- Peters, N., Tawse-Smith, A., Leichter, J., Tompkins, G. Laser therapy: The future of peri-implantitis management. J Periodontol. 22 (1), 1(2012).
- Alhaidary, D., Franzen, R., Hilgers, R. D., Gutknecht, N. First investigation of dual-wavelength lasers (2780 nm Er,Cr:YSGG and 940 nm diode) on implants in a simulating peri-implantitis situation regarding temperature changes in an in vitro pocket model. Photobiomodul Photomed Laser Surg. 37 (8), 508-514 (2019).
- Rezeka, M. A., Metwally, N. A., Abd El Rehim, S. S., Khamis, M. M. Evaluation of the effect of diode laser application on the hydrophilicity, surface topography, and chemical composition of titanium dental implant surface. J Prosthodont. 2024, 1-8 (2025).
- Khalil, M. I., Sakr, H. Implant surface topography following different laser treatments: An in vitro study. Cureus. 15 (5), e38731(2023).
- Tosun, E., Tasar, F., Strauss, R., Kivanc, D. G., Ungor, C. Comparative evaluation of antimicrobial effects of Er:YAG, diode, and CO2 on titanium discs: An experimental study. J Oral Maxillofac Surg. 70 (5), 1064-1069 (2012).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Park, J., Heo, S., Koak, J., Kim, S. K., Han, C. H., Lee, J. H. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 27 (6), Accessed September 22, 2024 1215-1221 (2012).
- Aoki, A., Mizutani, K., Schwarz, F., et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 68 (1), 217-269 (2015).
- Roncati, M., Lucchese, A., Carinci, F. Non-surgical treatment of peri-implantitis with the adjunctive use of an 810-nm diode laser. J Indian Soc Periodontol. 17 (6), 812-817 (2013).
- Romanos, G. E., Gutknecht, N., Dieter, S., Schwarz, F., Crespi, R., Sculean, A. Laser wavelengths and oral implantology. Lasers Med Sci. 24 (6), 961-970 (2009).
- Hauser-Gerspach, I., Stübinger, S., Meyer, J. Bactericidal effects of different laser systems on bacteria adhered to dental implant surfaces: An in vitro study comparing zirconia with titanium. Clin Oral Implants Res. 21 (3), 277-283 (2010).
- Hafeez, M., Calce, L., Hong, H., Hou, W., Romanos, G. E. Thermal effects of diode laser-irradiation on titanium implants in different room temperatures in vitro. Photobiomodul Photomed Laser Surg. 40 (8), 554-558 (2022).
- Koopaie, M., Kia Darbandsari, A., Hakimiha, N., Kolahdooz, S. Er,Cr:YSGG laser surface treatment of gamma titanium aluminide: Scanning electron microscopy-energy-dispersive X-ray spectrometer analysis, wettability and Eikenella corrodens and Aggregatibacter actinomycetemcomitans bacteria count - in vitro study. Proc Inst Mech Eng H. 234 (8), 769-783 (2020).
- Kayar, N. A., Hatipoǧlu, M. Could we set a convenient irradiation time to reduce the possibility of thermal pulp damage during diode laser as an adjunct to periodontal treatment? An in vitro analysis. Photobiomodul Photomed Laser Surg. 39 (7), 480-485 (2021).
- Barrak, H., Mahdi, S. S., Alkurtas, S. A., Size, P. Clinical applications of a 940 nm diode laser for laser troughing versus conventional method: A preliminary study. Iraqi J Laser. 23 (2), (2024).
- Beer, F., Körpert, W., Passow, H., et al. Reduction of collateral thermal impact of diode laser irradiation on soft tissue due to modified application parameters. Lasers Med Sci. 27 (5), 917-921 (2012).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an erbium, chromium-doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Al-Omari, W. M., Palamara, J. E. The effect of Nd:YAG and Er,Cr:YSGG lasers on the microhardness of human dentin. Lasers Med Sci. 28 (1), 151-156 (2013).
- Kreisler, M., Götz, H., Duschner, H., d’Hoedt, B. Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAlAs laser irradiation on surface properties of endosseous dental implants. Int J Oral Maxillofac Implants. 17 (5), 202-209 (2002).
- Kottmann, L., Franzen, R., Conrads, G., Wolfart, S., Marotti, J. Effect of Er,Cr:YSGG laser with a side-firing tip on decontamination of titanium disc surface: An in vitro and in vivo study. Int J Implant Dent. 9 (1), 7(2023).
- Yao, W. L., Lin, J. C. Y., Salamanca, E., et al. Er,Cr:YSGG laser performance improves biological response on titanium surfaces. Materials. 13 (3), 756(2020).
- Smeo, K., Nasher, R., Gutknecht, N. Antibacterial effect of Er,Cr:YSGG laser in the treatment of peri-implantitis and their effect on implant surfaces: A literature review. Lasers Dent Sci. 2 (2), 63-71 (2018).
- Fletcher, P., Linden, E., Cobb, C., Zhao, D., Rubin, J., Planzos, P. Efficacy of removal of residual dental cement by laser, ultrasonic scalers, and titanium curette: An in vitro study. Compend Contin Educ Dent. , (2025).
- Lollobrigida, M., Fortunato, L., Serafini, G., et al. The prevention of implant surface alterations in the treatment of peri-implantitis: Comparison of three different mechanical and physical treatments. Int J Environ Res Public Health. 17 (8), 2624(2020).
- Arora, S., Lamba, A. K., Faraz, F., Tandon, S., Ahad, A. Evaluation of the effects of Er,Cr:YSGG laser, ultrasonic scaler and curette on root surface profile using surface analyser and scanning electron microscope: An in vitro study. J Lasers Med Sci. 7 (4), 243-249 (2016).
- Jin, S. H., Lee, E. M., Park, J. B., Kim, K. K., Ko, Y. Decontamination methods to restore the biocompatibility of contaminated titanium surfaces. J Periodontal Implant Sci. 49 (3), 193-204 (2019).
- Kayar, N. A., Hatipoǧlu, M. Can we determine an appropriate timing to avoid thermal pulp hazard during gingivectomy procedure? An in vitro study with diode laser. Photobiomodul Photomed Laser Surg. 39 (2), 94-99 (2021).
- Monzavi, A., Fekrazad, R., Chinipardaz, Z., Shahabi, S., Behruzi, R., Chiniforush, N. Effect of various laser wavelengths on temperature changes during peri-implantitis treatment: An in vitro study. Implant Dent. 27 (3), 311-316 (2018).
- Valente, N. A., Calascibetta, A., Patianna, G., Mang, T., Hatton, M., Andreana, S. Thermodynamic effects of 3 different diode lasers on an implant-bone interface: An ex-vivo study with review of the literature. J Oral Implantol. 43 (2), 94-99 (2017).
- Leja, C., Geminiani, A., Caton, J., Romanos, G. E. Thermodynamic effects of laser irradiation of implants placed in bone: An in vitro study. Lasers Med Sci. 28 (6), 1435-1440 (2013).
- Strever, J. M., Lee, J., Ealick, W., et al. Erbium, chromium:yttrium-scandium-gallium-garnet laser effectively ablates single-species biofilms on titanium disks without detectable surface damage. J Periodontol. 88 (5), 484-492 (2017).
- Bourauel, C., Fries, T., Drescher, D., Plietsch, R. Surface roughness of orthodontic wires via atomic force microscope, laser specular reflectance, and profilometry. Eur J Orthod. 20 (1), Accessed February 13, 2025 79-92 (1998).
- Choi, S., Kim, J. H., Kim, N. J., et al. Morphological investigation of various orthodontic lingual bracket slots using scanning electron microscopy and atomic force microscopy. Microsc Res Tech. 79 (12), 1193-1199 (2016).
- Huang, H. H., Chuang, Y. C., Chen, Z. H., Lee, T. L., Chen, C. C. Improving the initial biocompatibility of a titanium surface using an Er,Cr:YSGG laser-powered hydrokinetic system. Dent Mater. 23 (4), 410-414 (2007).
- Furtsev, T. V., Koshmanova, A. A., Zeer, G. M., et al. Laser cleaning improves stem cell adhesion on the dental implant surface during peri-implantitis treatment. Dent J. 11 (2), 30(2023).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Kim, H. K., Park, S. Y., Son, K., et al. Alterations in surface roughness and chemical characteristics of sandblasted and acid-etched titanium implants after irradiation with different diode lasers. Appl Sci. 10 (12), 4167(2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon