Method Article
実験室のげっ歯類を自宅のケージに定期的に給餌するための日曜大工システム
* これらの著者は同等に貢献しました
要約
この論文では、自動給餌システムの設計、組み立て、およびプロトコルと、テザー光遺伝学的またはファイバー測光実験のための最小限の変更で標準的なげっ歯類ケージに実装できる代替の蓋とケージの変更について詳しく説明します。給餌システムは、時限給餌および/またはカロリー制限のための費用対効果の高いツールを提供します。
要約
断続的な断食と、時限カロリー制限が体重調節と老化の結果に与える影響を取り巻く研究は、社会と研究室の両方でトレンドになっています。実験室で時間制限のある摂食および/またはカロリー制限を研究するために、割り当てられた量の食物がスケジュールされた時間間隔で分散されます。げっ歯類の定期的な給餌のための現在の技術には、ゲート付きの食品入口ポートを備えた特殊なケージ、時間ロックされたデジタルホッパー、または手動の食品配送が含まれます。このような実験のための特殊な機器は高価になる可能性があり、手動給餌では、研究者が深夜/早朝の時点で来店する必要があることが多く、長時間の研究が妨げられます。ここで説明する自動給餌システムは、最小限の変更で標準的なげっ歯類のケージに実装できる、時限給餌および/またはカロリー制限のための費用対効果の高いツールを提供します。このプロトコルは、標準的なマイクロアイソレータケージの蓋(マウス、ハムスター、ラット、またはモルモットのケージの蓋)に装備された既製のオートフィーダーを使用し、動物のホームケージでプログラムされた時間間隔で所望の食物割り当てを投与することができます。当社の設計は、さまざまなフィーダーやケージの寸法のわずかな変化を受け入れるように変更できます。当社は、フィーディングシステムの設計、組み立て、およびプロトコルを提供するとともに、テザー光遺伝学またはファイバーフォトメトリー実験のための代替の蓋とケージの修正を提供します。
概要
断続的断食は、代謝と老化の研究の重要な分野です。摂食と概日リズムの適切な調整は、体重に対する食事の影響を変えることができます1,2,3,4。さらに、長期にわたる断続的断食は、寿命の延長と加齢性疾患の改善と関連しています5,6,7,8。長期の断食プロトコル(>20日)を実施する調査研究には、通常、専用の機器が必要です。スケジュールされた給餌プロトコルのために手動で食品を配達することは可能ですが、これには調査員が長時間にわたって多数の時間外時点に立ち会う必要がある場合があります。たとえば、4時間間隔の3つの給餌時間では、午後8時、午前12時、午前4時に手動で配達する必要があります。コンプライアンスの課題は、数日以上続く可能性があります。
実験室のげっ歯類に対する手動の食物供給に代わるものは、1)食物への自動ゲートアクセスを備えた特殊なケージ、または2)FED39などの食物への自動およびプログラムされたアクセスを提供するデジタルホッパーシステムです。ゲート付き食品アクセスを備えたケージシステムは高価であり、中には長期的な研究に適した家庭用ケージ環境を提供しないものもあります。たとえば、従来のオペラントコンディショニングボックスは、自動食品配送が可能ですが、床がワイヤー格子になっているため、長期滞在には適していません。Research DietsのBioDAQシステムは、ゲート付きの外部ポートを介して食料と水を提供します。プログラム可能な自動ゲートにより、長期的なスケジュールされた給餌または飲用研究が可能になりますが、システムは高価な投資です。機械化されたホッパーシステムは、自動化されたスケジュールされた供給プロトコル9,10のためのさらに別のツールです。引用された2つの機械化されたホッパーには、ホームケージの生活空間を減らすという注意点があります。食物制限のある空腹の動物は、給餌装置を噛んだり、ケージの破片がホッパーのメカニズムに干渉したりして、長期的な研究を行う可能性があります。最後に、高橋の研究グループがPhenome Technologyと共同で開発した機械化ホッパーは、長期の定期給餌研究用に特別に設計されました3。このシステムでは、機械化されたホッパーが標準的なケージのワイヤーラックの上に配置され、シュートで食品を配送します。しかし、Phenomeシステムは、パッチケーブルにつながれた動物(光遺伝学/ファイバー測光実験)に柔軟性を提供せず、ここで説明するオートフィーダー装置と比較して比較的高価です。
スケジュールされた給餌プロトコルの一般的な課題に対応して、費用対効果の高い治療法を提案します。当社の自動化システムは、所定の間隔で正確な食品の配達を容易にします。3Dプリントされた部品と市販の自動魚の餌箱の組み合わせにより、マイクロアイソレータトップを使用するスタンドアロンのげっ歯類ケージに装備できる日曜大工(DIY)の外部給餌システムを考案しています。ここで説明する給餌システムと部品は、マウス、ラット、ハムスター、またはモルモットのいずれかのげっ歯類ケージに直接適用できます。ただし、スタンドアロンケージがマイクロアイソレータトップを使用している場合に限ります。ケージのサイズが異なるため、配置は若干異なる場合がありますが、3Dプリントされたブラケット、給餌システム、および外部ウォーターボトルのデザインは、マイクロアイソレーターの蓋を備えたスタンドアロンのげっ歯類ケージ全体に適用できます。
ここでは、オートフィーダーの一例を紹介しますが、他にも多くの既製のオートフィーダーが利用可能で、3Dプリント部品を少し変更するだけでモジュラーシステムに取り付けることができます。3Dプリントされたホルダーを代替フィーダーやケージ寸法のわずかな変動に簡単に調整できるように、コンパニオンSTLファイルを使用して変更可能な3次元SolidWorksファイルを証明します。
オートフィーダーの外部配置は、ホームケージ内に完全なスペースを提供し、動物を中断することなくフィーダーの取り外し、滅菌、再装填または交換を可能にします。自動給餌システムは、長期記録に効率的で、手頃な価格で、さまざまな時間制限のある給餌および/またはカロリー制限プロトコルに適しています。ケージアセンブリの詳細な技術図面、設計、および供給システムを実装するためのプロトコル、およびサンプルデータを提供します。次に、光遺伝学的またはファイバー測光実験用のパッチケーブルにつながれた動物でオートフィーダーを使用するための標準ケージを変更するための一連の指示を提供します。
プロトコル
すべての手順は、マサチューセッツ大学アマースト校の施設の動物管理および使用委員会によって承認されました。
1. 標準的なマイクロアイソレータケージの蓋へのオートフィーダーの組み立て(図1)
- 1.5インチのカッティングホイール付きの回転工具を使用して、20 x 25 mmの正方形を切り取り、マイクロアイソレータケージの蓋に入れます。開口部を蓋の端から2.75 cm、ワイヤーラックの中央に配置します(図1B、左)。
- オートフィーダーをケージの蓋に結合するためのブラケットを3Dプリントします(図1A および 補足ファイル1)。ブラケットをケージの蓋の穴にはめ込みます(ステップ1.1; 図1B、中央)をクリックし、オートフィーダーを固定ブラケットの上部にスライドさせます(図1B [右] 、C)。

図1:オートフィーダーブラケットとケージリッドの改造と組み立て (A)オートフィーダーブラケットの技術図面(3Dスケールについては 、補足ファイル1 のSolidWorks/STLファイルを参照)。(B)左から右へ、20 x 25 mmの穴のあるケージトップ。ケージ上部に取り付けられ、Petbankオートフィーダーに取り付けられたブラケット。(C)ケージに組み立てられたPetbankオートフィーダーで、フードペレットをウォーターボトル付きの標準ワイヤーラックに落とします。スケールバー= 25 cm)。 この図の拡大版を表示するには、ここをクリックしてください。
2. サンプルの既製オートフィーダーのプログラミングと使用方法
- 時間制限のある実験では、最初に給餌時間を設定し、その後の調整によってクロック時間がシフトするため、同期フィーダークロックを最後に設定します。
- フィーダーが十分に充電されていることを確認してください。画面の時間設定が点滅するまで 、設定 ボタンを押し続けます。
- 時間設定に進みます。上矢印と下矢印を使用して、最初にスケジュールされた給餌時間に時間を調整します。
- この時点の割り当て数を設定します(フィード設定の横にあるドットの数で示されます)。手順 2.2 から 2.4 を繰り返して、さらに 2 つの時点まで繰り返します。
- オートフィーダーチャンバーに、≤1.5gの標準的なげっ歯類のチャウの所望の食物割り当てをロードします。より多くの食品が必要な場合は、特定の時点で複数の割り当てを配送するようにフィーダーを設定します。この例のフィーダーには 16 個のチャンバーがあります。
注:食品はサイズに合わせて注文するか、はさみでトリミングすることができます。 - 1つのチャンバーにテープまたは塗料でラベルを貼り、プログラムされたチャンバーの回転と食品の配送を確認します。フィーダーを運転しながら毎日確認してください。
3.オートフィーダーを備えたつながれた動物用の改良型ケージシステム
- パッチコードにつながれた動物用のオプションの交換用蓋インサート(図2)
- 厚さ3 mmの透明なアクリルを 図2A の仕様に合わせてレーザーカットします( 補足ファイル2も参照してください)。アクリルインサートは、ケージの上部にはめ込むためのタブが付いています。中央のスリット(190×5mm)はパッチケーブルを通すことができます。20 x 25 mmの正方形の穴は、オートフィーダーブラケットに適合します。20個の通気孔により、新鮮な空気の循環が可能です。
- マイナスドライバーまたはウェッジツールを使用して、標準のマイクロアイソレーター蓋の穴あきケージトップカバーをこじ開けます。タブをタブスロットから外し、穴あきインサートと濾紙の両方を取り外します(図2C、左と中央)。
- 穴あきトップと濾紙の下には、内部のリブ付きサポートグリッドがあります。回転工具と1.5インチのカッティングホイールを使用して、サポートグリッドを取り外します。 図2Cの中央に示されている矢印インジケーターに従います。サポートグリッドを取り外すためにカットした後、カットエッジを滑らかにするためにヤスリで削ります。
- 交換用のアクリルプレートインサート(手順3.1)をケージトップにはめ込みます。プレートタブを短辺のいずれかに沿ってタブスロットにスライドさせ、次に長辺の1つに沿ってスライドさせて取り付けを開始し、プレートが所定の位置にカチッと収まるまで静かに押します(図2C [右]、D)。
- パッチコードにつながれた動物用のオプションの外部ウォーターボトルブラケット(図3)
- ウォーターボトルシッパー用のポートをドリルで開けます:ケージの短辺を中心に、床から50 mmの直径11 mmの穴(図3B および 補足ファイル3)。
- 中央の穴(± 27.5 mm)の両側に、直径6mmの穴を2つ開けます。必要に応じて、8 mm角のパンチツールを使用して四角い穴を開けます( 図3Bを参照)。
- 外部ウォーターボトルブラケットを3Dプリントします(図3A および 補足ファイル4)。ウォーターボトルブラケットをキャリッジボルト(長さ2 cm、6 x 1 mm、または長さ0.75インチ1/4 x 20)でケージの底に取り付けます。 図2B、C)。
- ウォーターボトルの場合は、標準の50 mLコニカルチューブを取り付け、シッパー/ストッパーアセンブリ(#7ストッパーW / 3-1 / 2 "湾曲したシッパー、 材料の表を参照)でキャップを外部ブラケットに取り付けます。2〜3日ごとに水を補充してください。

図2:ケージトップへのアクリル板の組み立て。 (A,B)アクリル板とフィーダーポートプラグの技術図面。(C)左、穴あきインサートとフィルター付きの標準ケージトップ。中央、穴あきインサートとフィルターの取り外し(リブ付きグリッドは矢印で示された線に沿って切り抜く必要があります)。右、アクリル板が所定の位置にスナップ。(D)蓋の組み立てが完了します。スケールバー= 25 cm. この図の拡大版を表示するには、ここをクリックしてください。
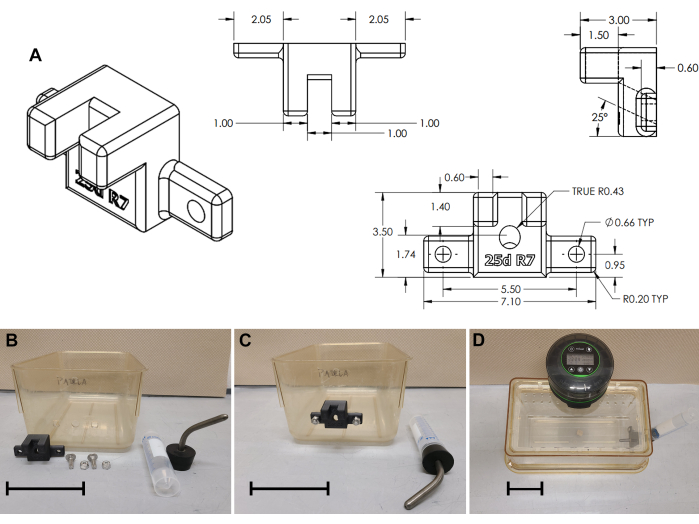
図3:ウォーターボトルブラケットアセンブリ (A)3Dプリントされたウォーターボトルブラケットの技術図面。(B)ケージの変更とウォーターボトルブラケットの組み立て。(C)ブラケットが取り付けられています。(D)ケージの組み立てが完了します。スケールバー= 10 cm。 この図の拡大版を表示するには、ここをクリックしてください。

図4:オートフィーダーによるケージ組立の概要(A)ワイヤーラック付き標準ケージ、(B)連結動物用の改造ケージ。この図の拡大版を表示するには、ここをクリックしてください。
結果
雌マウスに不妊を誘発するためのカロリー制限研究(21日間)(オートフィーダーとケージの設計、 図4A)
慢性的なエネルギー欠乏は、哺乳類の生殖能力を阻害するのに十分であり、この反応はげっ歯類と人間の両方で保存されています11,12。この研究では、カロリー制限を使用して長期的な体重減少を誘発します。成体の雌C57BL/6マウス、生後15-18週齢をシングルハウスで12:12の明暗サイクルで、Zeitgeber Time 12(ZT12)に消灯した。餌を入れたワイヤーラックを1週間の間隔で各動物について毎日体重を量り、ベースラインの食物摂取量である3.80±0.64g/日(平均±SE)を確立しました。次に、体重減少を誘発するために食事を制限しました。食物は3つの部分に配給され、オートフィーダーによってZT 12、16、および20の3つの間隔で分配されました(ケージ構成、図4A)。最初の48時間、動物はベースラインの食物摂取量の50%に制限されました。その後、動物は次の19日間でベースライン食物の~70%に制限され、制限の後半でわずかに調整されてベースライン体重の80〜90%を維持しました(図5A、下)。
ZT 0 と ZT 1 の間で、0.1 M リン酸緩衝生理食塩水を含む膣洗浄によって収集された細胞の組織学的特性評価により、動物を体重測定し、排卵周期を病期分類するために評価しました。サイクルの長さは、80〜90%の体重減少前と減少中に少なくとも11日間監視されました。10%を超える持続的な体重減少は、雌マウスの不妊症を誘発するのに十分であった、と過去に発表された11。
オートフィーダーは、適切なローテーションと食物の配達について毎日調査されました(プロトコルステップ3.1)。地面に残った食品やワイヤーラックに残った食品は廃棄されました。ここで紹介するフィーダーの例には 16 のチャンバーがあり、3 つの間隔で食品を配送するように設定できます ( 材料の表を参照)。チャンバーに収まるチャウの最大容量は2gであり、サイズに合わせてカットまたは注文できると判断しました。また、プログラムされた時間に達すると、フードデリバリーには~10秒かかることもわかりました。フロアゲートが完全に開くのに7秒かかり、次にチャンバーが開口部を越えて移動して食品ペレットが分配されるまでにさらに3秒かかります。ゲートが開き、食品のペレットが空のワイヤーラックに落ちる音(ビデオ1、音声録音付き)と一致するノイズがあります。
21日間にわたって、Petbankのこの特定のフィーダーを使用した回転と食品の配送の完全な精度を観察しました(材料の表)。テスト時点では、フィーダーは最初の使用から3〜6か月であり、内部の充電式バッテリーは21日間の試用期間中、フル充電の適応を維持していました。これはフィーダーのサンプルが比較的少なかったため(n = 4)、その後、10個のオートフィーダーを使用して別の21日間の研究を実施し、同じ速度で食品を分配するように設定しました。その後の研究は、フィーダーの最初の使用から10か月後に実施されました。21日間の試験では、1つのフィーダーが15日目に1バールの電力を失い(~25%の電力損失)、もう1つのフィーダーが17日目に1バーを失いましたが、残りの8つのフィーダーは21日間全体でフル充電の兆候を示しました。例のフィーダーの電力レベルは、4本のバーで示されます。この定量化では、各バーが 25% の検出力を表すと仮定しています。最初のテストと同様に、その後の研究のフィーダーは、研究期間中、エラーなく回転と食物の配達を再度実行しました。

図5:オートフィーダーを使用したカロリー制限中の雌マウスの発情サイクリングデータを重ね合わせた体重の軌跡(A)オートフィーダーを使用した平均体重減少の軌跡(下)は、3つの時点(消灯時から4時間間隔)でベースラインの食物摂取量の50〜70%を配信します。体重減少に合わせた代表的な発情周期のデータ(上)。灰色のハイライトは、開始体重の10%を超える体重減少を示します。矢印は、ワイヤーラックにフードを充填し、オートフィーダーを取り外すことにより、アドリバリットフードアクセスに戻ることを示しています。(B)減量中の発情サイクリング。動物が1%から10%の間にある場合のDiestrusの%時間の比較(オープンバー)の体重減少と>10%の体重減少(灰色のバー;注:Diestrusでの逮捕は不妊症の兆候です)N = 4。(C)減量とサイクリングのウォーターフォールプロット。最大8%の体重減少では、動物の100%が繁殖力があり、サイクリングをしていましたが、20%の体重減少では、動物の100%が非循環的で不妊でした。略語:P =発情前。E =発情;D = diestrus.エラーバーは平均の標準誤差を表します この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:ゲートが開き、食品のペレットが空のワイヤーラックに落ちることを示すノイズ。このビデオをダウンロードするには、ここをクリックしてください。
補足ファイル 1: オートフィーダー ブラケットの技術図面と SolidWorks + STL ファイルを含む ZIP ファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:アクリル板の製図。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:技術図面とポートプラグのSolidWorks+STLファイルを含むZipファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:技術図面、ウォーターボトルブラケットとボトルホルダーのSolidWorks + STLファイルを含むZipファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
前臨床動物モデルでは、カロリー制限は代謝を正確に操作し研究するための強力な実験ツールです。持続的な体重減少は、肥満、糖尿病、老化、生殖能力、更年期障害(生殖老化の一種)に影響を及ぼし、これらはすべて重要な翻訳エンドポイントです。しかし、カロリー制限のパラダイムは、長期間維持するのが難しい場合があります。この原稿では、実験室の設定で長期的なカロリー制限を達成するための費用対効果の高いソリューションを提供します。既製の自動フィーダーを標準的なマイクロアイソレーターの蓋を備えたげっ歯類のケージに結合する手順が提供されています。フィーダーは動物のホームケージに組み立てられ、スケジュールされた時間に餌を届けるようにプログラムされています。スケジュールされたフードデリバリーは、フードアクセスの量とタイミングを制御し、ハンドラーが部屋に入ることはありません。さらに、費用対効果の高いシステムは長期間(数ヶ月)稼働できるため、実験室での長期的なカロリー制限を達成する能力が向上します。
近年の神経科学の進歩により、研究者は、覚醒して行動する動物に摂食を促進するニューロンを操作したり、ニューロンから記録したりすることができるようになった。具体的には、神経活動を促進するために絶食を繰り返し、その後、神経活動の変化を調べるために、ニューロンを摂食する繊維測光記録(in vivo記録技術)が行われてきた13,14,15。動物のホームケージ16で生体内記録を行うことが最善であるが、パッチケーブルにつながれた状態で移動性を提供するために、しばしば外部のアリーナで行われる。さらに、in vivo 記録は、ゲート付きの食品アクセス手段を持たないハンドラーが部屋に入ることによって影響を受ける可能性があります。摂食回路におけるニューロンの測光記録に関する両方の交絡問題に対処するために、オートフィーダーに結合されたテザー動物を長期間収容するホームケージの改造を設計しました(プロトコルセクション3および4)。このアプローチの限界は、ケージの蓋インサートの設計にレーザーカッターが必要であることです。アクリルインサートをカットするために回転工具とスコアリング装置を使用することはできますが、ツールは小さなタブと薄いスリットを生成するのに失敗する可能性があります。
ここで説明する給餌システムには制限があります。つまり、アセンブリには3Dプリントされた部品が必要です。さらに、例示のオートフィーダのクロックは24時間周期で作動するので、概日研究のための食物供給のタイミングは、動物のフリーランニング期間17に手動で合わせなければならない。最後に、デバイスは16のチャンバーと3つのプログラムされた時間間隔に制限されています。フィーダーは食物を分配します。消費量は監視しません。決められた時間内に消費されなかった食品は、ケージの床やワイヤーラックから取り出すことができますが、食べ残しの食品の会計処理や回収に誤りがある場合があります。
標準的なげっ歯類のケージに装備された市販のオートフィーダーの利点を強調するために、デバイスがユーザーフレンドリーで、特定の時間間隔で正確な食物の割り当てを提供することを示します。このシステムは、ホームケージエリアを遮りません。フィーダーは動物のケージの外側に配置され、3Dプリントされたホルダーから簡単に取り外すことができるため、定期的なメンテナンス、フードの補充、清掃を動物への妨害を最小限に抑えて行うことができます。
例として、オートフィーダーを使用してカロリー制限を誘発し、最終的には不妊症を引き起こしました。21日間のカロリー制限研究(図5)でオートフィーダーの使用を実証し、その後、実験室での数多くの実験にフィーダーを使用しました。結果に書かれている通り、フィーダーは信頼性が高く、正確に食品が届けられました。内蔵の充電式バッテリーは時間の経過とともにやや減少するように見えますが、フィーダーを1年近く使用した後、わずかな電力損失を記録する前に最低15日間動作します。メーカーによると、バッテリーはフル充電から60日間動作できると推定されています。長期間の研究(>30日)では、フィーダーのバッテリー寿命が最大充電量の50%を下回ったときに、完全に充電された交換用フィーダーを回転させることをお勧めします。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
ジェイソン・レは、国立衛生研究所が資金提供するバカロレア後の研究教育プログラムの支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| #7 Stopper W/ 3-1/2" curved sipper tube no ball | Labex | 2067 | |
| AN75 mouse cage bottom | Ancare | AN75HT | |
| Automatic Fish Feeder for Aquarium | Petbank-tek.com | Amazon distribution (#B0BRCWP16K) | |
| Rodent Micro-filter Tops | Ancare | N10MBTPLF | |
| Rubber Stoppers, One Hole | United Scientific | S24009 | |
| standard rodent chow | Prolab IsoPro 3000 |
参考文献
- Arble, D. M., Bass, J., Laposky, A. D., Vitaterna, M. H., Turek, F. W. Circadian timing of food intake contributes to weight gain. Obesity (Silver Spring). 17 (11), 2100-2102 (2009).
- Hatori, M., et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 15 (6), 848-860 (2012).
- Acosta-Rodriguez, V. A., de Groot, M. H. M., Rijo-Ferreira, F., Green, C. B., Takahashi, J. S. Mice under caloric restriction self-impose a temporal restriction of food intake as revealed by an automated feeder system. Cell Metab. 26 (1), 267-277.e2 (2017).
- Gallop, M. R., Tobin, S. Y., Chaix, A. Finding balance: understanding the energetics of time-restricted feeding in mice. Obesity (Silver Spring). 31 (Suppl 1), 22-39 (2023).
- Hua, L., et al. Time-restricted feeding improves the reproductive function of female mice via liver fibroblast growth factor 21. Clin Transl Med. 10 (6), e195(2020).
- Strilbytska, O., Klishch, S., Storey, K. B., Koliada, A., Lushchak, O. Intermittent fasting and longevity: From animal models to implication for humans. Ageing Res Rev. 96, 102274(2024).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Longo, V. D., Panda, S. Fasting, Circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metab. 23 (6), 1048-1059 (2016).
- Matikainen-Ankney, B. A., et al. An open-source device for measuring food intake and operant behavior in rodent home-cages. Elife. 10, e66173(2021).
- Sahasrabudhe, A., Guy, C. R., Greenwell, B. J., Menet, J. S. Manipulation of rhythmic food intake in mice using a custom-made feeding system. J Vis Exp. (190), (2022).
- Kreisman, M. J., Tadrousse, K. S., McCosh, R. B., Breen, K. M. Neuroendocrine basis for disrupted ovarian cyclicity in female mice during chronic undernutrition. Endocrinology. 162 (8), ebqab103(2021).
- Allaway, H. C., Southmayd, E. A., De Souza, M. J. The physiology of functional hypothalamic amenorrhea associated with energy deficiency in exercising women and in women with anorexia nervosa. Horm Mol Biol Clin Investig. 25 (2), 91-119 (2016).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Chen, Y., Lin, Y. C., Kuo, T. W., Knight, Z. A. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell. 160 (5), 829-841 (2015).
- Mandelblat-Cerf, Y., et al. Arcuate hypothalamic AgRP and putative POMC neurons show opposite changes in spiking across multiple timescales. Elife. 4, e07122(2015).
- Kahnau, P., et al. A systematic review of the development and application of home cage monitoring in laboratory mice and rats. BMC Biol. 21 (1), 256(2023).
- Eckel-Mahan, K., Sassone-Corsi, P. Phenotyping circadian rhythms in mice. Curr Protoc Mouse Biol. 5 (3), 271-281 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved