Method Article
Un sistema de bricolaje para la alimentación programada de roedores de laboratorio en su jaula doméstica
* Estos autores han contribuido por igual
En este artículo
Resumen
Este documento detalla el diseño, el ensamblaje y el protocolo para un sistema de alimentación automatizado junto con una modificación alternativa de la tapa y la jaula que se puede implementar en jaulas de roedores estándar con modificaciones mínimas para experimentos de fotometría optogenética o de fibra atada. El sistema de alimentación ofrece una herramienta rentable para la alimentación programada y/o la restricción calórica.
Resumen
El ayuno intermitente y la investigación en torno a la influencia de la restricción calórica programada en la regulación del peso corporal y los resultados del envejecimiento son tendencia, tanto en la sociedad como en el laboratorio. Para estudiar la alimentación restringida en el tiempo y/o la restricción calórica en el laboratorio, las cantidades asignadas de alimento se dispersan a intervalos de tiempo programados. La tecnología actual para la alimentación programada de roedores implica jaulas especializadas con puertos de entrada de alimentos cerrados, tolvas digitales con bloqueo de tiempo o entrega manual de alimentos. El equipo especializado para tales experimentos puede ser costoso y la alimentación manual a menudo requiere que los investigadores acudan a altas horas de la noche o temprano en la mañana, lo que impide estudios prolongados. El sistema de alimentación automatizado descrito aquí proporciona una herramienta rentable para la alimentación programada y/o la restricción calórica que se puede implementar en jaulas estándar para roedores con modificaciones mínimas. El protocolo utiliza un alimentador automático listo para usar que está equipado con una tapa de jaula de microaislador estándar (tapas de jaula de ratón, hámster, rata o conejillo de indias) y puede administrar las asignaciones de alimento deseadas a intervalos de tiempo programados en la jaula de hogar del animal. Nuestro diseño puede ser modificado para aceptar varios comederos o ligeras variaciones en las dimensiones de la jaula. Proporcionamos el diseño, el ensamblaje y el protocolo para el sistema de alimentación junto con una modificación alternativa de la tapa y la jaula para experimentos de fotometría optogenética o de fibra atada.
Introducción
El ayuno intermitente es un área importante de la investigación metabólica y del envejecimiento. La alineación adecuada de la alimentación y el ritmo circadiano puede alterar el efecto de la dieta sobre el peso corporal 1,2,3,4. Además, el ayuno intermitente prolongado se asocia con una mayor longevidad y mejores trastornos relacionados con la edad 5,6,7,8. Los estudios de investigación que implementan protocolos de ayuno a largo plazo (>20 días) generalmente requieren equipo especializado. Si bien es posible entregar alimentos manualmente para los protocolos de alimentación programados, esto puede requerir que un investigador esté presente en numerosos puntos de tiempo fuera del horario laboral durante un período prolongado. Por ejemplo, tres horas de alimentación separadas por 4 horas requerirían una entrega manual a las 8:00 p.m., 12:00 a.m. y 4:00 a.m.; Es probable que se trate de un desafío de cumplimiento que se mantendrá durante más de unos pocos días.
Las alternativas a la entrega manual de alimentos para roedores de laboratorio son 1) jaulas especializadas con acceso automático a los alimentos o 2) sistemas de tolvas digitales que proporcionan acceso automatizado y programado a los alimentos, como FED39. Los sistemas de jaulas con acceso cerrado a los alimentos son costosos y algunos no proporcionan un entorno adecuado para estudios a largo plazo. Por ejemplo, las cajas de acondicionamiento operante tradicionales son capaces de realizar la entrega automatizada de alimentos, pero tienen un piso de rejilla de alambre que no es propicio para el alojamiento a largo plazo. El sistema BioDAQ de Research Diets proporciona alimentos y agua a través de puertos externos cerrados. Las puertas automatizadas programables permiten estudios de alimentación o bebida programados a largo plazo, sin embargo, el sistema es una inversión costosa. Los sistemas de tolva mecanizados son una herramienta más para los protocolos de alimentación programada automatizados 9,10. Las dos tolvas mecanizadas citadas vienen con la advertencia de reducir el espacio habitable de la jaula doméstica. Los animales hambrientos con restricción de alimentos pueden masticar los aparatos de alimentación y/o los desechos de la jaula pueden interferir con la mecánica de la tolva para estudios a largo plazo. Por último, una tolva mecanizada desarrollada por el grupo de investigación Takahashi junto con Phenome Technology fue diseñada específicamente para estudios de alimentación programada a largo plazo3. En este sistema, una tolva mecanizada se coloca sobre el estante de alambre de una jaula estándar con un conducto que entrega alimentos. El sistema Phenom, sin embargo, no proporciona flexibilidad para los animales atados a un cable de conexión (experimentos de optogenética/fotometría de fibra), y es relativamente caro en comparación con el aparato de alimentación automática descrito aquí.
En respuesta a los desafíos prevalecientes en los protocolos de alimentación programada, proponemos un remedio costo-efectivo. Nuestro sistema automatizado facilita la entrega precisa de alimentos a intervalos predeterminados. Con una combinación de piezas impresas en 3D junto con un comedero automático para peces disponible en el mercado, ideamos un sistema de alimentación externo de bricolaje (DIY) que se puede equipar en jaulas de roedores independientes que utilizan tapas de microaisladores. El sistema de alimentación y las piezas descritas aquí se pueden aplicar directamente a cualquiera de las siguientes jaulas de roedores: ratón, rata, hámster o conejillo de indias, siempre que las jaulas independientes utilicen tapas de microaisladores. Debido a que las jaulas varían en tamaño, las ubicaciones pueden variar ligeramente, pero los soportes impresos en 3D, el sistema de alimentación y el diseño de la botella de agua externa son generalmente aplicables en jaulas de roedores independientes con tapas de microaisladores.
Describimos un ejemplo de alimentador automático, pero hay muchos otros alimentadores automáticos disponibles en el mercado y se pueden instalar en el sistema modular con ligeros cambios en las piezas impresas en 3D. Para facilitar el ajuste del soporte impreso en 3D a alimentadores alternativos o ligeras variaciones en las dimensiones de la jaula, probamos un archivo SolidWorks 3dimensional modificable con un archivo STL complementario.
La ubicación externa del comedero automático proporciona espacio completo dentro de la jaula doméstica y permite el desmontaje, la esterilización y la recarga o reemplazo del comedero sin interrumpir al animal. El sistema de alimentación automatizado es eficiente para registros a largo plazo, asequible y susceptible a varios protocolos de alimentación restringida en el tiempo y/o restricción calórica. Proporcionamos dibujos técnicos detallados de los ensamblajes de jaulas, el diseño y el protocolo para implementar el sistema de alimentación, junto con datos de muestra. En segundo lugar, proporcionamos un conjunto de instrucciones para modificar el enjaulamiento estándar para el uso del autoalimentador con animales que están atados a un cable de conexión para experimentos de fotometría optogenética o de fibra.
Protocolo
Todos los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Massachusetts Amherst.
1. Montaje del alimentador automático en una tapa de jaula de microaislador estándar (Figura 1)
- Con una herramienta rotativa con un disco de corte de 1,5", corte un cuadrado de 20 x 25 mm en una tapa de jaula de microaislador. Coloque la abertura a 2,75 cm del borde de la tapa y centrada sobre la rejilla de alambre (Figura 1B, izquierda).
- Imprima en 3D un soporte para acoplar el alimentador automático en la tapa de la jaula (Figura 1A y Archivo Suplementario 1). Encaje el soporte en el orificio de la tapa de la jaula (paso 1.1; Figura 1B, centro) y deslice el alimentador automático en la parte superior del soporte asegurado (Figura 1B [derecha], C).

Figura 1: Modificación y montaje del soporte del alimentador automático y de la tapa de la jaula. (A) Dibujo técnico del soporte del alimentador automático (consulte los archivos SolidWorks/STL en el archivo complementario 1 para la escala en 3D). (B) De izquierda a derecha, jaula superior con orificio de 20 x 25 mm; soporte instalado en la parte superior de la jaula y montado con alimentador automático Petbank. (C) Alimentador automático de banco de mascotas ensamblado en una jaula con pellets de comida colocados en una rejilla de alambre estándar con una botella de agua. Barras de escala = 25 cm). Haga clic aquí para ver una versión más grande de esta figura.
2. Programación y uso del ejemplo de alimentador automático listo para usar
- Para experimentos cronometrados, establezca primero los tiempos de alimentación y al final el reloj del alimentador sincronizado, ya que los ajustes posteriores cambiarán el tiempo del reloj.
- Asegúrese de que el alimentador esté suficientemente cargado. Mantenga presionado el botón Configuración hasta que la configuración de la hora en la pantalla parpadee.
- Continúe con el ajuste de la hora . Con las flechas hacia arriba y hacia abajo, ajuste la hora al primer período de alimentación programado deseado.
- Establezca el número de asignaciones para este punto de tiempo (indicado por el número de puntos junto a la configuración del feed). Repita los pasos 2.2 y 2.4 hasta dos puntos de tiempo más.
- Cargue las cámaras de alimentación automática con las asignaciones de alimento deseadas de ≤1,5 g de comida estándar para roedores. Si se necesita más comida, configure el alimentador para que entregue varias asignaciones en un momento dado. El alimentador de ejemplo tiene 16 cámaras.
NOTA: La comida se puede pedir a medida o recortar con tijeras. - Etiquete una cámara con cinta adhesiva o pintura para confirmar la rotación programada de la cámara y la entrega de alimentos. Revise diariamente mientras hace funcionar los alimentadores.
3. Sistema de jaula modificado para animales atados con el autoalimentador
- Inserto de tapa de repuesto opcional para animales atados a un cable de conexión (Figura 2)
- Corte con láser una pieza de acrílico transparente de 3 mm de espesor según las especificaciones de la Figura 2A (consulte también el Archivo Suplementario 2). El inserto acrílico está diseñado con lengüetas para encajar en la parte superior de la jaula. La ranura central (190 x 5 mm) permite el paso del cable de conexión. El orificio cuadrado de 20 x 25 mm se ajusta al soporte del alimentador automático; 20 orificios de ventilación permiten la circulación de aire fresco.
- Con un destornillador de cabeza plana o una herramienta de cuña, retire la cubierta superior de la jaula perforada de la tapa de un microaislador estándar. Trabaje para liberar las lengüetas de las ranuras de las lengüetas y retire tanto el inserto perforado como el papel de filtro (Figura 2C, izquierda y centro).
- Debajo de la parte superior perforada y el papel de filtro hay una rejilla de soporte acanalada interna. Utilice una herramienta rotativa y un disco de corte de 1,5 pulgadas para quitar la rejilla de soporte; siguiendo los indicadores de flecha que se muestran en el centro de la Figura 2C. Después de cortar para quitar la rejilla de soporte, lime para alisar el borde cortado.
- Encaje el inserto de placa acrílica de repuesto (paso 3.1) en la parte superior de la jaula. Comience la instalación deslizando las lengüetas de la placa en las ranuras de las lengüetas a lo largo de cualquiera de los bordes cortos y luego uno de los bordes largos y presione suavemente hasta que la placa encaje en su lugar (Figura 2C [derecha], D).
- Soporte externo opcional para botella de agua para animales atados a un cable de conexión (Figura 3)
- Taladre un puerto para el sorbedor de la botella de agua: orificio de 11 mm de diámetro, a 50 mm del suelo, centrado en el borde corto de la jaula (Figura 3B y Archivo Suplementario 3).
- A cada lado del orificio central (± 27,5 mm), taladre dos orificios de 6 mm de diámetro. Opcionalmente, utilice una herramienta de perforación cuadrada de 8 mm para perforar agujeros cuadrados (como se muestra en la Figura 3B).
- Imprima en 3D un soporte externo para botella de agua (Figura 3A y Archivo Complementario 4). Monte el soporte de la botella de agua en la parte inferior de la jaula con pernos de carro (2 cm de largo, 6 x 1 mm o 0,75" de largo 1/4 x 20; Figura 2B,C).
- Para una botella de agua, coloque un tubo cónico estándar de 50 mL, tapado con un conjunto de sorbo/tapón (tapón #7 con sorbo curvo de 3-1/2", consulte la Tabla de materiales) en el soporte externo. Rellene el agua cada 2-3 días.

Figura 2: Montaje de la placa acrílica en la parte superior de la jaula. (A,B) Dibujos técnicos de la placa acrílica y el tapón del puerto de alimentación. (C) Izquierda, parte superior de la jaula estándar con inserto perforado y filtro. Centro, extracción del inserto perforado y del filtro (la rejilla acanalada debe cortarse a lo largo de las líneas indicadas con flechas). A la derecha, la placa acrílica encajó en su lugar. (D) Conjunto completo de la tapa. Barras de escala = 25 cm. Haga clic aquí para ver una versión más grande de esta figura.
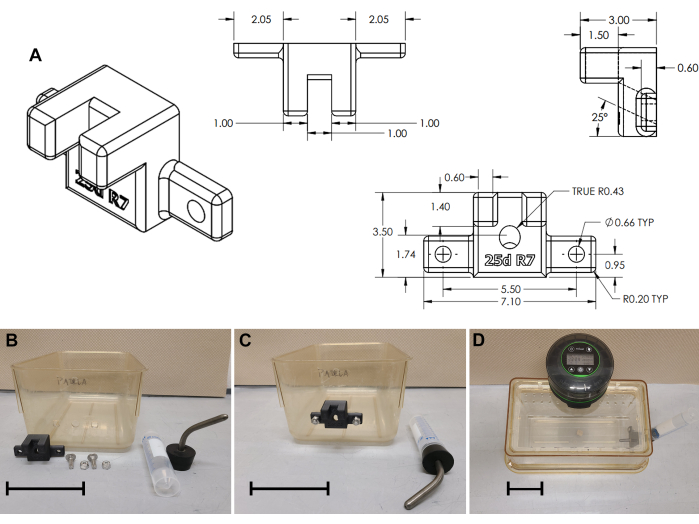
Figura 3: Montaje del soporte de la botella de agua. (A) Dibujo técnico del soporte de la botella de agua impreso en 3D. (B) Modificaciones de la jaula y montaje del soporte de la botella de agua; (C) Soporte instalado; (D) Ensamblaje completo de la jaula. Barras de escala = 10 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resumen del montaje completo de la jaula con el alimentador automático. (A) Jaula estándar con rejilla de alambre, (B) jaula modificada para animales atados. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Un estudio de restricción calórica (21 días) para inducir infertilidad en ratones hembra (diseño de autoalimentador y jaula, Figura 4A)
La deficiencia crónica de energía es suficiente para inhibir la fertilidad en los mamíferos, una respuesta que se conserva tanto en roedores como en humanos 11,12. En este estudio, utilizamos la restricción calórica para inducir la pérdida de peso corporal a largo plazo. Los ratones hembra adulta C57BL/6, de 15 a 18 semanas de edad, fueron alojados en un solo hogar y en un ciclo de luz:oscuridad de 12:12 h, con las luces apagadas en Zeitgeber Time 12 (ZT12). La rejilla de alambre que contenía el alimento se pesó diariamente para cada animal durante un intervalo de una semana para establecer la ingesta basal de alimento, 3,80 ± 0,64 g/día (media ± EE). A continuación, se restringió la comida para inducir la pérdida de peso. La comida se racionó en tres porciones y fue distribuida por el alimentador automático en tres intervalos: ZT 12, 16 y 20 (configuración de jaula, Figura 4A). Durante las 48 h iniciales, los animales se restringieron al 50% de la ingesta inicial de alimentos. Luego, los animales se restringieron a ~ 70% de la comida de referencia durante los siguientes 19 días, con ligeros ajustes en la segunda mitad de la restricción para mantener el 80-90% del peso de referencia (Figura 5A, abajo).
Entre ZT 0 y ZT 1, los animales fueron pesados y evaluados para estadificar el ciclo ovulatorio mediante la caracterización histológica de las células recolectadas por un lavado vaginal con solución salina tamponada con fosfato 0,1 M. La duración del ciclo se controló durante al menos 11 días antes y durante una pérdida de peso del 80-90%. La pérdida de peso sostenida de más del 10% fue suficiente para inducir infertilidad en ratones hembra, según se publicó anteriormente11.
Los alimentadores automáticos fueron inspeccionados diariamente para determinar la correcta rotación y entrega de alimentos (paso 3.1 del protocolo). Cualquier comida que quedara en el suelo o que quedara en la rejilla de alambre se desechó. El alimentador de ejemplo que se describe aquí tiene 16 cámaras y se puede configurar para entregar alimentos en tres intervalos (consulte la Tabla de materiales). Determinamos que el volumen máximo de comida que cabe en una cámara es de 2 g, que se puede cortar o pedir a medida. También determinamos que la entrega de alimentos tarda ~ 10 s una vez que se alcanza la hora programada. La compuerta del suelo tarda 7 s en abrirse por completo y luego otros 3 s para que la cámara se mueva sobre la abertura, dispensando la pelza de comida. Hay ruidos que coinciden con la apertura de la puerta y la bolita de comida cayendo en una rejilla de alambre vacía (Video 1, con grabación de sonido).
En el transcurso de 21 días, observamos una precisión completa de las rotaciones y la entrega de alimentos utilizando este comedero específico de Petbank (Tabla de Materiales). En el momento de la prueba, los alimentadores estaban entre 3 y 6 meses desde su uso inicial y las baterías recargables internas mantuvieron las indicaciones de carga completa durante la totalidad de la prueba de 21 días. Debido a que se trataba de una muestra relativamente pequeña de comederos (n = 4), posteriormente realizamos otro estudio de 21 días con 10 alimentadores automáticos, configurados para distribuir alimentos a un ritmo emparejado. El estudio posterior se realizó 10 meses después del uso inicial de los comederos. Durante la prueba de 21 días, un alimentador perdió una sola barra de potencia (~25% de pérdida de potencia) en el día 15 y otro perdió una sola barra en el día 17, mientras que los 8 alimentadores restantes tuvieron indicaciones de carga completa durante los 21 días completos. El nivel de potencia en el alimentador de ejemplo se indica como cuatro barras. Nuestra cuantificación supone que cada barra representa el 25% de potencia. Al igual que con nuestra prueba inicial, los comederos en el estudio posterior nuevamente realizaron la rotación y la entrega de alimentos sin errores durante la duración del estudio.

Figura 5: Trayectoria del peso corporal con datos de ciclo estral superpuestos en ratones hembra durante una restricción calórica utilizando el autoalimentador. (A) Trayectoria media de pérdida de peso (abajo) utilizando el autoalimentador para suministrar el 50-70% de la ingesta básica de alimentos en tres puntos de tiempo (4 h de diferencia, empezando por las luces apagadas). Datos representativos del ciclo estral alineados con la pérdida de peso (arriba). El resaltado gris indica una pérdida de peso superior al 10% del peso inicial. La flecha indica el regreso al acceso a alimentos ad libitum llenando la rejilla de alambre con alimentos y retirando el alimentador automático. (B) Ciclo estral durante la pérdida de peso; Comparación intrasujeto del porcentaje de tiempo en diestro cuando los animales tienen entre un 1% y un 10% de pérdida de peso (barra libre) frente a una pérdida de peso del >10% (barra gris; nota: la detención en diestro es un signo de infertilidad) n = 4. (C) Diagrama de cascada de pérdida de peso versus ciclismo. Con hasta un 8% de pérdida de peso, el 100% de los animales eran fértiles y cíclicos, mientras que con un 20% de pérdida de peso, el 100% de los animales eran acíclicos e infértiles. Abreviaturas: P = proestro; E = celo; D = diestro. Las barras de error representan el error estándar de la media . Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Ruidos que indican la apertura de la puerta y la bolita de comida cayendo en una rejilla de alambre vacía. Haga clic aquí para descargar este video.
Archivo complementario 1: Archivo zip que contiene el dibujo técnico y los archivos SolidWorks + STL para el soporte del alimentador automático. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Dibujo técnico de la placa acrílica. Haga clic aquí para descargar este archivo.
Archivo complementario 3: Archivo zip que contiene el dibujo técnico y los archivos SolidWorks + STL para el conector de puerto. Haga clic aquí para descargar este archivo.
Archivo complementario 4: Archivo zip que contiene el dibujo técnico, archivos SolidWorks + STL para el soporte de la botella de agua y el soporte de la botella. Haga clic aquí para descargar este archivo.
Discusión
En modelos animales preclínicos, la restricción calórica es una poderosa herramienta experimental para manipular y estudiar con precisión el metabolismo. La pérdida de peso sostenida tiene implicaciones en la obesidad, la diabetes, el envejecimiento, la fertilidad y la menopausia (un tipo de envejecimiento reproductivo), todos los cuales son criterios de valoración traslacionales importantes. Sin embargo, los paradigmas de restricción calórica pueden ser difíciles de mantener durante un tiempo prolongado. En este manuscrito, ofrecemos una solución rentable para lograr la restricción calórica a largo plazo en un entorno de laboratorio. Se proporcionan instrucciones para acoplar un alimentador automático listo para usar a una jaula de roedores con una tapa de microaislador estándar. El comedero se monta en la jaula del animal y está programado para entregar comida a horas programadas. La entrega programada de alimentos controla la cantidad y el momento del acceso a los alimentos y está libre de que un manipulador ingrese a la habitación. Además, el sistema rentable puede funcionar durante un período prolongado (meses), lo que mejora la capacidad de lograr la restricción calórica a largo plazo en un entorno de laboratorio.
Los avances recientes en neurociencia permiten a los investigadores manipular o registrar las neuronas que promueven la alimentación en animales despiertos y que se comportan. Específicamente, se han realizado registros de fotometría de fibra (una técnica de registro in vivo) de neuronas alimentadas con una secuencia de ayuno, para promover la actividad neuronal, y luego realimentación, para investigar el cambio en la actividad neuronal 13,14,15. Si bien es mejor realizar grabaciones in vivo en la jaula de origen del animal16, a menudo se realizan en una arena externa para proporcionar movilidad mientras están atadas a un cable de conexión. Además, las grabaciones in vivo pueden verse influidas por el hecho de que un manipulador entre en la habitación sin un medio de acceso a los alimentos. Para abordar ambos problemas de confusión para las grabaciones de fotometría de neuronas en los circuitos de alimentación, diseñamos una modificación de jaula doméstica para albergar animales atados durante un período prolongado, que se acopla al autoalimentador (secciones 3 y 4 del protocolo). Una limitación de este enfoque es que el diseño del inserto de la tapa de la jaula requiere una cortadora láser. Si bien se podría usar una herramienta rotativa y un dispositivo de incisión para cortar el inserto acrílico, es probable que las herramientas fallen al generar lengüetas pequeñas y una hendidura delgada.
Existen limitaciones en el sistema de alimentación descrito aquí. Es decir, el ensamblaje requiere piezas impresas en 3D. Además, el reloj del autoalimentador de ejemplo funciona en un ciclo de 24 horas, por lo que el tiempo de entrega de alimentos para los estudios circadianos debe alinearse manualmente con el período de funcionamiento libre del animal17. Por último, el dispositivo está limitado a 16 cámaras y tres intervalos de tiempo programados. El alimentador distribuye alimentos; No controla el consumo. Los alimentos que no se consumen durante un tiempo determinado, se pueden recuperar del suelo de la jaula o de la rejilla de alambre, pero puede haber errores en la contabilidad y la recuperación de los alimentos no consumidos.
Para resaltar las ventajas de un alimentador automático comercial listo para usar equipado con una jaula estándar para roedores, mostramos que el dispositivo es fácil de usar y proporciona asignaciones precisas de alimentos en intervalos de tiempo específicos. Este sistema no obstruye el área de la jaula de la casa. Debido a que el comedero está colocado fuera de la jaula del animal y se puede separar fácilmente del soporte impreso en 3D, el mantenimiento regular, las recargas de alimentos y la limpieza se pueden realizar con una molestia mínima para el animal.
Como ejemplo, utilizamos el autoalimentador para inducir la restricción calórica y, en última instancia, la infertilidad. Demostramos el uso del alimentador automático en un estudio de restricción calórica de 21 días (Figura 5) y, posteriormente, hemos utilizado los alimentadores para numerosos experimentos en el laboratorio. Como se describe en los resultados, los comederos fueron confiables y entregaron alimentos con precisión. La batería interna recargable parece disminuir un poco con el tiempo, pero después de casi un año de usar los alimentadores, funcionan durante un mínimo de 15 días antes de registrar incluso una ligera pérdida de energía. El fabricante estima que la batería puede funcionar durante 60 días, a partir de una carga completa. Para estudios prolongados (>30 días), es aconsejable tener alimentadores de repuesto completamente cargados para rotar cuando la vida útil de la batería del alimentador esté por debajo del 50% de la carga máxima.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Jason Lê cuenta con el apoyo del programa de educación en investigación posterior a la licenciatura financiado por los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| #7 Stopper W/ 3-1/2" curved sipper tube no ball | Labex | 2067 | |
| AN75 mouse cage bottom | Ancare | AN75HT | |
| Automatic Fish Feeder for Aquarium | Petbank-tek.com | Amazon distribution (#B0BRCWP16K) | |
| Rodent Micro-filter Tops | Ancare | N10MBTPLF | |
| Rubber Stoppers, One Hole | United Scientific | S24009 | |
| standard rodent chow | Prolab IsoPro 3000 |
Referencias
- Arble, D. M., Bass, J., Laposky, A. D., Vitaterna, M. H., Turek, F. W. Circadian timing of food intake contributes to weight gain. Obesity (Silver Spring). 17 (11), 2100-2102 (2009).
- Hatori, M., et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 15 (6), 848-860 (2012).
- Acosta-Rodriguez, V. A., de Groot, M. H. M., Rijo-Ferreira, F., Green, C. B., Takahashi, J. S. Mice under caloric restriction self-impose a temporal restriction of food intake as revealed by an automated feeder system. Cell Metab. 26 (1), 267-277.e2 (2017).
- Gallop, M. R., Tobin, S. Y., Chaix, A. Finding balance: understanding the energetics of time-restricted feeding in mice. Obesity (Silver Spring). 31 (Suppl 1), 22-39 (2023).
- Hua, L., et al. Time-restricted feeding improves the reproductive function of female mice via liver fibroblast growth factor 21. Clin Transl Med. 10 (6), e195(2020).
- Strilbytska, O., Klishch, S., Storey, K. B., Koliada, A., Lushchak, O. Intermittent fasting and longevity: From animal models to implication for humans. Ageing Res Rev. 96, 102274(2024).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Longo, V. D., Panda, S. Fasting, Circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metab. 23 (6), 1048-1059 (2016).
- Matikainen-Ankney, B. A., et al. An open-source device for measuring food intake and operant behavior in rodent home-cages. Elife. 10, e66173(2021).
- Sahasrabudhe, A., Guy, C. R., Greenwell, B. J., Menet, J. S. Manipulation of rhythmic food intake in mice using a custom-made feeding system. J Vis Exp. (190), (2022).
- Kreisman, M. J., Tadrousse, K. S., McCosh, R. B., Breen, K. M. Neuroendocrine basis for disrupted ovarian cyclicity in female mice during chronic undernutrition. Endocrinology. 162 (8), ebqab103(2021).
- Allaway, H. C., Southmayd, E. A., De Souza, M. J. The physiology of functional hypothalamic amenorrhea associated with energy deficiency in exercising women and in women with anorexia nervosa. Horm Mol Biol Clin Investig. 25 (2), 91-119 (2016).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Chen, Y., Lin, Y. C., Kuo, T. W., Knight, Z. A. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell. 160 (5), 829-841 (2015).
- Mandelblat-Cerf, Y., et al. Arcuate hypothalamic AgRP and putative POMC neurons show opposite changes in spiking across multiple timescales. Elife. 4, e07122(2015).
- Kahnau, P., et al. A systematic review of the development and application of home cage monitoring in laboratory mice and rats. BMC Biol. 21 (1), 256(2023).
- Eckel-Mahan, K., Sassone-Corsi, P. Phenotyping circadian rhythms in mice. Curr Protoc Mouse Biol. 5 (3), 271-281 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados