Method Article
Un système de bricolage pour l’alimentation programmée des rongeurs de laboratoire dans leur cage domestique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article détaille la conception, l’assemblage et le protocole d’un système d’alimentation automatisé, ainsi qu’une modification alternative du couvercle et de la cage qui peut être mise en œuvre sur des cages de rongeurs standard avec des modifications minimales pour les expériences d’optogénétique ou de photométrie de fibres. Le système d’alimentation offre un outil rentable pour l’alimentation chronométrée et/ou la restriction calorique.
Résumé
Le jeûne intermittent et la recherche sur l’influence de la restriction calorique chronométrée sur la régulation du poids corporel et les résultats du vieillissement sont à la mode, tant dans la société qu’en laboratoire. Pour étudier l’alimentation limitée dans le temps et/ou la restriction calorique en laboratoire, des quantités allouées de nourriture sont dispersées à des intervalles de temps programmés. La technologie actuelle pour l’alimentation programmée des rongeurs implique soit des cages spécialisées avec des ports d’entrée de nourriture fermés, des trémies numériques verrouillées dans le temps ou la livraison manuelle de nourriture. L’équipement spécialisé pour de telles expériences peut être coûteux et l’alimentation manuelle oblige souvent les chercheurs à venir tard le soir ou tôt le matin, ce qui empêche les études prolongées. Le système d’alimentation automatisé décrit ici fournit un outil rentable pour l’alimentation chronométrée et/ou la restriction calorique qui peut être mis en œuvre sur des cages à rongeurs standard avec des modifications minimales. Le protocole utilise un distributeur automatique prêt à l’emploi qui est équipé d’un couvercle de cage de micro-isolement standard (couvercles de cage de souris, de hamster, de rat ou de cobaye) et peut administrer les allocations de nourriture souhaitées à des intervalles de temps programmés dans la cage d’origine de l’animal. Notre conception peut être modifiée pour accepter diverses mangeoires ou de légères variations dans les dimensions de la cage. Nous fournissons la conception, l’assemblage et le protocole du système d’alimentation, ainsi qu’une modification alternative du couvercle et de la cage pour les expériences d’optogénétique ou de photométrie de fibres.
Introduction
Le jeûne intermittent est un domaine important de la recherche sur le métabolisme et le vieillissement. Un bon alignement de l’alimentation et du rythme circadien peut modifier l’effet de l’alimentation sur le poids corporel 1,2,3,4. De plus, le jeûne intermittent prolongé est associé à une longévité accrue et à une amélioration des troubles liés à l’âge 5,6,7,8. Les études de recherche mettant en œuvre des protocoles de jeûne à long terme (>20 jours) nécessitent généralement un équipement spécialisé. Bien qu’il soit possible de livrer la nourriture manuellement pour les protocoles d’alimentation programmés, cela peut nécessiter la présence d’un enquêteur à de nombreux moments hors des heures de travail pendant une période prolongée. Par exemple, trois heures de repas espacées de 4 heures nécessiteraient une livraison manuelle à 20h00, 12h00 et 4h00 ; Il s’agit probablement d’un défi de conformité qui durera plus de quelques jours.
Les alternatives à la livraison manuelle de nourriture pour les rongeurs de laboratoire sont 1) des cages spécialisées avec accès automatisé à la nourriture ou 2) des systèmes de trémie numériques qui fournissent un accès automatisé et programmé à la nourriture, tels que FED39. Les systèmes de cages avec accès limité à la nourriture sont coûteux et certains ne fournissent pas un environnement de cage domestique approprié pour des études à long terme. Par exemple, les boîtes de conditionnement opérantes traditionnelles sont capables de livrer des aliments automatisées, mais ont un sol grillagé qui n’est pas propice à un logement à long terme. Le système BioDAQ de Research Diets fournit de la nourriture et de l’eau via des ports externes fermés. Les portes automatisées programmables permettent des études d’alimentation ou d’abreuvement programmées à long terme, mais le système représente un investissement coûteux. Les systèmes de trémie mécanisés sont un autre outil pour les protocoles d’alimentation programmés automatisés 9,10. Les deux trémies mécanisées citées sont assorties de la mise en garde de réduire l’espace de vie de la cage domestique. Les animaux affamés soumis à des restrictions alimentaires peuvent mâcher les appareils d’alimentation et/ou les débris de la cage peuvent interférer avec la mécanique de la trémie pour des études à long terme. Enfin, une trémie mécanisée développée par le groupe de recherche Takahashi en collaboration avec Phenome Technology a été spécialement conçue pour des études d’alimentation programmées à long terme3. Dans ce système, une trémie mécanisée est positionnée au-dessus de la grille d’une cage standard avec une goulotte qui livre les aliments. Le système Phenome, cependant, n’offre pas de flexibilité pour les animaux attachés à un câble de raccordement (expériences d’optogénétique/photométrie à fibres), et il est relativement coûteux par rapport à l’appareil d’alimentation automatique décrit ici.
En réponse aux défis actuels dans les protocoles d’alimentation programmés, nous proposons un remède rentable. Notre système automatisé facilite la livraison précise des aliments à des intervalles prédéterminés. Avec une combinaison de pièces imprimées en 3D et d’une mangeoire automatique à poissons disponible dans le commerce, nous concevons un système d’alimentation externe à faire soi-même (DIY) qui peut être installé sur des cages à rongeurs autonomes qui utilisent des couvercles de micro-isolateur. Le système d’alimentation et les pièces décrits ici peuvent être appliqués directement sur l’une des cages de rongeurs suivantes : souris, rat, hamster ou cochon d’Inde, à condition que les cages autonomes utilisent des couvercles de micro-isolateur. Étant donné que les cages varient en taille, les emplacements peuvent varier légèrement, mais les supports imprimés en 3D, le système d’alimentation et la conception externe des bouteilles d’eau sont généralement applicables aux cages pour rongeurs autonomes avec des couvercles de micro-isolateur.
Nous présentons un exemple d’auto-alimentateur, mais de nombreux autres auto-alimentateurs prêts à l’emploi sont disponibles et peuvent être montés sur le système modulaire avec de légères modifications des pièces imprimées en 3D. Pour faciliter l’ajustement du support imprimé en 3D à d’autres mangeoires ou à de légères variations dans les dimensions de la cage, nous testons un fichier SolidWorks modifiable en 3 dimensions avec un fichier STL associé.
Le placement externe de la mangeoire automatique offre tout l’espace dans la cage familiale et permet le détachement, la stérilisation et le rechargement ou le remplacement de la mangeoire sans perturber l’animal. Le système d’alimentation automatisé est efficace pour les enregistrements à long terme, abordable et se prête à divers protocoles d’alimentation et/ou de restriction calorique limités dans le temps. Nous fournissons des dessins techniques détaillés des assemblages de cages, de la conception et du protocole de mise en œuvre du système d’alimentation, ainsi que des données d’échantillons. Deuxièmement, nous fournissons un ensemble d’instructions pour modifier la cage standard pour l’utilisation de l’automangeoire avec des animaux attachés à un câble de raccordement pour des expériences d’optogénétique ou de photométrie de fibres.
Protocole
Toutes les procédures ont été approuvées par le comité institutionnel de protection et d’utilisation des animaux de l’Université du Massachusetts à Amherst.
1. Assemblage de l’alimentateur automatique sur le couvercle d’une cage de micro-isolateur standard (Figure 1)
- À l’aide d’un outil rotatif avec une molette de coupe de 1,5 po, découpez un carré de 20 x 25 mm dans le couvercle d’une cage de micro-isolateur. Placez l’ouverture à 2,75 cm du bord du couvercle et centrée au-dessus de la grille (Figure 1B, à gauche).
- Imprimez en 3D un support pour coupler le chargeur automatique sur le couvercle de la cage (Figure 1A et fichier supplémentaire 1). Enclenchez le support sur le trou du couvercle de la cage (étape 1.1 ; Figure 1B, au centre) et faites glisser le chargeur automatique sur le dessus du support sécurisé (Figure 1B [à droite], C).

Figure 1 : Modification et assemblage du support d’autochargeur et du couvercle de la cage. (A) Dessin technique du support d’auto-chargeur (voir les fichiers SolidWorks/STL dans le fichier supplémentaire 1 pour l’échelle en 3D). (B) De gauche à droite, cage-top avec trou de 20 x 25 mm ; support installé sur le dessus de la cage et monté avec le chargeur automatique Petbank. (C) Chargeur automatique Petbank assemblé sur une cage avec des granulés de nourriture déposés sur une grille standard avec une bouteille d’eau. Barres d’échelle = 25 cm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Programmation et utilisation de l’exemple d’alimentateur automatique prêt à l’emploi
- Pour les expériences chronométrées, réglez les heures d’alimentation en premier et l’horloge synchronisée de l’alimentation en dernier, car les ajustements ultérieurs décaleront l’heure de l’horloge.
- Assurez-vous que la mangeoire est suffisamment chargée. Appuyez sur le bouton Paramètres et maintenez-le enfoncé jusqu’à ce que le réglage de l’heure à l’écran clignote.
- Passez au réglage de l’heure . À l’aide des flèches vers le haut et vers le bas, ajustez l’heure à la première période d’alimentation programmée souhaitée.
- Définissez le nombre d’allocations pour ce point temporel (indiqué par le nombre de points à côté du paramètre de flux). Répétez les étapes 2.2 à 2.4 pour un maximum de deux points temporels supplémentaires.
- Chargez les chambres d’alimentation automatique avec les quantités de nourriture souhaitées de ≤1,5 g de nourriture standard pour rongeurs. Si vous avez besoin de plus de nourriture, réglez la mangeoire pour qu’elle distribue plusieurs lots à un moment donné. L’exemple de mangeoire a 16 chambres.
REMARQUE : Les aliments peuvent être commandés à la taille ou coupés avec des ciseaux. - Étiquetez une chambre avec du ruban adhésif ou de la peinture pour confirmer la rotation programmée de la chambre et la distribution de nourriture. Vérifiez quotidiennement pendant que vous faites fonctionner les mangeoires.
3. Système de cage modifié pour les animaux attachés avec l’auto-mangeoire
- Insert de couvercle de remplacement en option pour les animaux attachés à un cordon de raccordement (Figure 2)
- Découpez au laser un morceau d’acrylique transparent de 3 mm d’épaisseur selon les spécifications de la figure 2A (voir aussi le fichier supplémentaire 2). L’insert en acrylique est conçu avec des languettes pour s’enclencher dans le haut de la cage. La fente centrale (190 x 5 mm) permet le passage du câble de brassage. Le trou carré de 20 x 25 mm s’adapte au support du chargeur automatique ; 20 trous d’aération permettent la circulation de l’air frais.
- À l’aide d’un tournevis à tête plate ou d’un outil de calage, soulevez le couvercle supérieur de la cage perforée d’un couvercle de micro-isolateur standard. Efforcez-vous de libérer les languettes des fentes des languettes et retirez à la fois l’insert perforé et le papier filtre (Figure 2C, à gauche et au centre).
- Sous le dessus perforé et le papier filtre se trouve une grille de support nervurée interne. Utilisez un outil rotatif et une roue de coupe de 1,5 pouce pour retirer la grille de support ; en suivant les flèches indiquées au centre de la Figure 2C. Après avoir coupé pour retirer la grille de support, limez pour lisser le bord de coupe.
- Enclenchez l’insert de plaque acrylique de remplacement (étape 3.1) dans le haut de la cage. Commencez l’installation en faisant glisser les languettes de la plaque dans les fentes des languettes le long de l’un des bords courts, puis de l’un des bords longs, puis appuyez doucement jusqu’à ce que la plaque s’enclenche (Figure 2C [droite] ,D).
- Support de bouteille d’eau externe en option pour les animaux attaché à un cordon de raccordement (Figure 3)
- Percez un orifice pour la bouteille d’eau : trou de 11 mm de diamètre, à 50 mm du sol, centré sur le bord court de la cage (figure 3B et fichier supplémentaire 3).
- De chaque côté du trou central (± 27,5 mm), percez deux trous de 6 mm de diamètre. En option, utilisez un poinçonneur carré de 8 mm pour percer des trous carrés (illustré à la Figure 3B).
- Imprimez en 3D un support externe de bouteille d’eau (Figure 3A et Fichier supplémentaire 4). Montez le support de bouteille d’eau au fond de la cage à l’aide de boulons de carrosserie (2 cm de long, 6 x 1 mm ou 0,75" de long 1/4 x 20 ; Figures 2B et C).
- Pour une bouteille d’eau, installez un tube conique standard de 50 ml, recouvert d’un ensemble sipper/stopper (#7 Stopper W/ 3-1/2" curved sipper, voir le tableau des matériaux) sur le support externe. Faites le plein d’eau tous les 2-3 jours.

Figure 2 : Assemblage de la plaque acrylique sur le dessus de la cage. (A,B) Dessins techniques de la plaque acrylique et du bouchon de port d’alimentation. (C) Gauche, haut de cage standard avec insert perforé et filtre. Centre, retrait de l’insert perforé et du filtre (la grille nervurée doit être découpée le long des lignes indiquées par les flèches). À droite, la plaque acrylique s’est enclenchée. (D) Assemblage complet du couvercle. Barres d’échelle = 25 cm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
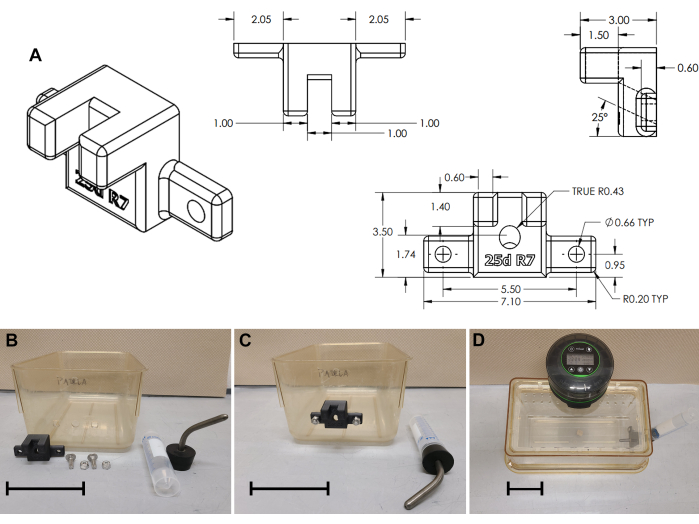
Figure 3 : Assemblage du support de bouteille d’eau. (A) Dessin technique du support de bouteille d’eau imprimé en 3D. (B) Modifications de la cage et assemblage du support de bouteille d’eau ; (C) Support installé ; (D) Assemblage complet de la cage. Barres d’échelle = 10 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Résumé de l’assemblage complet de la cage avec l’automangeoire. (A) Cage standard avec grille métallique, (B) Cage modifiée pour les animaux attachés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Une étude de restriction calorique (21 jours) pour induire l’infertilité chez les souris femelles (conception de l’auto-mangeoire et de la cage, Figure 4A)
Une carence énergétique chronique est suffisante pour inhiber la fertilité chez les mammifères, une réponse qui est conservée chez les rongeurs et les humains 11,12. Dans cette étude, nous utilisons la restriction calorique pour induire une perte de poids corporel à long terme. Les souris femelles adultes C57BL/6, âgées de 15 à 18 semaines, étaient logées seules et suivaient un cycle lumière/obscurité de 12:12 h, avec les lumières éteintes à l’heure Zeitgeber 12 (ZT12). La grille contenant la nourriture a été pesée quotidiennement pour chaque animal pendant une semaine afin d’établir l’apport alimentaire de base, soit 3,80 ± 0,64 g/jour (moyenne ± ET). Ensuite, la nourriture a été restreinte pour induire une perte de poids. La nourriture a été rationnée en trois portions et distribuée par l’automangeur sur trois intervalles : ZT 12, 16 et 20 (configuration en cage, figure 4A). Pendant les 48 premières heures, les animaux ont été limités à 50 % de l’apport alimentaire de base. Ensuite, les animaux ont été limités à ~70 % de la nourriture de base au cours des 19 jours suivants, avec de légers ajustements dans la seconde moitié de la restriction pour maintenir 80 à 90 % du poids de base (figure 5A, en bas).
Entre ZT 0 et ZT 1, les animaux ont été pesés et évalués pour déterminer le stade du cycle ovulatoire par caractérisation histologique des cellules recueillies par un lavage vaginal avec une solution saline tamponnée au phosphate 0,1 M. La durée du cycle a été surveillée pendant au moins 11 jours avant et pendant une perte de poids de 80 à 90 %. Une perte de poids soutenue de plus de 10 % était suffisante pour induire l’infertilité chez les souris femelles, comme publié précédemment11.
Les mangeoires automatiques ont été inspectées quotidiennement pour s’assurer qu’elles effectuaient une rotation appropriée et qu’elles livraient de la nourriture (étape 3.1 du protocole). Toute nourriture laissée sur le sol ou restant dans la grille a été jetée. L’exemple de mangeoire profilé ici dispose de 16 chambres et peut être réglé pour livrer de la nourriture à trois intervalles (voir tableau des matériaux). Nous avons déterminé que le volume maximal de nourriture qui tient dans une chambre est de 2 g, qui peut être coupé ou commandé à la bonne taille. Nous avons également déterminé que la livraison de nourriture prend ~10 s une fois l’heure programmée atteinte. Il faut 7 s pour que la porte du sol s’ouvre complètement, puis 3 s supplémentaires pour que la chambre se déplace au-dessus de l’ouverture, distribuant les granulés de nourriture. Il y a des bruits qui coïncident avec l’ouverture de la porte et la chute de la boule de nourriture dans une grille vide (vidéo 1, avec enregistrement sonore).
Pendant 21 jours, nous avons observé une précision totale des rotations et de la livraison de nourriture à l’aide de cette mangeoire spécifique de Petbank (Table of Materials). Au moment des essais, les mangeoires étaient entre 3 et 6 mois après leur utilisation initiale et les batteries rechargeables internes ont maintenu des indications de charge complète pendant toute la durée de l’essai de 21 jours. Comme il s’agissait d’un échantillon relativement petit de mangeurs (n = 4), nous avons ensuite mené une autre étude de 21 jours avec 10 mangeurs automatiques, prêts à distribuer de la nourriture à un rythme apparié. L’étude subséquente a été réalisée 10 mois après la première utilisation des mangeoires. Au cours de l’essai de 21 jours, un distributeur a perdu une seule barre de puissance (~25 % de perte de puissance) au 15e jour et un autre a perdu une seule barre au 17e jour, tandis que les 8 autres distributeurs avaient des indications de charge complète pendant les 21 jours. Le niveau de puissance sur l’exemple d’alimentateur est indiqué par quatre barres. Notre quantification suppose que chaque barre représente 25 % de puissance. Comme pour notre test initial, les mangeoires de l’étude subséquente ont de nouveau effectué une rotation et une distribution de nourriture sans erreur pendant la durée de l’étude.

Figure 5 : Trajectoire du poids corporel avec données de cycle œstral superposées chez les souris femelles pendant une restriction calorique à l’aide de l’automangeoire. (A) Trajectoire moyenne de perte de poids (en bas) à l’aide de l’auto-mangeoire pour fournir 50 à 70 % de l’apport alimentaire de base sur trois points temporels (à 4 heures d’intervalle, en commençant à l’extinction des feux). Les données représentatives du cycle œstral sont alignées sur la perte de poids (en haut). Le surlignage gris indique une perte de poids supérieure à 10 % du poids de départ. La flèche indique le retour à l’accès aux aliments à volonté en remplissant la grille avec des aliments et en retirant le chargeur automatique. (B) Cycle œstral pendant la perte de poids ; Comparaison intra-sujet du % de temps dans le diestrus lorsque les animaux ont une perte de poids comprise entre 1 % et 10 % (open bar) par rapport à >10 % de perte de poids (barre grise ; remarque : l’arrêt dans le diestrus est un signe d’infertilité) n = 4. (C) Graphique en cascade de la perte de poids par rapport au cyclisme. Avec une perte de poids allant jusqu’à 8 %, 100 % des animaux étaient fertiles et cycliques, tandis qu’à 20 % de perte de poids, 100 % des animaux étaient acycliques et infertiles. Abréviations : P = proestrus ; E = œstrus ; D = diestrus. Les barres d’erreur représentent l’erreur type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Bruits indiquant l’ouverture d’une porte et la chute d’une boule de nourriture dans une grille vide. Veuillez cliquer ici pour télécharger cette vidéo.
Fichier supplémentaire 1 : Fichier Zip contenant le dessin technique et les fichiers SolidWorks + STL pour le support du chargeur automatique. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Dessin technique de la plaque acrylique. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 3 : Fichier zip contenant le dessin technique et les fichiers SolidWorks + STL pour la prise de port. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 4 : Fichier zip contenant le dessin technique, fichiers SolidWorks + STL pour le support de bouteille d’eau et le porte-bouteille. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans les modèles animaux précliniques, la restriction calorique est un outil expérimental puissant pour manipuler et étudier avec précision le métabolisme. La perte de poids soutenue a des implications sur l’obésité, le diabète, le vieillissement, la fertilité et la ménopause (un type de vieillissement reproducteur), qui sont tous des critères d’évaluation translationnels importants. Les paradigmes de restriction calorique, cependant, peuvent être difficiles à maintenir pendant une période prolongée. Dans ce manuscrit, nous proposons une solution rentable pour obtenir une restriction calorique à long terme en laboratoire. Vous trouverez des instructions pour coupler une mangeoire automatique standard à une cage à rongeurs avec un couvercle de micro-isolateur standard. La mangeoire est montée sur la cage d’accueil de l’animal et est programmée pour livrer la nourriture à des heures programmées. La livraison de nourriture programmée contrôle la quantité et le moment de l’accès à la nourriture et est exempte d’entrée d’un manipulateur dans la pièce. De plus, le système rentable peut fonctionner pendant une période prolongée (mois), améliorant ainsi la capacité à atteindre une restriction calorique à long terme dans un laboratoire.
Les progrès récents en neurosciences permettent aux chercheurs de manipuler ou d’enregistrer à partir de neurones qui favorisent l’alimentation des animaux éveillés et au comportement élevé. Plus précisément, des enregistrements par photométrie par fibre (une technique d’enregistrement in vivo) des neurones nourrisseurs ont été effectués avec une séquence de jeûne, pour favoriser l’activité neuronale, puis de réalimentation, pour étudier le changement de l’activité neuronale 13,14,15. Bien qu’il soit préférable d’effectuer des enregistrements in vivo dans la cage de l’animal16, ils sont souvent effectués dans une arène externe pour assurer la mobilité tout en étant attaché à un câble de raccordement. De plus, les enregistrements in vivo peuvent être influencés par un manipulateur entrant dans la pièce sans moyen d’accès à la nourriture fermée. Pour résoudre ces deux problèmes de confusion pour les enregistrements photométriques des neurones dans les circuits d’alimentation, nous avons conçu une modification de la cage domestique pour héberger des animaux attachés pendant une période prolongée, qui est couplée à l’automangeoire (sections 3 et 4 du protocole). Une limite à cette approche est que la conception de l’insert de couvercle de la cage nécessite une découpeuse laser. Bien qu’un outil rotatif et un dispositif de rainurage puissent être utilisés pour couper l’insert en acrylique, les outils ne parviendraient probablement pas à générer de petites languettes et une fine fente.
Il y a des limites au système d’alimentation décrit ici. À savoir, l’assemblage nécessite des pièces imprimées en 3D. De plus, l’horloge de l’exemple de distributeur automatique fonctionne sur un cycle de 24 heures, de sorte que le moment de la distribution de la nourriture pour les études circadiennes doit être aligné manuellement sur la période de course libre de l’animal17. Enfin, le dispositif est limité à 16 chambres et trois intervalles de temps programmés. La mangeoire distribue la nourriture ; Il ne surveille pas la consommation. La nourriture qui n’est pas consommée pendant une période déterminée peut être récupérée sur le sol de la cage ou sur une grille, mais il peut y avoir des erreurs dans la comptabilisation et la récupération de la nourriture non consommée.
Pour mettre en évidence les avantages d’un distributeur automatique commercial équipé d’une cage à rongeurs standard, nous montrons que l’appareil est convivial et délivre des allocations précises de nourriture à des intervalles de temps spécifiques. Ce système n’obstrue pas la zone de la cage d’origine. Parce que la mangeoire est positionnée à l’extérieur de la cage de l’animal et peut être facilement détachée du support imprimé en 3D, un entretien régulier, des recharges de nourriture et un nettoyage peuvent être effectués avec un minimum de dérangement pour l’animal.
À titre d’exemple, nous avons utilisé l’automangeoire pour induire une restriction calorique et, finalement, l’infertilité. Nous démontrons l’utilisation de l’alimentateur automatique dans une étude de restriction calorique de 21 jours (figure 5) et avons par la suite utilisé les mangeoires pour de nombreuses expériences en laboratoire. Comme décrit dans les résultats, les mangeoires étaient fiables et distribuaient la nourriture avec précision. La batterie interne rechargeable semble diminuer quelque peu avec le temps, mais après près d’un an d’utilisation des mangeoires, elles fonctionnent pendant au moins 15 jours avant d’enregistrer la moindre perte de puissance. Le fabricant estime que la batterie peut fonctionner pendant 60 jours, à partir d’une charge complète. Pour les études prolongées (>30 jours), il est conseillé d’avoir des mangeoires de remplacement complètement chargées pour tourner lorsque la durée de vie de la batterie de la mangeoire est inférieure à 50 % de la charge maximale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Jason Lê est soutenu par le programme d’éducation par la recherche post-baccalauréat financé par les National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| #7 Stopper W/ 3-1/2" curved sipper tube no ball | Labex | 2067 | |
| AN75 mouse cage bottom | Ancare | AN75HT | |
| Automatic Fish Feeder for Aquarium | Petbank-tek.com | Amazon distribution (#B0BRCWP16K) | |
| Rodent Micro-filter Tops | Ancare | N10MBTPLF | |
| Rubber Stoppers, One Hole | United Scientific | S24009 | |
| standard rodent chow | Prolab IsoPro 3000 |
Références
- Arble, D. M., Bass, J., Laposky, A. D., Vitaterna, M. H., Turek, F. W. Circadian timing of food intake contributes to weight gain. Obesity (Silver Spring). 17 (11), 2100-2102 (2009).
- Hatori, M., et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 15 (6), 848-860 (2012).
- Acosta-Rodriguez, V. A., de Groot, M. H. M., Rijo-Ferreira, F., Green, C. B., Takahashi, J. S. Mice under caloric restriction self-impose a temporal restriction of food intake as revealed by an automated feeder system. Cell Metab. 26 (1), 267-277.e2 (2017).
- Gallop, M. R., Tobin, S. Y., Chaix, A. Finding balance: understanding the energetics of time-restricted feeding in mice. Obesity (Silver Spring). 31 (Suppl 1), 22-39 (2023).
- Hua, L., et al. Time-restricted feeding improves the reproductive function of female mice via liver fibroblast growth factor 21. Clin Transl Med. 10 (6), e195(2020).
- Strilbytska, O., Klishch, S., Storey, K. B., Koliada, A., Lushchak, O. Intermittent fasting and longevity: From animal models to implication for humans. Ageing Res Rev. 96, 102274(2024).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Longo, V. D., Panda, S. Fasting, Circadian rhythms, and time-restricted feeding in healthy lifespan. Cell Metab. 23 (6), 1048-1059 (2016).
- Matikainen-Ankney, B. A., et al. An open-source device for measuring food intake and operant behavior in rodent home-cages. Elife. 10, e66173(2021).
- Sahasrabudhe, A., Guy, C. R., Greenwell, B. J., Menet, J. S. Manipulation of rhythmic food intake in mice using a custom-made feeding system. J Vis Exp. (190), (2022).
- Kreisman, M. J., Tadrousse, K. S., McCosh, R. B., Breen, K. M. Neuroendocrine basis for disrupted ovarian cyclicity in female mice during chronic undernutrition. Endocrinology. 162 (8), ebqab103(2021).
- Allaway, H. C., Southmayd, E. A., De Souza, M. J. The physiology of functional hypothalamic amenorrhea associated with energy deficiency in exercising women and in women with anorexia nervosa. Horm Mol Biol Clin Investig. 25 (2), 91-119 (2016).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Chen, Y., Lin, Y. C., Kuo, T. W., Knight, Z. A. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell. 160 (5), 829-841 (2015).
- Mandelblat-Cerf, Y., et al. Arcuate hypothalamic AgRP and putative POMC neurons show opposite changes in spiking across multiple timescales. Elife. 4, e07122(2015).
- Kahnau, P., et al. A systematic review of the development and application of home cage monitoring in laboratory mice and rats. BMC Biol. 21 (1), 256(2023).
- Eckel-Mahan, K., Sassone-Corsi, P. Phenotyping circadian rhythms in mice. Curr Protoc Mouse Biol. 5 (3), 271-281 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon