Method Article
ラット子宮内膜上皮幹細胞からのラット子宮オルガノイドの作製と特性評価
要約
ここでは、ラット子宮内膜上皮幹細胞(reESC)を単離して培養し、ラット子宮内膜オルガノイドを作製するプロトコールを紹介します。この方法は、子宮内膜疾患の in vitro 研究を容易にし、遺伝子編集やその他の細胞操作を可能にします。
要約
子宮内膜オルガノイドは、子宮内膜疾患の発症と病態生理学に関する貴重な洞察を提供し、薬物試験のプラットフォームとして機能します。ヒトとマウスの子宮内膜オルガノイドが開発されている一方で、ラットの子宮内膜オルガノイドに関する研究はまだ限られています。ラットは、子宮内癒着などの特定の子宮内膜の病状をよりよくシミュレートできることを考慮して、この研究はラットの子宮内膜オルガノイドを確立することを目指しました。ラット子宮内膜上皮幹細胞(reESC)の単離と培養、およびラット子宮内膜オルガノイドの作製に関する詳細なプロトコールを提示します。精製されたreESCs増殖培地を用いて、reESCの単離と安定増殖に成功し、その長期培養の可能性を示しました。reESCで生成されたオルガノイドは、ホルモン応答性を含む、子宮内膜の典型的な構造的および機能的特性を示しました。その結果、ラットの子宮内膜オルガノイドは、子宮内膜上皮の腺構造、細胞極性、機能特性を維持しながら、安定的に増殖しながら長期間培養できることが示されました。この新しいラット由来の子宮内膜オルガノイドモデルは、子宮内膜疾患の研究や治療介入の試験のための貴重なプラットフォームを提供し、さまざまな哺乳類種への応用が期待できます。
概要
子宮内膜は、人体の多用途で再生可能な組織であり、卵巣ホルモンの影響下で周期的な脱落、再生、分化を経験します1。子宮内膜の異常は、子宮内膜症、子宮内膜がん、不妊症など、さまざまな女性の生殖器系疾患に関連しています2。子宮内膜の信頼できる研究モデルの欠如は、これらの疾患の病因、臨床診断、および治療に関する詳細な研究を妨げています。細胞株や動物モデルは一般的に子宮内膜の研究に利用されていますが、細胞株の表現型の不安定性、動物モデルの種間の違いなどの課題により、ヒト子宮内膜の複雑な生理学的構造や動的な機能変化を再現することは困難です3。
オルガノイドは、幹細胞を細胞外環境で培養することで形成される立体構造で、自己複製能力と自己組織化能力を持っています。それらは生理学的および病理学的組織の構造と機能を模倣することができ、ヒト疾患の前臨床モデルとして認識されています4。2017年には、酵素消化によって得られた断片化された遊離子宮内膜組織を細胞外マトリックスの足場に埋め込み、続いて特定の成長因子とシグナル伝達因子の混合物を添加して培養することにより、マウスおよびヒトの子宮内膜オルガノイドの構築に成功しました5。その結果、 ex vivo 子宮内膜オルガノイドは、粘液分泌やホルモン応答など、子宮内膜上皮の腺構造、細胞極性、機能特性を維持しながら、長期的かつ安定した増殖能力を示すことが実証されました6。しかし、子宮内膜オルガノイドを形成する成体幹細胞の ex vivo 培養には、腺のような構造的支持が必要であり、幹細胞性の喪失や継代の困難さなどの課題が生じます7。
現在、子宮内膜オルガノイドの培養は、組織ブロック消化培養法に依存しています。これまでの研究で、私たちの研究チームは、Y27632を主成分とする初代培地を用いて、ヒト子宮内膜上皮幹細胞を in vitro で長期間培養し、子宮内膜オルガノイドを構築しました8。この成功を基に、ラットの子宮内膜組織から低分子化合物培養液を用いて子宮内膜上皮幹細胞を単離・培養し、長期 のin vitro 培養系を確立しました。さらに、ラット子宮内膜上皮幹細胞(reESC)を利用して、ラット子宮内膜オルガノイドを作製しました。このモデルの開発は、ラットモデルと組み合わせた子宮内膜関連疾患の将来の in vitro および in vivo 研究を強化します。
プロトコル
この研究では、体重200〜250 gの6匹の7/8週齢の雌Sprague-Dawleyラットを使用しました。ネズミは、餌と水 を自由に利用できる温度 調節された動物施設に収容されました。動物を含むすべての実験手順は、実験動物の世話と使用に関する施設ガイドラインに準拠して実施され、美州人民病院の研究倫理委員会の動物実験に関する施設審査委員会によって承認されました。
次のセクションでは、Y27632、A8301、およびCHIR990217 8,9を主成分とする精製されたreESCs増殖培地(REEM)を用いて、ラット子宮内膜上皮幹細胞を単離、継代、凍結、融解するプロセスについて概説します。REEM製剤は、特定の濃度の主要成分(10 μM Y27632、3 μM CHIR99021、および0.5 μM A8301)が豊富に設定された無血清DMEM/F12に基づいています。コンポーネントに関する包括的な詳細は、資料の表に記載されています。ラットがイソフルラン吸入で麻酔されたら、図1に示されている後続の手順を実施する必要があります。.
1.外科的処置
- イソフルラン吸入によりラットに麻酔をかけます。.
- ラットを酸素と混合した3〜5%イソフルランで満たされた誘導チャンバーに入れます。つま先をつまむことに対する反応がなく、立ち直反射がなくなることにより、適切な麻酔を確認します。
- 麻酔をかけたら、処置中にノーズコーンを介してラットを1〜3%イソフルラン未満に維持します。.ラットが麻酔下にある間の乾燥を防ぐために、獣医軟膏を目に塗布します。
- 腹部の正中線を低く切開して、子宮の角を露出させます。
注:すべての手術器具は、使用前に滅菌する必要があります。ラットの手術領域を剃り、消毒液で消毒します。外科医は滅菌手袋、マスク、ガウンを着用します。外科的処置は滅菌ドレープで行われます。 - 子宮の両側に縦方向の切開を行い、内膜を露出させます。T10メスの刃を使用して、表面がざらざらするまで子宮内膜をこすり落とします。
- 外科的処置の後、ラットを温度と湿度が調整された無菌で暖かい回復エリアに移し、完全な意識を取り戻し、胸骨の横臥位で自分自身を支えられるようになるまで、ラットを注意深く監視します。別々のケージに別々に3匹の術後ラットのハウスグループ。術後の痛みを軽減するために、ブプレノルフィン(0.05-0.1 mg / kg、皮下)などの鎮痛薬を投与します。必要に応じて、8〜12時間ごとに最大48〜72時間繰り返します。
2. ティッシュプロセッシング
- すべての子宮子宮内膜の断片を3.5 cmの皿に入れ、PBSで3回洗います。
- 子宮子宮内膜フラグメントを3 mLの1%コラゲナーゼI型(0.25%トリプシン/1 mM EDTAで希釈)と37°Cで60分間混合します。100 μmの細胞ストレーナーを使用して未消化組織をろ過し、濾液を分離して収集し、さらに培養します。
- 収集した細胞をREEM培地中の12ウェルプレートに播種し、さらに培養します。目的の細胞密度(通常、1.5 mLのREEM中に105 細胞/ウェル×10~2~1)を達成するために、12ウェルプレートの各ウェルで細胞を播種するために必要な細胞懸濁液の量を計算します。
- ステップ2.2で収集した細胞をPBSで3回洗浄します。最初の洗浄後、細胞を300 × g で5分間遠心分離します。上清を捨てます。1% BSA(ウシ血清アルブミン)を含むPBSに細胞ペレットを再懸濁して非特異的結合を最小限に抑え、氷上で15〜30分間インキュベートします。
- 異なるマーカーに特異的な一次抗体( 材料表を参照)と細胞をインキュベートし、4°Cで30分から1時間。 製造元の指示に従って、抗体をPBSで1%BSAで希釈します。
- インキュベーション後、細胞をPBSで2回洗浄し、結合していない抗体をすべて除去します。最終洗浄後、フローサイトメトリー分析のために、細胞を1% BSAを含むPBS600 μLに再懸濁します。
- 実験で使用する蛍光色素(FITC、PE、APC)に適したレーザーとフィルターを使用して装置を構成します。前方散乱光(FSC)および側方散乱光(SSC)の設定を使用して、デブリと細胞凝集体を除く、生きた単一細胞集団にゲートします。未染色のコントロールを使用してフローサイトメーターをキャリブレーションし、適切なアライメントを確保します。未染色のコントロールに基づいて特定のゲートを設定し、関心のある各マーカーの陽性集団を定義します(しきい値は0.02%)。
3. ラット子宮内膜上皮幹細胞の長期培養
- コロニー形成アッセイ
注:このアッセイは、reESCに最適な培地を決定するのに役立ちました。- P0 reESCを1,000細胞/ウェルの密度で6ウェルプレートに播種し、REEMまたはA8301、Y27632、またはCHIR99021を欠くREEMのいずれかで14日間培養します。
- 培養期間後、細胞を4%パラホルムアルデヒドで室温で20分間固定し、続いてクリスタルバイオレット溶液でさらに20分間染色します。
- 50個を超える細胞を含む細胞クラスターの数を定量化します。細胞クラスターの増殖をサポートする培地に基づいて、培地を選択します。
注:REEMから特定の要因が省略されたため、reESCの増殖能力が低下しました(図1B、C)。これらの知見に基づき、REEMは、培養条件を最適化するためのreESCの培養に適した培地として選択されました。
- REEMは2日ごとに交換してください。細胞が80〜90%のコンフルエントに達したら、0.25%トリプシン/ 1 mM EDTAで5〜6分間消化します。
- REEMで1:3の比率で細胞を継代します。
- 増殖アッセイ
- P1、P7、およびP14 reESCを、150 μLのREEM中に4 × 103 細胞/ウェルの密度で96ウェルプレートに播種します。
- 24時間、48時間、72時間、96時間の培養後に各ウェルに10 μLのCCK-8試薬を加え、続いて37°Cで2時間のインキュベーションを行います。
- マイクロプレートリーダーを使用して450nmの吸光度を測定することにより、増殖速度を決定します。
- 冷凍ストックの準備と使用
- 10% DMSOを含むREEMを使用して凍結ストック溶液を調製します。
- 0.25% トリプシン/1 mM EDTA で reESC を回収します。
- 細胞ペレットを凍結ストック溶液に1×106 細胞/mLの濃度で再懸濁します。細胞懸濁液をチューブに移します。
- まずチューブを-80°Cで凍結し、次に24時間以内に液体窒素に移します。
注:細胞をすぐに解凍する場合は、凍結細胞を最大6か月間-80°Cで保存することをお勧めします。 - REEMを37°Cに予温します。
- 凍結したreESCを取り出し、37°Cのウォーターバスに1〜2分間浸します。
- 解凍したreESCを、REEM中の播種密度が1×105 細胞/ウェルの6ウェルプレートに移します。
- 免疫蛍光染色
- 対数成長期のreESCをu-Slide 8ウェルプレートにウェルあたり2×103 細胞の密度で播種し、REEMで培養します。
- reESCが90%のコンフルエンスに達したら、4%パラホルムアルデヒドで20分間固定します。固定の前後にreESCをPBS 2xで洗浄します。
- 0.2% Triton X-100で細胞を10分間透過処理します。
- 5%ウシ血清アルブミン(BSA)で希釈した30%ヤギ血清で細胞を室温で30分間ブロックします。ブロッキングの前後にreESCをPBS2xで洗浄します。
- 細胞を一次抗体(抗SSEA-1および抗サイトケラチン)と4°Cで12時間インキュベートします。 インキュベーション後、reESCをPBS 2xで洗浄します。
- 細胞を二次抗体と室温で1時間インキュベートします。インキュベーション後、reESCをPBS 2xで洗浄します。
- 150 μLのDAPIで細胞を対比染色し、すべての核を標識します。
- 倒立共焦点顕微鏡を使用して染色した細胞の画像をキャプチャします。
4. reESCからのラット子宮内膜オルガノイドの樹立
- オルガノイドの生成
- reESCが70%のコンフルエントに達したら、0.25%トリプシン/1 mM EDTAで細胞を5〜6分間消化します。
- 500 μLの解凍マトリゲル溶液に5 ×10 5 reESCを再懸濁し、12ウェルプレートに入れます。プレートを37°Cで20分間インキュベートし、ゲル化します。
- 細胞-マトリゲル混合物が固まったら、1.5 mL/ウェルのREEMをマトリゲルで覆います。REEMは2〜3日ごとに交換してください。
- 免疫蛍光染色
- REEMを吸引し、12ウェルプレートに予冷したオルガノイドハーベスティング溶液1 mL/ウェルを加えます。氷上で40〜60分間インキュベートします。
- パスツールピペットでオルガノイドを回収し、300 × g で4°Cで3分間遠心分離します。
- オルガノイドをPBSで2〜3回すすぎます。
- オルガノイドを4%パラホルムアルデヒドで20分間固定し、5%BSAを使用して60分間ブロックします。
注意: 各ステップの前後にPBSで2回洗ってください。 - オルガノイドを1% BSAで希釈した一次抗体を用いて、4°Cで一晩インキュベートします。
- オルガノイドを二次抗体と室温で1時間インキュベートします。
- オルガノイドを200 μLのDAPIで対比染色します。
- 倒立共焦点顕微鏡を使用して画像を撮影します。
- HE染色
- 等級付けされたエタノールシリーズを通じてオルガノイドを脱水します:70%エタノールを30分間。80%エタノールを30分間;95%エタノールを30分間;100%エタノールを2 x 30分間。オルガノイドをキシレンに2 x 30分間浸して透明にします。
- 透明化したオルガノイドを溶かしたパラフィンに60°Cで1時間浸します。パラフィンに浸潤したオルガノイドを包埋型に移し、溶融したパラフィンを型に充填し、型をコールドプレートに入れてパラフィンを固化させます。パラフィンが固まったら、パラフィンブロックを型から取り出し、余分なパラフィンを切り取ります。
- パラフィンブロックをミクロトームに取り付けます。厚さ5μmの切片を切って温水浴(42-45°C)に浮かべて平らにします。切片を慎重にスライドガラスに移し、スライドウォーマーで乾かします。
- スライドをキシレンに2 x 5分間浸すことにより、切片を脱パラフィンします。一連の等級付けされたエタノールで再水和します:100%エタノールを2 x 3分間。95%エタノールを3分間;70%エタノールを3分間。蒸留水ですすいでください。
- ヘマトキシリンで5分間染色します。その後、水道水で5分間すすぎます。1%酸性アルコールで数秒間分化します。水道水で5分間すすぎます。0.2%アンモニア水に青色で30秒間置きます。水道水で5分間すすぎます。エオシンで2分間染色します。等級付けされたエタノールによる脱水:70%エタノールを1分間。95%エタノールを1分間;100%エタノールを2 x 1分間。キシレンで2 x 1分間透明にします。
- 染色した切片に埋込剤を一滴加えます。次に、気泡を避けて、ティッシュ部分にカバースリップを置きます。染色切片を光学顕微鏡で観察します。
- 蛍光染色
- ステップ4.3.1で説明されているように、脱パラフィンと再水和を実行します。を 4.3.4 に更新します。
- 抗原賦活化溶液を電子レンジで予熱します。スライドを加熱した抗原賦活化溶液に入れ、沸騰以下の温度で20分間維持します。スライドを抗原賦活化溶液中で40分間冷却します。スライドを脱イオン水で5分間すすぎます。
- スライドをメタノール中の0.3%過酸化水素で10分間インキュベートし、内因性ペルオキシダーゼ活性をクエンチします。スライドをPBSで3 x 5分間すすぎ、加湿チャンバー内の室温でブロッキング溶液に1時間インキュベートします。余分なブロッキング溶液を軽くたたいますが、すすぎないでください。
- 一次抗体をブロッキング溶液で希釈し、製造元の指示に従ってください。希釈した一次抗体を組織切片にアプライし、加湿チャンバー内で4°Cで一晩インキュベートします。
- スライドをPBSで3 x 5分間洗浄します。HRP標識二次抗体をブロッキング溶液で希釈し、製造元の指示に従ってください。希釈した二次抗体を組織切片にアプライし、加湿チャンバー内で室温で1時間インキュベートします。スライドをPBSで3 x 5分間洗浄し、結合していない二次抗体を除去します。
- キットの指示に従って、フルオレセインチラミドの作業溶液を調製します。作業溶液を組織切片に塗布し、加湿チャンバー内で室温で15分間インキュベートします。スライドをPBSで3 x 5分間すすぎます。
- 手順4.4.1を繰り返します。4.4.5 まで、3 つの抗体すべてで染色が完了します。DAPIを含む蛍光封入剤を各組織切片に一滴塗布します。気泡を避けるために、ティッシュ部分にカバースリップを慎重に置きます。スライド倒立共焦点顕微鏡を調べます。
- 定量PCR
- 手順4.2.1の説明に従ってオルガノイドを収集します。を 4.2.3 に設定します。PBSを吸引し、製造元の指示に従ってオルガノイドから全RNAを抽出します。
- 市販の逆転写キットを使用して、1 μgの全RNAからcDNAを合成します。キットメーカーのプロトコルに従ってq-PCR反応を設定します。q-PCRに用いるプライマー配列については 、Table of Materials をご参照ください。
5. ラット子宮内膜オルガノイドの長期培養
- REEMを吸引し、オルガノイド採取液1 mLを40分間加えてオルガノイドを解離します。オルガノイドの完全性を維持するために、氷上でインキュベートします。
- インキュベーション後、パスツールピペットを使用してオルガノイドを回収し、300 × g で4°Cで3分間遠心分離して、さらに処理するためにペレット化します。
注:ピペットチップのトリミングは、より大きなオルガノイド(500 μm以上)を損傷することなく取り扱うのに役立ちます。 - ペレット化したオルガノイドをMatrigelに1:2または1:3の比率で再懸濁し、12ウェルプレートに包埋し、その後培養します。
- 凍結ストック溶液を調製します:10%DMSOでREEM。
- オルガノイドを採取し、冷凍ストック溶液に再懸濁した後、-80°Cの冷凍庫または液体窒素で長期保存します。
- 凍結したオルガノイドを解凍するには、REEMを37°Cのウォーターバスで予温し、凍結したストックチューブをウォーターバスに浸してオルガノイドを静かに解凍します。
- 解凍後、オルガノイドを500 μLのマトリゲルに再懸濁し、12ウェルプレートに再包包して培養します。手順 4.1.2 に従います。を 4.1.3 に設定します。
注:凍結オルガノイドは-80°Cで短時間保存するか、液体窒素に移して長期保存することをお勧めします。
6. オプション:オルガノイドの接着培養への移行
注:このプロトコルでは、オルガノイドを接着培養に移行することにより、オルガノイドの形態の再構築を可能にする、フラット培養されたreESCを得るための代替方法が言及されています。
- REEMを吸引し、オルガノイドハーベスティング溶液1 mLを加えてオルガノイドを解離します。オルガノイドの完全性を維持するために、氷上でインキュベートします。
- インキュベーション後、パスツールピペットを使用してオルガノイドを回収し、遠心分離機にかけ、300 × g で4°Cで3分間ペレット化します。
- オルガノイドを予熱したREEM3 mLに再懸濁し、再懸濁したオルガノイドを3.5 cmの皿に移します。REEMメディアは2日ごとに交換してください。
- 細胞が70%のコンフルエント度に達したら、0.25%トリプシン/ 1 mM EDTAで5〜6分間消化します。
- reESCを使用してオルガノイドを再構築するには、手順4.1.1から4.1.3に従います。
7. オルガノイドとエストラジオール(E2)とプロゲステロン(P4)による逐次培養
- E2 およびP4 のストック溶液をDMSOで調製します。ストック溶液を所望の使用濃度(E2:10 nM;P4: 1 μM) を REEM で検出し、最終 DMSO 濃度が 0.1% を超えないようにして、細胞毒性の影響を回避します。
- ステップ4.1.1としてREEMでオルガノイドを培養します。を 4.1.3 に設定します。4日間。培地をE2 を添加したREEMと交換し、7日間培養します。オルガノイドの成長と形態を毎日監視します。2〜3日ごとに媒体を交換してください。
- メディウムをE2 およびP4を追加したREEMと交換します。オルガノイドの成長と形態を毎日監視します。2〜3日ごとに媒体を交換してください。オルガノイドを7日間培養し続けます。
結果
reESCとラット子宮オルガノイドは、 図1に概説したプロトコルに従って、体重200 gから250 gの6匹の雌Sprague-Dawleyラットから確立されました。ヒト子宮内膜上皮幹細胞の長期培養の成功を受けて、REEM製剤は主にY27632、A8301、およびCHIR99021で構成されていました。 in vitroでreESCを安定化するために、最初に酵素的および機械的手法を使用してラット子宮内膜から子宮内膜細胞を単離しました。 図2A のフローサイトメトリー解析により、初代子宮内膜細胞は、CD9を発現する上皮細胞の約50%(49.8%)で構成され、EpCAM細胞(4.49%)およびCD24(2.64%)のレベルが低いことが明らかになりました。reESCのSSEA-1マーカーは6.58%に存在し、内皮マーカーCD31(30.9%)とCD45(70.3%)は比較的高かった。
しかし、REEMで培養すると、P1 reESCは均一な渦巻き状または多面体の形態を示し、コンパクトなクローン構造を形成しました(図2D)。REEMから個々の要因を徐々に取り除くと、reESCの増殖能力がそれに応じて減少しました。クローン形成アッセイは、reESCの安定培養におけるY27632の重要な役割を強調しました(図2B、C)。3回目の継代までに、reESCはSSEA-1とCytokeratinの一貫した発現を示し、培養中の一次reESCの増殖が成功したことを示しています(図2F)。さらに、reESCは後期通過時でも堅牢で安定した増殖能力を維持し(図2E)、現在のREEMシステムでの分離と拡張に成功していることを示しています。
オルガノイド培養は、以前に報告されたヒト子宮内膜幹細胞8に由来するシステムに従って確立されました。3日以内に、reESCは中心が空洞を持つオルガノイド様構造に急速に自己組織化し、その後、サイズと厚さが増加しました( 図3Aを参照)。reESCによるオルガノイドの形成を示す典型的なHE染色結果を 図3Bに示します。これらのオルガノイド培養は、直接継代サイクルと凍結融解サイクルの両方に続くKi67染色によって示される高い細胞生存率によって証明されるように、継代を通じて維持することができます。さらに、第10世代のオルガノイドに対してHE染色を行ったところ、オルガノイドの構造をそのまま維持できることが示されました( 図3E参照)。さらに、qPCRの結果は、Nanog、Sox2、およびOct4がP1世代と同等のレベルで発現していることを示しました(図3F)。この知見は、現在のシステム内でオルガノイドを長期培養できる可能性を示唆しています。
私たちの研究では、ラットの子宮様構造のE2 およびP4に対する応答について予備調査を行いました。 図4A の免疫蛍光染色により、エストロゲン受容体とプロゲステロン受容体の存在が明らかになりました。E2 の補給後、これらのオルガノイドは、中空の球形からより密集した内部成長パターンに移行しました(図4C)。その後のP4 への曝露は、緻密な構造の透過性の低下につながり、最終的にはそれらの崩壊をもたらしました(図4B)。これらの知見は、E2 がラットの子宮様構造のさらなる分化を促進する可能性があるのに対し、P4 はアポトーシス経路を誘発する可能性があることを示唆しています。
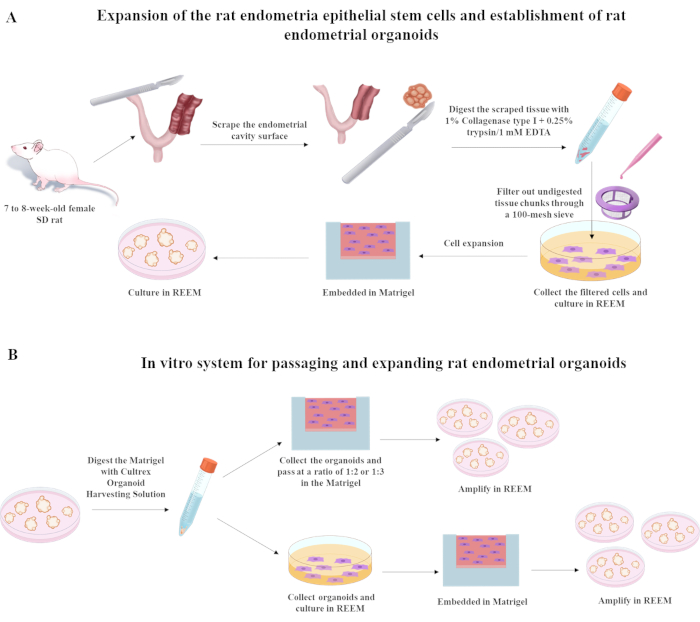
図1:ラット子宮内膜上皮幹細胞およびラット子宮オルガノイドの樹立に用いた手順。 略語:SD = Sprague-Dawley。 この図の拡大版を表示するには、ここをクリックしてください。
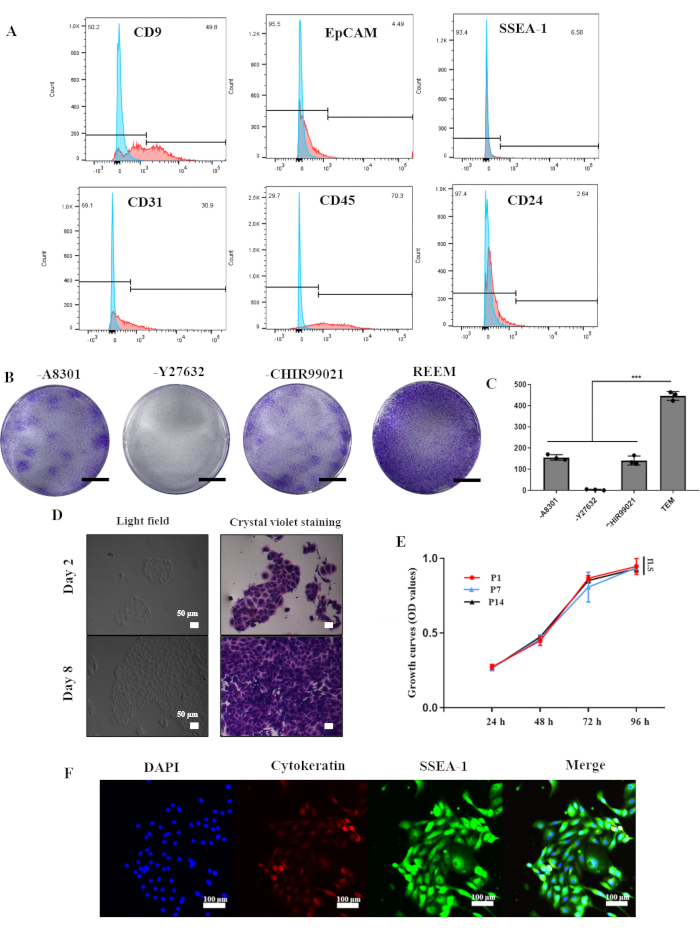
図2:ラット子宮内膜上皮幹細胞の in vitroでの作製と長期培養 (A)ラット子宮内膜の陽性細胞の割合を示すフローサイトメトリー解析。(B)A8301、Y27632、またはCHIR99021の有無にかかわらず、REEM中のクローンの結晶紫色染色。スケールバー = 1 cm. (C) 因子の有無にかかわらず、REEMのクローン番号。エラーバーは標準偏差を表します。n = 3 人のドナー (***, p<0.001)。(D)結晶紫色染色の有無にかかわらず、P1ラット子宮内膜上皮幹細胞の光学顕微鏡画像。(E)継代1、継代7、および継代14でのラット子宮内膜上皮幹細胞のCCK-8分析。エラーバーは標準偏差、n = 3を表します。(F)サイトケラチンとSSEA-1の発現を示す免疫蛍光分析。略語:REEM = reESCの拡張媒体。 この図の拡大版を表示するには、ここをクリックしてください。
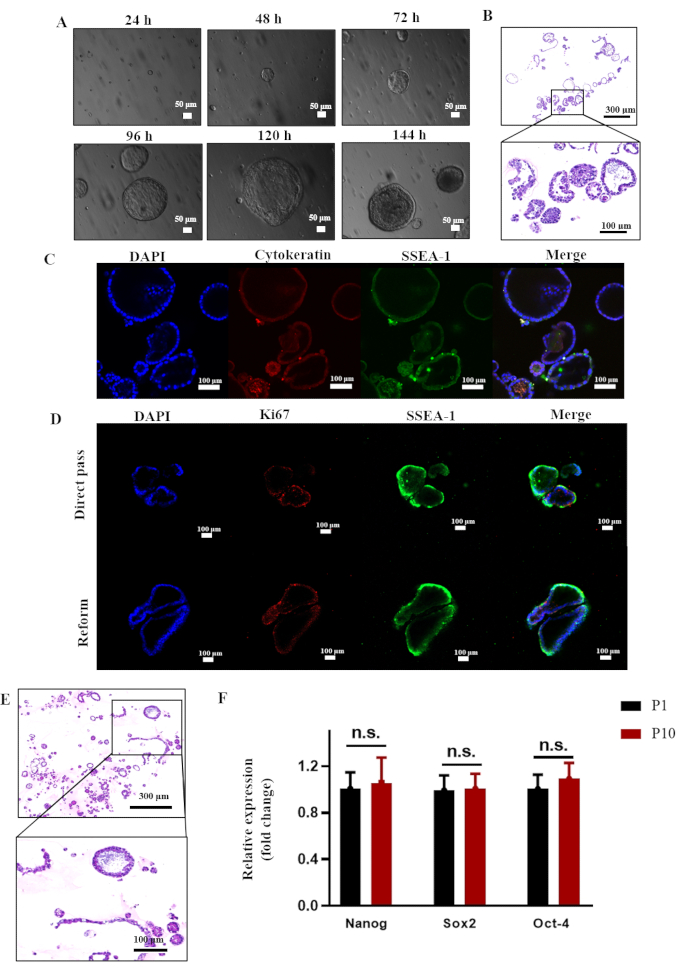
図3:ラット子宮内膜オルガノイドのin vitroでの作製と長期培養 。 (A)P1ラット子宮内膜オルガノイドの光学顕微鏡画像。(B)ラット子宮内膜上皮幹細胞由来のP1オルガノイドのH&E染色。(C)サイトケラチンとSSEA-1の発現を示す免疫蛍光分析。(D)Ki67およびSSEA-1の発現を示す免疫蛍光分析。(E)P 10ラットオルガノイドのH&E染色。(F)P1およびP10ラット子宮内膜オルガノイドにおけるNanog、Sox2、およびOct-4の発現に関するqPCR解析。GAPDH に正規化された式 (n = 3、両側の対応のない t 検定、n.s. = 有意ではない)。略語:H&E =ヘマトキシリンとエオシン。 この図の拡大版を表示するには、ここをクリックしてください。
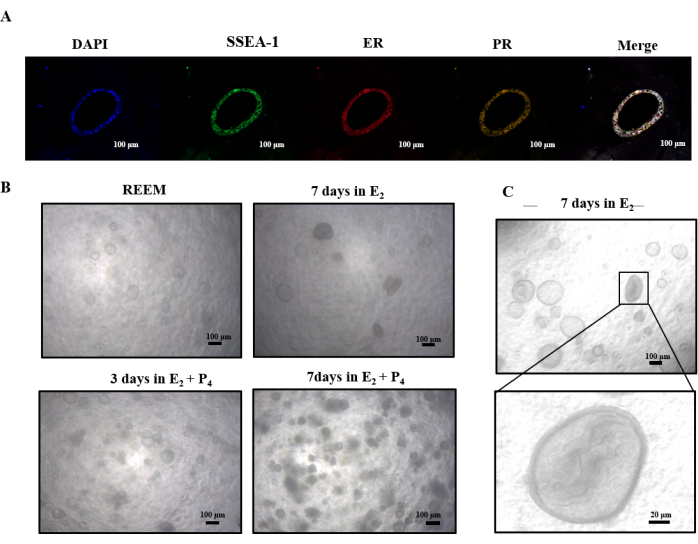
図4:E2 およびP4によるオルガノイドの逐次培養 (A)エストロゲン受容体、プロゲストーゲン受容体、およびSSEA-1の発現を示す免疫蛍光分析。(B)E2 およびP4で培養したラットオルガノイドの光学顕微鏡画像の概要。(C)光学顕微鏡画像は、E2で7日間培養した後、オルガノイドの内部空洞内で中空の球体が緻密に変化することを示しています。略語:ER =エストロゲン受容体;PR = プロゲストゲン受容体。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、ラット子宮内膜上皮幹細胞(reESC)を単離・培養する簡便な方法について説明し、ヒト子宮内膜上皮幹細胞8のex vivo系を改良した。私たちのアプローチでは、Y27632、A8301、CHIR99021をコア成分とする低分子培地を活用し、安定的かつ長期的なex vivo培養を可能にします。さらに、reESCを用いてラット子宮内膜オルガノイドをリアルタイムに作製することに成功しました。この新しいシステムは、通常組織ブロックに依存する現在の子宮内膜オルガノイド培養法を簡素化し、それによって細胞系統10に関するより明確な情報を提供します。重要なことに、私たちのシステムは、特定の遺伝子を発現するオルガノイドを生成するために、細胞レベルでの遺伝子編集やその他の操作を容易にします。さらに、このオルガノイドシステムは、ラット子宮内膜における特定の遺伝子の標的ノックアウトまたは過剰発現を可能にし、子宮内膜上皮幹細胞のスクリーニングと培養を可能にし、子宮内膜オルガノイドを作製することを可能にします。この包括的な研究アプローチにより、in vivoとex vivoの両方の観点から特定の遺伝子機能を解明し、子宮内膜上皮に関連する疾患の研究に道を開きます。
薬物スクリーニングは、オルガノイドの重要なアプリケーションです。しかし、現在のオルガノイドの供給源と調製方法は複雑であり、バッチ間で大きなばらつきがあり、薬物スクリーニング研究の結果に影響を与える可能性があります11,12。私たちのシステムは、安定したex vivo培養細胞株に由来するオルガノイドが、形成されたオルガノイド間の違いを効果的に最小限に抑え、実験セットアップの均一性を高めることができることを示しています。さらに、reESCによって形成されたラットオルガノイドは、in vitroでエストロゲン刺激に応答する能力を示しており、形態学的変化をもたらすことから、ex vivoでの薬物スクリーニングのツールとして利用できることが示唆されています。reESCは、ヒト子宮内膜上皮幹細胞と比較して、子宮内膜組織から容易に分離し、より少ない低分子でex vivoで増殖させることができます。この特性は、幹細胞の特性、前駆細胞、分化プロセス、微小環境相互作用の研究に特に役立ちます。重要なことは、このアプローチをサル、ブタ、イヌなどの他の哺乳類種に外挿できるため、子宮内膜の生物学、機能、疾患、薬物反応を研究するためのより生理学的に関連性のあるモデルとして機能する子宮内膜オルガノイド培養システムの確立が可能になることです。その利点にもかかわらず、この手法には制限があります。大きな制限の1つは、複雑で変動する細胞外マトリックスであるMatrigelに依存しているため、実験間に不整合が生じる可能性があることです。さらに、ラットモデルは貴重な洞察を提供しますが、種間の違いはまだ存在し、調査結果は人間の子宮内膜の生理学や病理に完全には変換されない可能性があります。今後の研究では、これらの制限に対処することを目指すべきであり、潜在的には、より明確で一貫性のある細胞外マトリックスの開発を通じて、また、このモデルの他の種への適用可能性を探ることによって、この限界に対処することを目指すべきである。
その利点にもかかわらず、この手法には制限があります。大きな制限の1つは、複雑で変動する細胞外マトリックスであるMatrigelに依存しているため、実験間に不整合が生じる可能性があることです。したがって、この研究の重要な手法は、マトリゲルの除去です。穏やかなマトリックスゲル消化剤の使用、氷上での操作の確保、および十分な消化時間が成功のために重要です。パスツールピペットは直径が大きいため、パスツールピペット吸引を使用すると、オルガノイドへの損傷を減らし、マトリックスゲルの消化を促進することができます。その後の研究では、オルガノイドの培養および消化システムをさらに最適化するために、さまざまな細胞外マトリックスゲル培養方法を比較することができます。今後の研究では、これらの制限に対処することを目指すべきであり、潜在的には、より明確で一貫性のある細胞外マトリックスの開発を通じて、また、このモデルの他の種への適用可能性を探ることによって、この限界に対処することを目指すべきである。
既存の文献では、上皮オルガノイドの ex vivo 培養技術が説明されていますが、この研究では、透明細胞に由来するラット子宮内膜オルガノイドを培養および拡大するための、新しく、簡単で、容易に再現可能なシステムを示しています。この進歩は、女性の生殖生物学の分野における研究のペースを向上させる準備ができています。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、広東省基礎応用基礎研究財団(2023A1515110760)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Anti-CD15 (SSEA-1) | Abcam | ab135377 | Rabbit, 1:200 (IHC) |
| Anti-Estrogen Receptor alpha | Abcam | ab32063 | Rabbit, 1:200 (IHC) |
| Anti-pan Cytokeratin | Abcam | ab7753 | Mouse, 1:250 (IHC) |
| Anti-Progesterone Receptor | Abcam | ab101688 | Rabbit, 1:200 (IHC) |
| Anti-Ki67 | Abcam | ab279653 | Mouse, 1:250 (IHC) |
| A8301 | TargetMol | 909910-43-6 | |
| β-Estradiol | Merck | E8875 | |
| Cell Counting Kit-8 | Beyotime | C0038 | |
| CD9 | BioLegend | 109819 | 1:20 (FC), Pacific Blue |
| CD24 | BioLegend | 101806 | 1:20 (FC), FITC |
| CD31 | BioLegend | 303120 | 1:20 (FC), APC |
| CD45 | BioLegend | 301703 | 1:20 (FC), PE |
| CHIR99021 | TargetMol | CT99021 | |
| Cultrex Organoid Harvesting Solution | R&D Systems | 3700-100-01 | |
| Cy3 TSA Fluorescence System Kit | APExBIO | K1051 | |
| Cy5 TSA Fluorescence System Kit | APExBIO | K1052 | |
| DAPI | Sigma | D9542 | 1 μg/mL |
| DMEM/F-12 | Invitrogen | 11330032 | |
| EpCAM | BioLegend | 369803 | 1:20 (FC), PerCP |
| Fluorescein TSA Fluorescence System Kit | APExBIO | K1050 | |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11008 | 1:500 |
| Goat anti-Mouse IgG, Alexa Fluor 555 | Invitrogen | A-21422 | 1:500 |
| Goat Anti-rabbit IgG/HRP antibody | APExBIO | bs-0295G-HRP | |
| Knockout serum replacement | Invitrogen | 10828028 | |
| Matrigel | Corning | 356234 | |
| PrimeScript RT Master Mix | Takara | RR063A | |
| Progesterone | Merck | 57-83-0 | |
| Sprague-Dawley rat | Shanghai JieSiJie Laboratory Animals Co., LTD, China | ||
| SSEA-1 | BioLegend | 323047 | 1:20 (FC), APC |
| TB Green Fast qPCR Mix | Takara | RR820A | |
| TriZOL | Invitrogen | 15596026CN | RNA extraction |
| u-Slide 8-well plates | Ibidi | 80827 | |
| Y27632 | TargetMol | 146986-50-7 | |
| qPCR primers of target genes | |||
| Genes | Company | Sequences | |
| rat GAPDH F | Sangon biotech | GACATGCCGCCTGGAGAAAC | |
| rat GAPDH R | Sangon biotech | AGCCCAGGATGCCCTTTAGT | |
| rat Nanog F | Sangon biotech | GACTAGCAACGGCCTGACTCA | |
| rat Nanog R | Sangon biotech | CTGCAATGGATGCTGGGATA | |
| rat Sox2 F | Sangon biotech | ATTACCCGCAGCAAAATGAC | |
| rat Sox2 R | Sangon biotech | ATCGCCCGGAGTCTAGTTCT | |
| rat Oct4 F | Sangon biotech | CCCAGCGCCGTGAAGTTGGA | |
| rat Oct4 R | Sangon biotech | ACCTTTCCAAAGAGAACGCCCA GG |
参考文献
- Jabbour, H. N., Kelly, R. W., Fraser, H. M., Critchley, H. O. Endocrine regulation of menstruation. Endocr Rev. 27 (1), 17-46 (2006).
- Garcia-Alonso, L., et al. Mapping the temporal and spatial dynamics of the human endometrium in vivo and in vitro. Nat Genet. 53 (12), 1698-1711 (2021).
- Li, M., Izpisua Belmonte, J. C. Organoids - preclinical models of human disease. N Engl J Med. 380 (6), 569-579 (2019).
- Mulaudzi, P. E., Abrahamse, H., Crous, A. Insights on three dimensional organoid studies for stem cell therapy in regenerative medicine. Stem Cell Rev Rep. 20 (2), 509-523 (2024).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development. 144 (10), 1775-1786 (2017).
- Turco, M. Y., et al. Long-term, hormone-responsive organoid cultures of human endometrium in a chemically defined medium. Nat Cell Biol. 19 (5), 568-577 (2017).
- Tempest, N., Maclean, A., Hapangama, D. K. Endometrial stem cell markers: current concepts and unresolved questions. Int J Mol Sci. 19 (10), 3240 (2018).
- He, W., et al. Long-term maintenance of human endometrial epithelial stem cells and their therapeutic effects on intrauterine adhesion. Cell Biosci. 12 (1), 175 (2022).
- Katsuda, T., et al. Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity. Cell Stem Cell. 20 (1), 41-55 (2017).
- Murphy, A. R., Campo, H., Kim, J. J. Strategies for modelling endometrial diseases. Nat Rev Endocrinol. 18 (12), 727-743 (2022).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Esfandiari, F., et al. Endometriosis organoids: prospects and challenges. Reprod Biomed Online. 45 (1), 5-9 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved