Method Article
توليد وتوصيف عضيات الرحم في الفئران من الخلايا الجذعية الظهارية لبطانة الرحم للفئران
In This Article
Summary
هنا ، نقدم بروتوكولا لعزل واستزراع الخلايا الجذعية الظهارية لبطانة الرحم للفئران (reESCs) ، مما يؤدي إلى توليد عضيات بطانة الرحم للفئران. تسهل هذه الطريقة الدراسات المختبرية لأمراض بطانة الرحم ، مما يتيح تحرير الجينات والتلاعب الخلوي الآخر.
Abstract
تقدم عضيات بطانة الرحم رؤى قيمة حول تطور أمراض بطانة الرحم والفيزيولوجيا المرضية لها وتعمل كمنصات لاختبار الأدوية. بينما تم تطوير عضيات بطانة الرحم البشرية والفئران ، لا تزال الأبحاث حول عضيات بطانة الرحم في الفئران محدودة. بالنظر إلى أن الفئران يمكنها محاكاة بعض أمراض بطانة الرحم بشكل أفضل ، مثل الالتصاقات داخل الرحم ، تهدف هذه الدراسة إلى إنشاء عضيات بطانة الرحم للفئران. نقدم بروتوكولا مفصلا لعزل واستزراع الخلايا الجذعية الظهارية لبطانة الرحم للفئران (reESCs) وتوليد عضيات بطانة الرحم في الفئران. باستخدام وسيط توسيع reESCs المكرر ، نجحنا في عزل وتوسيع reESCs بشكل مستقر ، مما يدل على إمكاناتها الثقافية على المدى الطويل. أظهرت العضيات التي تم إنشاؤها بواسطة reESC خصائص هيكلية ووظيفية نموذجية لبطانة الرحم ، بما في ذلك استجابة الهرمونات. أظهرت نتائجنا أنه يمكن استزراع عضيات بطانة الرحم في الفئران على المدى الطويل مع انتشار مستقر ، والحفاظ على البنية الغدية ، وقطبية الخلية ، والخصائص الوظيفية لظهارة بطانة الرحم. يوفر هذا النموذج العضوي الجديد المشتق من الفئران منصة قيمة لدراسة أمراض بطانة الرحم واختبار التدخلات العلاجية ، مع التطبيقات المحتملة عبر أنواع الثدييات المختلفة.
Introduction
تخضع بطانة الرحم ، وهي نسيج متعدد الاستخدامات ومتجدد في جسم الإنسان ، لسفط دوري وتجديد وتمايز تحت تأثير هرمونات المبيض1. ترتبط التشوهات في بطانة الرحم بأمراض الجهاز التناسلي الأنثوية المختلفة ، مثل الانتباذ البطاني الرحمي وسرطان بطانة الرحم والعقم2. يعيق الافتقار إلى نماذج بحثية موثوقة لبطانة الرحم الدراسات المتعمقة للتسبب في هذه الأمراض والتشخيص السريري وعلاجها. في حين أن خطوط الخلايا والنماذج الحيوانية تستخدم بشكل شائع لأبحاث بطانة الرحم ، فإن التحديات مثل عدم استقرار النمط الظاهري في خطوط الخلايا ، والاختلافات بين الأنواع في النماذج الحيوانية ، والقيود الأخرى تجعل من الصعب تكرار البنية الفسيولوجية المعقدة والتغيرات الوظيفية الديناميكية في بطانة الرحم البشرية3.
العضيات هي هياكل ثلاثية الأبعاد تتكون من زراعة الخلايا الجذعية في بيئة خارج الخلية ، وتمتلك قدرات التجديد الذاتي والتنظيم الذاتي. يمكنهم تقليد بنية ووظيفة الأنسجة الفسيولوجية والمرضية ويتم التعرف عليهم كنماذج قبل سريرية للأمراض البشرية4. في عام 2017 ، تم تحقيق بناء ناجح لعضيات بطانة الرحم الفئرانية والبشرية من خلال تضمين أنسجة بطانة الرحم الحرة المجزأة التي تم الحصول عليها من خلال الهضم الأنزيمي في سقالة مصفوفة خارج الخلية ، متبوعة بإضافة مزيج من عوامل النمو المحددة وعوامل الإشارات للزراعة5. أظهرت النتائج أن عضيات بطانة الرحم خارج الجسم الحي تظهر قدرة تكاثرية طويلة الأمد ومستقرة ، مما يحافظ على البنية الغدية ، وقطبية الخلية ، والخصائص الوظيفية لظهارة بطانة الرحم ، بما في ذلك إفراز المخاط والاستجابة الهرمونية6. ومع ذلك ، فإن الثقافة خارج الجسم الحي للخلايا الجذعية البالغة التي تشكل عضيات بطانة الرحم تتطلب دعما هيكليا يشبه الغدة ، مما يؤدي إلى تحديات مثل فقدان الجذع وصعوبات في المرور7.
حاليا ، تعتمد زراعة عضيات بطانة الرحم على طريقة ثقافة هضم كتلة الأنسجة. في دراسة سابقة ، قام فريق البحث لدينا بزراعة الخلايا الجذعية الظهارية لبطانة الرحم البشرية لفترة طويلة في المختبر باستخدام وسيط مزرعة أولي يتكون بشكل أساسي من Y27632 ، والذي استخدمناه لبناء عضيات بطانة الرحم8. بناء على هذا النجاح ، قمنا بعزل وزراعة الخلايا الجذعية الظهارية لبطانة الرحم من أنسجة بطانة الرحم في الفئران باستخدام وسط زراعة مركب جزيئي صغير ، مما أدى إلى إنشاء نظام زراعة مختبري طويل الأجل. علاوة على ذلك ، استخدمنا الخلايا الجذعية الظهارية لبطانة الرحم للفئران (reESCs) لتوليد عضيات بطانة الرحم للفئران. سيعزز تطوير هذا النموذج الدراسات المستقبلية في المختبر وفي الجسم الحي للأمراض المرتبطة ببطانة الرحم جنبا إلى جنب مع نماذج الفئران.
Protocol
تم استخدام ست فئران Sprague-Dawley البالغة من العمر 7/8 أسابيع تزن 200-250 جم في هذا العمل. تم إيواء الفئران في منشأة حيوانية يتم التحكم فيها بالمناخ مع إمكانية الوصول إلى الغذاء والماء. تم إجراء جميع الإجراءات التجريبية التي تشمل وفقا للإرشادات المؤسسية لرعاية واستخدام المختبر وتمت الموافقة عليها من قبل مجلس المراجعة المؤسسية للتجارب على في لجنة أخلاقيات البحث في مستشفى ميتشو الشعبي.
يوضح القسم التالي عملية عزل الخلايا الجذعية الظهارية لبطانة الرحم للفئران وتمريرها وتجميدها وإذابتها باستخدام وسيط تمدد reESCs المكرر (REEM) الذي يتكون بشكل أساسي من Y27632 و A8301 و CHIR9902178،9. تعتمد تركيبة REEM على DMEM / F12 الخالي من المصل المخصب بتركيزات محددة من المكونات الرئيسية: 10 ميكرومتر Y27632 ، و 3 ميكرومتر CHIR99021 ، و 0.5 ميكرومتر A8301. يمكن العثور على تفاصيل شاملة حول المكونات في جدول المواد. بمجرد تخدير الفئران باستنشاق الأيزوفلوران ، يجب تنفيذ الإجراءات اللاحقة الموضحة في الشكل 1 .
1. الإجراء الجراحي
- تخدير الفئران عن طريق استنشاق الأيزوفلوران.
- ضع الفئران في غرفة تحريض مملوءة ب 3-5٪ إيزوفلوران ممزوج بالأكسجين. تأكد من التخدير المناسب من خلال عدم وجود استجابة لقرصة إصبع القدم وفقدان المنعكس الصحيح.
- بمجرد التخدير ، حافظ على الفئران تحت 1-3٪ إيزوفلوران عبر مخروط الأنف أثناء العملية. ضع مرهما بيطري على العينين لمنع الجفاف أثناء وجود الجرذ تحت التخدير.
- قم بعمل شق خط وسط منخفض للبطن لكشف قرون الرحم.
ملاحظة: يجب تعقيم جميع الأدوات الجراحية قبل الاستخدام. يتم حلق المنطقة الجراحية على الفئران وتطهيرها بمحلول مطهر. يرتدي الجراح قفازات معقمة وقناعا وثوبا. يتم إجراء العملية الجراحية على ستارة معقمة. - قم بإجراء شقوق طولية على جانبي الرحم لكشف بطانة الرحم الداخلية. استخدم شفرة مشرط T10 لكشط بطانة الرحم حتى يصبح السطح خشنا.
- بعد العملية الجراحية ، انقل الفئران إلى منطقة تعافي معقمة ودافئة بمستويات منظمة لدرجة الحرارة والرطوبة وراقبها عن كثب حتى تستعيد وعيها الكامل ويمكنها دعم نفسها في وضع الاستلقاء القصي. مجموعات منزلية من ثلاثة فئران بعد الجراحة بشكل منفصل في أقفاص منفصلة. للتخفيف من آلام ما بعد الجراحة, إدارة المسكنات مثل البوبرينورفين (0.05-0.1 ملغ/كغ, تحت الجلد); كرر كل 8-12 ساعة لمدة تصل إلى 48-72 ساعة حسب الحاجة.
2. معالجة الأنسجة
- ضعي جميع شظايا بطانة الرحم في طبق 3.5 سم واغسليها 3 مرات باستخدام PBS.
- اخلطي شظايا بطانة الرحم مع 3 مل من الكولاجيناز 1٪ من النوع الأول (مخفف في 0.25٪ تريبسين / 1 ملي EDTA) عند 37 درجة مئوية لمدة 60 دقيقة. قم بتصفية الأنسجة غير المهضومة باستخدام مصفاة خلية 100 ميكرومتر لعزل المرشح وجمعه لمزيد من الزراعة.
- قم بزرع الخلايا المجمعة في 12 لوحة بئر في وسط REEM لمزيد من الزراعة. احسب حجم تعليق الخلية اللازم لزرع الخلايا في كل بئر من الصفيحة المكونة من 12 بئرا لتحقيق كثافة الخلية المطلوبة (عادة ~ 1-2 × 105 خلايا / بئر في 1.5 مل من REEM).
- اغسل الخلايا التي تم جمعها في الخطوة 2.2 لمدة 3 أضعاف باستخدام برنامج تلفزيوني. بعد الغسيل الأولي ، قم بالطرد المركزي للخلايا عند 300 × جم لمدة 5 دقائق. تجاهل الطافف. أعد تعليق حبيبات الخلية في PBS التي تحتوي على 1٪ BSA (ألبومين مصل الأبقار) لتقليل الارتباط غير المحدد واحتضانه لمدة 15-30 دقيقة على الجليد.
- احتضان الخلايا بالأجسام المضادة الأولية الخاصة بعلامات مختلفة (انظر جدول المواد) لمدة 30 دقيقة إلى ساعة واحدة عند 4 درجات مئوية. قم بتخفيف الأجسام المضادة في PBS بنسبة 1٪ BSA وفقا لتعليمات الشركة المصنعة.
- بعد الحضانة ، اغسل الخلايا 2x باستخدام PBS لإزالة أي أجسام مضادة غير مرتبطة. بعد الغسيل النهائي ، أعد تعليق الخلايا في 600 ميكرولتر من PBS مع 1٪ BSA لتحليل قياس التدفق الخلوي.
- قم بتكوين الجهاز باستخدام الليزر والمرشحات المناسبة للفلوروفورات المستخدمة في التجربة (على سبيل المثال ، FITC ، PE ، APC). استخدم إعدادات التشتت الأمامي (FSC) والمبعثر الجانبي (SSC) لتشغيل مجموعة الخلية المفردة الحية، باستثناء الحطام ومجاميع الخلايا. قم بمعايرة مقياس التدفق الخلوي باستخدام عنصر تحكم غير ملوث لضمان المحاذاة المناسبة. قم بتعيين بوابات محددة بناء على عنصر التحكم غير الملوثة لتحديد مجموعات سكانية إيجابية لكل علامة اهتمام (العتبة هي 0.02٪).
3. ثقافة طويلة الأمد للخلايا الجذعية الظهارية لبطانة الرحم للفئران
- مقايسة تكوين المستعمرة
ملاحظة: ساعد هذا الاختبار في تحديد وسيط الاستزراع الأمثل ل reESCs.- قم بزرع P0 reESCs في ألواح مكونة من 6 آبار بكثافة 1,000 خلية / بئر وزرعها لمدة 14 يوما إما في REEM أو REEM تفتقر إلى A8301 أو Y27632 أو CHIR99021.
- بعد فترة الثقافة ، قم بتثبيت الخلايا بنسبة 4٪ بارافورمالدهيد لمدة 20 دقيقة في درجة حرارة الغرفة ثم تلطيخها بمحلول بنفسجي بلوري لمدة 20 دقيقة أخرى.
- تحديد عدد مجموعات الخلايا التي تحتوي على أكثر من 50 خلية. حدد وسط الثقافة بناء على الوسيط الذي يدعم نمو مجموعات الخلايا.
ملاحظة: أدى إغفال عوامل محددة من REEM إلى انخفاض القدرة التكاثرية ل reESCs (الشكل 1 ب ، ج). بناء على هذه النتائج ، تم اختيار REEM كوسيلة مفضلة لاستزراع reESCs لتحسين ظروف الاستزراع.
- قم بتغيير REEM كل يومين. عندما تصل الخلايا إلى التقاء 80-90٪ ، قم بهضمها باستخدام 0.25٪ تريبسين / 1 ملي مولار EDTA لمدة 5-6 دقائق.
- قم بتمرير الخلايا بنسبة 1: 3 في REEM.
- اختبار الانتشار
- قم بزرع ReESCs P1 و P7 و P14 في ألواح 96 بئرا بكثافة 4 × 103 خلايا / بئر في 150 ميكرولتر من REEM.
- أضف 10 ميكرولتر من كاشف CCK-8 إلى كل بئر بعد 24 و 48 و 72 و 96 ساعة من الثقافة ، متبوعا بحضانة لمدة ساعتين عند 37 درجة مئوية.
- حدد معدل الانتشار عن طريق قياس الامتصاص عند 450 نانومتر باستخدام قارئ صفيحة دقيقة.
- تحضير واستخدام المخزون المجمد
- تحضير محلول المرق المجمد باستخدام REEM مع 10٪ DMSO.
- احصد reESCs باستخدام 0.25٪ تريبسين / 1 ملي EDTA.
- أعد تعليق حبيبات الخلية في محلول مخزون مجمد بتركيز 1 × 106 خلايا / مل. نقل تعليق الخلية إلى أنابيب.
- قم بتجميد الأنابيب أولا عند -80 درجة مئوية ثم انقلها إلى النيتروجين السائل في غضون 24 ساعة.
ملاحظة: إذا كنت تنوي إذابة الخلايا قريبا ، فمن المستحسن تخزين الخلايا المجمدة عند -80 درجة مئوية لمدة أقصاها 6 أشهر. - قم بتسخين REEM مسبقا إلى 37 درجة مئوية.
- استرجع reESCs المجمدة واغمرها في حمام مائي 37 درجة مئوية لمدة 1-2 دقيقة.
- انقل reESCs المذابة إلى ألواح مكونة من 6 آبار بكثافة بذر تبلغ 1 × 105 خلايا / بئر في REEM.
- تلطيخ التألق المناعي
- إعادة بناء البذور في مرحلة النمو اللوغاريتمي على ألواح u-Slide المكونة من 8 آبار بكثافة 2 × 103 خلايا لكل بئر ، وزراعتها في REEM.
- عندما تصل reESCs إلى 90٪ من التقاء ، قم بإصلاحها بنسبة 4٪ بارافورمالدهايد لمدة 20 دقيقة. اغسل reESCs باستخدام PBS 2x قبل التثبيت وبعده.
- تخلل الخلايا باستخدام 0.2٪ Triton X-100 لمدة 10 دقائق.
- قم بسد الخلايا بمصل الماعز بنسبة 30٪ مخفف في 5٪ من ألبومين مصل الأبقار (BSA) لمدة 30 دقيقة في درجة حرارة الغرفة. اغسل reESCs باستخدام PBS 2x قبل وبعد الحظر.
- احتضان الخلايا بالأجسام المضادة الأولية (مضاد ل SSEA-1 ومضاد السيتوكيراتين) لمدة 12 ساعة عند 4 درجات مئوية. اغسل reESCs باستخدام PBS 2x بعد الحضانة.
- احتضان الخلايا بالأجسام المضادة الثانوية لمدة 1 ساعة في درجة حرارة الغرفة. اغسل reESCs باستخدام PBS 2x بعد الحضانة.
- قم بتلطيخ الخلايا ب 150 ميكرولتر من DAPI لتسمية جميع النوى.
- التقط صورا للخلايا الملطخة باستخدام مجهر متحد البؤر المقلوب.
4. إنشاء عضيات بطانة الرحم للفئران من reESCs
- توليد العضيات
- عندما تصل reESCs إلى 70٪ من التقاء ، قم بهضم الخلايا بنسبة 0.25٪ تريبسين / 1 ملي EDTA لمدة 5-6 دقائق.
- أعد تعليق 5 × 105 reESCs في 500 ميكرولتر من Matrigel المذاب وضعها في 12 بئر لوحة. احتضان الألواح عند 37 درجة مئوية لمدة 20 دقيقة للسماح بالهلام.
- بمجرد أن يتجمد خليط الخلية و Matrigel ، أضف 1.5 مل / بئر REEM لتغطية Matrigel. قم بتغيير REEM كل 2-3 أيام.
- تلطيخ التألق المناعي
- استنشق REEM وأضف 1 مل / بئر من محلول الحصاد العضوي المبرد مسبقا في الألواح المكونة من 12 بئرا. احتضن على الجليد لمدة 40-60 دقيقة.
- اجمع العضيات باستخدام ماصة باستور وجهاز طرد مركزي عند 300 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- اشطف العضيات 2-3x باستخدام PBS.
- قم بإصلاح العضيات بنسبة 4٪ بارافورمالدهيد لمدة 20 دقيقة وقم بتثبيتها باستخدام 5٪ BSA لمدة 60 دقيقة.
ملاحظة: اغسل 2x باستخدام PBS قبل وبعد كل خطوة. - احتضان العضيات طوال الليل عند 4 درجات مئوية مع الأجسام المضادة الأولية المخففة في 1٪ BSA.
- احتضان العضيات بالأجسام المضادة الثانوية لمدة 1 ساعة في درجة حرارة الغرفة.
- قم بمضاد للعضيات ب 200 ميكرولتر من DAPI.
- التقط الصور باستخدام مجهر متحد البؤر المقلوب.
- تلطيخ
- تجفيف العضيات من خلال سلسلة الإيثانول المتدرجة: 70٪ إيثانول لمدة 30 دقيقة ؛ 80٪ إيثانول لمدة 30 دقيقة ؛ 95٪ إيثانول لمدة 30 دقيقة ؛ 100٪ إيثانول لمدة 2 × 30 دقيقة. قم بتنظيف العضيات عن طريق غمرها في الزيلين لمدة 2 × 30 دقيقة.
- اغمر العضيات التي تم تطهيرها في البارافين المذاب عند 60 درجة مئوية لمدة 1 ساعة. انقل العضيات المتسربة بالبارافين إلى قوالب التضمين ، واملأ القوالب بالبارافين المذاب ، وضع القوالب في طبق بارد حتى يتجمد البارافين. قم بإزالة كتل البارافين من القوالب بعد تصلب البارافين وتقليم البارافين الزائد.
- قم بتركيب كتل البارافين على الميكروتوم. قم بقص أقسام بسمك 5 ميكرومتر وقم بتعويمها في حمام مائي دافئ (42-45 درجة مئوية) لتسطيحها. انقل الأقسام بعناية إلى شرائح زجاجية وجففها على جهاز تسخين شرائح.
- قم بإزالة الأقسام عن طريق غمر الشرائح في الزيلين لمدة 2 × 5 دقائق. أعد الترطيب من خلال سلسلة من الإيثانول المتدرج: 100٪ إيثانول لمدة 2 × 3 دقائق ؛ 95٪ إيثانول لمدة 3 دقائق ؛ 70٪ إيثانول لمدة 3 دقائق ؛ اشطفها بالماء المقطر.
- وصمة عار مع الهيماتوكسيلين لمدة 5 دقائق ؛ ثم اشطفها بماء الصنبور الجاري لمدة 5 دقائق. التفريق في 1٪ الكحول الحمضي لبضع ثوان; اشطفها بماء الصنبور الجاري لمدة 5 دقائق ؛ توضع باللون الأزرق في ماء الأمونيا بنسبة 0.2٪ لمدة 30 ثانية ؛ اشطفها بماء الصنبور الجاري لمدة 5 دقائق ؛ وصمة عار مع اليوزين لمدة 2 دقيقة. التجفيف من خلال الإيثانول المتدرج: 70٪ إيثانول لمدة 1 دقيقة ؛ 95٪ إيثانول لمدة 1 دقيقة ؛ 100٪ إيثانول لمدة 2 × 1 دقيقة. نظف في الزيلين لمدة 2 × 1 دقيقة.
- أضف قطرة من وسط التثبيت إلى الأقسام الملطخة. ثم ضع غطاء فوق قسم الأنسجة ، وتجنب فقاعات الهواء. راقب الأقسام الملطخة تحت المجهر الضوئي.
- تلطيخ مضان
- قم بإجراء إزالة البارافينات وإعادة الجفاف كما هو موضح في الخطوات 4.3.1. إلى 4.3.4.
- سخن محلول استرجاع المستضد في فرن الميكروويف. ضع الشرائح في محلول استرجاع المستضد الساخن واحتفظ بها في درجة حرارة الغليان لمدة 20 دقيقة. اترك الشرائح لتبرد في محلول استرجاع المستضد لمدة 40 دقيقة. اشطف الشرائح بالماء منزوع الأيونات لمدة 5 دقائق.
- احتضان الشرائح في 0.3٪ بيروكسيد الهيدروجين في الميثانول لمدة 10 دقائق لإخماد نشاط البيروكسيديز الداخلي. اشطف الشرائح لمدة 3 × 5 دقائق في PBS واحتضانها في محلول مانع لمدة ساعة واحدة في درجة حرارة الغرفة في غرفة رطبة. اضغط على محلول الحجب الزائد ولكن لا تشطفه.
- تمييع الجسم المضاد الأساسي في محلول الحجب وفقا لتعليمات الشركة المصنعة. ضع الجسم المضاد الأولي المخفف على أقسام الأنسجة واحتضنه طوال الليل عند 4 درجات مئوية في غرفة رطبة.
- اغسل الشرائح لمدة 3 × 5 دقائق في PBS. قم بتخفيف الجسم المضاد الثانوي المترافق ب HRP في محلول الحجب وفقا لتعليمات الشركة المصنعة. ضع الجسم المضاد الثانوي المخفف على أقسام الأنسجة واحتضنه لمدة ساعة واحدة في درجة حرارة الغرفة في غرفة مرطبة. اغسل الشرائح لمدة 3 × 5 دقائق في PBS لإزالة الجسم المضاد الثانوي غير المرتبط.
- قم بإعداد محلول عمل الفلورسين التيراميد وفقا لتعليمات المجموعة. ضع محلول العمل على أقسام الأنسجة واحتضانه لمدة 15 دقيقة في درجة حرارة الغرفة في غرفة رطبة. اشطف الشرائح لمدة 3 × 5 دقائق في PBS.
- كرر الخطوة 4.4.1. إلى 4.4.5 حتى يكتمل التلوين بجميع الأجسام المضادة الثلاثة. ضع قطرة من وسط التثبيت الفلوري باستخدام DAPI على كل قسم من أقسام الأنسجة. ضع غطاء بعناية فوق قسم المناديل لتجنب فقاعات الهواء. افحص المجهر متحد البؤر المقلوب للشرائح.
- PCR الكمي
- اجمع العضيات كما هو موضح في الخطوات 4.2.1. إلى 4.2.3. استنشق PBS واستخرج إجمالي الحمض النووي الريبي من العضيات باتباع تعليمات الشركة المصنعة.
- استخدم أي مجموعة نسخ عكسي متوفرة تجاريا لتصنيع (كدنا) من 1 ميكروغرام من إجمالي الحمض النووي الريبي. قم بإعداد تفاعل q-PCR وفقا لبروتوكول الشركة المصنعة للمجموعة. انظر جدول المواد للتسلسلات التمهيدية المستخدمة في q-PCR.
5. ثقافة طويلة الأمد لعضيات بطانة الرحم في الفئران
- استنشق REEM وأضف 1 مل من محلول الحصاد العضوي لمدة 40 دقيقة لفصل العضيات. احتضن الثلج للحفاظ على سلامة العضوية.
- بعد الحضانة ، اجمع العضيات باستخدام ماصة باستور وجهاز طرد مركزي عند 300 × جم لمدة 3 دقائق عند 4 درجات مئوية لتكويبها لمزيد من المعالجة.
ملاحظة: يمكن أن يكون تشذيب طرف الماصة مفيدا في التعامل مع العضويات الأكبر حجما (أكثر من 500 ميكرومتر) دون التسبب في تلف. - أعد تعليق العضيات المحببة في Matrigel ، بنسبة 1: 2 أو 1: 3 ، للتضمين والزراعة اللاحقة في ألواح ذات 12 بئرا.
- تحضير محلول المرق المجمد: REEM مع 10٪ DMSO.
- احصد العضيات ، وأعد تعليقها في محلول المرق المجمد ، ثم قم بتخزينها في الفريزر عند -80 درجة مئوية أو في النيتروجين السائل لحفظها على المدى الطويل.
- لإذابة العضيات المجمدة ، قم بتسخين REEM مسبقا في حمام مائي بدرجة حرارة 37 درجة مئوية ، واغمر أنبوب المخزون المجمد في الحمام المائي لإذابة العضيات برفق.
- بعد الذوبان ، أعد تعليق العضيات في 500 ميكرولتر من Matrigel لإعادة التضمين والزراعة في صفيحة من 12 بئرا. اتبع الخطوات 4.1.2. إلى 4.1.3.
ملاحظة: ينصح بتخزين العضيات المجمدة عند -80 درجة مئوية لفترات أقصر أو نقلها إلى النيتروجين السائل للتخزين على المدى الطويل.
6. اختياري: نقل العضيات إلى الثقافة الملتصقة
ملاحظة: يذكر البروتوكول طريقة بديلة للحصول على reESCs مسطحة عن طريق نقل العضيات إلى الثقافة الملتصقة ، مما يسمح بإعادة هيكلة مورفولوجيا العضوية.
- استنشق REEM وأضف 1 مل من محلول الحصاد العضوي لفصل العضيات. احتضن الثلج للحفاظ على سلامة العضوية.
- بعد الحضانة ، اجمع العضيات باستخدام ماصة باستور وجهاز طرد مركزي لحبيبها عند 300 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- أعد تعليق العضيات في 3 مل من REEM المسخن مسبقا وانقل العضيات المعلقة إلى طبق 3.5 سم. قم بتغيير وسائط REEM كل يومين.
- عندما تصل الخلايا إلى 70٪ من التقاء ، قم بهضمها باستخدام 0.25٪ تريبسين / 1 ملي EDTA لمدة 5-6 دقائق.
- أعد بناء العضيات باستخدام reESCs باتباع الخطوات 4.1.1 إلى 4.1.3.
7. الاستزراع المتسلسل للعضيات مع الاستراديول (E2) والبروجسترون (P4)
- إعداد حلول المخزون من E2 و P4 في DMSO. تمييع محاليل المخزون إلى تركيزات العمل المرغوبة (E2: 10 nM ؛ P4: 1 μM) في REEM ، مما يضمن أن تركيز DMSO النهائي لا يتجاوز 0.1٪ لتجنب التأثيرات السامة للخلايا.
- عضيات الاستزراع في REEM كخطوات 4.1.1. إلى 4.1.3. لمدة 4 أيام. استبدل الوسط ب REEM المكملة ب E2 والثقافة لمدة 7 أيام. راقب نمو العضيات ومورفولوجيتها يوميا. قم بتغيير الوسيط كل 2-3 أيام.
- يستعاض عن الوسيط ب REEM المكملة بالهاء2 وP4. راقب نمو العضيات ومورفولوجيتها يوميا. قم بتغيير الوسيط كل 2-3 أيام. استمر في زراعة العضيات لمدة 7 أيام.
النتائج
تم إنشاء reESCs وعضيات رحم الفئران من ست إناث فئران Sprague-Dawley يتراوح وزنها بين 200 جم و 250 جراما باتباع البروتوكول الموضح في الشكل 1. بالاعتماد على نجاح الثقافة طويلة الأمد للخلايا الجذعية الظهارية لبطانة الرحم البشرية ، تتكون تركيبة REEM في الغالب من Y27632 و A8301 و CHIR99021. لتحقيق الاستقرار في المختبر ، قمنا في البداية بعزل خلايا بطانة الرحم من بطانة الرحم الفئران باستخدام تقنيات إنزيمية وميكانيكية. كشف تحليل قياس التدفق الخلوي في الشكل 2 أ أن خلايا بطانة الرحم الأولية تتكون من حوالي 50٪ من الخلايا الظهارية التي تعبر عن CD9 (49.8٪) ، مع مستويات منخفضة من EpCAM (4.49٪) و CD24 (2.64٪). كانت علامة SSEA-1 ل reESCs موجودة عند 6.58٪ ، بينما كانت علامات البطانة CD31 (30.9٪) و CD45 (70.3٪) مرتفعة نسبيا.
ومع ذلك ، نتج عن الاستزراع في REEM أن تعرض P1 reESCs مورفولوجيا موحدة أو متعددة السطوح وتشكل هياكل استنساخ مدمجة (الشكل 2 د). أدت الإزالة التدريجية للعوامل الفردية من REEM إلى انخفاض مماثل في القدرة التكاثرية ل reESCs. سلط مقايسة تكوين الاستنساخ الضوء على الدور الحاسم ل Y27632 في الثقافة المستقرة ل reESCs (الشكل 2 ب ، ج). بحلول المقطع الثالث ، أظهرت reESCs تعبيرا ثابتا عن SSEA-1 و Cytokeratin ، مما يشير إلى التوسع الناجح في reESCs الأولية أثناء الزراعة (الشكل 2F). علاوة على ذلك ، حافظت reESCs على قدرة تكاثرية قوية ومستقرة حتى في الممرات المتأخرة (الشكل 2E) ، مما يدل على عزلها الناجح وتوسعها في نظام REEM الحالي.
تم إنشاء الثقافات العضوية بعد نظام تم الإبلاغ عنه سابقا مشتق من الخلايا الجذعية لبطانة الرحمالبشرية 8. في غضون 3 أيام ، أظهرت reESCs تنظيما ذاتيا سريعا في هياكل شبيهة بالعضوية ذات مركز مجوف ، والتي زادت لاحقا في الحجم والسمك (انظر الشكل 3 أ). يتم عرض نتائج تلطيخ HE النموذجية التي توضح تكوين العضيات بواسطة reESCs في الشكل 3 ب. يمكن الحفاظ على هذه الثقافات العضوية من خلال المرور ، كما يتضح من قابلية الخلايا العالية للبقاء المشار إليها بواسطة تلطيخ Ki67 بعد كل من دورات المرور المباشر ودورات التجميد والذوبان. علاوة على ذلك ، تم إجراء تلطيخ HE على الجيل العاشر من العضيات ، وأظهرت النتائج أنه يمكن الحفاظ على الهيكل العضوي سليما (انظر الشكل 3E). بالإضافة إلى ذلك ، أشارت نتائج qPCR إلى أن Nanog و Sox2 و Oct4 تم التعبير عنها بمستويات مماثلة لتلك الخاصة بجيل P1 (الشكل 3F). تشير هذه النتيجة إلى إمكانية استزراع العضيات على المدى الطويل داخل النظام الحالي.
أجرت دراستنا تحقيقا أوليا في استجابة الهياكل الشبيهة بالرحم للفئران ل E2 و P4. كشف تلطيخ التألق المناعي في الشكل 4 أ عن وجود مستقبلات هرمون الاستروجين والبروجسترون. بعد مكملات E2 ، خضعت هذه العضيات للانتقال من شكل كروي مجوف إلى نمط نمو داخلي أكثر كثافة سكانية (الشكل 4 ج). أدى التعرض اللاحق ل P4 إلى انخفاض نفاذية الهياكل الكثيفة ، مما أدى في النهاية إلى تفككها (الشكل 4 ب). تشير هذه النتائج إلى أن E2 من المحتمل أن يؤدي إلى مزيد من التمايز في الهياكل الشبيهة بالرحم للفئران ، في حين أن P4 قد يؤدي إلى مسارات موت الخلايا المبرمج.
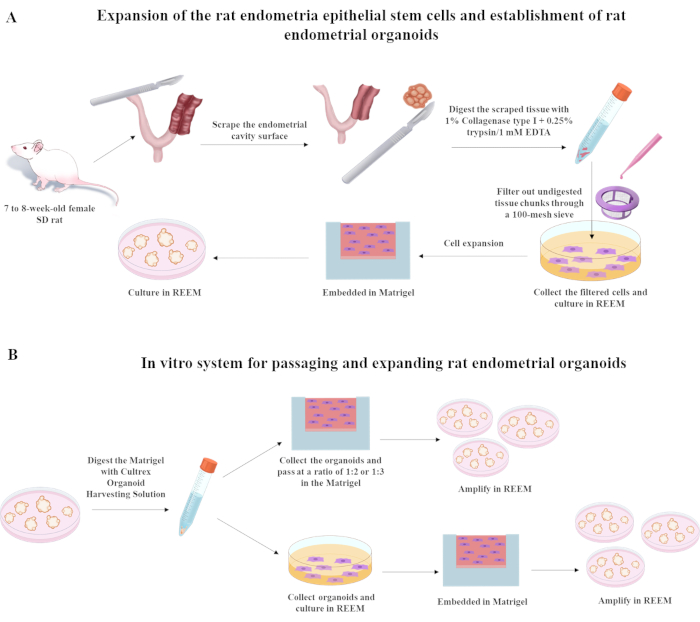
الشكل 1: الإجراءات المستخدمة لإنشاء الخلايا الجذعية الظهارية لبطانة الرحم للفئران وعضيات رحم الفئران. اختصار: SD = Sprague-Dawley. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
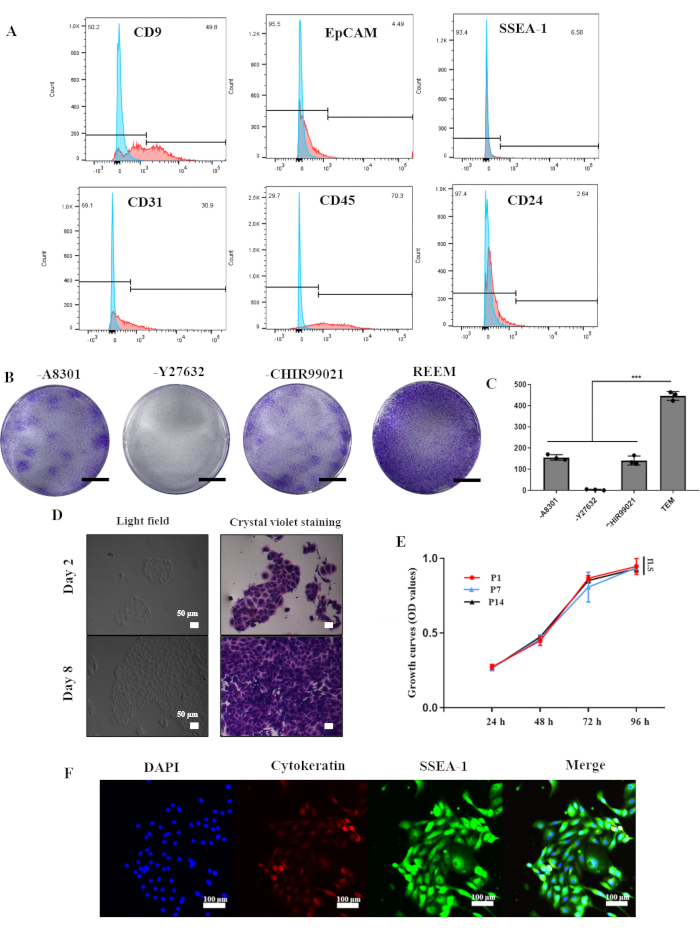
الشكل 2: توليد الخلايا الجذعية الظهارية لبطانة الرحم للفئران واستزراعها على المدى الطويل في المختبر. (أ) تحليل قياس التدفق الخلوي الذي يوضح نسبة الخلايا الإيجابية في بطانة الرحم للفئران. (ب) تلطيخ البنفسجي البلوري للنسخ في REEM مع أو بدون A8301 أو Y27632 أو CHIR99021 ، على التوالي. أشرطة المقياس = 1 سم. (C) أرقام الاستنساخ في REEM مع أو بدون عوامل. تمثل أشرطة الخطأ الانحراف المعياري. ن = 3 جهات مانحة (*** ، ص <0.001). (د) صور مجهرية ضوئية للخلايا الجذعية الظهارية لبطانة الرحم للفئران P1 مع أو بدون تلطيخ بنفسجي بلوري. (ه) تحليلات CCK-8 للخلايا الجذعية الظهارية لبطانة الرحم للفئران عند الممر 1 ، الممر 7 ، والممر 14. تمثل أشرطة الخطأ الانحراف المعياري ، ن = 3. (و) تحليلات التألق المناعي التي توضح التعبير عن السيتوكيراتين و SSEA-1. الاختصار: REEM = وسيط توسيع reESCs. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
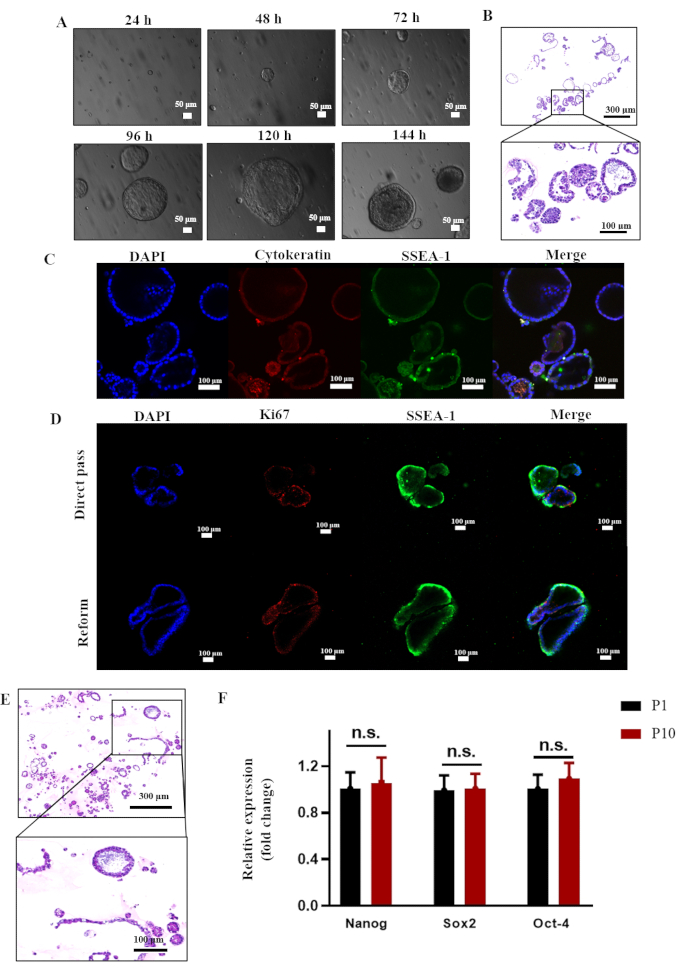
الشكل 3: توليد واستزراع طويل الأمد لعضويات بطانة الرحم في الفئران في المختبر. (أ) صور مجهرية ضوئية لعضيات بطانة الرحم للفئران P1. (ب) تلطيخ H & E للعضيات P1 من الخلايا الجذعية الظهارية لبطانة الرحم في الفئران. (ج) تحليلات التألق المناعي التي توضح التعبير عن السيتوكيراتين و SSEA-1. (د) تحليلات التألق المناعي التي توضح التعبير عن Ki67 و SSEA-1. (ه) تلطيخ H& E لعضويات الفئران P 10. (F) تحليلات qPCR للتعبير عن Nanog و Sox2 و Oct-4 في عضيات بطانة الرحم للفئران P1 و P10. تم تطبيع التعبير إلى GAPDH (ن = 3 ، اختبار t ثنائي الذيل غير المقترن ، n.s. = غير مهم). الاختصار: H & E = الهيماتوكسيلين واليوزين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
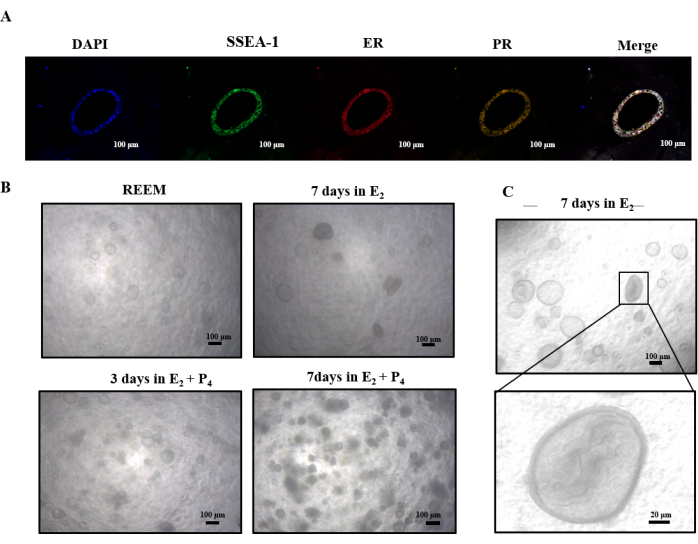
الشكل 4: الزراعة المتسلسلة للعضيات مع E2 و P4. (أ) تحليلات التألق المناعي التي توضح التعبير عن مستقبلات هرمون الاستروجين ومستقبلات البروجستيرون المفعول و SSEA-1. (ب) نظرة عامة على صور الفحص المجهري الضوئي لعضيات الفئران المستزرعة في E2 و P4. (ج) توضح صور الفحص المجهري الضوئي تحول كرة مجوفة إلى كثيفة داخل التجويف الداخلي للعضيات بعد زراعتها لمدة 7 أيام في E2. الاختصارات: ER = مستقبلات هرمون الاستروجين. العلاقات العامة = مستقبلات البروجستيرون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه الدراسة ، وصفنا طريقة مباشرة لعزل واستزراع الخلايا الجذعية الظهارية لبطانة الرحم للفئران (reESCs) وقمنا بتنقيح نظام خارج الجسم الحي الذي تم إنشاؤه مسبقا للخلايا الجذعية الظهارية لبطانة الرحم البشرية8. يستخدم نهجنا وسيطا صغيرا لثقافة الجزيئات يحتوي على Y27632 و A8301 و CHIR99021 كمكونات أساسية لتمكين ثقافة مستقرة وطويلة الأمد خارج الجسم الحي . علاوة على ذلك ، نجحنا في إنشاء عضيات بطانة الرحم للفئران في الوقت الفعلي باستخدام reESCs. يبسط هذا النظام الجديد طرق الاستزراع العضوي الحالية لبطانة الرحم ، والتي تعتمد عادة على كتل الأنسجة ، وبالتالي توفير قدر أكبر من الوضوح فيما يتعلق بنسب الخلية10. الأهم من ذلك ، أن نظامنا يسهل تحرير الجينات والتلاعب الآخر على المستوى الخلوي لتوليد عضيات تعبر عن جينات معينة. علاوة على ذلك ، يسمح هذا النظام العضوي بالضربة القاضية المستهدفة أو الإفراط في التعبير عن جينات معينة في بطانة الرحم للفئران ، مما يتيح فحص وزراعة الخلايا الجذعية الظهارية لبطانة الرحم لإنتاج عضيات بطانة الرحم. يوضح هذا النهج البحثي الشامل وظائف جينية محددة من منظور في الجسم الحي وخارج الجسم الحي ، مما يمهد الطريق للتحقيق في الأمراض المتعلقة بظهارة بطانة الرحم.
فحص الأدوية هو تطبيق حاسم للعضيات. ومع ذلك ، فإن المصادر الحالية وطرق تحضير العضيات معقدة ، مما يؤدي إلى تباين كبير بين الدفعات التي يمكن أن تؤثر على نتائج دراسات فحص الأدوية11،12. يوضح نظامنا أن العضيات المشتقة من خطوط الخلايا المستقرة خارج الجسم الحي يمكن أن تقلل بشكل فعال من الاختلافات بين العضيات المشكلة ، مما يعزز التوحيد في الإعدادات التجريبية. علاوة على ذلك ، أثبتت عضيات الفئران التي تشكلت بواسطة reESCs القدرة على الاستجابة لتحفيز هرمون الاستروجين في المختبر ، مما يؤدي إلى تغييرات مورفولوجية ، مما يشير إلى أنه يمكن استخدامها كأداة لفحص الأدوية خارج الجسم الحي. يمكن عزل الخلايا الجذعية الجذعية بسهولة من أنسجة بطانة الرحم وتوسيع خارج الجسم الحي مع عدد أقل من الجزيئات الصغيرة مقارنة بالخلايا الجذعية الظهارية لبطانة الرحم البشرية. هذه الخاصية ذات قيمة خاصة للتحقيق في خصائص الخلايا الجذعية ، والخلايا السليفة ، وعمليات التمايز ، وتفاعلات البيئة الدقيقة. الأهم من ذلك ، يمكن استقراء هذا النهج لأنواع الثدييات الأخرى مثل والخنازير ، مما يتيح إنشاء أنظمة استزراع عضيات بطانة الرحم التي تعمل كنماذج أكثر صلة من الناحية الفسيولوجية لدراسة بيولوجيا بطانة الرحم ووظيفتها وأمراضها واستجابات الأدوية. على الرغم من مزاياها ، إلا أن هذه التقنية لها قيود. أحد القيود الرئيسية هو الاعتماد على Matrigel ، وهي مصفوفة معقدة ومتغيرة خارج الخلية يمكن أن تؤدي إلى تناقضات بين التجارب. علاوة على ذلك ، في حين أن نماذج الفئران توفر رؤى قيمة ، إلا أن الاختلافات بين الأنواع لا تزال موجودة ، وقد لا تترجم النتائج بالكامل إلى فسيولوجيا بطانة الرحم البشرية وأمراضها. يجب أن تهدف الدراسات المستقبلية إلى معالجة هذه القيود ، ربما من خلال تطوير مصفوفات خارج الخلية أكثر تحديدا واتساقا ومن خلال استكشاف قابلية تطبيق هذا النموذج عبر الأنواع الأخرى.
على الرغم من مزاياها ، إلا أن هذه التقنية لها قيود. أحد القيود الرئيسية هو الاعتماد على Matrigel ، وهي مصفوفة معقدة ومتغيرة خارج الخلية يمكن أن تؤدي إلى تناقضات بين التجارب. لذلك ، فإن الأسلوب الرئيسي في هذه الدراسة هو إزالة Matrigel. يعد استخدام هضم جل مصفوفة لطيف ، وضمان العمليات على الثلج ، ووقت الهضم الكافي أمرا بالغ الأهمية للنجاح. نظرا للقطر الأكبر لماصة باستور، يمكن أن يؤدي استخدام شفط ماصة باستور إلى تقليل تلف العضيات وتسريع عملية هضم هلام المصفوفة. يمكن للبحث اللاحق مقارنة طرق مختلفة لزراعة هلام المصفوفة خارج الخلية لتحسين أنظمة الثقافة والهضم للعضيات. يجب أن تهدف الدراسات المستقبلية إلى معالجة هذه القيود ، ربما من خلال تطوير مصفوفات خارج الخلية أكثر تحديدا واتساقا ومن خلال استكشاف قابلية تطبيق هذا النموذج عبر الأنواع الأخرى.
في حين أن الأدبيات الحالية قد وصفت تقنيات زراعة العضيات الظهارية خارج الجسم الحي ، فإن هذه الدراسة تقدم نظاما جديدا ومباشرا وقابلا للتكرار بسهولة لزراعة وتوسيع عضيات بطانة الرحم للفئران التي يتم الحصول عليها من الخلايا الصافية. هذا التقدم يستعد لتعزيز وتيرة البحث في مجال البيولوجيا الإنجابية للمرأة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة GuangDong للبحوث الأساسية والتطبيقية (2023A1515110760).
Materials
| Name | Company | Catalog Number | Comments |
| Anti-CD15 (SSEA-1) | Abcam | ab135377 | Rabbit, 1:200 (IHC) |
| Anti-Estrogen Receptor alpha | Abcam | ab32063 | Rabbit, 1:200 (IHC) |
| Anti-pan Cytokeratin | Abcam | ab7753 | Mouse, 1:250 (IHC) |
| Anti-Progesterone Receptor | Abcam | ab101688 | Rabbit, 1:200 (IHC) |
| Anti-Ki67 | Abcam | ab279653 | Mouse, 1:250 (IHC) |
| A8301 | TargetMol | 909910-43-6 | |
| β-Estradiol | Merck | E8875 | |
| Cell Counting Kit-8 | Beyotime | C0038 | |
| CD9 | BioLegend | 109819 | 1:20 (FC), Pacific Blue |
| CD24 | BioLegend | 101806 | 1:20 (FC), FITC |
| CD31 | BioLegend | 303120 | 1:20 (FC), APC |
| CD45 | BioLegend | 301703 | 1:20 (FC), PE |
| CHIR99021 | TargetMol | CT99021 | |
| Cultrex Organoid Harvesting Solution | R&D Systems | 3700-100-01 | |
| Cy3 TSA Fluorescence System Kit | APExBIO | K1051 | |
| Cy5 TSA Fluorescence System Kit | APExBIO | K1052 | |
| DAPI | Sigma | D9542 | 1 μg/mL |
| DMEM/F-12 | Invitrogen | 11330032 | |
| EpCAM | BioLegend | 369803 | 1:20 (FC), PerCP |
| Fluorescein TSA Fluorescence System Kit | APExBIO | K1050 | |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11008 | 1:500 |
| Goat anti-Mouse IgG, Alexa Fluor 555 | Invitrogen | A-21422 | 1:500 |
| Goat Anti-rabbit IgG/HRP antibody | APExBIO | bs-0295G-HRP | |
| Knockout serum replacement | Invitrogen | 10828028 | |
| Matrigel | Corning | 356234 | |
| PrimeScript RT Master Mix | Takara | RR063A | |
| Progesterone | Merck | 57-83-0 | |
| Sprague-Dawley rat | Shanghai JieSiJie Laboratory Animals Co., LTD, China | ||
| SSEA-1 | BioLegend | 323047 | 1:20 (FC), APC |
| TB Green Fast qPCR Mix | Takara | RR820A | |
| TriZOL | Invitrogen | 15596026CN | RNA extraction |
| u-Slide 8-well plates | Ibidi | 80827 | |
| Y27632 | TargetMol | 146986-50-7 | |
| qPCR primers of target genes | |||
| Genes | Company | Sequences | |
| rat GAPDH F | Sangon biotech | GACATGCCGCCTGGAGAAAC | |
| rat GAPDH R | Sangon biotech | AGCCCAGGATGCCCTTTAGT | |
| rat Nanog F | Sangon biotech | GACTAGCAACGGCCTGACTCA | |
| rat Nanog R | Sangon biotech | CTGCAATGGATGCTGGGATA | |
| rat Sox2 F | Sangon biotech | ATTACCCGCAGCAAAATGAC | |
| rat Sox2 R | Sangon biotech | ATCGCCCGGAGTCTAGTTCT | |
| rat Oct4 F | Sangon biotech | CCCAGCGCCGTGAAGTTGGA | |
| rat Oct4 R | Sangon biotech | ACCTTTCCAAAGAGAACGCCCA GG |
References
- Jabbour, H. N., Kelly, R. W., Fraser, H. M., Critchley, H. O. Endocrine regulation of menstruation. Endocr Rev. 27 (1), 17-46 (2006).
- Garcia-Alonso, L., et al. Mapping the temporal and spatial dynamics of the human endometrium in vivo and in vitro. Nat Genet. 53 (12), 1698-1711 (2021).
- Li, M., Izpisua Belmonte, J. C. Organoids - preclinical models of human disease. N Engl J Med. 380 (6), 569-579 (2019).
- Mulaudzi, P. E., Abrahamse, H., Crous, A. Insights on three dimensional organoid studies for stem cell therapy in regenerative medicine. Stem Cell Rev Rep. 20 (2), 509-523 (2024).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development. 144 (10), 1775-1786 (2017).
- Turco, M. Y., et al. Long-term, hormone-responsive organoid cultures of human endometrium in a chemically defined medium. Nat Cell Biol. 19 (5), 568-577 (2017).
- Tempest, N., Maclean, A., Hapangama, D. K. Endometrial stem cell markers: current concepts and unresolved questions. Int J Mol Sci. 19 (10), 3240 (2018).
- He, W., et al. Long-term maintenance of human endometrial epithelial stem cells and their therapeutic effects on intrauterine adhesion. Cell Biosci. 12 (1), 175 (2022).
- Katsuda, T., et al. Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity. Cell Stem Cell. 20 (1), 41-55 (2017).
- Murphy, A. R., Campo, H., Kim, J. J. Strategies for modelling endometrial diseases. Nat Rev Endocrinol. 18 (12), 727-743 (2022).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Esfandiari, F., et al. Endometriosis organoids: prospects and challenges. Reprod Biomed Online. 45 (1), 5-9 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved