Method Article
Generación y caracterización de organoides de útero de rata a partir de células madre epiteliales endometriales de rata
En este artículo
Resumen
En este trabajo se presenta un protocolo para aislar y cultivar células madre epiteliales endometriales (reESCs) de rata, generando organoides endometriales de rata. Este método facilita los estudios in vitro de las enfermedades endometriales, permitiendo la edición génica y otras manipulaciones celulares.
Resumen
Los organoides endometriales ofrecen información valiosa sobre el desarrollo y la fisiopatología de las enfermedades endometriales y sirven como plataformas para las pruebas de fármacos. Si bien se han desarrollado organoides endometriales humanos y de ratón, la investigación sobre los organoides endometriales de rata sigue siendo limitada. Dado que las ratas pueden simular mejor ciertas patologías endometriales, como las adherencias intrauterinas, este estudio tuvo como objetivo establecer organoides endometriales en ratas. Presentamos un protocolo detallado para el aislamiento y cultivo de células madre epiteliales endometriales de rata (reESCs) y la generación de organoides endometriales de rata. Utilizando un medio de expansión de reESCs refinado, aislamos con éxito y expandimos de manera estable las reESC, demostrando su potencial de cultivo a largo plazo. Los organoides generados por reESC exhibieron características estructurales y funcionales típicas del endometrio, incluida la capacidad de respuesta hormonal. Nuestros resultados mostraron que los organoides endometriales de rata podían cultivarse a largo plazo con proliferación estable, manteniendo la estructura glandular, la polaridad celular y las características funcionales del epitelio endometrial. Este novedoso modelo de organoide endometrial derivado de ratas proporciona una valiosa plataforma para estudiar las enfermedades endometriales y probar intervenciones terapéuticas, con posibles aplicaciones en varias especies de mamíferos.
Introducción
El endometrio, un tejido versátil y regenerativo en el cuerpo humano, experimenta una muda, regeneración y diferenciación periódicas bajo la influencia de lashormonas ováricas. Las anomalías en el endometrio están relacionadas con diversas enfermedades del sistema reproductivo femenino, como la endometriosis, el cáncer de endometrio y la infertilidad2. La falta de modelos de investigación fiables para el endometrio dificulta los estudios en profundidad de la patogenia, el diagnóstico clínico y el tratamiento de estas enfermedades. Si bien las líneas celulares y los modelos animales se utilizan comúnmente para la investigación endometrial, desafíos como la inestabilidad fenotípica en las líneas celulares, las diferencias entre especies en modelos animales y otras limitaciones dificultan la replicación de la compleja estructura fisiológica y los cambios funcionales dinámicos en el endometrio humano.
Los organoides son estructuras tridimensionales formadas por el cultivo de células madre en un entorno extracelular, que poseen capacidades de autorrenovación y autoorganización. Pueden imitar la estructura y función de los tejidos fisiológicos y patológicos y son reconocidos como modelos preclínicos de enfermedades humanas4. En 2017, se logró la construcción exitosa de organoides endometriales de ratón y humanos mediante la incorporación de tejido endometrial libre fragmentado obtenido a través de la digestión enzimática en un andamio de matriz extracelular, seguido de la adición de una mezcla de factores de crecimiento específicos y factores de señalización para el cultivo5. Los resultados demostraron que los organoides endometriales ex vivo exhiben una capacidad proliferativa estable y a largo plazo, manteniendo la estructura glandular, la polaridad celular y las características funcionales del epitelio endometrial, incluyendo la secreción de moco y la respuesta hormonal6. Sin embargo, el cultivo ex vivo de células madre adultas que forman los organoides endometriales requiere un soporte estructural similar a una glándula, lo que lleva a desafíos como la pérdida de tallo y dificultades para el paso7.
Actualmente, el cultivo de organoides endometriales se basa en el método de cultivo de digestión en bloques de tejidos. En un estudio anterior, nuestro equipo de investigación cultivó células madre epiteliales endometriales humanas durante un período prolongado in vitro utilizando un medio de cultivo primario compuesto principalmente por Y27632, que empleamos para construir organoides endometriales8. Sobre la base de este éxito, aislamos y cultivamos células madre epiteliales endometriales a partir de tejido endometrial de rata utilizando un medio de cultivo compuesto de molécula pequeña, estableciendo un sistema de cultivo in vitro a largo plazo. Además, utilizamos células madre epiteliales endometriales de rata (reESCs) para generar organoides endometriales de rata. El desarrollo de este modelo mejorará los futuros estudios in vitro e in vivo de enfermedades relacionadas con el endometrio junto con modelos de ratas.
Protocolo
En este trabajo se utilizaron seis ratas Sprague-Dawley hembras de 7/8 semanas de edad con un peso de 200-250 g. Las ratas fueron alojadas en un animalario climatizado con acceso ad libitum a alimentos y agua. Todos los procedimientos experimentales con animales se llevaron a cabo de acuerdo con las Directrices Institucionales para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por la junta de revisión institucional para experimentos con animales en el Comité de Ética de Investigación del Hospital Popular de Meizhou.
La siguiente sección describe el proceso para aislar, pasar, congelar y descongelar células madre epiteliales endometriales de rata utilizando un medio de expansión de reESC refinado (REEM) compuesto principalmente por Y27632, A8301 y CHIR990217 8,9. La formulación de REEM se basa en DMEM/F12 sin suero enriquecido con concentraciones específicas de componentes clave: 10 μM Y27632, 3 μM CHIR99021 y 0,5 μM A8301. Los detalles completos sobre los componentes se pueden encontrar en la Tabla de materiales. Una vez que las ratas han sido anestesiadas con inhalación de isoflurano, se deben implementar los procedimientos posteriores descritos en la Figura 1.
1. Procedimiento quirúrgico
- Anestesiar a la rata por inhalación de isoflurano.
- Coloque las ratas en una cámara de inducción llena de isoflurano al 3-5% mezclado con oxígeno. Confirmar la anestesia adecuada por la ausencia de respuesta a un pinzamiento del dedo del pie y la pérdida del reflejo de enderezamiento.
- Una vez anestesiadas, mantenga a las ratas bajo 1-3% de isoflurano a través de un cono nasal durante el procedimiento. Aplique ungüento veterinario en los ojos para prevenir la sequedad mientras la rata está bajo anestesia.
- Haga una incisión en la línea media del abdomen para exponer los cuernos del útero.
NOTA: Todos los instrumentos quirúrgicos deben esterilizarse antes de su uso. El área quirúrgica de la rata se afeita y se desinfecta con una solución antiséptica. El cirujano usa guantes estériles, una mascarilla y una bata. El procedimiento quirúrgico se realiza sobre un paño estéril. - Realizar incisiones longitudinales en ambos lados del útero para exponer el endometrio interno. Use una hoja de bisturí T10 para raspar el endometrio hasta que la superficie esté áspera.
- Después del procedimiento quirúrgico, transfiera a las ratas a un área de recuperación estéril y cálida con niveles regulados de temperatura y humedad y vigílelas de cerca hasta que recuperen la conciencia completa y puedan sostenerse en una posición reclinada esternal. Aloje grupos de tres ratas postoperatorias por separado en jaulas separadas. Para aliviar el dolor postquirúrgico, administrar analgésicos como buprenorfina (0,05-0,1 mg/kg, por vía subcutánea); Repita cada 8-12 h durante un máximo de 48-72 h según sea necesario.
2. Procesamiento de tejidos
- Coloque todos los fragmentos de endometrio uterino en un plato de 3,5 cm y lávelos 3 veces con PBS.
- Mezclar los fragmentos de endometrio uterino con 3 mL de colagenasa tipo I al 1% (diluida en tripsina al 0,25%/EDTA al 1 mM) a 37 °C durante 60 min. Filtre el tejido no digerido con un colador de células de 100 μm para aislar y recoger el filtrado para su posterior cultivo.
- Siembre las células recolectadas en placas de 12 pocillos en medio REEM para su posterior cultivo. Calcule el volumen de la suspensión celular necesaria para sembrar las células en cada pocillo de la placa de 12 pocillos para lograr la densidad celular deseada (típicamente ~ 1-2 × 105 celdas/pocillo en 1,5 mL de REEM).
- Lave las células recogidas en el paso 2.2 durante 3 veces con PBS. Después del lavado inicial, centrifugar las células a 300 × g durante 5 min. Deseche el sobrenadante; resuspender el pellet celular en PBS que contenga un 1% de BSA (albúmina sérica bovina) para minimizar la unión inespecífica e incubar durante 15-30 min en hielo.
- Incubar las células con anticuerpos primarios específicos para diferentes marcadores (ver la Tabla de Materiales) durante 30 min a 1 h a 4 °C. Diluya los anticuerpos en PBS con 1% de BSA según las instrucciones del fabricante.
- Después de la incubación, lave las células 2 veces con PBS para eliminar los anticuerpos no unidos. Después del lavado final, vuelva a suspender las células en 600 μL de PBS con BSA al 1% para el análisis de citometría de flujo.
- Configure el instrumento con láseres y filtros apropiados para los fluoróforos utilizados en el experimento (por ejemplo, FITC, PE, APC). Utilice los ajustes de dispersión directa (FSC) y dispersión lateral (SSC) para bloquear la población viva de una sola célula, excluyendo los desechos y los agregados de células. Calibre el citómetro de flujo utilizando un control sin manchas para garantizar una alineación adecuada. Establezca puertas específicas basadas en el control no teñido para definir poblaciones positivas para cada marcador de interés (el umbral es 0,02%).
3. Cultivo a largo plazo de células madre epiteliales endometriales de rata
- Ensayo de formación de colonias
NOTA: Este ensayo ayudó a determinar el medio de cultivo óptimo para las reESC.- Siembre las reESC P0 en placas de 6 pocillos a una densidad de 1.000 células/pocillo y cultívelas durante 14 días en REEM o REEM sin A8301, Y27632 o CHIR99021.
- Después del período de cultivo, fije las células con paraformaldehído al 4% durante 20 min a temperatura ambiente y posteriormente tíñalas con solución de violeta cristalina durante otros 20 min.
- Cuantifique el número de grupos de células que contienen más de 50 células. Seleccione el medio de cultivo en función del medio que favorece el crecimiento de los grupos de células.
NOTA: La omisión de factores específicos del REEM resultó en una disminución de la capacidad proliferativa de las reESC (Figura 1B, C). Sobre la base de estos hallazgos, se seleccionó REEM como el medio preferido para el cultivo de reESCs con el fin de optimizar las condiciones de cultivo.
- Cambie el REEM cada 2 días. Cuando las células alcancen el 80-90% de confluencia, digerirlas con tripsina al 0,25%/EDTA 1 mM durante 5-6 min.
- Pase las celdas en una proporción de 1:3 en REEM.
- Ensayo de proliferación
- Siembre las reESC P1, P7 y P14 en placas de 96 pocillos a una densidad de 4 × 103 células/pocillo en 150 μL de REEM.
- Añada 10 μl de reactivo CCK-8 a cada pocillo después de 24, 48, 72 y 96 h de cultivo, seguido de una incubación de 2 h a 37 °C.
- Determine la tasa de proliferación midiendo la absorbancia a 450 nm utilizando un lector de microplacas.
- Preparación y uso de existencias congeladas
- Prepare la solución madre congelada utilizando REEM con DMSO al 10%.
- Coseche las reESC con 0,25% de tripsina/1 mM de EDTA.
- Vuelva a suspender el pellet de celda en una solución madre congelada a una concentración de 1 × 106 células/mL. Transfiera la suspensión celular a tubos.
- Congele los tubos primero a -80 °C y luego transfiéralos a nitrógeno líquido dentro de las 24 h.
NOTA: Si tiene la intención de descongelar las células pronto, se recomienda almacenar las células congeladas a -80 °C durante un período máximo de 6 meses. - Precalienta el REEM a 37 °C.
- Recupere los REESC congelados y sumérjalos en un baño de agua a 37 °C durante 1-2 minutos.
- Transfiera las reESC descongeladas a placas de 6 pocillos con una densidad de siembra de 1 × 105 células/pocillo en REEM.
- Tinción de inmunofluorescencia
- Siembre las REESC en la fase de crecimiento logarítmico en placas u-Slide de 8 pocillos a una densidad de 2 × 103 células por pocillo y cultícelas en REEM.
- Cuando las reESC alcancen el 90% de confluencia, fíjelas con paraformaldehído al 4% durante 20 min. Lave los reESC con PBS 2x antes y después de la fijación.
- Permeabilizar las células con Triton X-100 al 0,2% durante 10 min.
- Bloquear las células con un 30% de suero de cabra diluido en albúmina sérica bovina (BSA) al 5% durante 30 min a temperatura ambiente. Lave los reESC con PBS 2x antes y después del bloqueo.
- Incubar las células con anticuerpos primarios (anti-SSEA-1 y anti-Citoqueratina) durante 12 h a 4 °C. Lave los reESC con PBS 2x después de la incubación.
- Incubar las células con anticuerpos secundarios durante 1 h a temperatura ambiente. Lave los reESC con PBS 2x después de la incubación.
- Contratinción de las células con 150 μL de DAPI para marcar todos los núcleos.
- Capture imágenes de las células teñidas con un microscopio confocal invertido.
4. Establecimiento de organoides endometriales de rata a partir de reESCs
- Generación de los organoides
- Cuando las reESC alcancen el 70% de confluencia, digiera las células con tripsina al 0,25%/EDTA 1 mM durante 5-6 min.
- Vuelva a suspender 5 × 105 reESC en 500 μL de Matrigel descongelado y colóquelo en placas de 12 pocillos. Incubar las placas a 37 °C durante 20 min para permitir la gelificación.
- Una vez que la mezcla de célula y Matrigel se solidifique, agregue 1,5 mL/pocillo de REEM para cubrir el Matrigel. Cambie el REEM cada 2-3 días.
- Tinción de inmunofluorescencia
- Aspire el REEM y agregue 1 mL/pocillo de solución de recolección de organoides preenfriada en las placas de 12 pocillos. Incubar en hielo durante 40-60 min.
- Recoja los organoides con una pipeta Pasteur y centrifuga a 300 × g durante 3 min a 4 °C.
- Enjuague los organoides 2-3 veces con PBS.
- Fije los organoides con paraformaldehído al 4% durante 20 min y bloquee con BSA al 5% durante 60 min.
NOTA: Lave 2 veces con PBS antes y después de cada paso. - Incubar los organoides durante la noche a 4 °C con anticuerpos primarios diluidos en BSA al 1%.
- Incubar los organoides con anticuerpos secundarios durante 1 h a temperatura ambiente.
- Contratinción de los organoides con 200 μL de DAPI.
- Captura de imágenes con un microscopio confocal invertido.
- Tinción HE
- Deshidratar los organoides a través de una serie de etanol graduado: etanol al 70% durante 30 min; etanol al 80% durante 30 min; etanol al 95% durante 30 min; 100% etanol para 2 x 30 min. Limpie los organoides sumergiéndolos en xileno durante 2 x 30 min.
- Sumerja los organoides aclarados en parafina derretida a 60 °C durante 1 h. Transfiera los organoides infiltrados en parafina a moldes de inclusión, llene los moldes con parafina derretida y coloque los moldes en una placa fría para que la parafina se solidifique. Retire los bloques de parafina de los moldes después de que la parafina se haya solidificado y recorte el exceso de parafina.
- Monta los bloques de parafina en el micrótomo. Cortar secciones de 5 μm de grosor y hacerlas flotar en un baño de agua tibia (42-45 °C) para aplanarlas. Transfiera con cuidado las secciones a portaobjetos de vidrio y séquelas en un calentador de portaobjetos.
- Desparafinar las secciones sumergiendo los portaobjetos en xileno durante 2 x 5 min. Rehidratar a través de una serie de etanol graduado: etanol 100% durante 2 x 3 min; Etanol al 95% durante 3 min; etanol al 70% durante 3 min; Enjuague con agua destilada.
- Teñir con hematoxilina durante 5 min; Luego, enjuague con agua corriente del grifo durante 5 minutos. Diferenciar en alcohol ácido al 1% durante unos segundos; enjuague con agua corriente del grifo durante 5 minutos; colocar en azul en agua con amoníaco al 0,2% durante 30 s; enjuague con agua corriente del grifo durante 5 minutos; Teñir con eosina durante 2 min. Deshidratar a través de etanol graduado: 70% de etanol durante 1 min; etanol al 95% durante 1 min; Etanol 100% durante 2 x 1 min. Transparente en xileno durante 2 x 1 min.
- Agregue una gota de medio de montaje a las secciones manchadas. A continuación, coloque un cubreobjetos sobre la sección de pañuelo, evitando las burbujas de aire. Observe las secciones manchadas bajo un microscopio óptico.
- Tinción de fluorescencia
- Realice la desparafinación y la rehidratación como se describe en los pasos 4.3.1. al punto 4.3.4.
- Precaliente la solución de recuperación de antígenos en un horno microondas. Coloque los portaobjetos en la solución de recuperación de antígenos calentada y manténgalos a temperatura de ebullición durante 20 minutos. Deje que los portaobjetos se enfríen en la solución de recuperación de antígenos durante 40 minutos. Enjuague los portaobjetos en agua desionizada durante 5 min.
- Incubar los portaobjetos en peróxido de hidrógeno al 0,3% en metanol durante 10 minutos para calmar la actividad de la peroxidasa endógena. Enjuague los portaobjetos durante 3 x 5 min en PBS e incubelos en solución de bloqueo durante 1 h a temperatura ambiente en una cámara humidificada. Retira el exceso de solución bloqueadora, pero no enjuague.
- Diluya el anticuerpo primario en la solución bloqueante de acuerdo con las instrucciones del fabricante. Aplique el anticuerpo primario diluido a las secciones de tejido e incube durante la noche a 4 °C en una cámara humidificada.
- Lave los portaobjetos durante 3 x 5 minutos en PBS. Diluya el anticuerpo secundario conjugado con HRP en una solución bloqueante de acuerdo con las instrucciones del fabricante. Aplique el anticuerpo secundario diluido a las secciones de tejido e incube durante 1 h a temperatura ambiente en una cámara humidificada. Lave los portaobjetos durante 3 x 5 min en PBS para eliminar el anticuerpo secundario no unido.
- Prepare la solución de trabajo de fluoresceína tiramida de acuerdo con las instrucciones del kit. Aplique la solución de trabajo a las secciones de tejido e incube durante 15 min a temperatura ambiente en una cámara humidificada. Enjuague los portaobjetos durante 3 x 5 minutos en PBS.
- Repita el paso 4.4.1. hasta 4.4.5 hasta que se haya completado la tinción con los tres anticuerpos. Aplique una gota de medio de montaje fluorescente con DAPI a cada sección de tejido. Coloque con cuidado un cubreobjetos sobre la sección de pañuelos para evitar burbujas de aire. Examine los portaobjetos del microscopio confocal invertido.
- PCR cuantitativa
- Recoja los organoides como se describe en los pasos 4.2.1. al punto 4.2.3. Aspire el PBS y extraiga los ARN totales de los organoides siguiendo las instrucciones del fabricante.
- Utilice cualquier kit de transcripción inversa disponible en el mercado para sintetizar ADNc a partir de 1 μg de ARN total. Configure una reacción de q-PCR de acuerdo con el protocolo del fabricante del kit. Consulte la Tabla de materiales para conocer las secuencias de cebadores utilizadas para la q-PCR.
5. Cultivo a largo plazo de organoides endometriales de rata
- Aspirar el REEM y añadir 1 mL de Solución de Recolección de Organoides durante 40 min para disociar los organoides. Incubar en hielo para mantener la integridad de los organoides.
- Después de la incubación, recoja los organoides con una pipeta Pasteur y centrifugue a 300 × g durante 3 min a 4 °C para pellets para su posterior procesamiento.
NOTA: El recorte de la punta de la pipeta puede ser útil para manipular organoides más grandes (más de 500 μm) sin causar daños. - Resuspender los organoides peletizados en Matrigel, en una proporción de 1:2 o 1:3, para su inclusión y posterior cultivo en placas de 12 pocillos.
- Preparar la solución madre congelada: REEM con 10% de DMSO.
- Coseche los organoides, vuelva a suspenderlos en la solución madre congelada y luego guárdelos en un congelador a -80 °C o en nitrógeno líquido para su conservación a largo plazo.
- Para descongelar los organoides congelados, precaliente el REEM en un baño de agua a 37 °C y sumerja el tubo de caldo congelado en el baño de agua para descongelar suavemente los organoides.
- Después de la descongelación, vuelva a suspender los organoides en 500 μL de Matrigel para volver a incrustarlos y cultivarlos en una placa de 12 pocillos. Siga los pasos 4.1.2. al punto 4.1.3.
NOTA: Se recomienda almacenar los organoides congelados a -80 °C durante períodos más cortos o transferirlos a nitrógeno líquido para un almacenamiento a largo plazo.
6. Opcional: Transición de organoides a cultivo adherente
NOTA: El protocolo menciona un método alternativo para la obtención de reESCs de cultivo plano mediante la transición de organoides a cultivo adherente, lo que permite la reestructuración de la morfología de los organoides.
- Aspirar el REEM y añadir 1 mL de Solución de Recolección de Organoides para disociar los organoides. Incubar en hielo para mantener la integridad de los organoides.
- Después de la incubación, recoja los organoides con una pipeta Pasteur y centrífugue para peletizarlos a 300 × g durante 3 min a 4 °C.
- Vuelva a suspender los organoides en 3 mL de REEM precalentado y transfiera los organoides resuspendidos a un plato de 3,5 cm. Cambie el medio REEM cada 2 días.
- Cuando las células alcancen el 70% de confluencia, digerirlas con tripsina al 0,25%/EDTA 1 mM durante 5-6 min.
- Reconstrucción de los organoides con reESCs siguiendo los pasos 4.1.1 a 4.1.3.
7. Cultivo secuencial de organoides con estradiol (E2) y progesterona (P4)
- Prepare soluciones madre de E2 y P4 en DMSO. Diluir las soluciones madre hasta las concentraciones de trabajo deseadas (E2: 10 nM; P4: 1 μM) en REEM, asegurando que la concentración final de DMSO no supere el 0,1% para evitar efectos citotóxicos.
- Cultivo de organoides en REEM como paso 4.1.1. al punto 4.1.3. durante 4 días. Sustituir el medio por REEM suplementado con E2 y cultivo durante 7 días. Controle el crecimiento y la morfología de los organoides a diario. Cambie el medio cada 2-3 días.
- Sustituya el medio por REEM complementado con E2 y P4. Controle el crecimiento y la morfología de los organoides a diario. Cambie el medio cada 2-3 días. Continúe cultivando los organoides durante 7 días.
Resultados
Las reESCs y los organoides del útero de rata se establecieron a partir de seis ratas hembras Sprague-Dawley con un peso de entre 200 g y 250 g siguiendo el protocolo descrito en la Figura 1. Basándose en el éxito del cultivo a largo plazo de células madre epiteliales endometriales humanas, la formulación de REEM consistió principalmente en Y27632, A8301 y CHIR99021. Para estabilizar las reESCs in vitro, inicialmente aislamos células endometriales de endometrio de rata utilizando técnicas enzimáticas y mecánicas. El análisis de citometría de flujo en la Figura 2A reveló que las células endometriales primarias comprendían aproximadamente un 50% de células epiteliales que expresaban CD9 (49,8%), con niveles bajos de EpCAM (4,49%) y CD24 (2,64%). El marcador SSEA-1 para las reESC estuvo presente en un 6,58%, mientras que los marcadores endoteliales CD31 (30,9%) y CD45 (70,3%) fueron relativamente altos.
Sin embargo, el cultivo en REEM dio como resultado que las reESC P1 mostraran una morfología uniforme en espiral o poliédrica y formaran estructuras clonales compactas (Figura 2D). La eliminación gradual de factores individuales de REEM condujo a una disminución correspondiente en la capacidad proliferativa de las reESC. El ensayo de formación de clones destacó el papel crítico de Y27632 en el cultivo estable de reESC (Figura 2B, C). En el tercer pasaje, las reESCs exhibieron una expresión consistente de SSEA-1 y citoqueratina, lo que indica una expansión exitosa de las reESCs primarias durante el cultivo (Figura 2F). Además, las reESCs mantuvieron una capacidad proliferativa robusta y estable incluso en los últimos pasos (Figura 2E), lo que demuestra su exitoso aislamiento y expansión en el sistema REEM actual.
Los cultivos de organoides se establecieron siguiendo un sistema previamente reportado derivado de células madre endometriales humanas8. En 3 días, las reESCs exhibieron una rápida autoorganización en estructuras similares a organoides con un centro hueco, que posteriormente aumentaron en tamaño y grosor (ver Figura 3A). En la Figura 3B se presentan los resultados típicos de la tinción de HE que ilustran la formación de organoides por reESCs. Estos cultivos de organoides pueden sostenerse a través del paso, como lo demuestra la alta viabilidad celular indicada por la tinción con Ki67 después de los ciclos de paso directo y congelación-descongelación. Además, se realizó la tinción de HE en la 10ª generación de organoides, y los resultados mostraron que la estructura del organoide podía mantenerse intacta (véase la Figura 3E). Además, los resultados de la qPCR indicaron que Nanog, Sox2 y Oct4 se expresaron a niveles comparables a los de la generación P1 (Figura 3F). Este hallazgo sugiere el potencial para el cultivo a largo plazo de organoides dentro del sistema actual.
Nuestro estudio llevó a cabo una investigación preliminar sobre la respuesta de las estructuras similares al útero de rata a E2 y P4. La tinción de inmunofluorescencia en la Figura 4A reveló la presencia de receptores de estrógeno y progesterona. Después de la suplementación conE2 , estos organoides experimentaron una transición de una forma esférica hueca a un patrón de crecimiento interno más densamente poblado (Figura 4C). La exposición posterior a P4 condujo a una disminución de la permeabilidad de las estructuras densas, lo que finalmente resultó en su desintegración (Figura 4B). Estos hallazgos sugieren que E2 potencialmente impulsa una mayor diferenciación de estructuras similares al útero de rata, mientras que P4 puede desencadenar vías apoptóticas.
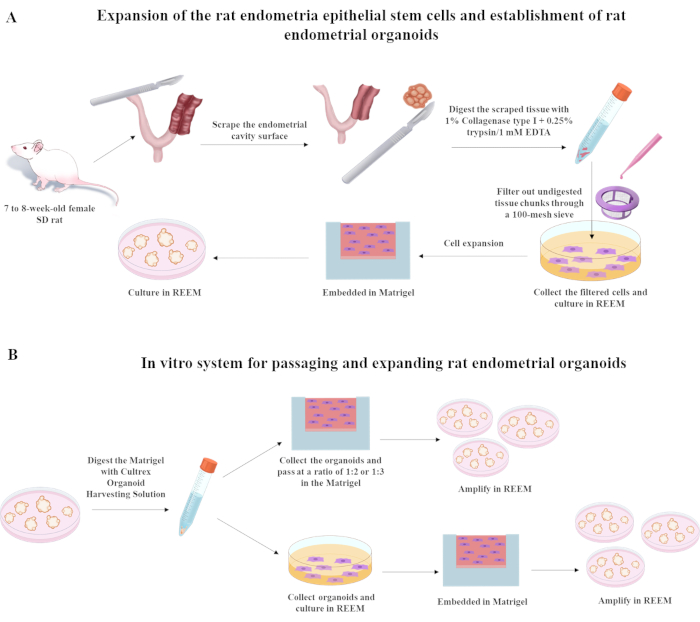
Figura 1: Procedimientos utilizados para establecer células madre epiteliales endometriales de rata y organoides de útero de rata. Abreviatura: SD = Sprague-Dawley. Haga clic aquí para ver una versión más grande de esta figura.
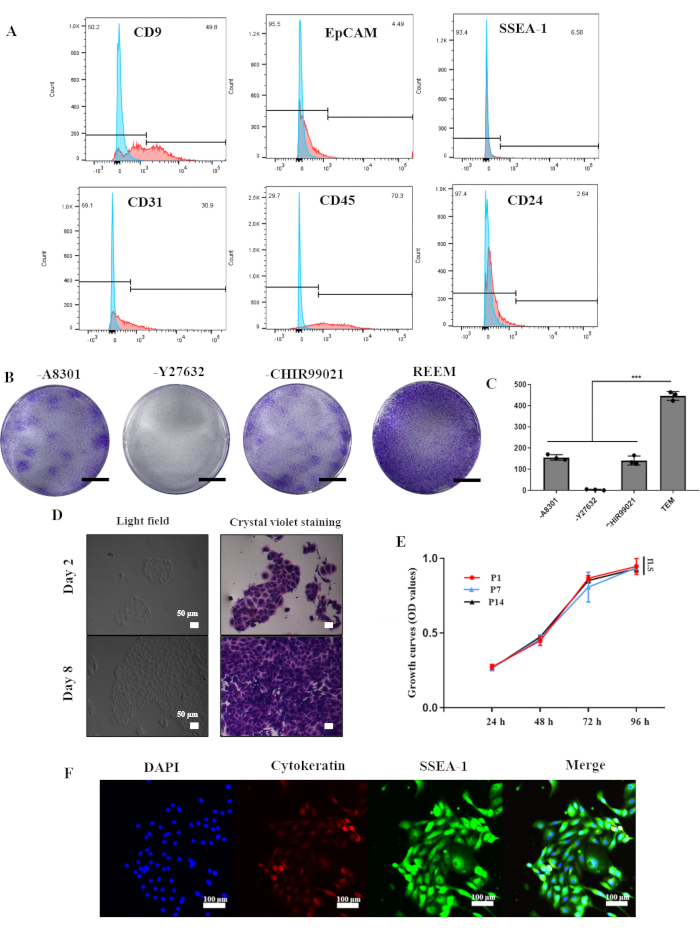
Figura 2: Generación y cultivo a largo plazo de células madre epiteliales endometriales de rata in vitro. (A) Análisis de citometría de flujo que muestra la proporción de células positivas en el endometrio de rata. (B) Tinción violeta cristalina de clones en REEM con o sin A8301, Y27632 o CHIR99021, respectivamente. Barras de escala = 1 cm. (C) Los números de clonación en REEM con o sin factores. Las barras de error representan la desviación estándar; n = 3 donantes (***, p<0,001). (D) Imágenes de microscopía óptica de células madre epiteliales endometriales de rata P1 con y sin tinción de violeta cristalino. (E) Análisis CCK-8 de células madre epiteliales endometriales de rata en el pasaje 1, el pasaje 7 y el pasaje 14. Las barras de error representan la desviación estándar, n = 3. (F) Análisis de inmunofluorescencia que demuestren la expresión de citoqueratina y SSEA-1. Abreviatura: REEM = medio de expansión reESCs. Haga clic aquí para ver una versión más grande de esta figura.
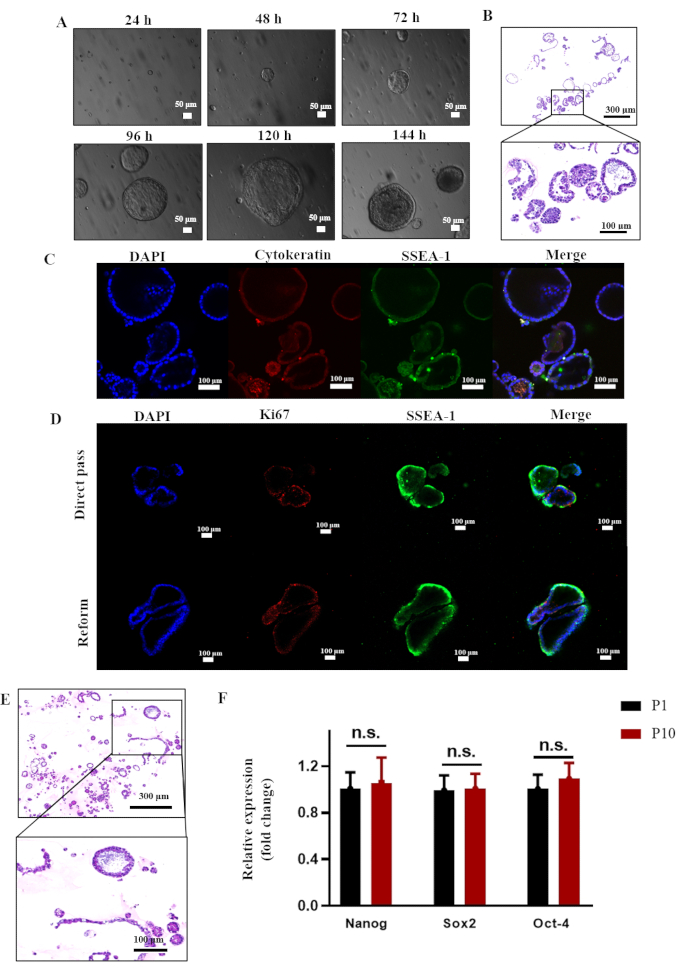
Figura 3: Generación y cultivo a largo plazo de organoides endometriales de rata in vitro. (A) Imágenes de microscopía óptica de organoides endometriales de rata P1. (B) Tinción de H&E para organoides P1 de células madre epiteliales endometriales de rata. (C) Análisis de inmunofluorescencia que demuestren la expresión de citoqueratina y SSEA-1. (D) Análisis de inmunofluorescencia que demuestren la expresión de Ki67 y SSEA-1. (E) Tinción de H&E para organoides de rata P 10. (F) Análisis de qPCR para la expresión de Nanog, Sox2 y Oct-4 en organoides endometriales de rata P1 y P10. Expresión normalizada a GAPDH (n = 3, prueba t desapareada de dos colas, n.s. = no significativa). Abreviatura: H&E = hematoxilina y eosina. Haga clic aquí para ver una versión más grande de esta figura.
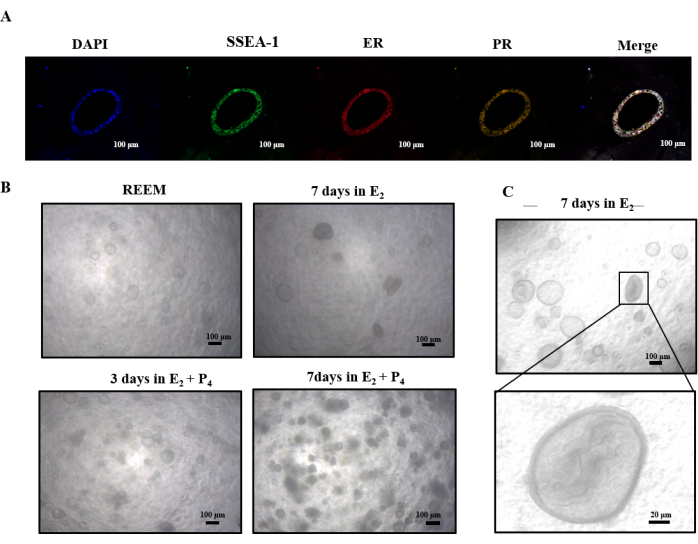
Figura 4: Cultivo secuencial de organoides conE2 y P4. (A) Análisis de inmunofluorescencia que demuestran la expresión del receptor de estrógeno, el receptor de progestágeno y SSEA-1. (B) Descripción general de las imágenes de microscopía óptica de organoides de rata cultivados en E2 y P4. (C) Las imágenes de microscopía óptica demuestran la transformación de una esfera hueca en densa dentro de la cavidad interna de los organoides después de ser cultivados 7 días en E2. Abreviaturas: ER = receptor de estrógeno; PR = receptor de progestágeno. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este estudio, hemos descrito un método sencillo para aislar y cultivar células madre epiteliales endometriales de rata (reESC) y hemos refinado el sistema ex vivo previamente establecido para células madre epiteliales endometriales humanas8. Nuestro enfoque utiliza un medio de cultivo de molécula pequeña que contiene Y27632, A8301 y CHIR99021 como componentes principales para permitir un cultivo ex vivo estable y a largo plazo. Además, generamos con éxito organoides endometriales de rata en tiempo real utilizando reESC. Este novedoso sistema simplifica los métodos actuales de cultivo de organoides endometriales, que normalmente se basan en bloques de tejidos, proporcionando así una mayor claridad sobre el linaje celular10. Es importante destacar que nuestro sistema facilita la edición de genes y otras manipulaciones a nivel celular para generar organoides que expresan genes específicos. Además, este sistema de organoides permite la knockout o sobreexpresión dirigida de genes específicos en el endometrio de rata, lo que permite la detección y el cultivo de células madre epiteliales endometriales para producir organoides endometriales. Este enfoque de investigación integral dilucida funciones específicas de los genes tanto desde perspectivas in vivo como ex vivo , allanando el camino para la investigación de enfermedades relacionadas con el epitelio endometrial.
El cribado de fármacos es una aplicación crítica de los organoides. Sin embargo, las fuentes actuales y los métodos de preparación de los organoides son complejos, lo que lleva a una variabilidad significativa entre lotes que puede afectar los resultados de los estudios de detección de fármacos11,12. Nuestro sistema demuestra que los organoides derivados de líneas celulares estables cultivadas ex vivo pueden minimizar eficazmente las diferencias entre los organoides formados, mejorando la uniformidad en las configuraciones experimentales. Además, los organoides de rata formados por reESCs han demostrado la capacidad de responder a la estimulación de estrógenos in vitro, lo que conduce a cambios morfológicos, lo que sugiere que pueden ser utilizados como una herramienta para el cribado de fármacos ex vivo. Las reESC pueden aislarse fácilmente del tejido endometrial y expandirse ex vivo con menos moléculas pequeñas en comparación con las células madre epiteliales endometriales humanas. Esta característica es particularmente valiosa para investigar las propiedades de las células madre, las células precursoras, los procesos de diferenciación y las interacciones del microambiente. Es importante destacar que este enfoque puede extrapolarse a otras especies de mamíferos como monos, cerdos y perros, lo que permite el establecimiento de sistemas de cultivo de organoides endometriales que sirven como modelos fisiológicamente más relevantes para estudiar la biología, la función, las enfermedades y las respuestas a los fármacos del endometrio. A pesar de sus ventajas, esta técnica tiene limitaciones. Una limitación importante es la dependencia de Matrigel, una matriz extracelular compleja y variable que puede introducir inconsistencias entre los experimentos. Además, si bien los modelos de ratas proporcionan información valiosa, aún existen diferencias entre especies y es posible que los hallazgos no se traduzcan completamente en la fisiología y las patologías endometriales humanas. Los estudios futuros deben apuntar a abordar estas limitaciones, potencialmente a través del desarrollo de matrices extracelulares más definidas y consistentes y explorando la aplicabilidad de este modelo en otras especies.
A pesar de sus ventajas, esta técnica tiene limitaciones. Una limitación importante es la dependencia de Matrigel, una matriz extracelular compleja y variable que puede introducir inconsistencias entre los experimentos. Por lo tanto, una técnica clave en este estudio es la eliminación de Matrigel. El uso de un digestivo en gel de matriz suave, que garantice las operaciones en hielo y un tiempo de digestión suficiente, es fundamental para el éxito. Debido al mayor diámetro de la pipeta Pasteur, el uso de la aspiración con pipeta Pasteur puede reducir el daño a los organoides y acelerar la digestión del gel de la matriz. Investigaciones posteriores pueden comparar diferentes métodos de cultivo en gel de matriz extracelular para optimizar aún más los sistemas de cultivo y digestión de organoides. Los estudios futuros deben apuntar a abordar estas limitaciones, potencialmente a través del desarrollo de matrices extracelulares más definidas y consistentes y explorando la aplicabilidad de este modelo en otras especies.
Si bien la literatura existente ha descrito técnicas para el cultivo ex vivo de organoides epiteliales, este estudio presenta un sistema novedoso, sencillo y fácilmente reproducible para cultivar y expandir organoides endometriales de rata a partir de células claras. Este avance está a punto de mejorar el ritmo de la investigación en el ámbito de la biología reproductiva de las mujeres.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación de Investigación Básica y Básica Aplicada de GuangDong (2023A1515110760).
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-CD15 (SSEA-1) | Abcam | ab135377 | Rabbit, 1:200 (IHC) |
| Anti-Estrogen Receptor alpha | Abcam | ab32063 | Rabbit, 1:200 (IHC) |
| Anti-pan Cytokeratin | Abcam | ab7753 | Mouse, 1:250 (IHC) |
| Anti-Progesterone Receptor | Abcam | ab101688 | Rabbit, 1:200 (IHC) |
| Anti-Ki67 | Abcam | ab279653 | Mouse, 1:250 (IHC) |
| A8301 | TargetMol | 909910-43-6 | |
| β-Estradiol | Merck | E8875 | |
| Cell Counting Kit-8 | Beyotime | C0038 | |
| CD9 | BioLegend | 109819 | 1:20 (FC), Pacific Blue |
| CD24 | BioLegend | 101806 | 1:20 (FC), FITC |
| CD31 | BioLegend | 303120 | 1:20 (FC), APC |
| CD45 | BioLegend | 301703 | 1:20 (FC), PE |
| CHIR99021 | TargetMol | CT99021 | |
| Cultrex Organoid Harvesting Solution | R&D Systems | 3700-100-01 | |
| Cy3 TSA Fluorescence System Kit | APExBIO | K1051 | |
| Cy5 TSA Fluorescence System Kit | APExBIO | K1052 | |
| DAPI | Sigma | D9542 | 1 μg/mL |
| DMEM/F-12 | Invitrogen | 11330032 | |
| EpCAM | BioLegend | 369803 | 1:20 (FC), PerCP |
| Fluorescein TSA Fluorescence System Kit | APExBIO | K1050 | |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11008 | 1:500 |
| Goat anti-Mouse IgG, Alexa Fluor 555 | Invitrogen | A-21422 | 1:500 |
| Goat Anti-rabbit IgG/HRP antibody | APExBIO | bs-0295G-HRP | |
| Knockout serum replacement | Invitrogen | 10828028 | |
| Matrigel | Corning | 356234 | |
| PrimeScript RT Master Mix | Takara | RR063A | |
| Progesterone | Merck | 57-83-0 | |
| Sprague-Dawley rat | Shanghai JieSiJie Laboratory Animals Co., LTD, China | ||
| SSEA-1 | BioLegend | 323047 | 1:20 (FC), APC |
| TB Green Fast qPCR Mix | Takara | RR820A | |
| TriZOL | Invitrogen | 15596026CN | RNA extraction |
| u-Slide 8-well plates | Ibidi | 80827 | |
| Y27632 | TargetMol | 146986-50-7 | |
| qPCR primers of target genes | |||
| Genes | Company | Sequences | |
| rat GAPDH F | Sangon biotech | GACATGCCGCCTGGAGAAAC | |
| rat GAPDH R | Sangon biotech | AGCCCAGGATGCCCTTTAGT | |
| rat Nanog F | Sangon biotech | GACTAGCAACGGCCTGACTCA | |
| rat Nanog R | Sangon biotech | CTGCAATGGATGCTGGGATA | |
| rat Sox2 F | Sangon biotech | ATTACCCGCAGCAAAATGAC | |
| rat Sox2 R | Sangon biotech | ATCGCCCGGAGTCTAGTTCT | |
| rat Oct4 F | Sangon biotech | CCCAGCGCCGTGAAGTTGGA | |
| rat Oct4 R | Sangon biotech | ACCTTTCCAAAGAGAACGCCCA GG |
Referencias
- Jabbour, H. N., Kelly, R. W., Fraser, H. M., Critchley, H. O. Endocrine regulation of menstruation. Endocr Rev. 27 (1), 17-46 (2006).
- Garcia-Alonso, L., et al. Mapping the temporal and spatial dynamics of the human endometrium in vivo and in vitro. Nat Genet. 53 (12), 1698-1711 (2021).
- Li, M., Izpisua Belmonte, J. C. Organoids - preclinical models of human disease. N Engl J Med. 380 (6), 569-579 (2019).
- Mulaudzi, P. E., Abrahamse, H., Crous, A. Insights on three dimensional organoid studies for stem cell therapy in regenerative medicine. Stem Cell Rev Rep. 20 (2), 509-523 (2024).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development. 144 (10), 1775-1786 (2017).
- Turco, M. Y., et al. Long-term, hormone-responsive organoid cultures of human endometrium in a chemically defined medium. Nat Cell Biol. 19 (5), 568-577 (2017).
- Tempest, N., Maclean, A., Hapangama, D. K. Endometrial stem cell markers: current concepts and unresolved questions. Int J Mol Sci. 19 (10), 3240 (2018).
- He, W., et al. Long-term maintenance of human endometrial epithelial stem cells and their therapeutic effects on intrauterine adhesion. Cell Biosci. 12 (1), 175 (2022).
- Katsuda, T., et al. Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity. Cell Stem Cell. 20 (1), 41-55 (2017).
- Murphy, A. R., Campo, H., Kim, J. J. Strategies for modelling endometrial diseases. Nat Rev Endocrinol. 18 (12), 727-743 (2022).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Esfandiari, F., et al. Endometriosis organoids: prospects and challenges. Reprod Biomed Online. 45 (1), 5-9 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados